Почвоведение, 2019, № 10, стр. 1163-1171
Сравнительная оценка адсорбции редкоземельных элементов некоторыми типами почв
Д. В. Ладонин *
МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: ladonin@inbox.ru
Поступила в редакцию 26.12.2018
После доработки 25.02.2019
Принята к публикации 25.03.2019
Аннотация
Адсорбцию скандия, иттрия и лантаноидов дерново-подзолистой и серой лесной почвами, а также черноземом выщелоченным изучали в конкурентных условиях. Скандий по своему поведению существенно отличается от остальных редкоземельных элементов быстрым установлением равновесия в системе почва–раствор и адсорбцией, не описываемой, в отличие от иттрия и лантаноидов, уравнением Ленгмюра. При проведении экспериментов по конкурентной адсорбции индивидуальные химические свойства РЗЭ проявляются наиболее отчетливо. В ряду иттрий–лютеций происходит постепенное снижение максимальной адсорбционной емкости (от 0.025 до 0.010 ммоль/кг в дерново-подзолистой почве и от 0.100 до 0.050 ммоль/кг в черноземе выщелоченном) и более ярко выраженное увеличение констант адсорбции Ленгмюра (от 5000 до 25 000 л/моль в дерново-подзолистой почве и от 5000 до 40 000 л/моль в черноземе выщелоченном). Это является отражением конкуренции различных элементов за почвенные сорбционные центры и напрямую связано с изменением ионных радиусов элементов (так называемым “лантаноидным сжатием”).
ВВЕДЕНИЕ
К редкоземельным элементам (РЗЭ) относят скандий, иттрий и 14 лантаноидов. Эти элементы находятся в побочной подгруппе третьей группы Периодической системы элементов. В силу особых химических свойств, уровней содержания и особенностей накопления в почвах, использования, методов определения в природных объектах РЗЭ обычно рассматривают как обособленную от других тяжелых металлов (ТМ) группу элементов.
Широкое использование РЗЭ в промышленности, и, как следствие, загрязнение ими почв, приняло заметные масштабы только в последние десятилетия, что связано с появлением и развитием новых технологий и материалов, получаемых на их основе. Несмотря на появление аналитических методов, позволяющих надежно определять даже очень низкие содержания РЗЭ в почвах, прежде всего, масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС) [18], эта группа элементов до сих пор остается мало изученной. Настоящий этап в развитии представлений о химии РЗЭ в почвах посвящен в основном накоплению знаний об уровнях содержания РЗЭ в почвах различных территорий, в том числе при техногенном воздействии, изучению поведения РЗЭ в системе почва–растение и, в меньшей степени, их форм соединений [2, 9, 10]. Закономерности адсорбции РЗЭ почвами изучены недостаточно полно.
Цель работы – изучить адсорбцию РЗЭ почвами, различающимися по физико-химическим свойствам. Задачи: 1 – определить химические свойства почв; 2 – изучить динамику адсорбции РЗЭ почвами; 3 – изучить адсорбцию РЗЭ почвами в статических условиях и построить изотермы адсорбции; 4 –рассчитать параметры уравнений адсорбции Ленгмюра и на их основе сравнить адсорбцию РЗЭ исследуемыми почвами и установить различия в адсорбции почвами индивидуальных элементов.
ХИМИЯ РЗЭ В ПОЧВАХ
РЗЭ объединяют в одну группу на основе сходного строения их электронных оболочек и, соответственно, химических свойств. Скандий и иттрий имеют на внешних электронных уровнях по одному d и по два s-электрона. У лантаноидов появляется 4f-подуровень, заполнение которого происходит постепенно в ряду Ce–Lu. Такое строение электронных оболочек – причина того, что основной степенью окисления РЗЭ является 3+ (табл. 1). Хотя для церия, празеодима и тербия известна степень окисления 4+, а для самария, европия и иттербия – 2+, в природных условиях только церий и европий проявляют степени окисления, отличные от 3+ [11].
Таблица 1.
| Элемент | Строение внешних электронных оболочек | Атомный радиус, нм | Ионный радиус Ln3+, нм | ||
|---|---|---|---|---|---|
| нейтральный атом | трехзарядный катион | КЧ = 6 | КЧ = 8 | ||
| La | 5d 16s2 | 4f 0 | 0.187 | 0.1032 | 0.1160 |
| Ce | 4f 15d16s2 | 4f1 | 0.183 | 0.1010 | 0.1143 |
| Pr | 4f 36s2 | 4f2 | 0.182 | 0.0990 | 0.1126 |
| Nd | 4f 46s2 | 4f3 | 0.182 | 0.0983 | 0.1109 |
| Sm | 4f 66s2 | 4f5 | 0.181 | 0.0958 | 0.1079 |
| Eu | 4f 76s2 | 4f6 | 0.202 | 0.0947 | 0.1066 |
| Gd | 4f 75d16s2 | 4f7 | 0.179 | 0.0938 | 0.1053 |
| Tb | 4f 96s2 | 4f8 | 0.177 | 0.0923 | 0.1040 |
| Dy | 4f 106s2 | 4f9 | 0.177 | 0.0912 | 0.1027 |
| Ho | 4f 116s2 | 4f10 | 0.176 | 0.0901 | 0.1015 |
| Er | 4f 126s2 | 4f11 | 0.175 | 0.0890 | 0.1004 |
| Tm | 4f 136s2 | 4f12 | 0.174 | 0.0880 | 0.0994 |
| Yb | 4f 146s2 | 4f13 | 0.193 | 0.0868 | 0.0985 |
| Lu | 4f 145d16s2 | 4f14 | 0.174 | 0.0861 | 0.0977 |
Химические свойства скандия приближают его к щелочноземельным элементам, атомы которых он может замещать в кристаллических решетках минералов [36]. Иттрий по своим свойствам приближается к группе лантаноидов. В отличие от других ТМ, химические свойства которых от элемента к элементу меняются не всегда очевидно, но, безусловно, в строгом соответствии со строением атомов, в ряду лантаноидов прослеживаются интересные закономерности.
Заполнение электронами 4f-слоя приводит к плавному уменьшению атомных (за исключением Eu и Yb) и ионных радиусов элементов (лантаноидное сжатие). Это в свою очередь приводит к столь же закономерному увеличению электроотрицательности, ионной поляризации, констант устойчивости комплексных соединений, констант гидролиза и снижению pH начала осаждения гидроксидов лантаноидов (табл. 2) [1, 3, 11].
Таблица 2.
Отрицательные логарифмы констант гидролиза лантаноидов (–lgβ) при бесконечном разбавлении (I → 0) и 25°С, электроотрицательность (χ) по Полингу [4, 29]
| Элемент | –lgβ | χ | Элемент | –lgβ | χ |
|---|---|---|---|---|---|
| La | 8.81 | 1.10 | Tb | 7.64 | –* |
| Ce(III) | 8.34 | 1.12 | Dy | 7.59 | 1.22 |
| Pr | 8.32 | 1.13 | Ho | 7.56 | 1.23 |
| Nd | 8.18 | 1.14 | Er | 7.52 | 1.24 |
| Sm | 7.84 | 1.17 | Tm | 7.39 | 1.25 |
| Eu | 7.76 | –* | Yb | 7.24 | –* |
| Gd | 7.83 | 1.22 | Lu | 7.27 | 1.27 |
В условиях отсутствия техногенного загрязнения почвы наследуют содержание РЗЭ от материнских пород. Минералогический состав почвообразующих пород контролирует уровень содержания РЗЭ в почвах [27, 31, 40]. Типичные интервалы содержания РЗЭ в породах различного происхождения приведены в табл. 3. Наиболее обогащенными РЗЭ среди магматических пород являются кислые, а среди осадочных – глинистые.
Таблица 3.
Среднее содержание РЗЭ в породах, мг/кг [28]
| Элемент | Земная кора | Магматические породы | Осадочные породы | |||
|---|---|---|---|---|---|---|
| мафические | кислые | глинистые | песчаные | карбонатные | ||
| La | 16–39 | 2–70 | 30–150 | 30–90 | 17–40 | 4–10 |
| Ce | 33–67 | 4–60 | 80–250 | 3–90 | 25–80 | 7–20 |
| Pr | 3.9–9.2 | 1–15 | 6–30 | 6–10 | 4–9 | 1–2.5 |
| Nd | 16–42 | 2–30 | 18–80 | 18–35 | 16–48 | 5–9 |
| Sm | 3.5–7.1 | 0.1–1.7 | 6–11 | 5–7 | 4–10 | 1–2 |
| Eu | 1.1–2.0 | 0.01–4 | 1–2 | 1–2 | 0.7–2 | 0.2–0.4 |
| Gd | 3.3–6.2 | 0.1–8 | 4–10 | 5–7.5 | 3–10 | 1.3–2.7 |
| Tb | 0.6–1.2 | 0.1–1.2 | 1–2.5 | 0.9–1.1 | 1.6–2 | 0.2–0.4 |
| Dy | 3.7–5.2 | 0.05–7 | 5–8 | 4–6 | 2.6–7.2 | 0.8–2 |
| Ho | 0.8–1.3 | 0.1–1.5 | 1.3–2 | 1–1.8 | 0.05–2 | 0.2–0.3 |
| Er | 2.1–3.5 | 0.1–1 | 0.7–3.4 | 2.5–4 | 1.5–6 | 0.4–1.7 |
| Tm | 0.3–0.5 | 0.1–0.6 | 0.3–0.7 | 0.2–0.6 | 0.3 | 0.03–0.2 |
| Yb | 2.0–3.2 | 0.1–3.5 | 3–4.5 | 2.2–4 | 1.2–4.4 | 0.3–1.6 |
| Lu | 0.3–0.8 | 0.1–0.6 | 0.5–1.2 | 0.2–0.7 | 0.8–1.2 | 0.03–0.2 |
В процессе почвообразования при разрушении первичных минералов происходит высвобождение ионов РЗЭ в почвенный раствор. Дальнейшая судьба РЗЭ в почвах (миграция, образование и трансформация РЗЭ-содержащих соединений и минералов) связана с их химическими свойствами.
Поскольку в почвенных условиях случаев образования собственных твердых фаз РЗЭ не зафиксировано, можно предположить, что перераспределение РЗЭ между почвенными компонентами в ходе почвообразовательных процессов и техногенного загрязнения в основном происходит за счет ионообменных и сорбционных взаимодействий, а также комплексообразования. Изучены закономерности сорбции РЗЭ основными почвенными компонентами, оказывающими влияние на поведение ТМ: (гидр)оксидами железа и марганца, органическим веществом, а также глинистыми минералами [13, 17, 20, 25, 30, 33, 35]. Наибольшая часть опубликованных данных касается лантаноидов. Показано, что их сорбция существенно возрастает при увеличении pH контактирующего с сорбентом раствора [19, 32, 34].
При сорбции лантаноидов глинистыми минералами, (гидр)оксидами железа и марганца из растворов с высокой ионной силой (то есть в условиях проведения экспериментов по специфической сорбции) прочность связи элементов с сорбентом растет по мере увеличения порядкового номера элемента, соответственно изменению ионных радиусов. При сорбции из растворов с низкой ионной силой (то есть в условиях проведения экспериментов по неспецифической сорбции) эта закономерность отсутствует [15, 19, 29]. Исследования адсорбции лантаноидов минеральными почвенными компонентами показали, что тяжелые лантаноиды сорбируются ими сильнее, чем легкие [19, 22, 38, 39]. Изучение образования комплексов лантаноидов с органическим веществом также показало, что тяжелые лантаноиды образуют более прочные комплексные соединения с органическими лигандами [16, 26, 34]. Изменение констант устойчивости комплексов лантаноидов с органическими лигандами сходно с изменением констант устойчивости поверхностных комплексов и также закономерно изменяется в соответствии с изменением порядкового номера (и ионного радиуса) элемента [14, 21]. Эти заключения согласуются с мнением В.М. Гольдшмидта, высказанным еще в 1937 г., что поведение легких редкоземельных элементов близко к поведению кальция, а тяжелых – к поведению алюминия [24].
Таким образом, можно предположить, что в ходе почвообразования, а также при поступлении РЗЭ в почву в результате техногенного загрязнения, следует ожидать различного перераспределения этих элементов между почвенными компонентами, а также в зависимости от порядкового номера (или атомной массы) элемента. Это связано с проявлением индивидуальных химических свойств РЗЭ, прежде всего, с изменениями констант комплексообразования и констант устойчивости ионных пар на поверхности твердых почвенных частиц в сорбционных процессах [3].
ОБЪЕКТЫ И МЕТОДЫ
В качестве объектов исследования выбраны верхние А горизонты почв трех типов, различающихся по свойствам, определяющим закрепление тяжелых металлов: дерново-подзолистой легкосуглинистой (Albic Retisol (Loamic, Cutanic, Differentic, Ochric) (Московская область), серой лесной среднесуглинистой (Eutric Retisol (Loamic, Aric, Cutanic, Ochric) и чернозема выщелоченного тяжелосуглинистого (Luvic Chernic Phaeozem (Loamic, Aric, Pachic) (Тульская область). Пробы всех почв отбирали с глубины 0–20 см. Для проведения сорбционных экспериментов пробы почв высушили, измельчили до размера частиц <0.25 мм и тщательно гомогенизировали.
Химические свойства почв определяли в соответствии с общепринятыми методами химического анализа [12]: органический углерод – по методу Тюрина с фотометрическим окончанием; содержание обменных Na, Mg, K, Ca – атомно-абсорбционным методом после извлечения 1 М раствором ацетата аммония; pH водной суспензии (1 : 5) – потенциометрически; содержание оксалаторастворимого (по Тамму) железа – атомно-абсорбционным методом.
Наши предыдущие исследования показали [7], что при изучении адсорбции ТМ из моноэлементных растворов не учитываются конкурентные взаимоотношения между различными элементами, присутствующими в жидкой фазе в реальных почвенных условиях. Проведение сорбционных экспериментов в условиях конкуренции (из полиэлементных растворов) позволяет взаимодействующим с почвой ионам различных ТМ закрепиться на поверхности твердофазных почвенных компонентов в соответствии с максимальным сродством к ним. В этих условиях различия в химических свойствах индивидуальных ТМ будут проявляться в наибольшей степени.
Для проведения сорбционных экспериментов в качестве исходных использовали растворы, приготовленные на основе многоэлементного стандартного раствора для ИСП-МС, содержащего по 10 мг/л скандия, иттрия и всех 14-ти лантаноидов. Подбор концентраций исходных растворов и отношения почвы к раствору был направлен на получение максимально широкого диапазона. Были приготовлены растворы, имеющие следующие концентрации: 2, 1, 0.5, 0.2, 0.1, 0.05, 0.02 и 0.01 мг/л. Максимальное значение (2 мг/л) определялось концентрацией исходного стандартного раствора. Минимальная концентрация (0.01 мг/л) определялась чувствительностью метода изменения содержания РЗЭ.
Для успешного выполнения экспериментов по адсорбции РЗЭ в статических условиях необходимо определение времени установления равновесия в системе почва–раствор РЗЭ. С этой целью провели эксперимент по изучению динамики адсорбции РЗЭ дерново-подзолистой почвой.
Для изучения динамики адсорбции навески дерново-подзолистой почвы заливали раствором с концентрацией редкоземельных элементов, равной 0.2 мг/л при соотношении почва : раствор 1 : 10. Время взаимодействия почвы с раствором составляло 5 мин, 1, 6, 24 и 48 ч при постоянном перемешивании. После взаимодействия суспензии фильтровали через бумажный фильтр “белая лента”.
Для проведения сорбционных экспериментов в статических условиях навески почвы заливали растворами, содержащими РЗЭ, при соотношении почва : раствор 1 : 10. Время взаимодействия почвы с растворами при постоянном перемешивании составляло 24 ч. После взаимодействия суспензии фильтровали через бумажный фильтр “белая лента”.
В полученных фильтратах измеряли концентрацию РЗЭ методом ИСП-МС на приборе 7500а ICP-MS (Agilent Technologies).По разности между концентрацией РЗЭ в исходных и равновесных растворах определяли содержание элементов, поглощенных почвой.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химические свойства исследованных почв. В табл. 4 приведены некоторые химические свойства исследованных почв. Обращает на себя внимание закономерно большее содержание гумуса в черноземе выщелоченном. Сумма обменных оснований увеличивается в зональном ряду исследованных почв. По содержанию железа по Тамму чернозем и серая лесная почва близки. Значения pH водной суспензии всех трех почв лежат в слабокислой и близкой к нейтральной области. Таким образом, из-за различий в химических свойствах следует ожидать разного проявления почвами сорбционной способности по отношению к РЗЭ.
Таблица 4.
Химические свойства исследованных почв
| Почва | Сорг, % | Сумма обменных Са2+, Mg2+, Na+, K+, смоль(экв)/кг | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | Fe по Тамму, % |
|---|---|---|---|---|
| Дерново-подзолистая среднесуглинистая | 1.21 | 23.37 | 6.51 | 0.42 |
| Серая лесная легкосуглинистая | 1.32 | 30.14 | 6.70 | 1.28 |
| Чернозем выщелоченный тяжелосуглинистый | 5.49 | 77.52 | 6.98 | 1.30 |
Динамика адсорбции РЗЭ дерново-подзолистой почвой. На рис. 1 представлена зависимость относительной равновесной концентрации РЗЭ от времени (отношение равновесной концентрации РЗЭ в момент времени τCτ к равновесной концентрации РЗЭ через 5 мин взаимодействия C5). Видно, что все исследованные элементы можно отнести к одной из трех групп. К первой группе относится скандий, адсорбция которого почвой протекает очень быстро – равновесие в системе почва–раствор устанавливается менее, чем за 5 мин. Скорее всего, адсорбция скандия почвами протекает по механизму ионного обмена, что приближает этот элемент к щелочноземельным металлам и существенно отличает его от остальных РЗЭ. Полученные результаты хорошо соответствуют литературным данным по адсорбции скандия минеральными поверхностями [23, 36].
Иттрий и первые четыре самых легких лантаноида (La, Ce, Pr, Nd) характеризуются длинным периодом установления равновесия в системе почва–раствор на уровне 24 ч. Вероятно, это связано со значительным вкладом в процесс адсорбции этих элементов реакций образования внутрисферных поверхностных комплексов и поверхностных осадков, более медленных, чем классические реакции ионного обмена. Это соответствует литературным данным [19, 22, 38, 39].
Более тяжелые лантаноиды, начиная с самария, по динамике адсорбции дерново-подзолистой почвой занимают промежуточное положение между скандием и легкими РЗЭ. Это может быть связано с меньшими размерами ионов (табл. 1) тяжелых лантаноидов, что облегчает их электростатическое взаимодействие с зарядами почвенного поглощающего комплекса и сокращает время установления равновесия в системе почва–раствор по сравнению с легкими лантаноидами и иттрием, имеющими большие ионные радиусы.
Таким образом, изучение динамики адсорбции РЗЭ позволило обосновать время взаимодействия почвы с растворами РЗЭ в дальнейших сорбционных экспериментах и установить его равным 24 ч.
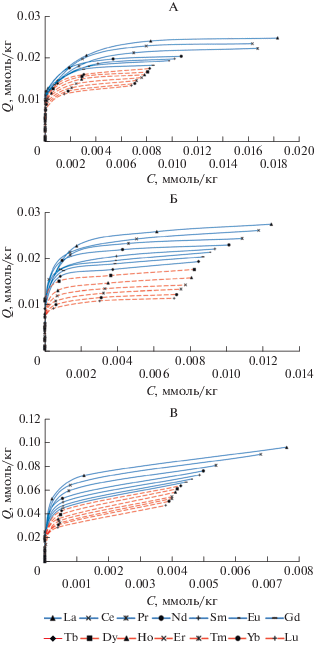
Изучение адсорбции РЗЭ почвами в статических условиях. По полученным результатам построили изотермы адсорбции (рис. 2, 3) в координатах равновесная концентрация ионов РЗЭ (С, ммоль/л) – количество поглощенных почвой РЗЭ (Q, ммоль/кг).
Рис. 2.
Изотермы адсорбции скандия (А) и иттрия (Б) почвами: 1 – дерново-подзолистой, 2 – серой лесной, 3 – черноземом выщелоченным.

Рис. 3.
Изотермы адсорбции лантаноидов дерново-подзолистой (А), серой лесной почвами (Б) и чернозем выщелоченным (В).
Адсорбция скандия существенно отличается от адсорбции других РЗЭ (см. далее) и существенно зависит от типа почвы: чернозем поглощает скандий очень активно – изотерма адсорбции элемента данной почвой в отличие от дерново-подзолистой не выходит на плато в используемом диапазоне концентраций. Серая лесная почва занимает промежуточное положение.
Адсорбция иттрия несколько отличается от адсорбции скандия. Изотермы адсорбции этого элемента исследуемыми почвами выходят на плато. Это говорит о том, что в условиях данного сорбционного эксперимента иттрий поглощается почвами в меньшем количестве, чем скандий.
Адсорбция скандия и иттрия черноземом существенно превосходит адсорбцию двумя другими почвами, ведущими себя по отношению к данным элементам схожим образом (особенно в случае иттрия). Вероятно, это связано с влиянием реакций комплексообразования с почвенным органическим веществом, содержание которого в черноземе существенно выше, чем в дерново-подзолистой и серой лесной почвах.
На рис. 3 представлены изотермы адсорбции лантаноидов исследованными почвами. Рассматривая изотермы, можно обнаружить закономерности, отражающие влияние на адсорбцию лантаноидов как свойств почв, так и индивидуальных химических свойств элементов. Так же как в случае с легкими РЗЭ, изотермы адсорбции лантаноидов дерново-подзолистой и серой лесной почвами весьма схожи. В отличие от них чернозем выщелоченный поглощает значительно большие количества лантаноидов. Вероятно, большее содержание гумуса в черноземе по сравнению с двумя другими почвами вносит в адсорбцию лантаноидов гораздо больший вклад, чем содержание оксалаторастворимого железа. Так, при более, чем трехкратном превосходстве в содержании железа по Тамму, серая лесная почва поглощает почти столько же лантаноидов, что и дерново-подзолистая. При этом содержание гумуса в этих почвах близко.
Индивидуальные свойства отдельных лантаноидов проявляются в том, что, вне зависимости от типа почвы, чем больше порядковый номер элемента или его атомная масса, тем ниже лежит его изотерма (рис. 3). Это говорит о том, что в условиях эксперимента по конкурентной адсорбции легкие лантаноиды поглощаются почвами в большем количестве, чем тяжелые.
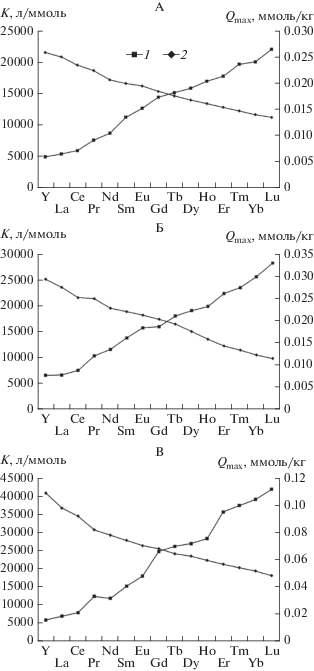
Для более удобного сравнения закономерностей адсорбции почвами разных химических элементов рассчитаны параметры уравнения адсорбции Ленгмюра для лантаноидов и иттрия. Поглощение скандия черноземом выщелоченным и серой лесной почвой не может быть описано уравнением адсорбции Ленгмюра, так как в выбранном диапазоне концентраций этого элемента адсорбция не выходит на плато. Рассчитанные значения максимальной адсорбционной емкости Qmax и констант Ленгмюра (K), отражающей прочность связи элементов с адсорбентом, приведены в графическом виде на рис. 4.
Рис. 4.
Константы Ленгмюра (1) и максимальная адсорбционная емкость Qmax (2) при адсорбции РЗЭ почвами: дерново-подзолистой (А), серой лесной (Б) черноземом выщелоченным (В).
По сравнению с нашими предыдущими исследованиями по адсорбции почвами и почвенными компонентами традиционных ТМ (меди, цинка, никеля, кадмия и свинца), проведенными в аналогичных условиях [5, 6, 8], поглощение почвами РЗЭ характеризуется существенно большими значениями K и существенно более низкими значениями Qmax. Это свидетельствует о большой “специфичности” адсорбции редкоземельных элементов почвами, то есть о существовании на поверхности почвенных компонентов сравнительно небольшого числа сорбционных центров, обладающих высоким сродством к данным химическим элементам.
Общей закономерностью, проявляющейся в экспериментах по конкурентной адсорбции РЗЭ всеми исследованными почвами, является зависимость параметров уравнения адсорбции Ленгмюра от порядкового номера (соответственно ионного радиуса) элемента. В ряду иттрий–лютеций происходит постепенное уменьшение максимальной адсорбционной емкости Qmax при одновременном увеличении константы Ленгмюра. Похожие закономерности получены ранее при изучении конкурентной адсорбции других ТМ [7]. Такое поведение РЗЭ является следствием существования между индивидуальными РЗЭ конкурентных взаимоотношений, выражающихся в преимущественном закреплении ионов металлов на тех сорбционных центрах, к которым данные элементы имеют большее сродство.
На данную закономерность накладываются индивидуальные особенности взаимодействия РЗЭ с каждой из трех исследованных почв, связанные с их свойствами. Так, в ряду Y–Lu максимальная абсорбционная емкость Qmax уменьшается в дерново-подзолистой почве в 2.6 раза, в серой лесной почве – в 2.0 раза и в черноземе выщелоченном – в 2.3 раза. Одновременно с этим константы адсорбции Ленгмюра возрастают в дерново-подзолистой почве в 4.3 раза, в серой лесной почве – в 4.4 раза, а в черноземе выщелоченном – в 7.2 раза. Видно, что различия в типе почв гораздо сильнее влияют на изменение прочности связи металлов с адсорбентом, нежели на величину адсорбционной емкости. Это логично, учитывая относительно низкие исходные концентрации РЗЭ, использованные в экспериментах по их адсорбции почвами.
ВЫВОДЫ
1. По динамике сорбции почвами РЗЭ можно разделить на три группы. В первую группу входит скандий, адсорбция которого почвой происходит очень быстро (равновесие устанавливается менее, чем за 5 мин). Во вторую группу входят тяжелые лантаноиды, начиная с самария. Эти элементы поглощаются почвой быстро, равновесие в системе устанавливается менее, чем за час. В третью группу входит иттрий и первые четыре легких лантаноида (лантан, церий, празеодим, неодим). Для этих элементов мы наблюдаем установление равновесия в системе почва–раствор в течение суток.
2. В условиях экспериментов по конкурентной адсорбции поглощение почвами всех РЗЭ, кроме скандия, описывается уравнением Ленгмюра.
3. Установлена зависимость параметров уравнения Ленгмюра от изменения порядкового номера РЗЭ. В ряду иттрий–лютеций происходит существенное увеличение констант Ленгмюра (до 7.2 раз) и менее выраженное (до 2.4 раз) снижение максимальной сорбционной емкости. Это может быть связанно с уменьшением ионного радиуса элементов и проявлением конкуренции между ионами разных РЗЭ за взаимодействие с сорбционными центрами.
4. Чернозем выщелоченный сильно отличается от серой лесной и дерново-подзолистой почв поглощением большего количества РЗЭ и более прочным их закреплением. Это связано с высоким содержанием органического вещества. Различия в содержании оксалаторастворимого железа сказываются на изменении адсорбции РЗЭ почвами в гораздо меньшей степени.
Список литературы
Балашов Ю.А. Геохимия редкоземельных элементов. М.: Наука, 1976. 267 с.
Водяницкий Ю.Н., Рогова О.Б. Биогеохимия лантанидов в почвах // Бюл. Почв. ин-та им. В.В. Докучаева. 2016. № 84. С. 101–118.
Дубинин А.В. Геохимия редкоземельных элементов в океане. М.: Наука, 2006. 360 с.
Войткевич Г.В., Мирошников А.Е., Поваренных А.С., Прохоров В.Г. Краткий справочник по геохимии. М.: Недра, 1977. 184 с.
Карпухин М.М., Ладонин Д.В. Влияние компонентов почвы на поглощение тяжелых металлов в условиях техногенного загрязнения // Почвоведение. 2008. № 11. С. 105–115.
Ладонин Д.В. Особенности специфической сорбции меди и цинка некоторыми почвенными минералами // Почвоведение. 1997. № 12. С. 1478–1486.
Ладонин Д.В. Конкурентные взаимоотношения ионов при загрязнении почвы тяжелыми металлами // Почвоведение. 2000. № 10. С. 1285–1293.
Ладонин Д.В.Влияние железистых и глинистых минералов на поглощение меди, цинка, кадмия и свинца в конкреционном горизонте подзолистой почвы // Почвоведение. 2003. № 10. С. 1197–1206.
Ладонин Д.В. Лантаноиды в почвах зоны воздействия Череповецкого металлургического комбината // Почвоведение. 2017. № 6. С. 680–689.
Переломов Л.В., Асаинова Ж.С., Йошида С., Иванов И.В. Содержание редкоземельных элементов в почвах Приокско-Террасного биосферного заповедника // Почвоведение. 2012. № 10. С. 1115–1126.
Рябчиков Д.И., Рябухин В.А. Аналитическая химия редкоземельных элементов и иттрия. М.: Наука, 1966. 380 с.
Теория и практика химического анализа почв / Под ред. Л.А. Воробьевой. М.: ГЕОС, 2006. 400 с.
Bau M. Scavenging of Dissolved Yttrium and Rare Earths by Precipitating Iron Oxyhydroxide: Experimental Evidence for Ce Oxidation, Y–Ho Fractionation, and Lanthanide Tetrad Effect // Geochim. Cosmochim. Acta, 1999. V. 63. P. 67–77.
Bryne R.H., Kim K.-H. Rare Earth Element Scavenging in Seawater // Geochim. et Cosmochim. Acta. 1990. V. 54. P. 2635–2656.
Bonnot-Courtois C., Jaffrezic-Renault N. Etude Des Echanges Entre Terres Rares Et Cations Interfoliaires De Deux Argiles // Clay Minerals. 1982. V. 17. P. 409–420.
Cantrell K.J., Byrne R.H. Rare Element Complexation by Carbonate and Oxalate ions // Geochim. Cosmochim. Acta. 1987. V. 51 № 3. P. 597–605.
Chang C., Li F., Liu F., Gao J., Tong H., Chen M. Fractionation Characteristics of Rare Earth Elements (REEs) Linked with Secondary Fe, Mn and Al Minerals in Soils // Acta Geochim. 2016. V. 35. № 4. P. 329–339.
Chao X.D., Chen Y., Gu Z.M., Wang X.R. Determination of Trace Rare Earth Elements in Plant and Soil Samples by Inductively Coupled Plasma-Mass Spectrometry // Int. J. Environ. Analytical Chem. 2000. V. 76. № 4. P. 295–309.
Coppin F., Berger G., Bauer A., Castet S., Loubet M. Sorption of Lanthanides on Smectite and Kaolinite // Chemical Geology. 2002. V. 182. P. 57–68.
Davranche M., Pourret O., Gruau G., Dia A. Impact of Humate Complexation on the Adsorption of REE onto Fe Oxyhydroxide // J. Colloid Interface Sci. 2004. V. 277. P. 271–279.
Elderfield H. The Oceanic Chemistry of the Rare-Earth Elements // Philos. Trans. Roy. Soc. London A. 1988. V. 325. P. 105–126.
Fendorf S., Fendorf M. Sorption Mechanisms of Lanthanum on Oxide Minerals // Clays and Clay Minerals. 1996. V. 44. № 2. P. 220–227.
Giret S., Hu Y., Masoumifard N., Boulanger J.–F., Juère E., Kleitz F., Larivière D. Selective Separation and Preconcentration of Scandium with Mesoporous Silica // ACS Appl. Mater. Interfaces. 2018. V. 10. № 1. P. 448–457.
Goldschmidt V.M. The Principles of Distribution of Chemical Elements in Minerals and Rocks // J. Chem. Soc. 1937. V. 49. P. 655–673.
Grybos M., Davranche M., Gruau G., Petitjean P. Is Trace Metal Release in Wetland Soils Controlled by Organic Matter Mobility or Fe–Oxyhydroxides Reduction? // J. Coll. Interface Sci. 2007. V. 314. P. 490–501.
Henderson P. Rare Element Geochemistry / Developments in Geochemistry. V. 2. Amsterdam: Elsevier, 1984. 510 p.
Hu Z., Haneklaus S., Sparovek G., Schnug E. Rare Earth Elements in Soils // Commun. Soil Sci. Plant Anal. 2006. V. 39. № 9–10. P. 1381–1420.
Kabata-Pendias A., Mukherjee A.B. Trace Elements from Soil to Human. Springer, 2007. 550 p.
Klugness G.D., Byrne R.H. Comparative hydrolysis behavior of the rare earths and yttrium: the influence of temperature and ionic strength // Polyhedron. 2000. V. 19. P. 99–107.
Koeppenkastrop D., de Carlo E.H. Uptake of Rare Earth Elements from Solution by Metal Oxides // Environ. Sci. Technol. 1993. V. 27. P. 1796–1802.
Laveuf C., Cornu S. A review on the Potentiality of Rare Earth Elements to Trace Pedogenic Processes // Geoderma. 2009. V. 154. P. 1012.
Maza-Rodriguez J., Olivera–Pastor P., Bruque S., Jimenez–Lopez A. Exchange Selectivity of Lanthanide Ions in Montmorillonite // Clay Minerals. 1992. V. 27. P. 81–89.
Ohta A., Kawabe I. REE № III.Adsorption Onto Mn Dioxide (δ-MnO2) and Fe Oxyhydroxide: Ce(III). Oxidation by δ-MnO2 // Geochim. Cosmochim. Acta. 2001. V. 65. P. 695–703.
Ozaki T., Ambe S., Takahashi Y., Yoshida S., Minai Y. The Adsorption of Rb, Ba, Pt and Lanthanides on Metallic Oxides Affected by Humate Complex Formation // Environ. Technol. 2000. V. 21. P. 1255–1260.
Pourret O., Davranche M. Rare earth element sorption onto hydrous manganese oxide: A modeling study // J. Coll. Interface Sci. 2013. V. 395. P. 18–23.
Scandium: Its Occurrence, Chemistry Physics, Metallurgy, Biology and Technology / Ed. C.T. Horovitz. London: Elsevier, 1975. 598 p.
Shannon R.D. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides // Acta Crystallogr. A. 1976. V. 32. P. 751–767.
Tang J., Johannesson K.H. Controls on the geochemistry of rare earth elements along a groundwater flow path in the Carrizo sand aquifer, Texas, USA // Chemical Geology. 2006. V. 225. P. 156–171.
Tertre E., Hofmann A., Berger G. Rare Earth element sorption by basaltic rock: experimental data and modelling results using the “generalized composite approach” // Geochim. Cosmochim. Acta. 2008. V. 72. P. 1043–1056.
Yamasaki S.-I., Takeda A., Nanzyo M., Taniyama I., Nakai V. Background levels of trace and ultra-trace elements in soils of Japan // Soil Science and Plant Nutrition. 2001. V. 47. № 4. P. 755–765.
Дополнительные материалы отсутствуют.



