Почвоведение, 2019, № 10, стр. 1172-1184
Разложение растительных остатков и формирование активного органического вещества в почве инкубационных экспериментов
В. М. Семенов a, *, Н. Б. Паутова a, Т. Н. Лебедева a, Д. П. Хромычкина a, Н. А. Семенова a, В. О. Лопес де Гереню a
a Институт физико-химических и биологических проблем почвоведения РАН – обособленное подразделение
ФИЦ “Пущинский научный центр биологических исследований Российской академии наук”
142290 Московская область, Пущино, ул. Институтская, 2, Россия
* E-mail: v.m.semenov@mail.ru
Поступила в редакцию 11.12.2018
После доработки 29.01.2019
Принята к публикации 25.03.2019
Аннотация
В лабораторном опыте при постоянных условиях температуры и влажности путем количественного измерения продуцируемого C–CO2 исследовали разложение и минерализацию разных растительных остатков (листьев дуба и осины, хвои сосны, мелких ветвей и тонких корней деревьев, надземной массы и корней луговых трав, надземной массы и корней клевера, соломы и корней ячменя), инкубируемых при смешивании с вермикулитом или с серой лесной почвой (Greyzemic Phaeozems Albic)). За год инкубирования минерализовалось 25–67% от Cорг, содержащегося в растительных остатках. Листья дуба, надземная масса луговых трав, надземная масса и корни клевера характеризовались структурой из трех пулов органического вещества со средней (0.1 > k1 > 0.01 сут–1), медленной (0.01 > k2 > 0.001 сут–1) и очень медленной (k3 < 0.001 сут–1) скоростью минерализации, тогда как остальные виды – структурой из двух пулов с медленной и очень медленной скоростью минерализации. Получена обратная зависимость скорости разложения органических материалов от соотношения в их составе C : N. Cлабо разлагаемые виды растительных остатков были основным источником дисперсного органического вещества (CPOM) в почве, а сильно разлагаемые – микробной биомассы (Смик). Содержание потенциально-минерализуемого органического вещества в почве с растительными остатками положительно коррелировало с CPOM и с Cмик.
ВВЕДЕНИЕ
Царство растений – самый крупный компартмент биосферы. Из ≈550 Гт углерода биомассы ≈450 Гт C Земли приходится на высшие растения, в том числе ≈320 и ≈130 Гт C соответственно на надземную и подземную части растений [14]. Актуальная биомасса лесных угодий на Земле оценивается в пределах 297–368 Гт C, лугов и пастбищ – 119–120 Гт C, а пахотных земель на уровне 10 Гт C, а потенциальная в объемах 443–460, 374–379 и 139–141 Гт C [24]. Запасы древесной мортмассы и лесного опада на поверхности и внутри почвы составляют 73 ± 6 и 43 ± 3 Гт C соответственно [34]. В лесном опаде может быть сосредоточено 2.83 Гт углерода, а в мертвой древесине 36–72 Гт C [13]. При лесозаготовках на поверхности почвы остается в среднем от 10 до 15% надземной биомассы [15]. Масса древесных остатков на поверхности почвы варьирует в зависимости от региона, вида, возраста, типа участка и ассортимента древесины от 1 до 500 т/га с медианой значений 18 т/га [16]. На подземный растительный опад в лесах и лугопастбищных угодьях приходится в среднем 48 и 33% ежегодных поступлений растительных остатков [26].
Послеуборочные остатки сельскохозяйственных культур являются важной статьей баланса углерода в агроценозах. По одним оценкам продукция остатков для зерновых культур в мире составляют 1.26 Гт C/год, для 17 видов зерновых и бобовых культур – 1.40 Гт C/год, а для 27 видов культур – 1.69 Гт C/год [31]. В других исследованиях масса послеуборочных остатков культур (пшеница, ячмень, кукуруза, рис, соя, сахарный тростник) оценивается от 1.66 до 2.43 Гт C/год [27]. При современных урожаях сельскохозяйственных культур в России ежегодная продукция растительных остатков составляет 0.25 Гт C, что соответствует 3.37 т C/га пахотных земель [1].
Остатки надземной и подземной биомассы, осваиваются сообществами мезо- и микрофауны, эпифитных и почвенных микроорганизмов. Главными факторами, которые контролируют скорость и полноту разложения органических остатков, являются: географические переменные (широта и высота местоположений), среднегодовая температура, среднегодовое количество осадков и годовая эвапотранспирация, качество остатков (например, содержание N, отношение C : N, содержание лигнина и полифенолов, отношение лигнин : N), типы растительности и остатков [36, 41]. Листовой опад эвдикотов (двудольных растений) разлагается в среднем в 4 раза быстрее, чем бриофитов (мохообразные), в 3 раза, чем папоротниковидных, в 1.8 раза, чем голосеменных и в 1.6 раза, чем однодольных растений [21]. В зонах с неблагоприятными климатическими условиями разложение растительных остатков лимитируется преимущественно факторами окружающей среды, тогда как при благоприятных гидротермических условиях – качеством органического материала [25]. Добавление азота стимулирует разложение высококачественных остатков, то есть с низким содержанием лигнина, в экосистемах с атмосферными выпадениями азота меньше 5 кг/га в год, но замедляет разложение низкокачественных материалов с высоким содержанием лигнина в экосистемах с поступлением азота в 2–20 раз выше естественного [29].
Разложение органических материалов традиционно оценивается по убыли массы (метод сетчатых мешочков) или образованию C–CO2 (метод закрытых камер). Хотя эти способы имеют свои преимущества и недостатки [38], оба позволяют установить долю разложившегося вещества и соответствующую константу скорости процесса. Получение и уточнение констант скорости разложения и минерализации разных по происхождению органических материалов является важной исследовательской задачей. Практически во всех моделях динамики и трансформации углерода и азота используются константы скорости разложения свежего и трансформированного органического вещества, полученные эмпирическим путем [33]. Особенно важно отразить соответствующими константами структурно-молекулярную неоднородность разлагаемого органического вещества [12, 28].
Цель работы – сравнить динамику разложения разных видов растительных остатков, получить константы скорости минерализации и величины потенциально-минерализуемого углерода в этих материалах, установить вклад свежего и трансформированного органического вещества органических остатков в формирование активного пула почвенного органического вещества.
ОБЪЕКТЫ И МЕТОДЫ
Характеристика органических материалов и условия проведения опытов. В лабораторных экспериментах на вермикулите (опыт 1) и с серой лесной среднесуглинистой почвой (Greyzemic Phaeozems Albic) (опыты 2 и 3), отобранной в слое 0–20 см под мелколиственным лесом (54°8340′ N 37°5719′ E), некосимым лугом (54°8337′ N 37°5755′ E) и на пашне (54°8240′ N 37°5641′ E), исследовали динамику разложения растительных остатков древесных и травянистых видов лесного и лугового фитоценозов соответственно, и сельскохозяйственных культур. Образцы лесной растительности отбирали в октябре, луговых трав, сельскохозяйственных культур и почвы – в первой декаде сентября. Все органические материалы высушивали при температуре 65°C и измельчали до частиц 10–3 мм. Листья деревьев характеризовались более узким соотношением C : N, чем мелкие ветви и тонкие корни (табл. 1). В надземной биомассе луговых трав и в соломе ячменя за исключением клевера отношение C : N было уже, чем в корнях.
Таблица 1.
Содержание углерода и азота в разных растительных остатках и в почве
| № | Материал | C | N | C : N |
|---|---|---|---|---|
| % от массы | ||||
| 1 | Опавшие листья дуба | 43.0 ± 3.2 | 0.99 ± 0.02 | 43.6 |
| 2 | Опавшие листья осины | 42.9 ± 0.6 | 0.92 ± 0.02 | 46.4 |
| 3 | Хвоя сосны | 49.1 ± 0.2 | 1.01 ± 0.01 | 48.9 |
| 4 | Опавшие ветви осины диаметром 10–3 мм | 46.5 ± 0.4 | 0.74 ± 0.03 | 63.1 |
| 5 | Тонкие корни деревьев диаметром 10–3 мм | 44.0 ± 1.1 | 0.53 ± 0.04 | 82.7 |
| 6 | Надземная масса лугового разнотравья | 41.1 ± 1.5 | 2.31 ± 0.10 | 17.8 |
| 7 | Корни лугового разнотравья | 39.1 ± 3.7 | 1.09 ± 0.07 | 36.1 |
| 8 | Солома ячменя | 37.7 ± 0.6 | 0.73 ± 0.03 | 52.1 |
| 9 | Корни ячменя | 37.0 ± 1.1 | 0.53 ± 0.06 | 70.3 |
| 10 | Надземная масса клевера | 40.9 ± 0.8 | 2.54 ± 0.03 | 16.1 |
| 11 | Корни клевера | 37.4 ± 0.9 | 3.02 ± 0.07 | 12.4 |
| 12 | Серая лесная почва под лесом | 1.88 ± 0.07 | 0.18 ± 0.00 | 10.5 |
| 13 | То же под луговыми травами | 1.57 ± 0.03 | 0.15 ± 0.00 | 10.2 |
| 14 | То же под посевом ячменя | 1.44 ± 0.02 | 0.14 ± 0.00 | 10.1 |
В опыте 1 оценивали чистое разложение растительных остатков без влияния почвы. Навески сухой массы органических материалов массой 0.1 г смешивали в стеклянных флаконах объемом 100 мл с вермикулитом (масса 1.3 г, объем 10 мл) и увлажняли до 70% от влагоемкости вермикулита, добавляя 4.4 мл дистиллированной воды. Вермикулит способствует равномерному увлажнению инкубируемых растительных остатков и придает нормальную аэрацию среды. Инкубацию образцов проводили при постоянной температуре 22°C. Постоянную влажность инкубируемых образцов поддерживали регулярным добавлением дистиллированной воды. Перед началом опыта инкубируемая смесь вермикулита с лесной растительностью инфицировалась суспензией, приготовленной из почвы, отобранной под лесом, с луговыми травами – под лугом, а с ячменем и клевером – на пашне. Продолжительность опыта 365 сут. Повторность – трехкратная. В течение инкубации определяли концентрацию C–CO2 в газовой фазе.
В опыте 2 исследовали влияние почвы на разложение растительных остатков. Навески растительных остатков массой 0.1 г смешивали с 10 г почвы, отобранной под соответствующими угодьями и помещали во флаконы объемом 100 мл. Остатки древесных видов смешивали с почвой из под леса, надземную биомассу и корни луговых трав – с почвой лугового участка, надземную биомассу и корни сельскохозяйственных культур – с пахотной почвой. Перед инкубацией добавляли дистиллированную воду до влажности почвы 25 мас. %. Продолжительность инкубации составляла 365 сут при температуре 22°C. Повторность – шестикратная. В трех флаконах измеряли концентрацию C–CO2 в газовой фазе проб в те же дни, что и в опыте 1. Остальные флаконы с образцами сохраняли для опыта 3.
В опыте 3 определяли последействие разных растительных остатков на размеры активного пула почвенного органического вещества (ПОВ). После основной инкубации почву из опыта 2 высушивали при температуре 65°C, перемешивали, добавляли 2.5 мл дистиллированной воды и повторно инкубировали при стандартных условиях температуры и влажности (22°C и 25 мас. %) на протяжении 183 сут, измеряя эмиссию C–CO2 в динамике.
Измерение продукции C–CO2 почвой и органическими остатками. Первое измерение концентрации C–CO2 в газовой фазе инкубируемых образцов проводили через 3–4 ч, а последующие – ежедневно в течение первой недели, затем три раза в неделю, в течение второго месяца инкубации – два раза в неделю, начиная с третьего месяца инкубации – один раз в семь или десять суток. За весь период инкубации в опытах 1 и 2 провели 49 отборов газовых проб, в опыте 3 – 25 отборов. Концентрацию C–СО2 определяли на газовом хроматографе (Кристалл Люкс 4000 М). После каждого измерения флаконы проветривали. Скорость потока C–CO2 (мг/100 г в сут) рассчитывали по разнице концентраций CО2 за время экспозиции. В вариантах с почвой количество продуцируемого органическими остатками C–CO2 устанавливали путем вычета C–CO2, выделившегося из почвы без добавления остатков. Кумулятивную величину продуцирования C–CO2 (мг/100 г) устанавливали путем прибавления количества C–CO2 в каждый срок измерения к сумме за предыдущие сроки.
Определение разложения органических материалов и содержания в почве активного органического вещества по количеству выделившегося C–CO2. Константу скорости разложения исследуемых образцов почвы и органических остатков в разные периоды инкубации и за целый год рассчитывали по уравнению:
(1)
$k = - {{\left[ {\ln \left( {{{{\text{C}}}_{{{{t}_{1}}}}}} \right) - \ln \left( {{{{\text{C}}}_{{{{t}_{2}}}}}} \right)} \right]} \mathord{\left/ {\vphantom {{\left[ {\ln \left( {{{{\text{C}}}_{{{{t}_{1}}}}}} \right) - \ln \left( {{{{\text{C}}}_{{{{t}_{2}}}}}} \right)} \right]} t}} \right. \kern-0em} t},$Количество биологически активного (потенциально-минерализуемого) органического вещества (С0) в исследуемых материалах рассчитывали по количеству минерализационных потерь C–CO2, используя однокомпонентное уравнение кинетики первого порядка:
где Ct – доля потерь C–CO2 (% от Cорг в образце) за время t (сут); C0 – содержание потенциально минерализуемого углерода, % от Cорг в образце; k – константа скорости минерализации, сут–1.Подставляя в уравнение (2) кумулятивные количества C–CO2 (Сt, мг/100 г), выделившегося за период инкубации (t, сут) в опытах 2 и 3, рассчитывали содержание в почве углерода активного органического вещества (С0, мг/100 г) на момент начала инкубации. Биокинетические параметры C0 и k вычисляли методом нелинейной оценки программы Statistica 6.0. Используя константы скорости минерализации, рассчитывали время кругооборота (TT, сут) углерода (TT = 1/k).
Определение в почве микробной биомассы, дисперсного органического вещества и органического углерода. Содержание углерода микробной биомассы (Смик) в почве определяли методом субстрат-индуцированного дыхания [10]. Фракцию дисперсного органического вещества (particulate organic matter, CPOM) выделяли по методу [19]. Воздушно-сухую почву размельчали до частиц меньше 2 мм. Навеску почвы массой 10 г диспергировали в 30 мл 0.5% раствора гексаметафосфата натрия (Na6P6O18) на шейкере в течение 15 ч при скорости 180 об./мин. Полученную суспензию пропускали через сито с диаметром отверстий 0.05 мм. Остаток на сите несколько раз промывали дистиллированной водой, до получения прозрачной промывной жидкости, далее сушили в течение часа при 40°С, после чего количественно переносили в емкость для высушивания при 65°С в течение суток. В каждом анализируемом образце почвы измеряли массу фракции в трех повторностях, содержание углерода во фракции CPOM в процентах от массы фракции и массы почвы. Содержание Cорг и Nобщ в целой почве, во фракции CPOM, и в растительных остатках, растертых до частиц <0.25 мм, определяли с помощью CNHS-анализатора (Leco 932, USA). Исходные данные даны в виде среднего ± стандартное отклонение.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Динамика разложения растительных остатков. Разложение – доминирующий в природе этап физических и химических изменений органических остатков. Для успешной внеклеточной деградации сложных органических гетерополимеров необходимо, чтобы органический субстрат присутствовал в почве и был доступен для микроорганизмов и/или экстрацеллюлярных ферментов; внеклеточные ферменты были защищены и функциональны; имелось корректное сочетание ферментов и микроорганизмов; химические и физические условия среды благоприятствовали катализу [18]. В глобальном и региональном масштабах скорость распада органических остатков контролируется температурой и влажностью среды, тогда как в местных условиях – химическим составом остатков, молекулярной организацией структур, их устойчивостью к воздействию ферментов и пространственной досягаемостью для микроорганизмов [17].
В нашем эксперименте за 30 сут инкубации на вермикулите разных растительных остатков было учтено от 22 до 73% от всего количества C–CO2, выделившегося за год (табл. 2). Энергичное образование диоксида углерода происходило при разложении корней и надземной массы клевера, надземной массы луговых трав (первая группа растительных остатков), более спокойное – в вариантах с листьями дуба и осины, корнями лугового разнотравья (вторая группа), заторможенное – с тонкими корнями и мелкими ветвями деревьев, хвоей сосны, корнями и соломой ячменя (третья группа). К концу второго и четвертого месяца инкубации доля диоксида углерода составила соответственно 37–82 и 54–88% от суммарного его количества за год. Если для первой группы растительных остатков доля C–CO2 между первым и четвертым месяцами инкубации возросла в 1.2–1.4 раза, то для второй и третьей группы – в 1.8–2.8 раза. Более трех четвертей от всей годовой продукции C–CO2, выделившегося при разложении надземной массой луговых трав, корней и надземной массы клевера, приходилось на стартовые 2 мес инкубации. Соответственно листьями дуба и осины – за 4 мес, а корнями луговых трав, соломой и корнями ячменя, хвоей сосны, тонкими корнями и мелкими ветвями деревьев – за 5–6 мес. На более поздних стадиях разложения темпы выделения C–CO2 из разных видов растительных остатков были примерно одинаковыми и слабыми.
Таблица 2.
Доля минерализационных потерь углерода на разных стадиях разложения органического вещества растительных остатков и почвы, % от всего C–CO2 за год
| Номер образца | Сутки с начала разложения | |||||
|---|---|---|---|---|---|---|
| 30 | 60 | 120 | 180 | 240 | 300 | |
| Опыт 1 с вермикулитом | ||||||
| 1 | 33 | 52 | 77 | 88 | 92 | 97 |
| 2 | 36 | 57 | 78 | 87 | 92 | 97 |
| 3 | 27 | 44 | 70 | 82 | 89 | 96 |
| 4 | 22 | 37 | 61 | 75 | 84 | 93 |
| 5 | 24 | 37 | 54 | 67 | 79 | 89 |
| 6 | 59 | 75 | 85 | 89 | 93 | 97 |
| 7 | 33 | 44 | 61 | 74 | 84 | 94 |
| 8 | 29 | 43 | 61 | 74 | 84 | 95 |
| 9 | 25 | 38 | 60 | 78 | 87 | 95 |
| 10 | 64 | 74 | 83 | 88 | 93 | 97 |
| 11 | 73 | 82 | 88 | 92 | 95 | 98 |
| Опыт 2 с почвой | ||||||
| 12 | 38 | 49 | 64 | 75 | 84 | 93 |
| 13 | 35 | 44 | 62 | 75 | 83 | 95 |
| 14 | 29 | 40 | 59 | 72 | 82 | 92 |
Примечание. Номера образцов см. в табл. 1.
Известно, что на ранних стадиях разложения растительного опада скорость ферментативного расщепления целлюлозы (целлюлолизис) в значительной степени контролируется наличием азота, а на поздних стадиях присутствием лигнина, который ограничивает доступ ферментов к полисахаридам клеточных стенок [3, 39]. Опад широколистных деревьев отличается большей начальной концентрацией питательных элементов и меньшим содержанием лигнина и полифенолов по сравнению с опадом хвойных деревьев [13, 36]. Эта разница в качестве способствует большей стартовой скорости разложения листьев широколистных пород.
Различия между растительными остатками по скорости и размерам минерализации. Из-за структурно-молекулярной неоднородности разлагаемого материала, присутствия гидрофобных и разных по сложности и растворимости биомолекул разложение остатков включает в себя от одной до нескольких стадий, различающихся по скорости потери массы или интенсивности продукции C–CO2 [8, 9, 12, 16].
Выраженная неравномерность разложения остатков деревьев, трав и сельскохозяйственных культур хорошо подтверждается изменением констант скорости минерализации на протяжении года инкубации (табл. 3). Исследуемые виды растительных остатков на разных стадиях инкубации разлагались со средней (0.1 > k1 > 0.01 сут–1), медленной (0.01 > k2 > 0.001 сут–1) и очень медленной (k3 < 0.001 сут–1) скоростью со временем оборота, равным 10 < TT1 < 100, 100 < TT2 < 1000 и TT3 > 1000 сут соответственно. Полученные константы совпадают с таковыми соответственно для свободных форм целлюлозы и гемицеллюлозы, лигноцеллюлозы и лигнина (кутина, суберина). Четырем видам растительных остатков (листья дуба, надземная масса луговых трав, надземная масса и корни клевера) была характерна структура из трех пулов органического вещества со средней, медленной и очень медленной скоростью минерализации, тогда как у семи остальных, преимущественно медленно разлагаемых – из двух пулов соответственно, с медленной и очень медленной скоростью минерализации. В нашем эксперименте не было получено констант, соответствующих четвертому пулу с быстрым разложением (k > 0.1 сут–1, TT < 10 сут), что могло быть обусловлено относительно низким содержанием быстро минерализуемых соединений (аминокислоты, амиды, простые белки и сахара), вклад которых в общую продукцию C–CO2 был малозаметным по сравнению с вкладом целлюлозно-гемицеллюлозного комплекса. Считается, что модель из трех пулов лучше всего описывает состав растительных остатков, органическое вещество которых представлено лабильным (растворимым) пулом с относительно быстрым разложением (k1 > 1 год–1), пулом целлюлозы с более медленным разложением (k2 ~ 0.8 год–1) и прочным пулом лигнина по существу не разлагаемым (k3 = 0) за 10-летний период [12]. Однако длительное разложение растительных остатков практически невозможно отобразить одним уравнением, три или четыре компонента которого были бы релевантны соответствующим пулам и имели бы реальные, математически достоверные и воспроизводимые значения. Более надежный подход при подразделении разлагаемого материала – это аппроксимация кривых потерь массы и/или выделения C–CO2 двухкомпонентным уравнением кинетики первого порядка с выделением двух пулов [2, 5, 9], либо подразделение на пулы по константам разложения, вычисленным для разных стадий процесса (табл. 3).
Таблица 3.
Константы скорости минерализации органического вещества растительных остатков и почвы на разных стадиях разложения, сут–1
| Номер образца | Сутки с начала разложения | |||||
|---|---|---|---|---|---|---|
| 1–4 | 4–30 | 30–90 | 90–180 | 180–270 | 270–365 | |
| Опыт 1 с вермикулитом | ||||||
| 1 | 0.010* | 0.006** | 0.004** | 0.002** | 0.0008*** | 0.0007*** |
| 2 | 0.007** | 0.005** | 0.003** | 0.001** | 0.0007*** | 0.0004*** |
| 3 | 0.006** | 0.003** | 0.002** | 0.001** | 0.0006*** | 0.0004*** |
| 4 | 0.003** | 0.002** | 0.001** | 0.0009*** | 0.0005*** | 0.0004*** |
| 5 | 0.005** | 0.002** | 0.001** | 0.0007*** | 0.0006*** | 0.0005*** |
| 6 | 0.028* | 0.014* | 0.005** | 0.001** | 0.001** | 0.0009*** |
| 7 | 0.009** | 0.004** | 0.002** | 0.001** | 0.001** | 0.0007*** |
| 8 | 0.006** | 0.004** | 0.002** | 0.002** | 0.001** | 0.0008*** |
| 9 | 0.005** | 0.002** | 0.001** | 0.001** | 0.0007*** | 0.0004*** |
| 10 | 0.045* | 0.012* | 0.003** | 0.001** | 0.001** | 0.0008*** |
| 11 | 0.043* | 0.022* | 0.004** | 0.001** | 0.001** | 0.0009*** |
| Опыт 2 с почвой | ||||||
| 12 | 0.004** | 0.0008*** | 0.0003*** | 0.0002*** | 0.0002*** | 0.0001*** |
| 13 | 0.003** | 0.0006*** | 0.0003*** | 0.0002*** | 0.0002*** | 0.0001*** |
| 14 | 0.001** | 0.0004*** | 0.0002*** | 0.0001*** | 0.0001*** | 0.0001*** |
Примечание. Номера образцов см. в табл. 1. Символы *, **, *** обозначают фракции со средней (0.1 > k1 > 0.01), медленной (0.01 > k2 > 0.001) и очень медленной (k3 < 0.001) скоростью минерализации, сут–1. Рассчитано по уравнению (1).
За год инкубации на вермикулите минерализовалось 25–67% от Cорг, содержащегося в исследуемых органических материалах (табл. 4). Минерализационная способность органических материалов уменьшалась в следующей последовательности: корни клевера > надземная масса луговых трав > > надземная масса клевера > листья дуба > солома ячменя > листья осины > корни луговых трав > > хвоя сосны > корни ячменя > мелкие ветви деревьев > тонкие корни деревьев. Корни и надземную массу клевера, надземную массу луговых трав можно отнести к группе сильно разлагаемых материалов (>50% от Cорг), листья дуба и осины, хвою сосны, корни луговых трав, солому и корни ячменя – к умеренно разлагаемым (от 30 до 50% от Cорг), а мелкие ветви деревьев и тонкие корни деревьев – к слабо разлагаемым (<30% от Cорг). Согласно литературным данным типы биомов по способности к разложению ранжируются в следующем порядке: тропический лес > болотный лес > широколиственный лес > широколиственный и хвойный смешанный лес > пастбища > кустарниковая земля > хвойные леса > > тундра [41]. Разложение подстилки тропических лесов было в семь раз быстрее, чем тундровой растительности [41]. По данным этих же авторов скорость разложения разных видов растительных остатков уменьшалась в следующей последовательности: листья трав > мох > опад широколиственных пород > корни > хвоя > кора > ветви > > древесина хвойных деревьев [41]. Тонкие корни разлагаются примерно в 1.5 и 2.8 раза медленнее, чем листовой опад тех же видов растений с сильными различиями между древесными и травянистыми видами [26].
Таблица 4.
Эффективность минерализации растительных остатков в зависимости от продолжительности их разложения
| Номер образца | Эффективность минерализации, % от Cорг в образце | Константа скорости минерализации, сут–1 | ||||
|---|---|---|---|---|---|---|
| I | II | III | I | II | III | |
| Опыт 1 с вермикулитом | ||||||
| 1 | 44.9 ± 2.4 | 51.0 ± 5.2 | 52.3 ± 3.2 | 0.046 | 0.014 | 0.013 |
| 2 | 38.8 ± 5.2 | 40.3 ± 2.4 | 42.9 ± 1.2 | 0.018 | 0.017 | 0.014 |
| 3 | 26.7 ± 0.5 | 33.5 ± 0.6 | 35.3 ± 1.4 | 0.015 | 0.011 | 0.010 |
| 4 | 18.5 ± 2.4 | 24.8 ± 2.5 | 27.8 ± 2.0 | 0.012 | 0.008 | 0.007 |
| 5 | 12.0 ± 1.0 | 17.1 ± 3.7 | 25.5 ± 5.1 | 0.023 | 0.013 | 0.006 |
| 6 | 52.0 ± 3.3 | 55.8 ± 2.9 | 59.3 ± 2.8 | 0.046 | 0.040 | 0.034 |
| 7 | 19.4 ± 2.3 | 27.2 ± 1.1 | 38.3 ± 4.0 | 0.040 | 0.019 | 0.009 |
| 8 | 24.9 ± 2.9 | 33.0 ± 4.8 | 43.8 ± 3.3 | 0.025 | 0.015 | 0.008 |
| 9 | 16.5 ± 0.3 | 27.7 ± 0.4 | 32.8 ± 0.4 | 0.021 | 0.009 | 0.007 |
| 10 | 45.7 ± 5.5 | 50.2 ± 5.8 | 54.5 ± 6.1 | 0.088 | 0.068 | 0.053 |
| 11 | 61.2 ± 1.0 | 63.8 ± 0.9 | 66.9 ± 0.9 | 0.066 | 0.060 | 0.053 |
| Опыт 2 с почвой | ||||||
| 12 | 5.1 ± 0.1 | 6.8 ± 0.1 | 9.0 ± 0.1 | 0.061 | 0.029 | 0.013 |
| 13 | 4.9 ± 0 | 6.8 ± 0 | 9.8 ± 0 | 0.059 | 0.023 | 0.011 |
| 14 | 3.6 ± 0.1 | 5.4 ± 0 | 7.4 ± 0 | 0.036 | 0.016 | 0.008 |
Примечание. Номера образцов см. в табл. 1. Цифрами I, II, III соответственно обозначена продолжительность разложения 90, 180 и 365 сут. Аппроксимация экспериментальных данных производилась по уравнению (2).
Как было отмечено выше, разложение органических материалов зависит от его биохимического качества, одним из показателей которого является соотношение C : N. В нашем исследовании, чем шире было соотношение C : N в разлагаемом материале, тем меньше был процент минерализации и меньше константа скорости минерализации (рис. 1). Отсутствие достоверных корреляций содержания Cорг в органическом материале со степенью разложения и с константой скорости минерализации и наличие таковых с содержанием общего азота указывает, что азот является основным фактором, лимитирующим разложение органических материалов. Содержание азота в растительном материале зависит от вида растений, физиологической специализации органов, стадии онтогенеза, питательного режима и других факторов. Хорошо известно, что представители бобовых характеризуются большим содержанием азота, чем другие виды, листья – чем стебли, а зеленая фитомасса ранних стадий, чем зрелая. Несмотря на одно и то же время отбора образцов лугового разнотравья и сельскохозяйственных культур, солома ячменя соответствовала зрелому состоянию растений, тогда как надземная масса разнотравья и клевера представляла собой зеленую массу. Ранее было показано, что зеленая масса одних и тех же видов растений разлагается значительно сильнее, чем зрелая [9]. Можно также заметить, что структура из трех или двух пулов органического вещества была свойственна растительным остаткам, существенно отличающимся по отношению C : N. Отношение C : N, давая общее представление о способности органических материалов к разложению, не всегда пригодно в качестве индикатора биологического качества разлагаемого материала и динамики разложения [36].
Рис. 1.
Зависимость размеров (I) и скорости (II) разложения растительных остатков от соотношения C : N и содержания азота в их составе.
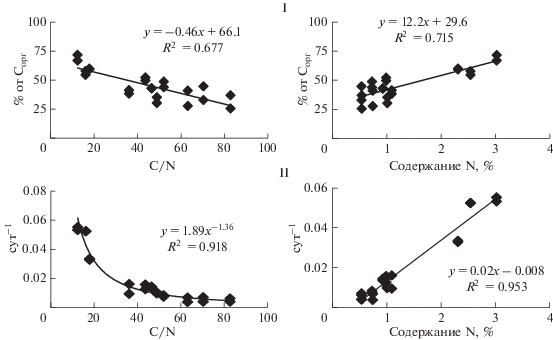
Из полученных данных следует, что при оценке разложения растительных остатков период наблюдений должен быть не только длительным, но и стандартным по продолжительности. В противном случае велика вероятность получения искаженных представлений о динамике разложения и способности органических материалов к разложению, особенно слабо разлагаемых видов. Если инкубировать не три, а шесть месяцев, то величины минерализации растительных остатков окажутся больше в среднем на 5.8% от Cорг, а константы скорости минерализации, наоборот, меньше почти в 1.7 раза. Увеличение продолжительности инкубации до года в большей мере отражается на значениях констант и в меньшей мере – на величинах минерализационного потенциала растительных остатков. Таким образом, краткосрочная инкубация в течение 1–3 мес, нередко используемая в исследованиях, неприемлема при оценке разложения растительных остатков. В исследованиях необходимо использовать одинаковую продолжительность наблюдений за разложением растительных остатков. При прогнозировании минерализационных потерь углерода растительных остатков важно учитывать продолжительность периода разложения и неравномерность скорости минерализации на ранней и поздней стадии трансформации. Получение параметров разложения растительных остатков по динамике выделения C–CO2 не дает строгой идентификации биохимического состава разлагаемого материала, но позволяет судить о его потенциальной способности трансформироваться микроорганизмами.
Влияние почвы на разложение растительных остатков. В нашем эксперименте одна часть образцов растительных остатков инкубировалась в смеси с вермикулитом (опыт 1), в которую добавляли разбавленную почвенную суспензию, а другая часть тех же образцов – с почвой (опыт 2). Это позволило оценить влияние почвы на разложение растительных остатков. Оказалось, что ни на ранних (4 и 30 сут), ни на поздних (180 и 365 сут) стадиях инкубации с вермикулитом и с почвой кумулятивные размеры продукции C–CO2 (г/100 г массы растительных остатков), константы скорости минерализации (сут–1) и коэффициенты минерализации (% от Cорг в растительных остатках) в среднем для 11 видов растительных остатков были одного и того же порядка, не различаясь в целом по t-критерию Стьюдента (табл. 5). В начале эксперимента (0–4 сут) смешивание растительных остатков с почвой способствовало достоверному усилению их разложения в 1.2–1.3 раза только в трех вариантах из одиннадцати по сравнению с компостированием на вермикулите, а в двух – ослаблению разложения. В остальных вариантах влияние почвы было не значимым. Через месяц положительное или отрицательное влияние почвы достоверно проявлялось для четырех видов растительных остатков, через полгода и к концу инкубации – для трех видов. Образование экстра-СО2 или экстра-Nмин в присутствии легкоразлагаемого субстрата связывается с развитием положительного прайминг-эффекта, а уменьшение размеров их продукции – отрицательного прайминг-эффекта [6, 30]. Внесение растительных остатков могло способствовать дополнительной минерализации органического вещества собственно почвы, а присутствие в почве минеральных форм азота – стимулировать разложение материалов с широким отношением C : N. В то же время промежуточные продукты разложения растительных остатков и новообразованной микробной биомассы могли прочнее стабилизироваться в почве, чем в вермикулите, что и предопределяло более слабое выделение C–CO2 в отдельные сроки трансформации некоторых видов растительных остатков, смешанных с почвой. Показано, что полидисперсный и полиминеральный состав суглинка способствует более быстрой и прочной стабилизации органических соединений, по сравнению с мономинеральной средой [5]. Таким образом, при инкубации с почвой получаются в целом те же характеристики процесса разложения растительных остатков, что и на вермикулите, инокулированном почвенной суспензией.
Таблица 5.
Оценка различий разложения растительных остатков, инкубируемых с вермикулитом и с почвой
| Сутки опыта | Фон | Минимум | Максимум | Среднее | Стандартное отклонение | t05 | P |
|---|---|---|---|---|---|---|---|
| Кумулятивное выделение C–CO2, г/100 г сухой массы | |||||||
| 4 | 1 | 0.5 | 6.8 | 2.2 | 2.1 | –0.16 | 0.88 |
| 2 | 0.4 | 6.8 | 2.4 | 2.4 | |||
| 30 | 1 | 2.5 | 19.8 | 8.1 | 6.2 | –0.29 | 0.77 |
| 2 | 2.7 | 20.4 | 8.8 | 6.2 | |||
| 180 | 1 | 7.1 | 25.2 | 15.6 | 6.5 | –0.37 | 0.71 |
| 2 | 7.9 | 27.9 | 16.6 | 6.9 | |||
| 365 | 1 | 10.6 | 27.3 | 18.6 | 6.2 | –0.86 | 0.40 |
| 2 | 13.7 | 30.0 | 20.8 | 5.8 | |||
| Константа скорости разложения, сут–1 | |||||||
| 4 | 1 | 0.003 | 0.045 | 0.015 | 0.016 | –0.10 | 0.92 |
| 2 | 0.001 | 0.049 | 0.016 | 0.018 | |||
| 30 | 1 | 0.002 | 0.022 | 0.007 | 0.007 | –0.20 | 0.84 |
| 2 | 0.002 | 0.022 | 0.007 | 0.006 | |||
| 180 | 1 | 0.001 | 0.002 | 0.001 | 0.000 | –0.45 | 0.66 |
| 2 | 0.001 | 0.002 | 0.001 | 0.000 | |||
| 365 | 1 | 0.0004 | 0.001 | 0.001 | 0.000 | –1.21 | 0.24 |
| 2 | 0.0004 | 0.001 | 0.001 | 0.000 | |||
| Эффективность минерализации, % от Cорг в растительных остатках | |||||||
| 4 | 1 | 1.1 | 16.6 | 5.5 | 5.4 | –0.18 | 0.86 |
| 2 | 0.6 | 16.9 | 6.0 | 6.2 | |||
| 30 | 1 | 5.8 | 52.9 | 19.9 | 16.2 | –0.22 | 0.83 |
| 2 | 5.9 | 54.2 | 21.4 | 16.2 | |||
| 180 | 1 | 16.2 | 67.2 | 37.8 | 16.8 | –0.16 | 0.87 |
| 2 | 17.5 | 72.6 | 39.1 | 18.3 | |||
| 365 | 1 | 24.2 | 72.9 | 45.2 | 16.4 | –0.43 | 0.67 |
| 2 | 30.2 | 77.3 | 48.1 | 15.7 | |||
Растительные остатки как источник атмосферного диоксида углерода. Ежегодно разложение растительного детрита и почвенного органического вещества дает в атмосферу в 10 раз больше CО2, чем сжигание ископаемого топлива и промышленные источники [35]. При разложении мировых запасов лесного опада (листья, хвоя, крупные и мелкие ветви, кора, цветы, шишки и др.) и мертвой древесины образуется соответственно 60 Тг и 2.1–11 Пг C–CO2 в год [13]. В старом хвойном лесу корневое и ризосферное дыхание составляло 23% от общей почвенной эмиссии CО2, разложение надземного опада – 19%, а разложение внутрипочвенных остатков – 58% [37]. Несмотря на количественно значимую роль разложения органических остатков в глобальном балансе углерода потенциальный вклад отдельных органических материалов в эмиссию диоксида углерода требует уточнений.
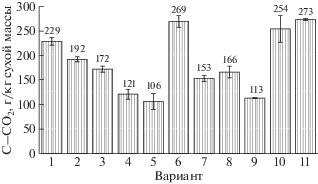
Из опавших листьев и хвои деревьев образовывалось почти в 2 раза больше CО2, чем из мелких ветвей и тонких корней (рис. 2). Остатки вегетирующих луговых трав, особенно наземная масса, давали высокие размеры продукции CО2, что могло быть обусловлено как преобладанием в травосмеси видов, не достигших еще физиологической зрелости, так и присутствием представителей бобовых растений. Последнее предположение подтверждается наибольшей среди всех органических материалов продукцией CО2 при разложении клевера. В пересчете на сухое вещество килограмм растительных остатков давал в 69–263 раз больше диоксида углерода, чем ПОВ. Поэтому, во-первых, чем сильнее почва обогащена растительными остатками, тем выше ее эмиссионный потенциал, и, во-вторых, локальные различия в размерах наземного и корневого опада могут быть причиной значительной вариабельности потоков диоксида углерода из почвы.
Рис. 2.
Годовые величины нетто продукции диоксида углерода разлагающимися растительными остатками. По данным опыта 1. Номера вариантов см. в табл. 1.
Роль органических материалов в формировании активного пула почвенного органического вещества. В результате ферментных атак органические материалы разрушаются на отдельные фрагменты и частицы, образуются крупные и мелкие молекулы биополимеров, которые либо стабилизируются, либо продолжают расщепляться, минерализуясь до диоксида углерода [32]. Из экспериментов, в которых разложение оценивалось по потере массы в сетчатых мешочках, следовало, что почвенное органическое вещество формируется в основном за счет медленно разлагаемой части опада и устойчивых к разложению соединений остатков [16]. По новому представлению 1) растительные ткани не обладают особой устойчивостью к распаду, поэтому стабильность ПОВ контролируется не за счет селективного сохранения прочных соединений, содержащихся в растительных тканях, а в результате физической, химической и биологической защищенности продуктов разложения; 2) растворимые и быстро разлагаемые компоненты растительных остатков эффективнее утилизируются микроорганизмами и стабилизируются минеральной матрицей, чем трудно разлагаемые соединения; 3) продукты разложения микробной биомассы стабилизируются прочнее, чем растительных остатков [5, 7, 9, 11, 20, 22, 23, 40].
В 9 из 11 вариантов с растительными остатками содержание Cорг в почве после года инкубации было таким же или немного больше, чем до инкубации (табл. 6). Это указывает на то, что минерализационные потери углерода почвы практически полностью компенсировались углеродом растительных остатков. В почве со слабо разлагаемыми растительными остатками получен самый высокий прирост Cорг (r = –0.886, P < 0.001). В контрольных вариантах без растительных остатков убыль Cорг сопровождалась уменьшением содержания дисперсного (СPOM) и биологически активного (С0) органического вещества в 1.2–1.5 и 2.6–2.8 раза соответственно. Следовательно, фракция CPOM дает лишь некоторую часть потенциально-минерализуемого ПОВ. В проинкубированной с остатками деревьев почве содержалось в 1.1–1.7 раза больше CPOM, чем в почве, которую инкубировали без растительных остатков. В почве с остатками луговых трав содержалось в 1.4–1.8 раз больше CPOM, а в пахотной почве с остатками ячменя и клевера – в 2.0–2.8 раза больше, чем без растительных остатков. В целом по опыту практически все виды растительных остатков компенсировали CPOM, расходуемый в течение годовой инкубации.
Таблица 6.
Содержание общего (Сорг), дисперсного (СPOM), активного (С0) органического вещества и микробной биомассы (Смик) в почве после 365-суточной инкубации с разными растительными остатками
| Вариант | Сорг, % от массы почвы | СPOM | С0 | Смик | |||
|---|---|---|---|---|---|---|---|
| мг/100 г | % от Cорг | мг/100 г | % от Cорг | мг/100 г | % от Cорг | ||
| Почва под лесом (фон I) | 1.67 (1.88) | 562 (680) | 33.8 (36.0) | 49 (128) | 2.9 (6.8) | 16 | 1.0 |
| I + листья дуба | 1.83 | 642 | 35.1 | 74 | 4.1 | 20 | 1.1 |
| I + листья осины | 1.89 | 669 | 35.5 | 64 | 3.4 | 19 | 1.0 |
| I + хвоя сосны | 2.03 | 721 | 35.5 | 75 | 3.7 | 18 | 0.9 |
| I + ветви осины | 1.97 | 889 | 45.0 | 78 | 4.0 | 16 | 0.8 |
| I + корни деревьев | 1.94 | 936 | 48.3 | 76 | 3.9 | 16 | 0.8 |
| Почва под лугом (фон II) | 1.46 (1.57) | 346 (430) | 23.7 (27.3) | 41 (112) | 2.8 (7.1) | 9 | 0.6 |
| II + надземная масса луговых трав | 1.60 | 497 | 31.0 | 62 | 3.9 | 13 | 0.8 |
| II + корни луговых трав | 1.67 | 614 | 36.7 | 66 | 4.0 | 13 | 0.8 |
| Пахотная почва (фон III) | 1.32 (1.44) | 155 (230) | 11.7 (15.9) | 27 (77) | 2.0 (5.4) | 6 | 0.4 |
| III + солома ячменя | 1.49 | 411 | 27.5 | 51 | 3.4 | 8 | 0.5 |
| III + корни ячменя | 1.56 | 434 | 27.8 | 61 | 3.9 | 8 | 0.5 |
| III + масса клевера | 1.49 | 340 | 22.8 | 47 | 3.1 | 10 | 0.7 |
| III + корни клевера | 1.41 | 309 | 21.9 | 44 | 3.1 | 11 | 0.8 |
Частично разложившиеся растительные остатки и продукты разложения создавали повышенный уровень содержания C0 в проинкубированной почве леса, луга и пашни в 1.3–1.6, 1.5–1.6 и 1.6–2.2 раз соответственно, по сравнению с вариантами без растительных остатков. Однако ни в одном случае не было полной компенсации потенциально-минерализуемого органического вещества, содержащегося в исходных образцах почвы до инкубации. Скорее всего, внесенных в почву растительных остатков из расчета ≈25 т/га сухого вещества было недостаточно для поддержания C0 на уровне, свойственном почвам в естественных условиях.
По однократному измерению углерода микробной биомассы (Смик) после года инкубации почвенных образцов нельзя дать точный вклад отмершей микробной биомассы в обновление ПОВ. Однако можно с уверенностью говорить, что разложение растительных остатков способствовало увеличению микробного органического вещества. При этом сильно разлагаемые растительные остатки давали больший прирост микробной биомассы в почве (r = 0.864, P = 0.001), что хорошо согласуется с данными [20, 23]. Наоборот, наибольшее увеличение содержания CPOM в почве обнаруживалось в вариантах со слабо разлагаемыми растительными остатками (r = –0.637, P = = 0.035). Положительное влияние слабо разлагаемых растительных остатков на содержание C0 в почве было более продолжительным, чем сильно разлагаемых, о чем свидетельствует отрицательная корреляция между процентом минерализации растительных остатков и содержанием C0 в почве по истечению года инкубации (r = –0.734, P = 0.010). Получена достоверная корреляция содержания в почве Cорг с CPOM (r = 0.945, P < 0.001), C0 (r = 0.909, P < 0.001) и Cмик (r = 0.870, P < 0.001) после завершения инкубации, с одной стороны, и между CPOM и C0 (r = 0.914, P < 0.001), CPOM и Cмик (r = 0.796, P = 0.001), C0 и Cмик (r = 0.748, P = 0.002), с другой. В другом эксперименте к концу 19-месячной инкубации остатков кукурузы с суглинком 12% внесенного углерода обнаруживалось в первой легкой фракции (LF1 < 1.4 г/см3), 9.7% – во второй легкой фракции (1.4 < LF2 < 2.2 г/см3) и 8.5% – в составе тяжелой фракции (HF > 2.2 г/см3), связанной с присутствующими в ней минералами [4].
На основании полученных связей можно предположить, что включение в ПОВ разлагающихся растительных остатков идет по пути их фрагментирования до твердых дискретных частиц по мере освоения субстрата микроорганизмами, и синтеза микробной биомассы. Твердые дискретные частицы, образующие фракцию CPOM, и микробная биомасса являются главными источниками биологически активного органического вещества в почве. Продукты разложения микробной биомассы вместе с высвобождаемыми из растительных остатков биополимерами, взаимодействуя между собой и с фракциями пыли и глины, образуют гумус, относящийся к стабильной части ПОВ. Остатки корней имеют более значимую роль в формировании ПОВ, чем надземной биомассы. Корни уже находятся в почве и их разлагаемые остатки могут сразу же участвовать в образовании агрегатов или связываться глинистыми минералами, приобретая защищенное от дальнейшего разложения состояние. Остатки корней, как правило, разлагаются медленнее, чем надземной биомассы, благодаря чему удлиняется период снабжения почвенных микроорганизмов углеродом.
ЗАКЛЮЧЕНИЕ
Скорость выделения C–CO2 является чувствительным индикатором разложения и минерализации растительных остатков, а кумулятивные величины эмиссии C–CO2 за длительный период инкубации позволяют оценить долю потенциально-минерализуемого органического вещества в растительных остатках. Более трех четвертей от всей годовой продукции газообразного C–CO2 при разложении надземной массой луговых трав, корней и надземной массы клевера выделилось за стартовые 2 мес инкубации, листьев дуба и осины – за 4 мес, корней луговых трав, соломы и корней ячменя, хвои сосны, тонких корней и мелких ветвей деревьев – за 5–6 мес. На более поздних стадиях разложения темпы выделения C–CO2 из разных видов растительных остатков были примерно одинаковыми и слабыми.
Органическому веществу листьев дуба, надземной массы луговых трав, надземной массы и корней клевера свойственна структура из трех пулов со средней (0.1 > k1 > 0.01 сут–1), медленной (0.01 > k2 > 0.001 сут–1) и очень медленной (k3 < < 0.001 сут–1) скоростью минерализации. Для корней луговых трав, соломы и корней ячменя, листьев осины, хвои сосны, тонких корней и мелких ветвей деревьев идентифицирована структура из двух пулов с медленной и очень медленной скоростью минерализации.
За год инкубирования на вермикулите минерализовалось 25–67% от Cорг, содержащегося в растительных остатках. Корни и надземная масса клевера, надземная масса луговых трав относятся к группе сильно разлагаемых материалов (>50% от Cорг), листья дуба и осины, хвоя сосны, корни луговых трав, солома и корни ячменя – к умеренно разлагаемым (от 30 до 50% от Cорг), а мелкие ветви и тонкие корни деревьев – к слабо разлагаемым материалам (<30% от Cорг). Содержание азота в растительных остатках было основным фактором, лимитирующим их разложение.
При прогнозировании минерализационных потерь углерода растительных остатков важно учитывать продолжительность периода разложения и неравномерность скорости минерализации на ранней и поздней стадии трансформации. Краткосрочная инкубация в течение 1–3 мес неприемлема при оценке разложения растительных остатков.
Включение разлагающихся растительных остатков в почвенное органическое вещество идет по пути их фрагментирования микроорганизмами-деструкторами и синтеза микробной биомассы. Медленно и слабо разлагаемые виды растительных остатков являются основным источником дисперсного органического вещества в почве, а быстро и сильно разлагаемые – микробной биомассы. Твердые дискретные частицы фракции дисперсного органического вещества (particulate organic matter) и микробная биомасса являются главными источниками биологически активного (потенциально-минерализуемого) органического вещества в почве.
Список литературы
Кудеяров В.Н. Дыхание почв и биогенный сток углекислого газа на территории России (аналитический обзор) // Почвоведение. 2018. № 6. С. 643–658. https://doi.org/10.7868/S0032180X18060011
Ларионова А.А., Квиткина А.К., Быховец C.С., Лопес де Гереню В.О., Колягин Ю.Г., Каганов В.В. Влияние азота на минерализацию и гумификацию лесных опадов в модельном эксперименте // Лесоведение. 2017. № 2. С. 128–139.
Ларионова А.А., Мальцева А.Н., Лопес де Гереню В.О., Квиткина А.К., Быховец C.С., Золотарева Б.Н., Кудеяров В.Н. Влияние температуры и влажности на минерализацию и гумификацию лиственного опада в модельном инкубационном эксперименте // Почвоведение. 2017. № 4. С. 438–448. https://doi.org/10.7868/S0032180X17020083
Мальцева А.Н., Золотарева Б.Н., Пинский Д.Л. Трансформация растительных остатков кукурузы в суглинистом и песчаном субстратах // Почвоведение. 2013. № 10. С. 1239–1252. https://doi.org/10.7868/S0032180X13100080
Пинский Д.Л., Мальцева А.Н., Золотарева Б.Н., Дмитриева Е.Д. Кинетика трансформации растительных остатков кукурузы и клевера в минеральных субстратах различного состава // Почвоведение. 2017. № 6. С. 690–697. https://doi.org/10.7868/S0032180X17060090
Семенов В.М. Образование экстра-азота в удобренных почвах и его роль в питании растений // Агрохимия. 1999. № 8. С. 5–12.
Cеменов В.М., Тулина А.С., Cеменова Н.А., Иванникова Л.А. Гумификационные и негумификационные пути стабилизации органического вещества в почве (обзор) // Почвоведение. 2013. № 4. С. 393–407. https://doi.org/10.7868/S0032180X13040114
Семенов В.М., Иванникова Л.А., Кузнецова Т.В., Тулина А.С., Кудеяров В.Н. Разложение и минерализация фитомассы в серой лесной почве: кинетический анализ // Почвоведение. 2001. № 5. С. 569–577.
Семенов В.М., Иванникова Л.А., Кузнецова Т.В., Cеменова Н.А. Роль растительной биомассы в формировании активного пула органического вещества почвы // Почвоведение. 2004. № 11. С. 1350–1359.
Семенов М.В., Cтольникова Е.В., Ананьева Н.Д., Иващенко К.В. Структура микробного сообщества почвы катены правобережья р. Оки // Известия РАН. Cер. биологическая. 2013. № 3. С. 299–308. https://doi.org/10.7868/S0002332913030089
Трофимов C.Я., Лазарев А.С., Фокин А.Д. Минерализация лабильных фрагментов органического вещества гумусово-аккумулятивного горизонта дерново-подзолистой почвы // Почвоведение. 2012. № 12. С. 1259–1268.
Adair E.C., Parton W.J., Del Grosso S.J., Silver W.L., Harmon M.E., Hall S.A., Burke I.C., Hart S.C. Simple three-pool model accurately describes patterns of long-term litter decomposition in diverse climates // Global Change Biology. 2008. V. 14. № 11. P. 2636–2660. https://doi.org/10.1111/j.1365-2486.2008.01674.x
Bani A., Pioli S., Ventura M., Panzacchi P., Borruso L., Tognetti R., Tonon G., Brusetti L. The role of microbial community in the decomposition of leaf litter and Deadwood // Applied Soil Ecology. 2018. V. 126. P. 75–84. https://doi.org/10.1016/j.apsoil.2018.02.017
Bar-On Y.M., Phillips R., Milo R. The biomass distribution on Earth // PNAS. 2018. V. 115 (25). P. 6506–6511. https://doi.org/10.1073/pnas.1711842115
Baruya P. World forest and agricultural crop residue resources for cofiring. London: IEA Clean Coal Centre, 2015. 66 p.
Berg B., McClaugherty C. Plant Litter: Decomposition, Humus Formation, Carbon Sequestration. Third Edition. Berlin, Heidelberg: Springer-Verlag, 2014. 315 p. https://doi.org/10.1007/978-3-642-38821-7
Bradford M.A., Berg B., Maynard D.S., Wieder W.R., Wood S.A. Understanding the dominant controls on litter decomposition // J. Ecology. 2016. V. 104. P. 229–238. https://doi.org/10.1111/1365-2745.12507
Burns R.G., DeForest J.L., Marxsen J., Sinsabaugh R.L., Stromberger M.E., Wallenstein M.D., Weintraub M.N., Zoppini A. Soil enzymes in a changing environment: Current knowledge and future Directions // Soil Biol. Biochem. 2013. V. 58. P. 216–234. https://doi.org/10.1016/j.soilbio.2012.11.009
Cambardella C.A., Elliott E.T. Particulate Soil Organic-Matter Changes across a Grassland Cultivation Sequence // Soil Sci. Soc. Am. J. 1992. V. 56. № 3. P. 777–783. https://doi.org/10.2136/sssaj1992.03615995005600030017x
Castellano M.J., Mueller K.E., Olk D.C., Sawyer J.E., Six J. Integrating plant litter quality, soil organic matter stabilization, and the carbon saturation concept // Global Change Biology. 2015. V. 21. № 9. P. 3200–3209. https://doi.org/10.1111/gcb.12982
Cornwell W.K., Cornelissen J.H.C., Amatangelo K., Dorrepaal E., Eviner V.T., Godoy O., Hobbie S.E., Hoorens B., Kurokawa H., Pérez-Harguindeguy N., Quested H.M., Santiago L.S., Wardle D.A., Wright I.J., Aerts R., Allison S.D., van Bodegom P., Brovkin V., Chatain A., Callaghan T.V., Díaz S., Garnier E., Gurvich D.E., Kazakou E., Klein J.A., Read J., Reich P.B., Soudzilovskaia N.A., Vaieretti M.V., Westoby M. Plant species traits are the predominant control on litter decomposition rates within biomes worldwide // Ecology Lett. 2008. V. 11. P. 1065–1071. https://doi.org/10.1111/j.1461-0248.2008.01219.x
Cotrufo M.F., Soong J.L., Horton A.J., Campbell E.E., Haddix M.L., Wall D.H., Parton W.J. Formation of soil organic matter via biochemical and physical pathways of litter mass loss // Nature Geoscience. 2015. V. 8. P. 776–779. https://doi.org/10.1038/NGEO2520
Cotrufo M.F., Wallenstein M.D., Boot C.M., Denef K., Paul E. The Microbial Efficiency-Matrix Stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: do labile plant inputs form stable soil organic matter? // Global Change Biology. 2013. V. 19. № 4. P. 988–995. https://doi.org/10.1111/gcb.12113
Erb K-H., Kastner T., Plutzar C., Bais A.L.S., Carvalhais N., Fetzel T., Gingrich S., Haberl H., Lauk C., Niedertscheider M., Pongratz J., Thurner M., Luyssaert S. Unexpectedly large impact of forest management and grazing on global vegetation biomass // Nature. 2018. V. 553. P. 73–76. https://doi.org/10.1038/nature25138
Fortunel C., Garnier E., Joffre R., Kazakou E., Quested H., Grigulis K., Lavorel S., Ansquer P., Castro H., Cruz P., Doležal J., Eriksson O., Freitas H., Golodets C., Jouany C., Kigel J., Kleyer M., Lehsten V., Lepš J., Meier T., Pakeman R., Papadimitriou M., Papanastasis V.P., Quétier F., Robson M., Sternberg M., Theau J.P., Thébault A., Zarovali M. Leaf traits capture the effects of land use changes and climate on litter decomposability of grasslands across Europe // Ecology. 2009. V. 90. № 3. P. 598–611. https://doi.org/10.1890/08-0418.1
Freschet G.T., Cornwell W.K., Wardle D.A., Elumeeva T.G., Liu W., Jackson B.G., Onipchenko V.G., Soudzilovskaia N.A., Tao J., Cornelissen J.H.C. Linking litter decomposition of above- and below-ground organs to plant–soil feedbacks worldwide // J. Ecology. 2013. V. 101. P. 943–952. https://doi.org/10.1111/1365-2745.12092
Hakala K., Kontturi M., Pahkala K. Field biomass as global energy source // Agricultural and Food Science. 2009. V. 18. № 3–4. P. 347–365.
Incerti G., Bonanomi G., Giannino F., Cartenì F., Spaccini R., Mazzei P., Piccolo A., Mazzoleni S. OMDY: a new model of organic matter decomposition based on biomolecular content as assessed by 13C-CPMAS-NMR // Plant and Soil. 2017. V. 411. № 1–2. P. 377–394. https://doi.org/10.1007/s11104-016-3039-2
Knorr M., Frey S.D., Curtis P.S. Nitrogen additions and litter decomposition: a meta-analysis // Ecology. 2005. V. 86. № 12. P. 3252–3257. https://doi.org/10.1890/05-0150
Kuzyakov Y., Friedel J.K., Stahr K. Review of Mechanisms and Quantification of Priming Effects // Soil Biol.Biochem. 2000. V. 32. P. 1485–1498. https://doi.org/10.1016/S0038-0717(00)00084-5
Lal R. World crop residues production and implications of its use as a biofuel // Environ. Int. 2005. V. 31. № 4. P. 575–584. https://doi.org/10.1016/j.envint.2004.09.005
Lehmann J., Kleber M. The contentious nature of soil organic matter // Nature. 2015. V. 528. P. 60–68. https://doi.org/10.1038/nature16069
Manzoni S., Porporato A. Soil carbon and nitrogen mineralization: Theory and models across scales // Soil Biol. Biochem. 2009. V. 41. № 7. P. 1355–1379. https://doi.org/10.1016/j.soilbio.2009.02.031
Pan Y., Birdsey R.A., Fang J., Houghton R., Kauppi P.E., Kurz W.A., Phillips O.L., Shvidenko A., Lewis S.L., Canadell J.G., Ciais P., Jackson R.B., Pacala S.W., McGuire A.D., Piao S., Rautiainen A., Sitch S., Hayes D. A Large and Persistent Carbon Sink in the World’s Forests // Science. 2011. V. 333. № 6045. P. 988–993. https://doi.org/10.1126/science.1201609
Prentice I.C., Farquhar G.D., Fasham M.J.R., Goul-den M.L., Heimann M., Jaramillo V.J., Kheshgi H.S., LeQuéré C., Scholes R.J., Wallace D.W.R. The Carbon Cycle and Atmospheric Carbon Dioxide // Climate Change 2001: The Scientific Basis / Ed. Houghton J.T. et al. Cambridge: Cambridge University Press, 2001. P. 183–237.
Prescott C.E. Litter decomposition: what controls it and how can we alter it to sequester more carbon in forest soils? // Biogeochemistry. 2010. V. 101. P. 133–149. https://doi.org/10.1007/s10533-010-9439-0
Sulzman E.W., Brant J.B., Bowden R.D., Lajtha K. Contribution of aboveground litter, belowground litter, and rhizosphere respiration to total soil CO2 efflux in an old growth coniferous forest // Biogeochemistry. 2005. V. 73. P. 231–256. https://doi.org/10.1007/s10533-004-7314-6
Sun L., Teramoto M., Liang N., Yazaki T., Hirano T. Comparison of litter-bag and chamber methods for measuring CO2 emissions from leaf litter decomposition in a temperate forest // J. Agricultural Meteorology. 2017. V. 73. № 2. P. 59–67. https://doi.org/10.2480/agrmet.D-16-00012
Talbot J.M., Yelle D.J., Nowick J., Treseder K.K. Litter decay rates are determined by lignin chemistry // Biogeochemistry. 2012. V. 108. № 1–3. P. 279–295. https://doi.org/10.1007/s10533-011-9599-6
Von Lützow M., Kögel-Knabner I., Ekschmitt K., Matzner E., Guggenberger G., Marschner B., Flessa H. Stabilization of organic matter in temperate soils: Mechanisms and their relevance under different soil conditions – a review // Eur. J. Soil Sci. 2006. V. 57. P. 426–445. https://doi.org/10.1111/j.1365-2389.2006.00809.x
Zhang D., Hui D., Luo Y., Zhou G. Rates of litter decomposition in terrestrial ecosystems: global patterns and controlling factors // J. Plant Ecology. 2008. V. 1. № 2. P. 85–93. https://doi.org/10.1093/jpe/rtn002
Дополнительные материалы отсутствуют.


