Почвоведение, 2019, № 10, стр. 1211-1224
Краткосрочные изменения биотита различных гранулометрических фракций в подзолистой почве в полевом модельном эксперименте
И. И. Толпешта a, *, Т. А. Соколова a, Ю. Г. Изосимова a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: sokolt65@mail.ru
Поступила в редакцию 08.02.2019
После доработки 08.02.2019
Принята к публикации 15.03.2019
Аннотация
Проведен эксперимент по трансформации тест-биотита илистой фракции (<1 мкм) и фракции средней пыли (5–10 мкм) в процессе одно- и трехлетнего пребывания в горизонте AELоа подзолистой почвы. Установлено, что в условиях современного почвообразования за один год проведения эксперимента в горизонте AELоа подзолистой почвы биотит в составе фракции средней пыли и в составе илистой фракции частично трансформируется в неупорядоченный биотит-вермикулит. В течение трехлетнего пребывания в почве значительная доля биотита трансформируется в неупорядоченный биотит-вермикулит, биотит-вермикулит-почвенный хлорит, образуются небольшие количества вермикулита и почвенного хлорита. Образование лабильных структур из биотита сопровождается понижением заряда слоя, выносом межслоевого K и потерей Mg и Fe из октаэдрической сетки. Наиболее глубокая трансформация слюды происходит во фракции средней пыли, в которой в целом доля жестких биотитовых слоев и толщина кристаллитов после трехлетнего пребывания в почве уменьшается в большей степени, чем в илистой фракции.
ВВЕДЕНИЕ
Триоктаэдрические слюды являются важнейшим источником K и Mg, которые поступают в почвенный раствор в результате растворения и трансформации этих минералов. В кислых почвах с промывным водным режимом триоктаэдрические слюды неустойчивы, быстро растворяются и трансформируются. Эти процессы наиболее интенсивно протекают в органо-минеральных горизонтах почв, что приводит к относительному уменьшению в них содержания триоктаэдрических и увеличению содержания диоктаэдрических слюд и иллитов по сравнению с нижележащими горизонтами и почвообразующей породой.
При инконгруэнтном растворении триоктаэдрические слюды трансформируются в смешанослойные слюда-вермикулиты, слюда-смектиты, вермикулит, смектит, бейделлит [17, 18, 22, 23, 38, 49, 51]. По лабильным вермикулитизированным или смектитизированным слоям в органо-минеральных и подзолистых горизонтах суглинистых подзолистых почв образуются почвенные хлориты [2, 3, 19]. Хлоритизированные по вермикулиту и смектиту структуры называют “hydroxy-interlayered vermiculite(HIV)” и “hydroxy-interlayered smectite (HIS)” соответственно [51].
В процессе вермикулитизации в результате обмена на ионы H+ и гидратированные катионы Ca2+, Mg2+ происходит потеря межслоевого K. Вермикулитизация слюды сопровождается окислением и выносом Fe и выносом Mg из октаэдрической сетки, понижением заряда решетки [11, 18, 23, 28, 36, 45, 46]. В результате вермикулитизации уменьшается размер кристаллитов [12]. Хлоритизация образованных из слюды лабильных структур в почвенных условиях происходит в результате полимеризации в межслоях аквагидроксокомплексов алюминия в диапазоне значений рН от 4 до 6 и в отсутствии значительного количества сильных анионов-комплексообразователей [2, 48, 52].
Растворение и трансформация слюд начинаются с боковых граней [43]. Реакционная активность боковых поверхностей {hk0} биотита по данным разных авторов в 36–240 раз превышает таковую у планарных (001) [22, 23, 26]. Однако наличие трещин, каверн и других дефектов на базальной поверхности может ускорить растворение базальных поверхностей [32, 40]. С увеличением размера частиц количество микротрещин и каверн на таких поверхностях может возрастать, что приводит к увеличению вклада базальных поверхностей в растворение биотита [23].
Скорость растворения и трансформации биотита в определенных условиях значительно увеличивается при воздействии на минерал продуктов функционирования почвенной биоты (корней растений, грибных гиф, бактерий и лишайников, мезофауны) и также фульвокислот вследствие реакций протонирования, комплексообразования и обмена [14, 16, 24, 25, 27, 31, 53, 54].
В экспериментах по выветриванию базальной поверхности биотита в присутствии гиф Paxillus involutus, выращенных на корневой системе сосны обыкновенной (Pinus sylvestris), показано, что биомеханическое и химическое воздействие грибной микоризы ускоряет растворение и трансформацию поверхности в диапазоне значений рН от 3.5 до 5.8, а скорость растворения составляет около 0.04 мкмоль биотита/(м2 ч) [20]. Установлено, что Paxillus involutus способен окислять значительное количество структурного Fe(II) в биотите. При колонизации гифы на базальной плоскости (001) обнаружено интенсивное, неравномерное по длине гифы окисление Fe(II), которое затрагивает глубину в среднем до ~2 мкм. Окисленное Fe выпадает в виде гидроксида, в том числе и на достаточной от гифы глубине, так как проникает туда по трещинам, перпендикулярным базальной поверхности. В результате увеличения количества гидроксида Fe(III) происходит изменение объема и деформации внутри решетки биотита. Показано, что формирование слоя гидроксида железа происходит в направлении, параллельном базальным плоскостям, и сопровождается образованием микротрещин и расслоением решетки биотита [20].
Однако в литературе имеются свидетельства того, что не все эктомикоризные грибы ускоряют растворения и трансформацию биотита. Например, Laccaria bicolor S238N, существенно не увеличивает скорость выветривания биотита, хотя и повышает доступность K и Mg для сосны обыкновенной [25]. В лабораторных экспериментах с чистыми культурами эктомикоризных грибов Paxillus involutus (PI), Suillus bovinus (SB) и Piloderma fallax (PF), проведенными в колонках, заполненных биотитом, получили, что грибы стимулируют растворение минерала, но непосредственное прикрепление гиф к поверхности и образование фигур травления вносило небольшой вклад в растворение по сравнению с другими факторами, такими как скорость и объемы, прошедшего через колонки раствора [16].
Скорость растворения и трансформации биотита увеличивается с увеличением площади реакционной поверхности за счет уменьшения размера частиц и образования микротрещин и каверн [23, 41]. В тех случаях, когда увеличение размеров частиц сопровождается увеличением количества микротрещин и других повреждений поверхности биотит более крупных фракций может трансформироваться в большей степени по сравнению с биотитом меньших по размерам частиц.
Цель работы заключалась в оценке трансформационных изменений биотита различных гранулометрических фракций в гор. AELоа подзолистой почвы в условиях современного педогенеза по результатам проведения полевых модельных экспериментов в течение 1 года и 3 лет.
ОБЪЕКТЫ И МЕТОДЫ
Эксперименты по трансформации биотита проводили на территории Центрально-лесного государственного природного биосферного заповедника в Нелидовском районе Тверской области.
Пластины биотита размалывали и фракции выделяли методом седиментации. К 200 мг биотита с размерами частиц от 5 до 10 мкм (фракция средней пыли) и <1 мкм (илистая фракция) прибавляли 1.5 г отмытого 1 н. HCl и дистиллированной водой кварцевого песка (фракция 0.5–1 мм). Полученную смесь помещали в контейнеры из синтетического нетканого материала торговой марки “Лутрасил-23” с плотностью 23 г/м2, армированные для прочности чехлом из капроновой сетки с ячейкой 1 мм2. Материал контейнеров проницаем для почвенных растворов, тонких корней растений, грибных гиф вирусов и бактерий, так как размеры этих представителей биоты варьируют от <1 до 45 мкм [30, 33, 44].
Контейнеры, заполненные смесью биотита и кварцевого песка, в 20-кратной повторности помещали в гор. AELоа подзолистой почвы под елями 14–17-летнего возраста непосредственно у корней. Исследованная почва относится к типу подзолистых почв [2], к типу подзолистых почв, отделу текстурно-дифференцированных почв по классификации почв России 2004 г. [9], по WRB 2007 − к реферативной группе Альбелювисолей (Albeluvisols), по WRB 2014 − к реферативной группe Ретисолей (Retisols) [56, 57 ] .
В разные годы и сезоны наблюдений рН Н2О в гор. AELоа в целом варьирует от 4.39 до 4.58. В указанном горизонте сосредоточена основная масса корней ели обыкновенной и содержится наибольшее количество органического вещества по сравнению с другими минеральными горизонтами подзолистой почвы − 2.6–6.4% Сорг в почве и от 22 до 34 мг/л Сорг в почвенном растворе [3, 8].
Образцы тест-биотита извлекали из почвы через 1 год и через 3 года проведения эксперимента (по 10 образцов в каждом году).Биотит отделяли от зерен кварца путем просеивания образцов через сито с диаметром отверстий 0.25 мм. Полноту удаления кварца контролировали под бинокуляром. За время проведения эксперимента вес биотита уменьшился на 10−70% по сравнению с исходным. Вероятно, в условиях проведенных экспериментов значительную потерю биотита можно объяснить его вымыванием из материала контейнеров, размеры пор которого превышают размеры фракций биотита, использованных в эксперименте. Можно допустить, что незначительное количество биотита в процессе эксперимента растворилось. Поскольку уменьшение веса биотита, обусловленное растворением и выносом материала из контейнеров, в условиях проведенного эксперимента невозможно оценить количественно, в настоящей работе обсуждаются только процессы трансформация биотита, оставшегося в контейнерах после окончания экспериментов.
В результате значительных потерь образца не все 10 повторностей тест-минерала оказались в достаточном для проведения рентгендифрактометрического анализа количестве.
Для рентгендифрактометрии все образцы были переводили в Са-форму. Съемку ориентированных препаратов проводили на приборе ДРОН-3 с использованием CuKα-излучения, фильтрованного Ni в диапазоне от 1.5 до 62° 2θ. Шаг съемки составил 0.05° 2θ, время экспозиции −10 с, напряжение и ток на трубке составляли 35 кВ и 20 мА соответственно. Съемку образцов проводили в воздушно-сухом состоянии, после насыщения этиленгликолем и после двухчасового прокаливания при температурах 350 и 550°С.
Моделирование экспериментальных дифракционных картин проводили с использованием программы Sybilla©, разработанной компанией Chevron [13]. Программа Sybilla© создана для моделирования спектров ориентированных препаратов глин, поэтому из моделирования исключали небазальные отражения и отражения от неглинистых минералов. Область малых углов 1.5°до 3.5° 2θ также не моделировали [34]. Поскольку модель для триоктаэдрических слюд в программе отсутствует, то она была создана на основе z-позиций атомов, рассчитанных для триоктаэдрических слюд [47]. Моделирование провели для образца, насыщенного этиленгликолем, и образца в воздушно-сухом состоянии. Количество жестких и лабильных структур, содержание фаз и вероятностные параметры для смешанослойных минералов при моделировании образцов в обоих состояниях совпадали. Модели для хлоритизированных слоев создавали путем замены в существующих в программе Sybilla© моделях собственно хлоритов атомов Mg на атом Al, так как интенсивность дифрагированных лучей зависит от количества электронов в атомах. При моделировании учитывали вид минерала, межплоскостное расстояние, толщину кристаллитов, количество катионов в межслоях и количество Mg, Fe и Al в октаэдрах. Во всех моделях использовали постоянную величину σ* = 12°, которая отражает преимущественную ориентацию кристаллитов в препарате [34]. Подобранные модели сравнивали с экспериментальными дифрактограммами и оценивали ошибку моделирования.
Для уточнения положения и расчета ширины пиков на полувысоте (FWHM) использовали программу Fityk [55].
Валовой химический состав минерала после его разложения HF или сплавлением со щелочами определяли атомно-эмиссионным методом с индуктивно-связанной плазмой на спектрометре Optima-4300 DV (Perkin-Elmer, США). Валовое содержание Fe2+ определяли титриметрическим методом.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Свойства исходного биотита по данным химического и рентгендифрактометрического анализов. Валовое содержание элементов во фракции средней пыли Са-биотита в процентах в пересчете на абсолютно-сухую навеску составляет: Na2O − 0.47, MgO − 24.7, Al2O3 − 11.5, SiO2 − 42.9, K2O − 9.41, CaO − 0.39, TiO2 − 0.56, MnO − 0.25, FeO, 2.63, Fe2O3 − 5.05. Потеря от прокаливания образца при 1000°С равна 1.86%. По данным химического анализа с использованием катионного метода [1], рассчитали формулу биотита:
Как видно из формулы, биотит в составе фракции средней пыли характеризуется высоким зарядом слоя, а в октаэдрической сетке двухвалентные катионы преимущественно представлены Mg2+.
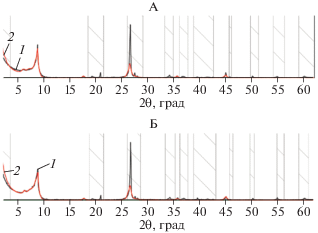
На рентгенограммах фракции средней пыли прописываются базальные d(001) 1.01 нм, d(002) 0.50 нм, d(003) 0.33 нм, d(005) 0.20 нм, небазальные отражения d(020) 0.46 нм, d(200) 0.266 нм, d(131) 0.262 нм, d(131) 0.25 нм, d(201) 0.244 нм, d(139) 0.17 нм, d(060) 0.154 нм биотита [6].Наличие отражения 0.154 нм свидетельствует о триоктаэдрическом типе заполнения октаэдрической сетки [42] (рис. 1).
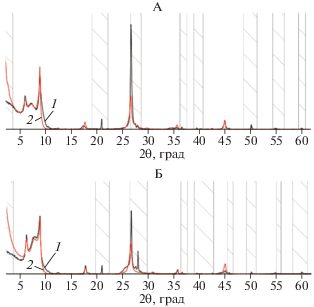
Рис. 1.
Экспериментальная (1) и расчетная (2) рентгенограммы фракции средней пыли исходного биотита, насыщенного этиленгликолем (А) и в воздушно-сухом состоянии (Б). Здесь и далее: числа на кривых −d/n в нм. Штриховкой показаны области, исключенные из моделирования.
Согласно модели, в которой учитывался химический состав образца межплоскостное расстояние биотита d/n = 1.01 нм, содержание межслоевого K (Kint), октаэдрического Fe (Feoct), октаэдрического Mg (Mgoct) и октаэдрического Al (Aloct) соответственно равно 1.7, 0.92, 5.28 и 0.06 атомов на формульную единицу (расчет на 20 кислородов). Результаты моделирования представлены на рис. 1.
Согласно подобранной модели, толщина кристаллита биотита во фракции средней пыли с вероятностью 95% составляет 35 слоев. Толщина кристаллита также была рассчитана по уравнению Дебая–Шеррера [10]. Для этого в программе Fityk с использованием функции SplitePearson7 уточнили положение пика и измерили ширину пика на полувысоте (FWHM) [6]. Величина FWHM составила 0.2096°2θ. С использованием этого значения в уравнении Дебая–Шеррера получили, что в кристаллите биотита содержится 35 слоев, что полностью соответствует расчетам, сделанным в программе Sybilla.
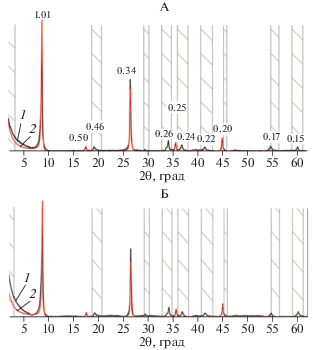
Биотит в составе илистой фракции содержит меньше K и Fe [4] по сравнению с таковым в составе фракции средней пыли. Рентгендифрактограммы биотита в составе ила удовлетворительно описываются моделью, согласно которой Kint, Feoct, Mgoct и Aloct составляют 1.34, 0.66, 5.28 и 0.06 атомов на формульную единицу в расчете на 20 кислородов соответственно, а кристаллиты илистой фракции состоят из 20 слюдистых слоев (P = 0.95) (рис. 2).
Рис. 2.
Экспериментальная (1) и расчетная (2) рентгенограммы илистой фракции исходного биотита, насыщенного этиленгликолем (А) и в воздушно-сухом состоянии (Б).
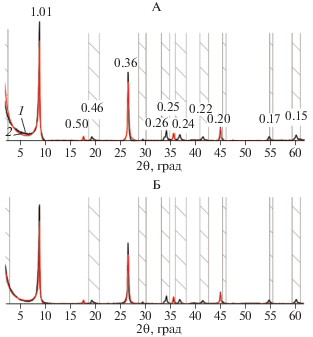
Минералогический состав тест-минерала во фракции средней пыли после пребывания в почве. После годичного пребывания в гор. AELoa подзолистой почвы почве в тест-минерале произошли незначительные изменения. На рентгенограммах некоторых образцов появляется заметное уширение основания отражения 001 биотита в сторону малых углов, что особенно отчетливо видно на рентгенограммах препаратов, насыщенных этиленгликолем. При прокаливании образцов при температурах 350°С и особенно 550°С отмеченного выше уширения не наблюдается (рис. 3).
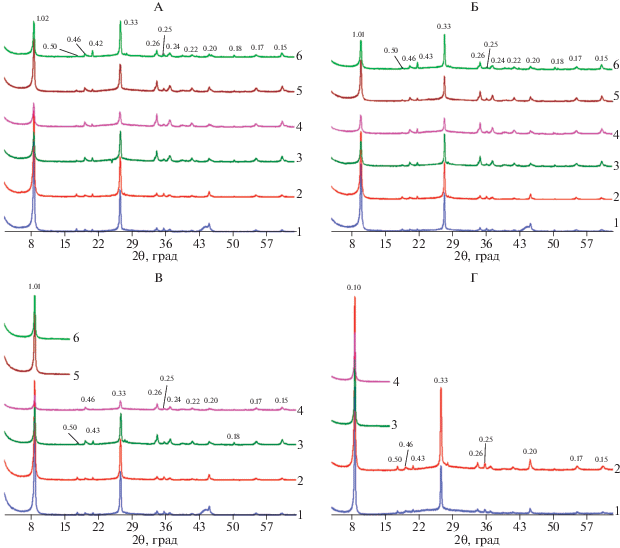
Рис. 3.
Рентгендифрактограммы тест-минерала фракции средней пыли после 1 года пребывания в почве в воздушно-сухом состоянии (А), насыщенных этиленгликолем (Б) и прокаленных при 350 (В) и 550°С (Г). 12–18 – номера образцов.

Описанные изменения на рентгенограммах могут свидетельствовать о появлении в составе минерала лабильных слоев.
Для образца 15, в котором отчетливо наблюдается уширение рефлекса 1.01 нм в сторону малых углов при насыщении этиленгликолем, в программе Sybilla© была рассчитана кривая, которая удовлетворительно описывала экспериментальную в случае ввода в модель второй фазы – неупорядоченного (R0) биотита-вермикулита в количестве 3–6% (табл. 1).
Таблица 1.
Состав и содержание алюмосиликатов в тест-минерале после 1 и 3 лет пребывания в почве
| Минерал | Средняя пыль | Ил | ||||||
|---|---|---|---|---|---|---|---|---|
| 1 год, образец 15 | 3 года, образец 31 | 1 год, образец 1 | 3 года, образец 22 | |||||
| в.с.* | эг** | в.с. | эг | в.с. | эг | в.с. | эг | |
| Биотит | 94 | 97 | 20 | 27 | 79 | 85 | 14 | 17 |
| R0 биотит/вермикулит | 6 | 3 | 26 | 23 | 21 | 15 | 7 | 8 |
| Вермикулит | −*** | − | 0.7 | 4 | − | − | 1 | 2 |
| HIV | − | − | 3 | <1 | − | − | <1 | 0 |
| R0 биотит/вермикулит/HIV | − | − | 51 | 46 | − | − | 78 | 73 |
| Ошибка моделирования, % | 15 | 14 | 12 | 10 | 10 | 10 | 8 | 6 |
После трехлетнего пребывания в почве с биотитом в составе фракции средней пыли произошли более существенные изменения. Практически на всех рентгенограммах образцов в воздушно-сухом состоянии (рис. 4, А) появляется в разной степени выраженное отражение 1.42 Å, которое незначительно сдвигается в сторону малых углов после насыщения образцов этиленгликолем (рис. 4, Б) и исчезает в результате нагревания до 350 и 550°С (рис. 4, В, 4, Г), что свидетельствует о присутствии в образцах высокозарядного вермикулита.
Рис. 4.
Рентгендифрактограммы тест-минерала фракции средней пыли после трехлетнего пребывания в почве в воздушно-сухом состоянии (А), насыщенных этиленгликолем (Б) и прокаленных при 350 (В) и 550°С (Г). 31–40 – номера образцов.
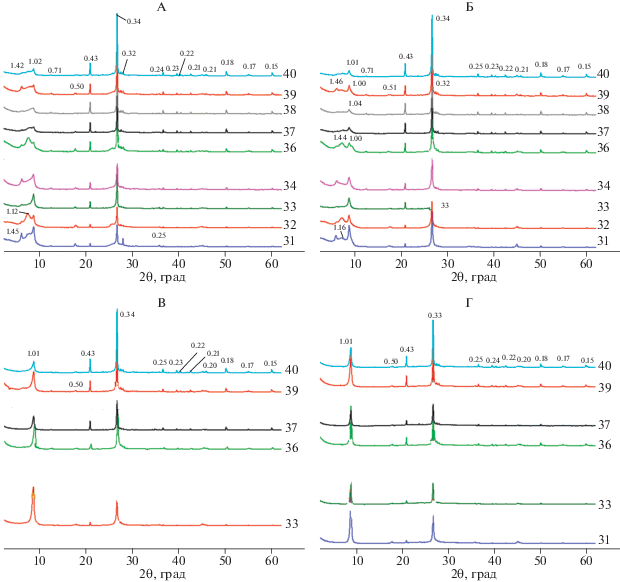
Самостоятельное отражение или диффузное рассеяние в диапазоне от 6.6° до 8.6°2θ, которые смещаются в сторону малых углов при насыщении этиленгликолем, могут принадлежать смешанослойному биотиту-вермикулиту. Неполное сжатие кристаллической решетки 1.4 нм минералов после прокаливания до 350°С образцов 39 и 40 (рис. 4, В) может свидетельствовать о хлоритизации вермикулитизированных слоев (образовании HIV).
Из моделирования, проведенного для рентгенограммы образца 31, следует, что экспериментальная кривая с ошибкой 10–12% удовлетворительно описывается четырехфазной моделью, в которую включены биотит, неупорядоченный (R0) биотит/вермикулит, R0 биотит/вермикулит/ HIV, вермикулит и почвенный хлорит (рис. 5, табл. 1). Из вышеперечисленных фаз в образце преобладает R0 биотит/вермикулит/HIV, содержание которого составляет 51 и 46% по результатам моделирования рентгенограмм образца в воздушно-сухом состоянии и после насыщения этиленгликолем соответственно. Биотит и R0 биотит-вермикулит содержатся в образце приблизительно в равных количествах (около 24%), а вермикулит и почвенный хлорит (HIV) присутствуют в незначительных количествах.
Рис. 5.
Экспериментальная (1) и расчетная (2) рентгенограммы фракции средней пыли после трехлетнего пребывания в почве образца 31, насыщенного этиленгликолем (А), и в воздушно-сухом состоянии (Б).
Минералогический состав тест-минерала в составе илистой фракции после пребывания в почве. В процессе однолетнего пребывания в почве биотит в составе илистой фракции претерпел некоторые изменения. На рентгенограммах образцов 1, 2, 3, 5 и 6 после насыщения этиленгликолем наблюдается уширение основания 1.01 нм отражения в сторону малых углов, по сравнению с исходным биотитом (рис. 2, рис. 6, Б). После прокаливания образцов при 350 и 550°С интенсивность 1.01 нм отражения несколько возрастает, а пик становится более симметричным.
Рис. 6.
Рентгендифрактограммы тест-минерала илистой фракции после 1-го года пребывания в почве в воздушно-сухом состоянии (А), насыщенных этиленгликолем (Б) и прокаленных при 350 (В) и 550°С (Г). 1–6 – номера образцов.
Описанные изменения объясняются появлением в биотите лабильных слоев. Из моделирования рентгенограммы образца 1 следует, что в илистой фракции тест-минерала за 1 год проведения эксперимента образовалась дополнительная фаза, представленная неупорядоченным биотитом-вермикулитом. В составе ила этого смешанослойного минерала оказалось на 15 и 12% больше по сравнению с фракцией средней пыли по результатам расчетов для образцов в воздушно-сухом состоянии и насыщенных этиленгликолем соответственно.
После трехлетнего пребывания в почве на всех рентгенограммах образцов илистой фракции в воздушно-сухом состоянии присутствуют асимметрия и пологий спад отражения 1.01 нм в сторону малых углов. После насыщения этиленгликолем асимметрия 1.01 нм отражения увеличивается в сторону малых углов незначительно, что может свидетельствовать о присутствии в указанных образцах лишь небольшого количества лабильных слоев.
В отличие от фракции средней пыли на рентгенограммах воздушно-сухих образцов илистой фракции в результате трехлетнего пребывания в почве отражение 1.44 нм прописывается только в трех (образцы 22, 28 и 30) из 10 исследованных образцов (рис. 7). Наличие отчетливого самостоятельного отражения с d/n 1.44 на рентгенограммах образца после насыщения этиленгликолем, значительное уменьшение его интенсивности после прокаливания при 350°С и полное сжатие решетки минерала до d(001) 1.01 нм после прокаливания при 550°С дают основание предполагать наличие в образце 28 высокозарядного вермикулита. Диффузное рассеяние в интервале от 6.6° до 8.6°2θ, выраженное в разной степени на рентгенограммах всех образцов, прокаленных при 350°С, может свидетельствовать о присутствии хлоритизированных слоев.
Рис. 7.
Рентгендифрактограммы тест-минерала илистой фракции после трехлетнего пребывания в почве в воздушно-сухом состоянии (А), насыщенных этиленгликолем (Б) и прокаленных при 350 (В) и 550°С (Г). 21–30 – номера образцов.
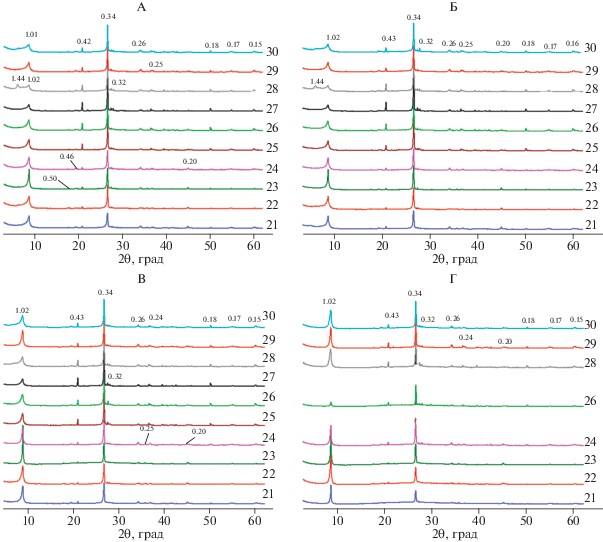
Из моделирования экспериментальных рентгенограмм образца 22 следует (рис. 8), что после трехлетнего пребывания в почве в тест-минерале илистой фракции содержится 14 и 17% биотита и присутствует 78 и 73% неупорядоченного биотитита/вермикулита/почвенного хлорита, исходя из расчета, сделанного для воздушно-сухого и насыщенного этиленгликолем образца соответственно. Содержание неупорядоченного биотита-вермикулита не превышает 8%, а почвенный хлорит как самостоятельная фаза практически не образуется.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные эксперименты показали, что в условиях современного педогенеза в органо-минеральном гор. AELoa триоктаэдрическая слюда неустойчива и за короткие сроки (от 1 до 3 лет) проведения полевых опытов трансформируется с образованием новых кристаллических фаз.
Как было показано выше, трансформационные изменения в биотите происходят неодинаково в образцах, представляющих разные повторности одного варианта опыта, что можно объяснить неравномерным распространением корней растений и грибных гиф в почвенной массе горизонта. Кроме того, известно, что в суглинистых почвах почвенные растворы перемещаются не фронтально, а по преимущественным путям, поэтому вероятность равномерного контакта почвенных растворов со всеми тест-минералами крайне мала.
Основными процессами трансформации биотита являются вермикулитизация и хлоритизация. Эти процессы происходят с разной глубиной и с разной скоростью во фракции средней пыли и в илистой фракции.
Использованный в работе прием моделирования экспериментальных дифракционных картин на примере четырех образцов позволил описать основные механизмы выявленных трансформационных изменений.
Вермикулитизация биотитовых слоев наблюдается уже через 1 год проведения эксперимента. Во фракции средней пыли неупорядоченный биотит-вермикулит содержит 90% биотитовых слоев и 10% вермикулитовых. Вермикулитовые слои однородны. В их межслоях размещается 2 слоя молекул воды (2w) или этиленгликоля (2g). В илистой фракции неупорядоченный биотит-вермикулит состоит из 80% биотитовых и 20% однородных вермикулитовых слоев с двумя слоями молекул воды или этиленгликоля (табл. 2).
Таблица 2.
Фазовый состав и структурные параметры алюмосиликатов в тест-минерале после 1 и 3 лет трансформации в почве (по результатам моделирования в программе Sybilla©)
| Минерал | Структурный параметр* | Средняя пыль (5–10 мкм) | Ил (<1 мкм) | ||
|---|---|---|---|---|---|
| 1 год (образец 15) |
3 года (образец 31 |
1 год (образец 1) |
3 года (образец 22) |
||
| cодержание слоев, % | |||||
| Биотит | N | 20 | 20 | 18 | 18 |
| R0 биотит(B)/вермикулит(V) | N | 10 | 0 | 10 | 10 |
| B/V2w/1w | 90/10/0 | 50/15/35 | 80/20/0 | 40/15/45 | |
| B/V2g/1g | 90/10/0 | 50/20/30 | 80/20/0 | 40/10/50 | |
| Вермикулит | N | −** | 10 | − | 10 |
| V2w/1w | 100/0 | 100/0 | |||
| V2g/1g | 100/0 | 75/25 | |||
| HIV | N | − | 10 | − | 10 |
| R0 биотит/вермикулит/HIV | N | − | 10 | − | 10 |
| B/V2w/HIV | 90/5/5 | 90/5/5 | |||
| B/V2g/HIV | 90/5/5 | 90/5/5 | |||
После трех лет пребывания в почве трансформация биотита проходит до более глубокой стадии – уменьшается содержание биотита, увеличивается содержание биотита-вермикулита и появляются вермикулит и биотит-вермикулит-почвенный хлорит. Во фракции средней пыли количество биотитовых слоев в составе неупорядоченного биотита-вермикулита уменьшается до 50%, а 50% вермикулитовых слоев характеризуются разнородностью состава межслоев, в которых размещаются либо два, либо один слой молекул воды или этиленгликоля. Количественные закономерности сорбции молекул воды или этиленгликоля в межслоях вермикулита определяются многими факторами, в том числе и зарядом слоя. Можно предположить, что за 3 года проведения эксперимента количество вермикулитизированных слоев увеличивается, по сравнению с однолетним экспериментом, и процесс вермикулитизации проходит через стадию образования смешанослойных вермикулитовых слоев с разной величиной заряда.
В составе трехслойного неупорядоченно биотита-вермикулита-почвенного хлорита присутствуют 90% биотитовых слоев, 5% однородных вермикулитовых и 5% хлоритизированных слоев. Вермикулит обнаружен в незначительных количествах и представлен однородными слоями.
В илистой фракции за 1 и 3 года проведения экспериментов с биотитом произошли изменения, аналогичные описанным для фракции средней пыли.
Полученные результаты полностью подтверждают представления о трансформационных изменениях слюд в кислых почвах нетропических гумидных областей [14, 15, 38, 50–52].
Изменение биотита сопровождается выносом межслоевого K, октаэдрических Fe и Mg. В процессе трехлетней трансформации содержание межслоевого K в биотите, представленном самостоятельной фазой в образце 31, уменьшается с 1.7 до 1.5 атомов на формульную единицу, а октаэдрических Fe и Mg с 0.91 и 5.08 до 0.6 и 4.5 соответственно. Уменьшение содержания Kint, Feoct и Mgoct в дискретной фазе биотита в составе илистой фракции образца 22 по сравнению с исходным биотитом не выявлено (табл. 3).
Таблица 3.
Количество межслоевых K (Kint) и Ca (Caint) и октаэдрических Fe (Feoct) и Mg (Mgoct) в расчете на 20 атомов кислорода
| Минерал | Атом металла | Средняя пыль, образец 31 |
Ил, образец 22 |
|---|---|---|---|
| количество атомов | |||
| Исходный биотит | |||
| Биотит | Kint Feoct Mgoct |
1.7 0.92 5.08 |
1.34 0.66 5.28 |
| Тест-минерал после трансформации в почве в течение 3-х лет | |||
| Биотит | Kint Feoct Mgoct |
1.5 0.6 4.5 |
1.34 0.66 5.28 |
| Вермикулит в составе R0 биотита/вермикулита |
Caint Feoct Mgoct |
0.5 0.6 5.0 |
0.6 0.6 5.1 |
| Вермикулит в составе R0 биотита/вермикулита/HIV |
Caint Feoct Mgoct |
0.5 0.6 5.0 |
0.5 0.6 5.0 |
| Вермикулит | Caint Feoct Mgoct |
0.5 0.6 5.0 |
0.6 0.6 5.0 |
| HIV | Alint Feoct Mgoct |
1.5 0.6 5.0 |
1.5 0.6 5.0 |
| HIV в составе R0 биотитa/вермикулита/HIV | Alint Feoct Mgoct |
2.0 0.6 5.0 |
2.0 0.6 5.0 |
В октаэдрической сетке вермикулитовых слоев в составе образовавшихся смешанослойных структур и в вермикулите, представленном самостоятельной фазой, как во фракции средней пыли, так и в илистой фракции содержится меньше октаэдрических Fe и Mg в расчете на формульную единицу по сравнению с октаэдрической сеткой исходного биотита, в котором содержится 6 атомов октаэдрических катионов. Можно предположить, что трансформация биотита сопровождается незначительным изменением характера заполнения октаэдрической сетки в сторону образования диоктаэдрических фрагментов. Выветривание триоктаэдрических структур в процессе педогенеза с образованием диоктаэдрических, описано в литературе [29, 41].
Вермикулитизация сопровождается уменьшением заряда слоя. В межслоях вермикулита как в составе смешанослойных структур, так и в составе самостоятельной фазы содержится 0.5–0.6 атомов Са, что соответствует заряду в 1–1.2 моль в расчете на формульную единицу (моль/ф.е.). Таким образом, трансформация биотита приводит к уменьшению заряда слоев на 0.7–0.5 и 0.34–0.14 моль/ф.е. для фракций средней пыли и ила соответственно.
Исходя из результатов рентгендифрактометрии (рис. 4 и 7) и моделирования, проведенного для некоторых рентгенограмм, можно заключить, что в целом за 3 года эксперимента с биотитом во фракции средней пыли произошли более глубокие изменения по сравнению с илистой фракцией. Более глубокую трансформацию слюды во фракции средней пыли по сравнению с илистой фракцией можно объяснить большим количеством дефектов в крупных кристаллитах, которые могут возникать вследствие механического и химического воздействия на них различных компонентов биоты и почвенного раствора в процессе выветривания [20, 21, 23, 40]. Однако в литературе описываются и противоположные результаты [41]. Из приведенных авторами данных следует, что в наибольшей степени трансформируются слюды в составе более тонкие фракции. Полученные закономерности объясняются увеличением площади удельной поверхности при уменьшении размеров кристаллитов.
Такая противоречивость результатов может быть следствием разного количества дефектов, как на базальных гранях, так и на боковых сколах минеральных частиц в образцах, использованных разными авторами. Эти различия могут быть унаследованными от исходных триоктаэдрических слюд из разных месторождений или возникнуть в процессе размола и подготовки образцов к рентгендифрактометрическому анализу.
Хлоритизация вермикулитизированных структур диагностирована в образцах после трехлетнего пребывания тест-минерала в почве. Очень небольшие (<3%) количества дискретной фазы почвенного хлорита обнаружены во фракции средней пыли и <1% во фракции ила. По 5% хлоритизированных слоев обнаружено в составе неупорядоченного биотита-вермикулита-почвенного хлорита в обеих изученных фракциях тест-минерала. Показано, что почвенные хлориты могут быть представлены как самостоятельной фазой, так и в составе смешанослойных структур [37, 48, 51, 52].
Количество атомов Al в межслоях дискретных почвенных хлоритов и в хлоритизированных структурах в составе смешанослойных минералов оказалось разным и составило 1.5 и 2 атома Al в расчете на формульную единицу. Если исходить из того, что при полном заполнении межслоев полимерами Al число атомов Al в расчете на формульную единицу составляет 4, то степень заполнения в первом и втором случаях соответствует 38 и 50% соответственно. Различий в степени заполнения межслоев алюминием во фракциях разного размера не выявлено. Ранее было показано, что в кислых суглинистых почвах степень алюминизации хлоритизированных слоев более крупных фракций больше, по сравнению с более тонкими фракциями, в силу меньшего заряда лабильных слоев в последних [52].
Толщина кристаллита. Трансформационные изменения биотита сопровождаются уменьшением толщины кристаллитов. Как сказано выше, кристаллиты исходного биотита в составе фракции тонкой пыли и в составе илистой фракции содержат 35 и 20 слоев. Число слоев N в кристаллитах биотита после пребывания в почве уменьшается до 20 и 18 для фракции средней пыли и илистой фракции соответственно. Кристаллиты продуктов трансформации биотита в среднем содержат по 10 слоев (табл. 4). По данным разных авторов, кристаллиты почвенного хлорита и смешанослойных иллита-вермикулита(смектита) в кислых почвах разного возраста и во фракциях разного размера варьируют от 3 до 7 и от 3 до 30 слоев соответственно [12, 34, 35].
Таблица 4.
Толщина (Т) и содержание кристаллитов в тест-минерале до и после трансформации в почве
| Период проведения эксперимента, лет | № образца | Минерал | Т, Å | Содержание, % |
|---|---|---|---|---|
| Фракция средней пыли | ||||
| 0 | Биотит | 353 | 100 | |
| 1 | 15 | Биотит R0 биотит/вермикулит |
202 105 |
95 5 |
| 3 | 31 | Биотит R0 биотит/вермикулит R0 биотит/вермикулит/HIV |
202 114 110 |
25 25 48 |
| Илистая фракция | ||||
| 0 | Биотит | 202 | 100 | |
| 1 | 1 | Биотит R0 биотит/вермикулит |
181 109 |
82 18 |
| 3 | 22 | Биотит R0 биотит/вермикулит R0 биотит/вермикулит/HIV |
181 118 105 |
15 7 76 |
Зная среднее число слоев в кристаллите, межплоскостные расстояния и содержание слоев различных типов рассчитали толщину кристаллитов в Å (Т) и содержание кристаллитов различных минералов в образце. Толщина кристаллитов исходного биотита в среднем составляет 353 Å.
После одного года пребывания в почве толщина кристаллитов биотита и продуктов его трансформации во фракции средней уменьшилась в 1.7 и 3.4, а в илистой фракции – в 1.1 и 1.9 раза соответственно. При этом в обеих фракциях среди продуктов трансформаций преобладают кристаллиты больших размеров в силу большего содержания самостоятельной биотитовой фазы.
Трехлетняя трансформация привела к более значительному уменьшению средней толщины кристаллитовв тест-минералах за счет образования большего по сравнению более коротким сроком проведения эксперимента количества, прежде всего, смешанослойных структур. Во фракции средней пыли содержание кристаллитов, толщина которых уменьшилась в ≈3 раза по сравнению с исходным биотитом, составляет около 73%. В илистой фракции содержится около 83% кристаллитов смешанослойных минералов, толщина которых в среднем в 1.8 раз меньше толщины исходного биотита.
ВЫВОДЫ
1. В условиях современного почвообразования за один год проведения эксперимента в гор. AEL подзолистой почвы биотит в составе фракции средней пыли и в илистой фракции частично трансформируется в неупорядоченный биотит-вермикулит.
2. В течение трехлетнего пребывания в почве значительная доля биотита в составе фракции средней пыли и в илистой фракции трансформируется в неупорядоченный биотит-вермикулит, биотит-вермикулит-почвенный хлорит, образуются небольшие количества вермикулита и почвенного хлорита.
3. Наиболее глубокая трансформация слюды происходит во фракции средней пыли, в которой в целом доля жестких биотитовых слоев после трехлетнего пребывания в почве уменьшается в большей степени, чем в илистой фракции.
4. Образование лабильных структур из биотита сопровождается понижением заряда слоя, выносом межслоевого K и потерей Mg и Fe из октаэдрической сетки.
5. Трансформация биотита приводит к уменьшению толщины кристаллитов, которое в условиях проведения эксперимента в наибольшей степени проявилось при выветривании фракции средней пыли по сравнению с илистой фракцией.
Список литературы
Булах А.Г. Расчет формул минералов. М.: Недра, 1964. 132 с.
Классификация и диагностика почв СССР. М.: Колос, 1977. 221 с.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 341 с.
Рентгеновские методы изучения и структура глинистых минералов / Под. ред. Брауна Г. М.: Мир, 1965. 599 с.
Сахаров Б.А., Дриц В.А. Методика определения содержания смектитовых слоев в дисперсных диоктаэдрических K-содержащих слюдистых минералах // Литология и полезные ископаемые. 2015. № 1. С. 55–86.
Толпешта И.И., Леман М. Пространственное варьирование и оценка аддитивности показателей кислотно-основного состояния палево-подзолистых почв Центрально-лесного заповедника // Вестник Моск. ун-та. Сер. 17, почвоведение. 2000. № 3. С. 12–19.
Толпешта И.И., Соколова Т.А. Подвижные соединения алюминия в почвах катен южной тайги (на примере почв Центрально-Лесного заповедника) // Почвоведение. 2010. № 8. С. 956–968.
Толпешта И.И., Соколова Т.А., Бонифачио Э., Фальсонэ Г. Почвенные хлориты в подзолистых почвах разной степени гидроморфизма: происхождение, и условия образования // Почвоведение. 2010. № 7. С. 831–842.
Шлыков В.Г. Использование структурных характеристик глинистых минералов для оценки физико-химических свойств дисперсных грунтов // Геоэкология. 2000. № 1. С. 43–52.
Acker J.G., Bricker O.P. The influence of pH on biotite dissolution and alteration kinetics at low temperature // Geochim. Cosmochim. Acta. 1992. V. 56. P. 3073–3092.
Aoudjit H., Elsass F., Righi D., Robert M. Mica weathering in acidic soils by analytical electron microscopy // Clay Minerals. 1996. V. 31. P. 319-332.
Aplin A.C., Matenaar I.F., McCarty D.K., and van der Pluijm B.A. Influence of mechanical compaction and clay mineral diagenesis on the microfabric and pore-scale properties of deep-water Gulf of Mexico mudstones // Clays and Clay Minerals. 2006. V. 54. P. 500–514.
Arocena J.M., Glowa K.R. Mineral weathering in ectomycorrhizosphere of subalpine fir (Abieslasiocarpa (Hook.) Nutt.) as revealed by soil solution composition // Forest Ecology and Management. 2000. V. 133. P. 61–70.
Augusto L., Ranger J., Turpault M.-P., Bonnaud P. Experimental in situ transformation of vermiculites to study the weathering impact of tree species on the soil // European J. Soil Science. 2001. V. 52. P. 81–92.
Balogh-Brunstad Z., Keller C.K., Shi Z., Wallander H., Stipp S.L.S. Ectomycorrhizal fungi and mineral interactions in the rhizosphere of scots and red pine seedlings // Soils. 2017. V. 1. № 1. P. 5. https://doi.org/10.3390/soils1010005
Barnhisel R.I., Bertsch P.M. Chlorites and hydroxy-interlayered vermiculite and smectite / Minerals in Soil Environments / Eds. Dixon J.B., Weed S.B. Soil Science Society of America, SSSA Book Series, 1. Madison, Wisconsin, USA. 1989. P. 729–788.
Bisdom E.B.A., Ctoops G., Delvigne J., Curmi P., Altemuller H.-J. Micromorphology of weathering biotite and its secondary products // Pedologie. 1982. V. XXXII. № 2. P. 225–252.
Bonifacio E., Falsone G., Simonov G., Sokolova T., Tolpeshta I. Pedogenic processes and clay transformations in bisequal soils of the Southern Taiga zone // Geoderma. 2009. V. 149. P. 66–75.
Bonneville S., Bray A.W., Benning L.G. Structural Fe(II) Oxidation in biotite by an ectomycorrhizal fungi drives mechanical forcing // Environ. Sci. Technol. 2016. V. 50. P. 5589−5596.
Bonneville S., Morgan D.J., Schmalenberger A., Bray A., Brown A., Banwart S.A., Benning L.G. Tree-mycorrhiza symbiosis accelerate mineral weathering: Evidences from nanometer-scale elemental fluxes at the hypha–mineral interface // Geochim. Cosmochim. Acta. 2011. V. 75. P. 6988–7005.
Bray A.W., Benning L.G., Bonneville S., Oelkers E.H. Biotite surface chemistry as a function of aqueous fluid composition // Geochim. Cosmochim. Acta. 2014. V. 128. P. 58–70.
Bray A.W., Oelkers E.H., Bonneville S., Wolff-Boenisch D., Potts N.J., Fones G., Benning L.G. The effect of pH, grain size, and organic ligands on biotite weathering rates // Geochim. Cosmochim. Acta. 2015. V. 164. P. 127–145.
Calvaruso C., Turpault M.-P., Frey-Klett P. Root-associated bacteria contribute to mineral weathering and to mineral nutrition in trees: a budgeting analysis // Appl. Environ. Microbiol. 2006. P. 1258–1266.
Calvaruso C., Turpault M.-P., Uroz S., Leclerc E., Kies A., Frey-Klett P. Laccaria bicolor S238N improves Scots pine mineral nutrition by increasing root nutrient uptake from soil minerals but does not increase mineral weathering // Plant Soil. 2010. V. 328. P. 145–154.
Cama J., Ganor J. Dissolution kinetics of clay minerals// Natural and Engineered Clay Barriers. 2015. V. 6. P. 102–152.
Chen J., Blume H.-P., Beyer L. Weathering of rocks induced by lichen colonization – a review // Catena. 2000. V. 39. P. 121–146.
Ferrow E.A. Experimental weathering of biotite, muscovite and vermiculite: a Mössbauerspectroscopy study // European J. Mineralogy. 2002. V. 14. P. 85–95.
Fordham A.W. Weathering of biotite into dioctahedral clay minerals // Clay Minerals. 1990. V. 25. P. 51–63.
Gobran G.R., Turpault M.-P., Courchesne F. Contribution of rhizospheric processes to mineral weathering in forest soils // Biogeochemistry of Trace Elements in the Rhizosphere. 2005. P. 3–26.
Gregory P.J. Roots, rhizosphere and soil: the route to a better understanding of soil science // European J. Soil Sci. 2006. V. 57. P. 2–12.
Haward S.J., Smits M.M., Ragnarsdottir K.V., Ragnarsdottir J.R.L., Banwart S.A., McMaster T.J. In situ atomic force microscopy measurements of biotite basal plane reactivity in the presence of oxalic acid // Geochim. Cosmochim. Acta. 2011. V. 75. P. 6870–6881.
Heinemeyer A., Wilkinson M., Vargas R., Subke J.-A., Casella E., Morison J.I.L., Ineson P. Exploring the “overflow tap” theory: linking forest soil CO2 fluxes and individual mycorrhizosphere components to photosynthesis // Biogeosciences. 2012. V. 9. P. 79–95.
Hubert F., Caner L., Meunier A., Ferrage E. Unraveling complex <2 μm clay mineralogy from soils using X-ray diffraction profile modeling on particle-size sub-fractions: Implications for soil pedogenesis and reactivity // American Mineralogist. 2012. V. 97. P. 384–398.
Hubert F., Caner L., Meunier A., Lanson B. Advances in characterization of soil clay mineralogy using X-ray diffraction: from decomposition to profile fitting // European J. Soil Sci. 2009. V. 60. P. 1093–1105.
Kalinowsky B.E., Schweda P. Kinetics of muscovite, phlogopite, and biotite dissolution and alteration at pH 1–4, room temperature // Geochim. Cosmochim. Acta. 1996. V. 60. № 3. P. 367–385.
Kapoor B.S. The formation of 2 : 1–2 : 2 intergrade clays in some Norwegian podzols // Clay Minerals. 1973. V. 10. P. 79–86.
Kapoor B.S. Weathering of micaceous clays in some Norwegian podzols // Clay Minerals. 1972. V. 9. P. 383–394.
Kodama H., Schnitzer M., Jaakkimainen M. Chlorite and biotite weathering by fulvic acid solutions in closed and open systems // Can. J. Soil Sci. 1983. V. 63. P. 619–629.
Li J., Zhang W., Li S., Li X., Lu J. Effects of citrate on the dissolution and transformation of biotite, analyzed by chemical and atomic force microscopy // Appl. Geochem. 2014. V. 51. P. 101–108.
Mavris C., Plötze M., Mirabella A., Giaccai D., Valboa G., Egli M. Clay mineral evolution along a soil chrono sequence in an Alpine proglacial area // Geoderma. 2011. V. 165. P. 106–117.
Moore D.M., Reynolds R.C. X-Ray diffraction and the identification and analysis of clay minerals. Oxford: Oxford University Press, 1989. 332 p.
Murakami T., Utsunomiya S., Yokoyama T., Kasama T. Biotite dissolution processes and mechanisms in the laboratory and in nature: Early stage weathering environment and vermiculitization // Am. Mineralogist. 2003. V. 88. P. 377–386.
Nottingham A.T., Turner B.L., Winter K., van der Heijden M.G.A., Tanner E.V.J. Arbuscular mycorrhizal mycelial respiration in a moist tropical forest // New Phytologist. 2010. V. 186. P. 957–967.
Price J.R., Velbel M.A. Rates of biotite weathering, and clay mineral transformation and neoformation, determined from watershed geochemical mass-balance methods for the coweeta hydrologic laboratory, Southern Blue Ridge Mountains, North Carolina, USA // Aquat. Geochem. 2014. V. 20. P. 203–224. https://doi.org/10.1007/s10498-013-9190-y
Robert M. The experimental transformation of mica Toward smectite; relative importance of total charge and tetrahedral substitution // Clays and Clay Minerals. 1973. V. 21. P. 167–174.
Rock-Forming Minerals. 3A. Sheet Silicates: Micas. London: The Geological Society, 2003. P. 758.
Turpault M.-P., Righi D., Uterano C. Clay minerals: Precise markers of the spatial and temporal variability of the biogeochemical soil environment // Geoderma. 2008. V. 147. P. 108–115.
Van Breemen N., Lundstrom U.S., Jongmans A.G. Do plants drive podzolization via rock-eating mycorrhizal fungi? // Geoderma. 2000. V. 94. P. 163–171.
Van Rompaey K., Van Ranst E., Verdoodt A., De Coninck F. Use of the test-mineral technique to distinguish simple acidolysis from acido-complexolysis in a Podzol profile // Geoderma. 2007. V. 137. P. 293–299.
Vicente M.A., Razzaghe M., Robert M. Formation of aluminum hydroxyl vermiculite (intergrade) and smectite from mica under acidic conditions // Clay Minerals. 1977. V. 12. P. 101–112.
Viennet J.-C., Hubert F., Ferrage E., Tertre E., Legout A., Tu rpault M.-P. Investigation of clay mineralogy in temperate acidic soil of forest using X-ray diffraction profile modeling: Beyond the HIS and HIV description // Geoderma. 2015. № 241–242. P. 75–86.
Voinot A., Lemarchand D., Collignon C., Graneta M., Chabaux F., Turpault M.-P. Experimental dissolution vs. transformation of micas under acidic soil conditions: Clues from boron isotopes // Geochim. Cosmochim. Acta. 2013. V. 117. P. 144–160.
Wang W., Sun J., Dong C., Lian B. Biotite weathering by Aspergillus niger and its potential utilization // J. Soils Sediments. 2016. V. 16. P. 1901–1910.
Wojdyr M. Fityk: a general-purpose peak fitting program // J. Appl. Cryst. 2010. V. 43. P. 1126–1128.
World Reference Base for Soil Resources 2006, first update 2007. World Soil Resources Reports. № 103. FAO, Rome. 116 p.
World reference base for soil resources 2014. International soil classification system for naming soils and creating legends for soil maps. Update 2015. food and agriculture organization of the united nations. Rome, 2015. 192 p.
Дополнительные материалы отсутствуют.