Почвоведение, 2019, № 10, стр. 1203-1210
Антагонизм и резистентность к антибиотикам актиномицетов из почв трех особо охраняемых природных территорий
И. Г. Широких a, b, c, *, А. А. Широких a, b
a Федеральный аграрный научный центр Северо-Востока им. Н.В. Рудницкого
610007 Киров, ул. Ленина, 166а, Россия
b Вятский государственный университет
610000 Киров, ул. Московская, 36, Россия
c Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: irgenal@mail.ru
Поступила в редакцию 27.08.2018
После доработки 17.01.2019
Принята к публикации 30.01.2019
Аннотация
Актуальность изучения устойчивости микроорганизмов к антибиотикам на особо охраняемых природных территориях обусловлена необходимостью управления процессами распространения резистентности среди патогенов человека, животных и растений. Микроорганизмы в составе природных микробных сообществ, в первую очередь почвенные микробоценозы, согласно концепции резистома, могут нести множество генов резистентности к антибиотикам и активно ими обмениваться. Сведений о распространении резистентности к антибиотикам среди микроорганизмов в ненарушенных хозяйственной деятельностью местообитаниях в настоящее время недостаточно. Из почв разного генезиса: аллювиальной дерновой (Fluvisols) (государственного природного заповедника “Нургуш”, Кировская область), горной коричневой (Cambisols) (заказник “Новый Свет”, Крым) и бурой лесной (Cambisols) (государственное природоохранное учреждение “Беловежская пуща”, Белоруссия) – были изолированы 48 штаммов стрептомицетов. Охарактеризована их антагонистическая активность в отношении микроскопических грибов и бактерий. Показано, что потенциал антагонистического действия изолятов из кислой аллювиальной дерновой почвы превосходит таковой у культур, выделенных из двух других исследованных почв. Оценка устойчивости природных изолятов к восьми антибиотикам из разных классов и разного механизма действия (ингибиторы синтеза клеточной стенки, нуклеиновых кислот, белка и метаболических путей) выявила специфические черты, отличающие друг от друга спектры резистентности стрептомицетов, изолированных из ненарушенных природных почв разного генезиса. Полученные данные расширяют имеющиеся представления о распространении устойчивости к антибиотикам в ненарушенных биотопах, представляют интерес для оценки рисков, связанных с передачей генов устойчивости из окружающей среды патогенам.
ВВЕДЕНИЕ
Беспрецедентное нарастание устойчивости к антибиотикам у патогенных микроорганизмов часто связывают с недостаточным контролем использования и распространения антимикробных соединений в медицине, сельском хозяйстве, пищевой промышленности. Поскольку накопление детерминант резистентности микроорганизмов к антибиотикам происходит в первую очередь в местах сброса сточных вод, внимание исследователей сосредоточено, чаще всего, на муниципальных и госпитальных очистных сооружениях [4, 21, 25], а также стоках животноводческих ферм [12]. Между тем гены резистентности к антибиотикам обнаружены у микроорганизмов, никогда ранее не имевших контакта с продуктами хозяйственной деятельности человека [15]. Это указывает на связь проблемы резистентности к антибиотикам со сложными экологическими и эволюционными отношениями между самими микроорганизмами, сложившимися задолго до появления человека как биологического вида [5]. Устойчивость микроорганизмов к антибиотикам − неотъемлемый атрибут любого микробного сообщества, а механизмы устойчивости к антибиотикам отражают способность к восстановлению сообщества при различных нарушениях [10]. В природных экосистемах антибиотики играют роль внутриклеточных сигнальных молекул, посредством которых осуществляется обмен информацией между представителями разных таксонов [8, 19]. Благодаря этому оба явления − способность синтезировать антибиотики и резистентность к их действию − широко распространены в микробном мире и существуют на протяжении многих миллионов лет. Большую роль в формировании и распространении наиболее “успешных” механизмов резистентности играют мобильные генетические элементы (транспозоны, интегроны, IS-элементы, плазмиды) и универсальные процессы обмена генетической информацией у бактерий (конъюгация, трансформация, трансдукция, рекомбинация) [26]. Благодаря наличию мобильных генетических элементов, гены резистентности к антибиотикам, еще до начала клинического использования антибиотиков, могли свободно циркулировать в природе, передаваясь от одних бактерий другим. Очевидно, в настоящее время продолжается приобретение бактериями устойчивости к антибиотикам в результате передачи готовых генетических кассет в составе мобильных элементов генома [16]. Поэтому для лучшего понимания механизмов возникновения и распространения устойчивости к антибиотикам среди клинически значимых микроорганизмов важно изучать антибиотикорезистентность не только в условиях, опосредованных деятельностью человека, но и в ненарушенных природных биотопах [23].
В соответствии с концепцией резистома, конкретным микробным сообществам присущи определенные наборы факторов резистентности [14]. Почва как естественная среда обитания микроорганизмов представляет собой резервуар устойчивых форм и содержит соответствующую генетическую информацию об устойчивости к антибиотикам [20]. Однако распространение устойчивости к антибиотикам в почвах разного генезиса изучено недостаточно. Особый интерес в этом отношении представляют почвы особо охраняемых природных территорий (ООПТ), в силу своей пространственной изоляции от муниципальных, госпитальных, аграрных и иных объектов хозяйственной деятельности. Поэтому антибиотический резистом таких почв можно рассматривать как результат формирования почвенных микробных сообществ в отсутствие селективного пресса, характерного для современной “эры антибиотиков”.
Высокие уровни устойчивости, как средство самозащиты от разрушения собственными антибиотиками, характерны для мицелиальных прокариот – актиномицетов, которые лидируют среди известных в настоящее время промышленных продуцентов антибиотиков. Установлено, что пути биосинтеза эритромицина и стрептомицина существуют у актиномицетов не менее 500 млн лет [9], что предполагает наличие у них не менее древних генетических механизмов резистентности [5]. Значительный вклад актиномицетов в формирование почвенного резистома отмечался исследователями неоднократно [7, 13, 14, 22].
Цель работы – изучение антагонистической активности и антибиотической резистентности актиномицетов, выделенных из почв лесных фитоценозов трех географически удаленных друг от друга ООПТ.
ОБЪЕКТЫ И МЕТОДЫ
Для выделения актиномицетов в чистые культуры использовали почвенные образцы, отобранные на модельных участках лесных фитоценозов трех пространственно удаленных друг от друга ООПТ.
Первый участок находился в центральной части Кировской области, на территории государственного природного заповедника (ГПЗ) “Нургуш” (57°58′–58°04′ N; 48°24′–48°31′ E) и представлял собой липняк с примесью дуба. Образцы аллювиальной дерновой зернистой среднегумусной глинистой почвы (Fluvisols) отбирали в восточной части квадрата 102, в районе перемычки озер Нургуш и Малое Кривое, рядом с поймой р. Вятка. Реакция почвенного раствора кислая (рНKCl 3.8), содержание Сорг 3.8%.
Второй участок расположен в государственном природоохранном учреждении (ГПУ) “Национальный парк “Беловежская пуща”, вблизи д. Каменюки (52°56′98″ N, 23°80′31″ E), Белорусссия. Образцы бурой лесной почвы (Cambisols) отобрали на территории выдела 77В/80Б смешанного леса, представленного дубравой грабово-кисличной. Реакция почвенного раствора слабокислая (рНKCl 4.8–5.1), содержание Сорг 6.2%.
Третий участок находился на территории Государственного природного заказника регионального значения Республики Крым “Новый Свет” (44°49′47″ N; 34°54′47″ E). Образцы горной коричневой почвы (Cambisols) отобрали в реликтовой роще, под пологом древовидного можжевельника (Juniperus excelsa). Реакция почвенного раствора нейтральная (рНKCl 7.1), содержание Сорг 1.8–2.0%.
Модельные участки имели площадь 100 м2 каждый. Образцы отбирали стандартным методом, из верхнего почвенного слоя до глубины 10–12 см, с выделением подстилки (0–4 см). Для каждого участка объединяли по 5 индивидуальных проб, массой не менее 100 г.
Культуры актиномицетов выделяли при посеве из разведений почвенных суспензий на среду с пропионатом натрия и казеин-глицериновый агар (КГА) [2]. Каждый объединенный образец при посеве характеризовали пятью индивидуальными навесками. Для ограничения роста немицелиальных бактерий использовали селективный прием: прогревание почвы при 70°С в течение 4 ч. Инкубация посевов происходила при 28°С в течение двух недель, после чего проводили дифференцированный учет выросших колоний по морфотипам и выделение клонов для дальнейшей работы. Выделенные культуры хранили в пробирках со скошенной овсяной средой при температуре 4°C. После процедуры очистки принадлежность выделенных актиномицетов к определенному роду устанавливали, как описано ранее [6]. Морфологические признаки исследовали при помощи светового микроскопа Leica DM 2500 (Carl Zeiss, Германия).
Диагностические признаки природных изолятов стрептомицетов изучали на минеральном агаре 1, органическом агаре 11, глицерин-нитратной, овсяной и пептон-дрожжевой средах в соответствии с ключом Гаузе с соавт. [1].
Для уточнения таксономического положения вновь выделенных штаммов выборочно проводили анализ фрагментов 16S рРНК в НПК “Синтол” (Москва). Первичный сравнительный анализ полученных нуклеотидных последовательностей с последовательностями из базы данных GenBank проводили с помощью программы NCBI BLAST (http://www.ncbi.nlm.nih.gov/blast). Нуклеотидные последовательности генов 16S рРНК штаммов выровнивали с соответствующими последовательностями ближайших видов бактерий с помощью программы LALIGN (https://embnet.vital-it.ch/ software/LALIGN_form.html).
Антагонистическую активность природных изолятов изучали методом диффузии в агар в отношении тест-культур микромицетов: Fusarium oxysporum, Alternaria alternata, Paecilomyces sp., Trichoderma sp., Candida albicans и бактерий: Pseudomonas putuda, Pseudomonas fluorescens, Pseudomonas sepacia, Streptococcus sp., Escherichia coli. Тест-культуры грибов выращивали на среде Чапека, бактерий – на среде RHM.
Для определения резистентности выделенных культур стрептомицетов использовали диски индикаторные ДИ-ПЛС-50-01 по ТУ 9398-001-39484474-2000 (НИЦФ, Россия, СПб) с антибиотиками в следующих концентрациях: 20/10 мкг амоксициллин/клавулановая кислота (АКК); 30 мкг налидиксовая кислота (НК); 1.25/23.75 мкг триметоприм/сульфаметоксазол (ТС); 30 мкг тетрациклин (ТЕТ); 30 мкг стрептомицин (СТР), 5 мкг рифампицин (РФМ); 300 ЕД полимиксин (ПМ); 15 мкг линкомицин (ЛНК). Интерпретацию результата проводили в соответствии с инструкцией на конкретную тест-систему: зоны задержки роста <16, ≤11, ≤19, ≤19, <13, ≤19, ≤13, <10 мм свидетельствовали об устойчивости к антибиотикам РФП, ПМ, ЛНК, СТР, НК, ТЕТ, АМК, ТС соответственно. Тестировали не менее 15 природных изолятов из каждого биотопа.
Статистическую обработку данных проводили стандартными методами с использованием программ Statgrafiсs и Excel 5.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Среднее количество актиномицетов, вырастающих при посеве из разведений почвенных суспензий, изменялось в зависимости от места отбора образца от десятков тысяч (“Беловежская пуща”) до миллионов (“Новый Свет” и “Нургуш”) колониеобразующих единиц (КОЕ) в пересчете на 1 г субстрата (табл. 1). Доля актиномицетов в прокариотном комплексе исследуемых почв (0–31.9%) и подстилок (3.3–53.0%) также варьировала в широких пределах в зависимости от конкретного биотопа. Дифференцированный учет колоний по морфотипам позволил установить, что аллювиальная дерновая, бурая лесная и коричневая горная почвы ООПТ различалась между собой не только по концентрации, но и по биоразнообразию актиномицетов. Общей закономерностью для актинобиоты исследуемых почв явилось преобладание в посевах колоний, микроскопия которых выявила типичные для рода Streptomyces морфологические признаки: нефрагментированный мицелий, длинные цепочки спор – на воздушном и отсутствие спор – на субстратном мицелии [3].
Таблица 1.
Количественные показатели актинобиоты исследуемых почв ООПТ
| Показатель | “Нургуш” | “Беловежская пуща” | “Новый Свет” | |||
|---|---|---|---|---|---|---|
| подстилка | почва | подстилка | почва | подстилка | почва | |
| Общая численность актиномицетов, тыс. КОЕ/г | 1035 ± 147 | 1501 ± 354 | 578 ± 134 | 21.8 ± 0.94 | 2817 ± 873 | 8158 ± 344 |
| Доля актиномицетов в прокариотном комплексе, % | 16 | 10 | 28–53 | 0–9 | 3.3 – 8.5 | 24.1–31.9 |
| Количество родов, выделяемых на среде с пропионатом натрия | 5 | 3 | 5 | 3 | 4 | 5 |
| Относительное обилие в актиномицетном комплексе представителей рода Streptomyces, % | 68 | 22 | 55–85.3 | 50–72.6 | 67.6–79.0 | 62.5–77.1 |
| Количество секций и серий рода Streptomyces | 5 | 6 | 5 | 4 | 8 | 7 |
| Количество выделенных для исследования культур | 7 | 8 | 10 | 6 | 6 | 11 |
Идентификация выделенных штаммов, основанная на анализе фрагментов гена 16S рРНК, подтвердила, что изоляты с данным морфотипом являются представителями рода Streptomyces, семейства Streptomycetaceae, порядка Streptomycetales, класса Actinobacteria. В то же время видовая идентификация стрептомицетов, основанная на анализе гена 16s рРНК, вызвала значительные затруднения, так как нуклеотидные последовательности данного гена обладали высоким сходством для различных представителей рода Streptomyces. Все нуклеотидные фрагменты, выданные BLAST для исследуемых штаммов, более чем на 98% соответствовали введенным последовательностям, что послужило основанием к уточнению их таксономического положения с привлечением фенотипических признаков: цвет воздушного и субстратного мицелия, наличие и цвет растворимого пигмента, форма цепочек спор.
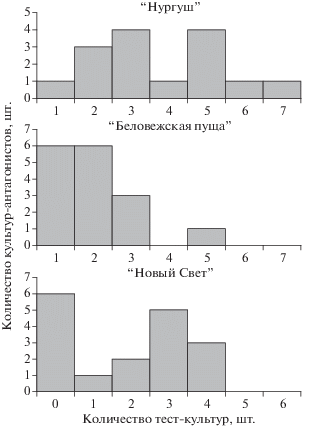
Оценка антифунгальной и антибактериальной активности стрептомицетов, выделенных из почв разных типов, показала, что антагонизм распространен наиболее широко среди изолятов из аллювиальной дерновой почвы ГПЗ “Нургуш”. Практически все стрептомицетные культуры подавляли рост от одной до семи использованных в работе тест-культур (рис. 1).
В отдельности антифунгальным и антибактериальным действием характеризовались по 86% культур. Одновременную активность в отношении грибов и бактерий обнаружили 40% изолятов (табл. 2). Наиболее широким спектром действия, против шести и семи тест-культур, отличались штаммы S. wedmorensis 1-18r и S. sindenensis 1-10 соответственно.
Таблица 2.
Распространение антагонистически активных штаммов среди изолятов стрептомицетов из почв различных ООПТ
| Тест-культура | Доля антагонистов в почвах ООПТ, % | |||
|---|---|---|---|---|
| “Нургуш” | “Беловежская пуща” | “Новый Свет” | ||
| Грибы | Fusarium oxysporum | 64 | 37 | 35 |
| Alternaria alternate | 71 | 0 | 0 | |
| Paecilomyces sp. | 43 | 12 | 18 | |
| Trichoderma sp. | 64 | 56 | 41 | |
| Candida albicans | Не опр. | 0 | Не опр. | |
| Бактерии | Pseudomonas putida | 33 | 12 | 0 |
| Pseudomonas fluorescens | Не опр. | 12 | 23 | |
| Pseudomonas cepacia | 47 | 6 | 0 | |
| Staphylococcus aureus | 60 | 44 | 59 | |
| Ervinia rhapontici | 7 | Не опр. | Не опр. | |
| Escherichia coli | Не опр. | 19 | 12 | |
При переходе от аллювиальной дерновой к бурой лесной почве ГПУ “Беловежская пуща” относительная доля изолятов с антифунгальной и антибактериальной активностью сократилась от 86 до 81 и 62% соответственно. Большинство изолятов ингибировали рост одной–двух тест-культур.
Антагонистическим действием против грибов и бактерий одновременно обладала лишь четверть (25%) выделенных культур стрептомицетов. Широким спектром действия (против P. fluorescens, Streptococcus sp., F. oxysporum, Paecilomyces sp., Trichoderma sp.) в выборке из этого биотопа отличалась лишь культура S. varsoviensis БП-31.
Антагонистический потенциал стрептомицетов, выделенных из горной коричневой почвы заказника “Новый Свет”, значительно уступал потенциалу природных изолятов из более кислых почв северных территорий. Так, 35% стрептомицетов из данной выборки не ингибировали рост ни одной из используемых в работе тест-культур. Антифунгальную и антибактериальную активность проявили соответственно 41 и 29% изолятов, то есть приблизительно вдвое меньше, чем изоляты из аллювиальной дерновой и бурой лесной почв. Вместе с тем доля изолятов, активных одновременно против грибов и бактерий, в данной выборке была наиболее высокой и составила 47%. При этом спектр действия культур-антагонистов был значительно уже, чем у стрептомицетных изолятов из других почв, ограничиваясь, максимум, четырьмя тест-культурами. Значительным антагонистическим потенциалом отличался штамм S. oligocarbophilus К3-11, активный одновременно в отношении P. fluorescens, Streptococcus sp., F. oxysporum, Trichoderma sp. (зоны ингибирования составили соответственно 37, 30, 19, 24 мм).
Против изолятов из каждой исследуемой почвы был использован одинаковый набор антибиотиков. Он включал препараты из разных функциональных классов, с различными внутриклеточными мишенями [24]: ингибитор синтеза нуклеиновых кислот из группы хинолонов (НК); ингибиторы синтеза белка на уровне 30S – рибосом (ТЕТ и аминогликозидный антибиотик СТР); ЛНК, нарушающий синтез белка на уровне 50S – рибосом; ингибитор синтеза клеточной стенки из группы пенициллинов с клавулановой кислотой, ингибитором бета-лактамазы (АКК); полусинтетический антибиотик из группы ансамакролидов, ингибитор ДНК-зависимой РНК-полимеразы (РИФ); ингибитор функций цитоплазматической мембраны (ПМ), а также антиметаболит фолиевой кислоты (ТС).
Определение устойчивости природных изолятов в отношении набора антибиотиков позволило выявить специфические черты, отличающие друг от друга спектры резистентности стрептомицетов из почв разных биотопов (рис. 2).
Рис. 2.
Спектры устойчивости к антибиотикам изолятов стрептомицетов из почв ООПТ: АКК – амоксициллин/клавулановая кислота, НК – налидиксовая кислота, ТС – триметоприм/сульфаметоксазол, ТЕТ – тетрациклин, СТР – стрептомицин, РФМ – рифампицин, ПМ – полимиксин, ЛНК – линкомицин.
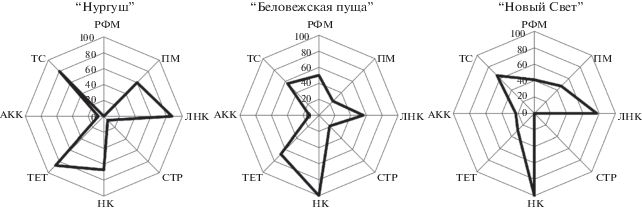
Для аллювиальной дерновой почвы ГПЗ “Нургуш” отличительными признаками служили отсутствие штаммов, устойчивых к РИФ, а также более высокая, чем в выборках из других почв, доля культур, резистентных к ЛНК (87%), ТС (80%), и ПМ (60%). Особенностью резистома горной коричневой почвы из заказника “Новый Свет” явилось отсутствие культур с устойчивостью к СТР в сочетании с широким распространением в выборке устойчивости к НК (100%). Бурая лесная почва ГПУ “Беловежская пуща” также характеризовалась тотальной устойчивостью изолятов к НК (100%), но при этом отличалась более равномерным, чем в других почвах, долевым участием в выборке стрептомицетов с резистентностью к каждому из использованных в работе тест-антибиотиков.
Сопоставление спектров резистентности природных изолятов в ряду исследованных почв показало, что в направлении с северо-востока (“Нургуш”) на юго-запад (“Новый Свет”) постепенно возрастает (от 7 до 23%) доля культур, устойчивых в отношении АКК, тогда как доля культур, резистентных к ТЕТ, напротив, сокращается (от 87 до 29%). В отношении изменения доли стрептомицетов с устойчивостью к другим антибиотикам, в зависимости от географического места их изоляции, определенных тенденций не выявлено.
Сравнение выборок стрептомицетов по ширине спектра антибиотической устойчивости показало, что между резистомами разных почв существует определенное сходство по этому критерию. Так, ни один изолят из трех сравниваемых почв не был устойчив ко всем восьми тест-антибиотикам одновременно. В то же время каждый из 48 изученных изолятов характеризовался устойчивостью, по меньшей мере, к одному, а чаще – к нескольким антибиотикам одновременно. Максимальное количество изолятов из аллювиальной дерновой (53%) и горной коричневой почв (35%) проявили резистентность к трем из восьми антибиотиков (рис. 3).
Гораздо реже в выборках из “Нургуша” (26%) и “Нового Света” (29%) встречались культуры с устойчивостью к пяти и более тест-антибиотикам. В то же время изоляты из бурой лесной почвы Беловежья распределялись по устойчивости к двум, трем, четырем и пяти антибиотикам относительно равномерно (от 12 до 25%). Множественной устойчивостью к пяти и более антибиотикам среди них характеризовались 37% изолятов.
Обнаруженные различия между резистомами исследованных почв могут быть связаны с геохимическими особенностями почвенного покрова в пределах географически удаленных друг от друга ООПТ. В пользу этого предположения свидетельствуют имеющиеся в литературе сообщения о влиянии на возникновение и развитие устойчивости микроорганизмов к антибиотикам соединений аммония [17], меди [11] и других тяжелых металлов [18]. На пул резистентности к антибиотикам в природной среде могут также оказывать влияние, через процессы горизонтального переноса генов, такие природные факторы, как температура, доступность кислорода, рН почвенного раствора и трофические характеристики почвы [20]. Однако для выявления строгих количественных зависимостей между распространением устойчивых к антибиотикам актиномицетов и физико-химическими свойствами почвенной среды необходимо проведение специальных экспериментов, выходящих за рамки данной работы.
ЗАКЛЮЧЕНИЕ
В результате выполненных исследований показано, что устойчивые к антибиотикам стрептомицеты присутствуют в составе природных микробных сообществ почв разного генезиса, различающихся по реакции почвенного раствора и содержанию органического вещества: аллювиальной дерновой, бурой лесной и горной коричневой. Выявление резистентности микроорганизмов в ненарушенных природных местообитаниях ООПТ свидетельствует о том, что устойчивость к антибиотикам – перманентно и самопроизвольно поддерживающийся в почвах процесс. Детерминанты устойчивости длительное время могут присутствовать в природных популяциях в условиях отсутствия антибиотиков, как селективного фактора. Резистомы почв формируются в результате сложного взаимодействия клеток гетерогенных микробных популяций в конкретных условиях местообитания и имеют специфические черты, обусловленные в числе прочих факторов, вероятно, особенностями геохимической среды.
Различия между резистомами стрептомицетов в исследуемых почвах заключались в первую очередь в вариабельности долевого участия культур с устойчивостью к антибиотикам, различающегося по механизмам действия. Изоляты из сильнокислой аллювиальной дерновой почвы проявляли чаще устойчивость к антибиотикам, специфически блокирующим синтез белка на уровне 30S (ТЕТ) и 50S (ЛНК) рибосом, а также к ингибитору метаболизма фолиевой кислоты (ТС). Все культуры, выделенные из менее кислой бурой лесной и нейтральной горной коричневой почвы, несли гены устойчивости к НК – антибиотику из группы хинолонов, нарушающему процессы репликации ДНК за счет ингибирования фермента ДНК-гиразы.
Сопоставление результатов по распространению в почвах стрептомицетов, устойчивых к антибиотикам, и стрептомицетов, антагонистически активных, не выявило прямой связи между этими характеристиками. Около трети всех изолятов из каждого биотопа: аллювиальной (26%), бурой (37%) и коричневой (29%) почв – характеризовались множественной устойчивостью к антибиотикам, тогда как только культуры, выделенные из сильнокислой аллювиальной почвы ГПЗ “Нургуш” демонстрировали высокий антагонистический потенциал.
Полученные спектры резистентности стрептомицетов к антибиотикам можно использовать для оценки рисков, связанных с передачей генов устойчивости из окружающей среды в популяции ассоциированных с человеком микроорганизмов. При этом необходимо учитывать, что на долю стрептомицетов в прокариотном комплексе исследованных почв приходится только несколько процентов, поэтому в реальности антибиотический резистом ненарушенных природных почв гораздо более значителен.
Список литературы
Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А., Терехова Л.П., Максимова Т.С. Определитель актиномицетов. Роды Sreptomyces, Streptoverticillium, Chainia. М.: Наука, 1983. 248 с.
Добровольская Т.Г., Головченко А.В., Лысак Л.В., Зенова Г.М. Физикохимия и биология торфа // Методы оценки численности и разнообразия бактериальных и актиномицетных комплексов торфяных почв. Томск: Изд-во Томского гос. педагогического ун-та, 2010. 97 с.
Определитель бактерий Берджи / Под ред. Хоулт Дж. и др. М.: Мир, 1997. Т. 2. 800 с.
Сазыкин И.С., Сазыкина М.А., Хмелевцова Л.Е., Селиверстова Е.Ю. Клинически значимые гены резистентности бактерий в микробоценозах Нижнего Дона, находящихся под антропогенным прессингом // Актуальные вопросы эпидемиологии, микробиологии и диагностики инфекционных и паразитарных заболеваний в Ростовской области. 2017. С. 148−151.
Супотницкий М.В. Механизмы развития резистентности к антибиотикам у бактерий // Биопрепараты. 2011. № 2. С. 4–44.
Широких И.Г., Ашихмина Т.Я., Широких А.А. Особенности актиномицетных комплексов в урбаноземах г. Киров // Почвоведение. 2011. № 2. С. 199–205.
Allen H.K., Donato J., Wang H.H., Cloud-Hansen K.A., Davies J., Handelsman J. Call of the wild: antibiotic resistance genes in natural environments // Nature Reviews Microbiology. 2010. V. 8. № 4. P. 251−259. https://doi.org/10.1038/nrmicro2312
Aminov R.I. The role of antibiotics and antibiotic resistance in nature // Environ Microbiol. 2009. V. 11. P. 2970–2988. https://doi.org/10.1111/j.1462-2920.2009.01972.x
Baltz R.H. Antimicrobials from Actinomycetes: back to the future // Am. Soc. Microbiol. 2007. V. 2. P. 125–131.
Baquero F., Alvarez-Ortega C., Martinez J.L. Ecology and evolution of antibiotic resistance // Environ. Microbiol. Reports. 2009. V. 1. № 6. P. 469−476. https://doi.org/10.1111/j.1758-2229.2009.00053.x
Berg J., Tom-Petersen A., Nybroe O. Copper amendment of agricultural soil selects for bacterial antibiotic resistance in the field // Lett. Appl. Microbiol. 2005. V. 40. № 2. P. 146−151. https://doi.org/10.1111/j.1472-765X.2004.01650.x
Chee-Sanford J.C., Mackie R.I., Koike S., Krapac I.G., Lin Y.F., Yannarell A.C., Maxwell S., Aminov R.I. Fate and transport of antibiotic residues and antibiotic resistance genes following land application of manure waste // J. Environ. Quality. 2009. V. 38. P. 1086e1108. https://doi.org/10.2134/jeq2008.0128
D’Costa V.M., King C.E., Kalan L., Morar M., Sung W.W., Schwarz C., Froese D., Zazula G., Calmels F., Debruyne R., Golding G.B., Poinar H.N., Wright G.D. Antibiotic resistance is ancient // Nature. 2011. V. 477. P. 457−461.
D’Costa V.M., McGrann K.M., Hughes D.W., Wright G.D. Sampling the antibiotic resistome // Science. 2006. V. 311. № 5759. P. 374−377. https://doi.org/10.1126/science.1120800
Finley R.L., Collignon P., Larsson D.J., McEwen S.A., Li X.Z., Gaze W.H., Topp E. The scourge of antibiotic resistance: the important role of the environment // Clinical Infectious Diseases. 2013. P. cit355.
French G.L. The continuing crisis in antibiotic resistance // Int. J. Antimicrob. Agents. 2010. V. 36. № 3. P. 3−7. https://doi.org/10.1016/S0924-8579(10)70003-0
Gaze W.H., Abdouslam N., Hawkey P.M., Welling-ton E.M.H. Incidence of class 1 integrons in a quaternary ammonium compound-polluted environment // Antimicrobial agents and chemotherapy. 2005. V. 49(5). P. 1802−1807. https://doi.org/10.1128/AAC.49.5.1802-1807.2005
Knapp C.W., McCluskey S.M., Singh B.K., Campbell C.D., Hudson G., Graham D.W.L. Antibiotic resistance gene bundances correlate with metal and geochemical conditions in archived Scottish soils // PLoS One. 2011. V. 6. № 11. P. e27300. https://doi.org/10.1371/journal.pone.0027300
Kozhevin P.A., Vinogradova K.A., Bulgakova V.G. Natural functions of antibiotics as “informbiotics” // Moscow University Soil Science Bulletin. 2014. T. 69. № 3. P. 93−98.
Kozhevin P.A., Vinogradova K.A., Bulgakova V.G. The soil antibiotic resistome // Moscow University Soil Science Bulletin. 2013. V. 68. № 2. P. 3−10.
Pepper I.L., Brooks J.P., Gerba C.P. Antibiotic resistant bacteria in municipal wastes: Is there reason for concern? // Environmental Sci. Technol. 2018. T. 52. № 7. C. 3949–3959. https://doi.org/10.1021/acs.est.7b04360
Schlatter D.C., Kinkel L.L. Do tradeoffs structure antibiotic inhibition, resistance, and resource use among soil-borne Streptomyces? // BMC Evolutionary Biol. 2015. V. 15. № 1. P. 186. https://doi.org/10.1186/s12862-015-0470-6
Surette M.D., Wright G.D. Lessons from the environmental antibiotic resistome // Annual Rev. Microbiol. 2017. V. 71. P. 309−329. https://doi.org/10.1146/annurev-micro-090816-093420
Valdivia L., Rice L.B. Target-Mediated Antibacterial Resistance // Antimicrobial Drug Resistance. Springer, Cham, 2017. P. 89–95.
Verlicchi P., Al Aukidy M., Galletti A., Petrovic M., Barceló D. Hospital effluent: investigation of the concentrations and distribution of pharmaceuticals and environmental risk assessment // Sci Total Environ. 2012. V. 430. P. 109–118. https://doi.org/10.1016/j.scitotenv.2012.04.055
Wright G.D. Antibiotic resistance in the environment: a link to the clinic? //Curr. Opin. Microbiol. 2010. V. 13. P. 589–594. https://doi.org/10.1016/j.mib.2010.08.005
Дополнительные материалы отсутствуют.