Почвоведение, 2019, № 3, стр. 355-369
Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы
М. В. Семенов 1, *, Д. А. Никитин 1, 2, А. Л. Степанов 2, В. М. Семенов 3
1 Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, Россия
2 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
3 Институт физико-химических и биологических проблем почвоведения РАН
142290 Московская обл., Пущино, ул. Институтская, 2, Россия
* E-mail: mikhail.v.semenov@gmail.com
Поступила в редакцию 14.02.2018
После доработки 14.02.2018
Принята к публикации 26.09.2018
Аннотация
Проведено сравнение таксономического состава, численности и разнообразия бактериальных и грибных сообществ ризосферных и внекорневых локусов серой лесной почвы (Eutric Retisol (Loamic, Aric, Cutanic, Humic)) под картофелем, кукурузой и горчицей, выращиваемых с применением минеральных и органических удобрений. Среди бактерий доминантами по численности и частоте встречаемости в почве всех вариантов опыта были виды Bacillus megaterium и Paenibacillus polymyxa. Сообщество микромицетов было представлено 39 видами, относящихся к 19 родам. Под действием органических удобрений увеличивалась численность Trichoderma harzianum, являющегося антагонистом многих фитопатогенов. Обнаружено сокращение численности представителей рода Fusarium sp. как в ризосфере, так и вне ее. Система удобрения была наиболее значимым фактором, определяющим структуру и разнообразие сообществ микромицетов в почве и ризосфере. Внесение минеральных удобрений уменьшало разнообразие микромицетов в почве, тогда как применение органических удобрений, наоборот, увеличивало. В целом, органическая система удобрения может быть более благоприятной для ризосферного и внекорневого микобиомов и общей почвенной супрессивности, чем минеральная система.
Ризосфера – тонкий слой почвы, непосредственно прилегающий к корням растения и формирующийся под действием корневых экссудатов. Считается, что ризосфера является одной из “горячих точек” микробной активности в почве и относится к наиболее сложным по разнообразию и межвидовым связям локусам [30, 36]. Состав и численность микроорганизмов ризосферы отличны от таковых во внеризосферной почве (bulk soil). В состав ризосферного микробиома входят азотфиксаторы, ризобактерии (PGPR), микоризообразователи и многие другие микроорганизмы, благотворно влияющие на рост и развитие растений, так и фитопатогенные бактерии, грибы, оомицеты, оказывающие негативное воздействие на урожай [35]. В ризосфере происходят активные взаимодействия между фитопатогенами и остальным микробным сообществом, от исхода которых во многом зависит супрессивность почвы – способность подавлять или элиминировать отдельные виды патогенов. Поэтому при оценке супрессивной активности почвы следует ориентироваться на показатели, описывающие свойства ризосферного микробиома либо отдельных ключевых его представителей.
Состав и структура ризосферного микробиома зависит от физико-химических свойств почвы (содержание углерода и азота, pH, гранулометрический состав и др.), сезонных изменений температуры и влажности [46], вида, сорта и стадии развития растений [1, 6, 39, 46]. Еще одним фактором, определяющим структуру микробиома ризосферных локусов, так и микробного сообщества почвы в целом, является использование минеральных и/или органических удобрений. Влияние традиционной и органической систем земледелия на разнообразие микробных сообществ почвы считается сложным, противоречивым и до конца не ясным [27]. Высокие концентрации минеральных удобрений в зоне их размещения в почве подавляют ферментативную активность почвы [9], вызывают разные типы модификационной изменчивости микробного сообщества почвы с соответствующей адаптивной реакцией, характерной для гомеостаза, стресса, резистентности и репрессии [4]. Длительное внесение минерального азота может снижать интенсивность микоризации корней сельскохозяйственных культур [33], уменьшать образование спор и развитие мицелия арбускулярных микоризных грибов [24], а также ограничивать видовое богатство грибов и бактерий за счет подкисления почвы при внесении физиологически кислых солей [41].
Применение органических удобрений в виде навоза или компостов способствует обогащению почвы микробной биомассой как содержащейся в самом удобрении, так и развивающейся в почве благодаря дополнительному поступлению углерода и азота [18]. Отклик бактерий и грибов на внесение органических удобрений может существенно различаться, поскольку большинство бактерий используют только простые и легкодоступные органические вещества, тогда как многие грибы могут разлагать и сложные субстраты [34]. При органическом земледелии изменяется состав почвенного микробиома в сторону повышения доли r-стратегов [16], увеличивается функциональное и таксономическое разнообразие микробного сообщества, в том числе за счет роста численности таксонов-антагонистов [22, 43], что ведет к уменьшению числа возбудителей болезней растений [44].
Однако использование только органических удобрений, особенно жидкого и не обеззараженного навоза, также может быть причиной экологических нарушений в почвенной экосистеме [38]. Во-первых, с вносимым навозом поступает большое количество микроорганизмов, не свойственных почвенной среде. Во-вторых, органические удобрения обогащены легкоразлагаемыми органическими соединениями, присутствие которых может инициировать развитие быстрорастущих таксонов с доминированием фитопатогенов, а также оказывать ингибирующее действие на не адаптированные к таким соединениям виды почвенных микроорганизмов.
Таким образом, ризосфера представляет собой динамичный локус со специфической структурой почвенного сообщества. Значительное варьирование состава ризосферного микробиома, вызванное экофизиологическими ритмами корневых выделений в течение онтогенеза разных видов растений, осложняет идентификацию типичных для ризосферы микроорганизмов. Можно предположить, что ризосферные и внеризосферные микробиомы будут отличаться по своему отклику на внесение удобрений. В данной работе был проведен анализ численности и разнообразия культивируемых бактерий и микромицетов в ризосферных и внеризосферных локусах серой лесной почвы под картофелем, горчицей и кукурузой в разных фазах онтогенеза с применением органической и минеральной систем удобрения.
ОБЪЕКТЫ И МЕТОДЫ
Почва. Исследования проводили с образцами серой лесной почвы (Eutric Retisol (Loamic, Aric, Cutanic, Humic)), отобранными в многолетнем микрополевом опыте (Институт физико-химических и биологических проблем почвоведения РАН, Пущино, Московская обл.). Серая лесная почва характеризуется сбалансированным микробным ростом при наличии субстрата [31]. В составе микробной биомассы серой лесной почвы преобладают грибы, а вклад бактерий составляет не более 9–20% [5, 13]. Условия проведения микрополевого опыта подробно описаны в работе [7]. Образцы почв отбирались с двух вариантов опыта, в которых на протяжении семи лет ежегодно вносилось полное минеральное удобрение в дозах N180P180K180 (мочевина, суперфосфат, сернокислый калий), и свежий навоз крупного рогатого скота в дозе 50 т/га. Опытными культурами были кукуруза (гибрид Молдавский 215 МВ), картофель (Жуковский) и горчица белая (Радуга). Первый отбор образцов почвы проводили в третьей декаде июня (фаза 2–4 листьев кукурузы, начало бутонизации картофеля и цветения горчицы), второй – в конце июля (фаза 6–8 листьев кукурузы, начало клубнеобразования картофеля и образования стручков горчицы). Отбор почвы производился в двух локусах: в ризосфере вегетирующих растений и в междурядье (в случае картофеля – на расстоянии 10–15 см от высаженного клубня). Контролем служила почва под длительным чистым паром. Все почвенные образцы обозначены индексами по схеме: растение – система удобрения – почвенный локус – срок отбора. Варианты растений обозначены индексами P – картофель, W – горчица белая, M – кукуруза; системы удобрения, соответственно, M – минеральная и O – органическая; локусы почвы имеют индексы B – внекорневой и R – ризосферный, а сроки отбора 1 – июнь и 2 – июль. Чистый пар (bare fallow) обозначен индексом BF (табл. 1).
Таблица 1.
Основные химические свойства почвы исследуемых вариантов
| Индекс | Культура | Система удобрения | Локус | С орг | N общ | С/N | pH водной вытяжки |
|---|---|---|---|---|---|---|---|
| % | |||||||
| Июнь | |||||||
| PMB-1 | Картофель | Минеральная | Почва | 1.23 | 0.131 | 9.4 | 4.51 |
| PMR-1 | Ризосфера | 1.34 | 0.134 | 10.0 | 4.53 | ||
| POB-1 | Органическая | Почва | 1.68 | 0.153 | 11.0 | 5.92 | |
| POR-1 | Ризосфера | 1.80 | 0.157 | 11.5 | 6.11 | ||
| WMB-1 | Горчица | Минеральная | Почва | 1.23 | 0.131 | 9.4 | 4.33 |
| WMR-1 | Ризосфера | 1.36 | 0.141 | 9.7 | 4.82 | ||
| WOB-1 | Органическая | Почва | 1.59 | 0.153 | 10.4 | 6.27 | |
| WOR-1 | Ризосфера | 1.76 | 0.160 | 11.0 | 6.37 | ||
| MMB-1 | Кукуруза | Минеральная | Почва | 1.22 | 0.135 | 9.0 | 4.44 |
| MMR-1 | Ризосфера | 1.35 | 0.142 | 9.5 | 4.56 | ||
| MOB-1 | Органическая | Почва | 1.67 | 0.158 | 10.6 | 5.75 | |
| MOR-1 | Ризосфера | 1.81 | 0.166 | 10.9 | 6.20 | ||
| Июль | |||||||
| PMB-2 | Картофель | Минеральная | Почва | 1.22 | 0.122 | 10.0 | 4.39 |
| PMR-2 | Ризосфера | 1.35 | 0.131 | 10.3 | 4.41 | ||
| POB-2 | Органическая | Почва | 1.64 | 0.157 | 10.4 | 6.16 | |
| POR-2 | Ризосфера | 1.97 | 0.189 | 10.4 | 6.39 | ||
| WMB-2 | Горчица | Минеральная | Почва | 1.22 | 0.130 | 9.3 | 4.75 |
| WMR-2 | Ризосфера | 1.28 | 0.133 | 9.6 | 4.76 | ||
| WOB-2 | Органическая | Почва | 1.64 | 0.159 | 10.3 | 6.16 | |
| WOR-2 | Ризосфера | 1.89 | 0.167 | 11.3 | 6.19 | ||
| MMB-2 | Кукуруза | Минеральная | Почва | 1.21 | 0.124 | 9.8 | 4.40 |
| MMR-2 | Ризосфера | 1.33 | 0.131 | 10.2 | 4.58 | ||
| MOB-2 | Органическая | Почва | 1.58 | 0.154 | 10.3 | 6.15 | |
| MOR-2 | Ризосфера | 1.82 | 0.170 | 10.8 | 6.35 | ||
| BF | Чистый пар (контроль) | Почва | 1.01 | 0.110 | 9.1 | 6.12 | |
Образцы всех вариантов отбирали в трех повторностях. Вначале вырезали монолит почвы в междурядье размером 5 × 5 × 10 см, из которого отбирали три смешанных образца. Затем вырезали почвенный монолит с вегетирующим растением. На разделочном столе отделяли крупные комки почвы, после чего с помощью кисточки стряхивали ризосферную почву с поверхности корней [10]. Почвенные образцы для микробиологических анализов отбирали с соблюдением требований по контролю микробиологической контаминации. Образцы почвы до анализов хранились в стерильных пакетах в течение месяца в холодильнике при температуре +4°С. Для определения химических свойств почв использовали воздушно-сухие образцы.
Химические свойства почвы и содержание микробной биомассы. Весовую влажность свежих образцов почвы определяли высушиванием при температуре +105°С в течение 24 ч. Содержание органического углерода (С орг) и общего азота (N общ) в почве определяли на автоматическом HCNS-анализаторе “Leco 932" (США). Величины водного pH почвы измеряли потенциометрическим способом при соотношении почва : вода, равном 1 : 2.5.
Культивирование на питательных средах. Таксономический состав культивируемых бактерий и микроскопических грибов определяли методом микробиологического посева. В стерильных пластиковых пробирках готовили суспензии исследуемых образцов с разведением 1 : 10. Десорбцию клеток бактерий осуществляли путем обработки почвенной суспензии ультразвуком “Branson Digital Sonifier S-450” (Branson Ultrasonics, США) в течении 2-х мин при мощности 70% от максимальной, а микроскопических грибов – на вортексе “MSV-3500” (Латвия) при скорости 3500 об/мин в течение 5 минут. Аликвоту почвенной суспензии объемом 100 мкл помещали на поверхность стерильных агаризованных сред Чапека и картофельного агара в чашках Петри диаметром 90 мм. Повторность посевов шестикратная. Для подавления роста грибов в среды для бактериальных посевов добавляли нистатин (70 мг/л). Ингибирование роста бактерий в грибных посевах осуществляли добавлением стрептомицина (100 мг/л). Учет численности выросших колониеобразующих единиц (КОЕ) бактерий проводили на 3, 7, 10 и 14-е сут, а микромицетов – на 7, 14 и 20-е сут. Из посевов в чистые культуры выделяли морфотипы по макро- и микрокультуральным признакам. Общее разнообразие грибных сообществ оценивали по индексу Шеннона.
Идентификация штаммов бактерий и грибов. Идентификацию штаммов бактерий проводили с помощью анализа нуклеотидных последовательностей гена 16S рРНК. Геномную ДНК экстрагировали с использованием набора “Проба-экспресс” (“Синтол”, Россия) с добавлением 5% Triton X-100 (“AppliChem”, Германия). Далее суспензию клеток в лизирующем растворе кипятили при +100°C в течение 15 мин, после чего подвергали гомогенизации с использованием стеклянных шариков (50–200 мкм) на гомогенизаторе Mini-BeadBeater (США) при 5000 об./мин в течение 60 с. Полимеразную цепную реакцию (ПЦР) проводили с использованием ПЦР-смеси “ScreenMix” (“Евроген”, Россия) с праймерами 27f + Un1492r (штаммы Н1, Н8, Н9, Н10, Н12) [17] и 27f + 537r (штаммы Н2–Н7, Н11) [17, 29]. ПЦР-продукты были очищены и секвенированы по методу Сэнгера компанией “Синтол” (Москва, Россия) с использованием внутреннего праймера 1100r (штаммы Н1, Н8, Н9, Н10, Н12) и праймера 537r (штаммы Н2–Н7, Н11) [29]. Полученные нуклеотидные последовательности редактировали с помощью программы ChromasLite 2.01 (http://www.technelysium.com.au). Выравнивание, сравнение и идентификацию нуклеотидных последовательностей проводили с помощью программы CLUSTALW2 (http://www.ebi.ac.uk/Tools/ clustalw2/index.html) и алгоритма BLAST базы данных GenBank (http://blast.ncbi.nlm.nih.gov/ Blast.cgi). Полученные последовательности были депонированы в базу данных NCBI GenBank под номерами MG372733, MG372734, MG372735, MG372736, MG372737, MG372738, MG372739, MG372740, MG372741, MG372742, MG372743, MG372744.
Видовую идентификацию микромицетов проводили по определителям для разных групп грибов [19, 20]. Таксономическую принадлежность отдельных штаммов дополнительно проверяли по анализу участков ITS1 и ITS2 рДНК. Выделение ДНК осуществляли по методике, описанной Глушаковой с соавторами [3] для дрожжей, но с тремя подобными циклами, поскольку мицелиальные грибы часто устойчивы к перепадам температуры и действию лизирующего буфера. Полимеразную цепную реакцию (ПЦР) осуществляли с использованием ПЦР-смеси “ScreenMix” (“Евроген”, Россия) с праймерами ITSf1 и NL4 (“Евроген”, Россия). ПЦР-продукты были очищены и секвенированы по методу Сэнгера компанией “Синтол” (Москва, Россия) с использованием набора реактивов BigDye Terminator V3.1 Cycle Sequencing Kit (“Applied Biosystems”, USA). Анализ продуктов реакции проводили на секвенаторе Applied Biosystems 3130l Genetic Analyzer с использованием праймера ITS1f.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химические свойства почвы. Под всеми выращиваемыми культурами и в оба срока отбора проб значения С орг, N общ, С : N, pH в почве с минеральными удобрениями были меньше, чем с органическими, а во внеризосферном локусе – чем в ризосферном (табл. 1). Содержание С орг в почве внеризосферного и ризосферного локусов при внесении NPK составляло соответственно 1.2–1.3 и 1.3–1.4%, а на фоне органических удобрений – 1.5–1.7 и 1.8–2%. Содержание общего азота колебалось от 0.11 до 0.19%, соотношение C : N – от 9.0 до 11.5. Серая лесная почва характеризовалась слабокислым pH, равным 6.1. При внесении органических удобрений реакция среды практически не менялась, в некоторых вариантах становясь чуть менее кислой. Длительное внесение физиологически кислых минеральных удобрений, наоборот, существенно подкисляло почву. Во всех случаях в ризосфере растений pH среды было выше, чем во внекорневой зоне почвы. Повышение pH в ризосфере объясняется экскрецией анионов OH− и ${\text{HCO}}_{3}^{ - }$ корнями при поглощении нитратов [37].
Численность и таксономический состав бактерий. В почве исследуемых вариантов было выявлено 6 видов бактерий (рис. 1), относящихся к родам Bacillus и Paenibacillus (филум Firmicutes, класс Bacilli). Эти грамположительные бактерии являются типичными представители микробиома почв умеренной полосы и часто обнаруживаются в серых лесных почвах [12]. Также был обнаружен неидентифицированный штамм бактерий, обозначенный как “G”, культивирование и идентификация которого были затруднены чрезвычайно медленным его ростом.
Рис. 1.
Таксономическая структура и численность почвенного бактериального сообщества, детектируемые на среде Чапека (верхний рисунок) и КДА (нижний рисунок).
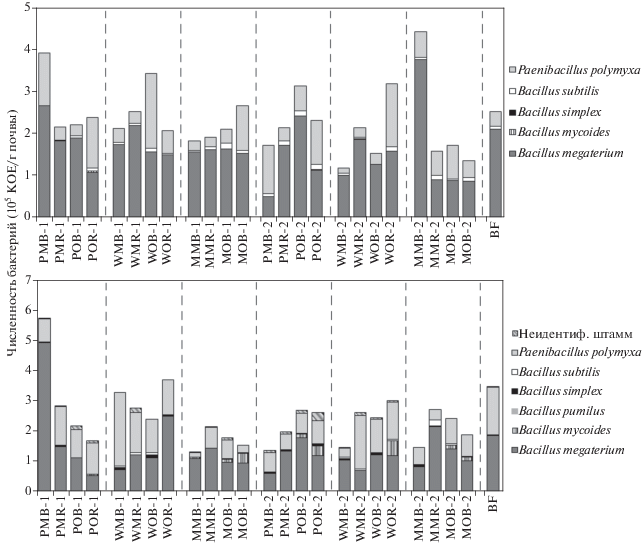
Количество выделенных видов бактерий в почвенных образцах варьировало от 4 до 7. Наибольшее видовое разнообразие (7 видов) было в варианте картофель–навоз–ризосфера на второй срок отбора (POR-2), 6 видов – в вариантах POR-1, WOB-1, MMB-1, MMR-2. Наименьшее число идентифицированных видов бактерий обнаружено в образцах PMB-1, PОB-1 и чистого пара (BF). Число культивируемых видов в ризосфере было больше, чем во внеризосферной части почвы, или, как минимум, одинаковым. Подобная закономерность отмечена в других работах [2]. Для всех вариантов с минеральными (PMB, PMR, WMB, WMR, MMB, MMR) и органическими удобрениями (POB, POR, WOB, WOR, MOR), за исключением варианта кукуруза–навоз–почва (MOB), число видов возрастало ко второму сроку отбора по сравнению с первым. Это может быть связано с увеличением корневых выделений и более разнообразным их составом по мере нарастания биомассы растений [45].
Доминантами по численности и частоте встречаемости во всех вариантах опыта и на обеих питательных средах были виды Bacillus megaterium и Paenibacillus polymyxa. Известно, что данные виды бактерий часто обнаруживаются в ризосфере растений, способны колонизировать поверхность корней, и, по-видимому, являются эндофитами [23]. К редко встречающемуся виду можно отнести B. pumilus, присутствие которого было выявлено лишь в вариантах WOB-1 и POR-2. Под горчицей ни в одном из вариантов ризосферы или внекорневой почвы не был выявлен B. mycoides, а под кукурузой – B. pumilus.
Часть видов бактерий культивировались исключительно (B. pumilus и G) или преимущественно (B. mycoides и B. simplex) на среде КДА, что косвенно указывает на связь этих штаммов с корневыми выделениями растений. Тем не менее, у выделенных видов не было выявлено строгих локусных предпочтений. Как правило, в вариантах с органическими удобрениями и в ризосфере обнаруживалось большее количество видов, чем при использовании минеральных удобрений и во внерезиосферной зоне почвы. В почве чистого пара присутствовали те же виды, которые доминировали во всех других вариантах опыта: B. megaterium, B. subtilis и Paenibacillus polymyxa.
Общее количество колониеобразующих единиц бактерий в исследованных образцах составляло порядка 105 КОЕ/г почвы для всех вариантов, что соответствует данным, обычно получаемым методом культивирования для серых лесных почв [8]. Тем не менее, подбор специальных сред и условий культивирования может повышать количество детектируемых КОЕ в серых лесных почвах до 107 КОЕ/г почвы [25, 42]. Наибольшая численность бактерий на среде Чапека отмечена в варианте кукуруза– NPK–почва (MMB-2) и картофель–NPK–почва (PMB-1) (4.5 × 105 и 4.0 × 105 КОЕ/г почвы соответственно). В этих образцах максимум численности был выявлен также на среде КДА. Минимальная численность бактерий на среде Чапека была характерна для вариантов с минеральными удобрениями во второй срок отбора: горчица–NPK–почва (WMB-2), кукуруза–NPK–почва (MMB-2), картофель–NPK–почва (PMB-2), где детектировалось 1.2–1.6 × 105 КОЕ/г почвы. На среде КДА, максимальная численность бактерий (5.8 × 105 КОЕ/г почвы) выявлена в варианте картофель–NPK–почва (PMB-1), а минимальная (1.3 × 105 и 1.4 × 105 КОЕ/г почвы, соответственно) – в вариантах горчица–NPK–почва (MMB-1) и картофель–NPK–почва (PMB-2).
Таким образом, хотя на используемых средах выявлялось низкое видовое разнообразие бактериального сообщества, полученные результаты свидетельствуют о зависимости роста и развития бактерий родов Bacillus и Paenibacillus от вида растения и фазы его развития, а также от системы удобрения и почвенного локуса.
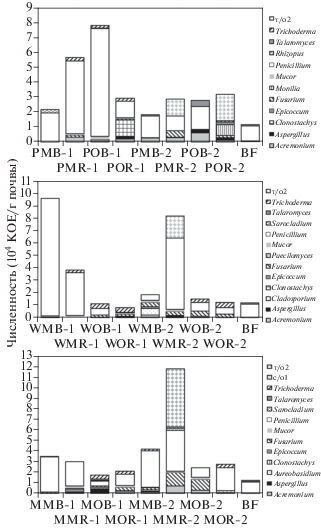
Численность и таксономический состав микромицетов. Всего в образцах почвы было выделено 39 видов микроскопических грибов (табл. 2), которые относятся к 19-ти родам трех подотделов (Zygomycotina, Ascomycotina, Deuteromycotina). Подотдел Zygomycotina представлен видами родов Mucor и Rhizopus; подотдел Ascomycotina – видами родов Acremonium, Aspergillus, Aureobasidium, Cladosporium, Clonostachys, Epicoccum, Fusarium, Monilia, Mucor, Paecilomyces, Penicillium, Phialophora, Phoma, Sarocladium, Stachybotrys, Talaromyces, Trichoderma, Verticillium. Основную часть выделенных изолятов составляли анаморфные грибы, представители подотдела Deuteromycotina. Среди них наибольшим разнообразием характеризовались роды Penicillium (9 видов), Fusarium (4 вида), Acremonium и Aspergillus (по 3 вида). Телеоморфой был представлен лишь единственный род Talaromyces. Также обнаружено 5 изолятов (с/о1, с/о2, т/о1, т/о2, т/о3), представленных стерильным пигментированным или гиалиновым, часто дрожжеподобным, мицелием. Их таксономическая принадлежность не была определена по результатам анализа ITS рДНК из-за формирования малой биомассы или перехода в некультивируемое состояние при пересевах.
Таблица 2.
Видовой состав почвенного микобиома на среде Чапека (Ч) и КДА (К)
| Вид | Вариант | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PMB-1 | PMR-1 | POB-1 | POR-1 | WMB-1 | WMR-1 | WOB-1 | WOR-1 | MMB-1 | MMR-1 | MOB-1 | MOR-1 | PMB-2 | PMR-2 | POB-2 | POR-2 | WMB-2 | WMR-2 | WOB-2 | WOR-2 | MMB-2 | MMR-2 | MOB-2 | MOR-2 | BF | |
| Acremonium fusidioidesb | К | К | ЧК | К | ЧК | ЧК | К | ||||||||||||||||||
| Acr. murorumb | К | ЧК | К | К | К | ЧК | Ч | ЧК | |||||||||||||||||
| Acr. strictuma | ЧК | К | Ч | ЧК | ЧК | К | К | ЧК | ЧК | ||||||||||||||||
| Aspergillus flavusa,e | Ч | Ч | Ч | ||||||||||||||||||||||
| As. fumigatusa,e | Ч | К | К | К | К | К | ЧК | К | ЧК | К | К | К | |||||||||||||
| As. versicolora,e | К | Ч | Ч | ||||||||||||||||||||||
| As. ustusa,e | Ч | Ч | Ч | Ч | Ч | Ч | Ч | ЧК | К | ЧК | Ч | ЧК | Ч | Ч | Ч | Ч | Ч | Ч | Ч | ||||||
| Aureobasidium pullulansa,e | Ч | Ч | К | Ч | Ч | ||||||||||||||||||||
| Cladosporium сladosporioidesa,c,e | Ч | ЧК | |||||||||||||||||||||||
| Clad. herbaruma,c,e | Ч | К | К | ||||||||||||||||||||||
| Clonostachys roseaa | Ч | ЧК | К | Ч | Ч | ЧК | Ч | ЧК | Ч | ЧК | Ч | ЧК | Ч | ||||||||||||
| Epicoccum nigruma,c | Ч | Ч | К | К | ЧК | Ч | Ч | ||||||||||||||||||
| Fusarium dimeruma,c | Ч | ||||||||||||||||||||||||
| F. oxysporuma,c | ЧК | К | К | К | К | Ч | Ч | К | ЧК | Ч | |||||||||||||||
| F. poaea,c | ЧК | Ч | ЧК | К | ЧК | ЧК | Ч | ЧК | Ч | ЧК | ЧК | ЧК | ЧК | К | ЧК | ЧК | ЧК | Ч | Ч | ||||||
| F. solania,c | К | К | Ч | ЧК | |||||||||||||||||||||
| Monilia geophilaa | К | ЧК | К | К | |||||||||||||||||||||
| Mucor hiemalisa,c,e | Ч | К | К | К | ЧК | ЧК | К | ЧК | К | К | К | К | К | К | К | К | Ч | ||||||||
| Paecilomyces lilacinusa,e | К | ||||||||||||||||||||||||
| Paec. variotiia,e | К | ||||||||||||||||||||||||
| Penicillium canescensa,c | Ч | ||||||||||||||||||||||||
| P. communea | ЧК | К | К | К | Ч | Ч | ЧК | Ч | |||||||||||||||||
| P. corylophiluma | К | К | К | Ч | ЧК | ЧК | К | К | ЧК | К | Ч | К | ЧК | Ч | ЧК | ||||||||||
| P. funiculosuma,c | К | Ч | К | ЧК | ЧК | К | ЧК | К | К | ЧК | ЧК | ЧК | Ч | Ч | ЧК | ЧК | ЧК | Ч | ЧК | Ч | ЧК | ||||
| P. griseofulvuma | ЧК | Ч | ЧК | ЧК | Ч | ||||||||||||||||||||
| P. implicatuma | К | ЧК | Ч | ||||||||||||||||||||||
| P. janthinelluma | Ч | ЧК | К | К | ЧК | К | ЧК | Ч | ЧК | Ч | К | К | ЧК | К | К | Ч | |||||||||
| P. purpurogenuma,c | К | К | Ч | ||||||||||||||||||||||
| P. spinulosuma | К | ||||||||||||||||||||||||
| P. verrucosuma | Ч | ЧК | К | К | ЧК | ЧК | К | ЧК | ЧК | ЧК | Ч | Ч | Ч | Ч | Ч | ЧК | ЧК | ЧК | ЧК | ЧК | |||||
| P. waksmaniia | К | К | К | К | |||||||||||||||||||||
| Phialophora fastigiata*,a,d | ЧК | ||||||||||||||||||||||||
| Phoma exigua*,a,b,c | ЧК | ||||||||||||||||||||||||
| Rhizopus stolonifera,d | К | Ч | |||||||||||||||||||||||
| Sarocladium kiliense*,b,e | Ч | Ч | Ч | К | К | ЧК | ЧК | Ч | Ч | ЧК | Ч | К | Ч | Ч | ЧК | Ч | ЧК | ||||||||
| Stachybotrys chartarumа,d | Ч | ||||||||||||||||||||||||
| Talaromyces flavusа | Ч | ЧК | Ч | Ч | Ч | ЧК | ЧК | К | ЧК | ЧК | Ч | Ч | Ч | Ч | ЧК | ||||||||||
| Trichoderma harzianuma,b,d | ЧК | ЧК | ЧК | К | ЧК | ЧК | Ч | ЧК | ЧК | Ч | Ч | Ч | ЧК | ЧК | ЧК | ЧК | Ч | ЧК | Ч | ||||||
| Verticillium albo-atrumc,d | Ч | К | Ч | ||||||||||||||||||||||
| Verticillium tenerumc,d | ЧК | ||||||||||||||||||||||||
| с/о1 | ЧК | ЧК | |||||||||||||||||||||||
| с/о2 | Ч | ||||||||||||||||||||||||
| т/о1 | ЧК | ЧК | Ч | ||||||||||||||||||||||
| т/о2 | К | К | К | К | |||||||||||||||||||||
| т/о3 | К | ||||||||||||||||||||||||
Примечание. Таксономическое положение определено с помощью секвенирования участка ITS рДНК; а – cапротрофы; b – эндофиты, эккрисотрофы или обитатели ризосферы; c – потенциальные патогены растений; d – целлюлозолитики; e – условные патогены животных и человека; с/о – светлый/гиалиновый стерильный мицелий, т/о – темный/пигментированный/меланизированный стерильный мицелий.
Количество выделенных видов микроскопических грибов в исследуемых образцах почвы варьировало от 6 до 25. Такая широкая вариабельность связана с разнонаправленным влиянием эколого-трофических факторов в вариантах опыта. Наибольшее видовое разнообразие было отмечено в варианте кукуруза–NPK–ризосфера второго срока отбора (MMR-2), минимальное – в варианте горчица–NPK–почва в первый срок отбора (WMB-1). Количество видов грибов в ризосфере было всегда выше по сравнению с почвой внекорневой зоны, за исключением вариантов с картофелем и горчицей при использовании органических удобрений во второй срок отбора (POB-2, POR-2 и WOB-2, WOR-2).
Число видов микромицетов при использовании минеральных или органических удобрений практически не отличалось. Для всех вариантов с минеральными удобрениями (PMB, PMR, WMB, WMR, MMB, MMR) число видов микроскопичеcких грибов возрастало во второй срок отбора по сравнению с первым. Такая закономерность, по-видимому, связана с фазой развития растений и их аллелопатическим влиянием на микромицетов. Если сложить общее число видов во всех вариантах опыта, то больше всего видов грибов обнаруживалось в почве с кукурузой (58 видов в первый срок и 62 во второй срок отбора), а меньше всего – в почве с горчицей (35 видов в первый срок и 48 видов во второй срок отбора).
Наиболее часто встречаемыми видами микроскопических грибов (минимум в 17 вариантах опыта из 25) были Aspergillus ustus, Fusarium poae, Mucor hiemalis, Penicillium funiculosum, Sarocladium kiliense, Trichoderma harzianum. Среди наиболее редких видов (не более чем в трех вариантах опыта) – Aspergillus flavus, Cladosporium сladosporioides, C. herbarum, Phialophora fastigiata, Verticillium albo-at-rum, V. tenerum, а также неидентифицированные изоляты с/о1, с/о2, т/о3. Большинство из перечисленных видов – потенциальные фитопатогены [19].
Восемь из 39 выделенных видов грибов (Aureobasidium pullulans, Fusarium dimerum, F. solani, Monilia geophila, Verticillium tenerum, с/о1, т/о2, т/о2) были обнаружены исключительно в ризосфере растений. По литературным данным, представители этих видов, зачастую, являются эккрисотрофами или фитопатогенами [19]. Лишь три вида встречались исключительно во внекорневых локусах почвы – Penicillium canescens, P. spinulosum и с/о2. Кроме того, виды Fusarium oxysporum и Rhizopus stolonifer были обнаружены в ризосфере на обеих средах, а вне ризосферы – только на среде КДА, богатой питательными веществами растительного происхождения, что демонстрирует специфику трофических условий в ризосферных локусах по сравнению с внекорневыми. Fusarium oxysporum является фитопатогеном, а Rhizopus stolonifer – целлюлозолитиком, поэтому их присутствие в ризосфере растений закономерно.
Таксономический состав сообществ микромицетов в почве под картофелем, горчицей и кукурузой также был различен. В вариантах с картофелем род Aspergillus был представлен лишь двумя из четырех видов (все они встречались в вариантах с кукурузой и горчицей), а вместо характерного для кукурузы и горчицы Fusarium solani в микобиоме почвы под картофелем доминировал Fusarium dimerum. Только в почве под картофелем присутствовали виды Stachybotrys chartarum и Penicillium spinulosum, но не были детектированы Penicillium purpurogenum, с/о1 и т/о3. Многие штаммы рода Stachybotrys являются целлюлозолитиками и могут проявлять антагонистическую активность по отношению к фитопатогенным грибам [19]. В вариантах с горчицей, в отличии от вариантов с картофелем и кукурузой, отсутствовали сразу несколько групп микромицетов: роды Aureobasidium, Monilia, Verticillium, вид Penicillium implicatum и стерильные морфотипы мицелия с/о2, т/о1, т/о3. Столь широкий спектр отсутствующих видов, по-видимому, был вызван воздействием корневых выделений горчицы, оказывающих биоцидный эффект по отношению к ряду микромицетов [15]. В нашем исследовании специфичными для кукурузы микромицетами являлись роды Paecilomyces, Phialophora и Phoma, а также оба выявленных вида родов Cladosporium и Verticillium. В то же время только в вариантах под кукурузой отсутствовали виды Rhizopus stolonifer, Penicillium canescens, Penicillium waksmanii и стерильный мицелий изолята т/о2.
Различия в видовом составе культивируемых микромицетов оказались характерными также для разных стадий вегетации растений. В почве под картофелем во второй срок отбора образцов (начало клубнеобразования) исчезают виды Acremonium strictum, Aureobasidium pullulans, Cladosporium herbarum, Epicoccum nigrum, Fusarium dimerum, Penicillium spinulosum, Rhizopus stolonifer, Stachybotrys chartarum, с/о2. В то же время появляются виды Monilia geophila, Verticillium albo-atrum, а также Penicillium canescens, P. commune, P. waksmanii и т/о2. Исчезновение многих родов в ризосферной и внекорневой почве в вариантах с картофелем может быть связано с изменением состава корневых экссудатов картофеля, а также влиянием быстрорастущих Monilia и Verticillium. В почве под горчицей во второй срок отбора не были выявлены виды Aspergillus ustus, Fusarium solani, Penicillium griseofulvum, P. purpurogenum, Rhizopus stolonifer и с/о1, но появляются Acremonium fusidioides, Ac. murorum, Ac. strictum, Aspergillus versicolor, Cladosporium сladosporioides, Epicoccum nigrum, Penicillium canescens, P. commune, P. corylophilum, т/о2. В почве с кукурузой во второй срок отбора исчезают виды Aspergillus flavus, Cladosporium сladosporioides, Paecilomyces lilacinus, Penicillium implicatum, Verticillium tenerum, но появляются Acremonium fusidioides, Paecilomyces variotii, Penicillium griseofulvum, Penicillium purpurogenum, Phialophora fastigiata, Phoma exigua, Verticillium albo-atrum, с/о1, т/о1 и т/о2. В контрольной почве под чистым паром детектировались лишь те виды, которые чаще всего встречались в других вариантах опыта.
В ризосферной и внекорневой частях почвы при внесении органических удобрений детектировался ряд специфических родов микромицетов, не обнаруженных в вариантах с внесением минеральными удобрениями. В вариантах под картофелем таковыми были Acremonium, Aureobasidium, Cladosporium и Epicoccum в первый срок отбора, и Monilia, Verticillium – во второй. Под горчицей только в вариантах с внесением органических удобрений в первый срок отбора выделялись Clonostachys, Epicoccum и Rhizopus, во второй срок отбора – Trichoderma. В вариантах под кукурузой лишь при внесении органических удобрений в первый срок были выделены Acremonium, Cladosporium, Monilia и Paecilomyces, а во второй срок – Paecilomyces и Phialophora. Таким образом, в июле количество видов грибов, уникальных для вариантов с внесением органических удобрений, становилось значительно меньше.
Общее количество микромицетов в исследованных образцах составляло порядка 104 КОЕ/г почвы для всех вариантов (рис. 2, 3), что соответствует литературным данным для серых лесных почв [8]. Наибольшая численность микромицетов (9.2 × 104 КОЕ/г почвы) на среде Чапека выявлена в варианте горчица–NPK–почва (WMB-1). Также высокой численностью микромицетов (7.6 × 104 КОЕ/г почвы) на среде Чапека характеризовался вариант кукуруза–NPK–почва (МMR-2), где было выявлено наибольшее количество КОЕ на среде КДА, а также “кукуруза–навоз–ризосфера” (MOR-2). Минимальная численность микроскопических грибов (1.1–1.6 × 104 КОЕ/г почвы) детектировалась в вариантах горчица–навоз–почва (WОB-1, WОB-2) и горчица–навоз–ризосфера (WОR-2) на обеих питательных средах, а также в контроле под чистым паром на среде КДА. Количество КОЕ микроскопических грибов в вариантах с применением минеральных удобрений было всегда выше или равно таковой в вариантах, где применялись органические удобрения. Численность микромицетов в ризосфере всех растений была больше, чем в неризосферной части почвы, за исключением вариантов PMB-2, PMR-2 и WMB-2, WMR-2.
Рис. 2.
Таксономическая структура и численность почвенного микобиома на уровне рода, детектируемые на среде КДА.
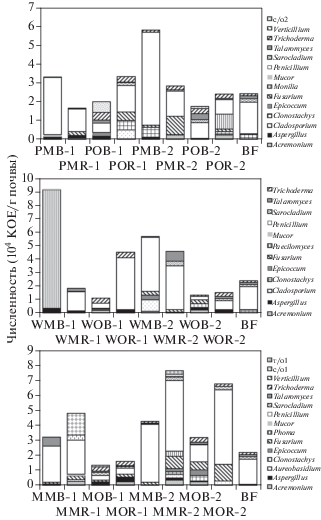
Рис. 3.
Таксономическая структура и численность почвенного микобиома на уровне рода в разных вариантах опыта, детектируемые на среде Чапека.
Полученные данные по разнообразию и численности КОЕ микроскопических грибов подтверждают наличие скрытого отрицательного эффекта минеральных удобрений в кислых почвах [11]. Данное явление заключается в резком увеличении количества различных микотоксинов (риботоксин, ходицидин, усниновая кислота, патулин и др.) в почве из-за резкого увеличения численности видов Penicillium funiculosum, P. verrucosum var. cyclopium, P. purpurogenum, P. jantinellum, Talaromyces flavus и Aspergillus ustus, замещающих типичные для этих почв виды микромицетов. Данная перестройка микробного сообщества приводит к уменьшению урожайности сельскохозяйственных культур без заметных изменений агрохимических свойств почвы [11]. Преобладание указанных видов было выявлено в вариантах с внесением минеральных удобрений.
Расширение представителей видов микромицетов в вариантах с органическими удобрениями по сравнению с минеральными удобрениями может быть вызвано тремя причинами. Во-первых, внесение навоза является эффективным способом повышения уровня биогенности почвы и важным источником активного органического вещества [7], что приводит к росту и развитию копиотрофных микроорганизмов [16]. Во-вторых, использование минеральных удобрений приводит к перестройке сообщества микомицетов с замещением видов, распространенных в естественных почвах. В-третьих, с органическими удобрениями в почву привносятся аллохтонные виды микроорганизмов. Необходимо отметить, что вопрос таксономической структуры микобиома органических удобрений и его выживаемости при попадании в почву до сих пор остается открытым.
Индикаторные таксоны в составе почвенного микробиома. С целью выявления индикаторных таксонов была проведена кластеризация разных вариантов эксперимента с использованием неметрического многомерного шкалирования (NMDS) и метрики Брэя-Кертиса (рис. 4). Индикаторным считался такой таксон, численность которого на обеих питательных средах четко дифференцировала весь пул рассматриваемых вариантов опыта по определенному признаку (растение, почвенный локус, система удобрения, срок отбора). В результате анализа каждой из таких групп, нами были выявлены два индикаторных таксона – Trichoderma harzianum и род Fusarium. Вид Trichoderma harzianum четко разделил варианты с внесением органических (высокая численность вида) и минеральных (низкая численность или отсутствие вида) удобрений. Этот вид является антагонистом многих фитопатогенов [28]. Известно, что внесение органических удобрений позволяет поддерживать рост и высокую активность Trichoderma harzianum в почве [26]. В нашем исследовании почва под чистым паром попала в один кластер с почвой под минеральными удобрениями, поэтому можно сделать вывод, что внесение органических удобрений увеличивает численность Trichoderma harzianum, а значит, может положительно сказываться на супрессивной активности почв по отношению к грибным патогенам растений.
Рис. 4.
Кластеризация разных вариантов эксперимента на основе численности (А) Trichoderma harzianum и (Б) Fusarium sp. на средах КДА и Чапека с использованием неметрического многомерного шкалирования (NMDS) и метрики Брэя-Кертиса.
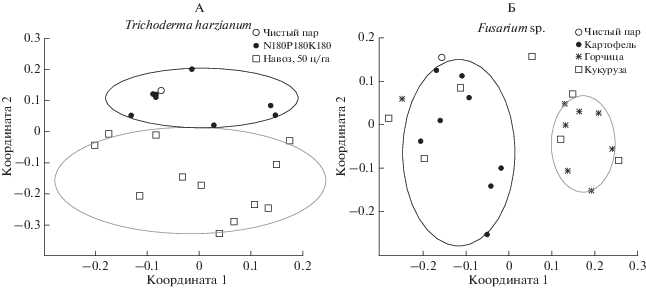
Анализ численности рода Fusarium позволил разделить почвы под картофелем (численность рода выше) и горчицей (численность рода ниже) на отдельные непересекающиеся кластеры, тогда как варианты с кукурузой занимали промежуточное положение, пересекаясь с обоими кластерами. Представители рода Fusarium являются одними из наиболее широко распространенных фитопатогенных грибов [19, 32]. Поскольку почва под чистым паром попала в один кластер с почвой под картофелем, можно заключить, что присутствие горчицы снижает численность представителей рода Fusarium и потенциально может повышать супрессивность почв.
Характеристика α-разнообразия микромицетов. Для почвенных микобиомов изучаемых вариантов опыта был рассчитан индекс Шеннона (рис. 5), оценивающий α-разнообразие сообществ [14]. Индекс Шеннона варьировал от 0.29 и 0.55 для вариантов “горчица–NPK–почва” (WMB-1) и “картофель–NPK–почва” (PMB-1) до 2.94 и 2.75 для вариантов “кукуруза–навоз–почва” (MOB-1) и “кукуруза–навоз–ризосфера” (MOR-1), соответственно. Индекс Шеннона для микобиома чистого пара составлял 1.56. Минимальные значения индекса Шеннона отмечались во всех вариантах внеризосферной почвы с внесением минеральных удобрений в оба срока отбора, за исключением варианта “горчица–NPK–почва” (WMB-2). Снижение α-разнообразия также обнаруживалось в ризосфере горчицы при внесении навоза (WOR-2). Как видно из рис. 5, при внесении минеральных удобрений в пяти из шести вариантов внекорневой почвы происходило резкое (в 2–3 раза) снижение грибного α-разнообразия. Среди всех вариантов с минеральными удобрениями лишь в ризосфере кукурузы (MMR-1 и MMR-2) α-разнообразие было выше, чем в контрольной почве. Напротив, при внесении органических удобрений в 10 из 12 вариантов в 1.5–2 раза возрастали показатели α-разнообразия как во внеризосферном, так и ризосферном локусах почвы. Положительный эффект органического земледелия на повышение разнообразия и устойчивости бактериального сообщества отмечался в других исследованиях [21].
Рис. 5.
α-разнообразие почвенных микобиомов на основе индекса Шеннона. Серыми стрелками указано увеличение α-разнообразия по сравнению с контрольным образцом чистого пара (BF), белыми – уменьшение.

В отличии от количества КОЕ отдельных таксонов или общей численности микромицетов, оценка индекса разнообразия Шеннона выявила четкие тренды в отклике микобиома, который был связан, главным образом, с системой удобрения. Использование органических удобрений приводило к значительному повышению разнообразия микромицетов как во внекорневой почве, так и в ризосфере, тогда как минеральные удобрения отрицательно сказывались на разнообразии грибов. Тип почвенного локуса и тип растения также играли корректирующую роль в формировании таксономической структуры грибного сообщества: драматичное снижение грибного α-разнообразия вследствие внесения минеральных удобрения выявлялось лишь во внекорневой почве, тогда как в ризосфере данный эффект нивелировался, а в варианте с кукурузой разнообразие грибов даже увеличивалось. Таким образом, на основе полученных индексов Шеннона можно предположить, что именно система удобрения является ведущим фактором, определяющим таксономический состав и разнообразие микромицетов в почве и ризосфере.
Характеристика β-разнообразия микромицетов. Проверка β-разнообразия микобиомов разных вариантов опыта была проведена на основе кластерного анализа сходства с использованием попарного сравнения и евклидовой метрики (рис. 6А), а также неметрического многомерного шкалирования (NMDS) и метрики Брэя-Кертиса (рис. 6Б). Вариант “горчица–NPK–почва” (WMB-1) в первом сроке отбора принципиально отличался от всех других образцов по составу микобиома (рис. 6А). Это связано с очень высокой численностью и полным доминированием рода Paecilomyces, который детектировался на среде Чапека только в этом варианте. Для остальных вариантов эксперимента, микобиомы минеральной и органической систем удобрения формировали 2 непересекающихся кластера (рис. 6A, Б). Верхний кластер на рис. 6А оказался полностью сформирован из образцов с органическим удобрением, а нижний – с внесением минеральных удобрений, за исключением двух случаев с ризосферными микобиомами вариантов MOR-2 и WOR-1 (рис. 6A, Б). Промежуточное положение, с большей близостью к вариантам с органическим удобрением, оказались микобиомы почвы под черным паром, а также ризосферы картофеля, горчицы и кукурузы с минеральным удобрением (PMR-1, WMR-1 и MMR-1). Эти результаты полностью согласуются с данными, полученными методом DGGE на разных почвах Японии, которые продемонстрировали более важную роль фактора удобрений в формировании почвенного микобиома, нежели типа почвы [40].
Рис. 6.
β-разнообразие почвенных микобиомов: А – кластерный анализ сходства микобиомов с использованием попарного сравнения и евклидовой метрики; Б – оценка сходства микобиомов с использованием неметрического многомерного шкалирования (NMDS) и метрики Брэя-Кертиса. Для удобства изображения материала существенно отличающийся от остальных микобиомов вариант WMB-1 на рис. Б не отображен.

Таким образом, данные по α- и β-разнообразию дают основание относить систему удобрения к числу главных факторов, определяющих структуру и разнообразие сообществ микромицетов в почве и ризосфере. Это означает, что внесение органических соединений может способствовать элиминированию негативных процессов, сопровождающихся развитием фитотоксичности, и служить эффективным приемом целенаправленного корректирования состава грибного сообщества в почве и ризосфере для контроля активности фитопатогенов и повышения общей почвенной супрессивности. Кроме того, показатели численности и разнообразия микобиома или отдельных таксонов микромицетов могут быть более эффективными микробиологическими индикаторами фитосанитарного состояния почв по сравнению с бактериальными сообществами.
ЗАКЛЮЧЕНИЕ
Анализ микробиомов ризосферного и внекорневого локусов почвы под кукурузой, картофелем и горчицей, выращиваемых при органической и минеральной системах удобрения, позволил выявить индикаторные таксоны микромицетов Trichoderma harzianum и Fusarium sp. Внесение органических удобрений повышает численность Trichoderma harzianum, выступающего антагонистом многих грибных фитопатогенов, что может негативно сказываться на супрессивной активности почв. Выращивание горчицы снижает численность представителей рода Fusarium как в ризосфере, так и во внекорневой части почвы в целом.
Система удобрения является ведущим фактором, определяющим состав и разнообразие микромицетов в почве, и более значимым, чем местоположение почвенного локуса, а также вид и фаза развития растения. Внесение минеральных удобрений негативно сказывается на разнообразии микромицетов в почве, тогда как органические удобрения увеличивают грибное разнообразие, как в почве, так и в ризосфере. Внесение органических соединений в почву может служить эффективным приемом управления почвенным и ризосферным микобиомами и общей почвенной супрессивностью. Сообщество микромицетов может быть более точным индикатором фитосанитарного состояния почвы, чем бактериальное сообщество.
Благодарность. Работа выполнена при поддержке Российского Научного Фонда, проект № 17-76-00002.
Список литературы
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество научных изданий КМК, 2016. 243 с.
Воронина Е.Ю. Численность почвообитающих бактерий и микромицетов в ризосфере, микоризосфере и гифосфере симбиотрофных базидиомицетов // Микология и фитопатология. 2009. Т. 43. № 5. С. 398–406.
Глушакова А.М., Качалкин А.В., Чернов И.Ю. Особенности динамики эпифитных и почвенных дрожжевых сообществ в зарослях недотроги железконосной на перегнойно-глеевой почве // Почвоведение. 2011. № 8. С. 966–972.
Гузев В.С., Кураков А.В., Бондаренко Н.Г., Мирчинк Т.Г. Действие извести и минеральных удобрений на микробную систему дерново-подзолистой почвы // Микробиология. 1984. Т. 53. № 4. С. 669–675.
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А., Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1087. doi 10.7868/S0032180X15090038
Евдокимов И.В. Динамика ризосферного эффекта в почве // Почвоведение. 2013. № 6. С. 715–724. doi 10.7868/S0032180X13060026
Зинякова Н.Б., Семенов В.М. Влияние возрастающих доз органических и минеральных удобрений на пулы растворенного, подвижного и активного органического вещества в серой лесной почве // Агрохимия. 2014. № 6. С. 8–19.
Козлова А.А., Макарова А.П. Почвенно-микробиологическая характеристика целинных и залежных серых лесных почв Приангарья, сформированных в условиях бугристо-западинного рельефа // Живые и биокосные системы. 2014. № 7. URL: http://www.jbks.ru/archive/issue-7/article-8.
Мергель А.А., Семенов В.М., Соколов О.А. Влияние концентрированного очага азотных удобрений на азотный режим и ферментативную активность серой лесной почвы // Почвоведение. 1987. № 12. С. 55–63.
Методы почвенной микробиологии и биохимии / Под ред. Д.Г. Звягинцева. М.: Изд-во Моск. ун-та, 1991. 304 с.
Мирчинк Т.Г. Почвенная микология. М.: Изд-во Московского университета, 1988. 220 с.
Панов А.В., Есикова Т.З., Соколов С.Л., Кошелева И.А., Боронин А.М. Влияние загрязнения почвы на состав микробного сообщества // Микробиология. 2013. Т. 82. № 2. С. 239–246. doi 10.7868/ S0026365613010114
Семенов М.В., Стольникова Е.В., Ананьева Н.Д., Иващенко К.В. Структура микробного сообщества почвы катены правобережья р. Оки // Известия РАН. Серия биологическая. 2013. № 3. С. 299–308. doi 10.7868/S0002332913030089
Чернов Т.И., Тхакахова А.К., Кутовая О.В. Оценка различных индексов разнообразия для характеристики почвенного прокариотного сообщества по данным метагеномного анализа // Почвоведение. 2015. № 4. С. 462–468. doi 10.7868/S0032180X15040036
Angus J.F., Gardner P.A., Kirkegaard J.A., Desmarchelier J.M. Biofumigation: Isothiocyanates released from Brassica roots inhibit growth of the take-all fungus // Plant and Soil. 1994. V. 162. P. 107–112. https:// doi.org/10.1007/BF01416095.
Chaudhry V., Rehman A., Mishra A., Chauha, P.S., Nautiyal C.S. Changes in bacterial community structure of agricultural land due to long-term organic and chemical amendments // Microbiol. Ecol. 2012. V. 64. P. 450–460. https://doi.org/10.1007/s00248-012-0025-y.
Dartnell L.R., Hunter S.J., Lovell K.V., Coates A.J., Ward J.M. Low-temperature ionizing radiation resistance of Deinococcus radiodurans and Antarctic Dry Valley bacteria // Astrobiology. 2010. V. 10. P. 717–732. https://doi.org/10.1089/ast.2009.0439.
Diacono M., Montemurro F. Long-term effects of organic amendments on soil fertility. A review // Agronomy for Sustain. Development. 2010. V. 30. P. 401–422. https://doi.org/10.1007/978-94-007-0394-0_34.
Domsch K.H., Gams W., Anderson T.-H. Compendium of soil fungi, 2nd taxonomically revised edition by W. Gams. Eching: IHW-Verlag, 2007. 627 p.
Ellis M.B. Dematiaceous hyphomycetes. Kew, London: Commonwealth Mycological Institute, 1971. 608 p.
Ge Y., Zhang J.B., Zhang L.M., Yang M., He J.Z. Long-term fertilization regimes affect bacterial community structure and diversity of an agricultural soil in northern China // J. Soils Sediments. 2008. V. 8. P. 43–50. https:// org/10.1065/jss2008.01.27010.1065/ jss2008.01.270.
Gonthier D.J., Ennis K.K., Farinas S., Hsieh H.Y., Iverson A.L., Batary P., Rudolphi J., Tscharntke T., Cardinale B.J., Perfecto I. Biodiversity conservation in agriculture requires a multi-scale approach // Proc. Royal Soc. 2014. V. B281. P. 20141358. http://dx.org/ 10.1098/rspb.2014.1358.
Govindasamy V., Senthilkumar M., Magheshwaran V., Kumar U., Bose P., Sharma V., Annapurna K. Bacillus and Paenibacillus spp.: potential PGPR for sustainable agriculture // Plant growth and health promoting. Springer Berlin Heidelberg, 2010. P. 333–364. https:// org/10.1007/978-3-642-13612-2_1510.1007/978-3-642-13612-2_15.
Gryndler M., Hršelová H., Vosatka M., Votruba J., Klir J. Organic fertilization changes the response of mycelium of arbuscular mycorrhizal fungi and their sporulation to mineral NPK supply // Folia microbiologica. 2001. V. 46. P. 540–542. https://doi.org/10.1007/ BF02817999.
He M., Ma W., Zelenev V.V., Khodzaeva A.K., Kuznet-sov A.M., Semenov A.M., Semenov V.M., Blok W., van Bruggen A.H. Short-term dynamics of greenhouse gas emissions and cultivable bacterial populations in response to induced and natural disturbances in organically and conventionally managed soils // Appl. Soil Ecol. 2017. V. 119. P.294–306. https://org/10.1016/j.apsoil. 2017.07.01110.1016/j.apsoil.2017.07.011.
Hoitink H.A.J., Boehm M.J. Biocontrol within the context of soil microbial communities: a substrate-dependent phenomenon // Annual Rev. of Phytopathol. 1999. V. 37. P. 427–446. https://doi.org/10.1146/annurev.phyto.37.1.427.
Kleijn D., Berendse F., Smit R., Gilissen N. Agri-environment schemes do not effectively protect biodiversity in Dutch agricultural landscapes // Nature. 2001. V. 413. P. 723–725. doi 10.1038/35099540.
Kok C.J., Hageman P.E.J., Maas P.T., Postma J., Roozen N.J.M., Van Vuurde J.W.L. Processed manure as carrier to introduce Trichoderma harzianum: population dynamics and biocontrol effect on Rhizoctonia solani // Biocontrol Sci. and Technol. 1996. V. 6. P. 147–162. https://doi.org/10.1080/09583159650039359.
Lane D.J. 16S/23S rRNA Sequencing // Nucleic Acid Techniques in Bacterial Systematics / Eds.: E. Stackebrandt, M. Goodfellow. New York: John Wiley and Sons, 1991. P. 115–175.
Loeppmann S., Semenov M., Blagodatskaya E., KuzyakovY. Substrate quality affects microbial-and enzyme activities in rooted soil // J. Plant Nutr. and Soil Sci. 2016. V. 179. P. 39–47. doi 10.1002/jpln.201400518
Loeppmann S., Semenov M., Kuzyakov Y., Blagodatskaya E. Shift from dormancy to microbial growth revealed by RNA: DNA ratio // Ecol. Indic. 2018. V. 85. P. 603–612. https://org/10.1016/j.ecolind.2017.11.02010.1016/ j.ecolind.2017.11.020.
Ma L.J., Van Der Does H.C., Borkovich K.A., Coleman J.J., Daboussi M.J., Di Pietro A., Dufresne M., Freitag M., Grabherr M., Henrissat B., Houterman P.M. Comparative genomics reveals mobile pathogenicity chromosomes in Fusarium // Nature. 2010. V. 464. P. 367–373. doi 10.1038/nature08850
Mäder P., Fliessbach A., Dubois D., Gunst L., Fried P., Niggli U. Soil fertility and biodiversity in organic farming // Science. 2002. V. 296. P. 1694–1697. doi 10.1126/ science.1071148
Meidute S., Demoling F., Bååth E. Antagonistic and synergistic effects of fungal and bacterial growth in soil after adding different carbon and nitrogen sources // Soil Biol. and Biochem. 2008. V. 40. P. 2334–2343. https://org/ 10.1016/j.soilbio.2008.05.01110.1016/j.soilbio.2008.05.011.
Mendes R., Kruijt M., de Bruijn I., Dekkers E., van der Voort M., Schneider J.H.M., Piceno Y.M., DeSan-tis T.Z., Andersen G.L., Bakker P.A.H.M., Raaijmakers J.M. Deciphering the rhizosphere microbiome for disease-suppressive bacteria // Science. 2011. V. 332. P. 1097–1100. doi 10.1126/science.1203980
Raaijmakers J.M., Paulitz T.C., Steinberg C., Alabouvette C., Moenne-Loccoz Y. The rhizosphere: a playground and battlefield for soilborne pathogens and beneficial microorganisms // Plant and Soil. 2009. V. 321. P. 341–361. https://org/10.1007/s11104-008-9568-610.1007/s11104-008-9568-6.
Rodriguez M.B., Godeas A., Lavado R.S. Soil Acidity Changes in Bulk Soil and Maize Rhizosphere in Response to Nitrogen Fertilization // Comm. Soil Sci. and Plant Anal. 2008. V. 39. P. 2597–2607. https://org/ 10.1080/0010362080235865610.1080/00103620802358656.
Semenov A.V. Ecology and modelling of Escherichia coli O157 : H7 and Salmonella enterica serovar Typhimurium in cattle manure and soil. Doctoral thesis, Biological Farming Systems Group, Wageningen University, the Netherlands. 2008. 212 p. URL: http://edepot.wur.nl/122071.
Smalla K., Wieland G., Buchner A., Zock A., Parzy J., Kaiser S., Roskot N., Heuer H., Berg G. Bulk and rhizosphere soil bacterial communities studied by denaturing gradient gel electrophoresis: plant-dependent enrichment and seasonal shifts revealed // Appl. Environ. M-icrobiol. 2001. V. 67. P. 4742–4751. doi 10.1128/ AEM.67.10.4742-4751.2001
Suzuki C., Nagaoka K., Shimada A., Takenaka M. Bacterial communities are more dependent on soil type than fertilizer type, but the reverse is true for fungal communities // Soil Sci. Plant Nutr. 2009.V. 55. I. 1. P. 80–90. doi 10.1111/j.1747-0765.2008.00344.x
Toljander J.F., Santos-González J.C., Tehler A., Finlay R.D. Community analysis of arbuscular mycorrhizal fungi and bacteria in the maize mycorrhizosphere in a long-term fertilization trial // FEMS M-icrobiol. Ecol. 2008. V. 65. I. 2. P. 323–338. https://org/10.1111/j.1574-6941.2008.00512.x10.1111/ j.1574-6941.2008.00512.x.
van Bruggen A.H.C., He M., Zelenev V.V., Semenov V.M., Semenov A.M., Semenova E.V., Kuznetsova T.V., Khodzaeva A.K., Kuznetsov A.M., Semenov M.V. Relationships between greenhouse gas emissions and cultivable bacterial populations in conventional, organic and long-term grass plots as affected by environmental variables and disturbances // Soil Biol. and Biochem. 2017. V. 114. P. 145–159. https://org/10.1016/j.soilbio.2017.07.01410.1016/j.soilbio.2017.07.014.
van Bruggen A.H.C., Semenov A.M. In search of biological indicators for plant health and disease suppression // Appl. Soil Ecology. 2000. V. 15. P. 13–24. https://org/10.1016/S0929-1393(00)00068-810.1016/ S0929-1393(00)00068-8.
van Bruggen A.H.C., Termorshuizen A.J. Integrated a-pproaches to root disease management in organic farming systems // Australasian Plant Pathology. 2003. V. 32. P. 141–156. https://org/10.1071/AP0302910.1071/ AP03029.
van Dam N.M., Bouwmeester H.J. Metabolomics in the rhizosphere: tapping into belowground chemical communication // Trends in Plant Sci. 2016. V. 21. P. 256–265. https://org/10.1016/j.tplants.2016.01.00810.1016/ j.tplants.2016.01.008.
van Overbeek L., Van Elsas J.D. Effects of plant genotype and growth stage on the structure of bacterial communities associated with potato (Solanum tuberosum L.) // FEMS Microbiol. Ecol. 2008. V. 64. P. 283–296. https://org/10.1111/j.1574-6941.2008.00469.x10.1111/ j.1574-6941.2008.00469.x.
Дополнительные материалы отсутствуют.


