Почвоведение, 2019, № 3, стр. 370-376
Запасы и структура микробной биомассы в торфяниках карстовых ландшафтов Тульской области
А. В. Головченко 1, *, Е. М. Волкова 2, **
1 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
2 Тульский государственный университет
300012 Тула, пр. Ленина, 92, Россия
* E-mail: golovchenko.alla@gmail.com
** E-mail: convallaria@mail.ru
Поступила в редакцию 07.03.2018
После доработки 06.07.2018
Принята к публикации 26.09.2018
Аннотация
В торфяниках карстовых ландшафтов Тульской области люминесцентно-микроскопическим методом определена биомасса микроорганизмов и выявлена ее структура. В верхнем полуметровом слое она варьирует от 11 до 37 мг/г, максимальных значений достигает в молодом маломощном торфянике. В мощных торфяниках микробная биомасса в расчете на весь профиль составляет 15–21 мг/г. Верхние слои вносят существенный вклад (78–86%) в микробную биомассу, в структуре которой преобладает грибная составляющая, представленная мицелием. В нижних слоях доминируют бактерии, их доля в микробной биомассе высока – от 54 до 85%. Глубокозалежные торфяники карстовых ландшафтов пополняют спектр почв, в большей части профиля которых, в структуре микробной биомассы преобладает прокариотная составляющая. В торфяниках, представляющих сукцессионный ряд развития сплавин, отмечено уменьшение микробной биомассы от молодых мелкозалежных к древним глубокозалежным торфяникам, обусловленное, с одной стороны, сменой эвтрофных растительных сообществ на мезотрофные, с другой, – увеличением толщины сплавины.
ВВЕДЕНИЕ
Микроорганизмы являются основными агентами, осуществляющими деструкцию и синтез разнообразных органических веществ в торфяниках. Микробиологический аспект изучения торфяников приобретает особое значение, учитывая глобальность процессов аккумуляции органического углерода в болотах. Запасы углерода в болотах РФ оцениваются от 113.5 × 109 т [27] до 200 × × 109 т [20], что составляет от 20 до 50% запасов углерода в торфяных болотах в целом.
На кафедре биологии почв факультета почвоведения МГУ имени М.В. Ломоносова проводится многолетний микробиологический мониторинг торфяников, расположенных в разных регионах России. В торфяниках европейской части России и Западной Сибири определены запасы, жизнеспособность и соотношение основных компонентов микробной биомассы; выявлены особенности таксономической структуры бактериального и грибного блоков; проанализированы различные экологические факторы, ограничивающие функционирование микробных сообществ в верховых торфяниках [4–9, 11, 18, 21, 22, 24, 26].
Настоящее исследование, объектом которого являются торфяники карстовых ландшафтов [2], продолжает цикл работ по этой тематике. Микробиологические характеристики этих торфяников немногочисленны и посвящены изучению эколого-таксономической структуры бактериальных комплексов [10]. Цель работы – определить запасы и структуру микробной биомассы в торфяниках карстовых ландшафтов. Запасы жизнеспособной микробной биомассы наряду с мощностью профиля и составом органического вещества торфов, слагающих торфяную залежь, следует рассматривать в качестве основных показателей, характеризующих различные типы торфяников и их экологическое состояние.
ОБЪЕКТЫ И МЕТОДЫ
Выбранные в качестве объектов исследования торфяники находятся в 12 км от Тулы около пос. Озерный (Тульская обл., Ленинский р-н). Они отнесены к Засечному болотному району м-езо- и эвтрофных болот, сформированных в карстовых образованиях и представляют сукцессионный ряд в развитии сплавин, начиная от пионерных эвтрофных сообществ, сформированных на листовом опаде, и заканчивая мезо- и м-езоолиготрофными сообществами, формирующимися на сплавинах, образованных переходными видами торфа [1].
Исследуемые торфяники различаются по возрасту, глубине карстового провала, мощности сплавины, ботаническому составу и степени разложения торфа, pHсол (табл. 1). Торфяник № 1 (Т1) – самый молодой, растительный покров находится в процессе формирования, торфяник № 2 (Т2) – возраст около 2–2.5 тыс. лет эвтрофного типа и торфяник № 3 (Т3) – наиболее древний, мезотрофного типа. По современной классификации почв они соответствуют торфяным эутрофным типичным почвам [12] (Т1, Т2 – Eutric Fibric Histosols; Т3 – Dystric Fibric Histosols).
Таблица 1.
Характеристика объектов исследования
| Показатель | Торфяник | ||
|---|---|---|---|
| Т1 | Т2 | Т3 | |
| Возраст | Несколько сотен лет | 2–2.5 тыс. лет | 3–4 тыс. лет |
| Глубина карстового провала, м | 3 | 7 | >12 |
| Мощность сплавины, м | 0.5 | 2 | 2.5 |
| Виды торфа (степень разложения, %) | Травяно-гипновый низинный (25%) | Травяно-сфагновый низинный (30–35%); травяной низинный (45%) |
Сфагновый переходный (10–15%); пушицево-сфагновый переходный (20–25%) |
| pH KCl | 5.6–5.8 | 5.0–5.4 | 4.9–5.3 |
Образцы отбирали в летний и осенний периоды 2017 г. на пяти площадках каждого из анализируемых торфяников. Исследовали слои: 0–10, 10–20, 20–50, 50–100, 100–150, 150–200 см.
Численность и биомассу микроорганизмов определяли прямым методом с использованием люминесцентной микроскопии [14]. Для исследования отбирали 1 г образца и помещали в колбу со 100 мл стерильной воды. Для десорбции клеток полученную суспензию обрабатывали на ультразвуковом диспергаторе “Bandelin Sonopuls HD 2070” (Germany) в течение 2 мин при мощности 50%. Суспензии образцов наносили микропипеткой на тщательно обезжиренные предметные стекла (0.01 мл на препарат для бактерий и 0.02 мл на препарат для грибов) и равномерно распределяли петлей на площади 4 см2. Для одного образца готовили 6 бактериальных и 6 грибных препаратов. Препараты высушивали на воздухе, а затем фиксировали над пламенем горелки. Окраску препаратов производили водными растворами акридина оранжевого (для учета бактерий и актиномицетного мицелия) и калькофлуора белого (для учета грибов). Окрашенные препараты просматривали на люминесцентном микроскопе Л-ЮМАМ-ИЗ (Россия) (светофильтры ЖС-19, ЖС-18, объектив ×90 Л, окуляры ×4 или ×5): по 20-ти полей зрения на каждом препарате для бактерий и по 50‑ти полей зрения – для грибов и актиномицетного мицелия.
Численность клеток бактерий в 1 г образца (NБ) определяли по формуле: NБ= S1× a × n/ν × S2× c, где: S1 – площадь препарата (мкм2); а – среднее число бактерий в поле зрения; n – показатель разведения суспензии (мл); ν – объем капли, наносимой на стекло (мл); S2 – площадь поля зрения микроскопа (мкм2); с – навеска образца (г).
Длину актиномицетного мицелия (м в 1 г образца) (NМА) определяли по формуле: NМА=S1× a × n/ν × × S2× c × 106, где: S1 – площадь препарата (мкм2); а – средняя длина обрывков актиномицетного мицелия в поле зрения (мкм); n – показатель разведения суспензии (мл); ν – объем капли, наносимой на стекло (мл); S2 – площадь поля зрения микроскопа (мкм2); с – навеска образца (г).
Длину грибного мицелия (м в 1 г образца) (NМГ) определяли по формуле: NМГ= S1× a × n/ν × S2× × c × 106, где: S1 – площадь препарата (мкм2); а – средняя длина обрывков грибного мицелия в поле зрения (мкм); n – показатель разведения суспензии (мл); ν – объем капли, наносимой на стекло (мл); S2 – площадь поля зрения микроскопа (мкм2); с – навеска образца (г).
Численность спор грибов в 1 г образца (NСГ) определяли по формуле: NСГ= S1× a × n/ν × S2× c, где: S1 – площадь препарата (мкм2); а – среднее число спор грибов в поле зрения; n – показатель разведения суспензии (мл); ν – объем капли, наносимой на стекло (мл); S2 – площадь поля зрения микроскопа (мкм2); с – навеска образца (г).
Осуществляли пересчет численности микроорганизмов на 1 г сухого образца. Влажность определяли, высушивая образцы при 105°С в течение 6 ч.
Для расчета микробной биомассы принимали во внимание, что удельная масса (плотность) микроорганизмов равна 1 г/см3, содержание воды в клетках – 80%.
Биомассу бактерий (ББ) рассчитывали по формуле: ББ = NБ × 2 × 10–14 (г), где NБ – численность бактерий в 1 г образца, а биомасса сухого вещества для 1 бактериальной клетки объемом 0.1 мкм3 составляет 2 × 10–14 г [13].
Биомассу актиномицетного мицелия (БМА): БМА = = NМА × 3.9 × 10–8 (г), где NМА – длина актиномицетного мицелия в 1 г образца, а биомасса 1 м актиномицетного мицелия диаметром 0.5 мкм составляет 3.9 × 10–8 г [13].
Биомассу грибного мицелия (БМГ) определяли по формуле: БМГ = 0.628 × r2 × NМГ × 10–6 (г), где r – замеренный усредненный радиус обрывков грибного мицелия, NМГ – длина грибного мицелия в 1 г образца [15].
Биомассу спор грибов (БСГ) определяли по формуле: БСГ = 0.0836 × r3 × NСГ × 10–11 (г), где r – замеренный усредненный радиус спор грибов, NСГ – численность спор грибов в 1 г образца [15].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В исследуемых торфяниках численность бактерий варьировала от 9 × 109 до 2 × 1011 кл./г торфа; длина актиномицетного мицелия – от 233 м/г до 1.5 км/г, длина грибного мицелия – от 262 м/г до 3.5 км/г, численность грибных спор и дрожжеподобных клеток – от 13 × 106 до 78 × 107 спор/г в зависимости от объекта исследования, глубины залегания торфа и срока отбора образцов. Заметим, что численность микроорганизмов в исследуемых торфяниках была одного порядка с таковой для торфяников Тверской и Томской областей [4, 18, 21, 23, 25].
Проанализируем динамику численности микроорганизмов в верхнем полуметровом слое торфяников. По терминологии гидрогеологов этот слой называется деятельным слоем торфяной залежи. Будем учитывать следующие факторы: пространственную неоднородность (исследовали 5 точек каждого из трех болот – Т1, Т2, Т3); глубину залегания торфа (рассматривали слои: 0–10, 10–20 и 20–50 см) и срок отбора образцов (летний и осенний периоды). Трехфакторный дисперсионный анализ показал, что влияние всех перечисленных факторов на численность микроорганизмов статистически достоверно. Различной оказалась сила влияния факторов (табл. 2).
Таблица 2.
Оценка силы влияния факторов (численное значение – критерий Фишера при уровне значимости <0.001) на численность различных групп микроорганизмов в верхней 50-сантиметровой толще исследуемых торфяников (по результатам трехфакторного дисперсионного анализа)
| Группа микроорганизмов | Фактор* | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| Грибной мицелий | 64.33 | 175.73 | 15.81 |
| Споры грибов | 11.74 | 112.52 | 153.74 |
| Бактерии | 36.23 | 171.34 | 398.27 |
| Актиномицетный мицелий | 34.82 | 32.42 | 35.84 |
Так, численность бактерий и спор грибов в большей степени определял срок отбора образцов. Их обилие было в 2–3 раза больше летом, чем осенью (рис. 1).
Рис. 1.
Распределение бактерий (А, клеток/г), грибных спор (Б, спор/г) в толще исследуемых торфяников летом (I) и осенью (II).

Длина грибного мицелия максимально зависела от глубины залегания торфа. Следует отметить, что мицелий грибов обнаруживали в верхней толще торфяника. В летний период он проникал до глубины 20 см, осенью – до 50 см. Его содержание убывало по профилю, причем более резко в торфянике под мезотрофной растительностью (Т3) (рис. 2).
Рис. 2.
Распределение грибного мицелия (м/г) в толще исследуемых торфяников летом (I) и осенью (II).
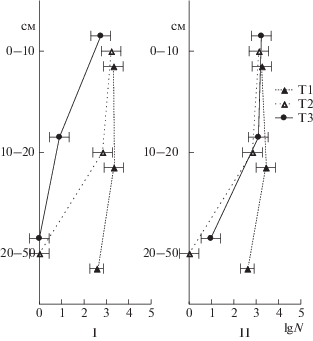
Аналогичную картину распределения грибного мицелия по профилю (встречается только в верхней полуметровой толще) наблюдали в нормальнозольных низинных торфяниках [3] и высокозольных низинных торфяниках [25].
Из условий среды обитания, которые могут быть весомыми при решении вопроса о распространении грибного мицелия в толще низинных торфяников следует привести: неблагоприятные физические свойства низинного торфа, как субстрата (преобладание в структуре порового пространства ультрамикропор, заполненных водой, в которых развитие грибного мицелия проблематично [19]); высокая биомасса представителей мезофауны (использующих грибной мицелий в пищу) в верхних слоях [16]; недостаточное количество кислорода в болотных водах [17].
В отличие от грибного мицелия, споры грибов, а также бактерии были обнаружены по всему профилю торфяников, мощность которых для Т2 и Т3 составляет 2 и 2.5 м соответственно. Распределение бактерий и спор грибов по профилю мощных торфяников можно охарактеризовать как равномерное. Сезонная динамика показателей обилия этих групп микроорганизмов отчетливо прослеживалась только в верхней полуметровой толще этих торфяников. Для актиномицетного мицелия определенных закономерностей, как в распределении по профилю, так и в сезонной динамике не выявлено.
Микробная биомасса, рассчитанная на грамм сухого торфа, варьировала в верхней 50 см толще от 11 до 37 мг/г в зависимости от сезона и объекта исследования (табл. 3). Максимальные значения были выявлены для торфяника Т1, они были в 2–3 раза больше, чем для Т2 и Т3. Очевидно, что в молодом, мелкозалежном торфянике Т1, сформированном на листовом опаде эвтрофных сообществ, лучшая обеспеченность питательными элементами, чем в торфяниках Т2 и Т3, формирующихся на сплавинах, образованными переходными видами торфа, под мезо- и мезоолиготрофными сообществами.
Таблица 3.
Содержание (над чертой, мг/г) и запасы (под чертой, т/га) микробной биомассы в торфяниках
| Торфяник | 0–50 см | 50–200 см | 0–200 см | |||
|---|---|---|---|---|---|---|
| лето | осень | лето | осень | лето | осень | |
| Т1 | $\frac{{36.7 \pm 2.1}}{{4.9}}$ | $\frac{{22.1 \pm 3.6}}{{2.9}}$ | _* | _ | _ | _ |
| Т2 | $\frac{{14.5 \pm 1.5}}{{2.6}}$ | $\frac{{12.8 \pm 2.2}}{{1.6}}$ | $\frac{{2.8 \pm 0.7}}{{2.1}}$ | $\frac{{2.3 \pm 0.4}}{{2.2}}$ | $\frac{{17.3 \pm 2.1}}{{4.7}}$ | $\frac{{15.1 \pm 3.2}}{{3.8}}$ |
| Т3 | $\frac{{17.8 \pm 2.3}}{{2.2}}$ | $\frac{{10.8 \pm 1.5}}{{1.4}}$ | $\frac{{2.7 \pm 0.4}}{{4.4}}$ | $\frac{{2.9 \pm 0.3}}{{1.8}}$ | $\frac{{20.5 \pm 3.4}}{{6.6}}$ | $\frac{{13.7 \pm 1.4}}{{3.2}}$ |
Микробная биомасса для мощных торфяников (Т2 и Т3) в расчете на весь профиль составляет 15–21 мг/г. Выявлена тенденция убывания микробной биомассы с глубиной: так, если в верхней 50 см толще ее значения составляют 11–18 мг/г, то в нижней (50–200 см) – 2–3 мг/г. Таким образом, верхние слои вносят существенный вклад (78–86%) в микробную биомассу, рассчитанную на весь профиль. На слои глубже 50 см приходится 14–22% от суммарной микробной биомассы. Следует отметить, что в них менее выражена, чем в верхних слоях, сезонная динамика этого показателя обилия.
Запасы микробной биомассы в торфяниках (рассчитанные с учетом мощности и плотности торфяных слоев) варьируют в слое 0–50 см – от 1.4 до 5 т/га. В порядке убывания микробной биомассы, исследуемые торфяники выстраиваются в следующий ряд: Т1, Т2 и Т3. В этом же ряду происходит уменьшение трофности питающих болота вод и pHсол. Запасы микробной биомассы в мощных торфяниках в расчете на их двухметровую толщу не превышают 7 т/га.
При сравнении величин, характеризующих микробный пул в исследуемых торфяниках (в расчете на метровую толщу) и торфяниках других регионов [23, 25], было показано, что их нижний предел совпадает с таковым для других типов торфяников. Верхний предел находится на уровне эутрофных торфяников других регионов и в 4–8 раз меньше, чем в олиготрофных торфяниках.
Анализ структуры микробной биомассы (рис. 3) показал, что верхние (до 50 см) и нижние (от 50 см до 2 м) слои торфяников различались по соотношению основных компонентов микробной биомассы. Если в верхних слоях преобладала эукариотная составляющая микробной биомассы (51–93%), то в нижних – прокариотная (52–86%). Эукариотная составляющая микробной биомассы была представлена мицелием и спорами грибов. В верхней толще в популяционной структуре грибного комплекса всех торфяников, как правило, доминировал мицелий, в нижней толще – споры грибов. Прокариотная составляющая микробной биомассы была представлена клетками бактерий и актиномицетным мицелием, доля которого в суммарной прокариотной биомассе не превышала 15%.
Рис. 3.
Процентное соотношение компонентов микробной биомассы в толще исследуемых торфяников. Обозначения: I – слой 0–50 см; II – слой 50–250 см. Компоненты микробной биомассы: МГ – грибной мицелий; СГ – споры грибов; Б + МА – бактерии и актиномицетный мицелий.
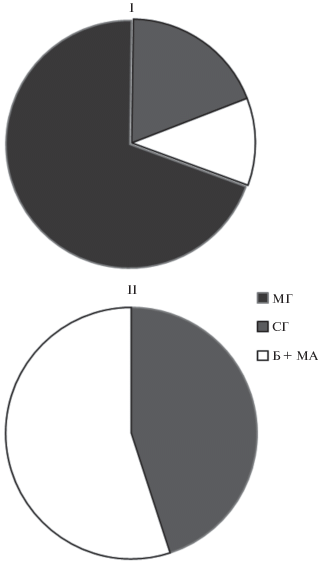
В мощных торфяниках (Т2 и Т3) доминирование прокариотной составляющей было отмечено с глубины 20 см в летний период и с 50 см – в осенний. Бактериальная биомасса варьировала от 0.2 до 2 мг/г. Она в 2–6 раз превосходила грибную биомассу, представленную в этой толще грибными спорами.
Общая закономерность в превышении эукариотной биомассы над прокариотной, выявленная при анализе структуры микробной биомассы большинства типов почв [15], была подтверждена только для молодого маломощного торфяника Т1 и для верхних слоев мощных торфяников Т2 и Т3. Специфическая структура микробной биомассы, характеризующаяся высокой долей прокариотных микроорганизмов, спор грибов и клеток дрожжей, была выявлена при исследовании глубоких слоев олиготрофных торфяников [21, 23, 24], однако в этих торфяниках прокариотная сооставляющая никогда не была доминирующей. Глубокозалежные торфяники карстового происхождения пополняют спектр почв, в большей части профиля которых, в структуре микробной биомассы превалирует прокариотная составляющая. К таким почвам относятся нормальнозольные и высокозольные низинные торфяники [3, 24].
ЗАКЛЮЧЕНИЕ
Использование прямых микроскопических методов позволило оценить микробный пул в торфяниках карстовых ландшафтов, определить соотношение основных компонентов микробной биомассы, провести сравнительный анализ с торфяниками других регионов России.
Запасы микробной биомассы в исследуемых торфяниках варьируют в слое 0–50 см от 1.4 до 5 т/га, в расчете на двухметровую толщу – от 3 до 7 т/га, что соответствует показателям, установленным для низинных торфяников.
Выявлены различия по анализируемым показателям обилия в торфяниках, представляющих сукцессионный ряд в развитии сплавин, начиная от пионерных эвтрофных сообществ, сформированных на листовом опаде (Т1), и заканчивая мезо- и мезоолиготрофными растительными сообществами, формирующимися на сплавинах, образованных переходными видами торфа (Т2 и Т3).
Молодой мелкозалежный торфяник Т1 характеризуется высокой численностью микроорганизмов, максимальной микробной биомассой, в структуре которой по всему профилю доминирует эукариотная составляющая, представленная преимущественно грибным мицелием.
Для глубокозалежных торфяников характерна четкая дифференциация верхних и нижних слоев. В суммарной микробной биомассе на долю верхних слоев (до 50 см) приходится 33–55%, на долю нижних, мощность которых в 3 раза больше (50–200 см) – 45–67%. В верхних слоях, как и в Т1, в структуре микробной биомассы преобладает грибная составляющая, тогда как в нижних – бактериальная (54–85%).
Благодарность. Работа выполнена при финансовой поддержке гранта РФФИ № 16-04-00452-а.
Список литературы
Волкова Е.М., Бурова О.В., Вислогузова Д.В. Принципы районирования болот Тульской области // Естественные и технические науки. 2003. № 4. С. 34–38.
Волкова Е.М., Шереметьева И.С., Лакомов А.Ф., Светашева Т.Ю. Карстовые болота Тульской области, предлагаемые к охране // Тульский экологический бюллетень. 2006. Вып. 2. С. 322–338.
Головченко А.В., Волкова Е.М. Численность, запасы и структура микробных комплексов низинных торфяников Тульской области // Мат-лы пятой научной школы “Болота и биосфера” Томск: Изд-во ЦНТИ, 2006. С. 158–162.
Головченко А.В., Добровольская Т.Г., Звягинцев Д.Г. Микробиологические основы оценки торфяника как профильного почвенного тела // Вестник Томского гос. педагогического ун-та. 2008. Вып. 4(78). Сер. Биологические науки. С. 46–53.
Головченко А.В., Полянская Л.М., Добровольская Т.Г., Васильева Л.В., Чернов И.Ю., Звягинцев Д.Г. Особенности пространственного распределения и структуры микробных комплексов болотно-лесных экосистем // Почвоведение. 1993. № 10. С. 78–89.
Головченко А.В., Санникова Ю.В., Добровольская Т.Г., Звягинцев Д.Г. Сапротрофный бактериальный комплекс верховых торфяников Западной Сибири // Микробиология. 2005. Т. 74. № 4. С. 545–551.
Добровольская Т.Г., Полянская Л.М., Головченко А.В., Смагина М.В., Звягинцев Д.Г. Микробный пул в торфяных почвах // Почвоведение. 1991. № 7. С. 69–76.
Звягинцев Д.Г., Добровольская Т.Г., Головченко А.В., Зенова Г.М., Смагина М.В. Структура сапротрофного комплекса микроорганизмов в торфяниках // Микробиология. 1991. Т. 60. Вып. 6. С. 155–164.
Звягинцев Д.Г., Зенова Г.М. Экология актиномицетов. М.: ГЕОС, 2001. 257 с.
Иванова А.О., Головченко А.В., Добровольская Т.Г. Бактериальное разнообразие торфяников карстового происхождения // Вестн. Моск. ун-та. Сер. 17. Почвоведение. 2008. № 4. С. 52–56.
Качалкин А.В., Глушакова А.М.,Чернов И.Ю. Специфичность эпифитных дрожжевых сообществ торфяно-болотных почв // Доклады по экологическому почвоведению. 2009. Т. 2. № 12. С. 20–36.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. С. 257–261.
Кожевин П.А., Полянская Л.М., Звягинцев Д.Г. Динамика развития различных микроорганизмов в почве // Микробиология. 1979. Т. 48. № 4. С. 490–494.
Методы почвенной микробиологии и биохимии / Под ред. Д.Г. Звягинцева. М.: Изд-во Моск. ун-та, 1991. 303 с.
Полянская Л.М. Микробная сукцессия в почве. Автореф. дис. … докт. биол. н. М., 1996. 96 с.
Рахлеева А.А., Седова Т.С. Почвенные беспозвоночные (мезофауна) заболоченных ельников южной тайги (Центрально-Лесной заповедник, Тверская обл.) // Russ. Entomol. J. 2002. V. 11. № 1. P. 93–100.
Сирин А.А. Водообмен и сруктурно-функциональные особенности лесных болот (на примере европейской тайги). Автореф. дис. … докт. биол. н. М., 1999. 44 с.
Функционирование микробных комплексов верховых торфяников – анализ причин медленной деструкции торфа. М.: Товарищество научных изданий КМК, 2013. 128 с.
Alekhina L.K., Golovchenko A.V., Pochatkova T.N., Dobrovol’skaya T.G., Zvyagintsev D.G. The Effect of Hydrophysical Soil Properties on the Structure of Microbial Complexes // Eurasian Soil Science. 2002. V. 35. № 8. Р. 890–897.
Botch M.S., Kobak K.I., Vinson T.S. Carbon pools and accumulation in peatlands of the former Soviet Union // Global Biogeochem Cycles. 1995. V. 9. P. 37–46.
Dobrovol’skaya T.G., Golovchenko A.V., Kukharenko O.S., Yakushev A.V., Semenova T.A., Inisheva L.I. The structure of the microbial communities in low-moor and high-moor peat bogs of Tomsk oblast // Eurasian Soil Science. 2012. V. 45. № 3. P. 273–281.
Dobrovol’skaya T.G., Golovchenko A.V., Zvyagintsev D.G. Analysis of ecological limiting the destruction of high-moor peat // Eurasian Soil Science. 2014. V. 47. № 3. P. 182–193.
Golovchenko A.V., Dobrovol’skaya N.G., Inisheva L.I. Structure and Stocks of Microbial Biomass in Oligotrophic Peat Bogs of the Southern Taiga in Western Siberia // Eurasian Soil Science. 2002. V. 35. № 12. P. 1296–1301.
Golovchenko A.V., Kurakov A.V., Semenova T.A., Zvyagintsev D.G. Abundance, diversity, viability, and factorial ecology of fungi in peatbogs // Eurasian Soil Science. 2013. V. 46. № 1. P. 74–90.
Golovchenko A.V., Tikhonova E.Yu., Zvyagintsev D.G. Abundance, biomass, structure, and activity of the microbial complexes of minerotrophic and ombrotrophic peatlands // Microbiology (Moscow). 2007. V. 76. № 5. P. 630–637.
Kachalkin A.V., Glushakova A.M., Yurkov A.M., Chernov I.Y. Characterization of yeast groupings in the phyllosphere of Sphagnum mosses // Microbiology. 2008. V. 77. № 4. P. 474–481.
Vompersky S.E., Tsyganova O.P., Valyeva N.A. Peat covered wetlands of Russia and carbon pool of their peat // Peatland use – present, past and future / Proc. Intern. Peat. Congr. 1996. V. 10. P. 381–390.
Дополнительные материалы отсутствуют.


