Почвоведение, 2019, № 5, стр. 570-577
Трансформация соединений азота в почвах горно-тундровых экосистем Хибин
И. С. Бузин 1, М. И. Макаров 1, *, Т. И. Малышева 1, М. С. Кадулин 1, Н. Е. Королева 2, М. Н. Маслов 1
1 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
2 Полярно-альпийский ботанический сад-институт им. Н.А. Аврорина
184256 Мурманская обл., Кировск, ул. Ботанический сад, 29, Россия
* E-mail: mikhail_makarov@mail.ru
Поступила в редакцию 17.04.2018
После доработки 18.06.2018
Принята к публикации 26.09.2018
Аннотация
Определено содержание разных соединений азота и изучены процессы N-минерализации и нитрификации в почвах четырех биогеоценозов горной тундры Хибин. Полученные результаты демонстрируют различия в концентрациях экстрагируемых неорганических и органических соединений N и в активностях процессов их трансформации между почвами кустарничковых и травяных биогеоценозов. Характер зависимости между активностью N-минерализации и соотношением C/N в органическом веществе, а также между активностью минерализации и количеством микробной биомассы в почвах также различен. При больших значениях C/N микроорганизмы ассимилируют больше доступного азота, что приводит к уменьшению интенсивности N-минерализации. В почвах луговых сообществ по сравнению с кустарничковыми активность N-минерализации более резко реагирует на изменение микробной биомассы, соотношение С/N и долю N микробной биомассы в составе лабильного азота. Микробное сообщество в изученных почвах горно-тундровых экосистем переходит от минерализации к иммобилизации азота при соотношении С/N в органическом веществе почвы около 20.5 и достижении концентрации углерода микробной биомассы около 1000 мг/кг.
ВВЕДЕНИЕ
Тундровые почвы характеризуются значительными запасами азота (N), однако большая его часть находится в составе органического вещества в недоступной для растений форме. Это обуславливает важную роль микробного сообщества почв в управлении доступностью N для растений [11, 23]. Основным механизмом влияния микробиоты на доступность N считается минерализация органических соединений азота (N-минерализация) сапротрофными микроорганизмами [21]. Однако соотношение между N-минерализацией и иммобилизацией азота в составе микробной биомассы зависит от соотношения углерода (C) и N в минерализуемом субстрате: при дефиците N микроорганизмы повышают эффективность его ассимиляции и иммобилизации [16].
В условиях низкой обеспеченности неорганическими соединениями N, в частности в тундровых экосистемах, растения могут успешно конкурировать с микроорганизмами за N, находящийся в форме низкомолекулярных органических соединений [20]. Важная роль в этом принадлежит микоризным грибам, которые занимают ключевое положение в азотном цикле в тундровых почвах, обеспечивая деполимеризацию высокомолекулярных органических соединений и доступ растений к органическим соединениям N без их предварительной минерализации [12]. Однако и безмикоризные растения семейства Cyperaceae, типичные для тундровых сообществ, способны поглощать аминокислоты из почвы [18, 19]. Известно, что растения могут влиять на интенсивность минерализации органического вещества, изменяя состав и количество корневых экссудатов и тем самым, действуя на состав и активность микробного сообщества ризосферы [17].
Таким образом, процессы трансформации азотсодержащих соединений в почвах тундровых экосистем разнообразны, и изучение соотношения между микробной минерализацией и иммобилизацией N в тундровых почвах, характеризующихся разной обеспеченностью N, представляет несомненный интерес на фоне меняющихся условий окружающей среды в сторону большего благоприятствования для прироста биомассы (повышение температуры и концентрации СО2) [8, 10]. В этих условиях вопрос доступности N для растений становится еще более актуальным. В связи с этим мы изучили азотное состояние и процессы N-минерализации и нитрификации в почвах горно-тундровых экосистем Хибин, занимающих разное положение в мезорельефе и характеризующихся разным составом фитоценозов.
ОБЪЕКТЫ И МЕТОДЫ
Исследование выполнено в нескольких экосистемах горной тундры Хибин, расположенных на геохимически сопряженных элементах мезорельефа в пределах одной катены на территории Ботанического цирка Полярно-альпийского ботанического сада-института имени Н.А. Аврорина (Мурманская область). На выпуклом борту цирка в условиях малого снегонакопления представлена кустарничково-лишайниковая пустошь (КЛП), где преобладают лишайники Flavocetraria nivalis, F. cucullata, Cetraria islandica, Alectoria ochroleuca, а из сосудистых растений представлены кустарнички Empetrum hermaphroditum, Vaccinium vitis-idaea, V. uliginosum. На пологом склоне, в условиях умеренного снегонакопления расположена кустарничковая пустошь (КП) с кустарниковым ярусом, образованным Betula nana. В травяно-кустарничковом ярусе преобладают Phyllodoce caerulea, Empetrum hermaphroditum, Vaccinium myrtillus, Solidago lapponica, Arctous alpina. В мохово-лишайниковом – Polytrichum juniperinum, Cetraria islandica, Cladonia arbuscula. На перегибе горной террасы, в условиях умеренного снегонакопления расположен злаковый луг (ЗЛ), здесь преобладают Avenella flexuosa, Nardus stricta, Juncus trifidus, а также представители разнотравья Solidago lapponica. Из мхов наиболее обычен Racomitrium microcarpon, из лишайников Cetraria islandica, Cetrariella delisei, Stereocaulon alpinum. На дне и берегах временного водоема, в условиях значительного зимнего снегонакопления и избыточного увлажнения расположен осоковый луг (ОЛ). Из сосудистых растений здесь преобладают Carex bigelowii, Avenella flexuosa, Juncus trifidus. Мохово-лишайниковый покров не развит. Максимальное расстояние между сообществами не превышало 100 м, а максимальное превышение по высоте составило 10 м.
В изученных экосистемах формируются сухоторфяно-подбур иллювиально-гумусовый (Folic Leptosol) в КЛП, сухоторфяно-литозем перегнойно-грубогумусовый (Folic Leptosol) в КП и литоземы перегнойно-темногумусовые (Haplic Leptosols) в луговых сообществах.
Изучались два горизонта почв – поверхностный органогенный и верхний минеральный (органно-минеральный). Органогенная часть профиля в сухоторфяно-подбуре и сухоторфяно-литоземе представлена хорошо сформированным (до 10–15 см) сухоторфяным гор. TJ, а в литоземах перегнойно-темногумусовых луговых биогеоценозов – маломощным (до 5 см) подстилочно-торфяным гор. O. Минеральный горизонт в сухоторфяно-подбуре представлен супесчаным или легкосуглинистым гор. Bh мощностью до 10 см. В сухоторфяно-литоземе перегнойно-грубогумусовом под гор. TJ залегает легкосуглинистый гор. АОh, а в литоземах перегнойно-темногумусовых – гор. АН суглинистого состава.
Образцы почв отбирали в начале августа 2017 г. в пределах каждого биогеоценоза случайным образом в пяти повторностях и замораживали не позднее трех часов после отбора. До выполнения анализов почвенные образы хранились в замороженном состоянии. Ранее мы показали относительно небольшое изменение концентраций лабильных углерода и азота в почвенных образцах в результате их замораживания [4]. Также замораживание не оказывает влияния на определение активностей трансформации соединений азота и сохраняет при этом естественные различия между разными почвами [2, 4].
В почвах определяли общее содержание С (Собщ) и N (Nобщ) и содержание их лабильных соединений (Слаб, Nлаб), которые экстрагировали 0.05 М K2SO4 из “условно свежих” образцов сразу после размораживания. Лабильные соединения были представлены органическими С (Сорг) и N (Nорг), аммонийным и нитратным N (N-${\text{NH}}_{4}^{ + }$ и N-${\text{NO}}_{3}^{ - }$) и С и N микробной биомассы (Смикр и Nмикр). Последние определяли методом фумигации-экстракции, который заключается в определении количеств С и N, высвобождаемых из клеток микроорганизмов в результате их гибели и лизиса при обработке почвы парами хлороформа в вакуумном эксикаторе (разница между С и N, экстрагируемыми 0.05 М K2SO4 после фумигации и до фумигации). Концентрации Смикр и Nмикр представлены концентрациями хлороформ-мобилизуемых элементов без использования коэффициентов, учитывающих неполную экстрагируемость компонентов микробной биомассы.
Потенциальные активности N-минерализации и нитрификации определяли в эксперименте с инкубацией образцов почв в аэробных условиях в течение 20 сут. при естественной влажности и температуре 22°С. Изменение концентраций N‑${\text{NH}}_{4}^{ + }$ и N-${\text{NO}}_{3}^{ - }$ в результате инкубации характеризует активность процессов N-минерализации (сумма N‑${\text{NH}}_{4}^{ + }$ и N-${\text{NO}}_{3}^{ - }$) и нитрификации (только N-${\text{NO}}_{3}^{ - }$).
Общее содержание С и N определяли на элементном анализаторе Carlo Erba NC 2500 в предварительно высушенных образцах после их измельчения на вибрационной мельнице Retch MM 200. Неорганические формы N анализировали колориметрически на спектрофотометре Genesys 10 UV. Для определения N-${\text{NH}}_{4}^{ + }$ использовали салицилат-нитропруссидный метод [14], а N-${\text{NO}}_{3}^{ - }$ – восстановление до ${\text{NO}}_{2}^{ - }$ на кадмиевой колонке с последующим получением окрашенного азосоединения при реакции с сульфаниламином и N-(1-нафтил)-этилендиамин-дигидрохлоридом [9]. Концентрации Cорг и Nорг измеряли на автоматическом анализаторе TOC-VCPN.
Полученные результаты подвергались однофакторному дисперсионному анализу с последующим определением НЗР с помощью теста Тьюки, а также анализу по методу главных компонент в пакете Statistica. Для проведения этого анализа были использованы определенные в работе параметры: Cобщ, Nобщ, Cобщ/Nобщ, Cорг, Nорг, Cорг/Nорг, Смикр, Nмикр, Nмикр в % от Nлаб, N-${\text{NH}}_{4}^{ + },$ N-${\text{NO}}_{3}^{ - },$ минерализация и нитрификация органических соединений азота.
Для определения порогового значения почвенных характеристик, при которых характер реакции микробного сообщества изменяется, применялся пакет “Многомерные адаптивные регрессионные сплайны (MARSplines)”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Азот и углерод в почвах. Почвы горно-тундровых экосистем характеризуются большими концентрациями Собщ и Nобщ не только в поверхностных органогенных, но и в верхних минеральных горизонтах, где они достигают 9.3–14.6 и 0.43–0.91% для Собщ и Nобщ соответственно. При этом почвы луговых биогеоценозов отличаются более высокими концентрациями этих элементов в маломощных органических горизонтах, тогда как минеральные горизонты разных почв содержат близкие концентрации Собщ. Концентрации Nобщ, в свою очередь, больше в минеральных горизонтах луговых почв. В результате для них характерны меньшие соотношения С/N (14.0–15.9), то есть органическое вещество относительно обогащено азотом (табл. 1).
Таблица 1.
Содержание углерода и азота в почвах горно-тундровых экосистем (среднее ± стандартное отклонение)
| Сооб-щес-тво | Гори-зонт | Валовые формы | Лабильные формы | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Cобщ | Nобщ | Cобщ/Nобщ | Cорг | Nорг | Cорг/Nорг | N-${\text{NH}}_{4}^{ + }$ | N-${\text{NO}}_{3}^{ - }$ | ||
| мг/кг | |||||||||
| мг/кг | |||||||||
| % | |||||||||
| КЛП | TJ | 23.6 ± 5.2а* | 1.12 ± 0.20ав | 21.0 ± 1.1а | 166 ± 41а | 9.7 ± 1.2а | 17.0 ± 2.5абв | 1.81 ± 0.98а | 0.121 ± 0.003а |
| Bh | 10.8 ± 4.3б | 0.50 ± 0.16б | 20.8 ± 3.4а | 101 ± 21б | 7.9 ± 1.6а | 12.9 ± 2.2а | 1.62 ± 0.96а | 0.112 ± 0.003б | |
| КП | TJ | 32.2 ± 2.2в | 1.23 ± 0.04а | 26.3 ± 2.0б | 466 ± 106в | 25.5 ± 5.1б | 18.3 ± 1.4бв | 2.37 ± 3.27а | 0.221 ± 0.004в |
| AOh | 9.3 ± 2.2б | 0.43 ± 0.08б | 21.2 ± 1.2а | 124 ± 19аб | 8.4 ± 1.3а | 14.9 ± 1.8ав | 1.88 ± 0.71а | 0.112 ± 0.003б | |
| ЗЛ | О | 40.7 ± 2.6г | 1.38 ± 0.19аг | 29.8 ± 3.8б | 1402 ± 333г | 73.5 ± 19.1в | 19.0 ± 3.1вг | 86.2 ± 16.3б | 0.96 ± 0.77г |
| АH | 14.6 ± 4.6б | 0.91 ± 0.26вд | 15.9 ± 0.7в | 248 ± 40д | 16.4 ± 3.2г | 15.2 ± 0.9аг | 13.7 ± 3.8в | 2.72 ± 1.01д | |
| ОЛ | О | 36.0 ± 1.5д | 1.72 ± 0.21г | 21.1 ± 1.9а | 1290 ± 303г | 77.5 ± 33.2в | 15.1 ± 4.5абвг | 113 ± 40б | 4.64 ± 2.94д |
| АH | 11.0 ± 0.7б | 0.79 ± 0.04д | 14.0 ± 0.2в | 461 ± 41в | 30.1 ± 3.2б | 15.4 ± 0.6аг | 7.7 ± 1.0г | 1.93 ± 0.43г | |
Гораздо сильнее почвы, расположенные на разных элементах геоморфологического профиля, различаются по содержанию экстрагируемых соединений С и N. Концентрации Сорг в органических горизонтах почв луговых биогеоценозов в 3–8 раз больше, чем кустарничковых. Подобные концентрации Сорг характерны, например, для торфяников северной тайги Западной Сибири [1, 6, 7]. В минеральных горизонтах соответствующее превышение составляет 2–4 раза. Та же закономерность характерна и для Nорг. Экстрагируемое органическое вещество более обогащено N в сравнении с общим органическим веществом в почвах кустарничковых биогеоценозов и в органических горизонтах почв луговых биогеоценозов, тогда как для минеральных горизонтов последних это не характерно. В целом, экстрагируемое органическое вещество во всех почвах имеет близкое соотношение С/N (15.1–19.0 в органических горизонтах и 12.9–15.4 – в минеральных), и по этому показателю почвы кустарничковых и луговых биогеоценозов не дифференцируются.
Еще сильнее изученные почвы различаются по содержанию неорганических соединений азота. Очень низкие концентрации N-${\text{NH}}_{4}^{ + }$ (1–2 мг/кг) и N-${\text{NO}}_{3}^{ - }$ (0.1–0.2 мг/кг) характерны для почв кустарничковых биогеоценозов, тогда как в почвах лугов концентрация N-${\text{NH}}_{4}^{ + }$ составляет 86–113 мг/кг (примерно в 50 больше) в органических горизонтах и 7–13 мг/кг (в 4–8 раз больше) – в минеральных. Концентрации N-${\text{NO}}_{3}^{ - }$ в почвах луговых биогеоценозов также в 10–20 раз больше, чем в почвах пустошей. Подобные низкие концентрации минеральных соединений N характерны также для горно-тундровых почв пустошей на севере Швеции, однако там, хотя и наблюдается повышение концентраций N-${\text{NH}}_{4}^{ + }$ и N-${\text{NO}}_{3}^{ - }$ в почвах луговых биогеоценозов, но не столь значительное [5]. Рост концентраций неорганических соединений N вдоль геоморфологического профиля характерен и для горно-луговых почв альпийских экосистем на Северо-Западном Кавказе [3].
В разных почвах отличается соотношение отдельных соединений азота. В почвах КЛП и КП экстрагируемый N представлен в основном органическими соединениями, на долю которых приходится 80–90%. В почвах луговых биогеоценозов концентрация Nорг в 3 раза превышает концентрацию неорганических соединений азота только в гор. АН почвы осокового луга. В других случаях на долю Nорг приходится менее половины от суммы экстрагируемого элемента.
Концентрации Смикр и Nмикр гораздо более высокие в органогенных горизонтах. При этом содержание Смикр значительно варьирует (от 1015 ± 202 мг/кг для органогенного горизонта почв сообщества КЛП до 3991 ± 869 мг/кг для органогенного горизонта почв сообщества ОЛ), не демонстрируя связи с принадлежностью почв к кустарничковым или луговым биогеоценозам, различия между которыми хорошо выражены по другим лабильным соединениям С и N. Наибольшие концентрации Смикр и Nмикр отмечены в почве ЗЛ, а наименьшие – в почве КЛП (для органических горизонтов) и в почвах КП и ОЛ (для минеральных горизонтов) (табл. 2). Схожие высокие концентрации Смикр и Nмикр ранее были показаны для органогенных горизонтов болотных [1, 6, 7] и горно-тундровых [5] почв.
Таблица 2.
Углерод и азот микробной биомассы, и процессы N-минерализации и нитрификации в почвах горно-тундровых экосистем (среднее ± стандартное отклонение)
| Сооб-щество | Гори-зонт | Смикр | Nмикр | Смикр/Nмикр | Nмикр, % от Nлаб | Минерализация | Нитрификация |
|---|---|---|---|---|---|---|---|
| мг/кг | мг/кг в сут | ||||||
| КЛП | TJ | 1015 ± 202а* | 78 ± 25а | 12.8 ± 1.2а | 86.1 ± 4.6аб | 0.35 ± 0.04а | 0.09 ± 0.04а |
| Bh | 247 ± 113бг | 23 ± 7б | 10.8 ± 0.9абв | 70.5 ± 14.9авг | 0.31 ± 0.03а | 0.07 ± 0.02а | |
| КП | TJ | 3205 ± 316в | 285 ± 50вд | 11.4 ± 1.5ав | 90.5 ± 1.2б | 0.79 ± 0.12б | 0.36 ± 0.14б |
| AOh | 119 ± 20б | 14 ± 4б | 9.1 ± 1.0бвг | 57.8 ± 6.0вг | 0.50 ± 0.05в | 0.16 ± 0.10а | |
| ЗЛ | О | 3991 ± 869в | 357 ± 58в | 11.1 ± 1.4абв | 68.4 ± 7.3в | 15.9 ± 1.1г | 9.37 ± 1.12в |
| АH | 410 ± 86г | 35 ± 6г | 11.7 ± 1.4ав | 51.8 ± 8.8г | 4.7 ± 0.7д | 2.73 ± 0.41г | |
| ОЛ | О | 1765 ± 284д | 195 ± 51д | 9.3 ± 1.2вг | 53.7 ± 11.5вг | 14.9 ± 3.1г | 7.80 ± 1.19в |
| АH | 131 ± 18б | 15 ± 3б | 8.6 ± 1.1г | 27.8 ± 6.8д | 3.8 ± 0.5д | 3.01 ± 0.39г | |
Соотношение между С и N в микробной биомассе меньше, чем в общем и экстрагируемом органическом веществе. Хотя это соотношение не сильно различается в разных почвах и горизонтах, все же, в целом, оно следует закономерности, показанной для изменения обогащенности почв лабильными соединениями N. Соотношение Смикр/Nмикр проявляет тенденцию к постепенному уменьшению от почвы КЛП к почве ОЛ и значимо различается в органогенных и минеральных горизонтах этих почв, занимающих крайние позиции в изученном геоморфологическом ряду.
Углерод и азот микробной биомассы составляют от 50 до 90% Слаб и Nлаб, за исключением гор. АН почвы ЗЛ, где на долю Смикр и Nмикр приходится всего 22–28% от количества экстрагируемых элементов. В целом, доли Смикр и Nмикр в составе Слаб и Nлаб последовательно уменьшаются от почвы КЛП к почве ЗЛ. Если для органических горизонтов этот показатель начинает уменьшаться при переходе от группы почв пустошей к почвам луговых биогеоценозов, то для минеральных горизонтов такое уменьшение характерно и для перехода от почвы КЛП к почве КП.
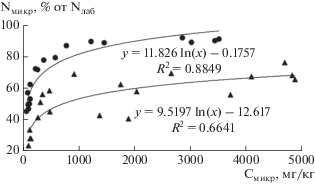
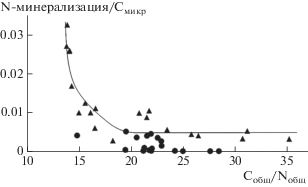
При увеличении соотношения С/N в органическом веществе почвы, то есть при возрастании дефицита азота, доля Nмикр в составе экстрагируемых форм элемента увеличивается (рис. 1). Рост микроорганизмов может быть ограничен количеством доступной энергии (C), дефицитом питательных веществ (N), или и тем, и другим. В случаях, когда субстрат характеризуется высоким соотношением C/N, микроорганизмы стремятся иммобилизовать N и высвободить избыток С через дыхание. Если же органическое вещество богато N (низкие соотношения C/N), то его избыток начинает активно минерализоваться [16]. Зависимость можно разделить на два участка: доля Nмикр в составе Nлаб возрастает при увеличении соотношения C/N в области его относительно низких значений, но, достигнув примерно 80–90%, этот показатель практически не меняется при дальнейшем обеднении органического вещества почвы азотом. Для исследуемых почв пороговое значение C/N, при котором происходит изменение зависимости, составило 20.5, что хорошо соотносится с ранее полученными данными [16].
Рис. 1.
Взаимосвязь между соотношением C/N в органическом веществе почв и долей Nмикр в составе лабильного азота. Здесь и на рис. 2–5: 1 – почвы кустарничковых сообществ, 2 – почвы луговых сообществ.

Зависимость иммобилизации азота микробным сообществом, выраженной как доля Nмикр в составе Nлаб, от содержания Cмикр демонстрирует изменение стратегии микробного сообщества при достижении микробной биомассой величины около 1000 мг Cмикр/кг почвы (рис. 2). Характер зависимости одинаков для почв пустошей и лугов, но положение кривых аппроксимации на графике демонстрирует различие в способности микробных сообществ почв пустошей и лугов иммобилизовать лабильный азот. Микроорганизмы почв пустошей способны усваивать до 90% Nлаб, а в почвах лугов этот показатель составляет 60–65%.
Минерализация органических соединений азота и нитрификация. В соответствии с минимальными концентрациями N-${\text{NH}}_{4}^{ + },$ N-${\text{NO}}_{3}^{ - },$ Cмикр и Nмикр в почве КЛП активность N-минерализации оказалась наименьшей, составив всего 0.35 и 0.31 мг N/кг в сутки в органогенном и минеральном горизонтах соответственно, а интенсивность нитрификации составила 0.09 и 0.07 мг N/кг в сутки (табл. 2). В почве КП, которая содержит больше экстрагируемых органических C и N, а также больше Cмикр и Nмикр в органогенном горизонте, показатели N-минерализации и нитрификации в 2–4 раза выше. При этом несколько возрастает доля нитрифицированного N в составе минерализованного, достигая почти половины в органогенном горизонте и 32% – в минеральном.
Почвы луговых биогеоценозов характеризуются в десятки раз большими активностями N-минерализации и нитрификации, что соответствует гораздо большим концентрациям в них N-${\text{NH}}_{4}^{ + }$ и N-${\text{NO}}_{3}^{ - }.$ Схожая закономерность наблюдается в почвах горно-тундровых экосистем на севере Швеции при переходе от пустошей к лугам [5]. В почвах лугов нитрифицируется более половины минерализованного N, достигая максимального значения 79% в гор. АН почвы осокового луга. Поскольку концентрации N-${\text{NO}}_{3}^{ - }$ в почвах луговых биогеоценозов значительно уступают концентрациям N-${\text{NH}}_{4}^{ + },$ то можно предположить, что растения активно поглощают нитраты.
Активность N-минерализации демонстрирует разную взаимосвязь с количеством микробной биомассы в почвах пустошей и лугов, хотя концентрации Cмикр и Nмикр в них существенно не различаются (рис. 3). В почвах лугов при переходе от минерального горизонта (низкое содержание Cмикр) к органогенному горизонту (высокое содержание Cмикр), N-минерализация резко возрастает. Интенсивный рост характерен до ~1000 мг Cмикр/кг, после чего прирост микробной биомассы уже не приводит к увеличению N-минерализации, вероятно, из-за накопления в микробной биомассе достаточного количества азота для поддержания функционирования микробного сообщества без дополнительной минерализации ресурса. Такой результат согласуется с данными о зависимости между иммобилизацией азота и количеством микробной биомассы в почве, демонстрирующей снижение активности иммобилизации при достижении микробной биомассой величины около 1000 мг Cмикр/кг почвы (рис. 2).
Рис. 3.
Взаимосвязь между микробной биомассой и минерализацией органических соединений азота. Прозрачные фигуры – органогенные горизонты, закрашенные фигуры – минеральные горизонты.
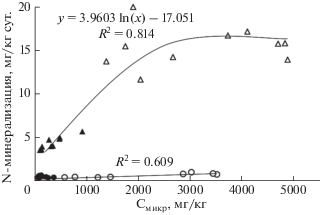
Для почв пустошей характерно очень медленное линейное возрастание N-минерализации при увеличении микробной биомассы. Такое различие может быть связано с тем, что микробные сообщества в почвах пустошей и лугов сильно отличаются. Характерной особенностью тундровых биогеоценозов с доминированием кустарничковой растительности (пустоши) является развитие эктомикоризы и эрикоидной микоризы [13], которая позволяет растениям получать доступ к органическим формам N, минуя стадию минерализации сапротрофными микроорганизмами [15]. Следовательно, в почвах пустошей значительная часть микробной биомассы может быть представлена внешним мицелием микориз. Показано, что в тундровых почвах грибная биомасса может на порядок превышать бактериальную [22], при этом более половины ее приходится на микоризные грибы [24]. Поэтому при определении N-минерализации, когда микоризные грибы в отсутствии растений не проявляют активность, в почвах пустошей мы наблюдаем низкую интенсивность процесса и небольшое ее увеличение при резком возрастании микробной биомассы в органогенных горизонтах.
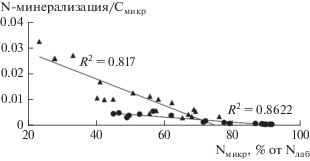
Активность N-минерализации на единицу микробной биомассы уменьшается при увеличении доли Nмикр в составе Nлаб, то есть при уменьшении содержания лабильного немикробного N, являющегося ближним резервом для минерализации (рис. 4). При этом интенсивность снижения больше в почвах луговых сообществ, где концентрации доступного N в целом больше. Таким образом, наши данные подтверждают, что количество N, ассимилированного микробной биомассой, может быть фактором, влияющим на цикл азота в почвах и на доступность неорганических форм элемента растениям [16].
Рис. 4.
Зависимость между долей Nмикр в составе лабильного азота и N-минерализацией на единицу Смикр.
Активность N-минерализации уменьшается также при уменьшении обеспеченности субстрата азотом (соотношение Cобщ/Nобщ) (рис. 5). Снижение N-минерализации на единицу микробной биомассы имеет разный характер в почвах луговых сообществ и сообществ пустошей, что также может быть связано с особенностями состава микробного сообщества в них. В случае луговых сообществ, в диапазоне отношения C/N от 13.8 до 20.5, происходит резкое падение интенсивности N-минерализации, которая остается практически неизменной в диапазоне C/N 20.5–35.2. Таким образом, при уменьшении обеспеченности субстрата азотом его минерализация на единицу углерода микробной биомассы снижается, достигая порогового значения при C/N около 20.5, что хорошо соотносится с зависимостью микробной иммобилизации от обогащения субстрата азотом (C/N) (рис. 1).
Рис. 5.
Взаимосвязь между соотношением C/N в органическом веществе почв и минерализацией органических соединений азота на единицу Смикр.
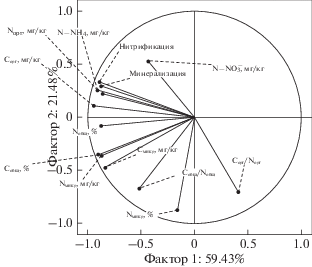
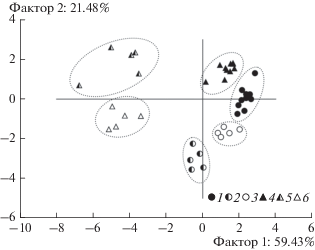
Совокупность различий горно-тундровых почв изученных биогеоценозов, связанных с разной активностью процессов азотного цикла, хорошо демонстрируется проведенным анализом по методу главных компонент, который показывает разделение всех образцов на 6 групп (рис. 6). На 4 разные группы разделились образцы верхних горизонтов исследованных почв, что говорит о существенных различиях в характеристиках их обеспеченности азотом и функционирования микробного сообщества. Образцы из минеральных горизонтов почв разделились на две группы, свидетельствуя, что различия между этими горизонтами принципиальны для почв пустошей и лугов, но слабо выражены в почвах разных сообществ пустошей или лугов.
Рис. 6.
Разделение изученных почв по совокупности свойств в плоскости двух главных компонент. Почвы кустарничковых сообществ: 1 – минеральные горизонты, 2 – органогенный горизонт почвы КП, 3 – органогенный горизонт почв КЛП. Почвы луговых сообществ: 4 – минеральные горизонты, 5 – органогенный горизонт почвы ОЛ, 6 – органогенный горизонт почвы ЗЛ.
Наибольший вклад в фактор-1 вносят показатели Cобщ, Nобщ, Cорг, Nорг, Смикр, Nмикр, N-${\text{NH}}_{4}^{ + },$ N-минерализация и нитрификация. Максимальный вклад в фактор-2 вносят показатели N-${\text{NO}}_{3}^{ - },$ Nмикр в % от Nлаб, соотношения Cобщ/Nобщ и Cорг/Nорг (рис. 7). Суммарно, оба фактора объясняют около 81% выборочной дисперсии, что считается достаточным для надежного разделения изученных объектов.
ЗАКЛЮЧЕНИЕ
Концентрации валовых и лабильных форм С и N в почвах горно-тундровых биогеоценозов возрастают от пустошей к лугам. В этом же направлении происходит обогащение органического вещества азотом, и уменьшаются доли Nорг, Смикр и Nмикр в составе лабильных форм элементов. Доступность N для микробного сообщества выступает в качестве регулятора минерализации органических соединений азота. При низкой доступности N в почвах пустошей микроорганизмы иммобилизуют элемент в биомассе, а при повышении доступности в почвах лугов N-минерализация резко возрастает. В почвах пустошей, где значительная часть микробной биомассы, вероятно, представлена внешним мицелием микоризных грибов, отклик N-минерализации на изменение таких показателей, как количество микробной биомассы, обогащенность органического вещества азотом и доля Nмикр в составе лабильного N выражен гораздо слабее, чем в почвах лугов. Согласно нашим данным, микробное сообщество горно-тундровых почв переходит от минерализации к иммобилизации азота при соотношении С/N в органическом веществе почвы ~20.5 и достижении концентрации углерода микробной биомассы ~1000 мг/кг. Это может объясняться тем, что при большей микробной биомассе микробное сообщество осуществляет рециркуляцию азота в собственном пуле, решая, таким образом, проблему разделения ограниченного азотного ресурса с растениями.
Благодарность. Работа выполнена при поддержке РФФИ (проект 16-04-00544).
Список литературы
Гончарова О.Ю., Бобрик А.А., Матышак Г.В., Макаров М.И. Роль почвенного покрова в сохранении структурной и функциональной целостности северотаежных экосистем Западной Сибири // Сибирский экологический журн. 2016. № 1. С. 3–12.
Макаров М., Кузнецова Е., Малышева Т., Маслов М., Меняйло О. Влияние условий хранения образцов почв на экстрагируемость углерода и азота // Почвоведение. 2017. № 5. С. 569–579.
Макаров М., Леошкина Н., Ермак А., Малышева Т. Сезонная динамика минеральных форм азота в горно-луговых альпийских почвах // Почвоведение. 2010. № 8. С. 969–978.
Макаров М., Малышева Т., Мулюкова О., Меняйло О. Влияние замораживания горно-луговых альпийских почв на процессы трансформации соединений азота и углерода // Экология. 2015. № 4. С. 257–257.
Маслов М., Макаров М. Трансформация соединений азота в тундровых почвах северной Фенноскандии // Почвоведение. 2016. № 7. С. 813–821.
Матышак Г.В., Богатырев Л.Г., Гончарова О.Ю., Бобрик А.А. Особенности развития почв гидроморфных экосистем северной тайги Западной Сибири в условиях криогенеза // Почвоведение. 2017. № 10. С. 1155–1164.
Огнева О.А., Матышак Г.В., Гончарова О.Ю., Бобрик А.А., Пономарева О.Е. Почвы торфяных пятен бугристых торфяников севера Западной Сибири // Криосфера Земли. 2016. Т. ХХ. № 2. С. 61–68.
Bazzaz F.A. The response of natural ecosystems to the rising global CO2 levels // Annual Review Ecology Systematics. 1990. V. 21. P. 167–196.
Dorich R., Nelson D. Evaluation of Manual Cadmium Reduction Methods for Determination of Nitrate in Potassium Chloride Extracts of Soils // Soil Sci. Soc. Am. J. 1984. V. 48. P. 72–75.
Forkel M., Carvalhais N., Rödenbeck C., Keeling R., Heimann M., Thonicke K., Zaehle S., Reichstein M. Enhanced seasonal CO2 exchange caused by amplified plant productivity in northern ecosystems // Science. 2016. V. 351. P. 696–699.
Galloway J.N., Dentener F.J., Capone D.G., Boyer E.W., Howarth R.W., Seitzinger S.P., Asner G.P., Cleveland C.C., Green P., Holland E.A. Nitrogen cycles: past, present, and future // Biogeochemistry. 2004. V. 70. P. 153–226.
Hobbie E., Hobbie J. Natural abundance of 15N in nitrogen-limited forests and tundra can estimate nitrogen cycling through mycorrhizal fungi: a review // Ecosystems. 2008. V. 11. P. 815.
Iversen C.M., Sloan V.L., Sullivan P.F., Euskirchen E.S., McGuire A.D., Norby R.J., Walker A.P., Warren J.M., Wullschleger S.D. The unseen iceberg: plant roots in arctic tundra // New Phytologist. 2015. V. 205. P. 34–58.
Kandeler E. Ammonium // Methods in Soil Biology. 1996. P. 406–408.
Meier I.C., Pritchard S.G., Brzostek E.R., McCormack M.L., Phillips R.P. The rhizosphere and hyphosphere differ in their impacts on carbon and nitrogen cycling in forests exposed to elevated CO2 // New Phytologist. 2015. V. 205. P. 1164–1174.
Mooshammer M., Wanek W., Hämmerle I., Fuchslueger L., Hofhansl F., Knoltsch A., Schnecker J., Takriti M., Watzka M., Wild B. Adjustment of microbial nitrogen use efficiency to carbon: nitrogen imbalances regulates soil nitrogen cycling // Nature Communications. 2014. V. 5. P. 3694.
Murphy C.J., Baggs E.M., Morley N., Wall D.P., Paterson E. Nitrogen availability alters rhizosphere processes mediating soil organic matter mineralisation // Plant and Soil. 2017. V. 417. P. 499–510.
Raab T.K., Lipson D.A., Monson R.K. Non-mycorrhizal uptake of amino acids by roots of the alpine sedge Kobresia myosuroides: implications for the alpine nitrogen cycle // Oecologia. 1996. V. 108. P. 488–494.
Raab T.K., Lipson D.A., Monson R.K. Soil amino acid utilization among species of the Cyperaceae: plant and soil processes // Ecology. 1999. V. 80. P. 2408–2419.
Schimel J.P., Bennett J. Nitrogen mineralization: challenges of a changing paradigm // Ecology. 2004. V. 85. P. 591–602.
Schmidt I.K., Jonasson S., Michelsen A. Mineralization and microbial immobilization of N and P in arctic soils in relation to season, temperature and nutrient amendment // Applied Soil Ecology. 1999. V. 11. P. 147–160.
Schmidt N., Bölter M. Fungal and bacterial biomass in tundra soils along an arctic transect from Taimyr Peninsula, central Siberia // Polar Biology. 2002. V. 25. P. 871–877.
Urcelay C., Bret-Harte M.S., Díaz S., Chapin F.S. Mycorrhizal colonization mediated by species interactions in arctic tundra // Oecologia. 2003. V. 137. P. 399–404.
Voříšková J., Brabcová V., Cajthaml T., Baldrian P. Seasonal dynamics of fungal communities in a temperate oak forest soil // New Phytologist. 2014. V. 201. P. 269–278.
Дополнительные материалы отсутствуют.