Почвоведение, 2019, № 5, стр. 558-569
Распределение углерода и азота в почвенном покрове прибрежной территории Баренцева моря (Хайпудырская губа)
Е. В. Шамрикова 1, *, С. В. Денева 1, О. С. Кубик 1
1 Институт биологии Коми научного центра Уральского отделения РАН
167982 Сыктывкар, Коммунистическая, 28, Россия
* E-mail: shamrik@ib.komisc.ru
Поступила в редакцию 04.05.2018
После доработки 16.08.2018
Принята к публикации 26.09.2018
Аннотация
В почвах ненарушенных ландшафтов побережья Баренцева моря (Хайпудырская губа) методом газовой хроматографии определено содержание общего углерода и азота, объемно-метрическим методом – содержание углерода неорганических соединений. Выделены две группы почв: засоленные маршевые почвы, формирующиеся в условиях периодического затопления приливными и нагонными морскими водами, и почвы тундровых экосистем, подверженные выпадению морских аэрозолей. В первой группе содержание Сорг варьирует по горизонтам от 5 до 75 г/кг, содержание Nобщ – от 1 до 5 г/кг, отношение Cорг/Nобщ – от 10 до 18. В средней части профиля маршевых почв наблюдаются гумусово-аккумулятивные горизонты, погребенные современными морскими отложениями. Во второй группе содержание Сорг составляет 430–470 г/кг, общего азота 4–7 г/кг, отношение Cорг/Nобщ в поверхностных торфяных горизонтах равно 64–95, с глубиной оно уменьшается в 3–7 раз. Более других неорганического углерода содержит почва маршей низкого уровня, затапливаемая в каждый прилив, а в ней – поверхностный горизонт. Массовая доля неорганического углерода варьирует в пределах 4–20% от общего содержания элемента. Источником Снеорг могут быть морская вода и карбонатные породы. Выявлена связь содержания Сорг и Nобщ в почвах с их количеством в современных растительных сообществах. Определенное влияние на содержание Сорг и Nобщ в почвах оказывает жизнедеятельность птиц и поступление органического материала с морскими водами.
ВВЕДЕНИЕ
Активное вмешательство человека в биосферу породило ряд экологических проблем Северного Ледовитого океана и примыкающих к нему территорий. Глобальное потепление вызывает ускоренное таяние льдов, перемещение береговой линии, деградацию мерзлоты, резкую интенсификацию почвенных процессов в маршевой зоне [15, 16, 43, 47, 54, 67]. В этой связи отмечен современный всплеск интереса к исследованию циклов углерода и азота почв экосистем Крайнего севера, в том числе, побережий северных морей. Анализ литературы о почвах восточно-европейской части Российской Арктики [13, 28, 42, 61], севера Швеции [53, 59], о. Шпицберген [74, 75, 81, 83, 84] свидетельствует о широкой вариабельности содержания органического углерода, общего азота и их отношения как для арктических маршей, так и зональных тундровых почв. В целом отмечено резкое уменьшение степени обогащения гумуса азотом в ряду от маршевых почв (Cорг/Nобщ = 1–33) к почвам водоразделов (Cорг/Nобщ = 20–80). Особенно низкое отношение углерода к азоту свойственно орнитогенным почвам маршей. Даже для прибрежных почв, развивающихся под различными типами тундровой растительности и включающих экскременты птиц (показано на примере прибрежных районов о. Шпицберген), отношение Cорг к Nобщ в среднем составляет 9–14 [74, 81].
Прибрежная арктическая зона России, как части циркумполярной цивилизации, на сегодняшний день исследована недостаточно [5, 24, 32]. Наименее изученным остается побережье Баренцева моря [36]. Информация о среднем уровне содержания элементов в почвах является обязательным условием рационального природопользования, необходима для регионального и локального мониторинга [11, 22, 48, 74]. Потребность в первичной пространственно-геохимической характеристике почв бассейна обусловлена также международным значением региона в деле сохранения и поддержания биоразнообразия Арктики в целом. Хайпудырская губа с прилегающими тундровыми участками является местом массового гнездования и линьки гусей, уток, лебедя, важного транзитного и остановочного пункта для птиц, пролетающих Восточно-Атлантическим миграционным путем [47–49, 51, 56, 72, 80]. Эта зона является ключевой территорией для сохранения редких и исчезающих видов пернатых, занесенных в Красные книги Российской Федерации и Ненецкого автономного округа [2, 3, 18, 19, 22].
Цель работы – установление закономерностей распределения содержания углерода органических и неорганических соединений, а также общего азота в почвах побережья Баренцева моря.
ОБЪЕКТЫ И МЕТОДЫ
Район исследований располагается в прибрежной части Хайпудырской губы Баренцева моря. Природные условия и факторы почвообразования исследуемой территории детально описаны ранее [38]. Разнообразие растительных ассоциаций, геоморфологических условий, почвообразующих субстратов, а также специфические климатические условия района определили значительную пестроту почвенного покрова. На исследуемой территории выделено пять наиболее характерных для данной местности участков, которые по уменьшению степени засоленности морскими водами образуют следующий ряд:
– участок I (68°19′49.0″ с. ш., 59°31′05″ в. д.): марши низкого уровня; моноценоз Carex subspathacea (осока обертковидная); почва маршевая примитивная гиттиевая иловато-легкосуглинистая (Tidalic Fluvisols (Loamic, Protosalic)), далее маршевая примитивная гиттиевая почва) со строением профиля: W(0–3)–ACao,h(3–24)–ACao,g(24–67)–СG(67–89)–СG┴(89–97), затапливается регулярно, в каждый прилив. Для почвы характерны фрагментарность гумусового горизонта (W), слабосвязанного рыхлыми корневыми системами, накопление и послойное захоронение грубого и тонкого талассогенного органического вещества, наличие глеевых горизонтов;
– участок II расположен в 100 м от первого вглубь материка (68°19′49.4″ с. ш., 59°31′07.8″ в. д.): марши среднего уровня; осоково-злаковое сообщество с галофитами; почва маршевая дерново-глеевая супесчаная (Tidalic Fluvisols (Arenic, Ochric, Epiprotosalic)), далее маршевая дерново-глеевая почва) со следующим строением профиля: AYao(0–10)–AYh(10–19)–ACao,g(19–30)–СG(30–63)–СG(63–78), подвергается периодическому подтоплению солеными водами во время сизигийных приливов, штормов и нагонов воды. Профиль формируется под влиянием двух ведущих почвенных процессов: дернового – в верхних и глеевого – в нижних горизонтах. Почва отличается хорошо развитой дерниной;
– участок III (68°18′26.5″ с. ш., 59°44′12.8″ в. д.) по расположению аналогичен участку II: марши среднего уровня; разнотравно-злаковое растительное сообщество с галофитами; почва маршевая примитивная дерново-глеевая тяжелосуглинистая (Tidalic Fluvisols (Loamic, Ochric, Epiprotosalic)), подстилаемая супесчаными отложе-ниями, далее почва маршевая примитивная д-ерново-глеевая, строение профиля которой: AYao(0–4)–AYh(4–11)–ACao,h,g(11–30)–СG(30–57)–СG┴(57–66). Для почвы характерны аккумуляция тонкодисперсного органического вещества морского происхождения в подповерхностных органо-минеральных горизонтах, ярко выраженные признаки оглеения нижней части.
Профили всех маршевых почв характеризуется слоистостью. В маршевой примитивной гиттиевой и маршевой примитивной дерново-глеевой почвах на глубине 3–30 см диагностировано погребение развитой осоково-злаковой оторфованной дернины с максимальным количеством слаборазложившихся торфяных прослоек, переплетенных многочисленными корнями, чередующихся заиленными прослойками. Ниже в профиле количество торфяных прослоек уменьшается в пользу минеральной составляющей. На первом участке в почвенных горизонтах отмечено присутствие представителей морской флоры, фауны и продуктов их жизнедеятельности, принесенных водой в результате регулярного чередования приливов и отливов. В пределах всех трех участков наблюдаются признаки активной деятельности – помет, перья, поеди. На втором участке следы их пребывания наименее обильны. В маршевых почвах всех участков присутствие карбонатов морфологически не отмечено. Вскипание отдельных морфонов от действия хлороводородной кислоты (ω(HCl) = 10%) не выражено.
– участок IV (68°20′05.7″ с. ш., 59°33′21.9″ в. д.) расположен на высоком обрывистом берегу, подверженном влиянию засоленных морских вод посредством выпадения морских аэрозолей. Плоскополигональный болотный комплекс (кустарничковое мохово-лишайниковое растительное сообщество); почва торфяная олиготрофная мерзлотная (Cryic Folic Histosols) характеризуется следующим строением профиля: О(0–1)–Т1(1–16)–Т2(16–23)–Т⊥(23–30);
– участок V (68°16′58.9″ с. ш., 59°54′49.5″ в. д.) находится на выровненной водораздельной территории, менее всех подверженной влиянию засоленных морских вод. Почва – торфяно-глеезем криогенно-ожелезненный мерзлотный (Histic Reductaquic Cryosols, далее торфяно-глеезем), профиль которой представлен последовательностью следующих горизонтов: О(0–3)–Т1(3–11)–Т2(11–13)–Gсfтикc(13–27)–G1(27–38)–G2(38–55(69))–G⊥(55(69)–75).
По уменьшению степени засоленности морскими водами рассматриваемые участки можно расположить в следующий ряд: участок I (марши низкого уровня, моноценоз Carex subspathacea) → → участок II (марши среднего уровня, опушечное осоково-злаковое сообщество с галофитами) → участок III (марши среднего уровня, опушечное разнотравно-злаковое сообщество с галофитами) → участок IV (плоскополигональный болотный комплекс,) → участок V (пушицево-кустарничковая моховая тундра). Закономерность в изменении видового состава растительности выражается в резком уменьшении количества специфических видов-галофитов и их обилия за границей зоны влияния морских приливов. На высоких уровнях исследованной территории развиты зональные растительные сообщества, характерные для данного района. Более подробно описание растительности изучаемых участков приведено ранее [38]. Об уменьшении степени засоления свидетельствует и состав жидкой фазы почв. Электропроводность æ водных вытяжек, измеренная при соотношении почва : вода, равном 1 : 5, во всех почвах максимальна в поверхностных горизонтах и последовательно снижается в пределах трех верхних горизонтов. В маршевой примитивной гиттиевой почве она составляет 2.6–5.3 и в маршевой дерново-глеевой – 1.8–4.4 (сильнозасоленные почвы), маршевой примитивной дерново-глеевой – 1.3–2.1 (среднезасоленная), торфяных почвах – <0.1 дСм/м (незасоленные) [38].
Таким образом, почвы можно объединить в две группы, существенно различающиеся по генезису. К первой относятся широко распространенные засоленные маршевые почвы, формирующиеся в условиях периодического затопления приливными и нагонными морскими водами. Вторая группа – почвы тундровых экосистем, подверженные влиянию моря лишь посредством выпадения морских аэрозолей в результате переноса их воздушными массами. Незасоленные тундровые почвы формируются на наиболее высоких позициях рельефа, где доминирующее значение приобретают зональные факторы почвообразования [5, 24, 32].
При проведении полевых исследований в различных ландшафтных условиях были заложены опорные разрезы, основной метод изучения которых – традиционный морфологический анализ вертикального почвенного профиля с последующим отбором проб по генетическим горизонтам в соответствии с требованиями ГОСТа 17.4.4.02-8411.
Химический состав почв приведен в табл. 1. Данные получены в лаборатории Экоаналит, а также отделе “Почвоведение” Института биологии Коми НЦ УрО РАН. Массовая доля общего углерода и азота в почвах измерена методом газовой хроматографии на CHNS-O-элементном анализаторе ЕА 1110 (Carlo Erba, Италия). Относительные погрешности измерения: общего углерода: ±δ = = 3.5, 10, 15 и 23% при содержании общего углерода ω(Собщ) = 30.0–100.0, 5.00–30.0, 2.00–5.00, 0.1–2.00% соответственно; общего азота: ±δ = 11, 20 и 29% при ω(Nобщ) = 0.600–5.00, 0.0400–0.60, 0.0100–0.040% соответственно2. Согласно нормативному документу22, адекватная оценка углерода органических соединений на анализаторе может быть получена для почв с ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ < 6.8. В этом случае выполняется равенство ω(Собщ) = ω(Сорг), так как следовые количества неорганического углерода учитываются в погрешности метода. В образцах почв, где данное равенство имеет место, далее ω(Собщ) приводили как ω(Сорг). В менее кислых почвах ω(Собщ) > ω(Сорг) вследствие присутствия неорганического углерода, в данном случае не выявленного при морфологическом описании. В этой связи для образцов почв с ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ > 6.8 объемно-метрическим методом с помощью кальциметра 08.53 Eijkelkamp (SA07, США-Нидерланды) [ISO 10693]33 выполнено измерение показателя содержания карбонатов в почве. Анализ проведен в замкнутой безвоздушной системе. Определение основано на установлении разницы между двумя уровнями воды в бюретке, которые соответствуют нулевому исходному значению и возрастающему за счет выделения СО2 давлению. Углекислый газ выделяется в ходе реакции взаимодействия образца почвы, содержащего карбонаты и гидрокарбонаты, с хлороводородной кислотой (с(HCl) = = 4 моль/дм3). Массовую долю углерода органических соединений в этих образцах находили по разности общего углерода и углерода неорганических соединений (ω(Снеорг)) ω(Сорг) = ω(Собщ) – – ω(Снеорг). Абсолютная погрешность определения ω(Снеорг) в пересчете на карбонат кальция составляет ±Δ = +2.1 г/кг.
Таблица 1.
Химический состав исследуемых почв побережья Баренцева моря (Хайпудырская губа)
| Горизонт | Глубина, см | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | Массовая доля ω, г/кг | Cорг/Nобщ | *ωИФ, % | |
|---|---|---|---|---|---|---|
| Собщ (Снеорг) | Nобщ | |||||
| Маршевая примитивная гиттиевая иловато-легкосуглинистая почва | ||||||
| W | 0–3 | 7.17 | 9.1 (1.8) | 0.89 | 10 | 11 |
| ACao,h | 3–24 | 5.98 | 41.0 | 3.30 | 14 | 13 |
| ACao,g | 24–67 | 6.82 | 10.7 (0.4) | 0.79 | 15 | 14 |
| СG | 67–89 | 7.19 | 14.4 (0.8) | 0.98 | 16 | 17 |
| Маршевая дерново-глеевая супесчаная почва | ||||||
| AYao | 0–10 | 4.77 | 75.0 | 5.00 | 18 | – |
| AYh | 10–19 | 5.52 | 13.4 | 0.95 | 16 | 11 |
| ACao,g | 19–30 | 3.58 | 4.8 | 0.43 | 13 | 8 |
| СG | 30–63 | 4.10 | 7.1 | 0.57 | 15 | 11 |
| СG | 63–78 | 5.45 | 11.4 | 0.88 | 15 | 14 |
| Маршевая примитивная дерново-глеевая тяжелосуглинистая почва | ||||||
| AYao | 0–4 | 6.21 | 6.1 (0)** | 0.49 | 15 | 18 |
| AYh | 4–11 | 6.46 | 38.0 (0)** | 3.00 | 15 | 19 |
| ACao,h,g | 11–30 | 6.69 | 26.0 (0)** | 1.80 | 17 | 23 |
| СG | 30–57 | 7.20 | 5.3 (0.6) | 0.32 | 17 | 7 |
| Торфяная олиготрофная мерзлотная почва | ||||||
| O | 0–1 | 3.87 | 434.0 | 7.90 | 64 | – |
| T1 | 1–16 | 3.96 | 447.0 | 14.00 | 37 | – |
| Т2 | 16–23 | 3.98 | 444.0 | 18.00 | 29 | – |
| Т⊥ | 23–30 | 4.04 | 468.0 | 20.00 | 27 | – |
| Торфяно-глеезем криогенно-ожелезненный мерзлотный | ||||||
| О | 0–3 | 4.16 | 403.0 | 5.00 | 94 | – |
| Т1 | 3–11 | 3.93 | 409.0 | 6.50 | 73 | – |
| Т2 | 11–13 | 4.43 | 310.0 | 12.50 | 29 | – |
| Gсf,тикc | 13–27 | 5.51 | 3.7 | 0.34 | 13 | 15 |
| G1 | 27–38 | 5.48 | 3.9 | 0.35 | 13 | 16 |
| G2 | 38–55 (69) | 5.53 | 7.5 | 0.50 | 16 | 18 |
| G⊥ | 55 (69)–76 | 5.92 | 4.6 | 0.33 | 18 | 15 |
Измерение значений рН почв проводили на иономере универсальном Анион-4100 (Россия), относительная погрешность измерения +0.1 ед. рН. Оценку массовой доли илистой фракции почв выполняли методом Качинского [1].
Систематика и номенклатура приморских почв северных побережий остается дискуссионной проблемой отечественного почвоведения. В настоящее время разработаны региональные классификации, которые во многом сохраняют существующие классификационные разработки для наиболее сходных с ними континентальных почв с учетом специфики объекта. Во избежание увеличения числа персонифицированных классификаций в данной работе использованы принципы уже опубликованных схем разделения маршевых почв по разным таксономическим единицам [35, 36, 38, 40, 77]. Названия зональных почв даны в соответствии с классификацией и диагностикой почв России [17, 29]. Приведено наименование почв в соответствии с системой мировой базы почвенных ресурсов [21].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Массовая доля углерода неорганических соединений (ω(Снеорг)) колеблется в пределах 0.4–1.8 г/кг (табл. 1), что составляет 4–20% от общего содержания элемента в образцах исследуемых почв побережья с ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ > 6.8. Наиболее засолена почва, расположенная на маршах низкого уровня и затапливаемая в каждый прилив. Максимальное значение ω(Снеорг) свойственно ее поверхностному горизонту. Карбонаты присутствуют и в нижнем горизонте почвы третьего участка. Вероятно, изучаемые маршевые почвы развиты на разных породах: маршевые примитивные – на карбонатных, маршевая дерново-глеевая почва – на бескарбонатной породе. На этом фоне в почве участка I возможен привнос Снеорг и с морской водой. В какой форме поступает углерод неорганических соединений (растворенные гидрокарбонаты, карбонаты, взвеси) в рамках данной работы не установлено.
Особенностью засоленных почв является также и тот факт, что изменение массовой доли органического углерода и общего азота в каждом из профилей тесно взаимосвязано (ω(Nобщ) = = 0.07ω(Сорг) + 0.13, r = 0.99, P = 0.95, табл. 1), что уже было отмечено ранее для бескарбонатных почв [75]. Закономерности изменения показателей зависят от ряда факторов. Например, поступление минеральной массы, приносимой непосредственно морем, либо крупной водной артерией – р. Море-ю, несущей во время приливов большой объем морской воды вглубь материка. Регулярное наслоение и перемешивание материала препятствуют зарастанию территории, в результате чего часть площади первого и третьего участков лишена растительного покрова, и поступление свежих растительных остатков на поверхность почв, формирующихся на таких площадях, ограничено. Это, вероятно, является важнейшей причиной низкого содержания углерода органических соединений и общего азота в поверхностных горизонтах маршевых примитивных почв (ω(Сорг) ~ 7 г/кг, ω(Nобщ) ~ 0.9 г/кг). Существенно более высокие значения данных показателей (30–40 и ~3 г/кг соответственно) отмечены в подповерхностных горизонтах почв, где наблюдается аккумуляция грубого органического вещества (осоково-злаковых растительных остатков, водорослевых выбросов) в виде обособленных прослоев. Есть вероятность, что погребение горизонтов ACao,h (3–24 см) почвы участка I, а также AYh (4–11 см) и ACao,h,g (11–30 см) почвы участка III происходило одновременно. На это указывают сходные значения мощностей горизонтов: мощность малогумусированных поверхностных слоев составляет 3–4 см, органо-минеральной толщи 21 и 26 см соответственно. Если провести ориентировочные расчеты, взяв средний ежегодно отлагающийся нанос в маршевых почвах по 0.35–1.35 см/год [31], то можно предположить, что эти седиментационные процессы протекали в последние 3–7 лет.
Уменьшение содержания Сорг и Nобщ в современных отложениях может быть связано не только с изменением состава и скорости поступления взвешенного материала, но и в некоторой степени со смещением береговой линии в связи с повышением уровня моря. В течение XX столетия средняя скорость повышения глобального уровня Мирового океана составляла в среднем 2, в истекшее десятилетие – 3 мм/год [41]. Согласно последним сценариям [26], наиболее вероятная средняя скорость трансгрессии достигнет 4–5 мм/год. Регионально, в частности в южных районах Печорского моря, можно ожидать, что за счет тектонической составляющей относительные величины подъема уровня будут несколько больше [27]. Таким образом предполагаем, что состав погребенных горизонтов маршевых примитивных почв сходен с поверхностной толщей маршевой дерново-глеевой почвы, которая расположена на более высокой позиции и затапливается лишь в моменты массовых разливов (во время половодья, вызванного весенним таянием снега), что способствует сохранности верхнего гумусово-аккумулятивного горизонта и накоплению в нем элементов ω(Сорг) = 75 г/кг, ω(Nобщ) = 5 г/кг при закономерном уменьшении с глубиной.
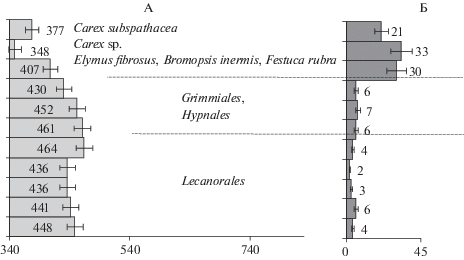
Существенным источником данных элементов в почвах является прибрежная растительность. В зоне непосредственного влияния моря – это специфичная солеустойчивая флора [38, 52, 74, 78]. Ранее в наземной живой биомассе обычных злаков Elymus fibrosus, Bromopsis inermis, Festuca rubra и осок Carex sp. сырых лугов (место сбора – полуостров Канин, побережье Белого моря), а также в растительном материале галофитов Carex subspathacea (арктический приморский циркумполярный вид, характерный для полосы прилива) и Triglochin maritimum (циркумполярный полизональный галофитный вид, характерный для приморских сырых лугов, место сбора – побережье Баренцева моря) было определено содержание органического углерода ω(Сорг) = 350–410 г/кг и общего азота ω(Nобщ) = 21–33 г/кг (рис. 1) [39, 68]. Отношение углерода к азоту фитомассы составляет Cорг/Nобщ = 12–21 (рис. 2). Названные растения встречаются в напочвенном покрове маршей низкого и среднего уровней – на участках I–III [38].
Высокое содержание азота в данных объектах подтверждается и накоплением в них аминокислот, в частности их растворимой фракции, существенно превышающей аналогичный показатель для напочвенного покрова тундровых экосистем (15–50 и менее 1 г/кг) [37, 39]. Аккумуляция в цитозоле осмолитов – растворимых органических, в том числе азотсодержащих, соединений, не токсичных в больших концентрациях для клеточного метаболизма, является проявлением адаптации растений к условиям засоленной среды [55, 70]. Примером может быть накопление “cтрессового субстрата” пролина, который помимо осморегуляции выполняет протекторную функцию, а также является источником азота в постстрессовый период [39, 62, 65, 68, 69, 73]. Одной из причин большего обогащения травянистых растений высоких широт азотом по сравнению со мхами и лишайниками (за исключением цианолишайников в связи с наличием азотфиксирующей цианобактерии в их составе [68]) является хорошо развитая корневая система первых, позволяющая извлекать N из глубинных (вплоть до 30 см) слоев почв [64].
Обогащению всех почв углеродом и азотом (особенно маршевых примитивных почв) способствует активная жизнедеятельность птиц, приобретающая в местах массового гнездования значение одного из факторов почвообразования, поскольку помет птиц состоит из азотсодержащих органических соединений, мочевой, щавелевой, а также неорганических кислот и их солей. Накопление гуано, перьев, яичной скорлупы, тушек птиц оказывает значительное влияние на круговорот C и N. Отношение Cорг/Nобщ гуано птиц по разным источникам составляет менее 8. Разложение аллохтонного органического вещества как экзотермическая реакция приводит к повышению температуры в верхних горизонтах почв [7, 9, 74, 75, 83, 84].
Не следует также полностью исключать поступление углерода и азота за счет биологического материала морских организмов (водорослей, бентоса, рыбы) с одной стороны как части пищевой цепи, обеспечивающей питание перелетных птиц [80, 83, 84], с другой – выносимого на побережье во время приливов [46, 51 ]. Отношение Cорг к Nобщ диатомовых водорослей и перидиний, из которых на 90% состоит фитопланктон Баренцева моря, равен 6–8; копепод (веслоногие ракообразные) – 5 [34], взвешенных частиц, включающих автохтонное и аллохтонное органическое вещество прибрежных вод о. Шпицберген – 6.5–10.7 [81], взвесей морей Северного Ледовитого океана и арктических шельфов – 6.4–8.8 при среднем значении 7.4 [50], морских и пресноводных объектов – 8.3 [71]. Возможно, именно в этой связи отношение Cорг/Nобщ поверхностного гор. W (0–3 см) почвы маршей низкого уровня, где отмечено обилие биоматериала, приносимого морем, имеет минимальное значение Cорг/Nобщ = 10.
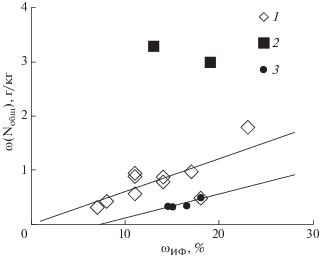
В минеральных горизонтах источником общего азота может быть фиксированный аммоний, а также азот протеинов и близких к ним N-содержащих соединений, адсорбированных глинистыми минералами и гидроксидами Fe [43, 57, 58]. В рамках данной работы недостаточно материала для оценки роли каждого из этих вариантов. На сорбцию азота указывает тесная корреляция между содержанием общего азота и массовой долей илистой фракции, к которой и приурочены упомянутые адсорбенты (ωИФ = 0.06 ω(Nобщ), r = 0.75, рис. 3). Выборка не включает сведения о двух погребенных горизонтах маршевых примитивных почв (ACao,h и AYh), в которых аккумуляцию азота, очевидно, контролируют другие факторы. Этим объектам присуще высокое содержание Cорг, с которым, вероятно, преимущественно и связан азот.
Рис. 3.
Взаимосвязь массовых долей общего азота и илистой фракции в почвах: 1 – погребенные горизонты ACao,h маршевой примитивной гиттиевой и AYh маршевой примитивной дерново-глеевой почвы; 2 – горизонты маршевых почв за исключением погребенных горизонтов; 3 – минеральные горизонты торфяно-глеезема криогенно-ожелезненного мерзлотного.
В целом для почв первых трех участков отношение Cорг/Nобщ = 10–18 (табл. 1), то есть обогащение гумуса азотом засоленных почв оценивается как низкое (11–14) и очень низкое (>14) [25]. Значения Cорг/Nобщ маршевых почв близки к таковым у наземной фитомассы представителей флоры, произрастающих на соответствующих участках, что подтверждает определяющую роль состава растений в направлении процессов гумусообразования. Большая обогащенность гумуса азотом поверхностных горизонтов обеих маршевых примитивных почв связана с поступлением морского биоматериала и помета птиц. Закономерное увеличение Cорг/Nобщ с глубиной в этих почвах от 10 (15) до 19 (17) соответствует ранее полученным результатам [74] и указывает на более быстрое разложение и освобождение в них азота по сравнению с выделением СО2 [43, 66]. В засоленных почвах минерализации азота способствуют нейтральные и близкие к нейтральным значения рН почв, а иммобилизации углерода – повышенная ионная сила раствора, определяющая коагуляцию коллоидных форм органических и органоминеральных соединений.
В профиле маршевой дерново-глеевой почвы отношение Cорг/Nобщ равно 13–18, минимальное значение свойственно срединному горизонту ACao,g (табл. 1). Разнонаправленное изменение отношения углерода к азоту в профилях маршевых почв также было отмечено ранее [43]. Возможно, несколько более высокое значение отношения Сорг и Nобщ в верхнем 20-сантиметровом слое, представляющем собой мощную, слегка оторфованную дернину, обусловлено низкой степенью разложения растительных остатков, а также меньшим поступлением помета и биоматериала моря. Незначительное увеличение отношения Cорг/Nобщ с глубиной по почвенному профилю – аналогично обеим маршевым примитивным почвам.
Региональные особенности морских берегов обуславливают многообразие комбинаций факторов существования приморских экосистем. Разнообразие растительных ассоциаций связано не только c удаленностью от моря, но и рельефом местности. Это определяет возможность формирования участков с зональной тундровой растительностью в непосредственной близости к морю [74, 78]. В нашем исследовании примером тому является торфяная олиготрофная почва.
Верхняя часть профилей обеих зональных почв состоит из органического субстрата, обычно торфа, разной степени разложения. Элементный состав материала, особенно верхних горизонтов торфяных почв, в основном определяется поступающими на поверхность органическими остатками – опадом кустарничков, немногочисленных травянистых растений, и, главным образом, отмирающими частями мохообразных, формирующих подстилку, а также условиями их разложения.
Для зональных растительных сообществ высоких широт характерен круговорот веществ с пониженной биологической активностью. Это является следствием ограниченной продуктивности – небольшого ежегодного прироста, а, следовательно, и поступления органического материала с опадом. Низкие температуры и краткость вегетационного периода, бедность бактериальной флоры препятствуют минерализации отмерших частей тундровых растений, и для всех сообществ тундры характерно существенное накопление мертвых органических остатков, как в надземной части, так и в почве.
Содержание углерода органических соединений у представителей зональной тундровой растительности участков IV и V в 1.2–1.5 раза больше по сравнению с солеустойчивой флорой, а количество общего азота, напротив, в 1.5–2 раза меньше. В частности, массовая доля органического углерода и общего азота мхов порядка Grimmiales и Hypnales, а также лишайников порядка Lecanorales (рис. 1), представленных в мохово-лишайниковом и моховом напочвенном покрове этих участков, равна ω(Сорг) = 430–470, ω(Nобщ) = 4–7 г/кг [38, 68], что совпадает с полученными ранее данными для растений арктических тундр и пустынь [30]. Отношение Сорг и Nобщ наземной живой фитомассы перечисленных растений составляет Cорг/Nобщ = 80–140 (рис. 2), отмерших корней и листьев Eriophorum vaginatum – 70–80, листьев Betula nana около 40 [79], представителей р. Sphagnum – 55–95 [53, 61]. Следует подчеркнуть, что моховой покров исследуемых участков на 75–95% сложен сфагновыми мхами [38].
Количество углерода и азота у представителей тундровой флоры сопоставимо с содержанием элементов в торфяных горизонтах изучаемых почв. В торфяных почвах ω(Сорг) равны 430–470, в растениях – 310–410 г/кг, ω(Nобщ) – 8–20 и 7–13 г/кг соответственно. В торфяно-глееземе отмечена аккумуляция обоих элементов в минеральной надмерзлотной толще в 1.6 раза большая по сравнению с нижележащим мерзлотным горизонтом (табл. 1). Феномен накопления органических веществ в минеральной толще мерзлотных суглинистых почв Восточной Сибири детально рассмотрен ранее Мергеловым и Таргульяном [20]. Надмерзлотную аккумуляцию органического углерода авторы связывают с “мерзлотной ретинизацией гумуса” (вмывание и накопление бесцветного гумуса [4, 6, 10, 12, 14, 23, 33]), а также криогенным массообменном, в частности, криотурбациями (механическое поглощение органического вещества [8, 44, 63, 76, 82]). Авторы [20] подчеркивают важность изучения и учета этого явления при оценке глобальных процессов эмиссии и секвестирования углерода почвами, поскольку ареал подобных объектов в северном полушарии велик [20]. Стоит отметить, что содержание органического углерода в минеральной части профиля взаимосвязано с содержанием азота (ω(Nобщ) = 0.04ω(Сорг) + 0.17, r = 0.95), в органогенных горизонтах эта связь отсутствует.
Кроме того, общее содержание азота в минеральных горизонтах торфяно-глеезема тесно коррелирует с массовой долей илистой фракции (рис. 3), как это было отмечено выше для непогребенных горизонтов маршевых почв. Однако линия тренда взаимосвязи двух показателей описывается иным уравнением ω(Nобщ) = 0.04ω(Сорг) + 0.17 (r = = 0.97) и отличается от аналогичного уравнения для засоленных почв лишь свободным членом, свидетельствуя о меньшем закреплении азота илистой фракцией торфяно-глеезема.
Отношение элементов в поверхностных горизонтах водораздельных почв составляет Cорг/Nобщ = = 70–94, что сопоставимо со значениями показателя доминирующих видов растений изучаемых участков. В торфяной олиготрофной почве в пределах торфяной толщи происходит заметное (2.5 раза) уменьшение отношения углерода к азоту с глубиной. В минеральной части профиля торфяно-глеезема по сравнению с поверхностью отношение Cорг/Nобщ меньше в 6–7 раз, максимальное значение показателя свойственно надмерзлотной толще. Природа органического вещества надмерзлотного горизонта требует дальнейшего изучения.
Ранее при исследовании торфяных мерзлотных почв лесотундры и южной тундры европейского северо-востока России с разным уровнем залегания мерзлоты исследователями также был отмечен характерный четко выраженный максимум Cорг/Nобщ в поверхностных горизонтах, значения которого достигают 75 [13, 28]. Наиболее высоким отношением Cорг/Nобщ (до 80–100) характеризуются поверхностные слабо разложившиеся торфяные горизонты, в растительном покрытии которых господствуют сфагновые мхи [42, 60, 61]. В пределах деятельного слоя торфяных мерзлотных почв зафиксировано резкое снижение показателя Сорг/Nобщ с глубиной. Сильнокислая реакция среды почв, источники которой были детально рассмотрены ранее [37], а также анаэробные условия подавляют минерализацию азота. Темпы его утилизации ниже, чем органического углерода, что связано с бóльшей потерей С по сравнению с N из-за вымывания растворимых органических соединений, возможно, в первую очередь безазотистых, а также неэквивалентного выделения углерод- и азотсодержащих газов. В результате происходит постепенное обогащение мертвых растительных остатков азотом [30], что обратно процессам, протекающим в маршевых почвах.
Шведские коллеги, представляющие близкие результаты по содержанию органического углерода и общего азота, объясняют уменьшение значений отношения Cорг/Nобщ в профиле торфяных мерзлотных почв (68°21′ с. ш., 18°49′ в. д.) сменой омбротрофных условий на минератрофные. Период, охватывающий смену типов питания геокриологического комплекса, составляет 40–45 лет [45]. Причиной смены типа питания может быть деградация мерзлоты в период температурных оптимумов, приводящая к просадке бывшего бугра, и/или его (бугра) разрушение вследствие эрозии и превращение в мочажину. На уменьшение относительного показателя вследствие деградации многолетней мерзлоты, способствующей усилению гумификации, так же указывали [53, 59].
ЗАКЛЮЧЕНИЕ
Выделено две группы прибрежных почв Хайпудырской губы Баренцева моря, существенно различающихся по генезису: засоленные маршевые почвы, формирующиеся в условиях периодического затопления приливными и нагонными морскими водами и почвы тундровых экосистем, подверженные влиянию моря лишь посредством выпадения морских аэрозолей.
В первой группе содержание Сорг варьирует по горизонтам от 5 до 75 г/кг, содержание Nобщ – от 1 до 5 г/кг, отношение Cорг/Nобщ – от 10 до 18. Источниками элементов в почвах являются прибрежная солеустойчивая флора (Cорг/Nобщ = 12–21), а также гуано и биологический материал морских организмов (Cорг/Nобщ = 2–10). В почвенных профилях изменение Cорг/Nобщ с глубиной разнонаправлено. Значения Сорг и Nобщ во всех маршевых почвах тесно взаимосвязаны ω(Сорг) = 0.1ω(Nобщ) + 0.1, r = 0.99. Выявлена корреляция между содержанием общего азота и массовой долей илистой фракции ωИФ = 0.06 ω(Nобщ) (r = 0.75). Выборка не включает сведения о гумусово-аккумулятивных горизонтах, погребенных современными морскими отложениями и наблюдаемых в средней части профилей.
Во второй группе содержание Сорг составляет 430–470 г/кг, общего азота 4–7 г/кг, отношение Cорг/Nобщ в поверхностных торфяных горизонтах равно 64–95, что сопоставимо со значениями показателя фитомассы доминирующих видов растений участков (Cорг/Nобщ = 60–140). В пределах деятельного слоя торфяных мерзлотных почв Cорг/Nобщ уменьшается в 3–7 раз в связи с более эффективной минерализацией Cорг по сравнению с N и обогащением мертвых растительных остатков последним. Взаимная связь содержания элементов выражена только в минеральной части профиля торфяно-глеезема криогенно-ожелезненного мерзлотного ω(Сорг) = 20.9ω(Nобщ) – 3, r = 0.95. Отмечено накопление элементов в минеральной надмерзлотной толще по сравнению с нижележащим мерзлотным горизонтом в 1.6 раза. Общее содержание азота в минеральных горизонтах этой почвы тесно коррелирует с массовой долей илистой фракции ωИФ = 0.06 ω(Nобщ) – 0.5, r = 0.97.
Содержание неорганического углерода маршевых почв равно ω(Снеорг) = 0.4–1.8 г/кг, что составляет 4–20% от общего содержания элемента. Более других неорганического углерода содержит маршевая примитивная гиттиевая почва, затапливаемая в каждый прилив, а в ней – поверхностный горизонт. Источниками Снеорг являются карбонатные породы, а в почве маршей низкого уровня, дополнительно, морская вода.
Благодарность. Исследования выполнены в рамках проекта № 18-9-4-13 Комплексной программы УрО РАН (2018–2020) “Междисциплинарный синтез – ключ к познанию функционирования приморских арктических экосистем России в свете нарастающих угроз современности (на примере Баренцева моря)” (номер госрегистрации: АААА-А17-117112870194-6).
Список литературы
Агрохимические методы исследования почв. М.: Наука, 1975. 656 с.
Ануфриев В.В. НЕ-003 Хайпудырская губа, о‑ва Большой Зеленец, Долгий, Матвеев // Ключевые орнитологические территории России. Т. 1. Ключевые орнитологические территории международного значения в европейской России. М.: Союз охраны птиц России, 2000. С. 78.
Ануфриев В.В., Глотов А.С. Гусеобразные птицы островов Печорского моря // Русский орнитологический журнал. 2012. Т. 21. № 720. С. 111–113.
Арчегова И.Б. Гумусообразование на севере европейской территории СССР. Л.: Наука, 1985. 136 с.
Бахмет О.Н. Особенности почв скальных ландшафтов Карельского побережья Белого моря // Уч. зап. Петрозаводского гос. ун-та. Сер. Сельскохозяйственные науки. 2013. № 6. С. 55–59.
Васильевская В.Д. Почвообразование в тундрах Средней Сибири. М.: Наука, 1980. 235 с.
Горячкин С.В. Почвенный покров Севера (структура, генезис, экология, эволюция). М.: ГЕОС, 2010. 414 с.
Губин С. Динамика верхней границы многолетней мерзлоты и проблема ретинизации гумуса в тундровых почвах Северо-Востока России // Проблемы эволюции почв. Пущино, 2003. С. 168–172.
Добровольский В.В. О геохимической специфике почвообразования на морских и океанических островах и побережьях // Почвоведение. 1991. № 4. С. 89–102.
Еловская Л.Г. Классификация и диагностика мерзлотных почв Якутии. Якутск, 1987. 172 с.
Жарикова Е.А. Геохимическая характеристика почв восточного побережья Северо-Сахалинской низменности // Почвоведение. 2017. № 1. С. 40–47.
Игнатенко И.В. Почвы восточно-европейской тундры и лесотундры. М.: Наука, 1979. 279 с.
Каверин Д.А., Пастухов А.В., Лаптева Е.М., Биази К., Марущак М., Мартикайнен П. Строение и свойства почв многолетнемерзлых торфяников юго-востока Большеземельской тундры // Почвоведение. 2016. № 5. С. 542–556.
Караваева Н.А. Тундровые почвы Северной Якутии. М.: Наука, 1969. 208 с.
Касимов Н.С., Касатенкова М.С., Геннадиев А.Н., Лычагин М.Ю. Современная геохимическая эволюция лагунно-маршевых ландшафтов западного Прикаспия // Почвоведение. 2012. № 1. С. 9–20.
Касимов Н.С., Лычагин М.Ю., Крооненберг С.Б. Геохимическая индикация циклических колебаний уровня Каспия // Вестник Моск. ун-та. Сер. География. 2011. № 2. С. 72–77.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Лавриненко О.В., Лавриненко И.А. Эколого-динамические ряды сообществ соленых и солоноватых маршей побережья Баренцева моря // IX Галкинские Чтения: Мат-лы конф. (5–7 февраля 2018 г. г. Санкт-Петербург). СПб, СПбГЭТУ “ЛЭТИ”, 2018. С. 134–137.
Лавриненко О.В., Петровский В.В., Лавриненко И.А. Локальные флоры островов юго-восточного побережья Баренцева моря // Ботанический журнал. 2016. Т. 101. № 10. С. 1144–1190.
Мергелов Н.С., Таргульян В.О. Процессы накопления органического вещества в минеральной толще мерзлотных почв приморских низменностей Восточной Сибири // Почвоведение. 2011. № 3. С. 275–287.
Мировая реферативная база почвенных ресурсов 2014. Международная система почвенной классификации для диагностики почв и создания легенд почвенных карт. Исправленная и дополненная версия 2015 / Научные редакторы перевода: М.И. Герасимова, П.В. Красильников. ФАО и МГУ им. М.В. Ломоносова, 2017.
Московченко Д.В. Биогеохимические особенности верховых болот Западной Сибири // География и природные ресурсы. 2006. № 1. С. 63–70.
Ногина Н.А. Почвы Забайкалья. М.: Наука, 1964. 314 с.
Орешникова Н.В., Красильников П.В., Шоба С.А. Маршевые почвы Карельского берега Белого моря // Вестн. Моск. ун-та. Сер. 17, почвоведение. 2012. № 4. С. 13–20.
Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. М.: Изд-во Моск. ун-та, 1990. 325 с.
Павлидис Ю.А. Возможные изменения уровня океана в начале третьего тысячелетия // Океанология. 2003. № 3. С. 441–446.
Павлидис Ю.А., Никифоров С.Л., Огородов С.А., Тарасов Г.А. Печорское море: прошлое, настоящее и будущее // Океанология. 2007. № 6. С. 927–939.
Пастухов А.В., Кноблаух К., Яковлева Е.В., Каверин Д.А. Маркеры трансформации органического вещества в мерзлотных бугристых болотах на европейском Северо-Востоке // Почвоведение. 2018. № 1. С. 49–62. doi https://doi.org/10.1134/S1064229318010131
Полевой определитель почв России. М.: Почв. ин-т им. В.В. Докучаева, 2008. 182 с.
Родин Л.Е., Базилевич Н.И. Динамика органического вещества и биологический круговорот зольных элементов и азота в основных типах растительности Земного шара. М.: Наука, 1965. 264 с.
Сафьянов Г.А. Эстуарии. М.: Мысль, 1987. 189 с.
Сидорова В.А., Святова Е.Н., Цейц М.А. Пространственное варьирование свойств маршевых почв и их влияние на растительность (Кандалакшский залив) // Почвоведение. 2015. № 3. С. 259–267. doi https://doi.org/10.7868/S0032180X15030119
Фоминых Л.А. Особенности почвообразования в Колымских тундрах // Почвоведение. 1997. № 8. С. 917–926.
Хорн Р. Морская химия (структура воды и химия гидросферы). М.: Мир, 1972. 400 с.
Цейц М.А., Добрынин Д.В. Морфогенетическая диагностика и систематика маршевых почв Карельского Беломорья // Почвоведение. 1997. № 4. С. 411–416.
Черноусенко Г.И., Орешникова Н.В., Украинцева Н.Г. Засоление почв побережья северных и восточных морей России // Почвоведение. 2001. № 10. С. 1192–1206.
Шамрикова Е.В., Денева С.В., Кубик О.С., Пунегов В.В., Кызъюрова Е.В., Боброва Ю.И., Зуева О.М. Кислотность органогенных горизонтов арктических почв побережья Баренцева моря // Почвоведение. 2017. № 11. С. 1325–1335. doi https://doi.org/10.7868/ S0032180X17110107
Шамрикова Е.В. Денева С.В., Панюков А.Н., Кубик О.С. Свойства почв и характера растительности побережья Хайпудырской губы Баренцева моря // Почвоведение. 2018. № 4. С. 401–412. doi https://doi.org/10.7868/S0032180X18040020
Шамрикова Е.В., Кубик О.С., Денева С.В., Панюков А.Н. Растворимые органические соединения представителей солеустойчивой флоры // Мат-лы VII Всерос. науч. конф. с межд. участием “Гуминовые вещества в биосфере”. 2018.
Шляхов С.А. Классификация почв морских побережий. Владивосток, 1996. 35 с.
ACIA, Impacts of Warming Arctic: Arctic Climate Impact Assessment. Cambridge University Press, 2002. 140 p.
Andersson R.A., Meyers P., Hornibrook E., Kuhry P., Mörth C.-M. Elemental and isotopic carbon and nitrogen records of organic matter accumulation in a Holocene permafrost peat sequence in the East European Russian Arctic // J. Quaternary Science. 2012. V. 27. № 6. P. 545–552. doi https://doi.org/10.1002/jqs.2541
Bai J., Ouyang H., Deng W., Zhu Y., Zhang X., Wang Q. Spatial distribution characteristics of organic matter and total nitrogen of marsh soils in river marginal wetlands // Geoderma. 2005. V. 124. P. 181–192. doi https://doi.org/10.1016/j.geoderma.2004.04.012
Bockheim J.G., Tarnocai C. Recognition of cryoturbation for classifying permafrost-affected soils // Geoderma. 1998. V. 81. P. 281–293.
Broder T., Blodau C., Biester H., Knorr K. H. Peat decomposition records in three pristine ombrotrophic bogs in southern Patagonia // Biogeosciences. 2012. V. 9. P. 1479–1491. doi https://doi.org/10.5194/bg9-1479-2012
Cesário M. Teresa, Fonseca M., Manuela R., Marques Mafalda M., de Almeida M. Catarina M.D. Marine algal carbohydrates as carbon sources for the production of biochemicals and biomaterials // Biotechnology Advances. 2018. V. 36. Is. 3. P. 798–817. https://org/ doi https://doi.org/10.1016/j.biotechadv.2018.02.006
Domínguez-Tejo E., Metternicht G., Johnston E., Hedge L. Marine Spatial Planning advancing the Ecosystem-Based Approach to coastal zone management: A review // Marine Policy. 2016. V. 72. P. 115–130. http://dx.doi.org/https://doi.org/ 10.1016/j.marpol.2016.06.023
Eliasson K., Ulfarsson G.F., Valsson T., Gardarsson S.M. Identification of development areas in a warming Arctic with respect to natural resources, transportation, protected areas, and geography // Futures. 2017. V. 85. P. 14–29. http://dx.org/10.1016/j.futures.2016.11.005
Eriksen E., Gjøsæter H., Prozorkevich D., Shamray E., Dolgov A., Skern-Mauritzen M., Stiansen J.E., Kovalev Yu., Sunnanå K. From single species surveys towards monitoring of the Barents Sea ecosystem // Progress in Oceanography. 2017. P. 1–11. http://dx.org/10.1016/ j.pocean.2017.09.007
Frigstad H., Andersen T., Bellerby R.G.J., Silyakova A., Hessen D. Variation in the seston C : N ratio of the Arctic Ocean and pan-Arctic shelves // J. Marine System, 2014. V. 129. P. 214–223. http://dx.org/10.1016/ j.jmarsys.2013.06.004
Harris C.M., McTigue N.D., McClelland J.W., Dunton K.H. Do high Arctic coastal food webs rely on a terrestrial carbon subsidy? // Food Webs. 2018. V. 15. P. 1–14. https://org/https://doi.org/10.1016/j.fooweb.2018.e00081
Himabindua Y., Chakradhar Th., Reddy M.C., Kanygin A., Redding K.E., Chandrasekhar Th. Salt-tolerant genes from halophytes are potential key players of salt tolerance in glycophytes // Environmental and Experimental Botany. 2016. V. 124. P. 39–63. http://dx.org/ 10.1016/j.envexpbot.2015.11.010
Hodgkinsa S.B., Tfaily M.M., McCalley C.K., Logan T.A., Crill P.M., Saleska S.R., Rich V.I., Chanton J.P. Changes in Arctic peat chemistry boost CH4 release // Proc. of the National Academy of Sciences. 2014. V. 111. № 16. P. 5819–5824. doi https://doi.org/10.1073/pnas.1314641111
IPCC Fourth Assessment Report: Climate Change. Geneva, Switzerland. 2007. 18 p.
Ishrat M., Hassan Md. I., Ahmad F., Islam A. Sugar osmolytes-induced stabilization of RNase A in macromolecular crowded cellular environment // Int. J. Biological Macromolecules. 2018. V. 115. P. 349–357. https://org/https://doi.org/10.1016/j.ijbiomac.2018.04.073
Kashulina G., Reimann C., Finne T.E., Halleraker J.H., Äyräs M., Chekushin V.A. The state of the ecosystems in the central Barents Region: scale, factors and mechanism of disturbance // The Science of the Total Environment. 1997. V. 206. P. 203–225. doi.org/https://doi.org/10.1016/ S0048-9697(97)80011-3
Kleber M. Minerals and carbon stabilization: towards a new perspective of mineralorganic interactions in soils // 19th World Congress of Soil Science, Soil Solutions for a Changing World 1–6 August 2010. Brisbane, Australia. 2010. Published on DVD.
Kleber P., Sollins R., Sutton M. A conceptual model of organo-mineral interactions in soils: self-assembly of organic molecular fragments into zonal structures on mineral surfaces // Biogeochemistry. 2007. V. 85. P. 9–24. doi https://doi.org/10.1007/s10533-007-9103-5
Kokfelt U., Reuss N., Struyf E., Sonesson M., Rundgren M., Skog G., Rosen P., and Hammarlund D. Wetland development, permafrost history and nutrient cycling inferred from late Holocene peat and lake sediment records in subarctic Sweden // J. Paleolimnol. 2010. V. 44. P. 327–342. doi https://doi.org/10.1007/s10933-010-9406-8
Krüger J.P., Leifeld J., Alewell C. Degradation changes stable carbon isotope depth profiles in palsa peatlands // Biogeosciences. 2014. V. 11. P. 3369–3380. https://org/https://doi.org/10.5194/bg-11-3369-2014
Kuhry P., Vitt D.H. Fossil carbon/nitrogen ratios as a measure of peat decomposition // Ecology. 1996. V. 77. № 1. P. 271–275.
Mansour M.M.F., Ali E.F. Evaluation of proline functions in saline conditions // Phytochemistry. 2017. V. 140. P. 52–68. http://dx.org/10.1016/j.phytochem.2017.04.016
Michaelson G.J., Dai X.Y., Ping C.L. Organic matter and bioactivity in Cryosols o Arctic Alaska // Cryosols. 2004. P. 463–477.
Oulehle F., Rowe E.C., Myška O., Chuman T., Evans C.D. Plant functional type affects nitrogen use efficiency in high-Arctic tundra // Soil Biology and Biochemistry. 2016. V. 94. P. 19–28. http://dx.org/10.1016/j.soilbio.2015.11.008
Rabbani G., Choi I. Roles of osmolytes in protein folding and aggregation in cells andtheir biotechnological applications // International J. of Biological Macromolecules. 2018. V. 109. P. 483–491. https:// org/https://doi.org/10.1016/ j.ijbiomac.2017.12.100
Rao P.S.C., Jessup R.E., Reddy K.R. Simulation of nitrogen dynamics in flooded soils // Soil Science. 1984. № 138. P. 54–62.
Ríos I., Bouza P.J., Bortolus A., Alvarez M. del P. Soil-geomorphology relationships and landscape evolution in a southwestern Atlantic tidal salt marsh in Patagonia, Argentina // J. South American Earth Sciences. 2018. V. 84. P. 385–398. https://org/ https://doi.org/10.1016/ j.jsames.2018.04.015
Shamrikova E.V., Kubick O.S., Kaverin D.A., Pastuhov A.V., Zavarzina A.G., Punegov V.V. Soluble organic compounds as a regulator of biochemical processes in the North (Electronic resource) // Dissolved Organic Matter (DOM): Properties, Applications and Behavior. New York: Nova science publishers, 2017. P. 55–80.
Sharma R., Bhardwaj R., Thukral A.K., Handa N., Kaur R., Kumar V. Osmolyte Dynamics: New Strategies for Crop Tolerance to Abiotic Stress Signals / Ed.: P. Ahmad. Emerging Technologies and Management of Crop Stress Tolerance. 2014. V. 2. Chapter 17. P. 405–430. http://dx.org/10.1016/B978-0-12-800875-1.00017-X
Singh L.R., Poddar N.K., Dar T.A., Kumar R., Ahmad F. Protein and DNA destabilization by osmolytes: The other side of the coin // Life Sciences. 2011. V. 88. P. 117–125. doi https://doi.org/10.1016/j.lfs.2010.10.020
Sterner R.W., Andersen T., Elser J.J., Hessen D.O., Hood J.M., McCauley E., Urabe J. Scale-dependent carbon:nitrogen:phosphorus seston stoichiometry in marine and freshwaters // Limnol. Oceanogr. 2008. № 53. P. 1169–1180.
Stramska M., Bialogrodzka J. Satellite observations of seasonal and regional variability of particulate organic carbon concentration in the Barents Sea // Oceanologia. 2016. V. 58. Is. 4. P. 249–263. http://dx.org/ 10.1016/j.oceano.2016.04.004
Szepesi Á., Szőllősi R. Mechanism of Proline Biosynthesis and Role of Proline Metabolism Enzymes Under Environmental Stress in Plants // Plant Metabolites and Regulation Under Environmental Stress. 2018. Chapter 17. P. 337–353. https://org/https://doi.org/10.1016/B978-0-12-812689-9.00017-0
Szymański W. Chemistry and spectroscopic properties of surface horizons of Arctic soils under different types of tundra vegetation – A case study from the Fuglebergsletta coastal plain (SW Spitsbergen) // Catena. 2017. V. 156. P. 325–337. http://dx.org/10.1016/j.catena.2017.04.024
Szymanski W., Wojtun B., Stolarczyk M., Siwek J., Wascinska J. Organic carbon and nutrients (N, P) in surface soil horizons in a non−glaciated catchment, SW Spitsbergen // Polish Polar Research. 2016. V. 37. № 1. P. 49–66. doi https://doi.org/10.1515/popore?2016?0006
Tedrow J.C.F. Soils of the polar landscapes. New Brunswick, NJ: Rutgers Univ. Press, 1974. 638 p.
Tseits M.A., Dobrynin D.V. Classification of Marsh Soils in Russia // Eurasian Soil Science. 2005. V. 38. Suppl. 1. P. 544–548.
Virtanen T., Ek M. The fragmented nature of tundra landscape // International J. Applied Earth Observation and Geoinformation. 2014. V. 27. P. 4–12. http://dx.org/10.1016/j.jag.2013.05.010
Wang P., Ruijven J., Heijmans M.M.P.D., Berendse F., Maksimov Ayal, Maximov T., Mommer L. Short-term root and leaf decomposition of two dominant plant species in a Siberian tundra // Pedobiologia – J. Soil Ecology. 2017. V. 65. P. 68–76. http://dx.org/10.1016/j.pedobi.2017.08.002
Wassmann P., Reigstad M., Haug T., Rudels B., Car-roll M.L., Hop H., Gabrielsen G.W., Falk-Petersen S., Denisenko S.G., Arashkevich E., Slagstad D., Pavlova O. Food webs and carbon flux in the Barents Sea // Progress in Oceanography. 2006. V. 71. P. 232–287. https:// org/https://doi.org/10.1016/j.pocean.2006.10.003
Zaborska A., Włodarska-Kowalczuk M., Legeżyńska J., Jankowska E., Winogradow A., Deja K. Sedimentary organic matter sources, benthic consumption and burial in west Spitsbergen fjords – Signs of maturing of Arctic fjordic systems? // J. Marine Systems. 2018. V. 180. P. 112–123. http://dx.org/10.1016/j.jmarsys.2016.11.005
Zimov S.A., Davydov S.P., Voropayev Yu.V., Prosiannikov S.F., Semiletova I.V. et al. Winter bioticactivity and production of CO2 in Siberian soils: A factor in the greenhouse effect // J. Geophys. Res. 1993. V. 98. P. 5017–5023.
Zmudczyńska-Skarbek K., Balazy P. Following the flow of ornithogenic nutrients through the Arctic marine coastal food webs // J. Marine Systems. 2017. V. 168. P. 31–37. http://dx.org/10.1016/j.jmarsys.2016.12.006
Zmudczyńska-Skarbek K., Balazy P., Kuklinski P. An assessment of seabird influence on Arctic coastal benthic communities // J. Marine Systems. 2015. V. 144. P. 48–56. http://dx.org/10.1016/j.jmarsys.2014.11.013
Дополнительные материалы отсутствуют.