Почвоведение, 2019, № 6, стр. 734-742
Экофизиологическая характеристика психротолерантных актиномицетов тундровых и лесных ландшафтов
В. В. Прокопенко 1, Г. М. Зенова 1, *, Н. А. Манучарова 1
1 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: zenova38@mail.ru
Поступила в редакцию 09.02.2018
После доработки 26.05.2018
Принята к публикации 24.10.2018
Аннотация
Исследовали актиномицетные комплексы почв и растительных субстратов тундры и тайги России и Финляндии. Молекулярно-биологическим методом (FISH) оценен метаболически активный компонент представителей группы Actinobacteria. В прокариотном микробном сообществе растительных субстратов тундры и тайги при инкубировании субстрата при 5°С биомасса метаболически активных психротолерантных представителей филогенетической группы Actinobacteria составляет 34% от биомассы всех бактерий, а при температуре 20°С эта доля увеличивается до 56%. В условиях низких температур у психротолерантных актиномицетов наблюдается активный рост и развитие как субстратного, так и воздушного мицелия. Численность выделенных психротолерантных актиномицетов составляет тысячи и десятки тысяч КОЕ/г для таежных мхов Финляндии, достигает миллионов КОЕ/г для тундровых цветковых растений на полуострове Таймыр в России, и убывает в ряду: торфяная почва > растения > моховые разрастания > очес. Длина мицелия актиномицетов с тундровых растений варьирует в пределах от 98 м/г при 5°С до 291 м/г при 20°С, в таежных моховых разрастаниях – от 120 до 180 м/г соответственно. Психротолерантный актиномицетный комплекс в основном представлен неокрашенными видами р. Streptomyces, обладающими такими экофизиологическими особенностями, как изменение окраски субстратного и воздушного мицелия, появление пигментации, увеличение скорости роста при повышении температуры инкубирования. Более 60% от всех выделенных из таежных мхов Финляндии актиномицетов составили психротолерантные представители р. Micromonospora.
ВВЕДЕНИЕ
Почвенные актиномицеты традиционно считались мезофильными организмами, которые с трудом адаптируются к низким температурам. Однако в последнее десятилетие в литературе появляется все больше работ, посвященных выделению психротолерантных мицелиальных актинобактерий из холодных мест обитания, в том числе из полярных и тундровых почв и холодных фьордов, антарктических лишайников [9, 14]. Эндофитные психротолерантные комплексы актиномицетов обнаружены при исследовании арктоальпийских видов растений тундры Финляндии, а также выделены из арктических почв и водных экосистем Лапландии [10–12].
Актиномицеты играют важную роль в круговороте органического вещества в природе, препятствуют росту некоторых патогенов ризосферы растений и разлагают сложные полимерные соединения благодаря своим внутриклеточным ферментам. Почвенные актинобактерии вносят основной вклад в сохранение буферной способности почв и являются агентами биоконтроля почвенной среды, так как участвуют в фиксации азота и разложении высокомолекулярных соединений, таких как углеводороды, в загрязненных почвах [6].
Психротолерантные актиномицеты в холодных условиях окружающей среды обладают значительным потенциалом продукции биологически активных веществ, что имеет важное значение для биотехнологии [8, 13].
Исследования актиномицетов, адаптированных к низким температурам, позволяют расширить пределы наших представлений об экологических нишах, занимаемых мицелиальными актинобактериями. В настоящее время актуальной задачей является выявление среди холодостойких видов актиномицетов продуцентов новых биологически активных веществ. Адаптированные к холоду биологически активные вещества обладают многими преимуществами: активностью при низких температурах, возможностью вызывать реакции с достаточно высокой скоростью, энергосбережением, термической защитой продуктов и лучшим их качеством [7].
Тем не менее, сведений о распространении психротолерантных актиномицетов в растительных субстратах и почвах наземных экосистем в литературе немного, они изучены недостаточно. Своевременной является проблема определения функциональной активности и экофизиологических свойств мицелиальных актинобактерий в условиях низких температур, поскольку они составляют значительную часть гидролитического комплекса почв и растительных субстратов северных регионов.
Цель работы – характеристика таксономических и функциональных особенностей метаболически активных психротолерантных представителей филума Actinobacteria тундровых и таежных растительных субстратов и почв.
ОБЪЕКТЫ И МЕТОДЫ
Образцы для исследования отобрали в северных регионах России и Финляндии в различных климатических зонах (табл. 1). Исследовали тундровые цветковые растения на полуострове Таймыр, мхи и очес на поверхности криоземов в Центральном Ямале и мохово-лишайниковой тундре в районе г. Воркуты, таежные мхи и лишайники на подзоле иллювиально-железистом в районе оз. Пяйянне, о‑ва Пайатсало в Финляндии, очес сфагновых мхов торфяной олиготрофной почвы Тверской области, торфяной окультуренной почвы Московской области, мхи и лишайники на дерново-подзолистой почве Калужской области в России.
Таблица 1.
Характеристика объектов исследования
| Субстрат для выделения актиномицетов, название почвы | Подзона | Место отбора образцов |
|---|---|---|
| Цветковые растения на тундровой глеевой почве: 1. Dryas punctata 2. Trisetum sibiricum 3. Papaver pulminatum 4. Minuartia arctica 5. Oxyria digyna 6. Oxytropis adamsiana |
Типичная тундра | П-ов Таймыр, пос. Тарея Россия |
| Мох и очес на поверхности торфяно-криозема типичного | Центральный Ямал, Россия | |
| Мох на поверхности криозема грубогумусного глееватого | Типичная (мохово-лишайниковая) тундра | Район г. Воркута, Россия |
| Мхи на подзоле иллювиально-железистом: 1. Hylocomium splendens 2. Pleurozium shreberi 3. Dicranum scoparium 4. Polytrichum juniperinum 5. Sanionia uncinata Лишайник Подзол иллювиально-железистый |
Типичная тайга | О-в Пайатсало, район оз. Пяйянне, Финляндия |
| Очес сфагновых мхов торфяной олиготрофной почвы: 1. Sphagnum fuscum 2. Sphagnum magellanicum |
Южная тайга | Тверская область, Западнодвинский район, Россия |
| Образцы торфяной окультуренной почвы 50 и 100 лет сельскохозяйственного освоения | Московская область, Дмитровский район, Россия | |
| Мхи на дерново-подзолистой почве: 1. Pleurozium shreberi 2. Polytrichum commune 3. Plagiomnium cuspidatum 4. Dicranum tauricum Лишайники: 1. Hypogymnia physodes 2. Parmelia sulcata 3. Xanthoria parietina |
Калужская область, Тарусский район, Россия |
Ниже приводятся описания исследуемых почв. Образцы почв отбирали из верхнего горизонта с глубины 0–5 см.
Тундровые почвы. Торфяно-криозем типичный (Histic Cryosol). Образцы отобрали в мохово-кустарничково-травяной тундре на территории Центрального Ямала на водоразделе. Профиль почвы: мох–О–Т1–ВСg. Значения рН находятся в диапазоне от 4 до 7, возрастая вниз по профилю.
Криозем грубогумусный глееватый (Haplic Cryosol) на территории мохово-лишайниково-кустарничковой тундры, окруженной болотными западинами, в районе г. Воркуты. Растительность представлена лишайником, голубикой, ерником, ивой и осоками. рН в исследуемом горизонте достигает 4.5.
Таежные почвы. Подзол иллювиально-железистый (Albic Podzol). Образцы отобрали на территории сосняка-черничника-зеленомошника вблизи оз. Пяйянне на о-ве Пайатсало южной части Финляндии. Почва кислая, значения pH водной вытяжки варьируют от 3.4 до 4.2. Сорг 0.5–1%. Почвенный профиль: O–E–BHF–C. Характеризуется относительно светлой окраской иллювиального горизонта, содержащего не более 2% гумуса. Содержание гумуса в подзолистом горизонте около 0.5–1%, состав фульватный.
Торфяная олиготрофная почва (Fibric Histosol). Образцы отобрали из верхового грядово-мочажинного полого-выпуклого болотного массива около д. Петрилово Западнодвинского района Тверской области. Образцы торфа отобрали из наиболее увлажненного участка, где концентрируется сток со значительной площади болотного массива, занятого шейхцериво-сфагновым микроландшафтом. Залежь сложена бедными верховыми торфами с низкой зольностью. В моховом ярусе присутствуют Sphagnum fuscum (Schimp) Kling и Sph. Magellanucum Brid.
Торфоземы, развитые на мощной древесной торфяной залежи (Fibric Histosols), расположены на мощных древесных торфах, подстилаемых залежью травяного и осокового торфа Яхромской поймы. Морфологический профиль следующий: гор. А пах характеризуется землистым темно-коричневым или коричневым цветом; верхний горизонт имеет мощность около 20 см с постепенным переходом от окультуренного горизонта к малоизмененному древесному или древесно-травяному торфу. Степень разложения окультуренного торфа обычно высока и достигает около 40%.
Метод посева на твердые питательные среды использовали для выделения и дифференцированного учета актиномицетов из растительных суспензий. Растертую надземную или подземную части растения массой 1 г после десорбирования растиранием в ступке (3 мин) помещали в колбу со 100 мл стерильной водопроводной воды, далее готовили разведение 1 : 300 и проводили посев на чашки с питательной средой Гаузе 1 [1]. В питательную среду Гаузе 1 добавляли нистатин (50 мкг/мл среды) для ограничения роста микромицетов.
Посевы инкубировали при температурах 5, 20 и 28°С до появления видимых колоний. Дифференцированный учет различных морфотипов колоний выполняли при микроскопировании на чашках с последующим выделением в чистую культуру на среду Гаузе 1. Выделенные культуры актиномицетов идентифицировали согласно определителю актиномицетов Гаузе с соавт. [1] с использованием культуральных, морфологических и физиологических признаков.
Температурные границы роста психротолерантных и мезофильных актиномицетов, принятые в работе, следующие: для мезофильных актиномицетов – диапазон роста от 20 до 42°С, оптимум роста при 28°С. Для психротолерантных актиномицетов – диапазон роста от 0 до 37°С с оптимумом от 5 до 20°С.
Длину мицелия актиномицетов определяли люминесцентно-микроскопическим методом [4]. Почвенную суспензию (разведение 1 : 100), предварительно обработанную на ультразвуковой установке УЗДН-19 (сила тока 0.40 A, частота 15 кГц) в течение 3 мин, наносили на тщательно обезжиренные предметные стекла и равномерно распределяли петлей на площади 4 см2. Препараты высушивали на воздухе и фиксировали легким нагреванием над пламенем газовой горелки, после чего окрашивали раствором акридина оранжевого (1 : 10 000, 2–4 мин). Окрашенные препараты высушивали при комнатной температуре. При микроскопировании на препарат наносили каплю воды и покрывали обезжиренным покровным стеклом. Препараты просматривали на люминесцентном микроскопе Mikroskop Axioskop 2 Plus Carl Zeizz (Германия) со светофильтром “set 09”.
Измеряли длину мицелия актиномицета в 100 полях зрения для каждого варианта опыта и рассчитывали по формуле:
где М – длина мицелия в 1 г образца, мкм; а – средняя длина мицелия в поле зрения люминесцентного микроскопа, мкм; n – разведение наносимой суспензии, р – площадь поля зрения микроскопа.При расчете биомассы учитывали, что 1 м сухого мицелия актиномицетов диаметром 0.5 мкм имеет массу 3.9 × 10–8 г [4].
Флуоресцентный метод in situ гибридизации с рРНК-специфичными флуоресцентно-мечеными олигонуклеотидными зондами (FISH – fluorescent in situ hybridization) использовали для оценки разнообразия и численности метаболически активных представителей филогенетической группы Actinobacteria почвенных и растительных субстратов. Использование метода FISH позволило учесть живые, метаболически активные клетки представителей филогенетической группы Actinobacteria в исследуемых образцах. Окраска препаратов красителем акридиновым оранжевым дала возможность оценить общую численность клеток микроорганизмов в образцах, включая покоящиеся формы.
Опыт проводили по следующей методике [2]:
1. Почвенную суспензию (1 : 10) обрабатывали ультразвуком (2 мин, сила тока 0.40 А, частота 22 кГц). Клетки микроорганизмов отделяли от крупных частичек почвы трехкратным центрифугированием при 1 тыс. оборотов в течение 10 мин. Суспензию, полученную за три цикла обработки, центрифугировали при 10 000 об./мин в течение 10 мин. Полученный осадок заливали стерильной дистиллированной водой до объема 2 мл.
2. Фиксацию образцов осуществляли с использованием формальдегида в качестве фиксирующего агента. 2 мл суспензии центрифугировали при 10 000 об./мин в течение 5 мин, полученный осадок ресуспензировали в 0.5 мл фосфатного буфера (NaCl – 8.0 г, КС1 – 0.2 г, Na2HPО4 – 1.44 г, NaH2PО4 – 0.2 г, Н2О – 1 л, рН 7.0), добавляли 1.5 мл 4%-ного раствора формальдегида в фосфатном буфере и инкубировали при комнатной температуре на качалке в течение 1.5 ч. Фиксированный материал собирали центрифугированием (8000 об./мин в течение 2 мин), промывали два раза фосфатным буфером, ресуспензировали в смеси этанола и фосфатного буфера (1 : 1) и до анализа хранили при –20°С.
3. Суспензию фиксированного образца в объеме 1 мкл наносили на предметные стекла для гибридизации с окошками, разделенными тефлоновым покрытием. Нанесенные на стекла фиксированные препараты клеток обрабатывали раствором лизоцима (10 мг в 1 мл 0.05 М EDTA и 0.1 М TRIS HC1, 1 : 1, рН 8.0) для увеличения проницаемости клеточных стенок бактерий. Полученные препараты выдерживали в течение 12–24 ч при комнатной температуре или в течение 1 ч при 37°С, затем обрабатывали последовательно в серии растворов этанола (50, 80 и 100%). Для гибридизации использовали набор рРНК-специфичных для группы Actinobacteria олигонуклеотидных зондов, с последовательностью нуклеотидов HGC69a-1CY3 TAT AGT TAC CAC CGC СGT, HGC69a-2 TAT AGT TAC GGC CGC CGT.
Синтез зондов, меченных флуоресцентным красителем СуЗ, осуществлялся компанией Синтол (Москва, Россия). Гибридизацию препаратов с флуоресцентно-мечеными зондами проводили в соответствии с методикой Amann (1995) при температуре 46°С [5].
По завершении процедуры гибридизации препараты докрашивали водным раствором акридина оранжевого (разведение 1 : 10 000, 2–4 мин). Избыток флуорохрома удаляли в процессе промывки, для чего стекла погружали на 10 мин в кюветы с дистиллированной водой. Препараты анализировали с использованием люминесцентного микроскопа ZEIZZ Mikroskop Axioskop 2 plus (Германия) со светофильтрами Filter set 15 для зондов и Filter set 09 для окраски акридиновым оранжевым. Численность микроорганизмов в образцах определяли путем учета количества гибридизованных с зондами клеток в 32 полях зрения микроскопа на одной ячейке.
Филогенетическое положение выделенных культур определяли на основании секвенирования гена 16S рРНК. Выделение ДНК из актиномицетной биомассы проводили с использованием набора реактивов Wizard Genomic DNA Purification Kit, технологии Promega, США, согласно рекомендациям производителя, с незначительными модификациями [3]. Получение полноразмерной копии гена проводили на приборе Mastercycler personal (Eppendorf 11F, Германия) с использованием праймеров: 11F 5'-AGAGTTTGATCMTGGCTCAG-3' 1492R 5'-TACGGYTACCTTGTTACGACTT-3', где M = C или A, Y = C или Т.
Объем амплификационной смеси составлял 50 мкл и имел следующий состав: 1×-буфер ДНК полимеразы BioTaq (17 мМ (NH4)2SO4, 67 мМ трис-HCl, pH 8.8, 2 мМ MgCl2), 12.5 нмоль каждого из dNTP, 50 нг ДНК-матрицы, 5 пмоль соответствующих праймеров (11F и 1492R), 3 ед. ДНК полимеразы BioTaq (Диалат ЛТД, Россия).
Температурно-временной профиль ПЦР: первый цикл – 94°С × 9 мин, 55°С × 1 мин, 72°С × 2 мин, последующие 30 циклов – 94°С × × 1 мин, 55°С × 1 мин, 72°С × 2 мин, завершающий цикл – 72°С × 7 мин.
Первичный анализ сходства нуклеотидных последовательностей гена 16S рНК изучаемого штамма был проведен с помощью программы BLAST. Построение бескорневых филогенетических деревьев исследуемых актиномицетов производили с помощью методов, реализованных в пакете программ MEGA.
Численность метаболически активных представителей филогенетической группы Actinobacteria определяли по формуле:
где M – численность метаболически активных клеток в 1 г растительного субстрата, a – среднее количество метаболически активных клеток в поле зрения люминесцентного микроскопа, P – площадь поля зрения микроскопа, равная 39 740 мкм2.Статистическую обработку данных проводили с помощью программы Statistica 6.0. Все пробы анализировали в 5-кратной повторности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении процедур учета численности и выделения актиномицетов из тундровых и таежных растительных субстратов полагали, что при инкубировании посевов при 5 и 20°С выделяются психротолерантные актиномицеты, при 28°С – мезофильные актиномицеты.
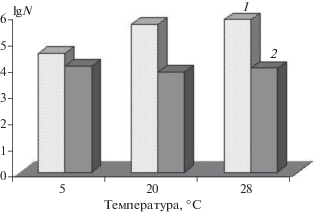
Численность психротолерантных актиномицетов, выделенных из цветковых растений тундры на полуострове Таймыр, колебалась в пределах от десятков до сотен тысяч КОЕ/г растительного материала и превышала численность почвенных актиномицетов, которые составили в тундровой глеевой почве России тысячи и десятки тысяч КОЕ/г почвы. При этом в моховых разрастаниях и очесе на поверхности криоземов в тундре на полуострове Ямал и мохово-лишайниковой тундре в районе г. Воркуты (Россия) не выявлено психротолерантных актиномицетов при инкубировании посевов при 5°C в отличие от таежных мхов Финляндии, где они обнаруживались при аналогичных условиях инкубирования посевов. При 20°С из образцов тундровых мхов и очеса, отобранных в России, выделялись психротолерантные актиномицеты в сопоставимом числе с мезофильными формами (рис. 1).
Рис. 1.
Численность актиномицетов, выделенных из растительных субстратов наземных экосистем тундры и тайги при разных температурах инкубирования: а – 5°С, б – 20°С, в – 28°С: 1–3 – цветковые растения тундры Dryas punctata, T-risetum sibiricum, Papaver pulvinatum (полуостров Таймыр), 4 – очес, 5 и 6 – мхи на поверхности торфяно-криозема типичного (Центральный Ямал), 7 – мох на поверхности криозема грубогумусного глееватого (район г. Воркута), 8 – очес на поверхности торфяной олиготрофной почвы (Тверская область), 9 – мох Plagiomnium cuspidatum на дерново-подзолистой почве (Калужская область), 10–12 – мхи Hylocomium splendens, Dicranum scoparium, Sanionia uncinata на поверхности подзола иллювиально-железистого о-ва Пайатсало (Финляндия).

В актиномицетном комплексе таежных мхов Финляндии численность психротолерантных актиномицетов превышала численность мезофильных форм и достигала десятков тысяч КОЕ/г растительного материала.
Сравнивая численность актиномицетов, выделенных из растительных субстратов тундры и тайги при разных температурах (рис. 2), можно увидеть, что психротолерантные актиномицеты выделялись активнее всего из образцов мха, взятых вблизи оз. Пяйянне на о-ве Пайатсало в Финляндии. Больше всего психротолерантных актиномицетов выделялось из образца мха 1 – Hylocomium splendens (Гилокомий блестящий).
Рис. 2.
Общая численность психротолерантных актиномицетов, выделенных из тундровых цветковых растений (1 – полуостров Таймыр, Россия) и таежных мхов (2 – о-в Пайатсало, Финляндия) при различных температурах.
Культуры, выделенные из образцов таежных мхов Финляндии, по фенотипическим признакам принадлежали к родам Streptomyces и Micromonospora (табл. 2). Наибольшее видовое разнообразие выделяемых актиномицетов наблюдалось в поверхностном слое (0–5 см) подзола иллювиально-железистого под мхами при инкубировании посевов при температуре 20 и 28°С. Помимо стрептомицетов из почвы Финляндии были выделены пигментированные оранжево-красные (шт. ФП.20.7) и бордово-розовые (шт. ФП.20.1, ФП.20.2, ФП.20.3) микромоноспоры. Пигментированные актиномицеты р. Micromonospora доминировали в почве Финляндии при всех температурах инкубирования посевов. При 20°С в почве появлялись актиномицеты секции и серии Helvolo-Flavus Helvolus.
Таблица 2.
Список выделенных культур
| Актиномицет, штамм | Район выделения, субстрат |
|---|---|
| Streptomyces griseus шт. ДВ5.2 S. сhrysomallus шт. ДВ5.3 S. lavendulae шт. ДН5.1 |
Таймырская тундра, растение дриадника Dryas punctata (Дриада точечная) |
| S. сandidus шт. ЛН5.1 S. хanthocidicus шт. ЛВ.20.1 S. violaceoruber шт. ЛВ.20.2 |
Таймырская тундра, растение луга Papaver pulvinatum (Мак подушковидный) |
| S. albolongus шт. ФМ1.20.4, ФМ5.20.1, ФМ3.20.2, ФМ4.20.2 S. varsoviensis шт. ФМ5.20.4, ФМ4.20.1 S. albus шт. ФМ5.20.10 S. alborubidus ФМ2.20.1 S. bikiniensis шт. ФМ5.20.3 S. diastatochromogenes шт.ФМ3.20.4 S. capuensis ФМ5.5.1 S. tumemacerans ФМ5.5.2 S. sindenensis ФЛ.20.2 S. albidochromogenes ФП.20.3 S. griseoplanus ФП.20.8 S. albolongus ФП.20.10 S. antimycoticus ФП.20.11 Micromonospora spp. ФП.20.1, ФП.20.2, ФП.20.6, ФП.20.7 |
Типичная тайга вблизи оз. Пяйянне, о-в Пайатсало, Финляндия. Образцы таежных мхов (ФМ1, ФМ2, ФМ3, ФМ4, ФМ5), лишайника (ФЛ) и подзола иллювиально-железистого под мхами (ФП) |
| S. parvus мох18 FR846234 | Южная тайга. Тверская область. Сфагновый очес на поверхности олиготрофной торфяной почвы |
| S. violaceoruber шт. N4.20.1.А, N4.20.1.В S. aurantiacus шт. N5.20.3 S. griseolus шт. N3.5.1, N6.5.1, N1.5.1 S. nodosus шт. N5.5.2, N1.5.2 |
Южная тайга. Московская область. Дмитровский район. Торфяная окультуренная почва |
| КМ1.20.1 КМ2.20.2 КЛШ.20.1 |
Южная тайга. Калужская область. Тарусский район. Образцы мхов и лишайников на дерново-подзолистой почве |
Из некоторых образцов таежных мхов (3 Dicranum scoparium и 5 Sanionia uncinata) при инкубировании посевов при 5°С были выделены редкие психротолерантные актиномицеты секции Imperfectus, не образующие воздушного мицелия на минеральной среде Гаузе 1. Согласно своим морфологическим и культуральным свойствам, выделенные психротолерантные актиномицеты были определены как S. capuensis и S. tumemacerans. При инкубировании посевов при 20 и 28°С в большом количестве выделялись актиномицеты, принадлежащие к роду Streptomyces, таксономическим секциям и сериям Cinereus Achromogenes и Albus Albus.
После многократных пересевов культур морфологические и культуральные свойств выделенных актиномицетов сохранялись.
Во всех образцах таежных мхов Финляндии (кроме образца 2 Pleurozium shreberi) при инкубировании посевов при 5°С доминируют психротолерантные актиномицеты рода Micromonospora, составляя более 60% от всех выделенных актиномицетов.
Из почвы под мхами актиномицеты рода Micromonospora выделяются в меньшем количестве, чем из образцов мхов Финляндии, что, вероятно, может быть обусловлено наличием во мхах по сравнению с почвой большего количества веществ, являющихся источниками питания для микромоноспор.
В биотопе дриадника на полуострове Таймыр наиболее распространенными актиномицетами являются Cinereus Achromogenes и Helvolo-Flavus Helvolus, а в актиномицетном комплексе растений луга – Helvolo-Flavus Helvolus и Albus Albus. Из растения луга Papaver pulvinatum были выделены редкие фиолетовые актиномицеты секции и серии Cinereus Violaceus, а также розовые актиномицеты Roseus Lavendulae-roseus.
Применение дисперсионного анализа показало, что температура инкубирования посевов достоверно влияет на разнообразие выделяемых из растений актиномицетов. Величина разнообразия определяется температурой инкубирования культур. Вклад температуры в общую дисперсию составляет 30%. Отмечено снижение видового разнообразия при инкубировании посевов в температурном ряду 28 > 20 > 5°С.
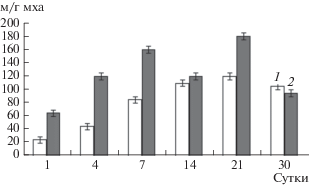
Наблюдение за динамикой развития мицелия психротолерантных актиномицетов производили в микрокосмах с таежным мхом Pleurozium shreberi, отобранным вблизи оз. Пяйянне на о-ве Пайатсало в Финляндии (рис. 3). Инкубировали микрокосмы с таежным мхом при температурах 5 и 20°С. Микробную сукцессию инициировали увлажнением (60% полной влагоемкости). Исследования показали, что мицелий психротолерантных актиномицетов растет и развивается в микрокосмах с таежным мхом Pleurozium shreberi как при 5, так и при 20°С. Длина мицелия в таежном мхе Pleurozium shreberi составляла 120 м/г на четвертые сутки инкубирования при 20°С, увеличиваясь до 160 м/г на седьмые сутки опыта. На 14-е сут инкубирования при 5°С мицелий достигал 110 м/г, увеличиваясь до 120 м/г к 21-м сут, и сохранялся на этом уровне до конца эксперимента. К 21-м сут инкубирования при 20°С длина мицелия достигала 180 м/г.
Рис. 3.
Динамика длины мицелия актиномицетов в ходе сукцессии, инициированной увлажнением таежного мха Pleurozium shreberi на подзоле иллювиально-железистом вблизи оз. Пяйянне на о-ве Пайатсало в Финляндии: 1 – 5°С, 2 – 20°С.
Доля психротолерантных актиномицетов в бактериальном комплексе, выделенном из почвы и таежных мхов Финляндии (Dicranum scoparium и Polytrichum juniperinum) при инкубировании посевов при 5°С, составила 70–80%. В остальных случаях при инкубировании посевов из таежных мхов при 5, 20 и 28°С наблюдалось доминирование бактерий (более 70% от всех выделенных микроорганизмов).
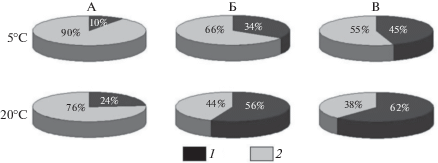
Исследование прокариотного микробного сообщества растительных субстратов тундры и тайги методом FISH показало, что биомасса метаболически активных психротолерантных представителей филогенетической группы Actinobacteria составляет 34% от биомассы всех бактерий в прокариотном микробном сообществе таежных мхов при инкубировании субстрата при 5°С, а при 20°С эта доля увеличивается до 56% (рис. 4).
Рис. 4.
Доля психротолерантных метаболически активных представителей филума Actinobacteria (1) от биомассы бактерий (2) в прокариотных микробных сообществах тундровых цветковых растений на полуострове Таймыр, Россия (А), таежных мхов на о-ве Пайатсало в Финляндии (Б) и мхов на дерново-подзолистой почве Калужской области в России (В).
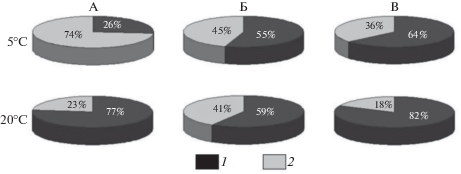
Психротолерантные метаболически активные мицелиальные актинобактерии по биомассе превышали одноклеточные, составляя больше половины актиномицетного комплекса таежных мхов Финляндии, как при 5°С (55%), так и при 20°С (59%) (рис. 5). При инкубировании тундровых цветковых растений полуострова Таймыр при 5°С одноклеточные представители филума Actinobacteria доминировали над мицелиальными и их доля составила 74%, но при повышении температуры до 20°С наблюдалось существенное увеличение доли мицелиальных актинобактерий до 77%.
Рис. 5.
Соотношение мицелиальных (1) и одноклеточных (2) представителей филогенетической группы Actinobacteria в прокариотных микробных сообществах тундровых растений на полуострове Таймыр, Россия (А), таежных мхов на о-ве Пайатсало в Финляндии (Б) и мхов на дерново-подзолистой почве Калужской области в России (В).
Из растительных субстратов и торфяной почвы были выделены культуры актиномицетов, которые идентифицированы по фенотипическим и/или молекулярно-генетическим признакам.
Таким образом, составлена коллекция культур психротолерантных актиномицетов, выделенных из наземных экосистем тундры и тайги. Выделенные культуры психротолерантных актиномицетов отнесены к родам Streptomyces и Micromonospora.
Температурный диапазон роста выделенных и исследованных культур стрептомицетов лежит в области 5–37°C с оптимумом роста в области 20°C, что свидетельствует об их психротолерантности.
Доля психротолерантных метаболически активных представителей филума Actinobacteria в моховых разрастаниях Финляндии составляет 34% от биомассы метаболически активных представителей домена Bacteria в прокариотном микробном сообществе при инкубировании субстрата при 5, 20°С доля метаболически активных представителей филума Actinobacteria от биомассы бактерий увеличивается до 56%.
В моховых разрастаниях Финляндии метаболически активные психротолерантные мицелиальные и одноклеточные актинобактерии в филуме Actinobacteria прокариотного микробного сообщества составляют примерно равные доли по биомассе как при инкубировании субстрата при 5°С, так и при инкубировании субстрата при 20°С.
ЗАКЛЮЧЕНИЕ
Численность психротолерантных актиномицетов в исследуемых субстратах наземных экосистем тундры и тайги варьирует от десятков тысяч до миллионов КОЕ/г субстрата и убывает в ряду: торфяная почва > растения > моховые разрастания > очес.
Психротолерантный актиномицетный комплекс растительных субстратов тундровых и таежных наземных экосистем представлен родами Streptomyces и Micromonospora.
Выявлены следующие экофизиологические особенности, свойственные актиномицетам в условиях низких температур: стабильность морфологических и культуральных свойств выделенных актиномицетов после многократных пересевов культур, появление более яркой окраски воздушного и субстратного мицелия и образование темных растворимых пигментов при повышении температуры инкубирования с 5 до 20°С. При низкой температуре инкубирования посевов (5°C) отмечено доминирование неокрашенных форм актиномицетов секций и серий Albus Albus и Cinereus Chromogenes. При 5°С в образцах мхов Dicranum scoparium и Sanionia uncinata выявлены актиномицеты S. capuensis и S. tumemacerans, секции Imperfectus, не образующие воздушный мицелий.
Образование темно-бурых и буровато-красных растворимых пигментов отмечено у большинства психротолерантных штаммов, выделенных из таежных мхов Финляндии, при повышении температуры инкубирования с 5 до 20°С.
Из образцов торфяной окультуренной почвы Яхромской поймы (Дмитровский район, Московская область) при температуре 20°С в большом количестве были выделены синие пигментированные стрептомицеты S. violaceoruber шт. N4.20.1.A и N4.20.1.B, интенсивно окрашивающие всю минеральную среду на чашках Петри в синий цвет.
Экспериментально доказано, что выделенные из исследованных растительных и почвенных субстратов тундровых и таежных наземных экосистем стрептомицеты по температурным предпочтениям являются психротолерантными.
Список литературы
Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А., Терехова Л.П., Максимова Т.С. Определитель актиномицетов. М.: Наука, 1983. С. 244.
Манучарова Н.А., Власенко А.Н., Менько Е.В., Звягинцев Д.Г. Специфика хитинолитического микробного комплекса в почвах, инкубируемых при различных температурах // Микробиология. 2011. Т. 80. № 2. С. 219–229.
Манучарова Н.А., Кутейникова Ю.В., Иванов П.В., Николаева С.К., Трофимов В.Т., Степанов П.Ю., Тяпкина Е.В., Липатов Д.Н., Степанов А.Л. Молекулярный анализ гидролитической прокариотной компоненты почв, загрязненных нефтепродуктами и восстановленных внесением хитина // Микробиология. 2017. Т. 86. № 3. С. 373–382. https://doi.org/10.7868/ S0026365617030119
Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. 303 с.
Amann R.I., Ludwig W., Schleifer K.-H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation // Microbiol. Rev. 1995. № 59. P. 143–169.
Bhatti A.A., Haq S., Bhat R.A. Actinomycetes benefaction role in soil and plant health // Microb. Pathog. 2017. V. 111. P. 458–467.
Fendrihan S., Negoita T. Psychrophilic microorganisms as important source for biotechnological processes // Adaptation of Microbial Life to Environmental Extremes / Eds. H. Stan-Lotter, S. Fendrihan. N.Y.: Springer Wien, 2012. P. 133–158.
Gesheva V. Production of antibiotics and enzymes by soil microorganisms from the windmill islands region, Wilkes Land, East Antarctica // Polar Biol. 2010. V. 33. № 10. P. 1351–1357.
Gesheva V., Negoita T. Psychrotrophic microorganism communities of Haswell Island, Antarctica, and their biosynthetic potential // Polar Biol. 2012. V. 35. № 2. P. 291–297.
Mannisto M.K., Haggblom M.M. Characterization of psychrotolerant heterotrophic bacteria from Finnish Lapland // Syst. Appl. Microbiol. 2006. V. 29. № 3. P. 229–243.
Mannisto M.K., Tiirola M., Haggblom M.M. Bacterial communities in Arctic fjelds of Finnish Lapland are stable but highly pH-dependent // FEMS Microbiol. Ecol. 2007. V. 59. № 2. P. 452–465.
Nissinen R.M., Mannisto M.K., van Elsas J.D. Endophytic bacterial communities in three arctic plants from low arctic fell tundra are cold-adapted and host-plant specific // FEMS Microbiol. Ecol. 2012. V. 82. № 2. P. 510–522.
Raja A., Prabakaran P., Gajalakshmi P. Isolation and screening of antibiotic producing psychrophilic actinomycetes and its nature from Rothan Hill soil against Streptococcus sp. // Res. J. Microbiol. 2010. V. 5. № 1. P. 44–49.
Selbmann L., Zucconi L., Ruisi S., Grube M., Cardinale M., Onofri S. Culturable bacteria associated with Antarctic lichens: affiliation and psychrotolerance // Polar Biol. 2010. № 33. P. 71–83.
Дополнительные материалы отсутствуют.


