Почвоведение, 2019, № 6, стр. 722-733
Влияние нонилфенолов на численность и таксономическую структуру почвенного микробного сообщества
И. Л. Кузикова 1, *, Т. Б. Зайцева 1, А. А. Кичко 2, С. В. Зиновьева 1, А. Д. Руссу 1, Н. В. Маячкина 1, Н. Г. Медведева 1
1 Санкт-Петербургский научно-исследовательский центр экологической безопасности РАН
197110 Санкт-Петербург, ул. Корпусная, 18, Россия
2 Всероссийский научно-исследовательский институт сельскохозяйственной микробиологии
196608 Санкт-Петербург, Пушкин 8, ш. Подбельского, Россия
* E-mail: ilkuzikova@ya.ru
Поступила в редакцию 23.06.2018
После доработки 12.09.2018
Принята к публикации 28.11.2018
Аннотация
В условиях модельных экспериментов проведен комплексный анализ влияния гормоноподобного ксенобиотика нонилфенола на численность, таксономическую структуру микробного сообщества и фитотоксичность дерново-подзолистой суглинистой почвы (Eutric Albic Retisol (Abruptic, Loamic, Aric, Ochric)). Объектом исследования являлись верхние горизонты дерново-подзолистой суглинистой почвы, отобранные в Ленинградской области. Численность и групповой состав почвенной микробиоты определяли общепринятыми в почвенной микробиологии методами высева почвенной суспензии на стандартные питательные среды. Таксономический состав микробного сообщества изучали с использованием метода пиросеквенирования (Illumina MiSeq). Содержание нонилфенолов в почвенных образцах определяли методом высокоэффективной жидкостной хроматографии. Фитотоксичность почвенных образцов оценивали по отношению к тест-культуре пшенице мягкой (Tríticum aestívum). Установлено, что нонилфенолы вызывают дозо- и время зависимое изменение численности основных физиологических групп почвенных микроорганизмов. В присутствии нонилфенолов происходит значительное увеличение количества гетеротрофных и олиготрофных микроорганизмов, а также бактерий, толерантных к нонилфенолу. Наиболее чувствительными к нонилфенолам являются актиномицеты и спорообразующие бактерии. Под воздействием нонилфенолов сокращается видовое разнообразие почвенного микробоценоза. В таксономической структуре микробного сообщества доминирующим филумом становится Proteobacteria (78%). В загрязненной нонилфенолами почве происходит снижение интенсивности процессов микробиологической минерализации азотсодержащих органических веществ, а также замедление процессов иммобилизации азота. Выявлена фитотоксичность образцов почвы, загрязненной высокой дозой нонилфенолов 300 мг/кг, в течение месячного инкубирования. Полученные результаты могут быть использованы при разработке научно-обоснованной методологии биоремедиации почв, загрязненных гормоноподобными токсикантами. Изменения филогенетической структуры почвенных микробоценозов могут выступать в качестве чувствительного биоиндикатора экологического состояния почв.
ВВЕДЕНИЕ
Среди загрязнителей окружающей среды в последние годы выделяют гормоноподобные ксенобиотики, которые могут быть причиной серьезных репродуктивных аномалий у живых организмов, вызывая у них феминизацию, снижение фертильности, гермафродитизм [32]. Свойство гормоноподобных ксенобиотиков вмешиваться в репродуктивный процесс обусловлено их способностью связываться со специфическими рецепторами половых стероидов и маскироваться под естественные половые гормоны (тестостерон, эстрадиол). Последнее обусловлено тем, что подобно стероидным гормонам, в структуре многих гормоноподобных ксенобиотиков присутствует фенольное кольцо.
Одно из ведущих мест среди гормоноподобных загрязнителей окружающей среды занимают нонилфенолы (НФ). НФ используются при производстве поверхностно-активных веществ – оксиэтилированных нонилфенолов, присадок к смазочным маслам, смол и других полимеров, пестицидов и др. Массовое попадание НФ в окружающую среду обусловлено и их образованием в результате разложения неионогенных поверхностно-активных веществ – нонилфенолэтоксилатов, широко используемых в промышленности и быту. Доля НФ в мировом производстве составляет 85% от всех производимых алкилфенолов. В результате сброса бытовых и промышленных стоков НФ загрязнены поверхностные воды как пресноводных, так и морских экосистем. Почвы могут быть загрязнены НФ за счет размещения осадков сточных вод (ОСВ). Загрязнение почвы НФ происходит и при не санкционированных свалках твердых биологических отходов. В Западной Европе и Северной Америке около 30% всех ОСВ используются в сельском хозяйстве. В Великобритании ОСВ используют для удобрения около 1.5% сельскохозяйственных угодий. Для этого на поля вносится около 350 тыс. т ОСВ в пересчете на сухое вещество. В Российской Федерации ежегодно накапливается около 2.6 млн т ОСВ в пересчете на сухое вещество [10]. Из этого количества от 4 до 10% используется в качестве удобрений [5]. В зависимости от количества внесенных органических удобрений (навоза) и осадков сточных вод содержание НФ в почвах варьирует в пределах 0.01–4900 мкг/кг сухой почвы [24, 33]. Сильнозагрязненные почвы могут содержать сотни миллиграмм НФ в 1 кг почвы [14]. НФ оказывают токсическое воздействие на водные и почвенные организмы, такие как водоросли, ракообразные, моллюски, рыбы, ногохвостки, дождевые черви, растения и др. [6, 16, 21, 36, 38]. Благодаря высокой биоаккумуляционной способности НФ могут накапливаться в водных и почвенных организмах, а также в растениях [15]. Продвигаясь по пищевой цепи, НФ попадают и в организм человека, представляя серьезную угрозу для здоровья.
В силу этих причин в ряде стран Европейского Союза введены ограничения на производство и использование НФ, регламентировано содержание НФ в объектах окружающей среды. Использование НФ в странах ЕС ограничено с 2005 г. НФ и его прекурсор – этоксилированный НФ включены в Список приоритетных опасных веществ Водной рамочной директивы ЕС. В соответствии с Нормативами качества окружающей среды (Приложение 1 Директива 2008/105/ЕС) предельно допустимая концентрация НФ в водоемах составляет 2 мкг/дм3. Содержание НФ в окружающей среде строго контролируется в США и Канаде. По нормам Агентства Соединенных Штатов по защите окружающей среды (ЕРА) содержание НФ в пресных и соленых водах не должно превышать 6.6 и 1.7 мкг/л соответственно, а в почве – 2.6 мг/кг. В Канаде допускается более высокое содержание НФ в почве, от 5.7 до 14 мг/кг в зависимости от их назначения, а нормативы содержания НФ в водоемах более строгие по сравнению с США – 1.0 и 0.7 мкг/л для пресноводных и соленых водоемов соответственно. Однако многие страны, включая Россию, Китай, Индию, продолжают производить и использовать НФ в больших количествах, содержание НФ в объектах окружающей среды в этих странах не регламентируется.
При попадании НФ в почву большая часть поллютанта остается в поверхностных слоях (0–20 см), с глубиной количество НФ уменьшается [26]. С течением времени в почве за счет биологических процессов (главным образом микробиологической деструкции) происходит деградация НФ. Время полураспада НФ в почве T50 в лабораторных условиях составляет от одного до 25 дней в зависимости от исходной концентрации НФ и типа почвы. При этом в конце эксперимента (до 120 дней) в почве остается до 30% НФ от исходного содержания [23]. Неполную деградацию НФ в почвах объясняют его прочной сорбцией органическим материалом, главным образом, гуминовыми кислотами [25]. В полевых условиях деградация НФ в почвах происходит значительно медленнее. Так, при исходном содержании НФ в почве 0.887 мг/кг T50 в лабораторных экспериментах и полевых условиях составляет 12 и 257 дней соответственно [23].
Проблема очистки загрязненных НФ почв как на теоретическом, так и на практическом уровне разработана недостаточно. За рубежом из донных отложений, активных илов очистных сооружений, загрязненных почв выделяют культуры бактерий, дрожжей и грибов, способных трансформировать и/или использовать НФ в качестве источника углерода и энергии [17, 28, 39], изучаются процессы фиторемедиации почв [23]. Практически отсутствуют в литературе данные по влиянию НФ на почвенную микробиоту, в том числе на видовое разнообразие микробоценозов. В России исследования по этим проблемам до настоящего времени не проводились.
Цель настоящего исследования – изучение влияния гормоноподобного ксенобиотика НФ на численность, таксономическую структуру микробного сообщества и токсичность дерново-подзолистой суглинистой почвы (Eutric Albic Retisol (Abruptic, Loamic, Aric, Ochric)) Ленинградской области.
ОБЪЕКТЫ И МЕТОДЫ
В работе использовали верхние горизонты (0–20 см) дерново-подзолистой суглинистой почвы (Eutric Albic Retisol (Abruptic, Loamic, Aric, Ochric)), отобранной с опытного поля Санкт-Петербургского государственного аграрного университета (г. Пушкин). Агрохимические показатели почвы, просеянной через сито (2 мм), определяли по стандартным методикам [2]. Агрохимическая характеристика почвы представлена в табл. 1.
Технический НФ CAS: 84852-15-3 производства Sigma-Aldrich, США растворяли в 4 мл ацетона и добавляли к 10 г стерильного кварцевого песка. После выпаривания ацетона (в течение 1 ч), обработанный НФ кварцевый песок смешивали с увлажненной почвой (60% от полной влагоемкости), создавая концентрацию НФ 30 и 300 мг/кг сухой почвы. В эксперименте использовали два контрольных варианта почв: 1 – дерново-подзолистую суглинистую с добавлением кварцевого песка (с предварительно выпаренным ацетоном, не содержащим НФ); 2 – дерново-подзолистую суглинистую с добавлением чистого кварцевого песка. Статистически значимых (р ≤ 0.05) различий в численности и структуре микробного сообщества между вариантами 1 и 2 контрольных почв не выявлено (данные не представлены). Для определения абиотической убыли НФ в почвенных образцах постановку эксперимента проводили аналогично вышеописанной схеме с использованием стерильной дерново-подзолистой суглинистой почвы. Стерилизацию образцов почвы (по 100 г сухой почвы) обеспечивали автоклавированием при давлении 1 атм в течение 1 ч 20 мин. Стерильность почвенных образцов контролировали на 1, 30 и 90 сут эксперимента путем высева почвенной суспензии на стандартные питательные среды. Почвенные образцы инкубировали при комнатной температуре в течение 90 сут и влажности почвы 60% от полной влагоемкости. Увлажнение почвенных образцов проводили один раз в неделю до уровня 60% от полной влагоемкости. Пробы отбирали в 1, 30 и 90 сут эксперимента. Численность и групповой состав почвенной микробиоты определяли общепринятыми в почвенной микробиологии методами высева почвенной суспензии на стандартные питательные среды: мясо-пептонный агар (МПА) – гетеротрофные микроорганизмы, усваивающие органические формы азота; крахмало-аммиачный агар (КАА) – актиномицеты и бактерии, использующие минеральные формы азота; среду Эшби – олигонитрофильные микроорганизмы; Гетчинсона – целлюлозоразрушающие микроорганизмы; МПА (1 : 10) – олиготрофные микроорганизмы. Численность спорообразующих бактерий учитывали на МПА, посев проводили из предварительно пастеризованной в течение 10 мин при температуре 80°С почвенной суспензии. Количество толерантных к НФ бактерий учитывали на среде, следующего состава: (NH4)2SO4 – 0.4%, K2HPO4 – 0.15%, KH2PO4 – 0.15%, MgSO4 × 7H2O – 0.02%, агар-агар – 2% с добавлением 300 мг/л НФ. Десорбцию микроорганизмов с почвенных частиц осуществляли путем обработки водно-почвенной суспензии ультразвуком (частота 40 КГц) в ультразвуковой ванне DA-963 (КНР) в течение 10 мин, а затем встряхиванием на шейкере Certomat BS-1 (180 об./мин) в течение 10 мин. Коэффициент минерализации органических соединений рассчитывали как отношение численности микроорганизмов, усваивающих минеральные формы азота (учтенных на КАА), к численности микроорганизмов, усваивающих органические формы азота (учтенных на МПА); коэффициент олигонитрофильности рассчитывали как отношение численности олигонитрофильных микроорганизмов (учтенных на среде Эшби) к численности гетеротрофов (учтенных на МПА) [3]. Эксперименты проводили в трехкратной повторности.
Таксономический состав микробного сообщества образцов дерново-подзолистой суглинистой почвы изучали с использованием метода пиросеквенирования (Illumina MiSeq). Для молекулярно-генетического анализа отбирали пробы почв массой 0.5–1 г в трехкратной повторности. До выделения ДНК пробы хранили в герметично закрытых стеклянных флаконах при температуре – 20°С. ДНК выделяли из навески почвы 0.5 г, согласно методике, описанной Андроновым с соавт. [1]. Очищенный препарат ДНК использовали в качестве матрицы в реакции ПЦР с универсальными праймерами к вариабельному участку V4 гена 16S рРНК F515 GTGCCAGCMGCCGCGGTAA и R806 GGACTACVSGGGTATCTAAT с добавлением олигонуклеотидных идентификаторов для каждой пробы и служебных последовательностей, необходимых для пиросеквенирования. Используемые праймеры сконструированы на основе анализа нуклеотидных последовательностей, как бактерий, так и архей, и позволяют амплифицировать фрагмент гена 16S рРНК длиной примерно 400 п. н. Подготовку проб и секвенирование проводили на приборе Illumina MiSeq согласно рекомендациям производителя. Секвенирование проводили с использованием оборудования ЦКП “Геномные технологии, протеомика и клеточная биология” ФГБНУ ВНИИСХМ. Данные обрабатывали с помощью программы QIIME 1.8.0 [12]. Сиквенсы объединяли в операционные таксономические единицы на основе 97%-ного порога сходства нуклеотидного состава. Общее разнообразие прокариотных сообществ (альфа-разнообразие) почвенных образцов оценивали по количеству выделенных операционных таксономических единиц, индексам Шеннона и Chao1 [11].
Для экстракции НФ из почвенных образцов к 1 г лиофильно высушенного почвенного образца добавляли 5 мл гексана, встряхивали в течение 1 мин, затем трижды по 15 мин обрабатывали ультразвуком (частота 40 КГц) в ультразвуковой ванне DA-963 (КНР). Далее добавляли 5 мл 0.095 М раствора тетрабутиламмоний сульфата в 50 мM NaH2PO4, встряхивали и снова обрабатывали ультразвуком дважды по 10 мин. После этого образцы центрифугировали 10 мин при 6000 об./мин и замораживали. Декантированные гексановые экстракты высушивали с безводным сульфатом натрия, а затем испаряли досуха в потоке газообразного азота. Полученные сухие экстракты растворяли в 400 мкл 100% ацетонитрила, центрифугировали при 10 000 об./мин в течение 1 мин. Для получения пробы для хроматографирования к 200 мкл надосадочной жидкости добавляли 300 мкл дистиллированной воды.
Анализ содержания НФ проводили методом высокоэффективной жидкостной хроматографии на приборе Hewlett-Packard H 1090 с диодно-матричным детектором при длине волны 278 нм с разрешением 1.2 нм. Условия хроматографирования: колонка Discovery HS C18 (7.5 см × 2.1 мм, 3 мкм) производства Supelco (США), температура колонки – 35°С, скорость потока элюента – 0.4 мл/мин, объем пробы – 200 мкл. В качестве элюента использовали 70%-ный водный раствор ацетонитрила, содержащий 0.1% трифторуксусной кислоты. Степень извлечения НФ из почвенных образцов составляла 98 ± 1%. Коэффициенты скорости деструкции НФ в быстрой фазе (k) и корреляционные коэффициенты (R) рассчитывали согласно [19].
Фитотоксичность почвенных образцов определяли путем сравнения статистически значимых различий по длине корней и проростков пшеницы мягкой (Tríticum aestívum), выросших на загрязненных и контрольных почвах через трое суток [8]. Критерием токсичности является ухудшение показателей развития растений в тестируемых вариантах более чем на 20% относительно контроля.
Статистическую обработку данных проводили с использованием пакета программ Statistica 6.0. Различия считали достоверными при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
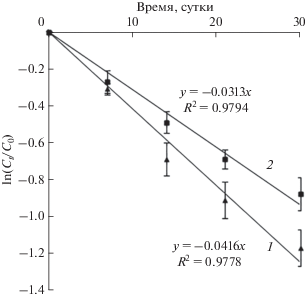
Динамика содержания НФ в дерново-подзолистой суглинистой почве. В почвенных образцах происходит уменьшение содержания НФ вследствие его биодеградации, главным образом, почвенными микроорганизмами. На биологический характер процесса деструкции НФ указывает отсутствие его убыли в стерильных почвенных образцах (рис. 1).
Рис. 1.
Убыль НФ в дерново-подзолистой суглинистой почве: 1 – 30 мг НФ/кг а.с.п.; 2 – 300 мг НФ/кг; 3 – стерильная почва (30 мг НФ/кг); 4 – стерильная почва (300 мг НФ/кг).

Процесс убыли НФ состоит из двух фаз: быстрой и замедленной. В течение первых 30 сут инкубирования (быстрая фаза) в почвенных образцах деградировано 69 и 59% от внесенного НФ – 30 и 300 мг/кг сухой почвы соответственно. За быстрым периодом следует период замедленной убыли поллютанта, в течение которого биодеградации подверглось еще 10 и 14% НФ соответственно. К концу эксперимента (через 90 сут) в почвенных образцах оставалось 6.3 и 81.0 мг НФ/кг, что соответствует 21 и 27% от внесенных количеств НФ – 30 и 300 мг/ кг.
Скорость деструкции НФ в быстрой фазе может быть выражена уравнением реакции первого порядка, что подтверждается высокими значениями корреляционных коэффициентов R > 0.95 (рис. 2, табл. 2).
Таблица 2.
Параметры биодеградации НФ в дерново-подзолистой суглинистой почве
| Концентрация НФ, мг/ кг | Т50, сутки | K, сутки–1 | R2 |
|---|---|---|---|
| 30 | 14.0 | 0.041 | 0.977 |
| 300 | 21.0 | 0.031 | 0.979 |
Убыль НФ в почвенных образцах зависит от начальной концентрации поллютанта. С повышением исходной концентрации НФ от 30 до 300 мг/кг скорость его биодеградации снижается в 1.3 раза, время полураспада НФ возрастает в 1.5 раза.
Выявленная двухстадийность убыли НФ и зависимость скорости биодеградации ксенобиотика от его содержания в дерново-подзолистой суглинистой почве согласуются с исследованиями [19], выполненными с использованием других типов почв: кислого глинистого грунта и известковой песчаной почвы.
Влияние НФ на численность основных физиологических групп микроорганизмов дерново-подзолистой суглинистой почвы. Внесение НФ в почву вызывает дозо- и время зависимые изменения численности основных физиологических групп микробного сообщества (табл. 3). Через сутки после загрязнения почвенных образцов 30 мг/кг НФ наблюдается статистически достоверное (р < 0.05) снижение численности актиномицетов и олиготрофных микроорганизмов в 3.4 и 1.8 раз соответственно. Десятикратное увеличение дозы НФ до 300 мг/кг после суточного инкубирования почвенных образцов привело к уменьшению содержания более широкого спектра исследуемых бактериальных групп. Помимо снижения численности актиномицетов и олиготрофных бактерий в 2.7 и 3.9 раз соответственно, наблюдается уменьшение численности гетеротрофных микроорганизмов в 1.8 раза, олигонитрофилов в 2.4 раза и бактерий, усваивающих минеральные формы азота, в 1.6 раза. При этом статистически значимых отличий в количестве спорообразующих и целлюлозоразрушающих бактерий в загрязненных НФ и контрольных (незагрязненных НФ) вариантах в 1 сут эксперимента не выявлено.
Таблица 3.
Влияние НФ на численность различных физиологических групп почвенных микроорганизмов (± среднеквадратичное отклонение)
| Содержание НФ, мг/кг | Физиологические группы микроорганизмов | Коэффициенты эколого-трофической структуры микробного сообщества | |||||||
|---|---|---|---|---|---|---|---|---|---|
| гетеротрофы КОЕ × 107 |
актиномице-ты КОЕ × 105 | спорообра-зующие бактерии КОЕ × 106 | олигонитро- филы КОЕ × 107 |
целлюлозо-разрушающие бактерии КОЕ × 107 |
олиготрофы КОЕ × 107 | бактерии, усваивающие минеральные формы азота КОЕ × 107 |
коэффициент минерали- зации | коэффициент олигонитро-фильности | |
| 1 сутки | |||||||||
| Контроль | 1.03 ± 0.16 | 6.5 ± 0.7 | 1.54 ± 0.25 | 1.18 ± 0.16 | 0.30 ± 0.07 | 1.21 ± 0.15 | 0.94 ± 0.12 | 0.91 ± 0.11 | 1.15 ± 0.14 |
| 30 | 0.79 ± 0.29 | 1.9 ± 0.3 | 1.87 ± 0.41 | 0.88 ± 0.04 | 0.26 ± 0.06 | 0.69 ± 0.05 | 0.75 ± 0.15 | 0.95 ± 0.10 | 1.11 ± 0.12 |
| 300 | 0.57 ± 0.10 | 2.4 ± 0.6 | 1.25 ± 0.13 | 0.50 ± 0.08 | 0.28 ± 0.02 | 0.31 ± 0.05 | 0.59 ± 0.08 | 1.03 ± 0.06 | 0.88 ± 0.11 |
| 30 суток | |||||||||
| Контроль | 10.9 ± 1.5 | 0.74 ± 0.03 | 3.21 ± 0.81 | 15.7 ± 2.3 | 5.4 ± 1.0 | 9.8 ± 2.5 | 19.8 ± 2.1 | 1.8 ± 0.22 | 1.44 ± 0.16 |
| 30 | 20.5 ± 3.9 | 0.88 ± 0.15 | 2.45 ± 0.33 | 25.0 ± 2.8 | 10.2 ± 0.7 | 13.7 ± 0.7 | 28.7 ± 3.2 | 1.4 ± 0.18 | 1.22 ± 0.14 |
| 300 | 18.3 ± 2.5 | 0.41 ± 0.07 | 1.40 ± 0.14 | 11.4 ± 1.4 | 11.3 ± 1.1 | 27.1 ± 3.0 | 7.3 ± 1.5 | 0.40 ± 0.05 | 0.62 ± 0.07 |
| 90 суток | |||||||||
| Контроль | 6.3 ± 1.7 | 1.63 ± 0.21 | 2.78 ± 0.44 | 6.8 ± 1.2 | 23.8 ± 4.8 | 8.2 ± 1.5 | 10.8 ± 1.2 | 1.71 ± 0.22 | 1.08 ± 0.11 |
| 30 | 14.6 ± 2.5 | 1.21 ± 0.12 | 2.72 ± 0.30 | 8.9 ± 1.6 | 30.1 ± 2.5 | 12.4 ± 2.1 | 19.0 ± 2.6 | 1.30 ± 0.11 | 0.61 ± 0.06 |
| 300 | 31.4 ± 6.4 | 0.79 ± 0.11 | 1.16 ± 0.23 | 5.6 ± 1.7 | 10.2 ± 1.1 | 32.6 ± 4.1 | 15.1 ± 1.3 | 0.48 ± 0.06 | 0.18 ± 0.03 |
Направленность действия НФ на численность отдельных групп микробного сообщества значительно изменяется после 30 и 90 сут воздействия токсиканта. При внесении как низкой дозы НФ (30 мг/кг), так и высокой (300 мг/кг) через 30 сут общая численность гетеротрофных микроорганизмов, в том числе целлюлозоразрушающих бактерий возрастает почти в 2 раза. В почвенных вариантах с низким содержанием НФ (30 мг/кг) наблюдается увеличение количества олигонитрофилов (на 59%), при этом в вариантах с высоким содержанием НФ (300 мг/кг) по сравнению с суточным воздействием токсиканта через 30 сут происходит восстановление численности олигонитрофильных микроорганизмов практически до уровня контрольных вариантов. Высокие дозы НФ также приводят к увеличению числа олиготрофных бактерий почти в 3 раза. Через 30 сут после внесения токсиканта в почвенные образцы в вариантах с низкой дозой НФ в микробном сообществе наблюдается восстановление численности актиномицетов, одной из наиболее чувствительных групп микроорганизмов, до контрольного уровня. Однако в почвенных образцах, загрязненных высокой дозой НФ, содержание актиномицетов и спорообразующих бактерий в 1.8 и 2.3 раза соответственно меньшее по сравнению с контрольной почвой. Содержание бактерий, усваивающих минеральные формы азота, в почвенных образцах, загрязненных низкой дозой НФ, возрастает в 1.4 раза, в то время как десятикратное увеличение содержания НФ приводит к значительному (в 2.7 раза) сокращению численности этой группы микроорганизмов.
Через 90 сут инкубирования сохраняется тенденция к увеличению численности гетеротрофных и олиготрофных микроорганизмов в почвенных образцах, загрязненных НФ, выявленная через 30 сут, причем степень этого увеличения значительно возрастает: количество гетеротрофов увеличивается в 2.3 и 5 раз, олиготрофов – в 1.5 и 4 раза при исходном содержании НФ 30 и 300 мг/кг соответственно. Особо следует выделить группу целлюлозоразрушающих бактерий: увеличение вдвое их численности при высокой дозе НФ (300 мг/кг), наблюдавшееся через 30 сут инкубирования, по истечении 90 сут сменилось на значительное (на 57%) уменьшение их количества. Выявленный эффект, возможно, связан с высокой чувствительностью данной группы микроорганизмов к образовавшимся продуктам деструкции НФ. Противоположный эффект наблюдался при определении количества бактерий, усваивающих минеральные формы азота: после 90 сут инкубирования их численность в почвенных вариантах, загрязненных НФ в концентрации 300 мг/кг, возросла по сравнению с контрольными в 1.4 раза. Наиболее чувствительными к воздействию НФ при концентрации 300 мг/кг являются актиномицеты, спорообразующие и целлюлозоразрушающие бактерии. При инкубировании почвенных образцов в течение 90 сут наблюдается статистически достоверное (р ≤ 0.05) уменьшение их содержания в почве по сравнению с контрольным вариантом.
Учитывая важную роль актиномицетов в процессе почвообразования и разложении недоступных для бактерий трудногидролизуемых соединений, выявленное снижение численности актиномицетов по мере возрастания уровня нагрузки, и на фоне увеличения общей численности гетеротрофных бактерий может привести к изменению интенсивности и направленности элементарных почвенных процессов. Снижение численности актиномицетов характерно для многих антропогенно-нарушенных почв [4, 9].
Дозозависимое увеличение микробной биомассы в первые 7 сут инкубирования ранее отмечено в образцах кислого глинистого грунта и известковой песчаной почвы, загрязненных НФ в концентрации от 80 до 240 мг/кг, о чем свидетельствует рост количества микробного углерода и азота. Однако в отличие от наших результатов при дальнейшем инкубировании почв (до 120 сут) различия между обработанными НФ и контрольными вариантами были незначительными [19]. Увеличение общего числа бактериальных клеток, в том числе метаболитически активных, зафиксировано в донных осадках, загрязненных НФ [20].
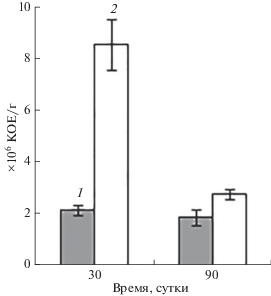
Увеличение численности отдельных групп микроорганизмов при загрязнении почвы НФ, скорее всего, связано с использованием его микроорганизмами как дополнительного питательного субстрата. При этом количество чувствительных к НФ микроорганизмов снижается, а устойчивые формы активно развиваются, о чем свидетельствуют полученные данные по численности толерантных к НФ бактерий (рис. 3). Количество толерантных к НФ микроорганизмов через 30 и 90 сут культивирования в 4 и 1.5 раза соответственно, превышает численность толерантных микроорганизмов в контрольной почве, не содержащей НФ.
В пользу предположения об использовании микроорганизмами НФ как источника углерода свидетельствуют многочисленные данные об участии микроорганизмов различных таксономических групп в процессах биодеградации НФ [22, 27, 29]. Рост общей численности бактерий, в том числе за счет увеличения популяции бактерий-деструкторов, наблюдался при загрязнении почвы другими ксенобиотиками: нафталином, нефтью, дизельным топливом, диоктилфталатом и др. [9].
Снижение коэффициентов минерализации и олигонитрофильности через 30 и 90 сут инкубирования почвенных образцов свидетельствует о замедлении интенсивности процессов микробиологической минерализации органических веществ и процессов иммобилизации азота в загрязненных НФ почвах.
Влияние НФ на таксономический состав микробного сообщества дерново-подзолистой суглинистой почвы. При загрязнении НФ дерново-подзолистой суглинистой почвы происходит изменение не только численности, но и таксономического состава микробного сообщества (рис. 4).
Рис. 4.
Таксономическая структура (на уровне филумов) прокариотных сообществ дерново-подзолистой суглинистой почвы в условиях действия НФ в течение 1 (А) и 90 (Б) суток. 1 – Crenarchaeota, 2 – Acidobacteria, 3 – Actinobacteria, 4 – Bacteroidetes, 5 – Chloroflexi, 6 – Firmicutes, 7 – Proteobacteria, 8 – Cyanobacteria, 9 – Gemmatimonadetes, 10 – Planctomycetes, 11 – Verrucomicrobia, 12 – другие.
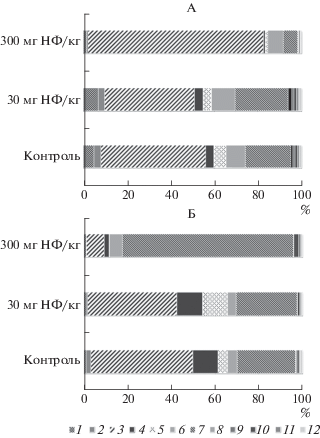
Анализ структуры почвенных микробных сообществ, при помощи высокопроизводительного секвенирования гена 16S рРНК показал, что абсолютное большинство в контрольных (незагрязненных НФ) образцах дерново-подзолистой почвы на уровне доменов, составляют бактерии (94.1%), доля архей 4.7%. Структура прокариотных сообществ исследуемой почвы сформирована преимущественно филумами Actinobacteria, Proteobacteria, Firmicutes, Chloroflexi, Bacteroidetes, Acidobacteria, Planctomycetes, Gemmatimonadetes, составляющими обычно ядро почвенных бактериальных сообществ [18], и археем филума Crenarchaeota, являющимся устойчивым и универсальным компонентом почвенного микробного сообщества. Наибольшие доли в микробиоме почвы имеют группы Actinobacteria (48%) и Proteobacteria (20.5%), часто занимающие доминантное положение в почвенных микробных сообществах. Помимо актинобактерий и протеобактерий, значительную долю в незагрязненной НФ почве составляют представители групп Firmicutes (9.0%), Chloroflexi (5.4%), Bacteroidetes (3.7%), Acidobacteria (3.2%), Planctomycetes (1.2%), Gemmatimonadetes (1.1%), Cyanobacteria (1%). Небольшой вклад менее 1% в общий состав микробного сообщества вносят филумы Verrucomicrobia и Nitrospirae. Доля неидентифицированных доменов составила 0.8%.
При сравнительном анализе таксономической структуры микробного сообщества через сутки после внесения 30 мг НФ/кг абсолютно сухой почвы выявлено, что по сравнению с контрольными образцами почвы соотношение доминирующих бактериальных филумов практически не изменилось, однако доля минорных филумов Cyanobacteria и Nitrospirae возросла в 1.7 и 2 раза соответственно. Число архей группы Crenarchaeota, представленных родом Candidatus nitrososphaera, увеличилось на 40%. На уровне родов отмечается сокращение доли прокариот Cellulomonas, Rhodococcus, Flavisolibacter, Anaerolinea.
При десятикратном (до 300 мг/кг) увеличении внесенной в почву дозы НФ выявлены значительные изменения таксономического состава микробного сообщества. На уровне доменов происходит снижение относительной доли практически всех выявленных групп бактерий и архей, за исключением доминирующего филума Actinobacteria, доля которого возросла до 80% от общего микробного сообщества, а на уровне семейства Micrococcaceae, преобладающего в этом филуме, до 70%. При этом содержание бактерий рода Cellulomonas, относящегося к филуму Actinobacteria, сократилось более чем в 2 раза. Количество протеобактерий, представленных в основном бактериями из семейств Comamonadaceae и Xanthomonadaceae родов Ramlibacter и Lysobacter, соответственно, снизилось с 20.5 до 6.8%. Относительная доля филумов Acidobacteria, Bacteroidetes, Chloroflexi, Cyanobacteria, Gemmatimonadetes, Planctomycetes, Verrucomicrobia сократилась от 3 до 5 раз. На уровне родов наблюдается значительное уменьшение доли архей рода Candidatus nitrososphaera и бактерий родов Cellulomonas, Mycobacterium, Rhodococcus, Flavisolibacter, Anaerolinea, Bacillus, Clostridium, Kaistobacter, Polaromonas, Ramlibacter, Anaeromyxobacter, Lysobacter.
Через 90 сут инкубирования содержание идентифицированных архей в опытных образцах почв не отличалось от контрольных образцов и составило 0.9%.
Значительные изменения в опытных образцах почв произошли в таксономической структуре на уровне бактериальных сообществ. В варианте с внесенным в почву НФ в дозе 300 мг/кг через 90 сут доля доминирующего филума Actinobacteria снизилась до 8.1%, как по сравнению с суточным воздействием НФ (80.4%), так и по сравнению с содержанием филума в контрольной почве (46.9%). Следует отметить, что внесение более низкой дозы НФ – 30 мг/кг по истечении 90 сут не привело к значимому изменению доли Actinobacteria как по сравнению с контрольной почвой, так и суточным воздействием НФ. Однако при этом наблюдается сокращение доли филумов Acidobacteria и Gemmatimonadetes и увеличение доли Chloroflexi.
При внесении в почву 300 мг НФ/кг через 90 сут сохраняется тенденция к дальнейшему сокращению относительной доли филумов Acidobacteria, Gemmatimonadetes, Bacteroidetes и Chloroflexi. Однако на фоне снижения вышеперечисленных групп бактерий доля филумов Proteobacteria, Verrucomicrobia, Planctomycetes, Cyanobacteria, напротив, возрастает. При этом доминирующим филумом в таксономической структуре микробного сообщества становится Proteobacteria, доля которого превышает 78%. Увеличение доли Proteobacteria на уровне родов происходит в основном за счет Acinetobacter, Lysobacter, Ramlibacter, а также родов Pseudomonas, Thermomonas и Geobacter, среди представителей которых выявлены деструкторы алкилфенолов [30, 31, 37]. Следует отметить, что доминирование протеобактерий является характерной чертой для нарушенных почвенных местообитаний, в том числе загрязненных токсичными ксенобиотиками [9]. Протеобактерии, включая Alphaproteobacteria, Betaproteobacteria и Gammaproteobacteria, были доминирующей группой в процессах биодеструкции НФ в грунтовых водах, загрязненных сточными водами [26]. Ванг с соавт. [35] также указывали на доминирование Gammaproteobacteria и Alphaproteobacteria, наряду с Bacteroidetes в речных донных осадках, загрязненных НФ.
Загрязнение почвы НФ в концентрации 300 мг/кг обедняет видовой состав микробоценоза, на что указывает снижение индексов Шеннона, Chao1 и количества операционных таксономических единиц. В присутствии низких доз НФ (30 мг/кг) видовое разнообразие прокариотного сообщества дерново-подзолистой суглинистой почвы практически не отличается от контрольных вариантов (табл. 4).
Таблица 4.
Число секвенированных последовательностей гена 16s-рРНК, операционных таксономических единиц (ОТЕ), и рассчитанные индексы разнообразия Шеннона и Chao1 для почвенных образцов
| Показатель | 1 сутки | 90 суток | ||||
|---|---|---|---|---|---|---|
| контроль | 30 мг НФ/кг | 300 мг НФ/кг | контроль | 30 мг НФ/кг | 300 мг НФ/кг | |
| Количество сиквенсов |
2512 | 2095 | 4180 | 3346 | 3763 | 4180 |
| Количество ОТЕ | 963 ± 48 | 926 ± 21 | 640 ± 59 | 800 ± 71 | 751 ± 25 | 671 ± 25 |
| Индекс Шеннона | 8.32 ± 0.13 | 8.71 ± 0.01 | 3.62 ± 0.41 | 6.74 ± 0.21 | 6.62 ± 0.09 | 5.45 ± 0.19 |
| Индекс Chao1 | 2660 ± 526 | 2665 ± 273 | 2060 ± 311 | 2327 ± 405 | 2187 ± 211 | 1852 ± 69 |
Уменьшение видового разнообразия бактериоценозов раннее отмечалось в почвах, характерных для вадозных зон русла рек северного Китая, загрязненных эндокринными деструкторами [26], а также в донных осадках, содержащих НФ в концентрации 125–150 мг/кг, как в аэробных [35], так и анаэробных условиях [13]. Однако имеются и противоположные результаты. Китайские исследователи экспериментально установили увеличение видового разнообразия бактериального сообщества речных осадков в анаэробных условиях под воздействием НФ в концентрации 100 мг/кг [34].
Обработанные НФ почвы (300 мг/кг) обладают фитотоксичностью (пшеница Tríticum aestívum) на протяжении месячного инкубирования (рис. 5).
Рис. 5.
Влияние загрязнения почвы НФ (30 (а) и 300 мг/кг (б)) на фитотоксичность в отношении пшеницы мягкой Tríticum aestívum: 1 – 1, 2 – 30, 3 – 90 сут.
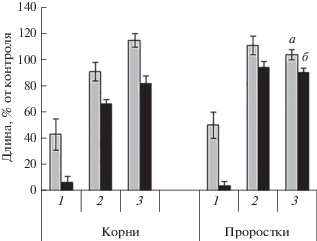
По истечении трехмесячного периода наблюдений фитотоксичность загрязненных образцов почв в отношении данных тест-объектов не выявлена, что может быть связано со значительной (до 78%) деструкцией НФ почвенными микроорганизмами.
ЗАКЛЮЧЕНИЕ
В образцах дерново-подзолистой суглинистой почвы, загрязненных НФ, происходит снижение содержания гормоноподобного ксенобиотика в основном за счет его биодеструкции почвенными микроорганизмами. После 90 сут инкубирования в почве было деградировано более 70% поллютанта при исходном его содержании 30 и 300 мг/кг. С увеличением исходного содержания НФ в почве возрастает время его полураспада и снижается скорость деструкции.
Нонилфенолы оказывают дозо- и время зависимое влияние на численность основных групп почвенных микроорганизмов. Выявлена различная чувствительность микроорганизмов основных физиологических групп к ксенобиотику. В присутствии НФ происходит значительное увеличение количества гетеротрофных и олиготрофных микроорганизмов, а также бактерий, толерантных к НФ. Наиболее чувствительными к НФ являются актиномицеты и спорообразующие бактерии. По истечении длительного 90-суточного срока инкубирования при значительном (до 73%) уменьшении содержания НФ в почве количество этих микроорганизмов не восстанавливается, их численность не превышает 50% от содержания в контрольной, не загрязненной НФ почве.
При загрязнении НФ дерново-подзолистой суглинистой почвы выявлены значительные сдвиги в таксономическом составе микробного сообщества. Существенные изменения отмечены в соотношении филумов, занимающих наибольшие доли в микробиоме: Actinobacteria и Proteobacteria. Через 90 сут доля Actinobacteria сократилась до 8%, при этом доминирующим филумом в таксономической структуре микробного сообщества становится Proteobacteria, доля которого превысила 78%. Увеличение доли Proteobacteria на уровне родов происходит в основном за счет Acinetobacter, Lysobacter, Ramlibacter, а также Pseudomonas, Thermomonas и Geobacter, среди представителей которых выявлены деструкторы алкилфенолов. В загрязненных НФ почвах формируется новое микробное сообщество. Согласно количеству обнаруженных операционных таксономических единиц на основе 97%-ного порога сходства нуклеотидного состава, индексов Шеннона и Chao1, характерной чертой микробоценоза дерново-подзолистой почвы, загрязненной НФ, становится более низкий уровень видового разнообразия.
Оценка коэффициентов эколого-трофической структуры микробного сообщества исследуемой почвы показала, что в дерново-подзолистой почве, загрязненной НФ, происходит снижение интенсивности процессов микробиологической минерализации азотсодержащих органических веществ, а также замедление процессов иммобилизации азота.
Выявлена фитотоксичность образцов почвы, загрязненной высокой дозой НФ 300 мг/кг в течение месячного инкубирования.
Полученные результаты могут быть использованы при разработке научно-обоснованной методологии биоремедиации почв, загрязненных гормоноподобными токсикантами. Изменения филогенетической структуры почвенных микробоценозов могут выступать в качестве чувствительного биоиндикатора экологического состояния почв.
Список литературы
Андронов Е.Е., Петрова С.Н., Чижевская Е.П., Коростик Е.В., Ахтемова Г.А., Пинаев А.Г. Влияние внесения генетически модифицированного штамма Sinorhizobium meliloti АСН-5 на структуру почвенного сообщества микроорганизмов // Микробиология. 2009. Т. 78. № 4. С. 525–534.
Аринушкина Е.В. Руководство по химическому анализу почв. М.: Изд-во Моск. ун-та, 1970. 488 с.
Воробьева Р.П., Давыдов А.С., Ананьева Ю.С. Экологическая оценка осадков сточных вод по влиянию на биологическую активность почвы // Вестник Алтайского гос. ун-та. 2003. № 4. С. 53–60.
Горовцов А.В. Показатели структуры микробоценоза почв г. Ростова-на-Дону как инструмент мониторинга состояния антропогеннопреобразованных почв // Научный журнал КубГАУ. 2013. № 89(05). С. 1–13.
Касатиков В.А. Агроэкологические и технологические аспекты использования нетрадиционных видов органических удобрений // Всерос. научно-методическая конф. “Совершенствование организации и методологии агрохимических исследований в Географической сети опытов с удобрениями”. М.: ВНИИА, 2006. 176 с.
Кондакова А.С., Черняев А.П., Соколова Л.И. Определение 4-НФа в природных водах методом высокоэффективной жидкостной хроматографии // Вода: химия и экология. 2012. № 12. С. 115–120.
Медведева Н.Г., Поляк Ю.М., Зиновьева С.В., Зайцева Т.Б. Влияние иприта и продуктов его гидролиза на почвенную микробиоту // Почвоведение. 2000. № 8. С. 1023–1028.
Методика выполнения измерений всхожести семян и длины корней проростков высших растений для определения токсичности техногенно загрязненных почв. ФР.1.39.2006.02264. СПб., 2009. 19 с.
Панов А.В., Есикова Т.З., Соколов С.Л., Кошелева И.А., Боронин А.М. Влияние загрязнения почвы на состав микробного сообщества // Микробиология. 2013. Т. 82. № 2. С. 239–246. https://doi.org/10.7868/S0026365613010114
Плеханова И.О. Степень самоочищения агродерново-подзолистых супесчаных почв, удобренных осадком сточных вод // Почвоведение. 2017. № 4. С. 506–512. https://doi.org/10.1134/S1064229317040081
Чирак Е.Л., Першина Е.В., Дольник А.С., Кутовая О.В., Василенко Е.С., Когут Б.М., Мерзлякова Я.В., Андронов Е.Е. Таксономическая структура микробных сообществ в почвах различных типов по данным высокопроизводительного секвенирования библиотек гена 16S-рРНК // Сельскохозяйственная биология. 2013. № 3. С. 100–109. https://doi.org/10.15389/agrobiology.2013.3.100eng
Caporaso J.G., Kuczynski J., Stombaugh J. et al. QIIME allows analysis of high-throughput community sequencing data // Nature Methods. 2010. V. 5. № 7. P. 335–336.
Chang B.V., Lu Z.J., Yuan S.Y. Anaerobic degradation of nonylphenol in subtropical mangrove sediments // J. Hazardous Materials. 2009. V. 165. P. 162–167. https://doi.org/https://doi.org/10.1016/j.jhazmat.2008.09.085
Das K.C., Xia K. Trans formation of 4-nonylphenol isomers during biosolids composting // Chemosphere. 2008. V. 70. P. 761–768. https://doi.org/https://doi.org/10.1016/j.chemosphere.2007.07.039
Doucette W., Wheeler B.R., Chard J.K., Bugbee B., Naylor C.G., Carbone J.P., Sims R.C. Uptake of nonylphenol and nonylphenol ethoxylates by crested wheatgrass // Environ. Sci. Technol. 2005. V. 24. P. 2965–2972. https://doi.org/https://doi.org/10.1897/05-171R.1
Ekelund R., Bergman A., Granmo A., Berggren M. Bioaccumulation of 4-nonylphenol in marine animals: a re-evalution // Environ. Poll. 1990. V. 64. P. 107–120. https://doi.org/https://doi.org/10.1016/0269-7491(90)90108-O
Fujii K., Urano N., Ushio H., Satomi M., Kimura S. Sphingomonas cloacae sp. nov., a nonylphenol-degrading bacterium isolated from wastewater of a sewage-treatment plant in Tokyo // Int. J. Syst. Evol. Microbiol. 2001. V. 51. P. 603–610. https://doi.org/10.1099/00207713-51-2-603
Hansel C., Fendorf P., Jardine S., Francis C. Changes in bacterial and archaeal community structure and functional diversity along a geochemically variable soil profile // Appl. Environ. Microbiol. 2008. V. 74. P. 1620–1633. https://doi.org/10.1128/AEM.01787-07
Hseu Z.Y. Response of microbial activities in two contrasting soils to 4-nonylphenol treated with biosolids // Chemosphere. 2006. V. 64. P. 1769–1776. https://doi. org/https://doi.org/10.1016/j.chemosphere.2005.12.042
Jontofsohn M., Stoffels M., Hartman A., Pfister G. et al. Influence of nonylphenol on the microbial community of lake sediments in microcosms // The Science of the Total Environment. 2002. V. 285. P. 3–10. https:// doi.org/https://doi.org/10.1007/BF02991042
Kim Y., Korshin G.V., Velichenko A.B. Comparative study of electrochemical degradation and ozonation of nonylphenol // Water Res. 2005. V. 39. P. 2527–2534. https://doi.org/https://doi.org/10.1016/j.watres.2005.04.070
Kuzikova I., Safronova V., Zaytseva T., Medvedeva N. Fate and effects of nonylphenol in the filamentous fungus Penicillium expansum isolated from the bottom sediments of the Gulf of Finland // J. Marine Systems. 2017. V. 171. P. 111–119. http://dx.doi.org/https://doi.org/10.1016/ j.jmarsys.2016.06.003
Langdon K.A., Warne M.St.J., Smernik R.J., Shareef A., Kookana R.S. Degradation of 4-nonylphenol, 4-t-octylphenol, bisphenol A and triclosan following biosolids addition to soil under laboratory conditions // Chemosphere. 2011. 84. P. 1556–1562. https://doi.org/ https://doi.org/10.1016/j.chemosphere.2011.05.053
Leschber R. PART I. Evaluation of the relevance of organic micro-pollutants in sewage sludge. In: Background values in European soils and sewage sludges. Results of a JRC-coordinated study on background values. Edited by B.M. Gawlik and G. Bidoglio. European Communities, 2006. 50 p.
Liu J., Shan J., Jiang B., Wang L., Yu B., Chen J., Guo H., Ji R. Degradation and bound-residue formation of nonylphenol in red soil and the effects of ammonium // Environ. Poll. 2014. P. 83–89. https://doi.org/https://doi.org/ 10.1016/ j.envpol.2013.11.017
Ma W., Nie C., Su F., Cheng X., Yan Y., Chen B., Lun X. Migration and biotransformation of three selected endocrine disrupting chemicals in different river-based aquifers media recharge with reclaimed water // Int. Biodeterioration Biodegradation. 2015. 102. P. 298–307.
Medvedeva N., Zaytseva T., Kuzikova I. Cellular responses and bioremoval of nonylphenol by the bloom-forming cyanobacterium Planktothrix agardhii 1113 // J. Marine Systems. 2017. V. 171. P. 120–128. http:// dx.doi.org/https://doi.org/10.1016/j.jmarsys.2017.01.009
Rajendran R.K., Huang S., Lin C., Kirschner R. Aerobic degradation of estrogenic alkylphenols by yeasts isolated from a sewage treatment plant // RSC Adv. 2016. V. 6. P. 82862–82871. https://doi.org/10.1039/c6ra08839b
Soares A., Guieysse B., Mattiasson B. Aerobic biodegradation of nonylphenol by cold-adapted bacteria // Biotechnol. Lett. 2003. V. 25. P. 731–738. https://doi.org/ https://doi.org/10.1023/A:1023466916678
Tuan N.N., Hsieh H.C., Lin Y.W., Huang S.L. Analysis of bacterial degradation pathways for long-chain alkylphenols involving phenol hydroxylase, alkylphenol monooxygenase and catechol dioxygenase genes // Bioresource Technology. 2011. V. 102. P. 4232–4240. https://doi.org/10.1016/j.biortech.2010.12.067
Tuan N.N., Lin Y.W., Huang S.L. Catabolism of 4-alkylphenols by Acinetobacter sp. OP5: Genetic organization of the oph gene cluster and characterization of alkylcatechol 2, 3-dioxygenase // Bioresource Technology. 2013. V. 131. P. 420–428. http://dx.doi.org
Vazquez-Duhalt R., Marquez-Rocha F., Ponce E., Licea A.F., Viana M.T. Nonylphenol, an integrated vision of a pollutant. Scientific Review // Appl. Ecol. Environ. Res. 2005. V. 4. № 1. P. 1–25.
Vikelsøe J., Thomsen M., Johansen E., Carlsen L. Phthalates and Nonylphenols in Soil. NERI Technical Report No. 268 // Ministry of Environment and Energy National Environmental Research Institute. 1999. 130 p.
Wang Z., Yang Y., Dai Y., Xi S. Anaerobic biodegradation of nonylphenol in river under nitrate- or sulfate-reducing conditions and associated bacterial community // J. Hazardous Materials. 2015. V. 286. P. 306–314. https://doi.org/https://doi.org/10.1016/j.jhazmat.2014.12.057
Wang Z., Yang Y., Sun W., Xie S., Liu Y. Nonylphenol biodegradation in river sediment and associated shifts in community structures of bacteria and ammonia-oxidizing microorganisms // Ecotoxicology and Environmental Safety. 2014. V. 106. P. 1–5. https://doi.org/https://doi.org/ 10.1016/j.ecoenv.2014.04.019
Widarto T.N., Holmstrup M., Forbes V.E. The influence of nonylphenol on life-history of the earthworm Dendrobaena octaedra Savigny: linking effects from the individual- to the population-level // Ecotoxicology and Environmental Safety. 2004. V. 58. P. 147–159. https://doi.org/https://doi.org/10.1016/j.ecoenv.2004.03.006
Yang C.W., Tang S.L., Chen L.Y., Chang B.V. Removal of nonylphenol by eartworms and bacterial community change // International Biodeterioration and Biodegradation. 2014. V. 96. P. 9–17. https://doi.org/https://doi.org/ 10.1016/j.ibiod.2014.09.010
Ying G.G., Kookana R.S., Dillon P. Sorption and degradation of selected five endocrine disrupting chemicals in aquifer material // Water Res. 2003. V. 37. P. 3785–3791. https://doi.org/https://doi.org/10.1016/S0043-1354(03)00261-6
Zhang Y., Liu Y., Dong H., Li X., Zhang D. The nonylphenol biodegradation study by estuary sediment-derived fungus Penicillium simplicissimum // Environ. Sci. Pollut. Res. 2016. V. 23. № 15. P. 15122–15132. https://doi.org/10.1007/s11356-016-6656-7
Дополнительные материалы отсутствуют.