Почвоведение, 2019, № 7, стр. 817-826
Сорбция ионов Cu2+ и Zn2+ гуминовыми кислотами тундровой торфяно-глеевой почвы
Е. Д. Лодыгин *
Институт биологии Коми научного центра Уральского отделения Российской академии наук
167982 Республика Коми, Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: soil99@mail.ru
Поступила в редакцию 06.08.2018
После доработки 15.11.2018
Принята к публикации 26.12.2018
Аннотация
Дана характеристика сорбционных свойств препаратов гуминовых кислот (ГК), выделенных из оторфованного горизонта тундровой торфяно-глеевой почвы (Histic Reductaquic Cryosols). Рассчитаны кинетические и термодинамические параметры сорбции ионов Cu2+ и Zn2+ на ГК. Установлено, что сорбция исследованных ионов тяжелых металлов препаратами ГК достоверно апроксимируется кинетическим уравнением реакции псевдопервого порядка. Отрицательные значения изменения энергии Гиббса при температурах 298.0 и 314.3 К для ионов Сu2+ (–26.2 и –24.5 кДж/моль соответственно) и для ионов Zn2+ (–22.2 и –22.0 кДж/моль соответственно) свидетельствует о возможности самопроизвольного протекания сорбции ионов данных металлов в исследованном диапазоне температур. Величины изменения энтальпии сорбции –33.1 кДж/моль для ионов Cu2+ и ‒4.5 кДж/моль для ионов Zn2+ указывают, что обе реакции являются экзотермическими. Показано, что с увеличением температуры константа сорбционного равновесия для ионов Сu2+ заметно снижается, в то время как для ионов Zn2+ ее изменение незначительно. Уменьшение значений констант сорбционного равновесия с ростом температуры указывает на смещение равновесия в сторону десорбции, что является характерным признаком физической сорбции и указывает на возможность двух механизмов связывания ионов на поверхности препаратов ГК – физическая и хемосорбция.
ВВЕДЕНИЕ
Антропогенная деятельность приводит к изменениям в структуре и функциях различных природных комплексов: изменяются темпы миграции и направления химических элементов, перемещаются зоны их накопления и выноса [3, 9, 13, 20, 35]. Тяжелые металлы (ТМ) уже сейчас занимают второе место по степени опасности, уступая лишь пестицидам и заметно опережая такие широко известные загрязнители, как оксиды серы и углерода. В будущем они могут стать опаснее отходов атомных электростанций. Загрязнение ТМ обусловлено с их широким применением в сельском хозяйстве и промышленном производстве [8, 16, 30]. В связи с несовершенными системами очистки промышленных отходов и выбросов, ТМ попадают в окружающую природную среду, в том числе в почву, загрязняя и отравляя ее [6, 24, 33]. ТМ относятся к особо токсичным загрязняющим веществам, наблюдения за которыми обязательны во всех средах [31].
По разным причинам окружающая среда оказывается перегруженной соединениями тяжелых металлов, в частности – меди и цинка [21, 40, 43]. Вследствие высокой биологической активности ионов Cu2+ и Zn2+, они, попадая в почву, включаются в разной степени в биологический круговорот [4, 11, 18].
Широко известно, что почва – главный депонирующий компонент экосистем для ТМ, куда они попадают из атмосферы и водной среды. Из почвы ТМ усваиваются растениями, которые затем попадают в пищу человека и животных [27, 29, 32]. Многочисленные исследования выявили некоторые естественные механизмы самоочищения почвы, приводящие к уменьшению биологической активности ТМ путем сорбции, осаждения в виде малорастворимых соединений и выноса из почвенного профиля [7, 19]. Для большинства ТМ процессы сорбции и биологической иммобилизации наиболее активно происходят в поверхностном слое почв, и превалирующее значение в них играют гумусовые вещества [1, 3, 36, 39, 48].
К настоящему времени накоплено немало данных о связывании ТМ гуминовыми кислотами (ГК) [5, 41, 46]. Существующие модели связывания и детоксикации ионов ТМ основаны на взаимодействии с O,N-содержащими функциональными группами, приуроченными к ароматическим фрагментам [49]. При этом вопрос об эффективности связывания таких поллютантов при низкой степени ароматичности гумусовых веществ тундровых почв европейского северо-востока России [25, 47] остается открытым. Слабая изученность кинетических и термодинамических характеристик взаимодействия ионов Cu2+ и Zn2+ с ГК обусловливает актуальность и выбор объектов исследования.
Цель работы – изучить сорбционные свойства препаратов ГК тундровой торфяно-глеевой почвы на основе определения величин кинетических и термодинамических параметров процессов сорбции ионов Cu2+ и Zn2+.
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследований служили препараты ГК из оторфованного горизонта тундровой торфяно-глеевой почвы (Histic Reductaquic Cryosols), расположенной в Большеземельской тундре Воркутинского р-на Республики Коми. Территория представляет полого-увалистую равнину, покрытую чехлом покровных пылеватых суглинков мощностью менее 10 м. Тундровым торфяно-глеевым почвам свойственно наличие поверхностной торфяной подстилки (10–30 см) и четко выраженного глеевого тиксотропного горизонта; минеральная толща малой мощности; слабодифференцированный почвенный профиль; деформация почвенного профиля, вызванная перемещением насыщенных влагой горизонтов при оттаивании и замерзании. Вечная мерзлота залегает на глубине от 55 до 80 см [5, 26]. Общая характеристика почвообразования, морфологические, физико-химические показатели почвы опубликованы ранее [1].
Выделение и очистка ГК. Экстракцию ГК проводили из воздушно-сухого образца почв путем двукратной экстракции раствором 0.1 моль/дм3 NaОН (соотношение почва раствор 1 : 10). Далее к щелочному экстракту добавляли насыщенный раствор Na2SO4 (20% от объема экстракта) для коагуляции коллоидных частиц и центрифугировали в течение 1 ч при 12000 об./мин. ГК осаждали в очищенном экстракте постепенным добавлением 10%-ного раствора H2SO4, доводя рН раствора до 2. Очистку препаратов ГК проводили диализом, затем переносили в фарфоровые чашки, сушили в сушильном шкафу при температуре 40°С, растирали в агатовой ступке и просеивали через сито с d = 0.25 мм.
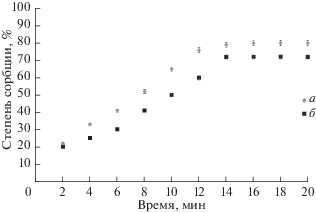
Кинетика сорбции. При исследовании кинетики сорбции ионов Cu2+ и Zn2+ использовали метод ограниченного объема [12]. Серию из десяти стеклянных колб помещали в термостат (298.0 К), в каждую из них вносили по 25 см3 исходного раствора металла и после достижения требуемой температуры раствора добавляли в него по 50 мг сухого препарата ГК, в качестве растворителя использовали 1 ммоль/дм3 раствор HNO3. Начальные концентрации растворов нитратов металлов с0(Cu2+) = = 0.787 ммоль/дм3, с0(Zn2+) = 0.765 ммоль/дм3 при pH 3, что гарантирует отсутствие гидролизных форм катионов и стабильность размеров частиц препаратов ГК. Смеси непрерывно встряхивали на шейкере, после 2, 4, 6, 8, 10, 12, 14, 16, 18, 20 мин от момента внесения адсорбента проводили их фильтрацию через мембранный фильтр “Millipore” с диаметром пор 0.22 мкм и определяли концентрацию оставшихся в растворе ионов. По разнице между введенной массой металла и оставшейся в растворе определяли количество сорбируемых ионов металлов.
Хемосорбция. Для изучения хемосорбции ионов Cu2+ и Zn2+ на ГК готовили исходные растворы, содержащих ионы металлов с концентрациями: 5, 10, 25, 35, 50, 75, 100 мкг/см3 из растворов государственных стандартных образцов (ГСО), которые разбавляли 1 ммоль/дм3 раствором HNO3. Величина рН приготовленных растворов была в пределах 3.0–3.1. Серию из семи стеклянных колб вместимостью 100 см3 с пришлифованными пробками помещали в термостат, в каждую из колб вносили навеску воздушно-сухого препарата ГК 50 мг, добавляли по 25 см3 растворов нитратов меди или цинка с нарастающей концентрацией от 5 до 100 мкг/см3. Растворы перемешивали в течение 1 ч с помощью шейкера. После установления адсорбционного равновесия отделяли взвешенные частицы от раствора путем фильтрации через мембранный фильтр “Millipore” с диаметром пор 0.22 μm. Эксперимент проводили при двух температурах: 298.0 и 314.3 К в трехкратной повторности.
Определение равновесных концентраций ионов Cu2+ и Zn2+ в фильтрате проводили на атомно-эмиссионном спектрометре с индуктивно-связанной аргоновой плазмой (Spectro Ciros, Германия) в экоаналитической лаборатории Института биологии.
Расчет показателей. Определение кинетических параметров сорбции ионов Cu2+ и Zn2+ проводилось по уравнению:
где η – степени сорбции, %; C0 – начальная молярная концентрация ионов металла (моль/дм3); C – молярная концентрация ионов металла в момент времени t (моль/дм3).Для определения псевдопорядка был выбран графический метод с использованием кинетических уравнений для реакций целочисленного порядка – первого (2), второго (3) и третьего (4) [14]:
где ki – константа скорости i-го порядка реакции; t – время реакции (мин).Удельная избыточная сорбция Гиббса рассчитывалась по уравнению:
где x/m – количество сорбированных ионов металла (x) на единицу массы (m) ГК, моль/г; Ср – равновесная молярная концентрация ионов металлов после сорбции, моль/дм3; V – объем раствора, дм3.Полученные изотермы сорбции теоретически могут быть описаны на основе двух уравнений:
1) эмпирического уравнения Фрейндлиха, которое обычно используют для представления среднего участка изотермы сорбции [37]:
(6)
${х \mathord{\left/ {\vphantom {х m}} \right. \kern-0em} m} = {\text{ }}{{K}_{{{\text{Fr}}}}}С _{{\text{р }}}^{{{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} n}} \right. \kern-0em} n}}}$или в линейной форме:
(7)
$\lg ({х \mathord{\left/ {\vphantom {х m}} \right. \kern-0em} m}) = \lg {{K}_{{{\text{Fr}}}}} + {1 \mathord{\left/ {\vphantom {1 n}} \right. \kern-0em} n}\lg {{С }_{{\text{р }}}},$2) модельного уравнения мономолекулярной сорбции Лэнгмюра, описывающего изотерму сорбции во всем интервале концентраций [49]:
(8)
${х \mathord{\left/ {\vphantom {х m}} \right. \kern-0em} m} = {{Q}_{{{\text{max}}}}}{{\left( {{{K}_{{{\text{sorb}}}}}{{C}_{{\text{p}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{K}_{{{\text{sorb}}}}}{{C}_{{\text{p}}}}} \right)} {\left( {1{\text{ }} + {{K}_{{{\text{sorb}}}}}{{C}_{{\text{p}}}}} \right)}}} \right. \kern-0em} {\left( {1{\text{ }} + {{K}_{{{\text{sorb}}}}}{{C}_{{\text{p}}}}} \right)}}$или в линейной форме:
(9)
${{{{{{С }_{{\text{р }}}}} \mathord{\left/ {\vphantom {{{{С }_{{\text{р }}}}} x}} \right. \kern-0em} x}} \mathord{\left/ {\vphantom {{{{{{С }_{{\text{р }}}}} \mathord{\left/ {\vphantom {{{{С }_{{\text{р }}}}} x}} \right. \kern-0em} x}} m}} \right. \kern-0em} m} = {1 \mathord{\left/ {\vphantom {1 {({{K}_{{{\text{sorb}}}}}{{Q}_{{{\text{max}}}}})}}} \right. \kern-0em} {({{K}_{{{\text{sorb}}}}}{{Q}_{{{\text{max}}}}})}} + ({1 \mathord{\left/ {\vphantom {1 {{{Q}_{{{\text{max}}}}}}}} \right. \kern-0em} {{{Q}_{{{\text{max}}}}}}}){{C}_{{\text{р }}}},$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Большая часть фундаментальных исследованию по изучению скоростей процессов, которые проходят с участием ионообменных материалов, посвящена проблеме кинетики ионного обмена, кроме того, количественная теория разработана только для идеальных систем [15]. Кинетика ионного обмена и процессов комплексообразования, осложненных образованием малодиссоциирующих соединений, остается наименее изученной областью [10, 22, 34 ]. Кроме того, образование малодиссоциирующих комплексных соединений ионов металлов с функциональными группами гумусовых кислот должно приводить к изменению кинетических закономерностей, отмеченных для чистого ионного обмена [42].
На рис. 1 представлены временные зависимости степени сорбции ионов металлов, рассчитанные по уравнению (1). Выход кинетических кривых на плато для обоих ионов соответствует 14–16 мин от начала сорбции.
Если принять, что количество лигандов в структуре ГК значительно превышает начальную концентрацию ионов металлов, то в законе действующих масс для процесса сорбции можно перейти к псевдопорядку относительно катионов металлов. Признаком соответствия кинетических данных определенному порядку реакции является их линейная зависимость в соответствующих координатах согласно уравнений (2)–(4). На основании экспериментальных данных были рассчитаны параметры трех типов линейных зависимостей и определены коэффициенты корреляции (табл. 1). Более высокие коэффициенты корреляции отмечены при описании экспериментальных данных с помощью кинетического уравнения реакции псевдопервого порядка.
Таблица 1.
Кинетические уравнения сорбции ионов Cu2+ и Zn2+ гуминовыми кислотами при T = 298.0 К и pH 3 и коэффициенты корреляции (r)
| Псевдопорядок реакции | Сорбируемый ион | |||
|---|---|---|---|---|
| Cu2+ | Zn2+ | |||
| Первый | lnC = –7.067 – 0.116t | r = 0.986 | lnC = –7.109 – 0.085t | r = 0.964 |
| Второй | 1/C = 252.0 + 384.6t | r = 0.955 | 1/C = 730.0 + 230.4t | r = 0.917 |
| Третий | 1/С2 = –9 × 106 + 3 × 106t | r = 0.915 | 1/С2 = –3 × 106 + 1 × 106t | r = 0.857 |
Таким образом, константы скорости сорбции ионов равны k (Cu2+) = 0.116 мин–1 и k (Zn2+) = = 0.085 мин–1. Кроме того, согласно полученным уравнениям рассчитанные значения начальных молярных концентраций исследуемых ионов (Сoi) для модели псевдопервого порядка близки к экспериментальным.
Анализ данных литературы свидетельствует, что в настоящее время существуют два основных подхода к исследованию взаимодействий ионов металлов с ГК в водной среде. Первый заключается в исследовании взаимодействия ионов металлов с дисперсиями препаратов ГК [5, 49], в силу их крайне низкой растворимости в воде, или с нативным торфом [17, 45], второй – в исследовании взаимодействия ионов металлов с растворенными ГВ [38, 44]. В нашей работе исследования сорбции ионов металлов на препаратах ГК были осуществлены в рамках первого подхода.
Взаимодействие катионов металлов с препаратами ГК обычно сводится к процессам сорбции. Количественной характеристикой сорбцией является удельная избыточная сорбция Гиббса, рассчитываемая по уравнению (5).
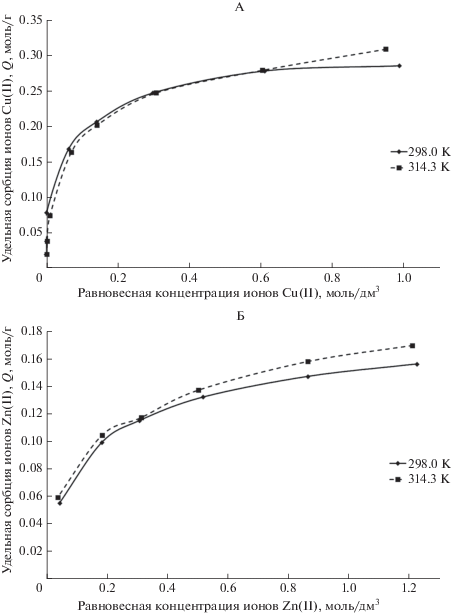
Экспериментально были определены изотермы сорбции для ионов Cu2+ и Zn2+ при двух температурах 298.0 и 314.3 К. Время сорбции составляло 1 ч. Результаты представлены в табл. 2.
Таблица 2.
Данные по сорбции ионов Cu2+ и Zn2+ при различных температурах
| Равновесная концентрация ионов Cu2+, С, ммоль/дм3 | Количество сорбированных ионов Cu2+ на единицу массы ГК, x/m, ммоль/г | Равновесная концентрация ионов Zn2+, С, ммоль/дм3 | Количество сорбированных ионов Zn2+ на единицу массы ГК, x/m, ммоль/г |
|---|---|---|---|
| Т = 298.0 К | |||
| 0.9845 | 0.2844 | 1.2253 | 0.1560 |
| 0.6093 | 0.2773 | 0.8655 | 0.1470 |
| 0.2969 | 0.2461 | 0.5190 | 0.1320 |
| 0.1406 | 0.2055 | 0.3092 | 0.1150 |
| 0.0625 | 0.1672 | 0.1847 | 0.0991 |
| 0.0012 | 0.0775 | 0.0453 | 0.0553 |
| 0.0008 | 0.0371 | – | – |
| 0.0005 | 0.0185 | – | – |
| Т = 314.3 К | |||
| 0.9468 | 0.3078 | 1.2107 | 0.1693 |
| 0.6031 | 0.2781 | 0.8656 | 0.1577 |
| 0.3063 | 0.2461 | 0.5043 | 0.1370 |
| 0.1422 | 0.2008 | 0.3151 | 0.1171 |
| 0.0703 | 0.1625 | 0.1862 | 0.1044 |
| 0.0109 | 0.0734 | 0.0394 | 0.0594 |
| 0.0031 | 0.0375 | – | – |
| 0.0016 | 0.0188 | – | – |
При построении изотерм сорбции ионов Cu2+ и Zn2+ при разных температурах (рис. 2) установлено, что они не выходят на плато. Полученные данные свидетельствуют, что концентрация ионов Cu2+ и Zn2+ в эксперименте (до 100 мкг/дм3) недостаточна для предельной сорбции.
Соответствие экспериментальных данных уравнениям Фрейндлиха и Ленгмюра доказывается на основе их линейных форм путем построения графиков в соответствующих координатах – если точки укладываются на прямую линию, то это служит критерием возможности использования указанных уравнений для описания изотерм сорбции (свертывание экспериментальных данных).
На рис. 3 представлены экспериментальные данные в координатах линейной формы уравнения Фрейндлиха. На основе определения коэффициентов линейной регрессии были рассчитаны параметры обоих уравнений (табл. 3). Выражения (10)–(13) представляют собой обработку массива экспериментальных точек по уравнению линейной регрессии:
Рис. 3.
Изотерма сорбции ионов Cu2+ (А) и Zn2+ (Б) на ГК в координатах линейной формы уравнения Фрейндлиха при температурах 298.0 (I) и 314.3 К (II). Коридор ошибок указан для P = 0.95.
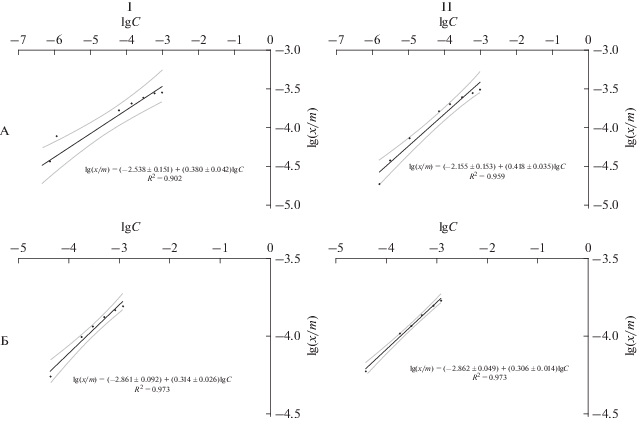
Таблица 3.
Параметры уравнений Фрейндлиха и коэффициенты корреляции (r)
| Температура, К | KFr | 1/n | r |
|---|---|---|---|
| Cu2+ | |||
| 298.0 | (2.90 ± 0.17) × 10–3 | 0.308 ± 0.042 | 0.950 |
| 314.3 | (7.00 ± 0.50) × 10–3 | 0.418 ± 0.035 | 0.979 |
| Zn2+ | |||
| 298.0 | (1.38 ± 0.04) × 10–3 | 0.314 ± 0.026 | 0.986 |
| 314.3 | (1.37 ± 0.02) × 10–3 | 0.306 ± 0.014 | 0.986 |
для ионов Cu2+
(10)
$\begin{gathered} \lg ({х \mathord{\left/ {\vphantom {х m}} \right. \kern-0em} m}) = (--2.538 \pm 0.151) + \\ + \,\,(0.308 \pm 0.042)\lg С \,(r = 0.950){\text{ }}298.0{\text{ К ,}} \\ \end{gathered} $(11)
$\begin{gathered} \lg ({х \mathord{\left/ {\vphantom {х m}} \right. \kern-0em} m}) = (--2.155 \pm 0.153) + \\ + \,\,(0.418 \pm 0.035)\lg С \,(r = 0.979){\text{ }}314.3{\text{ К }} \\ \end{gathered} $для ионов Zn2+
(12)
$\begin{gathered} \lg ({х \mathord{\left/ {\vphantom {х m}} \right. \kern-0em} m}) = (--2.861 \pm 0.092) + \\ + \,\,(0.314 \pm 0.026)\lg С \,(r = 0.986){\text{ }}298.0{\text{ К ,}} \\ \end{gathered} $(13)
$\begin{gathered} \lg ({х \mathord{\left/ {\vphantom {х m}} \right. \kern-0em} m}) = (--2.862 \pm 0.049) + \\ + \,\,(0.306 \pm 0.014)\lg С \,(r = 0.986){\text{ }}314.3{\text{ К }}. \\ \end{gathered} $На рис. 4 представлены экспериментальные данные в координатах линейной формы уравнения мономолекулярной адсорбции Ленгмюра. На основе определения коэффициентов линейной регрессии были рассчитаны параметры обоих уравнений – константы сорбции ионов и их предельная сорбция в расчете на единицу массы ГК (табл. 4). Выражения (14)–(17) представляют собой обработку массива экспериментальных точек по уравнению линейной регрессии:
Рис. 4.
Изотерма сорбции ионов Cu2+ (А) и Zn2+ (Б) на ГК в координатах линейной формы уравнения Ленгмюра при температурах 298.0 K (I) и 314.3 К (II). Коридор ошибок указан для P = 0.95.

Таблица 4.
Термодинамические параметры сорбции ионов Cu2+ и Zn2+ препаратами ГК
| Температура, К | Предельная удельная адсорбция, ммоль/г | Константа сорбционного равновесия | Изменение энергии Гиббса, кДж/моль | Тепловой эффект сорбции, кДж/моль |
|---|---|---|---|---|
| Cu2+ | ||||
| 298.0 | 0.288 ± 0.007 | 39 000 ± 11 000 | –26.2 | –33.1 |
| 314.3 | 0.313 ± 0.011 | 19 600 ± 5400 | –24.5 | |
| Zn2+ | ||||
| 298.0 | 0.170 ± 0.004 | 7800 ± 1000 | –22.2 | –4.5 |
| 314.3 | 0.185 ± 0.008 | 7100 ± 1400 | –22.0 | |
для ионов Cu2+
(14)
$\begin{gathered} {{{C \mathord{\left/ {\vphantom {C x}} \right. \kern-0em} x}} \mathord{\left/ {\vphantom {{{C \mathord{\left/ {\vphantom {C x}} \right. \kern-0em} x}} m}} \right. \kern-0em} m} = (0.089 \pm 0.037) + \\ + \,\,(3470 \pm 90)С (r = 0.998){\text{ }}298.0{\text{ К ,}} \\ \end{gathered} $(15)
$\begin{gathered} {{{C \mathord{\left/ {\vphantom {C x}} \right. \kern-0em} x}} \mathord{\left/ {\vphantom {{{C \mathord{\left/ {\vphantom {C x}} \right. \kern-0em} x}} m}} \right. \kern-0em} m} = (0.163 \pm 0.045) + \\ + \,\,(3190 \pm 110)С (r = 0.996){\text{ }}314.3{\text{ К }} \\ \end{gathered} $для ионов Zn2+
(16)
$\begin{gathered} {{{C \mathord{\left/ {\vphantom {C x}} \right. \kern-0em} x}} \mathord{\left/ {\vphantom {{{C \mathord{\left/ {\vphantom {C x}} \right. \kern-0em} x}} m}} \right. \kern-0em} m} = (0.754 \pm 0.097) + \\ + \,\,(5880 \pm 150)С (r = 0.999){\text{ }}298.0{\text{ К ,}} \\ \end{gathered} $(17)
$\begin{gathered} {{{C \mathord{\left/ {\vphantom {C x}} \right. \kern-0em} x}} \mathord{\left/ {\vphantom {{{C \mathord{\left/ {\vphantom {C x}} \right. \kern-0em} x}} m}} \right. \kern-0em} m} = (0.762 \pm 0.153) + \\ + \,\,(5410 \pm 230)С (r = 0.996){\text{ }}314.3{\text{ К }}{\text{.}} \\ \end{gathered} $Высокие коэффициенты корреляции для уравнений (14)–(17) позволяет нам утверждать, что модельное уравнение мономолекулярной адсорбции Ленгмюра адекватно описывает изотермы сорбции ионов Cu2+ и Zn2+ во всей области исследованных концентраций. Этот вариант описания изотермы сорбции имеет преимущество перед уравнением Фрейндлиха, которое применимо для ограниченного интервала концентраций, и, в нашем случае, имеет меньшие значения коэффициентов корреляции. Кроме того, уравнение Лэнгмюра следует из определенной модели сорбции и в рамках этой модели параметры Ksorb и Qmax имеют строгий термодинамический смысл – константы сорбционного равновесия и предельной удельной адсорбции [23].
На основе коэффициентов уравнений (14)–(17) были рассчитаны термодинамические характеристики сорбции ионов металлов. Из табл. 4 следует, что предельная удельная адсорбция ионов Cu2+ статистически достоверна выше, чем ионов Zn2+. Близкие результаты были получены другими исследователями. Так, по данным [28], при рН 3–5 и времени экспозиции 4 сут, предельная сорбция металлов на ГК различного происхождения составляла 0.17–0.22 ммоль/г для ионов Cu2+ и 0.09–0.18 ммоль/г для ионов Zn2+. По другим данным, для почвенных ГК при рН 3 она составляла 0.23 ммоль/г для ионов Cu2+ и 0.29 ммоль/г для Pb2+ [37].
С увеличением температуры константа сорбционного равновесия для ионов Сu2+ заметно снижается, в то время как для ионов Zn2+ ее изменение незначительно. Кроме того, константа сорбционного равновесия для ионов меди гораздо выше в 3–5 раз, чем у ионов цинка, что свидетельствует о более эффективном связывании ионов Cu2+ препаратами ГК и обусловлено усилением способности к π-дативному взаимодействию с функциональными группами ГК в ряду Zn2+–Cu2+ (табл. 4).
Отрицательные значения изменения энергии Гиббса при обеих температурах для ионов Сu2+ (–26.2 и –24.5 кДж/моль соответственно) и для ионов Zn2+ (–22.2 и –22.0 кДж/моль соответственно) свидетельствует о возможности самопроизвольного протекания сорбции ионов данных металлов в исследованном диапазоне температур. Величины изменения энтальпии сорбции ‒33.1 кДж/моль для ионов Cu2+ и –4.5 кДж/моль для ионов Zn2+, рассчитанные на основе интегральной формы уравнения Вант-Гоффа, указывают, что обе реакции являются экзотермическими.
ЗАКЛЮЧЕНИЕ
Сорбция ионов Cu2+ и Zn2+ препаратами ГК описывается кинетическими уравнениями реакции псевдопервого порядка. Предельная удельная адсорбция ионов металлов на ГК тундровой торфяно-глеевой почвы составляет 0.288–0.313 ммоль/г для ионов Cu2+ и она статистически достоверна выше, чем ионов Zn2+ (0.170–0.185 ммоль/г). Процесс сорбции экзотермичен, отрицательные значения изменения энергии Гиббса при температурах 298.0 и 314.3 К свидетельствуют о возможности его самопроизвольного протекания для ионов обоих металлов. Уменьшение значений констант сорбционного равновесия с ростом температуры указывает на смещение равновесия в сторону десорбции, что является характерным признаком физической сорбции и указывает на возможность двух механизмов связывания ионов на поверхности препаратов ГК – физическая и хемосорбция.
Благодарность. Работа выполнена в рамках госбюджетной темы Института биологии (№ Гр. AAAA-A17-117122290011-5).
Список литературы
Безносиков В.А., Лодыгин Е.Д. Фракционно-групповой состав гумусокриогенных поверхностно-глеевых и гидроморфных почв Большеземельской тундры // Вестн. СПб. ун-та. Сер. 3. Биология. 2012. Вып. 1. С. 107–120.
Безносиков В.А., Лодыгин Е.Д., Кондратенок Б.М. Оценка фонового содержания тяжелых металлов в почвах европейского северо-востока России // Почвоведение. 2007. № 9. С. 1064–1070.
Безносиков В.А., Лодыгин Е.Д., Чуков С.Н. Ландшафтно-геохимическая оценка фонового содержания тяжелых металлов в почвах таежной зоны // Вестн. СПб. ун-та. Сер. 3: Биология. 2010. Вып. 2. С. 114–128.
Богатырев Л.Г., Ладонин Д.В., Семенюк О.В. Микроэлементный состав некоторых почв и почвообразующих пород южной тайги Русской равнины // Почвоведение. 2003. № 5. С. 568–576.
Василевич Р.С., Безносиков В.А., Лодыгин Е.Д., Кондратенок Б.М. Комплексообразование ионов ртути (II) с гуминовыми кислотами тундровых почв // Почвоведение. 2014. № 3. С. 283–294. https://doi.org/10.7868/ S0032180X14030113
Водяницкий Ю.Н. Природные и техногенные соединения тяжелых металлов в почвах // Почвоведение. 2014. № 4. С. 420–432. https://doi.org/10.7868/ S0032180X14040108
Водяницкий Ю.Н., Плеханова И.О. Биогеохимия тяжелых металлов в загрязненных переувлажненных почвах (аналитический обзор) // Почвоведение. 2014. № 3. С. 273–282. https://doi.org/10.7868/ S0032180X14030125
Водяницкий Ю.Н., Плеханова И.О., Прокопович Е.В., Савичев А.Т. Загрязнение почв выбросами предприятий цветной металлургии // Почвоведение. 2011. № 2. С. 240–249.
Водяницкий Ю.Н., Яковлев А.С. Оценка загрязнения почвы по содержанию тяжелых металлов в профиле // Почвоведение. 2011. № 3. С. 329–335.
Голованов И.Б., Женодарова С.М., Хабарова М.И. Корреляционное соотношение структура – свойство. XXI. Пространственное влияние заместителей на энергию комплексообразования и кинетику химических реакций // Журнал общей химии. 2005. Т. 75. № 5. С. 719–723.
Головко Т.К., Гармаш Е.В., Скугорева С.Г. Тяжелые металлы в окружающей среде и растительных организмах // Вестник Института биологии Коми НЦ УрО РАН. 2008. № 7(129). С. 2–7.
Диффузионные процессы в ионитах / Под ред. Н.И. Николаева. М.: НИФХИ им. Л.Я. Карпова, 1983. 136 с.
Добровольский В.В. География микроэлементов. Глобальное рассеивание. М.: Мысль, 1983. 272 с.
Добычин Д.П., Каданер Л.И., Серпинский В.В., Буркат Т.М., Ганелина Е.Ш., Лобов Б.И. Физическая и коллоидная химия. М.: Просвещение, 1986. 463 с.
Долгоносов А.М., Хамизов Р.Х., Крачак А.Н., Прудковский А.Г., Колотилина Н.К. Нелинейная кинетика многокомпонентного ионного обмена. Макроскопическая модель и немонотонные кривые // Сорбционные и хроматографические процессы. 2014. Т. 14. № 5. С. 724–734.
Дубовик В.А. Тяжелые металлы в почвах тамбовской равнины и их нейтрализация // Вестник Российской академии сельскохозяйственных наук. 2009. № 4. С. 27–28.
Жуйкова А.В., Горленко Н.П., Чернов Е.Б., Наумова Л.Б. Математические модели сорбции ионов меди и кобальта верховым торфом // Вестник ТГАСУ. 2013. № 3. С. 236–242.
Золотарева Б.Н. Тяжелые металлы в почвах Верхнеокского бассейна // Почвоведение. 2003. № 2. С. 173–182.
Ильин В.Б. Тяжелые металлы в системе почва – растение // Почвоведение. 2007. № 9. С. 1112–1119.
Ильин В.Б., Сысо А.И., Байдина Н.Л., Конорбаева Г.А., Черевко А.С. Фоновое количество тяжелых металлов юга Западной Сибири // Почвоведение. 2003. № 5. С. 550–556.
Карпухин М.М., Ладонин Д.В. Влияние компонентов почвы на поглощение тяжелых металлов в условиях техногенного загрязнения // Почвоведение. 2008. № 11. С. 1388–1389.
Кондрашова А.В. Кинетика ионного обмена катионов металлов на природном сорбенте // Science Time. 2015. № 4(16). С. 382–385.
Ладонин Д.В. Особенности специфической сорбции меди и цинка некоторыми почвенными минералами // Почвоведение. 1997. № 12. С. 1478–1485.
Липатов Д.Н., Щеглов А.И., Манахов Д.В., Карпухин М.М., Завгородняя Ю.А., Цветнова О.Б. Распределение тяжелых металлов и бенз(а)пирена в торфяных олиготрофных почвах и торфяно-глееземах на северо-востоке о. Сахалин // Почвоведение. 2018. № 5. С. 551–562. https://doi.org/10.7868/S0032180X18050040
Лодыгин Е.Д., Безносиков В.А., Василевич Р.С. Молекулярный состав гумусовых веществ тундровых почв (13С-ЯМР-спектроскопия) // Почвоведение. 2014. № 5. С. 546–552. https://doi.org/10.7868/ S0032180X14010079
Мажитова Г.Г. Температурные режимы почв в зоне несплошной многолетней мерзлоты европейского северо-востока России // Почвоведение. 2008. № 1. С. 54–67.
Михеева Е.В., Жигальский О.А., Мамина В.П. Тяжелые металлы в системе почва–растение–животное в районе естественной геохимической аномалии // Экология. 2003. № 4. С. 318–320.
Орлов Д.С., Садовникова Л.К., Саврова А.Л. Сравнительное изучение сорбционного поглощения тяжелых металлов гуминовыми кислотами различного происхождения // Доклады РАН. Сер. Геохимия. 1995. Т. 34. № 4. С. 535–537.
Осипова Н.А., Язиков Е.Г., Янкович Е.П. Тяжелые металлы в почве и овощах как фактор риска для здоровья человека // Фундаментальные исследования. 2013. № 8–3. С. 681–686.
Раскатов А.В., Черников В.А., Кузнецов А.В., Раскатов В.А. Транслокация тяжелых металлов в загрязненном агроценозе // Известия ТСХА. 2002. № 3. С. 85–100.
СанПиН 2.1.7.1287-03. Санитарно-эпидемиологические требования к качеству почвы. Утверждены Главным государственным санитарным врачом Российской Федерации 16 апреля 2003 г., дата введения с 15 июня 2003 г. 12 с.
Трибис Л.И., Селицкая О.В., Борисов Б.А. Фитоэкстракция тяжелых металлов из техногенного грунта и состояние почвенных микроорганизмов // Известия ТСХА. 2015. № 2. С. 50–57.
Фахрутдинов А.И., Наконечный Н.В. Тяжелые металлы в почвах города Сургута // Известия Самарского научного центра РАН. 2013. Т. 15. № 3. С. 1012–1015.
Хохлов В.Ю., Пискунов К.П. Феноменологическая модель кинетики многокомпонентного ионного обмена в процессах хроматографического разделения веществ // Сорбционные и хроматографические процессы. 2006. Т. 6. № 1. С. 149–156.
Черников В.А., Соколов О.А. Стратегия получения экологически безопасной продукции // Агроэкология. 2014. № 1. С. 13–18.
Чимитдоржиева Г.Д., Нимбуева А.З., Бодеева Е.А. Тяжелые металлы в системе порода–почва–гумус–растение лугово-черноземной мерзлотной почвы Бурятии // Агрохимия. 2014. № 1. С. 90–96.
Ashley J.T.F. Adsorption of Cu (II) and Zn (II) by estuarine, riverine and terrestrial humic acids // Chemosphere. 1996. V. 33. №. 11. P. 2175–2187. https://doi.org/10.1016/ 0045-6535(96)00324-4
Baken S., Degryse F., Verheyen L., Merckx R., Smolders E. Metal complexation properties of freshwater dissolved organic matter are explained by its aromaticity and by anthropogenic ligands // Environmental Science and Technology. 2011. V. 45. № 7. P. 2584–2590. https://doi.org/10.1021/es103532a
Christl I., Kretzschmar R. Interaction of copper and fulvic acid at the hematite–water interface // Geochimica et Cosmochimica Acta. 2001. V. 65. № 20. P. 3435–3442.
Covelo E.F., Vega F.A., Andrade M.L. Simultaneous sorption and desorption of Cd, Cr, Cu, Ni, Pb, and Zn in acid soils II. Soil ranking and influence of soil characteristics // Journal of Hazardous Materials. 2007. V. 147. P. 862–870. https://doi.org/10.1016/j.jhazmat.2007.01.108
Gezici O., Kara H., Ayar A., Topkafa M. Sorption behavior of Cu(II) ions on insolubilized humic acid under acidic conditions: An application of Scatchard plot analysis in evaluating the pH dependence of specific and nonspecific bindings // Separation and Purification Technology. 2007. V. 55. P. 132–139. https://doi.org/10.1016/ j.seppur.2006.11.012
Leyden D.E., Underwood A.L. Equilibrium studies with the chelating ion-exchange resin Dowex A-1 // J. Phys. Chem. 1964. V. 68. № 8. P. 2093–2097.
Mathur R., Jin L., Prush V., Paul J., Ebersole C., Fornadel A., Williams J.Z., Brantley S. Cu isotopes and concentrations during weathering of black shale of the Marcellus Formation, Huntingdon County, Pennsylvania (USA) // Chemical Geology. 2012. V. 304–305. P. 175–184.
Mou J., Shi W., Li C., Wang G. Complexation and sorption studies of Co(II) with γ-alumina-bound fulvic acid: Effect of pH, ionic strength, fulvic acid and alumina concentration // Journal of Radioanalytical and Nuclear Chemistry. 2012. V. 291. № 3. P. 1099–1104. https://doi.org/10.1007/s10967-011-1567-z
Smith E.J., Rey-Castro C., Longworth H., Lofts S., Lawlor A.J., Tipping E. Cation binding by acid-washed peat, interpreted with Humic Ion-Binding Model VI-FD // European Journal of Soil Science. 2004. V. 55. № 3. P. 433–447. https://doi.org/10.1111/j.1365-2389.2004.00607.x
Tan X.L., Chang P.P., Fan Q.H., Zhou X., Yu S.M., Wu W.S., Wang X.K. Sorption of Pb(II) on Na-rectorite: Effects of pH, ionic strength, temperature, soil humic acid and fulvic acid // Colloids and Surfaces A: Physicochem. Eng. Aspects. 2008. V. 328. P. 8–14. https://doi.org/10.1016/j.colsurfa.2008.06.022
Vasilevich R., Lodygin E., Beznosikov V., Abakumov E. Molecular composition of raw peat and humic substances from permafrost peat soils of European Northeast Russia as climate change markers // Science of the Total Environment. 2018. V. 615. P. 1229–1238. https://doi.org/10.1016/j.scitotenv.2017.10.053
Wong J.W.C., Li K.L., Zhou L.X., Selvam A. The sorption of Cd and Zn by different soils in the presence of dissolved organic matter from sludge // Geoderma. 2007. V. 137. P. 310–317. https://doi.org/10.1016/j.geoderma.2006.08.026
Ying L., Qinyan Y., Baoyu G., Qian L., Chunling L. Adsorption thermodynamic and kinetic studies of dissolved chromium onto humic acids // Colloids and Surfaces B: Biointerfaces. 2008. V. 65. P. 25–29. https://doi.org/10.1016/j.colsurfb.2008.02.014
Дополнительные материалы отсутствуют.