Почвоведение, 2019, № 7, стр. 793-802
Изменение лабильного и микробного пулов углерода и азота в лесной подстилке при разных способах хранения образцов
М. Н. Маслов 1, *, О. А. Маслова 1, О. А. Токарева 1
1 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: maslov.m.n@yandex.ru
Поступила в редакцию 07.06.2018
После доработки 14.12.2018
Принята к публикации 26.12.2018
Аннотация
На примере образцов подстилки ельника черничного северной, средней и южной тайги проанализировано влияние способов хранения (высушивание, замораживание и хранение при низких положительных температурах) и предварительной аэробной инкубации на результат определения лабильного и микробного пулов углерода и азота. Установлено, что высушивание образцов подстилки и ее последующее увлажнение перед анализом приводит к уменьшению концентрации микробных углерода и азота на фоне увеличения концентрации элементов лабильного пула. Аналогичное воздействие на лабильный пул оказывает и замораживание образцов, однако оно не приводит к статистически значимому изменению концентрации углерода и азота микробной биомассы. Хранение при низких положительных температурах приводит к сокращению микробного пула, но неоднозначно действует на лабильные формы углерода и азота, что связано с циклами роста и отмирания микробной биомассы. Предварительная аэробная инкубация образцов подстилки не приводит к восстановлению характерной для свежих образцов концентрации углерода и азота. Основное направление трансформации соединений азота определяется соотношением C : N в лабильном органическом веществе и микробной биомассе и зависит от способа хранения: при высушивании преобладают процессы нетто-минерализации, при замораживании и хранении при низких положительных температурах – процессы нетто-иммобилизации.
ВВЕДЕНИЕ
Вопрос о влиянии способа хранения образцов на результат определения пулов углерода и азота в почвах является одной из дискуссионных методических проблем. Очевидно, что изменения параметров относительно естественного состояния будут минимальными при немедленном анализе после взятия пробы из разреза [5, 19, 24], однако часто это невозможно из-за большого количества образцов и видов анализа, либо специфики логистики. Кроме того, процедура хранения неизбежна при необходимости повторения анализов и подтверждения ранее полученных результатов. Наиболее распространенными способами хранения образцов почвы и подстилки до анализа являются высушивание до воздушно-сухого состояния, замораживание, а также хранение при низких положительных температурах. Для минимизации методических ошибок, способных существенным образом исказить получаемые результаты, целесообразно определить методы хранения, которые надежно обеспечивали бы целостность образца до тех пор, пока оператор не сможет провести соответствующий анализ.
Влияние разных способов хранения различно для разных микробиологических и химических параметров, а также почв с разным сочетанием свойств. При этом для органогенных почв и подстилок влияние способа хранения образцов на конечный результат анализа может быть более выраженным, чем для минеральных почв [16, 25]. Для исследования микробиологических параметров наиболее часто рекомендуется хранение свежих образцов при температуре +4°С [17, 22], препятствующей активному росту микробной биомассы [13, 15] и потреблению субстрата. В то же время установлено, что хранение при +4°С в течение 3 и 6 мес приводит к уменьшению содержания микробной биомассы и изменяет структуру микробного сообщества [31], а также снижает потенциальную скорость нитрификации [33]. Высушивание и последующее увлажнение может приводить к существенному изменению микробиологических параметров, в частности – уменьшению содержания микробной биомассы, а также изменяет активность большинства ферментов и почвенного дыхания [25]. Воздействие замораживания приводит к схожим результатам [28]. Одновременно с этим, высушивание и замораживание образцов сопровождается существенным увеличением концентрации лабильного углерода и азота [6, 8, 14, 34], предположительно связанным с повреждением клеток микроорганизмов. Для активизации микробиологических процессов и “оживления” хранившихся образцов почвы в практике научных исследований часто применяют их предварительную инкубацию при температуре около +22°С в течение нескольких дней [1, 4], однако этот процесс может быть связан с интенсивной минерализацией и иммобилизацией углерода и азота, что приведет к искажению получаемых результатов. На данный момент имеются немногочисленные данные, свидетельствующие о том, что восстановление биологических показателей после инкубации при оптимальных условиях зависит от метода анализа [29] и свойств почвы [21].
Цель работы – оценка влияния способа хранения и предварительной инкубации образцов лесной подстилки на результаты определения лабильного и микробного пулов углерода и азота.
ОБЪЕКТЫ И МЕТОДЫ
Использовали образцы лесной подстилки ельника черничного, собранные в экосистемах северной (Мурманская обл., Хибины), средней (Ленинградская обл., Лемболовская возвышенность) и южной (Ярославская обл., биологическая станция “Улейма”) тайги. Образцы отбирались в период с 25.08.2018 по 05.09.2018 г. В пределах каждой исследованной экосистемы выбирали участок площадью 100 м2 на котором случайным образом равномерно по площади отбирали образцы в четырехкратной повторности. Подстилка отбиралась с выделением горизонтов: свежего опада – L, ферментативного – F (присутствовал только в средней тайге) и перегнойного – H. Диагностика и классификация лесных подстилок проводилась согласно [3], все исследованные подстилки отнесены к типу перегнойных. Общая характеристика свойств изученных объектов представлена в табл. 1. Подстилки характеризуются высоким содержанием органического углерода (36–47%) на фоне низкой обеспеченности азотом (С : N = 25–46) и низкой зольности. По мере трансформации растительного опада в гор. F и H происходит постепенная потеря углерода и увеличение относительного содержания азота и зольных компонентов. По показателю рН водной суспензии все исследованные горизонты подстилки относятся к кислым, при этом в более южных экосистемах происходит постепенное увеличение актуальных значений рН горизонтов.
Таблица 1.
Общие свойства исследованных горизонтов лесной подстилки
| Зона | Горизонт | рН водн | Зольность | Собщ | Nобщ | C : N |
|---|---|---|---|---|---|---|
| % | ||||||
| Северная тайга | L | 4.2 ± 0.2 | 7.9 ± 1.2 | 45.5 ± 0.1 | 2.0 ± 0.2 | 27.3 ± 2.4 |
| H | 4.8 ± 0.3 | 18.3 ± 2.9 | 44.0 ± 1.7 | 2.0 ± 0.1 | 25.3 ± 0.4 | |
| Средняя тайга | L | 5.0 ± 0.1 | 9.8 ± 2.2 | 43.7 ± 3.6 | 1.1 ± 0.2 | 46.3 ± 1.2 |
| F | 4.6 ± 0.2 | 15.5 ± 3.2 | 38.2 ± 3.3 | 1.2 ± 0.1 | 37.2 ± 1.8 | |
| H | 4.9 ± 0.3 | 16.3 ± 2.5 | 36.3 ± 5.2 | 1.6 ± 0.2 | 26.5 ± 1.5 | |
| Южная тайга | L | 5.7 ± 0.1 | 9.6 ± 0.5 | 46.7 ± 1.0 | 1.5 ± 0.1 | 36.2 ± 2.0 |
| Н | 5.3 ± 0.1 | 23.7 ± 0.7 | 41.2 ± 2.2 | 1.8 ± 0.2 | 26.2 ± 1.7 | |
Свежие образцы доставлялись в лабораторию и анализировались не позднее, чем через 1 сут после отбора, что позволяет рассчитывать на получение результатов, соответствующих их естественному состоянию. Лабильные соединения С и N экстрагировали 0.05 М K2SO4 [8]. Определение экстрагируемого органического C (Cэкстр) и общего экстрагируемого N (Nэкстр) проводили на автоматическом анализаторе TOC-V CPN (Shimadzu), N-${\text{NH}}_{{\text{4}}}^{ + }$ определяли индофенольным методом, N‑${\text{NO}}_{{\text{3}}}^{--}$ – после восстановления на кадмиевой колонке до нитритов и получения окрашенного азосоединения по Гриссу. Колориметрические определения выполнены на спектрофотометре GENESYSTM 10 UV (США). Азот экстрагируемых органических соединений (Nорг) рассчитывали по разности между Nэкстр и суммой неорганических соединений элемента. Углерод и азот микробной биомассы (Смикр и Nмикр) определяли методом фумигации-экстракции [18, 32] как разницу между концентрацией Cэкстр и Nэкстр в фумигированных и нефумигированных навесках исследуемого образца.
Для выяснения влияния способа хранения на результат определения микробного и лабильного углерода и азота, каждый проанализированный свежий образец разделяли на три части. Первую часть высушивали до воздушно-сухого состояния, вторую – замораживали при –18°С, третью – помещали в холодильник при +4°С. Образцы хранили в течение трех месяцев, после чего повторно определяли описанные выше параметры. Высушенные образцы предварительно увлажняли до 60% полной полевой влагоемкости (ППВ). Определения также проводили через 7 сут предварительной инкубации при +22°С для выяснения возможности восстановления исходных свойств.
Статистический анализ проводился с использованием программы Statistica 10. Влияние типа горизонта подстилки и природной зоны на концентрацию лабильного и микробного пулов С и N оценивали с помощью двухфакторного дисперсионного анализа ANOVA (анализ выполнен для горизонтов L и H). Для выявления взаимосвязи консервативных и лабильных свойств подстилок для каждого компонента пулов углерода и азота проведен факторный анализ методом главных компонент. При оценке влияния способов хранения на пулы углерода и азота применяли попарное сравнение выборок с использованием t-критерия. При статистической обработке различия считали значимыми при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Содержание углерода и азота лабильного и микробного пулов в свежих образцах. Лесная подстилка характеризуется высокой концентрацией Сэкстр (500–2300 мг/кг, табл. 2), что существенно больше, чем в гумусовых горизонтах минеральных почв европейской территории России [7]. Доля экстрагируемого углерода в общем пуле составляет от 0.1 до 0.5%. Органические соединения являются преобладающей формой экстрагируемой фракции азота, а в составе минерального пула азота преобладает аммонийная форма. Лесная подстилка характеризуется высоким содержанием углерода и азота микробной биомассы; на долю этих фракций приходится в среднем 0.6–1.2% Собщ и 2.6–3.5% Nобщ. Обогащенность микробной биомассы азотом (соотношение C : N) изменяется в пределах 7–9.
Таблица 2.
Концентрация лабильных и микробных форм углерода и азота в свежих образцах лесной подстилки, мг/кг
| Зона | Горизонт | Сэкстр | Nорг | N-${\text{NH}}_{4}^{ + }$ | N-${\text{NO}}_{3}^{ - }$ | Смикр | Nмикр | Смикр : Nмикр |
|---|---|---|---|---|---|---|---|---|
| Северная тайга | L | 2298 ± 358 | 201 ± 24 | 29.8 ± 5.3 | 1.6 ± 0.1 | 4123 ± 695 | 680 ± 149 | 6.8 ± 0.5 |
| H | 689 ± 45 | 33 ± 4 | 14.3 ± 2.6 | 1.6 ± 0.1 | 3494 ± 403 | 585 ± 111 | 7.3 ± 0.9 | |
| Средняя тайга | L | 1201 ± 112 | 16 ± 3 | 22.5 ± 3.0 | 3.4 ± 1.1 | 5059 ± 557 | 690 ± 85 | 8.6 ± 0.6 |
| F | 501 ± 92 | 18 ± 4 | 9.0 ± 2.2 | 1.4 ± 0.4 | 2374 ± 211 | 316 ± 19 | 8.7 ± 0.6 | |
| H | 668 ± 158 | 23 ± 7 | 13.1 ± 2.0 | 1.1 ± 0.1 | 3383 ± 691 | 442 ± 95 | 8.7 ± 0.7 | |
| Южная тайга | L | 727 ± 96 | 51 ± 6 | 11.5 ± 1.1 | 1.6 ± 0.4 | 4126 ± 337 | 532 ± 66 | 9.0 ± 0.7 |
| Н | 1390 ± 234 | 126 ± 19 | 20.7 ± 3.2 | 12.9 ± 5.1 | 3677 ± 257 | 495 ± 23 | 8.4 ± 0.5 |
Варьирование концентраций лабильного и микробного пулов углерода и азота подстилок в разной степени обусловлено влиянием факторов природной зоны и генетического горизонта подстилки. Для всех показателей лабильного пула обнаружено статистически значимое (p < 0.05) влияние, как природной зоны, так и горизонта, а также взаимодействия этих факторов. В то же время природная зона не оказывает влияния на концентрацию микробных пулов углерода и азота, которая статистически значимо зависит только от типа горизонта. Таким образом, можно сделать вывод о том, что воздействие вида-эдификатора в лесных экосистемах в значительно большей степени определяет размер микробных пулов углерода и азота по сравнению с географической зоной. Ранее важность фактора древесной породы была показана для процессов микробиологической трансформации азота [10], а также биомассы гетеротрофных и денитрифицирующих микроорганизмов [9].
Факторный анализ позволил установить, что более 70% вариаций лабильного и микробного пулов углерода и азота в гор. L и H подстилок может быть объяснено действием двух групп факторов (табл. 3). Для всех показателей в первую группу факторов, объясняющих 41–58% вариации, относятся содержание общего углерода, соотношение C/N в органическом веществе подстилки и зольность, то есть свойства, которые можно объединить в группу “характер органического вещества”. Варьирование показателей микробного пула в подстилках объясняется действием факторов, связанных с органическим веществом в большей степени, чем варьирование концентраций лабильных форм. Вторая группа факторов, описывающая около 30% вариации, разнородна для разных показателей. Например, для концентрации экстрагируемого углерода в эту группу входят показатели Смикр и N-${\text{NH}}_{{\text{4}}}^{ + },$ что на наш взгляд связано с потреблением органического субстрата микроорганизмами в зависимости от обеспеченности источниками азотного питания. Вторым фактором, регулирующим концентрацию азота микробной биомассы, является концентрация общего и экстрагируемого азота.
Таблица 3.
Процент вариабельности концентраций лабильных и микробных форм углерода и азота, объясняемый общими факторами
| Показатель | Гор. L | Гор. H | ||
|---|---|---|---|---|
| Ф1 | Ф2 | Ф1 | Ф2 | |
| Cэкстр | 52.7 | 33.8 | 42.9 | 33.0 |
| Nорг | 49.2 | 35.6 | 41.4 | 33.2 |
| N-${\text{NH}}_{4}^{ + }$ | 56.2 | 29.1 | 45.7 | 32.9 |
| N-${\text{NO}}_{3}^{ - }$ | 55.9 | 30.4 | 42.0 | 33.1 |
| Cмикр | 58.1 | 30.4 | 50.3 | 32.5 |
| Nмикр | 58.6 | 30.4 | 50.4 | 30.1 |
Влияние способа хранения образцов лесной подстилки на результаты определения лабильного и микробного углерода и азота. Хранение образцов подстилки в течение трех месяцев существенным образом влияет на результат определения углерода и азота лабильного и микробного пулов (рис. 1–3). Несмотря на тенденцию к сохранению основных относительных параметров, в абсолютных величинах способ хранения образцов в большинстве случаев приводит к существенному изменению пулов углерода и азота. При этом изменение концентрации лабильного и микробного пулов углерода и азота после хранения не зависит от генетических особенностей горизонта подстилки: двухфакторный дисперсионный анализ не выявил достоверного взаимодействия факторов горизонт-способ хранения. Таким образом, можно говорить о том, что наблюдаемые после хранения изменения в свойствах подстилок не зависят от степени разложения растительного материала, а определяются реакцией микроорганизмов.
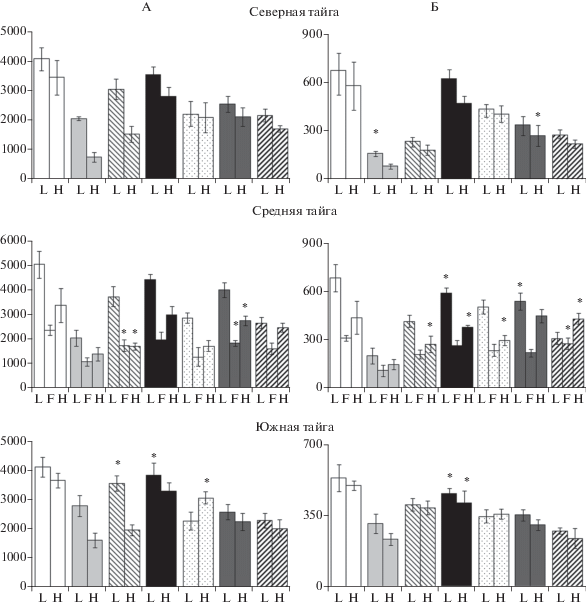
Рис. 1.
Концентрация (мг/кг) экстрагируемого органического углерода (А) и экстрагируемого органического азота (Б) в горизонтах подстилки ельника черничного. Обозначения здесь и далее: 1 – свежий образец; 2 – высушенный образец; 3 – инкубированный 7 суток высушенный образец; 4 – замороженный образец; 5 – инкубированный 7 суток замороженный образец; 6 – образец, хранившийся при низкой положительной температуре; 7 – инкубированный 7 суток образец, хранившийся при низкой положительной температуре. Знаком * в пределах каждого горизонта подстилки обозначено отсутствие статистически достоверных различий между результатами, полученными для свежего и хранившегося образца (p < 0.05).
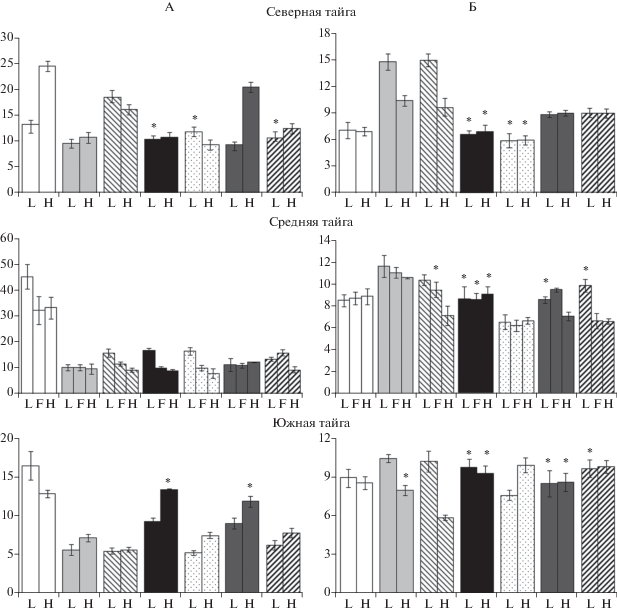
Высушивание до воздушно-сухого состояния и последующее увлажнение до 60% ППВ приводит к наиболее существенному изменению концентраций лабильного и микробного углерода и азота по сравнению с данными, полученными для свежих образцов. Основным трендом для всех изученных подстилок является резкое уменьшение концентрации микробных компонентов на фоне увеличения содержания лабильных форм углерода и азота, в том числе минерального азота. После высушивания наблюдается существенное обогащение лабильного органического вещества азотом (C : N = 6–10, в среднем около 8). Увеличение концентрации лабильных компонентов соотносится со снижением концентрации углерода и азота микробной биомассы (рис. 3), что позволяет предположить, что именно она является источником дополнительного количества лабильных форм углерода и азота. Механизм этого явления связан с денатурацией цитоплазматических мембран микроорганизмов при высушивании [11] и выходом в раствор их цитоплазмы при последующем увлажнении [2]. Аналогичная картина изменения соотношения лабильных и микробных пулов углерода и азота ранее была показана для других почв, в том числе органогенных [7, 26, 27].
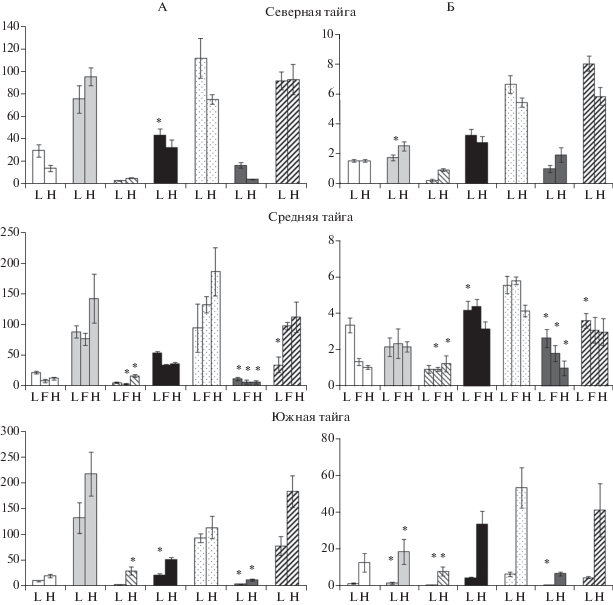
Высушивание лесной подстилки приводит к резкому увеличению концентрации минерального, в первую очередь аммонийного азота (рис. 2). Активная минерализация органических соединений лабильного пула азота после высушивания осуществляется сохранившейся частью устойчивого к иссушению микробного сообщества, которое при последующем увлажнении получает доступ к легкодоступному субстрату [20, 27, 34]. Высушивание лесных подстилок не оказывает статистически значимого воздействия на концентрацию нитратов, которая в целом остается низкой, так как в естественных условиях в кислой среде нитрификация слабо выражена.
Замораживание образцов лесной подстилки и их хранение при –18°С в наименьшей степени искажает результаты определения углерода и азота микробной биомассы: попарное сравнение с показателями свежих образцов с использованием t‑критерия не выявило статистически достоверных (p < 0.05) различий. Устойчивость микробных пулов углерода и азота может быть связана с адаптированностью микроорганизмов северных территорий к воздействию отрицательных температур, поскольку они функционируют в условиях периодических и длительных циклов замерзания-оттаивания. Такая особенность нашла свое отражение в методологии хранения почвенных образцов, принятой в Швеции и Финляндии, где замораживание и хранение при –20°С в течение до одного года считается не влияющим на результаты определения биологических свойств почвы [26]. В то же время после хранения в замороженном виде происходит увеличение концентраций углерода и азота лабильного пула, в том числе до 2–2.5 раз увеличение концентрации аммонийного и нитратного азота. Наиболее вероятный механизм этого явления сходен с механизмом изменения соотношения лабильного и микробного пулов при высушивании и связан с нарушением целостности цитоплазматических мембран микроорганизмов при замораживании и образовании кристаллов льда. Активизация минерализации азота после замораживания ранее была показана для органогенного горизонта почвы субарктической пустоши [23] и горной пустоши [14], а также представительного набора гумусовых горизонтов почв европейской территории России [7].
Влияние хранения образцов лесной подстилки в свежем виде при низких положительных температурах (+4°С) сказывается на результатах определения менее однозначно, чем при высушивании и замораживании. Для образцов подстилки наблюдается снижение концентрации Смикр и Nмикр (достоверные различия со свежими образцами для большинства объектов) (рис. 3). Концентрации экстрагируемого углерода, органического и минерального азота, как правило, демонстрируют статистически значимое, но разнонаправленное изменение (в большинстве рассмотренных случаев происходит уменьшение концентрации минерального азота и экстрагируемого углерода). Известно, что большинство микробиологических процессов в почве имеет волнообразную динамику, связанную с чередованием циклов роста и отмирания части микробной популяции. Такого рода динамика показана для численности микроорганизмов [30, 35], концентрации минерального азота [35] и азотфиксации [12]. Отсутствие единообразной картины изменения оцениваемых показателей связано с тем, что хранение при низких положительных температурах не останавливает биологические процессы, а лишь снижает скорость их протекания.
Влияние предварительной инкубации хранившихся образцов на результаты определения лабильного и микробного углерода и азота. Предварительная аэробная инкубация в большинстве случаев не приводит к восстановлению исходных (характерных для свежих образцов) концентраций пулов углерода и азота. Концентрации микробного и лабильного органического и минерального азота наиболее чувствительны к инкубации после хранения. При этом для образцов одних и тех же подстилок, но хранившихся разными способами, часто наблюдаются разнонаправленные тенденции трансформации азота лабильного и микробного пулов.
При инкубации высушенных образцов в течение семи суток после их увлажнения до 60% ППВ наблюдается существенная нетто-иммобилизация и снижение концентрации органических и минеральных соединений азота. Предварительная инкубация замороженных образцов, а также образцов, хранившихся при низкой положительной температуре, приводит к приросту концентрации экстрагируемого углерода и органического азота (рис. 1), а также снижению концентрации Смикр и Nмикр (рис. 3). Преобладающим процессом является нетто-минерализация (преимущественно аммонификация). Изменения размеров микробного и лабильного пулов углерода и азота при предварительной инкубации хранившихся образцов не всегда количественно согласовано, что с одной стороны связано с газообразными потерями, прежде всего, при дыхании микроорганизмов, а также с мобилизацией части углерода и азота консервативного пула.
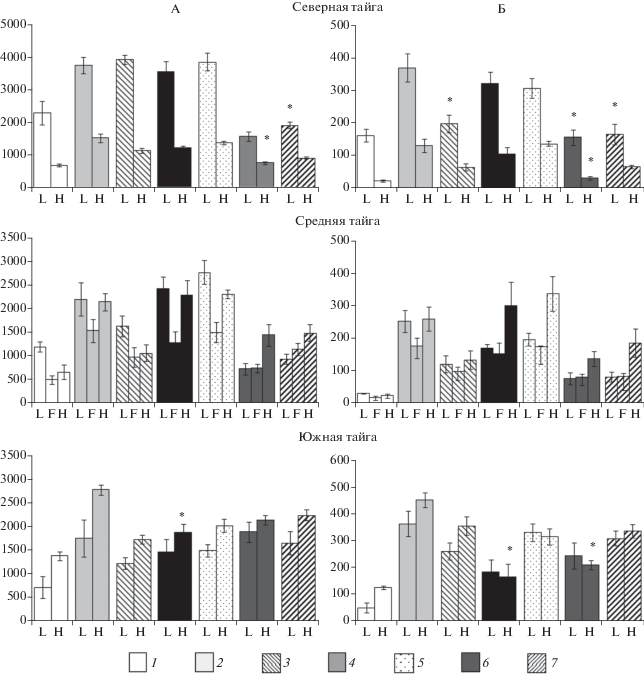
Преобладающий процесс трансформации лабильных соединений азота во время аэробной инкубации во многом определяется соотношением C : N в микробной биомассе и лабильном органическом веществе (рис. 4). После замораживания и хранения при низких положительных температурах микробная биомасса обогащена азотом в большей степени, чем лабильное органическое вещество, поэтому микроорганизмы лимитированы доступностью С и их дальнейший рост невозможен без гибели части сообщества и высвобождения дополнительного количества углерода. Высвобождающийся при гибели микроорганизмов органический азот включается в пул лабильного органического и минерального азота. После высушивания лабильное органическое вещество, как правило, обогащено азотом в большей степени, чем микробная биомасса. В этом случае в процессе инкубирования лесной подстилки происходит микробная иммобилизация азота, которая, прежде всего, затрагивает минеральные формы N, концентрация которых может существенно уменьшаться (рис. 2). Таким образом, преобладание процессов нетто-минерализации или нетто-иммобилизации в подстилке во многом зависит от способа хранения. После высушивания преобладающим процессом трансформации соединений азота становится нетто-минерализация, что не характерно для естественного состояния лесной подстилки.
ЗАКЛЮЧЕНИЕ
Реалистичные данные по содержанию углерода и азота микробной биомассы, минеральных форм азота и процессов их трансформации при изучении наземного детрита можно получить только при анализе свежих образцов. Любой способ хранения образцов приводит к определенной степени искажения абсолютных величин пулов углерода и азота. В наибольшей степени на результаты определения исследуемых параметров оказывает влияние высушивание образцов и их хранение в воздушно-сухом состоянии. Для оценки концентраций углерода и азота микробной биомассы в большинстве случаев возможно хранение подстилки в замороженном виде, однако этот способ не приемлем для последующего определения концентрации экстрагируемого углерода и азота, в том числе его минеральных форм. Установленные закономерности изменения концентраций лабильного и микробного пулов углерода и азота после хранения в разных условиях однотипны для горизонтов подстилки с разной степенью разложения растительного материала.
Предварительная инкубация хранившихся образцов не позволяет добиться восстановления исходных свойств. Интенсивность процессов нетто-минерализации и микробной нетто-иммобилизации соединений азота при предварительной инкубации образцов лесных подстилок зависит от степени обогащенности микробной биомассы и лабильного органического вещества азотом и для образцов одного и того же горизонта подстилки определяется способом их хранения.
Необходимо соблюдать определенную взвешенность и осторожность при обобщении и интерпретации ранее опубликованных результатов, полученных с использованием длительно хранившихся в высушенном состоянии или предварительно инкубированных образцов.
Благодарности. Работа выполнена при поддержке РНФ (грант № 17-76-10020). Авторы выражают глубокую признательность д. б. н., заведующему кафедрой общего почвоведения МГУ М.И. Макарову за предоставленную возможность определения содержания углерода и азота в вытяжках.
Список литературы
Ананьева Н.Д., Благодатская Е.В., Орлинский Д.Б., Мякшина Т.Н. Методические аспекты определения скорости субстрат-индуцированного дыхания почвенных микроорганизмов // Почвоведение. 1993. № 11. С. 72–77.
Благодатский С.А., Благодатская Е.В., Горбенко А.Ю., Паников Н.С. Регидратационный метод определения биомассы микроорганизмов в почве // Почвоведение. 1987. № 4. С. 64–71.
Богатырев Л.Г. О классификации лесных подстилок // Почвоведение. 1990. № 3. С. 118–127.
Гавриленко Е.Г., Сусьян Е.А., Ананьева Н.Д., Макаров О.А. Пространственное варьирование содержания углерода микробной биомассы и микробного дыхания почв южного Подмосковья // Почвоведение. 2011. № 10. С. 1231–1245.
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. 304 с.
Макаров М.И., Малышева Т.И., Мулюкова О.С., Меняйло О.В. Влияние замораживания горно-луговых альпийских почв на процессы трансформации соединений азота и углерода // Экология. 2015. № 4. С. 257–264.
Макаров М.И., Кузнецова Е.Ю., Малышева Т.И., Маслов М.Н., Меняйло О.В. Влияние условий хранения образцов почв на экстрагируемость углерода и азота // Почвоведение. 2017. № 5. С. 569–579.
Макаров М.И., Шулева М.С., Малышева Т.И., Меняйло О.В. Растворимость лабильных форм азота и углерода почв в К2SO4 разной концентрации // Почвоведение. 2013. № 4. С. 408–413. https://doi.org/10.7868/ S0032180X13040096
Меняйло О.В. Влияние древесных пород на биомассу денитрифицирующих бактерий в серой лесной почве // Почвоведение. 2007. № 3. С. 331–337.
Меняйло О.В. Влияние древесных пород Сибири на скорость минерализации почвенного органического вещества // Почвоведение. 2009. № 10. С. 1241–1247.
Мунблит В.Я., Тальрозе В.Л., Трофимов В.И. Термоинактивация микроорганизмов. М.: Наука, 1985.
Эмер Н.Р., Семенов А.М., Зеленев В.В., Зинякова Н.Б., Костина Н.В., Голиченков М.В. Ежесуточная динамика численности и активности азотфиксирующих бактерий на участках залежной и интенсивно возделываемой почвы // Почвоведение. 2014. № 8. С. 963–970.
Anderson J.P.E. Handling and storage of soils for pesticide experiments / Eds.: L. Somerville, M.P. Greaves. Pesticide Effects on Soil Microflora. Taylor and Francis, London, 1987. P. 45–60.
Austnes K., Vestgarden L.S. Prolonged frost increases release of C and N from a mountain heathland soil in southern Norway // Soil Biol. Biochem. 2008. V. 40. P. 2540–2546.
Bloem J., Schouten A.J., Sorensen S.J., Rutgers M., van der Werf A., Breure A.M. Monitoring and evaluating soil quality // Microbiological Methods for Assessing Soil Quality. London, CABI Publishing, 2006. P. 23–49.
Brohon B., Delolme C., Gourdon R. Qualification of soils through microbial activities measurements: influence of the storage period on intreductase, phosphatase and respiration // Chemosphere. 1999. V. 38. P. 1973–1984.
Brohon B., Delolme C., Gourdon R. Complementarity of bioassays and microbial activity measurements for the evaluation of hydrocarbon-contaminated soils quality // Soil Biol. Biochem. 2001. V. 33. P. 883–891.
Brookes P.C., Landman A., Pruden G., Jenkinson D.S. Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil // Soil Biol. Biochem. 1985. V. 17. P. 837–842.
Cui H., Wang C., Gu Z., Zhu H., Fu Sh., Yao Q. Evaluation of soil storage methods for soil microbial community using genetic and metabolic fingerprintings // European J. Soil Biology. 2014. V. 63. P. 5–63.
Fierer N., Schimel J.P. Effects of drying-rewetting frequency on soil carbon and nitrogen transformations // Soil Biol. Biochem. 2002. V. 34. P. 777–787.
Fierer N., Schimel J.P., Holden P.A. Influence of drying–rewetting frequency on soil bacterial community structure // Microbial Ecology. 2003. V. 45. P. 63–71.
Gonzalez A.M., Pineiro A.L., Fernandez M.R. Viability of culturable soil microorganisms during freeze storage // Current Research Topics in Applied Microbiology and Microbial Technology. Toh Tuck Link, World Scientific Publishing Co., 2009. P. 114–118.
Grogan P., Michelsen A., Ambus P., Jonasson S. Freeze-thaw effects on carbon and nitrogen dynamics in subarctic heath tundra mesocosms // Soil Biol. Biochem. 2004. V. 36. P. 641–654.
ISO 10381-6 Guidance on the collection, handling and storage of soil under aerobic conditions for the assessment of microbiological processes, biomass and diversity in the laboratory / The International Organization for Standardization, Geneva, Switzerland 2nd edition. 2009. 6 p.
Lee Y.B., Lorenz N., Dick L.K., Dick R.P. Cold storage and pretreatment incubation effects on soil microbial properties // Soil. Sci. Soc. Am. J. 2007. V. 71. P. 1299–1305.
Lorenz N., Lee Y.B., Dick L.K., Dick R. Impact of soil storage on soil microbial biomass, total DNA yield, enzyme activities and fatty acid microbial biomarkers // Materials of the World Congress of Soil Science. Philadelfia, USA. 2006. P. 659–660.
Mikha M.M., Rice C.W., Milliken G.A. Carbon and nitrogen mineralization as affected by drying and wetting circles // Soil Biol. Biochem. 2005. V. 37. P. 339–347.
Peoples M.S., Koide R.T. Considerations in the storage of soil samples for enzyme activity analysis // Appl. Soil. Ecol. 2012. V. 62. P. 98–102.
Pesaro M., Nicollier G., Zeyer J., Widmer F. Impact of soil drying–rewetting stress on microbial communities and activities and on degradation of two crop protection products // Appl. Environ. Microbiol. 2004. V. 70. P. 2577–2587.
Semenov A.M., van Bruggen A.H.C., Zelenev V.V. Moving waves of bacterial populations and total organic carbon along roots of wheat // Microbial Ecology. 1999. № 37. P. 116–128.
Trabue S.L., Palmouist D.E., Lydick T.M., Singles S.K. Effects of soil storage on the microbial community and degradation of metsulfuron-methyl // J. Agr. Food Chem. 2006. V. 54. P. 142–151.
Vance E.D., Brookes P.C., Jenkinson D.S. An extraction method for measuring soil microbial biomass C // Soil Biol. Biochem. 1987. V. 19. P. 703–707.
Verchot L.V. Cold storage of a tropical soil decreases nitrification potential // Soil Sci. Soc. Am. J. 1993. V. 63. P. 1942–1944.
Xiang S.-R., Doyle A., Holden P.A., Shimel J.P. Drying and rewetting effects on C and N mineralization and microbial activity in surface and subsurface California grassland soils // Soil Biol. Biochem. 2008. V. 40. P. 2281–2289.
Zelenev V.V., van Bruggen A.H.C., Semenov A.M. Short-term wavelike dynamics of bacterial populations in response to nutrient input from fresh plant residues // Microbial Ecology. 2005. № 49. P. 83–93.
Дополнительные материалы отсутствуют.