Почвоведение, 2019, № 7, стр. 781-792
Сравнение двух интегральных биотических индексов при оценке эффектов воздействия гуминовых препаратов в модельном эксперименте
О. С. Якименко 1, *, В. А. Терехова 1, 2, М. А. Пукальчик 3, М. В. Горленко 1, А. И. Попов 4
1 МГУ им. М.В. Ломоносова
119992 Москва, Ленинские горы, 1-12, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский пр., 33, Россия
3 Сколковский институт науки и технологий
143025 Московская область, Одинцовский район, Сколково, ул. Новая, 100, Россия
4 Институт наук о Земле СПбГУ
199034 Санкт-Петербург, Университетская набережная, 7–9, Россия
* E-mail: iakim@soil.msu.ru
Поступила в редакцию 10.01.2018
После доработки 10.12.2018
Принята к публикации 26.12.2018
Аннотация
Дана оценка дескриптивной (описательной) способности двух интегральных биотических индексов, полученных на основе лабораторных экспериментальных данных о действии гуминовых препаратов (ГП) на микробиоту в условиях загрязнения медью образцов модельного субстрата, приготовленного согласно международному стандарту (ISO 11268-1) из песка, каолина и торфа (Standard Soil), который рекомендован для оценки биологических эффектов. Для обобщения результатов экотоксикологических исследований загрязненных образцов (660 мг Cu/кг) и интегральной оценки воздействия ГП на их биотическую составляющую использовали статистическую модель с применением функции желательности Харрингтона и интегральный параметр благополучия почвенной микробной системы по данным мультисубстратного тестирования (отношение биоразнообразия к неустойчивости). Индексы, полученные на основе двух комплексов многомерных данных, сравнивали по своей дескриптивной способности при описании детоксицирующей эффективности ГП. Установлено, что ГП главным образом стимулируют многовидовые бактериальные комплексы, тогда как тест-культуры, представляющие высшие растения и водоросли, менее чувствительны к внесению гуматов. Три из пяти изученных ГП обнаружили выраженный детоксицирующий эффект и улучшили состояние исследуемой системы. Оба интегральных биотических индекса – обобщенная функция желательности Харрингтона D и параметр общего благополучия системы G показали сходный вектор воздействия. Для полноты и большей надежности системы биотических показателей при экологическом нормировании следует ориентироваться на применение интегрального подхода, основанного на обобщенной функции желательности.
ВВЕДЕНИЕ
Гуминовые препараты (ГП), полученные производственными компаниями из различного органического сырья: торфов, углей, несколько реже сапропелей и органических отходов, широко представлены на рынке, относительно недороги и могут рассматриваться в качестве современного средства рекультивации и ремедиации загрязненных почв [11, 22, 25, 31, 33]. Существует немало разнообразных оценок их положительного воздействия на почвы и биоту, в частности, в условиях загрязнения тяжелыми металлами. Так, в вегетационных опытах выявлено, что внесение в почву гумата натрия уменьшало токсичность соединений меди и кадмия по отношению к проросткам семян ячменя и пшеницы [7, 16]; а также содержание подвижных форм свинца и меди почве и накопление этих элементов в растениях [9]. Показана ремедиационная эффективность ГП, оцененная по изменению ряда химических, токсикологических и биоиндикационных показателей городских почв с высоким содержанием тяжелых металлов [14, 17, 32, 34].
Одновременно известно, что действие различных промышленных ГП на биотическую составляющую изучаемых субстратов неодинаково, диапазон стимулирующего или ингибирующего эффекта по отношению к живым организмам, так же как и оценка детоксицирующих свойств по отношению к определенному токсиканту, зависят от ряда факторов: химического состава и сырьевого источника гумата, вида тест-организма, дизайна эксперимента и условий проведения испытаний [13, 19, 21, 23]. Всеобъемлющие разносторонние схемы и способы оценки, которые могли бы дать надежное описание эффективности тех или иных ГП, пока не разработаны. В этой связи предпринимаются попытки введения различных интегральных показателей, которые могли бы учесть различные свойства ГП и чувствительность тест-культур, применяющихся для комплексной оценки воздействия гуматов на экосистему. Описаны несколько таких подходов: расчет индекса детоксикации [6, 28], метод Триад [15], показатель “здоровья” почв, основанный на параметрах функционального биоразнообразия (ФБР) почвенного микробного сообщества [3, 5].
Наряду с этим как возможный альтернативный подход к построению обобщенного критерия оценки воздействия токсикантов и ремедиационных эффектов ГП можно рассматривать применение обобщенной функции желательности (ОФЖ) Харрингтона [27]. Этот метод анализа представляет собой математический инструментарий перевода реальных значений параметров (откликов тест-систем) в единую безразмерную числовую шкалу с фиксированными границами от 0 до 1 и последующего отображения частных количественных шкал в обобщенные шкалы критериев качества. ОФЖ как один из наиболее удобных способов построения интегрального отклика часто используется в экологии и смежных с нею областях науки [2, 8, 26]. В почвоведении он пока малоизвестен, хотя переход от естественных шкал измерения показателей к непрерывным безразмерным шкалам и интеграция индивидуальных показателей представляет большой интерес. В основе построения ОФЖ лежит идея преобразования натуральных значений частных откликов в безразмерную шкалу желательности или предпочтительности [10, 12]. С ее помощью любые характеристики среды (количественные или качественные) получают субъективную оценку исследователя (“хорошо” – “плохо”), выраженную числами в диапазоне от 0 до 1. В отличие от баллов функция желательности (d) является непрерывной величиной. Выраженность качества объектов наблюдения соотносят с заранее определенной целью или разным весовым значением изучаемых признаков в достижении этой цели. Чем более важно значение определенного признака на пути к этой цели, тем более высокую оценку желательности оно получит.
Цель работы – охарактеризовать влияние ГП на биотическую составляющую модельного субстрата по широкому спектру разнородных данных и провести анализ дескриптивной способности двух интегральных индексов. Основная задача работы – совместить в одной серии экспериментов индексы, полученные на основе двух комплексов многомерных данных, а именно, сопоставить (а) тест-отклики батареи стандартных биотестов и (б) параметры мультисубстратного тестирования (МСТ) как изначально многофункционального метода оценки.
Для построения интегрального критерия воздействия ионов меди и ГП на биотическую составляющую исследуемых субстратов использовали: 1 – ОФЖ Харрингтона, рассчитанную на основе совокупности полученных данных по откликам тест-культур в батарее биотестов, основанных на реакциях тест-культур разных трофических уровней и таксономической принадлежности (высшие растения, водоросли и почвенное микробное сообщество); 2 – интегральный параметр благополучия микробной системы, рассчитанный на основе показателей ФБР с помощью системы “Эко-лог” (метод МСТ).
ОБЪЕКТЫ И МЕТОДЫ
Модельный эксперимент. Исследования проводили на образцах модельной смеси (Standard Soil), которая рекомендована для оценки биологических эффектов в качестве международного стандарта (ISO 11268-1: Soil quality-Effects of pollutants…) и состоит из 70% песка, 20% каолина и 10% переходного торфа. Водные растворы пяти ГП (в дозе 0.1 г/кг по сухому веществу) вносили в образцы исследуемого субстрата, ранее охарактеризованного по основным физическим и химическим показателям [5, 6, 13, 14], и инкубировали при комнатной температуре и влажности 60% от полной влагоемкости в течение 21 сут. В параллельной серии опытов к образцам субстрата после внесения ГП добавляли раствор соли меди до достижения массовой доли меди 660 мг Cu/кг, что соответствовало 5-кратному превышению ОДК для песчаных и супесчаных почв (ГН 2.1.7.2042-06). Используемые ГП представляли собой пять коммерческих гуматов натрия или калия, полученных промышленным способом из различных видов органического сырья (бурого угля, торфа и лигносульфоната) и рекомендованных производителями в качестве почвенных кондиционеров и стимуляторов роста растений (табл. 1). По окончании экспозиции образцов с ГП и с медью из каждого сосуда отбирали пробы для проведения биотестирования.
Таблица 1.
Состав и происхождение гуминовых препаратов
| Обозна-чение | Вносимый препарат | Золь-ность | Cобщ | Nобщ | СГК | СКРФ | Состав золы, мг/г | |||
|---|---|---|---|---|---|---|---|---|---|---|
| % | Na | K | Ca | Mg | ||||||
| Pe-FlexK | Гумат калия из торфа | 25.8 | 42.3 | 1.06 | 22.8 | 4.7 | 0.98 | 103 | 1.02 | 0.29 |
| Pe-EcoK | Гумат калия из торфа | 34.1 | 39.2 | 1.63 | 20.1 | 5.5 | 2.45 | 165 | 4.57 | 0.17 |
| BC-EnK | Гумат калия из бурого угля | 45.5 | 46.4 | 1.70 | 21.3 | 5.2 | 1.44 | 135 | 0.39 | 0.47 |
| BC-HumNa | Гумат натрия из бурого угля | 28.8 | 41.8 | 0.39 | 19.8 | 1.3 | 142 | 1.51 | 3.35 | 0.68 |
| OW-LhK | Гумат калия из лигносульфоната | 39.8 | 35.0 | 0.37 | 4.6 | 21.2 | 22.5 | 125 | 0.93 | 0.04 |
Методы биотестирования. В экотоксикологических экспериментах использовали водные экстракты тест-субстратов (1 : 4 твердая фаза : дистиллированная вода с рН 6.5–7.5; длительность экстракции 2 ч), которые исследовали с применением батареи тест-организмов (высших растений, водорослей и бактерий) в соответствии с приведенными ниже стандартными методиками биотестирования, рекомендованными для целей экологического контроля почв и техногенных объектов.
Для фитотестирования на высших растениях использовали семена двудольных и однодольных растений – горчицы белой (Sinapis alba L.) и ячменя обыкновенного (Hordeum vulgare L.). Семена проращивали в течение 96 ч при 25°С в темноте в чашках Петри, на дно которых помещали фильтровальную бумагу, пропитанную испытуемыми экстрактами. Эффект оценивали по изменению длины корней и проростков семян в опытных вариантах относительно контроля, где контролем служили водные экстракты образцов субстрата без добавок [20, 31].
Альготестирование проводили на культуре зеленых ценобиальных водорослей (Scenedesmus quadricauda (Turp.) Breb.) с использованием импульсного флуориметра ToxyPAM (Walz, Германия). Оценивали относительное изменение от контроля следующих параметров: F0 – фоновый уровень флуоресценции, и FV/FM (или Y) – квантовый выход фотохимического превращения поглощенной световой энергии в фотосистеме II (Yield) [29].
Среди биоиндикационных функциональных и структурно-функциональных показателей определяли интенсивность эмиссии СО2 методом газовой хроматографии [18] и активность азотфиксации (газовая хроматография с применением ацетиленового метода [18]).
Все биотесты проводили в трех повторностях. Статистическую обработку данных проводили с помощью пакета Statistica 10. Достоверность различий наблюдаемых откликов оценивали с помощью однофакторного дисперсионного анализа и попарного сравнения средних с использованием критерия наименьшей значимой разности Фишера (Fisher LSD test, Р < 0.05) для каждого показателя.
Функциональное биоразнообразие микробного сообщества оценивали методом МСТ с применением системы Эко-лог (ФР.1.37.2010.08619). Пробу обработанной суспензии анализуемой почвосмеси помещали в тест-планшет “Эко-лог”, содержащий набор питательных субстратов (сахара, аминокислоты, полимеры, нуклеозиды, соли органических кислот, спирты) и индикатор потребления (соль тетразолия). Планшеты инкубировали в термостате 72 ч при температуре 28°С до появления визуально регистрируемой окраски ячеек. В течение инкубационного периода происходило развитие микроорганизмов в ячейках с восстановлением трифенилтетразолия в формазан, придающий среде в ячейке красное окрашивание. Концентрация формазана и обусловленная им оптическая плотность ячейки определяются обилием и активностью микроорганизмов. После окончания инкубации осуществляли фотометрическое считывание оптической плотности ячеек в диапазоне 510 нм программно-аппаратным комплексом “Эко-лог”. Массив данных, полученный в результате фотометрического измерения значений оптической плотности по всем ячейкам, представляет собой спектр потребления питательных субстратов для данного микробного комплекса.
Для описания состояния микробной системы ранее нами была запатентована оригинальная трехпараметрическая модель рангового распределения потребления субстратов микробным сообществом почв [4]:
где n = ln(N), где N – номер ранга, соответствующий количеству потребленных субстратов; F(n) = = ln(yN), где yN – интенсивность потребления питательного компонента ранга N; e – основание натурального логарифма; E0, b, dg – параметры формы распределения.В интересующей нас области значений (положительные значения n и F(n)) параметры модели трактуются следующим образом. Коэффициент E0 описывает запас энергии системы (средний уровень потребления питательных компонентов), b – ширина плато в интересующем нас месте координатной плоскости, описывающая информационное разнообразие распределения: отношение стационарной (старшие ранги – доминанты) и динамической частей системы (младшие ранги, редкие классы) или же с позиций кинетики отношение быстрых/медленных функциональных компонентов, dg (крутизна хвоста распределения) – выражает присутствие редких классов – залога устойчивости системы (адаптационный индекс – критерий гибкости и устойчивости системы).
В данной работе для оценки состояния микробной системы по спектрам потребления субстратов использовали следующие параметры биоразнообразия: количество потребленных субстратов N как мера функционального разнообразия сообщества; метаболическая работа W, выраженная в суммарной оптической плотности всех потребленных субстратов в приборных единицах, и коэффициент рангового распределения спектров потребления субстратов dg как мера неустойчивости системы. Kоэффициент dg, варьируя в микробных системах от 0.01 до более 2, позволяет оценить благополучие и стабильность микробных сообществ. В благополучных избыточных системах, имеющих максимальный запас прочности, dg принимает значения от 0.01 до 0.1; в устойчивых стабильных системах – от 0.1 до 0.4; системам с истощенными ресурсами или находящимся под обратимым воздействием какого-либо нарушающего фактора характерны значения dg от 0.4 до 0.8; кризисным дестабилизированным системам соответствуют значения 0.8–1.0; значения >1 характерны для необратимо нарушенных систем, потерявших исходную функциональную целостность [3, 4].
Интегральные показатели оценки воздействия ГП и ионов меди на биотическую составляющую исследуемого субстрата. Для вычисления значений частных и обобщенных функций желательности применяли формулы, приведенные в табл. 2. Значение частной функции желательности (d) рассчитывали на основе величины кодированного отклика $\left( {{{Y}_{{{{Y}_{i}}}}}} \right)$ по результатам фитотестирования на высших растениях, альготестирования, эмиссии CO2 и азотфиксации. В свою очередь кодированные отклики определяли из среднего арифметического (${{\bar {Y}}_{K}}$) и стандартного отклонения (SY) отклика в контрольном варианте [8, 12]. Значения обобщенной функции желательности (D) рассчитывали как геометрическое среднее частных желательностей di с учетом количества откликов (n), по которым оценивалось влияние исследуемых веществ. Формула для преобразования шкалы измерения в шкалу желательности построена на предположении, что при использовании ГП реакция живых объектов имела оценку, лежащую в пределах: хорошо — очень хорошо.
Таблица 2.
Формулы для вычисления значений частных и обобщенных функций желательности
| Показатель | Формула |
|---|---|
| Кодированное значение отклика | ${{Y}_{{{{Y}_{i}}}}} = 2.75 - \frac{{0.75}}{{{{S}_{Y}}}}{{\bar {Y}}_{K}} + \frac{{0.75}}{{{{S}_{Y}}}}{{Y}_{i}}$ (1) |
| Частная функция желательности | d = exp[–exp(–YY + 2)] (2) |
| Обобщенная функция желательности | $D = \sqrt[n]{{\prod\limits_{i = 1}^n {{{d}_{i}}} }}$ (3) |
Примечание. ${{Y}_{{{{Y}_{i}}}}}$ – кодированное значение отклика; Yi – среднее арифметическое значение отклика в вариантах опыта; ${{\bar {Y}}_{K}}$ – среднее арифметическое значение отклика в контрольном варианте; SY – стандартное отклонение отклика в контрольном варианте; d – частная функция желательности; D – обобщенная функция желательности; n – количество тест-откликов.
Шкала желательности делится в диапазоне от 0 до 1 на 5 поддиапазонов: (0; 0.2) – очень плохо (0.2; 0.37) – плохо, (0.37; 0.63) – удовлетворительно, (0.63; 0.8) – хорошо, (0.8; 1.0) – очень хорошо [27].
Интегральный параметр благополучия микробной системы G рассчитывали по данным МСТ как отношение биоразнообразия к неустойчивости [3]:
где Nmax – общее количество питательных субстратов.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Используемые ГП (гуматы калия или натрия) получены фирмами-производителями по промышленным технологиям из различного органического сырья и представляют собой водорастворимые порошки или суспензии с содержанием органического вещества 60–75%, золы 26–45% и преобладанием калия или натрия в составе зольных элементов (табл. 1). Несмотря на сходный состав, им присущи некоторые индивидуальные особенности строения, во многом определяемые типом исходного органического сырья (уголь, торф или лигносульфонат). Так, препараты BС-HumNa и OW-LhK содержат наименьшее количество азота, и в последнем, в отличие от всех остальных, в составе органического вещества доминируют компоненты кислоторастворимой фракции (фульвокислоты и неспецифические низкомолекулярные соединения). Вероятно, именно вследствие указанных различий воздействие исследуемых гуматов на тест-культуры неодинаково.
Биотестирование показало, что исследованные ГП по разному влияют на тест-функции исследованного субстрата (рис. 1). Результаты однофакторного дисперсионного анализа свидетельствуют, что внесение ГП в условно чистые образцы не оказало значимого влияния на длину проростков ячменя (рис. 1, I, А), биолюминесценцию микроводорослей (рис. 1, I, В) и эмиссию СО2 (рис. 1, I, Г): для всех этих тест культур значение р превышало 0.05. Проростки горчицы разнонаправленно реагировали на внесение ГП: для корней выявлен как стимулирующий, так и угнетающий эффект в зависимости от вида гумата (рис. 1, I, Б). Полученные данные согласуются с другими исследованиями, показывающими, что при одинаковых условиях эксперимента определяющее значение имеет вид и происхождение ГП [19, 23, 24, 28, 35]. Более выраженным было воздействие гуматов на активность диазотрофного комплекса микроорганизмов: если в исходном субстрате азотфиксация практически отсутствовала, то после воздействия ГП отмечено значимое повышение азотфиксирующей активности (рис. 1, I, Д). Это может быть связано с привнесением в бедный питательными элементами и почти стерильный субстрат микроорганизмов и питательных компонентов с гуматами.
Рис. 1.
Отклики тест-культур при внесении ГП (I) и ГП по фону модельного загрязнения медью (II) (среднее, стандартная ошибка среднего и доверительный интервал при P > 0.05): А – длина корней и проростков ячменя, Б – длина корней и проростков горчицы; В – параметры флуоресценции водорослей сценедесмус; Г – эмиссия СО2; Д – интенсивность азотфиксации. Величины, обозначенные различными буквами, различаются достоверно по критерию LSD. Обозначения для I: 1 – контроль; 2 – Pe-Flex-K; 3 – Pe-EcoK; 4 – BC-EnK; 5 – BC-HumNa; 6 – OW-LhK: для II: 1 – контроль; 2 – Cu + Pe-Flex-K; 3 – Cu + Pe-EcoK; 4 – Cu + + BC-EnK; 5 – Cu + BC-HumNa; 6 – Cu + OW-LhK; 7 – Cu.

При внесении токсиканта для большинства тест-культур воздействие ГП проявилось более отчетливо (рис. 1, II). В фитотестах токсический эффект соли меди привел к угнетению развития корней обеих тест-культур: их длина достоверно уменьшилась до 75% (ячмень) и 68% (горчица) от контроля (рис. 1, II, А, Б). Длина надземной части проростков при этом значимо не изменялась. На этом фоне проявился детоксицирующий эффект отдельных ГП по отношению к культуре горчицы: согласно НСР-тесту, длина корней в вариантах с внесением ГП достоверно превышала таковую для загрязненного контроля. Для культуры ячменя уменьшения токсического эффекта не выявлено.
Оценка воздействия токсиканта в альготестах принципиально различна в зависимости от рассматриваемого тест-параметра. Так, по показателю Y выявился токсический эффект меди на S. quadricauda, значение которого уменьшилось до 21% от контроля, переводя пробу в категорию токсичной (рис. 1, II, В). На этом фоне внесение ГП оказывало детоксицирующий эффект: квантовый выход флуоресценции во всех вариантах превышал загрязненный контроль, в отдельных случаях превышая 50%, что уже позволяет считать пробы нетоксичными для роста и функционирования водоросли сценедесмус (S. quadricauda). В то же время по показателю F0 в откликах альгологической тест-системы на внесение ионов меди отдельно или совместно с ГП существенных различий не наблюдалось.
Также не обнаружено достоверных различий с контролем по показателю почвенного дыхания (рис. 1, II, Г) и азотфиксирующей способности (рис. 1, II, Д). Хотя для азотфиксации НСР-тест выявляет различия между вариантами, но ввиду ее изначально крайне низкой интенсивности эти различия варьируют в пределах ошибки метода и изменения под воздействием ГП вряд ли возможно трактовать как значимые.
Для расчета значений частных функций желательности d по результатам биотестов использовали преобразованные средние значения тест-откликов (табл. 3) и кодированные значения откликов (табл. 4). В табл. 3 для удобства дальнейших расчетов за 100% принимали максимальное значение отклика во всех вариантах опыта для каждого тест-параметра.
Таблица 3.
Средние значения характеристик биологической активности гуминовых препаратов (% от максимального значения для каждого тест-параметра)
| Вариант | Тест-параметры | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Варианты с внесением ГП | ||||||||
| Контроль | 100.0 | 96.9 | 91.7 | 70.6 | 84.7 | 100.0 | 0.203 | 69.4 |
| Pe-FlexK | 98.8 | 87.5 | 81.3 | 76.5 | 75.4 | 72.4 | 64.450 | 86.7 |
| Pe-EcoK | 85.4 | 87.5 | 91.7 | 76.5 | 69.5 | 72.4 | 58.325 | 90.7 |
| BC-EnK | 84.1 | 68.8 | 87.3 | 61.2 | 70.3 | 20.8 | 100.000 | 100.0 |
| BC-HumNa | 92.7 | 87.5 | 64.6 | 58.8 | 88.1 | 100.0 | 48.433 | 86.7 |
| OW-LhK | 98.8 | 84.4 | 100.0 | 88.2 | 98.3 | 87.1 | 66.408 | 66.0 |
| Варианты с внесением ГП по фону меди | ||||||||
| Cu | 74.4 | 96.9 | 62.5 | 64.7 | 94.1 | 20.8 | 0.232 | 56.2 |
| Pe-FlexK + Cu | 75.6 | 90.6 | 81.3 | 76.5 | 78.8 | 66.9 | 0.256 | 71.1 |
| Pe-EcoK + Cu | 63.4 | 84.4 | 70.8 | 70.6 | 87.3 | 33.7 | 0.187 | 64.6 |
| BC-EnK + Cu | 75.6 | 96.9 | 73.4 | 65.3 | 100.0 | 28.2 | 0.127 | 48.8 |
| BC-HumNa + Cu | 69.5 | 78.1 | 81.3 | 100.0 | 92.4 | 44.8 | 0.259 | 78.1 |
| OW-LhK + Cu | 81.7 | 100.0 | 81.3 | 70.6 | 98.3 | 63.2 | 0.216 | 66.0 |
| Стандартное отклонение контрольного варианта | ||||||||
| SY | 29.27 | 18.75 | 20.83 | 35.29 | 10.17 | 26.32 | 0.0218 | 6.81 |
Таблица 4.
Кодированное значение отклика
| Вариант | Тест-параметры | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Варианты с внесением ГП | ||||||||
| Контроль | 2.75 | 2.75 | 2.75 | 2.75 | 2.75 | 2.75 | 2.75 | 2.75 |
| Pe-FlexK | 2.72 | 2.38 | 2.38 | 2.88 | 2.06 | 1.96 | 2214.8 | 4.66 |
| Pe-EcoK | 2.38 | 2.38 | 2.75 | 2.88 | 1.63 | 1.96 | 2001.5 | 5.10 |
| BC-EnK | 2.34 | 1.63 | 2.59 | 2.55 | 1.69 | 0.49 | 3436.1 | 6.12 |
| BC-HumNa | 2.56 | 2.38 | 1.78 | 2.50 | 3.00 | 2.75 | 1660.9 | 4.66 |
| OW-LhK | 2.72 | 2.25 | 3.05 | 3.12 | 3.75 | 2.38 | 2280.2 | 2.38 |
| Варианты с внесением ГП по фону меди | ||||||||
| Cu | 2.09 | 2.75 | 1.70 | 2.63 | 3.44 | 0.49 | 3.76 | 1.30 |
| Pe-FlexK + Cu | 2.12 | 2.50 | 2.38 | 2.88 | 2.31 | 1.81 | 4.59 | 2.94 |
| Pe-EcoK + Cu | 1.81 | 2.25 | 2.00 | 2.75 | 2.94 | 0.86 | 2.23 | 2.22 |
| BC-EnK + Cu | 2.12 | 2.75 | 2.09 | 2.64 | 3.88 | 0.70 | 0.15 | 0.48 |
| BC-HumNa + Cu | 1.97 | 2.00 | 2.38 | 3.38 | 3.32 | 1.18 | 4.68 | 3.71 |
| OW-LhK + Cu | 2.28 | 2.88 | 2.38 | 2.75 | 3.75 | 1.70 | 3.21 | 2.38 |
Примечание. Кодированные значения отклика рассчитывали по формуле (1); обозначения тест-параметров как в табл. 3. Пример расчета кодированного значения отклика для тест-параметра 1. 1) 2.75 – 0.75 × 100.0/29.27 + 0.75 × 100.0/29.27 = 2.75; 7) 2.75 – 0.75 × 100.0/29.27 + 0.75 × 74.4/29.27 = 2.09.
Величины d (табл. 5) отражают стимулирующее или ингибирующее воздействие ГП для каждой тест-системы как в условно чистых образцах, так и по фону внесения токсиканта (соответственно по увеличению или снижению значения d по сравнению с контрольным вариантом). Для всех контрольных вариантов величина d составляет 0.624, поскольку, как следует из табл. 2, при расчете кодированного значения отклика $\left( {{{Y}_{{{{Y}_{j}}}}}} \right)$ (его величина для контрольных вариантов всегда равна 2.75, так как расчет ведется относительно контроля (${{\bar {Y}}_{K}}$ = Yi)).
Таблица 5.
Значения частных функций желательности
| Вариант | Частные функции желательности | |||||||
|---|---|---|---|---|---|---|---|---|
| d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | |
| Варианты с внесением ГП | ||||||||
| Контроль | 0.624 | 0.624 | 0.624 | 0.624 | 0.624 | 0.624 | 0.624 | 0.624 |
| Pe-FlexK | 0.614 | 0.503 | 0.504 | 0.659 | 0.391 | 0.354 | 1.000 | 0.932 |
| Pe-EcoK | 0.503 | 0.503 | 0.624 | 0.659 | 0.235 | 0.354 | 1.000 | 0.956 |
| BC-EnK | 0.492 | 0.234 | 0.575 | 0.562 | 0.255 | 0.011 | 1.000 | 0.984 |
| BC-HumNa | 0.566 | 0.503 | 0.286 | 0.545 | 0.692 | 0.624 | 1.000 | 0.932 |
| OW-LhK | 0.614 | 0.459 | 0.705 | 0.723 | 0.841 | 0.505 | 1.000 | 0.503 |
| Варианты с внесением ГП по фону меди | ||||||||
| Cu | 0.402 | 0.624 | 0.259 | 0.585 | 0.790 | 0.011 | 0.842 | 0.132 |
| Pe-FlexK + Cu | 0.414 | 0.545 | 0.504 | 0.659 | 0.482 | 0.297 | 0.928 | 0.676 |
| Pe-EcoK + Cu | 0.299 | 0.459 | 0.367 | 0.624 | 0.677 | 0.044 | 0.450 | 0.449 |
| BC-EnK + Cu | 0.414 | 0.624 | 0.402 | 0.589 | 0.858 | 0.026 | 0.002 | 0.010 |
| BC-HumNa + Cu | 0.356 | 0.368 | 0.504 | 0.777 | 0.765 | 0.103 | 0.934 | 0.834 |
| OW-LhK + Cu | 0.470 | 0.659 | 0.504 | 0.624 | 0.841 | 0.260 | 0.743 | 0.503 |
Примечание. Частные функции желательности (di) рассчитывали по формуле (2). Обозначения d1–d8 соответствуют тест-параметрам 1–8 в табл. 3. Пример расчета частных функций желательности для тест-параметра 1. 1) exp[–exp(–2.75 + 2)] = 0.624; 7) exp[–exp(–2.09 + 2)] = 0.402.
Анализ значений частных функций желательности (табл. 5) позволяет выявить те же закономерности в реакциях различных тест-культур на внесение гуматов, что были описаны выше при трактовке рис. 1. Тест-культуры различаются по чувствительности, как к присутствию меди, так и гуматов. Сами ГП, в силу описанных выше индивидуальных особенностей препаратов, также обнаруживают неодинаковый эффект, и в отдельных случаях проявляют стимулирующее или детоксицирующее действие. Так, в фитотестах выявлено слабо выраженное влияние ГП на развитие проростков высших растений: величины d1–d4 различаются незначительно, за исключением отдельных вариантов. В отношении показателей флуоресценции хлорофилла микроводорослей сценедесмус (S. quadricauda) (d5–d6) наблюдалось разнонаправленное воздействие ГП в зависимости от их свойств. В целом, как по фону внесения токсиканта, так и без него ГП улучшали показатели азотфиксации и дыхания в субстрате: за исключением отдельных вариантов наблюдается увеличение значений d7 и d8 по сравнению с контролем.
Применение обобщенного показателя желательности D позволило дать интегрированную оценку разных откликов (рис. 2, А). Один из пяти использованных ГП (OW-LhK) характеризовался высокой физиологической активностью и переводил интактную систему без добавления токсиканта из категории удовлетворительно в категорию хорошо. Судя по реакциям биоты, ионы меди оказывали негативное действие на субстрат (категория плохо). По фону внесения токсиканта три препарата проявили детоксицирующий эффект (величина D попадает в категорию удовлетворительно). В одном случае (BC-EnK) наблюдался негативный синергетический эффект, который складывался из угнетающего действия как самого ГП, так и ионов меди. Необходимо отметить, что механизмы действия различных ГП не ясны, и их выявление требует дальнейших целенаправленных исследований.
Рис. 2.
Комплексная оценка влияния гуминовых препаратов на образцы субстрата с внесением (1) и без внесения (2) соли меди (А) по величине обобщенной функции желательности D и интегральному параметру благополучия микробной системы G на основе МСТ (Б). Диапазоны шкалы желательности D: I – очень плохо (<0.2); II – плохо (0.2–0.37); III – удовлетворительно (0.37–0.63); IV – хорошо (0.63–0.8). Примечание: Обобщенные функции желательности D рассчитывали по формуле (3). Пример расчета обобщенных функций желательности для тест-параметра 1. 1. (0.624 × × 0.624 × 0.624 × 0.624 × 0.624 × 0.624 × 0.624 × 0.624)1/8 = 0.624; 2. (0.614 × 0.503 × 0.504 × 0.659 × 0.391 × 0.354 × 1.000 × × 0.932)1/8 = 0.583; 3. (0.503 × 0.503 × 0.624 × 0.659 × 0.235 × 0.354 × 1.000 × 0.956)1/8 = 0.549.
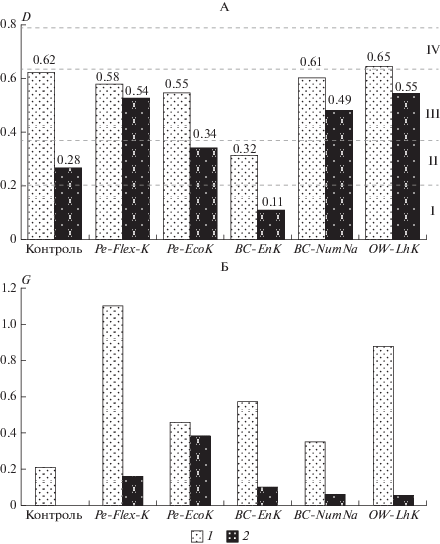
Параллельные расчеты экспериментальных данных по динамике функционального разнообразия микробных сообществ в ходе МСТ образцов, обработанных ГП, показали, что, так же как и в большинстве стандартных моновидовых биотестов, добавки ГП положительно влияют на микробиоту. Практически все испытанные ГП улучшали параметры ФБР изначально неблагополучного субстрата. Наблюдалось увеличение количества потребленных питательных компонентов, метаболической работы и стабильности микробного сообщества (величина dg уменьшалась от 1.9 до 0.6–1.4 на “чистом” фоне) (табл. 6). В итоге интегральный параметр благополучия микробной системы G, рассчитанный по показателям МСТ как отношение биоразнообразия к неустойчивости, значительно увеличился по сравнению с контрольным вариантом (до 0.35–1.10 против 0.21 на контроле; рис. 2, Б). На фоне внесения меди воздействие ГВ выражалось, главным образом, в увеличении метаболической работы. Для препаратов (Pe-Flex-K и Pe-EcoK) наблюдалось значимое улучшение состояния дестабилизированной внесением поллютанта микробной системы: интегральный параметр G возрастает от 0.07 на контроле до 0.16–0.38 (рис. 2, Б). Остальные три ГП не проявили детоксицирующего эффекта, величина G изменялась незначительно, составляя 0.05–0.10.
Таблица 6.
Параметры функционального разнообразия микробных сообществ по данным МСТ при внесении гуматов с/без внесения меди
| Вариант | Биоразнообразие, (N/ Nmax) × 100 | Метаболическая работа, W* | Неустойчивость, dg | Состояние микробной системы |
|---|---|---|---|---|
| Варианты с внесением гуматов | ||||
| Контроль | 40 | 1224 | 1.9 | Кризисное |
| Pe-Flex-K | 72 | 1882 | 0.7 | Нормальное |
| Pe-EcoK | 66 | 1611 | 1.4 | Кризисное |
| BC-EnK | 53 | 1574 | 0.9 | Нарушенное |
| BC-HumNa | 66 | 1359 | 1.9 | Кризисное |
| OW-LhK | 51 | 1370 | 0.6 | Хорошее |
| Варианты с внесением гуматов по фону меди | ||||
| Cu | 15 | 1074 | 2.3 | Кризисное |
| Pe-FlexK + Cu | 9 | 1204 | 0.5 | Хорошее |
| Pe-EcoK + Cu | 6 | 1378 | 0.2 | Отличное |
| BC-EnK + Cu | 15 | 1236 | 1.5 | Кризисное |
| BC-HumNa + Cu | 13 | 1123 | 2.2 | Кризисное |
| OW-LhK + Cu | 15 | 1161 | 3.0 | Кризисное |
Таким образом, в целом оба интегральных биотических индекса – обобщенная функция желательности Харрингтона D и параметр общего благополучия системы G – взаимно дополнили представление о реакциях разных групп биоты и показали сходный вектор воздействия.
ЗАКЛЮЧЕНИЕ
Впервые проанализированы и сопоставлены эффекты загрязнения медью и действие ремедиантов (ГП) по интегральным функциям, отражающим реакцию биотической составляющей исследованного субстрата (аналога стандартной почвы согласно ISO 11268-1) на основе двух математических подходов. Ценность проделанной работы в том, что эксперименты проводились именно на образцах стандартного модельного субстрата с известными, стабильными и воспроизводимыми основными почвенными характеристиками. Один подход, основанный на мультисубстратном тестировании микробных сообществ, отражает соотношение устойчивости систем и биоразнообразия, дает оценку эффектов по однотипным реакциям – метаболической активности потребления набора питательных компонентов микроорганизмами. Другой подход к экологической оценке субстрата основан на расчете функции желательности Харрингтона, которая успешно применяется в экологии, медицине и других отраслях знаний при решении оптимизационных задач. Ранее были отмечены достоинства и недостатки ее использования в экологическом нормировании [1]. К достоинствам отнесены такие свойства, как непрерывность, монотонность и гладкость. В числе недостатков указан субъективизм при назначении оценочной шкалы и весовых коэффициентов анализируемых признаков. Учитывая, что практически все существующие системы оценок экологического качества окружающей среды включают в себя элементы субъективизма, то возможность свертки разнородной информации, которая предполагается в ОФЖ Харрингтона, делает ее привлекательной и перспективной в экологическом нормировании.
Обобщая анализ двух математических функций, полученных при оценке разнородных показателей влияния ГП на биологическую активность исследованного субстрата, можно сказать, что реакции представителей биоты на внесение ГП как в незагрязненные, так и в загрязненные медью образцы были существенными в значениях обеих функций. Выраженность эффектов зависела от вида ГП и природы анализируемых признаков.
В вариантах без внесения токсиканта влияние ГП в основном выражалось в активной стимуляции многовидовых бактериальных комплексов, что было видно по изменению показателя G, рассчитанному по данным МСТ. При этом реакции высших растений и водорослей, учтенные в показателе D ОФЖ, были менее выражены. Под воздействием меди бактериальная активность уменьшалась, и в этих условиях заметно проявился детоксицирующий эффект ГП. В этих же вариантах с помощью моновидовых биотестов на основе реакций H. vulgare и S. alba, S. quadricauda показан нулевой или отрицательный отклик на внесение ГП, тогда как по показателям, учитывающим активность многовидовых комплексов микроорганизмов, наблюдалось стимулирование функциональной активности сообществ (эмиссия СО2, азотфиксация и ФБР).
В целом обе интегральные функции – обобщенная функция желательности Харрингтона D и параметр общего благополучия системы G – проявили сопоставимую дескриптивную значимость и взаимно дополнили представление о реакциях разных групп биоты. Учитывая, что при использовании обобщенной функции желательности D анализируется более разнородный набор признаков (биохимических, физиологических – фотосинтез микроводорослей, азотфиксация, дыхание, рост и развитие корней и ростков), а при расчете G в итоге мультисубстратного тестирования дается оценка эффектов по однотипным реакциям – метаболической активности потребления питательных компонентов микроорганизмами, то для полноты и для повышения надежности системы биотических показателей при экологическом нормировании следует ориентироваться на применение интегрального подхода, основанного на обобщенной функции желательности.
Благодарность. Исследования поддержаны РФФИ (грант № 18-04-01218-а).
Список литературы
Воробейчик Е.П., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локальный уровень). Екатеринбург: Наука, 1994. 280 с.
Гелашвили Д.Б., Снегирева М.С., Солнцев Л.А., Зазнобина Н.И. Экологическая характеристика Приволжского федерального округа на основе обобщенной функции желательности // Поволжский экологический журнал. 2014. № 1. С. 130–138.
Горленко М.В., Кожевин П.А. Мультисубстратное тестирование природных микробных сообществ. М.: МАКС Пресс, 2005. 88 с.
Горленко М.В., Кожевин П.А., Терехов А.С. Способ мультисубстратного тестирования микробных сообществ и его применение. Патент № 2335543 от 10.10.2008.
Горленко М.В., Якименко О.С., Голиченков М.В., Костина Н.В. Функциональное биоразнообразие почвенных микробных сообществ при внесении органических субстратов различной природы // Вестник Моск. ун-та. Сер. 17, почвоведение. 2012. № 2. С. 20–27.
Каниськин М.А., Изосимов А.А., Терехова В.А., Якименко О.С., Пукальчик М.А. Влияние гуминовых препаратов на биоактивность почвогрунта с фосфогипсом // Теоретическая и прикладная экология. 2011. № 1. С. 86–93.
Конышева Е.Н. Влияние детоксикантов тяжелых металлов на зерновые культуры в ювенильный период развития // Вестник КрасГАУ. 2010. № 5. С. 65–69.
Королева С.В. Практические аспекты использования функции желательности в медико-биологическом эксперименте // Современные проблемы науки и образования (электронный научный журнал). 2011. № 6.
Коротченко И.С., Еськова Е.Н. Накопление тяжелых металлов (Pb, Cu) в системе почва–растение при использовании разных детоксикантов // Вестник КрасГАУ. 2012. № 7. С. 91–95.
Носов В.Н., Булгаков Н.Г., Максимов В.Н. Построение функции желательности при анализе данных экологического мониторинга // Изв. РАН. 1997. Сер. биол. № 1. С. 69–74.
Попов А.И. Гуминовые вещества: свойства, строение, образование. СПб: СПбГУ, 2004. 248 с.
Попов А.И., Игамбердиев В.М., Алексеев Ю.В. Статистическая обработка экспериментальных данных: Методическое пособие. СПб.: Изд-во СПбГУ. 2009. 50 с.
Пукальчик М.А., Панова М.И., Терехова В.А., Якименко О.С., Федосеева Е.В. Действие гуминовых препаратов на активность почвенных ферментов в модельном опыте // Агрохимия. 2017. № 8. С. 94–101. https://doi.org/10.7868/S0002188117080105
Пукальчик М.А., Терехова В.А., Якименко О.С., Акулова М.И. Сравнение ремедиационных эффектов биочара и лигногумата на почвы при полиметаллическом загрязнении // Теоретическая и прикладная экология. 2016. № 2. С. 79–85.
Пукальчик М.А., Терехова В.А., Якименко О.С., Кыдралиева К.А., Акулова М.И. Метод TRIAD в оценке ремедиационного действия гуминовых препаратов на урбаноземы // Почвоведение. 2015. № 6. С. 1–10. https://doi.org/10.7868/S0032180X15060088
Семенов А.А., Завгородняя Ю.А., Демин В.В. Влияние гуминовых кислот на устойчивость организмов к тяжелым металлам // Тр.V Всерос. конф. Гуминовые вещества в биосфере. СПб: СПбГУ, 2010. Ч. 1. С. 444–451.
Степанов А.А., Якименко О.С. Ремедиация загрязненных городских почв с применением гуминовых препаратов // Живые и биокосные системы. 2016. № 18. http://www.jbks.ru/archive/issue-18/article-5
Степанов А.Л., Лысак Л.В. Методы газовой хроматографии в почвенной микробиологии. М.: МАКС-Пресс, 2002. 88 с.
Таран Д.О., Жданова Г.О., Саксонов М.Н., Бархатова О.А., Быбин В.А., Стом Д.И. Влияние гуминовых веществ на тест-объекты // Бюлл. ВСНЦ CO РАМН. 2013. № 6(94). С. 164–168.
Терехова В.А., Якименко О.С., Воронина Л.П., Кыдралиева К.А. Методика измерений биологической активности гуминовых веществ методом фитотестирования “Фитоскан”. М.: Доброе слово, 2014. 24 с. ISBN 978-5-905723-07-0
Торопкина М.А., Рюмин А.Г., Кечайкина И.О., Чуков С.Н. Влияние гуминовых кислот на метаболизм Сhlorella vulgaris в модельном опыте // Почвоведение. 2017. № 11. С. 1336–1343.
Чуков С.Н. Формирование и роль гуминовых веществ в биосфере // Теоретическая и прикладная экология. 2015. № 1. С. 8–12.
Якименко О.С., Терехова В.А. Гуминовые препараты и проблема оценки их биологической активности для целей сертификации // Почвоведение. 2011. № 11. С. 1334–1343.
Якименко О.С., Терехова В.А., Пукальчик М.А. Влияние гуминовых препаратов на живые организмы и оценка их детоксицирующей способности при загрязнении почвы медью в лабораторном эксперименте // Phytohormones, humic substances and other biologically active compounds for agriculture, human health and environmental protection. Proc. of IX Int. Scientific Conf. DaRostim-2013. Lviv, Ukraine: Publishing house of Lviv Polytechniс. 2013. С. 172–173.
Burlakovs J., Klavins M., Osinska L., Purmalis O. The impact of humic substances as remediation agents to the speciation forms of metals in soil // APCBEE Procedia. 2013. № 5. P. 192–196.
Coffey T., Gennings C., Moser V.C. The simultaneous analysis of discrete and continuous outcomes in a dose–response study: Using desirability functions // Regulatory Toxicology and Pharmacology. 2007. V. 48. P. 51–58.
Harrington E. The desirability function // Industrial Quality Control. 1965. V. 21. № 10. P. 494–498.
Kulikova N.A., Stepanova E.V., Koroleva O.V. Mitigating activity of humic substances: Direct influence on biota // Use of humic substances to remediate polluted environments: from theory to practice. Springer Netherlands, 2005. P. 285–310.
Lazar D., Sušila P., Nauš J. Early detection of plant stress from changes in distributions of chlorophyll a fluorescence parameters measured with fluorescence imaging // J. Fluorescence. 2006. V. 16. № 2. P. 173–176.
Nikolaeva O., Terekhova V. Improvement of laboratory phytotest for the ecological evaluation of soils // Eurasian Soil Science. 2017. V. 50. № 9. P. 1105–1114. https://doi.org/10.1134/S1064229317090058
Perminova I.V., Kulikova N.A., Zhilin D.M., Grechischeva N.Yu., Kovalevskii D.V., Lebedeva G.F., Matorin D.N., Venediktov P.S., Konstantinov A.I., Kholodov V.A., Petrosyan V.S. Mediating effects of humic substances in the contaminated environments. Concepts, results, and prospects // Viable Methods of Soil and Water Pollution Monitoring, Protection and Remediation. Ser. IV: Earth and Environmental Sciences. Springer Netherlands. 2006. V. 69. P. 249–274.
Pukalchik M., Panova M., Karpukhin M., Yakimenko O., Kydralieva K., Terekhova V. Using humic products as amendments to restore Zn and Pb polluted soil: a case study using rapid screening phytotest endpoint // J. Soils and Sediments. 2018. № 18. P. 750–761. https://doi.org/10.1007/s11368-017-1841-y
Soler-Rovira P., Madejyn E., Madejyn P., Plaza C. In situ remediation of metal-contaminated soils with organic amendments: role of humic acids in copper bioavailability // Chemosphere. 2010. V. 79. P. 844–849. https://doi.org/10.1016/j
Terekhova V.A. Soil bioassay: Problems and approaches // Eurasian Soil Science. 2011. V. 44. № 2. P. 173–179. https://doi.org/10.1134/S1064229311020141
Yakimenko O.S., Gorlenko M.V., Terekhova V.A., Izosimov A.A., Pukalchik M.A. Influence of commercial humic products on living organisms and their detoxification ability in Cu-polluted soil in model experiment / Eds.: J. Xu, J. Wu,Y. He. Functions of natural organic matter in changing environments. Springer-Verlag GmbH China, 2012. P. 616–618. doi https://doi.org/https://doi.org/ 10.1007/978-94-007-5634-2_202
Дополнительные материалы отсутствуют.


