Почвоведение, 2019, № 8, стр. 966-973
Сукцессия микробного сообщества серой лесной почвы при разложении различных органических соединений
Т. Э. Хомутова 1, *, К. С. Дущанова 2, В. Э. Смирнов 3, 4, А. В. Борисов 1
1 Институт физико-химических и биологических проблем почвоведения РАН
142290 Московская обл., Пущино, ул. Институтская, 2, Россия
2 Пущинский государственный естественно-научный институт
142290 Московская обл., Пущино, пр. Науки, 3, Россия
3 Центр по проблемам экологии и продуктивности лесов РАН
117997 Москва, ул. Профсоюзная, 84/32, стр. 14, Россия
4 Институт математических проблем биологии РАН, филиал Федерального исследовательского центра
Института прикладной математики им. М.В. Келдыша РАН
142290 Московская обл., Пущино, ул. Профессора Виткевича, 1, Россия
* E-mail: khomutova-t@rambler.ru
Поступила в редакцию 04.07.2018
После доработки 22.10.2018
Принята к публикации 28.11.2018
Аннотация
В модельном лабораторном эксперименте c серой лесной почвой изучена сукцессия микробного сообщества при разложении белков, липидов и полисахаридов. Белки были минерализованы в течение первых трех месяцев, активное разложение липидов началось спустя 2 месяца от начала эксперимента. Методом мультисубстратного тестирования микробного сообщества по его дыхательной активности выявлены различия в функциональном разнообразии сообщества в ходе сукцессии. Микробные дыхательные отклики на дополнительное внесение азотсодержащих соединений (аминокислот) были наиболее высокими в вариантах с разложением безазотистых соединений и низкими в вариантах с разложением белков. Предполагается, что отношение микробных откликов на внесение карбоновых кислот к таковому аминокислот может быть полезным при реконструкции исходного присутствия органических материалов при археологических реконструкциях.
ВВЕДЕНИЕ
Микроорганизмы – главные преобразователи органических соединений в почве. Трансформация растительного опада, пожнивных остатков и удобрений в почве хорошо изучена [6, 8–10, 12]. Малоизученным остается разложение ряда органических материалов, связанных с человеческой деятельностью, реконструкция исходного присутствия которых в погребениях и культурных слоях древних поселений важна для археологического почвоведения. Наша гипотеза состоит в том, что изменения в микробном сообществе после поступления в почву различных органических соединений могут иногда длительно сохраняться при условии быстрой консервации микроорганизмов из-за погребения почв.
При разложении органических материалов в почве возрастает численность микроорганизмов, вовлеченных в их трансформацию. После утилизации материалов часть микробного сообщества отмирает, а другая его часть переходит в покоящееся состояние [1]. С этой позиции культурные слои, почвы и почвогрунты археологических памятников выступают в качестве объектов, в которых поступившие в прошлом органические вещества могли оставить след в свойствах микробных сообществ [11]. Поиск информативных параметров состояния и структуры микробного сообщества для индикации исходного присутствия в почве органических материалов, связанных с человеческой деятельностью в прошлом, является необходимым этапом различных археологических реконструкций. Ранее по пространственной динамике содержания почвенных сапротрофных и термофильных бактерий и почвенной ферментативной активности были установлены границы древних сельскохозяйственных угодий, а также мест содержаний скота [5, 11], по трофической структуре микробных сообществ была проведена реконструкция содержимого ритуальных сосудов в захоронениях различных культур [4].
В последние годы в экологических исследованиях функциональное разнообразие микробных сообществ оценивается методом мультисубстратного тестирования (МСТ) по интенсивности потребления различных органических соединений: полимеров, углеводов, аминокислот, карбоновых кислот и др. [2, 3]. В одной из модификаций МСТ интенсивность потребления соединений определяется по эмиссии углекислого газа [14], достоинством этой модификации является краткая инкубация почвенных образцов без предварительного выделения или культивирования микроорганизмов, что более адекватно отражает разнообразие микробных сообществ. Эта методика чувствительна для детекции как краткосрочных, так и долговременных изменений функционального разнообразия микробных сообществ [14].
Цель работы – изучение сукцессии микробного сообщества при разложении белков, липидов, полисахаридов в модельном эксперименте и поиске индикаторов, отражающих исходное присутствие этих субстратов и перспективных для археологических реконструкций. Для этого в контролируемых условиях на серой лесной почве оценивали динамику содержания органического углерода (Сорг), микробной биомассы, дыхательной активности и функционального разнообразия микробного сообщества.
ОБЪЕКТЫ И МЕТОДЫ
Для проведения модельного эксперимента в окрестностях г. Пущино (Московская область) отобрали образцы серой лесной почвы из верхнего горизонта открытого участка многолетней (более 30 лет) залежи. Преобладающей растительностью на выбранном участке были злаки Agrostis tenuis Sibth., Bromopsis inermis (Leyss.) Holub, Calamagrostis epigeios (L.) Roth, Dactylis glomerata L. и Poa compressa L., разнотравье Taraxacum officinale Wigg. s.l., Melampyrum nemorosum L., Fragaria vesca L., Veronica chamaedrys L., Galium mollugo L. s.l. и бобовые Lathyrus pratensis L., Trifolium hybridum L., Vicia hirsuta (L.) S.F. Gray [7]. Почву очищали от мелких корней, усредняли и просеивали через сито 2 мм. Перед началом эксперимента определяли полную влагоемкость, рН, содержание органического азота и углерода. Модельный эксперимент включал семь вариантов, в которых к серой лесной почве добавляли один из следующих органических материалов: белки – казеин (Carl Roth, GmbH+Co), желатин (марка П-11) и шерсть (измельченную фабричную пряжу, г. Троицк), липиды – растительное масло и бараний жир, полисахариды – крахмал (растворимый, “ч. д. а.”, ООО Спектр-Хим) и растительные остатки (высушенный, растертый и просеянный через сито 2 мм сбор растительности с выбранного участка серой лесной почвы), восьмым вариантом была сама серая лесная почва (контроль).
Для стерилизации липидных материалов и их равномерного распределения в почве предварительно прогретые навески (20 г) растворяли в гексане и смешивали с 40 г кизельгура, предварительно обработанного сухим жаром, высушивали и просеивали через сито 2 мм. Органические материалы белковой и полисахаридной природы, а также растительные остатки обрабатывали сухим жаром (105°С, 30 мин), к навескам 20 г добавляли стерилизованный кизельгур (40 г). В увлажненные до 60% полной влагоемкости подготовленные образцы почв массой по 1 кг вносили подготовленные материалы с кизельгуром либо только кизельгур (контрольный вариант) и тщательно перемешивали. Масса вносимого органического материала в каждом варианте эксперимента составляла 2% от массы почвы с кизельгуром. Образцы почвы размещали в двойные полиэтиленовые пакеты с ватно-марлевыми пробками и располагали в термостате при 25°С. Постоянную влажность поддерживали, контролируя массу почвы, при необходимости ее восстанавливали орошением почвы до необходимого веса.
Во всех органических материалах, кизельгуре и серой лесной почве определяли содержание углерода и азота (CN-анализатор Elementar Vario El III, ЦКП ИФХиБПП РАН). Динамику разложения органических материалов анализировали еженедельно в первые два месяца эксперимента, затем ежемесячно измерением дыхательной активности микробных сообществ [13], а также определением потерь Сорг на разных сроках проведения эксперимента. Микробную биомассу определяли физиологическим методом (С-СИД) [13].
Функциональное разнообразие микробных сообществ оценивали МСТ [14]. Микробное сообщество тестировали на аминокислотах: глицине, аланине, аргинине, гистидине, тирозине и цистеине (L-изомеры), углеводах: маннозе (D+), арабинозе (L+), сахарозе, фруктозе, мальтозе (D+), глюкозе и карбоновых кислотах: аскорбиновой, лимонной, молочной, уксусной, щавелевевой и янтарной. Концентрация указанных субстратов в основном соответствовала рекомендованным [14]: аминокислоты – 15 мМ (исключение тирозин – 5 мМ), углеводы – 75 мМ, концентрация солей карбоновых кислот варьировала от 20 до 190 мМ (по аниону: лимонная 20 мМ, щавелевая 30 мМ, янтарная 50 мМ, аскорбиновая 100 мМ, молочная 160 мМ, уксусная 190 мМ). Все растворы доводили до рН 6–7 добавлением 1 н. NaOH или 1 н. НСl. Навески почвы из каждого варианта модельного эксперимента (1 г) помещали в пробирки с резиновыми пробками, инкубировали в течение 12 ч при 22°С, после проветривания вносили 200 мкл одного из субстратов и закрывали. Количество выделившегося СО2 измеряли после 4 ч инкубации при 22°С на газовом хроматографе (Кристаллюкс 4000М в ЦКП ИФХиБПП РАН). Рассчитывали дыхательную активность микробных сообществ (мкг С/ (г почвы в ч)). МСТ выполняли в образцах почв всех вариантов модельного эксперимента спустя 8, 10 и 13 месяцев от его начала. Все анализы выполняли минимум в трех независимых повторностях. Обработку данных проводили стандартными статистическими методами, принимая во внимание рекомендации Горленко и Кожевина [2]. Для удобства представления результатов дыхательные отклики на вещества близких химических свойств суммировали по классам соединений: углеводов, аминокислот и карбоновых кислот [3]. Данные МСТ статистически обрабатывали многофакторным анализом методом главных компонент. Выявление наиболее индикаторных показателей проводили на основе v-критерия [15]. Анализ метода главных компонент и v-критерия выполняли в программе R с помощью пакета FactoMineR [16].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка дыхательной активности микробных сообществ. Для контроля динамики разложения внесенных органических соединений, а также состояния микробного сообщества через 2 суток после начала эксперимента с недельной периодичностью измеряли собственную – актуальную и после добавления глюкозы – потенциальную дыхательную активность почвенных микробных сообществ (рис. 1). Во всех случаях актуальное дыхание было ниже потенциального, то есть внесение глюкозы оказывало дополнительное стимулирование микробного сообщества к выделению углекислого газа. Наиболее близкой контролю была дыхательная активность микробного сообщества в варианте с внесением крахмала. На достаточно низком уровне была и дыхательная активность микроорганизмов в вариантах с внесением липидов, причем в варианте с бараньим жиром первые 6 недель эксперимента могут быть рассмотрены как своеобразный лаг-период. Обогащение почвы растительными остатками привело к двукратному по сравнению с контролем увеличению как актуальной, так и потенциальной микробной дыхательной активности. Внесение в почву белков вызвало наиболее резкие всплески дыхательной активности в первые две недели эксперимента. Они превышали контроль в 2–12 (актуальная) и 2.5–25 (потенциальная) раз. Спустя два месяца микробная дыхательная активность в этих вариантах эксперимента снизилась практически до нуля и оставалась постоянной на предельно низких значениях, поэтому спустя пять месяцев инкубации измерения в этих вариантах эксперимента были прекращены.
Рис. 1.
Динамика актуальной (1) и потенциальной (2) дыхательной активности микробных сообществ в ходе модельного эксперимента: А – контроль, Б – крахмал, В – растительные остатки, Г – растительное масло, Д – бараний жир, Е – шерсть, Ж – желатин, З – казеин.
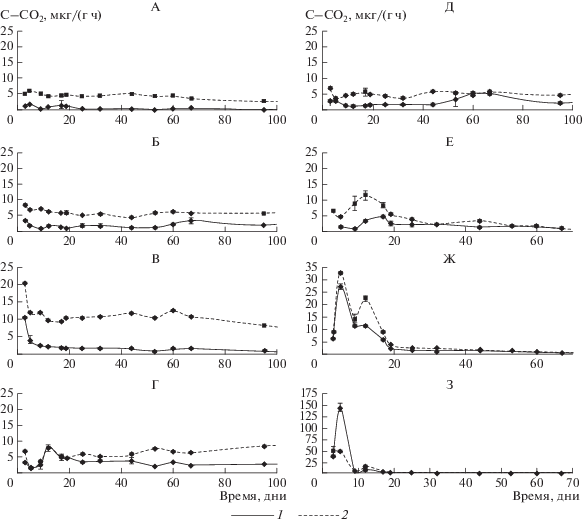
Потери органического углерода. Динамика потерь органического углерода в процессе эксперимента представлена в табл. 1. Спустя 3 месяца Сорг в вариантах с внесением белков снизилось на 53–59% от исходного содержания и стало на 8% меньше, чем в контроле, что подтверждает полную минерализацию к этому сроку внесенных белков из-за их высокой доступности для микробного разложения. Варианты с внесением липидов потеряли 32–42%, а с крахмалом и растительными остатками – 35–39% Сорг. В начале эксперимента отношение C : N было самым большим в вариантах с внесением липидов, а через 3.5 месяца оно снизилось в 3.5–5.5 раз. В течение последующих 6.5 месяцев в этих вариантах минерализация субстратов продолжалась наиболее активно. Содержание Сорг спустя 8 месяцев от начала эксперимента превышало таковое в контроле этого срока на 9% в вариантах с бараньим жиром и крахмалом, на 18% – в варианте с растительным маслом и на 36% – в варианте с растительными остатками.
Таблица 1.
Содержание органического углерода и соотношение C : N в ходе модельного эксперимента
| Вариант | Сорг*, % | С : N** | ||||
|---|---|---|---|---|---|---|
| время определения от начала эксперимента, месяц | ||||||
| 0 | 3.5 | 6.5 | 8 | 0 | 3.5 | |
| Контроль | 1.84 ± 0.04 | 1.29 ± 0.03 | Не опр. | 22.4 ± 0.6 | 6.4 ± 0.2 | |
| Желатин | 2.78 ± 0.06 | 1.20 ± 0.02 | » | 7.3 ± 0.2 | 4.1 ± 0.1 | |
| Казеин | 2.80 ± 0.06 | 1.16 ± 0.02 | » | 8.0 ± 0.2 | 3.3 ± 0.1 | |
| Шерсть | 2.75 ± 0.06 | 1.15 ± 0.02 | » | 7.6 ± 0.2 | 3.8 ± 0.1 | |
| Бараний жир | 3.41 ± 0.07 | 1.99 ± 0.04 | 1.79 ± 0.04 | 1.63 ± 0.03 | 43.2 ± 1.2 | 7.9 ± 0.2 |
| Растительное масло | 3.06 ± 0.06 | 2.09 ± 0.04 | 1.89 ± 0.04 | 1.81 ± 0.04 | 38.7 ± 1.1 | 11.0 ± 0.3 |
| Крахмал | 2.66 ± 0.05 | 1.74 ± 0.03 | 1.64 ± 0.03 | 1.49 ± 0.03 | 29.6 ± 0.8 | 5.9 ± 0.2 |
| Растительные остатки | 2.66 ± 0.05 | 1.61 ± 0.03 | 2.02 ± 0.04 | 2.02 ± 0.04 | 20.5 ± 0.6 | 7.7 ± 0.2 |
Функциональное разнообразие микробных сообществ. Изменение функционального разнообразия микробных сообществ в ходе разложения белков, липидов и полисахаридов оценивали по эмиссии углекислого газа в ответ на внесение спектра низкомолекулярных соединений. Отклики микробных сообществ всех вариантов были специфичными и в основном устойчивыми на разных сроках проведения эксперимента (8, 10 и 13 месяцев). Отклик микробного дыхания на внесение углеводов и аминокислот тесно коррелировал с микробной биомассой (r 0.96–0.99 и 0.94–0.97 соответственно, P < 0.001, n = 8), отклик на внесение карбоновых кислот был неоднозначным. Наиболее тесная корреляция с биомассой отмечена для уксусной, щавелевой, лимонной и янтарной кислот (r 0.88–0.95), менее тесная связь выявлена для аскорбиновой и молочной кислот (r 0.64 и 0.62 соответственно). Для удобства представления результатов дыхательных откликов на субстраты сходного химического состава данные представлены как суммы активностей по классам соединений: углеводы, аминокислоты и карбоновые кислоты (табл. 2). Отклик на карбоновые кислоты был самым высоким для всех вариантов и превышал контроль в 1.5–2.7 раз. Отклик на аминокислоты вариантов с внесением белков был ниже контроля, а в остальных вариантах он превышал его в 2.7–6 раз. Отношение отклика на внесение карбоновых кислот к таковому на внесение аминокислот оказалось специфичным и устойчивым на протяжении всех сроков измерения (рис. 2). По этому показателю варианты с внесением белков резко отличались от контроля и от вариантов с безазотистыми материалами (крахмал, жир, растительное масло, растительные остатки). Вследствие разнообразия и специфичности дыхательных откликов микробных сообществ на предлагаемый спектр низкомолекулярных соединений представлялось целесообразным выбрать наиболее индикаторные показатели. Так, отношение величины отклика на внесение аскорбиновой кислоты к таковому на внесение уксусной кислоты (АУ) в белковых вариантах превышало контрольные показатели в 2.6–5.2 раз через 8 месяцев эксперимента. В остальных вариантах оно не достигало контроля и составляло 55–81%. Однако на сроках 10 и 13 месяцев в белковых вариантах этот показатель снизился до 35–89 и 55–126% от контроля соответственно. Отношение откликов на внесение аскорбиновой кислоты к таковому на внесение молочной кислоты (АМ) через 8 месяцев было минимальным в белковых вариантах (13–46% от контроля), в остальных вариантах несколько выше (43–59%). Однако на сроках 10 и 13 месяцев это отношение возросло в белковых вариантах и превысило контрольные показатели в 1.7–2.5 и 1.1–1.7 раз соответственно, тогда как в остальных вариантах эксперимента оно отношение было существенно ниже (78–105 и 60–79%). Отношение откликов на внесение аскорбиновой кислоты к таковому на внесение цистеина (АЦ) было наиболее стабильным на протяжении всего эксперимента. В белковых вариантах этот показатель превышал контроль в 3–8, 2.5–3.5 и 5–6.6 раз на сроках 8, 10 и 13 месяцев, соответственно, а в остальных вариантах эксперимента был существенно ниже контроля (20–57%). Таким образом, показатели АУ, АМ, АЦ информативны и устойчивы и могут быть использованы как индикаторы присутствия в прошлом в почве исследуемых органических соединений. При разложении белков высоко АУ (8 месяцев), АМ (10 и 13 месяцев) и АЦ (весь эксперимент), а для безазотистых соединений (липиды, крахмал, растительные остатки) эти показатели минимальны.
Таблица 2.
Суммированные дыхательные отклики микробных сообществ разных вариантов модельного эксперимента на внесение углеводов, амино-и карбоновых кислот
| Вариант | Сумма дыхательных откликов, C–CO2 мкг/(г ч) | ||
|---|---|---|---|
| углеводы | аминокислоты | карбоновые кислоты | |
| Контроль | 8.9 ± 0.4 | 7.1 ± 0.6 | 20.4 ± 0.8 |
| Желатин | 3.5 ± 0.4 | 2.9 ± 0.2 | 48.0 ± 1.2 |
| Казеин | 2.7 ± 0.4 | 3.5 ± 0.3 | 55.3 ± 1.4 |
| Шерсть | 4.0 ± 0.4 | 4.1 ± 0.2 | 43.1 ± 0.4 |
| Бараний жир | 39.5 ± 0.7 | 41.8 ± 0.8 | 47.0 ± 0.6 |
| Растительное масло | 35.3 ± 0.5 | 31.8 ± 0.4 | 42.9 ± 0.6 |
| Крахмал | 34.4 ± 0.5 | 21.0 ± 0.3 | 37.2 ± 0.9 |
| Растительные остатки | 25.6 ± 0.4 | 19.5 ± 0.5 | 29.7 ± 1.4 |
Рис. 2.
Отношение дыхательных откликов микробных сообществ на внесение карбоновых кислот к таковому для аминокислот: а – бараньего жира, б – растительного масла, в – крахмала, г – растительных остатков, д – желатина, е – казеина, ж – шерсти; з – контрольный вариант.

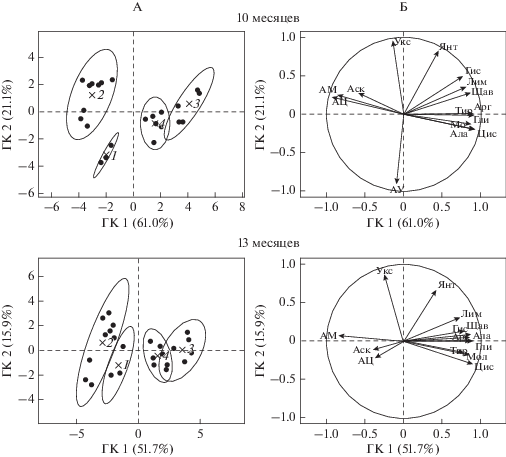
Указанные закономерности были проверены статистическим анализом методом главный компонент (ГК). Значимыми оказались первые две ГК, которые объясняют суммарно 81 (10 месяцев эксперимента) и 68% (13 месяцев) дисперсии данных (рис. 3). Биологический смысл ГК2 состоит в эффекте внесения в почву дополнительного органического вещества, так контроль располагается на графике ниже всех остальных вариантов. С ГК2 более всего коррелируют положительно – уксусная и янтарная кислоты, отрицательно – АУ. Биологический смысл ГК1 состоит в степени доступности азота в почве для микроорганизмов. Чем правее расположен вариант, тем дефицит азота сильнее. Наибольшие отрицательные корреляции с ГК1 демонстрируют АЦ, АМ, аскорбиновая кислота. Все остальные соединения проявляют сильную положительную связь с ГК1. В целом, корреляция между ГК и параметрами, лучше всего (R2 > 0.85) наблюдается между следующими низкомолекулярными субстратами и их соотношениями: после 10 месяцев эксперимента – АЦ, уксусной кислотой, цистеином, янтарной кислотой, после 13 месяцев – цистеином, АУ, глицином. На плоскости, заданной ГК1 и ГК2, почвенные варианты отчетливо разделяются, что говорит о хорошей дискриминирующей способности переменных, по которым проводился анализ.
Рис. 3.
Положение экспериментальных почвенных вариантов (А) и векторы переменных – субстратов (Б) для ГК1 и ГК2: 1 – контроль, варианты с внесением: 2 – белков (казеин, желатин, шерсть), 3 – липидов (растительное масло, бараний жир), 4 – полисахаридов (крахмал, растительные остатки); АУ, АЦ и АМ – отношение величин дыхательных откликов микробных сообществ на внесение аскорбиновой кислоты к таковому на внесение уксусной кислоты, цистеина и молочной кислоты соответственно; названия всех субстратов сокращены до первых трех букв. Корреляционные эллипсы ограничивают области с P = 0.95.
Анализ результатов МСТ с помощью v-критерия позволил установить наиболее индикаторные соединения для конкретных экспериментальных вариантов. Спустя 10 месяцев микробная биомасса (по отклику на глюкозу) в вариантах с внесением белков оказалась в 2.3–3.5 раза меньше (10 и 13 месяцев), липидов – в 1.9 раз больше, полисахаридов – значимо не отличалась от среднего значения по всему эксперименту. В белковых вариантах дыхательный отклик микробного сообщества на внесение аминокислот был значимо ниже среднего по эксперименту. Отклик микробных сообществ этих вариантов на внесение карбоновых кислот был также ниже среднего или не отличался от него, за исключением откликов на внесение аскорбиновой и уксусной кислот, которые превышали средние значения на 19% и в 2.2 раза спустя 10 месяцев, на 15 и 25% спустя 13 месяцев соответственно. Поскольку к этому сроку внесенные белковые материалы были утилизированы микроорганизмами, можно полагать, что сообщество частично перешло в покоящееся состояние. В липидных вариантах дыхательный отклик микробного сообщества на внесение аминокислот был значимо выше среднего по эксперименту в 1.8–2.3 (10 месяцев) и 1.7–2.1 (13 месяцев) раз. Наиболее стабильный отклик получен на внесение цистеина, различия в двух измерениях спустя 10 и 13 месяцев от начала эксперимента не превысили 3%. Выше среднего был отклик на внесение янтарной, щавелевой, молочной и лимонной кислот (10 месяцев) и янтарной, щавелевой и лимонной кислот (13 месяцев). На внесение аскорбиновой кислоты отклик составлял 84% от среднего (10 месяцев) и не отличался от него (13 месяцев). В отличие от белковых микробные сообщества липидных вариантов (безазотистые материалы) особенно охотно реагировали на внесение азотистых низкомолекулярных субстратов – аминокислот.
Таким образом, спустя 13 мес. от начала эксперимента микробные сообщества серой лесной почвы претерпели сукцессию. К этому сроку белки были полностью минерализованы, однако, несмотря на существенное уменьшение активной биомассы, микробные сообщества этих экспериментальных вариантов сохраняли потенциальную дыхательную активность и особенно сильно откликались на добавление аскорбиновой и уксусной кислот. Микробные сообщества вариантов с внесением липидов наиболее сильно откликались на внесение аминокислот и на внесение янтарной, щавелевой, лимонной и молочной кислот. Микробные сообщества вариантов с внесением полисахаридов (крахмал и растительные остатки) по дыхательным откликам, в целом достоверно не отличались от средних по эксперименту, и лишь на внесение молочной кислоты были значимо выше среднего на 20 и 32% соответственно спустя 10 и 13 месяцев.
Метод МСТ весьма трудоемок вследствие использования множества субстратов. Статистический анализ сократил их до наиболее индикаторных: аскорбиновой, уксусной и молочной кислот и цистеина. Предложенные соотношения АУ, АМ и АЦ являются индикаторами внесения азотсодержащих и безазотистых органических соединений, причем первые два показателя могут быть индикаторами на отдельных сроках микробной сукцессии (8, 10–13 месяцев), а показатель АЦ – на всем ее протяжении. Отклики на внесение углеводов тесно коррелируют с микробной биомассой, поэтому представляется целесообразным оставлять в МСТ лишь глюкозу как показатель активной микробной биомассы.
ЗАКЛЮЧЕНИЕ
В модельном лабораторном эксперименте изучена сукцессия микробных сообществ серой лесной почвы при разложении белков (казеин, желатин, шерсть), липидов (растительное масло, бараний жир) и полисахаридов (крахмал, растительные остатки). Динамика дыхательной активности микробных сообществ и потерь Сорг свидетельствуют о том, что основная масса белков в эксперименте была минерализована за первые 3 месяцев. В вариантах, обогащенных липидами, активное разложение началось спустя 2 месяца от начала эксперимента. Использование метода МСТ выявило различия в функциональном разнообразии сообществ по ходу их сукцессии. Величины дыхательного отклика микробных сообществ на внесение аминокислот были наиболее высокими в экспериментальных вариантах с безазотистыми материалами (липидами и полисахаридами) и низкими – в вариантах с белками, что свидетельствует о развитии микробных сообществ в условиях недостатка либо обеспеченности почвы азотом. Индикатором этого служит отношение дыхательных откликов на внесение карбоновых кислот к таковому на внесение аминокислот. Микробные сообщества экспериментальных вариантов различались также по соотношению дыхательных откликов на внесение аскорбиновой кислоты к внесению уксусной (АУ), молочной кислот (АМ) и цистеина (АЦ). Первые два показателя были индикаторными на отдельных сроках микробной сукцессии (8, 10–13 месяцев), а показатель АЦ – на всем ее протяжении, что представляется перспективным для использования этих показателей при реконструкции исходного присутствия белковых (азотистых) и иных (безазотистых), соединений в различных археологических контекстах.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при поддержке РФФИ: проведение модельного эксперимента осуществляли в рамках гранта 17-29-04257 ОФИ-М “Археологическая микробиология: теория и практика выявления исходного присутствия органических материалов в археологических исследованиях”, аналитические исследования выполняли за счет средств гранта 17-06-00412 “Выявление и идентификация органических материалов в погребальном обряде культур степной зоны России на основе методов почвенной микробиологии и энзимологии”.
Список литературы
Бухарин О.В., Гинцбург А.Л., Романова Ю.М., Эль-Регистан Г.И. Механизмы выживания бактерий. М.: Медицина, 2005. 367 с.
Горленко М.В., Кожевин П.А. Мультисубстратное тестирование природных микробных сообществ. М.: МАКС Пресс, 2005. 88 с.
Данилогорская А.А., Марфенина О.Е., Тухбатова Р.И. Опыт применения мультисубстратного тестирования для определения функционального разнообразия почвенных грибов // Микология и фитопатология. 2015. Т. 49. Вып. 6. С. 340–348.
Демкин В.А., Демкина Т.С., Удальцов С.Н. Реконструкция погребальной пищи в глиняных сосудах из курганных захоронений с использованием фосфатного и микробиологических методов // Вестник археологии, антропологии и этнографии. 2014. № 2(25). С. 148–159.
Каширская Н.Н., Плеханова Л.Н., Удальцов С.Н., Чернышева Е.В., Борисов А.В. Механизмы и временной фактор функционирования ферментативной организации палеопочв // Биофизика. 2017. Т. 62. № 6. С. 1235–1244.
Кизяков В.Е. Накопление питательных веществ за счет пожнивных и корневых остатков зерновых культур в обыкновенном черноземе // Агрохимия. 1981. № 2. С. 49–53.
Курганова И.Н., Ермолаев А.М., Лопес-де-Гереню В.О., Ларионова А.А., Кузяков Я., Келлер Т., Ланге Ш. Баланс углерода в почвах залежей Подмосковья // Почвоведение. 2007. № 1. С. 60–68.
Ларионова А.А., Золаторева Б.Н, Колягин Ю.Г., Квиткина А.К., Каганова В.В., Кудеяров В.Н. Состав структурных фрагментов и интенсивность минерализации органического вещества в почвах зонального ряда // Почвоведение. 2015. № 5. С. 1232–1241.
Медин Д.К., Русакова И.В. Эффективность применения птичьего помета в сочетании с соломой зерновых культур под тритикале на дерново-подзолистой супесчаной почве // Владимирский земледелец. 2013. № 1(63). С. 26–28.
Русакова И.В., Московин В.В. Исследование влияния микробиологических препаратов на процессы трансформации соломы зерновых культур в дерново-подзолистой почве // Владимирский земледелец. 2015. № 3–4(74). С. 18–21.
Чернышева Е.В., Борисов А.В., Коробов Д.С. Биологическая память почв и культурных слоев археологических памятников. М.: ГЕОС, 2016. 240 с.
Чертов О.Г., Комаров А.С., Надпорожская М.А. Анализ динамики и гумификации растительных остатков в почве // Почвоведение. 2007. № 2. С. 160–169.
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. № 3. P. 215–221.
Degens B.P., Harris J.A. Development of a physiological approach to measuring the catabolic diversity of soil microbial communities // Soil Biol. Biochem. 1997. V. 29. № 9/10. P. 1309–1320.
Husson F., Le S., Pagès J. Exploratory multivariate analysis by example using R. Chapman & Hall/CRC, 2017. 248 p.
R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria, 2017. http://www.R-project.org
Дополнительные материалы отсутствуют.


