Почвоведение, 2019, № 8, стр. 974-985
Биомасса и таксономическая структура микробных сообществ в почвах правобережья р. Оки
М. В. Семенов 1, *, Н. А. Манучарова 2, Г. С. Краснов 3, Д. А. Никитин 1, 2, А. Л. Степанов 2
1 Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, Россия
2 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
3 Институт молекулярной биологии им. В.А. Энгельгардта
119991 Москва, ул. Вавилова, 32, Россия
* E-mail: mikhail.v.semenov@gmail.com
Поступила в редакцию 26.10.2018
После доработки 06.11.2018
Принята к публикации 25.12.2018
Аннотация
Приведены данные по содержанию микробной биомассы, численности и таксономической структуре сообществ бактерий и архей в верхних горизонтах серой лесной (Eutric Retisol (Loamic, Cutanic, Humic)) и аллювиально-луговой (Fluvic Gleyic Phaeozem (Loamic, Pachic)) почв автономного, транзитного и аккумулятивного участков склонового ландшафта, представленных залежью, мелколиственным лесом и лугом соответственно. Микробная биомасса измерялась методами количественного определения ДНК и фумигации-экстракции хлороформом, численность архей и бактерий – методом FISH, а структура микробных сообществ с помощью высокопроизводительного секвенирования ампликонов гена 16S рРНК (ДНК-метабаркодинга). Содержание микробной биомассы, а также численность метаболически активных клеток архей и бактерий коррелировали с распределением органического углерода (Сорг) и общего азота (Nобщ), увеличиваясь вдоль склона от автономного участка к аккумулятивному и уменьшаясь от верхнего горизонта к нижележащим. Аллювиально-луговая почва аккумулятивного участка ландшафта характеризовалась резким уменьшением относительной численности филума Verrucomicrobia и ростом доли Proteobacteria и Firmicutes по сравнению с серой лесной почвой автономного и транзитного участков. Количество операционных таксономических единиц и индексы α-разнообразия значимо коррелировали с C/N, Cорг, Nобщ и почти не зависели от pH почвы. Таким образом, расположение в ландшафте определяет не только физико-химические, но и микробиологические свойства почв, формируя пространственную неоднородность численности и структуры микробных сообществ в масштабах мезорельефа.
ВВЕДЕНИЕ
Рельеф оказывает комплексное влияние на свойства почвы и протекающие в ней процессы, поэтому даже небольшие изменения в топографии могут приводить к существенным различиям в экологических условиях на относительно небольших расстояниях [7, 26, 33]. В зависимости от положения в ландшафте складываются особые условия почвообразования, формируются специфические водный, тепловой и воздушный режимы с отчетливой пространственной вариабельностью физико-химических и биологических свойств почв [12–14]. Почвы склонового ландшафта отличаются по содержанию микробной биомассы и органического углерода [14], потенциальной активности многих гидролитических ферментов, при этом данные различия часто выявляются только в подповерхностных горизонтах [15].
Геоморфологические и флористические особенности местоположений в пределах склонового ландшафта отражаются на скорости и направленности многих почвенных процессов, осуществляемых микроорганизмами [3, 14, 32]. Вдоль по склону происходит усиление минерализации азота и углерода, а также ослабление нитрификации [24, 39]. Это отражается в увеличении потоков диоксида углерода и закиси азота в направлении от автономных участков к аккумулятивным [5]. Кроме того, аккумулятивные участки характеризуются частыми периодами переувлажнения, что ведет к росту метаногенной активности в почвах нижних участков склона [5]. Интенсивность этих процессов зависит от состава, численности и активности микробного сообщества, присущих почвенно-экологическим условиям разных местоположений в ландшафте [1, 14, 32]. Поэтому вопросы пространственного распределения почвенных микроорганизмов в геохимически сопряженной последовательности почв являются одним из перспективных направлений современной экологии микроорганизмов.
В отличие от бактерий археи продолжают оставаться наименее изученной группой почвенных микроорганизмов, хотя появляется все больше доказательств их широкой представленности в почвах и важной роли в циклах биофильных элементов [11, 38]. Представители филума Thaumarchaeota способны проводить окисление аммония, а большинство классов в составе филума Euryarchaeota являются метаногенами. Распространение архей в почвах контролируется такими почвенно-экологическими факторами, как влажность, pH [22, 23], содержание углерода и азота [6], вид растительности [34], поэтому можно ожидать существенных сдвигов в численности и активности архей в почвах на разных участках склона.
В выполненной работе проведено определение микробной биомассы, численности и таксономической структуры сообществ бактерий и архей в верхних горизонтах почв с разными физико-химическими свойствами, залегающих в автономной, транзитной и аккумулятивной позициях склонового ландшафта, представленных тремя экосистемами (залежь, лес, луг).
ОБЪЕКТЫ И МЕТОДЫ
Почвы. Объектом исследований были почвы катены, расположенной на склоне западной экспозиции правой части бассейна р. Любожиха (правый приток р. Ока) в окрестностях г. Пущино Московской области. В пределах трансекты длиной 960 м были выбраны контрольные точки, соответствующие автономной (участок I), транзитной (участок II) и аккумулятивной (участок III) позициям склонового ландшафта. Координаты контрольных точек отбора: (54°49′05.1″ N, 37°35′39.3″ E), (54°49′08.2″ N, 37°35′01.3″ E) и (54°49′08.8″ N, 37°34′45.6″ E). Расстояние между участками I и II составляло 680, II и III – 280 м. Перепад высот между автономным и транзитным участками составил 20 м, между транзитным и аккумулятивным – 60 м. Автономная и транзитная части ландшафта представлены серой лесной почвой разной степени смытости (Eutric Retisol (Loamic, Cutanic, Humic)), а аккумулятивная – интразональной аллювиально-луговой почвой (Fluvic Gleyic Phaeozem (Loamic, Pachic)). Доминирующая растительность залежной экосистемы автономной позиции – рыхлокустовые и корневищные злаковые травы (20 лет), лесной экосистемы транзитной позиции – вторичный мелколиственный лес (80 лет), лугово-болотной экосистемы аккумулятивной позиции – лугово-болотная ассоциация.
Отбор почвенных образцов проводили из трех горизонтов: Ah, AE, EB (участок I), Ah, AE, EB (участок II), Ah1, Ah2, ABhg (участок III). В пределах выделенных генетических горизонтов из трех стенок почвенного разреза отбирали смешанные образцы в трехкратной повторности. Образцы почв, используемые для определения микробной биомассы методами фумигации-экстракции и количественного анализа ДНК, а также секвенирования ампликонов 16S рРНК гена, хранили при –20°С, для количественного подсчета численности метаболически активных клеток методом FISH – при температуре +4°С. Физико-химические свойств почв определяли в воздушно-сухих образцах. Весовую влажность свежих образцов почвы определяли высушиванием при температуре +105°С в течение 24 ч. Содержание органического углерода (Сорг) и общего азота (Nобщ) в почве определяли на автоматическом HCNS-анализаторе Leco 932 (США). Величины водного pH почвы измеряли потенциометрическим способом при соотношении почва : вода, равном 1 : 2.5.
Экстракция тотальной ДНК из почв. Почвенную ДНК экстрагировали из образцов массой 0.5 г с помощью набора FastDNA SPIN kit for Soil (MP Biomedicals, Germany) согласно протоколу производителя. Гомогенизацию почвенных образцов производили с использованием гомогенизатора FastPrep (MP Biomedicals, Germany). Выделенные экстракты ДНК до анализа хранили при температуре −20°C.
Определение содержания углерода микробной биомассы (Cмик) осуществляли методом фумигации-экстракции в парах хлороформа с использованием 0.05 M раствора K2SO4 [36]. Содержание экстрагированного углерода в вытяжках измеряли с использованием C/N-анализатора Multi N/C analyzer 2100S (Analytik Jena, Германия). Величину углерода микробной биомассы определяли по разнице между экстрагированным углеродом из фумигированной и нефумигированной почвы, используя коэффициент пересчета kEC = 0.45.
Углерод микробной биомассы определяли методом количественной экстракции тотальной почвенной двухцепочечной ДНК (дцДНК) [29, 36]. Для количественного анализа использовали флуоресцентный краситель PicoGreen (Molecular Probes, Life Technologies, Германия). Активность флуоресценции определяли с использованием автоматического флуориметра (Wallac 1420, Perkin Elmer, Turku, Финляндия) в диапазоне возбуждения 485 нм и эмиссии 525 нм. Углерод микробной биомассы Смик рассчитывали путем умножения содержания дцДНК на пересчетный коэффициент Fднк, равный 5.10 [28, 36].
Процедура определения метаболически активных клеток бактерий и архей с использованием метода гибридизации in situ (метод FISH) включала в себя десорбцию клеток от почвенных частиц, фиксацию клеток, нанесение фиксированного образца на поверхность предметного стекла, гибридизацию со специфичными пробами и микроскопирование [6, 31]. Фиксацию клеток проводили с помощью формальдегида. Для гибридизации использовали меченные флуоресцентным красителем СуЗ рРНК-специфичные олигонуклеотидные пробы EUB338, EUB338-II и EUB338-III для определения клеток бактерий и ARCH915 для клеток архей [9, 18]. Филогенетические группы в составе домена Archaea определяли с помощью специфических проб СREN537 и EURY806 [37], соответствующих филумам Thaumarchaeota и Euryarchaeota. Стекла с готовыми препаратами анализировали с помощью микроскопа ZEIZZ Axioskop 2 plus (Германия) со светофильтрами Filter set 15 для Cy3-меченых зондов.
ДНК-метабаркодинг. Для проведения анализа проводили амплификацию регионов V3-V4 гена 16S рРНК с использованием универсальных прямого и обратного праймеров 341F и 805R [25]. После получения ампликонов библиотеки очищали и смешивали эквимолярно с помощью набора SequalPrep™ Normalization Plate Kit (Thermo Fisher Scientific, Waltham, США). Результирующий пул библиотек проверяли на капиллярном электрофорезе и затем секвенировали на приборе Illumina MiSeq.
Биоинформатический анализ результатов секвенирования. Обработку данных, полученных в результате секвенирования ампликонов генов 16S рРНК, проводили при помощи программной среды R и QIIME [16]. Склеивание прямых и обратных нуклеотидных последовательностей осуществляли методом fastq-join. Операционные таксономические единицы (ОТЕ) идентифицировали с использованием алгоритма UCLUST на основе 97%-ного порога сходства сиквенсов по библиотеке реферативных сиквенсов базы данных RDP. Синглтоны (ОТЕ, содержащие один сиквенс), митохондрии и хлоропласты удаляли.
Для определения показателей общего разнообразия прокариотных сообществ (α-разнообразие) рассчитывали индексы Шеннона и Chao1. При расчете индексов разнообразия проводили нормализацию данных по образцу с минимальным числом полученных сиквенсов. Различия структуры бактериальных сообществ (β-разнообразие) между разными горизонтами почв анализировали методами unweighted и weighted UniFrac [30] при помощи многомерного неметрического шкалирования (NMDS).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химические свойства и углерод микробной биомассы почв. Содержание органического углерода и общего азота в верхних горизонтах почв последовательно увеличивалось вдоль склона от автономной к аккумулятивной позиции, составляя 1.41–0.14, 2.23–0.19, 4.78–0.40% для участков I, II и III соответственно (табл. 1). В нижележащих горизонтах почв величины Cорг и Nобщ значительно уменьшались, хотя гор. Ah2 и ABhg аллювиально-луговой почвы были достаточно гумусированными. Отношение C/N в разных горизонтах почв колебалось в диапазоне от 8.1 до 12.1. Серая лесная почва автономного и транзитного участков характеризовалась слабокислой реакцией среды, аллювиально-луговая – нейтральной.
Таблица 1.
Основные химические и биологические показатели почв разных позиций склонового ландшафта
| Горизонт | Глубина, см | Сорг, % | Nобщ, % | С/N | pH | ДНК-Смик, мкг/г | ФЭ-Смик, мкг/г | $\frac{{{{{\text{С }}}_{{{\text{м и к }}}}}}}{{{{{\text{С }}}_{{{\text{о р г }}}}}}},$ % |
|---|---|---|---|---|---|---|---|---|
| Автономная позиция склонового ландшафта | ||||||||
| Ah | 0–15 | 1.41 | 0.14 | 10.4 | 6.24 | 302 | 307 | 2.14 |
| AЕ | 15–36 | 0.85 | 0.08 | 10.4 | 6.67 | 94 | 114 | 1.11 |
| ЕB | 36–54 | 0.55 | 0.06 | 9.0 | 6.82 | 63 | 79 | 1.15 |
| Транзитная позиция склонового ландшафта | ||||||||
| Ah | 0–18 | 2.23 | 0.19 | 12.1 | 5.19 | 453 | 439 | 2.03 |
| AЕ | 18–38 | 0.49 | 0.06 | 8.8 | 5.79 | 40 | 49 | 0.80 |
| ЕB | 38–57 | 0.35 | 0.04 | 8.1 | 5.91 | 35 | 40 | 0.99 |
| Аккумулятивная позиция склонового ландшафта | ||||||||
| Ah1 | 0–20 | 4.78 | 0.40 | 11.9 | 7.02 | 840 | 816 | 1.76 |
| Ah2 | 20–38 | 1.79 | 0.17 | 10.7 | 6.91 | 209 | 203 | 1.17 |
| ABhg | 38–62 | 1.66 | 0.16 | 10.6 | 6.87 | 186 | 193 | 1.12 |
Оба метода измерения микробной биомассы с помощью количественного определения дцДНК и фумигации-экстракции хлороформом дали близкие величины Смик в почвах. Распределение микробной биомассы соответствовало содержанию Сорг и Nобщ, увеличиваясь вдоль склона от участка I к участку III и уменьшаясь от верхнего горизонта к нижележащим. Максимальное количество микробной биомассы (840 мкг/г) почвы находилось в верхнем гор. Ah1 аллювиально-луговой почвы.
Отношение Cмик/Cорг является индикатором доступности почвенного углерода для микроорганизмов [10]. Его сужение в почве указывает на прочность стабилизации органического субстрата или на наличие экологических условий и физических барьеров, препятствующих потреблению субстрата микроорганизмами. Увеличение содержания общей микробной биомассы в почвах от автономной позиции ландшафта к транзитной и аккумулятивной в 1.8 и 2.8 раза соответственно, сопровождалось уменьшением ее доли в почвенном органическом веществе. Этот факт согласуется с превалированием аккумуляционных процессов в трансформации органических материалов в переувлажненных условиях под лугово-болотной растительностью.
Численность метаболически активных клеток бактерий и архей в почвах разных участков катены. Количество метаболически активных клеток бактерий и архей в верхнем горизонте почв последовательно увеличивалось вниз по склону, от 5.7 до 9.2 × 108 г–1 почвы для бактерий, и от 0.8 до 1.7 × 108 г–1 почвы для архей. Численность бактерий резко уменьшалась с глубиной: по сравнению с поверхностным гор. Ah, в двух нижележащих горизонтах количество бактериальных клеток снижалось в 3.0–5.2 раза в почве участка I, в 3.8–6.7 раз – в почве участке II (рис. 1). В аллювиально-луговой почве участка III убывание численности бактерий с глубиной было более плавным (в 1.9–2.9 раз), что объясняется высоким содержанием углерода и азота в нижележащих горизонтах. Численность метаболически активных клеток архей уменьшалась в нижележащих горизонтах в 1.5–3 раза.
Рис. 1.
Численность метаболически активных клеток бактерий и архей, в том числе таумархеот и эвриархеот, гибридизующихся со специфическими олигонуклеотидными пробами. Здесь и далее: I – серая лесная почва автономной части ландшафта, II – серая лесная почва транзитной части ландшафта, III – аллювиально-луговая почва аккумулятивной части ландшафта.

Полученные данные по численности архей и бактерий в серой лесной и аллювиально-луговой почвах катены оказались сопоставимы с результатами метаболически активных клеток, ранее полученными для черноземов и бурых полупустынных почв [6]. Как и в предыдущем исследовании, численность метаболически активных клеток исчислялась n × 108 для бактерий и n × 107 для архей. Тем не менее, в отличие от серых лесных и бурых полупустынных почв черноземы характеризовались значительно меньшим количеством активных клеток на единицу углерода. Данный эффект может быть обусловлен недостаточным снабжением микроорганизмов органическим углеродом в черноземе из-за большей защищенности органического вещества [4], а также недоучетом клеток из-за сложности их отделения от глинистой фракции черноземов [6]. Полученные нами значения метаболически активных клеток имели одинаковый порядок с обилием рибосомальных генов бактерий и архей в серой лесной почве – 9.6 × 108 и 9 × 107 копий генов г–1 почвы соответственно [2].
Проведено определение двух ведущих филумов в составе архей: Thaumarchaeota и Euryarchaeota. Численность таумархеот в верхних горизонтах почв колебалась от 0.26 × 108 до 0.64 × 108 кл./г почвы с максимумом для лесной экосистемы транзитного участка склона. Количество метаболически активных клеток эвриархеот автономного и транзитного участков склона было одинаковым (0.44 × 108 кл./г почвы), но увеличивалось в 2.6 раза в переувлажненном участке III.
Соотношение бактерии/археи существенно сужалось с глубиной, а также в направлении от автономного участка к аккумулятивному. Величины данного соотношения в верхних горизонтах составили 7.4, 6.7 и 5.6 для участков I, II и II соответственно. Это означает, что вклад архей в общую метаболически активную биомассу прокариот в гор. Ah составил 12–15%. В подповерхностных горизонтах доля архей возрастала, достигая 16–21%.
Таблица 2.
Показатели α-разнообразия почв разных позиций склонового ландшафта
| Горизонт | Количество ОТЕ | Индекс Шеннона | Индекс Chao1 |
|---|---|---|---|
| Автономная | |||
| Ah | 3685 | 9.7 | 4334 |
| AЕ | 3515 | 9.14 | 4098 |
| ЕВ | 2193 | 8.24 | 2735 |
| Транзитная | |||
| Ah | 3658 | 9.64 | 4361 |
| AЕ | 2703 | 8.18 | 3328 |
| ЕB | 2297 | 8.13 | 2792 |
| Аккумулятивная | |||
| Ah1 | 4480 | 10.11 | 5289 |
| Ah2 | 4237 | 8.97 | 5311 |
| ABhg | 4128 | 9.44 | 5255 |
Различные исследования показывают как снижение доли архей с глубиной [9], так и увеличение [19, 23]. Упомянутые данные основаны на ДНК-методах, которые не дают представления о количественном распределении активных архей и бактерий. Еще одной трудностью при оценке вклада архей в микробное сообщество является проблема соотношения количества копий рибосомальных генов в разных группах микроорганизмов. Количество копий рибосомальных генов составляет от 1 до 15 для бактерий и от 1 до 4 для архей [27]. Это означает, что при оценке соотношений бактерии/археи вклад архей в микробные сообщества будет недоучитываться всеми методами, основанными на количественной оценке генов 16S рРНК. Подсчет численности метаболически активных клеток РНК-методом FISH показал, что в почвах увеличивается доля именно активно функционирующих архей [6]. Таким образом, роль архей в биогеохимических процессах почвенного профиля, по-видимому, увеличивается с глубиной.
Между численностью метаболически активных клеток обоих доменов и содержанием Сорг и Nобщ была выявлена тесная линейная зависимость (рис. 2). Таким образом, повышение обеспеченности почвы органическим углеродом и общим азотом приводило к закономерному постепенному росту количества метаболически активных клеток, как архей, так и бактерий. При этом отклик численности бактерий на увеличение содержания Сорг и Nобщ был в 5 раз выше, чем архей. Полученные результаты подтверждают гипотезу о том, что бактерии гораздо более чувствительны к обеспеченности субстратом и хуже приспособлены к условиям энергетического стресса по сравнению с археями [40].
Рис. 2.
Зависимость численности метаболически активных клеток бактерий и архей от содержания органического углерода и общего азота в почве.

Таксономическая структура микробных сообществ почв катены. Бактериальное сообщество почв катены состояло преимущественно из представителей 7 филумов: Acidobacteria, Actinobacteria, Bacteroidetes, Chloroflexi, Firmicutes, Proteobacteria и Verrucomicrobia, на долю которых приходилось более 95% от сообщества (рис. 3). Доля Acidobacteria (до 24%) практически не менялась вне зависимости от почвы и горизонта. Автономный участок ландшафта под залежью характеризовался наибольшим обилием филума Actinobacteria с последовательным увеличением доли этих бактерий к нижележащим горизонтам (от 24 до 34%). Доля филума Verrucomicrobia в подповерхностных гор. AE и EB серой лесной почвы транзитного участка II возрастала в 3 раза по сравнению с гор. Ah. Аллювиально-луговая почва аккумулятивного участка III существенно отличалась от серой лесной почвы участков I и II снижением доли Verrucomicrobia, а также увеличением доли филумов Proteobacteria и Firmicutes. Филум Bacteroidetes характеризовался строгой приверженностью к поверхностным горизонтам, резко снижаясь на глубине ниже 20 см. Полученные результаты в целом согласуются с данными по структуре прокариотных сообществ, полученными для черноземов Каменной степи [35], подтверждая доминирование Verrucomicrobia в подповерхностных горизонтах (20–60 см) почв, а также приуроченность филума Bacteroidetes к верхним горизонтам почв.
Рис. 3.
Структура микробных сообществ почв разных позиций склонового ландшафта на уровне филумов (приведены данные для классов с представленностью больше 0.5%).

На уровне классов 23 бактериальных таксона характеризовались относительной численностью более 0.5%, 9 из которых принадлежали к различным субгруппам ацидобактерий (рис. 4). Несмотря на то, что относительная численность филума Acidobacteria практически не изменялась в зависимости от глубины горизонта и положения участка в ландшафте, часть классов Acidobacteria существенно отличалась по вкладу в бактериальные сообщества разных генетических горизонтов исследуемых почв. Верхние горизонты почв характеризовались большей долей субгрупп Acidobacteria Gp4 и Gp6, тогда как с глубиной повышалась доля субгрупп Gp1 и Gp7. Доля субгруппы Gp2 возрастала в подповерхностных горизонтах почвы транзитного участка ландшафта лесной экосистемы. Распределение субгруппы Gp2 по горизонтам почв оказалось полностью идентичным классу Spartobacteria, ростом доли которого вызвано повышение численности филума Verrucomicrobia в почве транзитного участка II. Между классами Gp2 и Spartobacteria была выявлена статистически значимая (P < 0.01) линейная зависимость с коэффициентом детерминации R2 = 0.97, что говорит об устойчивой экологической связи этих двух таксонов, либо об их схожей экологии. Увеличение доли протеобактерий в микробном сообществе аллювиально-луговой почвы участка III было вызвано повышением численности β- и δ‑протеобактерий, тогда как относительная численность α- и γ-протеобактерий осталась без изменений. Приуроченность филума Bacteroidetes к верхнему гор. А определялась распределением классов Flaviobacteriia и Cytophagia, тогда как доля Sphingobacteriia не имела связи с глубиной и расположением почвы в ландшафте. Представители класса Bacteroidia детектировались лишь в аллювиально-луговой почве.
Рис. 4.
Структура микробных сообществ почв разных позиций склонового ландшафта на уровне классов (приведены данные для классов с представленностью больше 0.5%).

Анализ численности наиболее представленных родов позволил выявить основных доминантов в микробных сообществах почв разных участков ландшафта (рис. 5). Ключевыми бактериальными таксонами участка I оказались представитель актинобактерий – род Gaiella (6–9%), а также некультивируемый род Spartobacteria genera incertae sedis (4–6%) и ацидобактерий Gp6 (5–9%) и Gp16 (1.5–5%). Верхний горизонт транзитного участка II отличался обилием родов Acinetobacter, Gemmatimonas, Gp7 и Sphingomonas. Абсолютным доминантом в подповерхностных горизонтах (AE и EB) транзитного участка II оказался род Spartobacteria genera incertae sedis, относительная численность которого достигала более 20% от всех идентифицируемых родов. В микробном сообществе аллювиально-луговой почвы аккумулятивного участка III доминировали роды Bacillus, Clostridium, Desulfuromonas, Geobacter, ацидобактерии групп Gp2, Gp21, Gp22 и Gp6. Кроме того, выявлено наибольшее количество родов архей-метаногенов: Methanobacterium, Methanobrevibacter, Methanocella, Methanolinea, Methanomassiliicoccus, Methanoregula, Methanosarcina, Methanospirillum, Methanothrix. Низкой долей характеризовались многие роды, типичные для серой лесной почвы: Acinetobacter, Bradyrhizobium, Mycobacterium, Reyranella, Streptomyces и Spartobacteria genera incertae sedis. Таким образом, аллювиально-луговая почва существенно отличалась от серой лесной почвы автономного и транзитного участков по таксономическому составу микробных сообществ, в котором доминировали облигатные анаэробы: метаногены, денитрификаторы, сульфатредукторы и микроорганизмы цикла железа. Данный сдвиг в структуре микробных сообществ вызван систематическим переувлажнением, приводящим к развитию анаэробных зон, а также активному накоплению органического углерода и других биогенных элементов в аккумулятивном участке ландшафта. Оба фактора являются следствием положения почвы в мезорельефе, которое определяет структуру и активность почвенных микробных сообществ. Накопление органического вещества является причиной роста эмиссии диоксида углерода, а высокая численность и разнообразие метаногенов и денитрификаторов объясняют увеличение потока метана и закиси азота в почве аккумулятивного участка катены [5].
Рис. 5.
Тепловая карта, иллюстрирующая представленность доминирующих родов бактерий в составе микробных сообществ почв разных позиций склонового ландшафта.

α-Разнообразие микробных сообществ почв катены. Наличие большого количества видов на образец позволило выделить несколько тысяч ОТЕ в каждом из генетических горизонтов исследуемых почв катены. Количество ОТЕ ожидаемо снижалось с глубиной, а также увеличивалось в нижней части склона (участок III) с максимумом в гор. Ah1 – 4480. Индекс Шеннона и Chao1 также уменьшались вниз по профилю и имели максимальное значение (10.11 и 5289 соответственно) в верхнем горизонте участка III. Как и численность метаболически активных архей и бактерий, количество ОТЕ значимо коррелировало со значениями C/N (R2 = 0.85, P < 0.01), Cорг (R2 = 0.76, P < 0.05) и Nобщ (R2 = 0.79, P < 0.05). При этом, величина pH почвы никак не влияла на количество ОТЕ и общее α-разнообразие микробных сообществ. Полученные результаты опровергают гипотезу о pH почвы как ведущем факторе, определяющем структуру и разнообразие микробных сообществ [20, 21]. Несмотря на очевидную роль pH в экологии и физиологии микроорганизмов, данный фактор вряд ли можно назвать решающим, а высокая корреляция pH с показателями микробных сообществ часто может быть объяснена сопутствующей корреляцией реакции среды с такими ключевыми показателями почвы, как содержание углерода и азота, гранулометрический состав почвы.
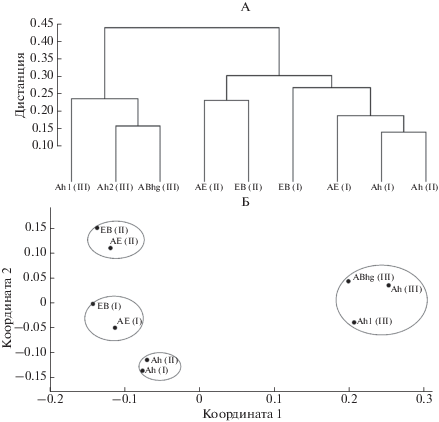
β-разнообразие микробных сообществ почв катены. Степень схожести микробных сообществ почв катены оценивали с помощью кластерного анализа и неметрического многомерного шкалирования по метрике unweighted и weighted UniFrac. Поскольку оба метода показали идентичные результаты, в данном разделе использовали результаты unweighted UniFrac (состав таксонов без учета их представленности), демонстрирующие наиболее яркие закономерности распределения микробных сообществ.
Выявлено два основных кластера наиболее сильно различавшихся групп образцов (рис. 6). В первую группу вошли горизонты серой лесной почвы автономного и транзитного участков склона (участки I и II), во вторую – горизонты аллювиально-луговой почвы участка III. В рамках первого кластера выделены три подкластера: 1) верхние гор. Ah участков I и II, 2) подповерхностные горизонты участка I и 3) подповерхностные горизонты участка II. Такое распределение по кластерам может быть объяснено спецификой свойств почвы и растительностью, доминирующей в экосистемах залежи и леса. Подповерхностные горизонты почвы транзитного участка склона под лесом на глубине 20–60 см отличаются высокой представленностью Verrucomicrobia и других микроорганизмов, ассоциированных с корнями древесных растений, что предопределяет общие структурные различия в таксономическом составе микробных сообществ серой лесной почвы под залежью и лесом. Из этого следует, что структура почвенного микробиома в пределах ландшафта формируется под влиянием не только физико-химических свойств почвы, но и флористического состава растительности.
ЗАКЛЮЧЕНИЕ
Почвы автономного, транзитного и аккумулятивного участков склонового ландшафта контрастно различались по своему микробиологическому состоянию, демонстрируя отчетливую пространственную вариабельность в масштабах мезорельефа. Содержание микробной биомассы, численность архей и бактерий, количество ОТЕ, индексы α-разнообразия последовательно увеличивались от верхнего автономного участка склона к нижнему аккумулятивному. Содержание органического углерода и общего азота было более значимым фактором формирования микробного сообщества почв катены, чем pH почвенной среды.
Аллювиально-луговая почва аккумулятивной позиции ландшафта существенно отличалась от серой лесной почвы автономного и транзитного участков не только по численности, но и по таксономическому составу микробных сообществ, в котором доминировали облигатные анаэробы: метаногены, денитрификаторы, сульфатредукторы и микроорганизмы цикла железа. Данный сдвиг в структуре микробных сообществ вызван систематическим переувлажнением, а также активным накоплением органического углерода и других биогенных элементов, что характерно для аккумулятивной части склона. Таким образом, местоположение в склоновом ландшафте выступает одним из ключевых почвенно-экологических факторов в биогеографии почвенных микробных сообществ.
Список литературы
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество научных изданий КМК, 2016. 243 с.
Железова А.Д., Кутовая О.В., Дмитренко В.Н., Тхакахова А.К., Хохлов С.Ф. Оценка количества ДНК разных групп микроорганизмов в генетических горизонтах темно-серой почвы // Бюл. Почв. ин-та им. В.В. Докучаева. 2015. № 78. С. 87–98.
Задорожний А.Н., Семенов М.В., Ходжаева А.К., Семенов В.М. Почвенные процессы продукции, потребления и эмиссии парниковых газов // Агрохимия. 2010. № 10. С. 75–92.
Семенов В.М., Когут Б.М., Зинякова Н.Б., Масютенко Н.П., Малюкова Л.С., Лебедева Т.Н., Тулина А.С. Биологически активное органическое вещество в почвах европейской части России // Почвоведение. 2018. № 4. С. 457–472. https://doi.org/10.7868/S0032180X1804007X
Семенов М.В., Кравченко И.К., Семенов В.М., Кузнецова Т.В., Дулов Л.Е., Удальцов С.Н., Степанов А.Л. Потоки диоксида углерода, метана и закиси азота в почвах катены правобережья р. Ока (Московская область) // Почвоведение. 2010. № 5. С. 582–590.
Семенов М.В., Манучарова Н.А., Степанов А.Л. Распределение метаболически активных представителей прокариот (архей и бактерий) по профилям чернозема и бурой полупустынной почвы // Почвоведение. 2016. № 2. С. 239–248.
Хитров Н.Б. Связь почв солонцового комплекса Северного Прикаспия с микрорельефом // Почвоведение. 2005. № 3. С. 271–284.
Чернов Т.И., Лебедева М.П., Тхакахова А.К., Кутовая О.В. Профильный анализ микробиомов сопряженных почв солонцового комплекса Прикаспийской низменности // Почвоведение. 2017. № 1. С. 71–76. https://doi.org/10.7868/S0032180X1701004X
Amann R.I., Ludwig W. Ribosomal RNA targeted nucleic acid probes for studies in microbial ecology // FEMS Microbiol. Rev. 2000. V. 24. P. 555–565.
Anderson T.H. Microbial eco-physiological indicators to asses soil quality // Agric. Ecosyst. Environ. 2003. V. 98 (1–3). P. 285–293.
Angel R., Claus P., Conrad R. Methanogenic archaea are globally ubiquitous in aerated soils and become active under wet anoxic conditions // ISME J. 2012. V. 6. P. 847–862.
Ascher J., Sartori G., Graefe U., Thornton B., Ceccherini M.T., Pietramellara G., Egli M. Are humus forms, mesofauna and microflora in subalpine forest soils sensitive to thermal conditions? // Biol. Fertil. Soils. 2012. V. 48. P. 709–725.
Barbosa W.R., Romero R.E., de Souza Junior V.S., Cooper M., Sartor L.R., de Moya Partiti C.S., de Oliveira Jorge F., Cohen R., de Jesus S.L., Ferreira T.O. Effects of slope orientation on pedogenesis of altimontane soils from the Brazilian semi-arid region (Baturité massif, Ceará) // Environ. Earth Sci. 2016. V. 73. № 7. P. 3731–3743.
Bardelli T., Ascher-Jenull J., Stocker E.B., Fornasier F., Arfaioli P., Fravolini G., Alves Medeiros L.R., Egli M., Pietramellara G., Insam H., Gómez-Brandón M. Impact of slope exposure on chemical and microbiological properties of Norway spruce deadwood and underlying soil during early stages of decomposition in the Italian Alps // Catena. 2018. V. 167. P. 100–115.
Bardelli T., Gómez-Brandón M., Ascher-Jenull J., Fornasier F., Arfaioli P., Francioli D., Egli M., Sartori G., Insam H., Pietramellara G. Effects of slope exposure on soil physico-chemical and microbiological properties along an altitudinal climosequence in the Italian Alps // Sci. Total Environ. 2017. V. 575. P. 1041–1055.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peña A.G., Goodrich J.K., Gordon J.I., Huttley G.A. QIIME allows analysis of high-throughput community sequencing data // Nat. methods. 2010. V. 7. P. 335–336.
Carletti P., Vendramin E., Pizzeghello D., Concheri G., Zanella A., Nardi S., Squartini A. Soil humic compounds and microbial communities in six spruce forests as function of parent material, slope aspect and stand age // Plant Soil. 2009. 315. 47–65.
Daims H., Brühl A., Amann R., Schleifer K.-H., Wagner M. The domain-specific probe EUB338 is insufficient for the detection of all bacteria: development and evaluation of a more comprehensive probe set // Systematic Appl. Microbiol. 1999. V. 22. P. 434–444.
Eilers K.G., Debenport S., Anderson S., Fierer N. Digging deeper to find unique microbial communities: the strong effect of depth on the structure of bacterial and archaeal communities in soil // Soil Biol. Biochem. 2012. V. 50. P. 58–65.
Fierer N., Jackson R.B. The diversity and biogeography of soil bacterial communities // P. Proc. Natl. Acad. Sci. USA. 2006. V. 103. P. 626–631.
Hackl E., Pfeffer M., Dona C., Bachmann G., Zechmeister-Boltenstern S. Composition of the microbial communities in the mineral soil under different types of natural forest // Soil Biol. Biochem. 2005. V. 37. P. 661–671.
He J.-Z., Shen J.-P., Zhang L.-M., Zhu Y.-G., Zheng Y.-M., Xu M.-G., Di H. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices // Environ. Microbiol. 2007. V. 9. P. 2364–2374.
Kemnitz D., Kolb S., Conrad R. High abundance of Crenarchaeota in a temperate acidic forest soil // FEMS Microbiol. Ecol. 2007. V. 60. P. 442-448.
Khalili-Rad M., Nourbakhsh F., Jalalian A., Eghbal M.K. The effects of slope position on soil biological properties in an eroded toposequence // Arid Land Res. Manag. 2011. V. 25(3). P. 308–312.
Klindworth A., Pruesse E., Schweer T., Peplies J., Quast C., Horn M., Glöckner F.O. Evaluation of general 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies // Nucleic Acids Res. 2013. V. 41(1). P. e1–e1.
Kravchenko A.N., Bullock D.G. Correlation of corn and soybean grain yield with topography and soil properties // Agron. J. 2000. V. 92(1). P. 75–83.
Lee Z.M.P., Bussema C., Schmidt T.M. rrnDB: documenting the number of rRNA and tRNA genes in bacteria and archaea // Nucleic Acids Res. 2009. V. 37 (suppl 1). P. D489–D493.
Loeppmann S., Semenov M., Blagodatskaya E., Kuzyakov Y. Substrate quality affects microbial-and enzyme activities in rooted soil // J. Plant Nutr. Soil Sci. 2016. V. 179. P. 39–47. https://doi.org/10.1002/jpln.201400518
Loeppmann S., Semenov M., Kuzyakov Y., Blagodatskaya E. Shift from dormancy to microbial growth revealed by RNA: DNA ratio // Ecol. Indic. 2018. V. 85. P. 603–612. https://doi.org/10.1016/j.ecolind.2017.11.020
Lozupone C., Lladser M.E., Knights D., Stombaugh J., Knight R. UniFrac: an effective distance metric for microbial community comparison // The ISME J. 2011. V. 5. P. 169.
Manucharova N.A., Kol’tsova E.M., Stepanov A.L., Demkina E.V., Demkin V.A., El’Registan G.I. Comparative Analysis of the Functional Activity and Composition of Hydrolytic Microbial Complexes from the Lower Volga Barrow and Modern Chestnut Soils // Microbiology. 2014. V. 83(5). P. 674–683. https://doi.org/10.1134/S002626171405018X
Nahidan S., Nourbakhsh F., Henneberger R., Lazzaro A., Zeyer J. Aggregate Size Distribution of Ammonia-Oxidizing Bacteria and Archaea at Different Landscape Positions // Geomicrobiol. J. 2017. V. 34(10). P. 895–902.
Pachepsky Y.A., Timlin D.J., Rawls W.J. Soil water retention as related to topographic variables // Soil Sci. Soc. Am. J. 2001. V. 65(6). P. 1787–1795.
Rooney-Varga J.N., Giewat M.W., Duddleston K.N., Chanton J.P., Hines M.E. Links between archaeal community structure, vegetation type and methanogenic pathway in Alaskan peatlands // FEMS Microbiol. Ecol. 2007. V. 60. P. 240–251.
Semenov M.V., Chernov T.I., Tkhakakhova A.K., Zhelezova A.D., Ivanova E.A., Kolganova T.V., Kutovaya O.V. Distribution of prokaryotic communities throughout the Chernozem profiles under different land uses for over a century // Appl. Soil Ecol. 2018. V. 127. P. 8–18.
Semenov M., Blagodatskaya E., Stepanov A., Kuzyakov Y. DNA-based determination of soil microbial biomass in alkaline and carbonaceous soils of semi-arid climate // J. Arid Environ. 2018. V. 150. P. 54–61.
Teira E., Reinthaler T., Peinthaler A. Peinthaler J. Herndl G.J. Combining catalyzed reporter deposition-fluorescence in situ hybridization and microautoradiography to detect substrate utilization by Bacteria and Archaea in the deep ocean // Appl. Environ. Microbiol. 2004. V. 70. P. 4411–4414.
Timonen S., Bomberg M. Archaea in dry soil environments // Phytochem. Rev. 2009. V. 8. P. 505–518.
Tsui C.C., Chen Z.-S., Hsieh C.F. Relationships between soil properties and slope position in a lowland rain forest of southern Taiwan // Geoderma. 2004. V. 123. P. 131–142.
Valentine D.L. Adaptations to energy stress dictate the ecology and evolution of the Archaea // Nature Rev. Microbiol. 2007. V. 5. P. 316–323.
Дополнительные материалы отсутствуют.