Почвоведение, 2020, № 1, стр. 81-88
Морфофизиологические особенности некоторых культивируемых бактерий засоленных почв Приаралья
Ш. А. Бегматов a, *, О. В. Селицкая a, Л. В. Васильева b, Ю. Ю. Берестовская b, Н. А. Манучарова c, Н. В. Дренова d
a РГАУ-МСХА им. К.А. Тимирязева
127550 Москва, Тимирязевская, 49, Россия
b Институт микробиологии им. С.В. Виноградского РАН
117312 Москва, пр-т 60-летия Октября, 7, Россия
c МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
d Всероссийский центр карантина растений
140150 Московская область, Раменское, ул. Пограничная, 32, Россия
* E-mail: shoxabdullayevich@gmail.com
Поступила в редакцию 19.02.2019
После доработки 08.05.2019
Принята к публикации 20.06.2019
Аннотация
Проведено выделение, идентификация, изучение культурально-морфологических, биохимических особенностей ассоциативных бактерий ризосферы растения солерос (Salicornia L.), распространенного в Приаральском регионе Узбекистана. Установлено, что доминирующими культивируемыми бактериями сильнозасоленной почвы исследуемого региона являются галофильные бактерии родов Halomonas и Planococcus, относящиеся к разным филогенетическим группам: Gamma-Proteobacteria и Firmicutes. Изучены морфофизиологические особенности выделенных штаммов, в частности, отношение к разным концентрациям соли и возможность использования различных источников углерода. При концентрации в питательной среде NaCl на уровне 8.0, 10.0 и 15.0% штаммы росли хорошо, а при концентрации 20.0, 25.0 и 30.0% NaCl не наблюдалось роста и накопления биомассы культур. Результаты исследований изучения биоразнообразия галофильных микроорганизмов в почве могут использоваться при диагностике состояния нарушенных засоленных почв, их биорекультивации и реабилитации.
ВВЕДЕНИЕ
В экстремальных экосистемах основными лимитирующими факторами роста и развития организмов являются высокая концентрация соли, высокая или низкая температура, повышенная радиация, атмосферное давление, кислотность или щелочность среды. Эти физические и химические факторы способствуют созданию экстремальных условий для существования организмов, в том числе и для микроорганизмов [3, 7, 8, 21, 35]. Гиперсоленые экосистемы – один из экстремальных видов экосистем, где могут существовать только те организмы, которые имеют комплексные адаптированные метаболические механизмы для снижения внутриклеточного осмотического давления или щелочности обитаемых ниш. Среди гиперсоленых экосистем выделяют сильноминерализованные воды и сильнозасоленные почвы [35]. Различной степенью засоленности обладают более 800 млн га почвы во всем мире [36]. Большая часть этих почвенных угодий сосредоточена в засушливых регионах, где высокая степень засоленности, наряду с недостатком влаги, препятствует оптимальному земледелию.
Специфические условия почвообразования, сложившиеся на высохшем дне Аральского моря, предопределили выделение здесь особых типов почв, таких как лугово-болотные солончаки, сероземные солонцы, сероземно-луговые солонцы [9] Solonchaks [29]. Усыхание Аральского моря под влиянием антропогенной аридизации привело к резкому увеличению площади солончаков Приаралья. Если в 1951–1953 гг. площадь гидроморфных солончаков составляла здесь 7% от общей площади “живой” дельты, то к 1981–1986 гг. эта территория расширилась и заняла 34% общей площади дельты [12]. К характерным особенностям подобных почв относятся высокое содержание соли в верхнем горизонте, подщелачивание, небольшое количество органических веществ (<1%), которые снижают их плодородие и соответственно приводят к исключению из сельскохозяйственного оборота [44].
Диагностике состояния нарушенных засоленных почв, их биорекультивации и реабилитации может способствовать исследование биоразнообразия галофильных почвенных микроорганизмов [15]. Известно, что адаптация почвенных микроорганизмов к экстремальным условиям, в том числе к условиям засоленности, повышается при вступлении в симбиотические взаимоотношения с растениями. Корневые экссудаты ризосферы растений способствуют росту и развитию микроорганизмов [50]. Получая от растений доступные органические субстраты, микроорганизмы ризосферы поставляют своим партнерам легкоусвояемые соединения азота и фосфора, синтезируют стимулирующие развитие растений фитогормоны и витамины, снижают численность и подавляют активность почвенных фитопатогенов. Обилие микроорганизмов и наличие их различных метаболитов в ризосфере приводит к существенным изменениям свойств почвы [14].
В последние годы многими исследователями проводилось изучение микробиома ризосферы солероса (Salicornia L., семейство Chenopodiaceae), распространенного на сильнозасоленных почвах Приаралья и обладающего солеаккумулирующей способностью [25]. В частности, определена общая микробная биомасса ризосферы солероса [27], проведен метагеномный анализ филлосферы [38], из ризосферы выделены галотолерантные диазотрофные бактерии [30], а также изучена ростстимулирующая активность эндофитов [55]. В солончаках, в первичной галофитной сукцессии, Salicornia europaea встречается в стадии однолетних галомезофитов и галоксеромезофитов, наряду с другими представителями данной первичной сукцессии, такими как Suaeda acuminata и S. prostrata [5].
К настоящему времени из гиперсоленых почв засушливых регионов выделены многие штаммы солеустойчивых и галофильных бактерий [1, 11, 16, 21]. Вместе с тем распространение, таксономия и экология этих микроорганизмов до сих пор полностью не исследованы [34]. С целью более глубокого изучения почвенных микроорганизмов экстремальных мест обитания нами проведено выделение, идентификация и оценка солеустойчивости ассоциативных бактерий из ризосферы солероса (Salicornia L.), доминирующего в сильнозасоленной почве Приаральского региона Узбекистана.
ОБЪЕКТЫ И МЕТОДЫ
Объекты исследований
Образцы почвы отбирали из ризосферы растения солероса (Salicornia L.) солончаковой почвы (Solonchaks) Приаралья (Узбекистан). Район исследования представляет собой наклонную прибрежную полосу осушенного дна Аральского моря, ограниченную со стороны суши морской террасой [6]. Климат исследуемой территории, расположенной на границе умеренной (субборальной) и субтропической пустынной зоны Узбекистана, характеризуется резкой континентальностью и очень малым количеством осадков (87–108 мм/год), высокими температурами летом (до 42°С) и низкими зимой (до –31°С) [9]. Растительный покров представлен семействами Chenopodiaceae, Asteraceae, Brassicaceae, Polygonaceae, Poaceae, Fabaceae и Boraginaceae [37]. Доминирующим видом растительного сообщества исследуемой солончаковой почвы является солерос.
Методы исследований
Образцы почвы с корней отобрали путем ручного встряхивания. Затем 10 г свежей почвы помещали в стерильную пластиковую пробирку, суспендировали со 100 мл 0.9%-ного физиологического раствора хлорида натрия в течение 30 мин, после чего центрифугировали при 750 оборотах в течение 10 мин [17].
Общую засоленность почв оценивали по величине электропроводимости водной вытяжки (почва : вода 1 : 5) методом кондуктометрии (ГОСТ 26423-85). Концентрацию хлорид-ионов и карбонат-ионов определяли методом прямой ионометрии, рН – потенциометрическим методом в той же водной вытяжке (ГОСТ 26425-85, ГОСТ 26424-85).
Выделение чистых культур
Из почвенной суспензии, полученной после центрифугирования, готовили разведения, которые высевали на агаризованную питательную среду МПА (мясо-пептонный агар) с добавлением 7.5% NaCl. Выделение чистых культур проводили методом Коха из одной колонии с помощью микроселекторов Перфильева [10]. Затем культуру выращивали в пробирках на жидкой среде МПА с добавлением 7.5% NaCl в течение 4 суток при 37°С.
Чистоту культур проверяли методом рассева на агаризованной среде в чашках Петри, а также микроскопированием.
Молекулярно-биологическая идентификация выделенных штаммов
Проводили секвенирование участков гена 16S рРНК выделенных штаммов. Геномную ДНК выделяли методом CTAB [51]. Для секвенирования участков гена 16S рРНК подбирали следующие универсальные праймеры: 8F(5'-AGAGTTTGATCCTGGCTCAG-3'), 519R (5'-GWATTACCGCGGCKGCTG-3') [45]. Полимеразную цепную реакцию (ПЦР) участков гена 16S рРНК проводили с помощью набора реактивов Tersus PCR Kit. Амплификацию – в амплификаторе Veirty в течение 35 циклов. ПЦР продукты анализировали на электрофорезе в 1%-ном агарозном геле и очищали в колонках с набором реактивов GeneJET PCR Purification Kit [43]. Секвенирование проводили по Сэнгеру на ДНК анализаторе (ДНК Технологии).
Биоинформатическую обработку (выравнивание, получение контигов) полученных сиквенсов и построение филогенетического дерева вели по методу ближайших соседей (Neighbor-joining tree) с помощью программы MEGA 7.0 [41, 42].
Изучение культуральных и морфологических свойств
Культуральные свойства выделенных изолятов изучали на плотной агаризованной и жидкой питательной среде МПА с добавлением 7.5% NaCl. Подвижность клеток, размер и окрашивание по Грамму исследовали под световым микроскопом Axio Imager 2 (Zeiss).
Рост на разных источниках углерода оценивали по оптической плотности при 600 нм клеточной суспензии [2] на спектрофотометре 2100 Spectrophotometer на модифицированной питательной среде ATCC 751 [19] следующего состава (г/л): дрожжевой экстракт – 0.15, NH4NO3 – 0.25, сахароза – 1.0, NaCl – 75, раствор модифицированных базальных солей Хантера – 20 мл; витамины – 10 мл, дистиллированная вода – 1 л. Состав раствора модифицированных базальных солей Хантера (г/л): нитрилотриацетат кислый – 10; MgSO4 ⋅ 7H2O – 29.7, CaCl2 ⋅ 2H2O – 3.34, аммоний молибдат – 0.0925, FeSO4 ⋅ 7H2O – 0.99, металлы “44” – 50 мл, дистиллированная вода – 1 л. Состав раствора металлов “44” (г/л): ЭДТА – 0.25, ZnSO4 ⋅ 7H2O – 1.1, FeSO4 ⋅ 7H2O – 0.5, MnSO4 ⋅ · 7H2O – 0.154, CuSO4 ⋅ 5H2O – 0.04, Co(NO3)2 ⋅ · 6H2O – 0.025, Na2B4O7 ⋅ 10H2O – 0.018, дистиллированная вода – 100 мл. Состав раствора витаминов (мг/л): биотин – 2.0, фолиевая кислота – 2.0, тиамина гидрохлорид – 5.0, кальция Д-пантотенат – 5.0, витамин B12 – 0.1, рибофлавин – 5.0, дистиллированная вода – 1.0 л, с добавлением 1% тестируемого источника углерода.
Рост культур при разных концентрациях соли исследовали в жидкой модифицированной питательной среде ATCC 751 с добавлением разной концентрации NaCl (%): 8, 10, 15, 20, 25, 30 на спектрофотометре 2100 Spectrophotometer [46].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Наши исследования показали, что анализируемая почва из ризосферы растения Salicornia L. является сильнозасоленной: характер засоленности – хлоридный. Общая засоленность по методу кондуктометрии составила 27.5 мСм/м, содержание хлорид-ионов – 1.76%, карбонат-ионов – 6.65%, pH – 8.70.
Изучение культуральных и морфологических свойств выделенных культур на питательной среде показало, что штаммы представлены четырьмя изолятами. В результате секвенирования участков гена 16S рРНК изолятов установлено, что выделенные культуры бактерий представлены родами Halomonas и Planococcus, которые относятся к различным филогенетическим группам: Gamma-Proteobacteria и Firmicutes соответственно. Известно, что представители родов Halomonas [2] и Planococcus [48] обитают в гиперсоленых экосистемах. Они имеют важное экологическое значение и, кроме того, нередко используются в биотехнологических процессах. Например, у представителей рода Halomonas выявлена способность продуцировать биотехнологически значимые ферменты, в частности, амилазы, [23] целлюлазы [40], эндоглюканазы [28], изоцитратдегидрогеназы [49], аланиндегидрогеназы [47], нуклеозид дифосфаткиназы [53]. Представители рода Planococcus являются галотолерантными бактериями и обитают в ризосфере галофитных растений, способствуя улучшению их роста [48]. В засоленных и загрязненных почвах нарушенных местообитаний Planococcus может активно участвовать в биодеградации химических поллютантов, таких как напроксен [52], моноароматические углеводороды (бенизин, толоул, ксилен) [24], и проявляет резистенцию к высоким концентрации мышьяка [22]. Симбиотические взаимоотношения представителей Halomonas и Planococcus с галофитными растениями в условиях засоления могут быть использованы для увеличения биологической активности деградированных почв. В некоторых исследованиях отмечается, что различные бактерии вышеуказанных родов улучшают рост и развитие растения-хозяина в процессе азотфиксации, продуцируя ИУК, сидерафоры, АЦК-деаминазы и усваивая нерастворимые формы фосфатов [18, 30, 33, 56]. Вышеуказанные свойства родов Halomonas и Planococcus еще раз подтверждают их биотехнологическую и экологическую значимость.
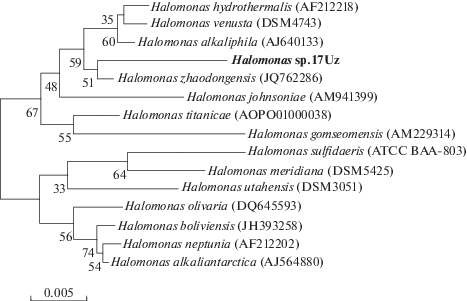
Выделенный нами штамм Halomonas sp.17Uz является грамотрицательной неспорообразующей подвижной мезофильной бактерией, на питательной среде МПА образует колонии округлой формы кремового цвета. Результаты секвенирования участков гена 16S рРНК подтвердили, что штамм относится к роду Halomonas и на филогенетическом дереве соседствует с видом Halomonas zhaodonegesis (рис. 1). Физиолого-биохимические показатели и отношение к различным концентрациям NaCl штамма Halomonas sp.17Uz и его ближайшего соседа Halomonas zhaodonegesis различаются. Halomonas zhaodonegesis выделен из морского ежа и способен расти при концентрации NaCl в среде 20% [20].
Рис. 1.
Филогенетическое положение штамма Halomonas sp.17Uz, основанное на результатах сравнительного анализа нуклеотидных последовательностей генов 16S рРНК. Цифрами показана статистическая достоверность порядка ветвления, определенная с помощью “bootstrap”-анализа 1000 альтернативных деревьев.
Наши исследования показали, что штамм Halomonas sp.17Uz гидролизирует и использует в качестве источника углерода из углеводов сахарозу; из органических кислот: янтарнокислый натрий, цитрат натрия, фумарат натрия, фталевокислый натрий, формиат натрия, пируват натрия; и из аминокислот: L-треонин, L-аспаргин и L-лизин. Не наблюдается ассимиляция следующих источников углерода из углеводов: крахмала, галактозы, арабинозы, целлюбиозы, мальтозы, глюкозы, D-фруктозы; из органических кислот: ацетата натрия, глюкуроновой кислоты, лимоннокислого натрия; и из аминокисот: L-гистидина, L-глутаминовой кислоты, L-серина, L-пролина (табл. 1).
Таблица 1.
Использование источников углерода выделенными штаммами Halomonas sp. и Planococcus sp.
| Штамм | Углеводы | Органические кислоты | Аминокислоты | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| крахмал | сахароза | галактоза | арабиноза | целлюбиоза | мальтоза | глюкоза | d-фруктоза | янтарнокислый натрий | цитрат натрия | ацетат натрия | фумарат натрия | фталевокислый натрий | глюкуроновая кислота | лимоннокислый калий | формиат натрия | пируват натрия | L-треонин | L-гистидин | L-глутаминовая кислота | L-серин | L-пролин | L-аспарагин | L-лизин | |
| Halomonas sp. | – | + | – | – | – | – | – | – | + | + | – | + | + | – | – | + | + | + | – | – | – | – | + | + |
| Planococcus sp. | + | + | – | – | + | – | – | – | + | + | + | + | + | – | – | + | + | + | – | – | – | – | + | + |
Штамм Planococcus sp.11Uz представляет собой грамположительную бактерию, с клетками шаровидной формы или в виде коротких палочек. На питательной среде МПА колонии розового цвета, округлой формы.
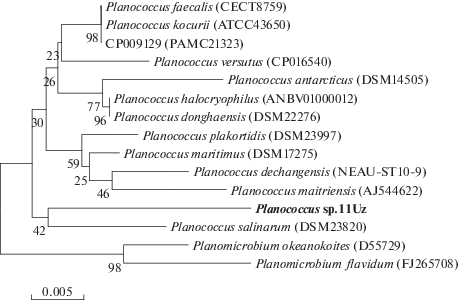
На филогенетическом дереве штамм Planococcus sp.11Uz расположен на одной ветке с Planococcus salinarum (рис. 2). Выделенный нами штамм Planococcus sp.11Uz отличается от близкого соседа Planococcus salinarum по месту обитания и физиолого-биохимическим показателям. Planococcus salinarum выделен из района разработки месторождения солей [54].
Рис. 2.
Филогенетическое положение штамма Planococcus sp.11Uz, основанное на результатах сравнительного анализа нуклеотидных последовательностей генов 16S рРНК. Цифрами показана статистическая достоверность порядка ветвления, определенная с помощью “bootstrap”-анализа 1000 альтернативных деревьев.
Штамм Planococcus sp.11Uz ассимилирует следующие сахара: крахмал, сахарозу; из органических кислот: янтарнокислый натрий, ацетат натрия, фумарат натрия, фталевокислый натрий, формиат натрия, пируват натрия; из аминокислот: L-треонин, L-аспаргин и L-лизин. Не использует следующие сахара: галактозу, арабинозу, мальтозу, глюкозу, D-фруктозу; из органических кислот: глюкуроновую кислоту, лимоннокислый натрий; и из аминокислот: L-гистидин, L-глутаминовую кислоту, L-серин, L-пролин.
Из литературы известно, что представители данного рода способны использовать следующие сахара: фруктозу, декстрин, D-салицин; органические кислоты: D-глюкуроновую кислоту; аминокислоты: D-аспартат, D-серин, L-аргинин и белки: желатин [26].
Некоторые сахара и другие источники углерода, такие как сахароза, трегалоза, арабиноза и маннит, повышают солеустойчивость бактериальной клетки в гиперсоленой системе, способствуя накоплению ряда осмопротекторов (пролин, бетаин, эктоин) [4, 13].
По отношению к концентрации соли микроорганизмы делятся на следующие физиологические группы: а) не галофилы, которые требуют менее 1% NaCl; б) галотолерантные, которые могут расти при высоких концентрациях солей, например при 25% NaCl; в) слабые галофилы, лучший рост которых наблюдается при 1–3% NaCl; г) умеренные галофилы, чей оптимальный рост на среде наблюдается при 3–15% NaCl; д) экстремальные галофилы, для оптимального роста которых требуется 15–25% NaCl [32].
По результатам исследования Кейи с соавт. [31], некоторые виды рода Halomonas, в частности H. neptunia, H. sulfidaeris, H. axialensis, H. hydrothermalis, способны расти при концентрации соли от 0.5 до 24%. Но оптимум для них находится в диапазоне 2–7%.
Изучение отношения к разной концентрации соли выделенного штамма Halomonas sp.17Uz подтвердило, что по классификации Кашнер [32] данный штамм относится к умеренным галофилам и способен расти на средах при концентрации соли до 15%, однако оптимум составляет 8% NaCl. При концентрации 10 и 15% соли накопление биомассы наблюдалось. Присутствие NaCl в питательной среде в количестве 20, 25 и 30% для данного штамма оказалось критическим (табл. 2).
Таблица 2.
Изучение способности выделенных штаммов Halomonas sp. и Planococcus sp. к росту в среде при различных концентрациях NaCl
| Штамм | Концентрация NaCl, % | |||||
|---|---|---|---|---|---|---|
| 8 | 10 | 15 | 20 | 25 | 30 | |
| Halomonas sp.17Uz | + | + | + | – | – | – |
| Planococcus sp.11Uz | + | + | + | – | – | – |
В соответствии с литературными данными, некоторые представители рода Planococcus толерантны к высоким концентрациям солей, однако многие представители этого рода умеренные галофилы [39]. Табл. 2 иллюстрирует, что штамм Planococcus sp.11Uz по типу солеустойчивости относится к умеренным галлофилам, и при 8, 10 и 15% NaCl рост наблюдается. Более 15% NaCl для данного штамма оказалось лимитирующим фактором, соответственно накопление биомассы не обнаружено.
ЗАКЛЮЧЕНИЕ
Установлено, что доминирующими культивируемыми бактериями сильнозасоленной почвы Приаральского региона (Узбекистан), выделенными на питательной среде МПА с добавлением 7.5% NaCl, являются галофильные бактерии родов Halomonas и Planococcus, относящиеся к разным филогенетическим группам грамотрицательных гамма-протеобактерий и грамположительных фирмикут домена Bacteria.
Выделены новые штаммы галофильных бактерий Halomonas sp.17Uz и Planococcus sp.11Uz. На основании анализа результатов секвенирования участков гена 16S рРНК установлено, что Halomonas sp.17Uz на филогенетическом дереве соседствует с видом Halomonas zhaodonegesis, а Planococcus sp.11Uz расположен на одной ветке с Planococcus salinarum.
Изучены морфофизиологические особенности данных штаммов, в частности, возможность использования различных источников углерода. Показано, что на увеличение концентрации солей в средах с различными источниками углерода, оба штамма реагируют практически одинаково.
Установлено, что выделенные штаммы относятся к умеренным галофилам. При концентрации в питательной среде NaCl на уровне 8, 10 и 15% штаммы Halomonas sp.17Uz и Planococcus sp.11Uz росли хорошо, а при концентрации 20, 25 и 30% NaCl роста и накопления биомассы культур не наблюдалось.
Список литературы
Андронов Е.Е., Петрова С.Н., Пинаев А.Г., Першина Е.В., Рахимгалиева С.Ж., Ахмеденов К.М., Горобец А.В., Сергалиев Н.Х. Изучение структуры микробного сообщества почв разной степени засоления с использованием TRFLP и ПЦР с детекцией в реальном времени // Почвоведение. 2012. № 2. С. 173–183.
Болтянская Ю.В., Кевбрин В.В., Лысенко А.М., Колганова Т.В., Турова Т.П., Осипов Г.А., Жилина Т.Н. Halomonas mongoliensis sp. nov. и Halomonas kenyensis sp. nov. – новые галоалкалофильные денитрификаторы из содовых озер, способные к восстановлению N2O // Микробиология. 2007. Т. 76. № 6. С. 834–843.
Гришко В.Н., Сыщикова О.В., Зенова Г.М., Кожевин П.А., Дуброва М.С., Лубсанова Д.А., Чернов И.Ю. Мицелиальные актинобактерии засоленных почв аридных территорий Украины и России // Почвоведение. 2015. № 1. С. 81–86.
Деткова Е.Н., Болтянская Ю.В. Осмоадоптация галоалкалофильных бактерий: роль осморегуляторов и возможности их практического применения // Микробиология. 2007. Т. 76. № 5. С. 581–593.
Димеева Л.А. Закономерности первичных сукцессий Аральского побережья // Аридные экосистемы. 2007. Т. 13. № 33–34. С. 89–100.
Духовный В.А., Авакян И.С., Жолдасова И.М., Мирабдуллаев И., Муминов Ш., Рощенко Е., Рузиев И.Б., Рузиев М.Т, Стулина Г.В., Сорокин А.Г., Сорокин А.Д., Заитов Ш., Ташмухаммедов Б.А., Тучин А.И., Эшчанов О. Аральское море и Приаралья: обобщение работ НИЦ МКВК по мониторингу состояния и анализу ситуации. Ташкент: Baktria Press, 2017. 120 с.
Звягинцев Д.Г., Зенова Г.М., Оборотов Г.В. Мицелиальные бактерии засоленных почв // Почвоведение. 2008. № 10. С. 1250–1257.
Зенова Г.М., Кожевин П.А., Манучарова Н.А., Лубсанова Д.А., Дуброва М.С. Экофизиологические особенности актиномицетов пустынных почв Монголии // Известия РАН. Сер. биологическая. 2014. № 3. С. 246–253.
Кузиев Р.К., Сектименко В.Е. Почвы Узбекистана. Ташкент, 2009. 308 с.
Нетрусов А.И., Егорова М.А., Захарчук Л.М. и др. Практикум по микробиологии. М.: Издательский центр “Академия”, 2005. 608 с.
Першина Е.В., Тамазян Г.С., Дольник А.С., Пинаев А.Г., Сергалиев Н.Х., Андронов Е.Е. Изучение структуры микробного сообщества засоленных почв с использованием высокопроизводительного секвенирования // Экологическая генетика. 2012. Т. 10. № 2. С. 32–39
Саттаров Д.С., Сектименко В.Е., Попов В.Г. Состояние почвенного покрова Приаралья в связи с усыханием Аральского моря // Почвоведение. 1991. № 10. С. 5–10.
Селиванова Е.А. Механизмы выживания микроорганизмов в гиперосмотических условиях // Бюллетень Оренбургского научного центра УрО РАН. 2012. № 3. С. 13.
Соколова Т.А. Специфика свойств почв в ризосфере: анализ литературы // Почвоведение. 2015. № 9. С. 1097–1111.
Халилова Э.А., Котенко С.Ц., Исламмагомедова Э.А., Гасанов Р.З., Абакарова А.А., Аливердиева Д.А. Экстремофильные микробные сообщества засоленных почв и их разнообразие в регионе прикаспийской низменности // Аридные экосистемы. 2017. Т. 23. № 2. С. 52–56.
Чернов Т.И., Тхакахова А.К., Лебедева М.П., Железова А.Д., Бгажба Н.А., Кутовая О.В. Микробиомы контрастных по засолению почв солонцового комплекса волго-уральского междуречья // Почвоведение. 2018. № 9. С. 1115–1124. https://doi.org/10.1134/S0032180X18090046
Aboudrar W., Schwartz C., Benizri C., Morel J.L., Boularbah A. Soil microbial diversity as affected by the rhizosphere of the hyperaccumulator Thlaspi caerulescens under natural conditions // Int. J. Phytoremediation. 2007. № 9. P. 41–52.
Argandona M., Fernandez-Carazo R., Llamas I., Martinez-Checa F., Caba J. M., Quesada E., Ana del Moral. The moderately halophilic bacterium Halomonas maura is a free-living diazotroph // FEMS Microbiol. Lett. 2005. V. 244. № 1. P. 69–74. https://doi.org/10.1016/j.femsle.2005.01.019
Atlas R.M. Handbook of microbiological media. Taylor and Francis Group, LLC. 2010. 2043 p.
Chen Y.G., Zhang Y.Q., Huang H.Y., Klenk H.P., Tang Sh.K., Huang K., Chen Q.H., Cui X.L., Li W.J. Halomonas zhanjiangensis sp. nov., a halophilic bacterium isolated from a sea urchin // Int. J. Systematic Evolutionary Microbiol. 2009. V. 59. P. 2888–2893. https://doi.org/10.1099/ijs.0.010173-0
Chenard C., Lauro F.M. Microbial Ecology of extreme environments. 2017. Switzerland: Springer, Cham. 245 p. https://doi.org/10.1007/978-3-319-51686-8
Chowdhury R., Sen A.K., Karak P., Chatterjee R., Giri A.K., Chaudhuri K. Isolation and characterization of an arsenic-resistant bacterium from a bore-well in West Bengal // India. Ann. Microbiol. 2009. № 59. P. 253–258.
Coronado M.J., Vargas C., Mellado E., Tegos G., Drai-nas C., Nieto J., Ventosa A. The α-amylase gene amyH of the moderate halophile Halomonas meridiana: cloning and molecular characterization // Microbiology. 2000. V. 146. № 4. P. 861–868.
Desouky S.E., El-Gamal M.S., Barghoth M.G. Aerobic biodegradation of BTX by halophilic Planococcus sp. strain TS1 isolated from Egypt // J. Adv. Biol. Biotechnol. 2015. № 4. P. 1–13.
Flowers T.J., Colmer T.D. Salinity tolerance in halophytes // New Phytol 2008. № 179. P. 945–963.
Gan L., Zhang H., Tian J., Li X., Long X., Zhang Y., Dai Y., Tian Y. Planococcus salinus sp. nov., a moderately halophilic bacterium isolated from a saline-alkali soil // Int. J. Syst. Evol. Microbiol. 2018. № 68. P. 589–595.
Goodfriend W.L., Olsen M.W., Frye R.J. Soil microfloral and microfaunal response to Salicornia bigelovii planting density and soil residue amendment // Plant and Soil. 2000. № 223. P. 23–32.
Huang X., Shao Z., Hong Y., Lin L., Li C., Huang F., Wang H., Liu Z. Cel8H, a novel endoglucanase from the halophilic bacterium Halomonas sp. S66-4: molecular cloning, heterogonous expression, and biochemical characterization // J. Microbiol. 2010. V. 48. № 3. P. 318–324.
IUSS Working Group WRB. World Reference Base for Soil Resources 2014. International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No. 106. FAO, Rome. 181 p.
Jha B., Gontia I., Hartmann A. The roots of the halophyte Salicornia brachiata are a source of new halotolerant diazotrophic bacteria with plant growth-promoting potential // J. Plant Soil. 2012. V. 356. P. 265–277. https://doi.org/10.1007/s11104-011-0877-9
Kaye J.Z., Ma’rquez M.C., Ventosa A., Baross J.A. Halomonas neptunia sp. nov., Halomonas sulfidaeris sp. nov., Halomonas axialensis sp. nov. and Halomonas hydrothermalis sp. nov.: halophilic bacteria isolated from deep-sea hydrothermal-vent environments // Int. J. Systematic and Evol. Microbiol. 2004. V. 54. P. 499–511. https://doi.org/10.1099/ijs.0.02799-0
Kushner D.J., Kamekura M. Physiology of halophilic eubacteria // Halophilic Bacteria. 1988. V. 1. P. 87–103.
Mapelli F., Marasco R., Rolli E., Barbato M., Cherif H., Guesmi A., Ouzari I., Daffonchio D., Borin S. Potential for plant growth promotion of rhizobacteria associated with Salicornia growing in Tunisian hypersaline soils // Biomed Res. Int. 2013. V. 2013. https://doi.org/10.1155/2013/248078
Oren A. Ecology of Halophiles // Extremophiles Handbook. 2011. P. 344–361.
Rodriguez-Valera F. Characteristics and microbial ecology of hypersaline environments // Halophilic Bacteria. 1988. V. 1. P. 3–30.
Rozema J., Flowers T. Crops for a salinized world // Science. 2008. V. 322. P. 478–1480.
Sherimbetov S.G., Pratov U.P., Mukhamedov R.S. Classification of plants in the South drying bottom of the Aral Sea // Вестник СПбГУ. 2015. Сер. 3. № 4.
Shi Y.W., Lou K., Li Ch., Wang L., Zhao Z.Y., Zhao Sh., Tian Ch.Y. Illumina-based analysis of bacterial diversity related to halophytes Salicornia europaea and Sueada ralocaspica // J. Microbiol. 2015. V. 53. № 10. P. 678–685.
Shivaji S. Planococcus. Bergey’s manual of systematics of archaea and bacteria. Bergey’s Manual Trust. 2015.
Shivanand P., Mugeraya G., Kumar A. Utilization of renewable agricultural residues for the production of extracellular halostable cellulase from newly isolated Halomonas sp. strain PS47 // Ann. Microbiol. 2013. V. 63. P. 1257–1263.
Tamura K., Nei M. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees // Molecular Biol. Evolution. 1993. V. 10. P. 512–526.
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0 // Molecular Biol. Evolution. 2013. P. 2725–2729.
Thermo Scientific GeneJET PCR Purification Kit #K0701, #K0702. 2013.
Toderich K.N., Shuyskaya E.V., Faisal K.T., Matsuo N., Ismail Sh., Aralova D.B., Radjabov T.F. Integrating agroforestry and pastures for soil salinity management in dryland ecosystems in Aral Sea basin // Developments in soil salinity assessment and reclamation: innovative thinking and use of Marginal soil and water resources in irrigated agriculture. Springer Science, 2013. P. 579–602.
Turner S., Pryer K.M., Miao V.P., Palmer J.D. Investigating deep phylogenetic relationships among cyanobacteria and plastids by small subunit rRNA sequence analysis // J. Eukaryotic Microbiol. 1999. V. 46. P. 327–338.
Ventosa A., Quesada E., Rodriguez-Valera F., Ruiz-Berraquero F., Ramos-Cormenzana A. Numerical Taxonomy of moderately halophilic gram-negative rods // J. General Microbiol. 1982. V. 128. P. 1959–1968.
Vreeland R.H., Litchfield C.D., Martin E.L., Elliot E. Halomonas elongata, a new genus and species of extremely salt-tolerant bacteria // Int. J. Syst. Bacteri. 1980. V. 30. № 2. P. 485–495.
Wah-Seng S.T., Yi T.J., Lim E.R., Convey Y.L., Peter Pearce D.A., Wai-Fong Y., Kok-Gan Ch. De novo assembly of complete genome sequence of Planococcus kocurii ATCC 43650(T), a potential plant growth promoting bacterium // Marine Genomics. 2016. V. 28. P. 33–35.
Weisser J., Trüper H.G. Osmoregulation in a new haloalkaliphilic Bacillus from the Wadi Natrun (Egypt) // Syst. Appl. Microbiol. 1985. V. 6. P. 7–11.
Willey J.M., Sherwood L.M., Woolverton Ch.J. Prescott’s principles of microbiology. New York: The McGraw-Hill Companies, Inc. 2009. 969 p.
William S., Feil H., Copeland A. Bacterial genomic DNA isolation using CTAB. DOE Join Genome Institute, 2012. 12 p.
Wojcieszynska D., Domaradzka D., Hupert-Kocurek K., Guzik U. Enzymes involved in naproxen degradation by Planococcus sp. S5 // Polish J. Microbiol. 2016. V. 65. № 2. P. 177–182.
Yonezawa Y., Tokunaga H., Ishibashi M., Tokunaga M. Characterization of nucleoside diphosphate kinase from moderately halophilic eubacteria // Biosci. Biotechnol. Biochem. 2001. V. 65. № 10. P. 2343–2346.
Yoon J.H., Kang S.J., Lee S.Y., Oh K.H., Oh T.K. Planococcus salinarum sp. nov., isolated from a marine solar saltern, and emended description of the genus Planococcus // Int. J. Systematic Evolutionary Microbiol. 2010. V. 60. P. 754–758. https://doi.org/10.1099/ijs.0.013136-0
Zhao Sh., Zhou N., Zhao Z.Y., Zhang K., Wu G.H., Tian Ch.Y. Isolation of endophytic plant growth-promoting bacteria associated with the halophyte Salicornia europaea and evaluation of their promoting activity under salt stress // Curr. Microbiol. 2016. V. 73. P. 574–581. https://doi.org/10.1007/s00284-016-1096-7
Zhou N., Zhao S., Tian C.Y. Effect of halotolerant rhizobacteria isolated from halophytes on the growth of sugar beet (Beta vulgaris L.) under salt stress // FEMS Microbiol. Lett. 2017. V. 364. № 11. P. 1–7. https://doi.org/10.1093/femsle/fnx091
Дополнительные материалы отсутствуют.


