Почвоведение, 2020, № 1, стр. 102-109
Возможность снижения аллелотоксичности почв для зерновых культур
Г. Н. Федотов a, *, И. В. Горепекин a, Л. В. Лысак a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: gennadiy.fedotov@gmail.com
Поступила в редакцию 08.02.2019
После доработки 04.06.2019
Принята к публикации 20.06.2019
Аннотация
Приведены результаты опытов по возможному снижению уровня аллелотоксичности почв для зерновых культур. Установлено, что при автоклавировании почв удается заметно снизить их аллелотоксичность, а пропускание слабого электрического тока через почву, промораживание и известкование почв практически не снижают их аллелотоксичности. Добавление в почвы навозов, молочной сыворотки и их смесей приводит к заметному уменьшению аллелотоксичности почв, которое проявляется наиболее сильно через 2 недели после внесения препаратов. Полученные результаты позволяют предположить существование двух механизмов снижения аллелотоксичности почв, основанных на увеличении численности и активности в почвах микроорганизмов, способных использовать аллелотоксины для своего питания в качестве источников углерода, и основанных на закреплении аллелотоксинов в гумусовой матрице почвенных гелей и переводе их в недоступное для растений состояние.
ВВЕДЕНИЕ
Существование аллелопатического почвоутомления (аллелотоксичности почв) и его негативное влияние на развитие растений известно [1, 6, 26, 29]. Оно обусловлено накоплением в почве аллелотоксинов [3, 5, 17, 23, 26, 29] из-за ее высокой сорбционной способности. Существуют различные пути поступления в почву этих токсинов. Они выделяются растениями для борьбы с конкурентами, а также в качестве сигнальных веществ для предупреждения об экологической опасности или для торможения своих биохимических процессов, чтобы возникшие негативные экологические факторы нанесли растениям минимальный урон [1, 8, 12, 16]. В результате действие любых негативных факторов в процессе вегетации приводит к усилению выработки растениями аллелотоксинов, выделению их и повышению аллелотоксичности почв [18, 19, 29]. Токсичные вещества вырабатываются микроорганизмами при борьбе с конкурентами за ресурсы, в качестве побочных продуктов метаболизма или фитопатогенами для ослабления иммунитета растений [1, 2, 5–7, 10, 15, 16, 23]. Кроме того, аллелотоксины выделяются из растительных остатков при их разложении в почвах [1, 15, 17].
Однако очень трудно доказать, что накопление в почвах аллелотоксинов является непосредственной причиной почвоутомления [1]. Связано это с тем, что негативное влияние аллелотоксинов на растения происходит очень постепенно, и на начальном этапе его трудно заметить. Ослабленные растения теряют стойкость к холоду или засухе, в них резко снижается иммунитет к фитопатогенам и вредителям, а также уменьшается конкурентоспособность по отношению к сорнякам. В этих условиях болезни, вредители, сорняки начинают активно развиваться. Они хорошо заметны, поэтому именно их принимают за истинную причину почвоутомления, тогда как они являются лишь реакцией экосистемы на наличие почвенной аллелотоксичности. Подавление болезней и вредителей, борьба с сорняками часто не дают результата, так как причина – наличие в почве аллелотоксинов – сохраняется [1].
Предпринимали попытки использовать различные методы для снижения аллелотоксичности почв [1, 5, 22]. В частности, промывали почвы водой [5] и органическими растворителями [23], промораживали [6], прогревали [1, 5], автоклавировали [5, 23] и известковали [5], но получали противоречивые результаты – одни и те же действия не всегда приводили к снижению аллелотоксичности почв. В ряде работ отмечали [1, 16, 18, 19, 22, 24, 27] влияние почвенных микроорганизмов на снижение аллелотоксичности почв за счет использования ими аллелотоксинов в качестве источников углерода [24].
Наличие у почв аллелотоксичности является одним из главных факторов, во многих случаях ограничивающих выращивание сельскохозяйственных растений и сбор высоких урожаев. В этой связи проблема уменьшения аллелотоксичности почв является чрезвычайно важной для сельского хозяйства. Однако уделяют ей мало внимания. А-ллелотоксичность почв не контролируют, полагая, что применение севооборотов гарантирует ее снижение меньше критического уровня.
Цель работы – проверка существования способов уменьшения аллелотоксичности почв и изучение природы ее снижения для почв Восточно-Европейской равнины. Для этого решили изучить решения, которые по литературным данным в некоторых случаях давали положительные результаты: автоклавирование, промораживание и известкование почв. Кроме того, была предпринята попытка использовать приемы, основанные на активации деятельности почвенных микроорганизмов электрическим током [4, 20] или внесением в почвы препаратов, содержащих большие количества микроорганизмов.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили на семенах яровой пшеницы (Triticum) сортов Лиза и Злата (оригинальные), озимой пшеницы (Triticum) сорт Безенчукская 380 (первая репродукция), озимого тритикале (Triticosecale) сорт Немчиновский 56 (оригинальные), ярового ячменя (Hordeum) сортов Нур и Раушан (оригинальные) и озимой ржи (Secale cereale) сорт Татьяна (оригинальные). Всхожесть семян озимой пшеницы Безенчукская 380 была 90%, остальных семян – выше 95%.
В работе использовали образцы [14] дерново-подзолистой почвы (${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ 6.3) из окрестностей поймы р. Яхрома влажностью 18.1% (после зерновых), серой лесной почвы (${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ 6.5) из Тульской области (Щекинский район) влажностью 21.6% (после зерновых), каштановой почвы (${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ 8.2) из Волгоградской области (Иловлинский район) влажностью 19.3% (залежь), а также чернозема типичного (${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ 7.5) из Липецкой области (Данковский район) влажностью 33.1% (после картофеля) и сухой отмытый речной песок с размером частиц 0.5–0.8 мм.
Изучали влияние различных воздействий на изменение длины проростков [9] 7.5 г семян (~200 шт.) при их прорастании в различных почвах. Длину проростков определяли, используя экспресс-метод, основанный на существовании линейной зависимости между насыпным объемом проросших семян в воде и длиной их проростков [14]. Проросшие в образцах почв семена отмывали от субстрата и помещали порциями в мерный цилиндр на 100 мл с водой, размещенный на вибростоле, колеблющемся с частотой 50 Гц. После помещения каждой порции проросших семян в цилиндр, которые создавали ажурную пористую структуру, на них на 15–20 с помещали небольшой грузик массой 8 г в виде резиновой пробки, что приводило к уплотнению структуры. После помещения всех проросших семян в цилиндр на них ставили грузик и проводили дополнительное уплотнение структуры легкими постукиваниями (30–40) цилиндра с семенами о стол. Все перечисленные операции позволяли создать однородную структуру, а нижняя граница груза позволяла определять насыпной объем с точностью до 0.5 мл.
При проведении экспериментов по проращиванию семян на дно чашки диаметром 95 мм помещали 30 г почвы, затем ровным слоем размещали 7.5 г семян, а сверху – 30 г почвы. После этого в чашку равномерно добавляли из мерной пипетки воду в количестве, обеспечивающем оптимальные водно-воздушные условия прорастания семян [14].
Для субстратов оптимальное количество воды составило: песок – 15 г, дерново-подзолистая почва – 9 г, серая лесная почва – 13.5 г, чернозем – 13.5 г, каштановая почва – 15 г [14].
Использовали шестикратную повторность с последующей статистической обработкой результатов. В связи с использованием в одном опыте 1000–1200 семян удавалось минимизировать ошибку, связанную с их разнокачественностью [11]. В результате ошибка определения суммарной длины проростков не превышала 7% при 95%-ной доверительной вероятности.
Для получения количественной информации по влиянию изучаемых почв на прорастание семян и развитие их проростков конкретных культур и сортов необходимо проводить сравнение со стандартными образцами. В связи с тем, что изучали прорастание семян и развитие их проростков в течение двух суток, когда процесс развития идет за счет накопленных питательных веществ, и поступление элементов питания из почв не оказывает значимого влияния на прорастание семян и развитие их проростков в качестве образца сравнения был выбран промытый речной песок. Аллелотоксичность почв (ингибирование развития семян почвами) оценивали, сравнивая суммарную длину проростков 7.5 г семян, выросших в почвах, с суммарной длиной проростков семян, выросших в песке, и выражали в процентах.
Влажность субстратов оказывает большое влияние на прорастание в них семян и развитие проростков, поэтому возник естественный вопрос: при какой влажности почв и песка проводить сравнение? Очевидно, что при недостаточной влажности прорастание семян и развитие проростков будут замедляться из-за недостатка воды или при избыточной влажности из-за недостатка кислорода. Прорастание семян и развитие проростков в оптимальных водно-воздушных условиях позволяет исключить влияние этих факторов (недостатка воды и кислорода) как негативных, что дает возможность количественно определять ингибирование прорастания семян и развития проростков токсинами, содержащимися в почвах.
Навеску воды для песка и почв подбирали [14] по максимальному количеству углекислоты, выделяемому системой за двое суток (на вторые сутки начинается развитие проростков). Концентрацию углекислоты измеряли при помощи прибора Testo 535, который позволяет определять концентрацию СО2 в газовой смеси при содержании 0–9999 ppm.
Для обработки почв промораживанием образцы почв помещали в морозильную камеру при – 22°С на 8 сут. Оттаивание почв проводили при комнатной температуре.
Автоклавирование образцов почв проводили в стеклянных колбах с ватными пробками в течение 20 мин при температуре 132°С и давлении 2 атм.
Карбонат кальция в виде порошка вносили в почвенный образец из расчета 1.5 г/кг почвы, тщательно перемешивали и оставляли на месяц.
Для пропускания электрического тока 500 г почвы помещали в пластиковые трубки с внутренним диаметром 46 мм и уплотняли постукиванием. Затем вставляли графитовые электроды и пропускали в течение 7 суток, используя электрическую батарею, постоянный электрический ток величиной до 350 мкА. Величину тока измеряли при помощи встроенного в электрическую цепь мультиметра Mastech MY-60. Регулировку тока проводили при помощи потенциометра.
Конский навоз вносили в почву в виде водной суспензии при соотношении компонентов 800 : : 100 : 24 – почва : вода : навоз соответственно.
Свежий навоз крупного рогатого скота (КРС) вносили в почву в виде водной суспензии при соотношении компонентов 800 : 80 : 24 – почва : вода : навоз соответственно.
Молочную сыворотку (80 г) вносили в 800 г почв.
Молочную сыворотку с навозом КРС вносили в почву в виде тщательно перемешанной суспензии при соотношении компонентов 800 : 80 : 24 – почва : сыворотка : навоз КРС соответственно.
Для изучения влияния количества вносимых добавок на детоксикацию почв вносили уменьшенные количества суспензии навоза КРС с молочной сывороткой.
После внесения добавок тщательно перемешивали почвенные образцы и оставляли на необходимое время. Перед измерением почву с внесенными добавками подсушивали на воздухе до исходной влажности.
Для снижения количества живых микроорганизмов суспензию молочной сыворотки с навозом обрабатывали 5 мин ультразвуком на УЗ-диспергаторе МЭФ 91.1 (ООО “МЭЛФИЗ – ультразвук”). Амплитуда колебаний – 55 мкм. Интенсивность ультразвукового воздействия – 250 Вт/см2. Рабочая частота – 22 кГц.
Проверку влияния УЗ-обработки на микроорганизмы проводили путем подсчета общей численности бактерий в образцах с помощью метода прямой люминесцентной микроскопии – окраска препаратов акридином оранжевым. Численность и состав культивируемых бактерий (сапротрофный бактериальный комплекс) определяли методом посева проб на глюкозо-пептонно-дрожжевую среду.
Вытяжки из почв получали, добавляя 200 г воды к 400 г почвы естественной влажности и периодически перемешивая. Через 4–5 ч отделяли вытяжку, центрифугируя полученную пасту 10 мин при 4000 об./мин на центрифуге Eppendorf 5804. При приготовлении вытяжек из высушенных почв к ним добавляли дополнительное количество воды, которое содержалось в почвах естественной влажности по сравнению с высушенными почвами. Полученные вытяжки добавляли при посеве семян в песок вместо воды в количестве (15 г/чашку), обеспечивающем оптимальные водно-воздушные условия для прорастания семян и развития их проростков.
Все эксперименты проводили в шестикратной повторности с последующей статистической обработкой данных. Полученные результаты выражали в процентах ингибирования (стимуляции) прорастания семян и развития их проростков почвами по сравнению с песком или при необходимости при сравнении с обработанными образцами почв по сравнению с необработанными (контрольными) образцами почв.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучено влияние промораживания, автоклавирования и известкования почв на снижение их аллелотоксичности (табл. 1). Из представленных данных следует, что автоклавирование почвенных образцов приводит к заметному снижению аллелотоксичности почв. Так, ингибирование прорастания семян и развитие их проростков озимого тритикале сорт Немчиновский 56 снижается в серой лесной почве на 139%, а яровой пшеницы сорт Лиза в черноземе – на 225%. При этом известкование и промораживание почв не оказывают заметного влияния на величину аллелотоксичности.
Таблица 1.
Влияние автоклавирования, промораживания и известкования почв на ингибирование прорастания семян и развитие их проростков различных культур
| Культура, сорт | Почва | Вид воздействия на почву | Ингибирование аллелотоксинами почв, %* | Увеличение суммарной длины проростков после обработки, % |
|---|---|---|---|---|
| Яровая пшеница сорт Лиза | Дерново-подзолистая | Автоклавирование | $\frac{{--38 \pm 5}}{{--25 \pm 5}}$ | 21 |
| Чернозем | Автоклавирование | $\frac{{--76 \pm 6}}{{--22 \pm 4}}$ | 225 | |
| Каштановая | Автоклавирование | $\frac{{--25 \pm 5}}{{--25 \pm 4}}$ | Значимо неразличимо | |
| Озимый тритикале сорт Немчиновский 56 | Серая лесная | Автоклавирование | $\frac{{--77 \pm 6}}{{--45 \pm 5}}$ | 139 |
| Яровой ячмень сорт Раушан | Чернозем | Промораживание 8 сут при –22оС | $\frac{{--38 \pm 5}}{{--32 \pm 4}}$ | Значимо неразличимо |
| Яровой ячмень сорт Нур | Серая лесная | Промораживание 8 сут при –22оС | $\frac{{--52 \pm 6}}{{--46 \pm 5}}$ | Значимо неразличимо |
| Серая лесная | Известкование | $\frac{{--52 \pm 6}}{{--52 \pm 6}}$ | Значимо неразличимо |
Больший интерес представляло изучение снижения концентрации аллелотоксинов за счет активации почвенных или внесенных в почву микроорганизмов, так как этот путь наиболее реален для внедрения. Активацию почвенных микроорганизмов, существующих в почвах, можно проводить, пропуская через почву электрический ток небольшой величины [4, 20]. Из представленных данных видно (рис. 1), что обработка дерново-подзолистой почвы постоянным электрическим током приводит к снижению ее аллелотоксичности. Обращает на себя внимание наличие двух пиков стимуляции (снятия угнетения). Первый из них находится в интервале 0–4 мкА/см2, а второй в области 4–20 мкА/см2, но величины снижения аллелотоксичности почв под действием электрического тока очень малы и находятся на уровне статистической погрешности.
Рис. 1.
Влияние плотности электрического тока, пропускаемого через дерново-подзолистую почву в течение 7 сут, на увеличение суммарной длины проростков при прорастании семян яровой пшеницы сорт Лиза в этих почвенных образцах по сравнению с прорастанием в исходной почве.

Значительно более перспективным выглядит снижение аллелотоксичности почв за счет внесения в них микроорганизмов, в частности, с навозом [1]. Поэтому изучали кинетику изменения аллелотоксичности почв при внесении в них навоза, молочной сыворотки и их смесей (рис. 2–4). Из представленных данных хорошо видно, что максимальное снижение ингибирующей способности почв происходит через 2 недели после внесения в них препаратов, содержащих микроорганизмы. Максимальный эффект на всех изученных почвах наблюдался для смеси навоза КРС с молочной сывороткой. Отметим, что на серой лесной почве (рис. 2Б) прослеживается проявление синергизма – эффект от совместного внесения навоза КРС с молочной сывороткой примерно в 1.5 раза выше суммы эффектов от внесения в почву навоза КРС и сыворотки.
Рис. 2.
Кинетика изменения суммарной длины проростков при прорастании семян озимой пшеницы сорт Безенчукская 380 в дерново-подзолистой почве (А) и ярового ячменя сорт Нур в серой лесной почве (Б) после внесения в нее суспензии навоза КРС в молочной сыворотке (1), навоза КРС (2), конского навоза (3) и молочной сыворотки (4) по сравнению с прорастанием в исходной почве.

Рис. 3.
Кинетика изменения суммарной длины проростков при прорастании семян озимой ржи сорт Татьяна в черноземе после внесения в нее суспензии навоза КРС в молочной сыворотке по сравнению с прорастанием в исходной почве.

Рис. 4.
Влияние дозы внесения суспензии навоза КРС в молочной сыворотке в дерново-подзолистую почву через 2 недели после внесения на увеличения суммарной длины проростков при прорастании в ней семян озимой пшеницы сорт Безенчукская 380 по сравнению с прорастанием в исходной почве.
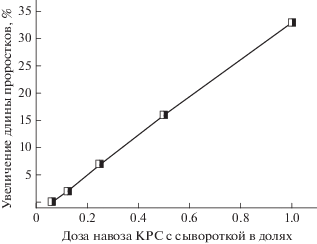
Обращает на себя внимание то, что на всех изученных почвах после достижения максимального снижения аллелотоксичности, наблюдаемой через 2 недели, начинается рост ингибирующей способности почв. Для дерново-подзолистой почвы он происходит заметно быстрее, чем для чернозема и серой лесной почвы, причем для двух последних почв он достаточно мал и близок к статистической погрешности.
Для проверки влияния именно живых микроорганизмов на снижение почвенной аллелотоксичности внесли в почву суспензию навоза КРС в молочной сыворотке после обработки суспензии в течение 5 мин ультразвуком, снижающей численность живых микроорганизмов. В результате эффект детоксикации почвенного образца уменьшился почти в 3 раза.
Изучали влияние количества внесенного препарата (суспензии навоза КРС в молочной сыворотке) на снижение аллелотоксичности почв (рис. 4). Из представленных данных видно, что величина эффекта детоксикации прямо пропорциональна количеству внесенного препарата.
Данные, полученные при изучении влияния автоклавирования почв на снижение их аллелотоксичности, нельзя объяснить разложением при повышенной температуре молекул аллелотоксинов, так как эти молекулы в воде при автоклавировании, как было показано [23], не разрушаются.
Можно предложить два объяснения данного явления. Первое из них состоит в массовой гибели почвенных микроорганизмов при автоклавировании почв. После этого начинается бурный рост микроорганизмов, которые используют в качестве источников углерода, содержащиеся в почве органические вещества, включая аллелотоксины, и снижают их концентрацию в почвах. Однако попытка реализации данного механизма путем обработки почвы раствором пероксида водорода не привела к снижению аллелотоксичности почвы, и это вызывает большие сомнения в его правильности.
Еще одним механизмом снижения действующей концентрации аллелотоксинов в почвах при автоклавировании может являться рост прочности их связи с почвой за счет структурного перехода в гумусовой матрице почвенных гелей [13]. Такой подход не противоречит развиваемым в настоящее время представлениям о супрамолекулярной природе гумуса [25, 28] или модели почвенного континиума [21].
Предпринята проверка возможности объяснения повышения прочности связей аллелотоксинов с гумусовой матрицей почвенных гелей при структурном переходе, которая состояла в изучении влияния температуры высушивания почв на перемещение из них в водную вытяжку аллелотоксинов. При повышении температуры высушивания структурный переход с обращением гидрофобных участков гумусовой матрицы к воздуху (наружу) должен реализовываться в большей степени. Связано это с ростом энергии активации структурных перестроек при снижении влажности почв и с тем, что аллелотоксины, имеющие в молекулах большие гидрофобные участки, должны закрепляться именно на гидрофобных участках гумусовой матрицы. В результате водная вытяжка из почв, высушенных при более высоких температурах, должна обладать большей ингибирующей способностью, которую определяли по используемой нами методике, проращивая семена на песке, добавляя к нему вытяжки из почвы.
Полученные результаты свидетельствуют (табл. 2), что повышение температуры высушивания почв увеличивает ингибирующую способность водных вытяжек. Особенно хорошо это видно на дерново-подзолистой почве.
Таблица 2.
Влияние ингибирования прорастания семян яровой пшеницы сорт Злата вытяжками из сухих почв по сравнению с вытяжками из почв естественной влажности, %
| Почва | Температура высушивания почвы | |
|---|---|---|
| 70°С | 90°С | |
| Дерново-подзолистая | 22 ± 4 | 31 ± 5 |
| Серая лесная | – | 12 ± 4 |
| Чернозем | – | 11 ± 3 |
Наличие двух максимумов детоксикации почв при пропускании через них слабого электрического тока, первый из которых соответствует стимуляции развития всех изученных в работе Кравцова [4] микроорганизмов, а в области второго развитие части микроорганизмов начинает угнетаться, позволяет сделать логичный вывод, что не все микроорганизмы способны использовать аллелотоксины в качестве источников углерода. Угнетение электрическим током тех видов микроорганизмов, которые не снижают концентрацию аллелотоксинов в почве, может не оказывать заметного влияния на прорастание семян и развитие их проростков. Однако наблюдаемая в экспериментах величина снятия токсикоза слишком мала, поэтому рекомендовать использование обработки почв электрическим током для снижения их аллелотоксичности на данном этапе исследования – нецелесообразно.
Сильное влияние УЗ-обработки суспензии навоза в молочной сыворотке на снижение аллелотоксичности почв при обработке их этой суспензией (уменьшение детоксицирующего эффекта) коррелировало с сокращением численности микроорганизмов в обработанной УЗ-суспензии. Общая численность бактерий в контроле была в 2 раза выше, чем при УЗ-обработке суспензии. Численность культивируемых бактерий (сапророфные бактерии на глюкозо-пептонно-дрожжевой среде) тоже была выше в контроле в 3 раза. Это подтверждает ведущую роль живых микроорганизмов в снижении аллелотоксичности почв. По-видимому, внесение в почвы вместе с навозами или молочной сывороткой питательных и биологически активных веществ играет в этом случае второстепенную роль. Также подтверждает роль живых микроорганизмов снижение эффекта детоксикации почв, пропорциональное уменьшению количества вносимых в почву живых микроорганизмов – суспензии навоза КРС с сывороткой.
Совокупность полученных данных по кинетике детоксикации почв после внесения в них суспензий навоза в воде и молочной сыворотке позволяет предположить, что внесенные в почвы микроорганизмы, содержащиеся в навозах и молочной сыворотке, либо погибают за две недели, либо теряют способность потреблять аллелотоксины. Рост аллелотоксичности почв, наблюдающийся через две недели, по-видимому, обусловлен поступлением аллелотоксинов в ту энергетическую область их связывания в почвах, из которой они могут переходить в развивающиеся семена.
Из-за более медленного восстановления аллелотоксичности в почвах, богатых гумусом (серой лесной почве и черноземе), по сравнению с дерново-подзолистой почвой можно говорить о более быстром перераспределении аллелотоксинов по энергии связи в почвенной матрице органо-минерального комплекса дерново-подзолистой почвы. Меньшая плотность гумусовой матрицы дерново-подзолистой почвы и, как следствие, меньшая энергия активации структурного перехода делает перераспределение аллелотокснов в этой почве более вероятным, что, по-видимому, и приводит к достаточно быстрому восстановлению аллелотоксичности дерново-подзолистой почвы.
Полученные результаты позволяют предположить существование двух механизмов снижения аллелотоксичности почв, на которые следует обратить внимание при дальнейших исследованиях. Первый из них основан на увеличении численности и активности в почвах микроорганизмов, способных использовать аллелотоксины для своего питания в качестве источников углерода. Однако этот механизм, по-видимому, будет реализовываться только при недостатке углеродсодержащих питательных веществ – большой величине отношения микроорганизмы/питательные вещества. Для его реализации необходимо либо вносить микроорганизмы в почвы, либо стимулировать развитие почвенных микроорганизмов, не внося в почвы питания для них в виде органических веществ.
Второй механизм основан на закреплении аллелотоксинов в гумусовой матрице почвенных гелей и переводе их в недоступное для растений состояние. Это направление может представлять особый интерес, так как, на наш взгляд, существует возможность разработки методов, провоцирующих структурный переход в гумусовой матрице почвенных гелей и снижающих активность аллелотоксинов в почвах.
Список литературы
Гродзинский А.М., Богдан Г.П., Головко Э.А., Дзюбенко Н.Н., Мороз П.А., Прутенская Н.И. Аллелопатическое почвоутомление. Киев: Наук. думка, 1979. 248 с.
Зинченко М.К., Селицкая О.В. Биологическая токсичность серой лесной почвы в зависимости от систем удобрений // Агрохимический вестник. 2011. № 5. С. 38–40.
Коношина С.Н. Влияние различных способов использования почвы на ее аллелопатическую активность. Дис. … канд. с.-х. Орел, 2000. 145 с.
Кравцов П.В. Влияние слабого электрического тока на развитие и активность почвенных микроорганизмов. Автореферат дис. … биол. наук. Ульяновск, 1965. 21 с.
Красильников Н.А. Микроорганизмы почвы и высшие растения. М.: Изд-во АН СССР, 1958. 464 с.
Лобков В.Т. Использование почвенно-биологического фактора в земледелии: монография. Орел: Изд-во ФГБОУ ВО Орловский ГАУ, 2017. 166 с.
Мирчинк Т.Г. Почвенная микология. М.: Изд-во Моск. ун-та, 1988. 220 с.
Млечко Е.А., Мотренко А.В. Аллелопатическое действие водного экстракта шалфея эфиопского (Salvia Aethiopis L.) на прорастание семян тест-растений // Вестник ВолГУ. 2015. Сер. 9. Вып. 13. С. 10–14.
Обручева Н.В., Антипова О.В. Физиология инициации прорастания семян // Физиология растений. 1997. Т. 44. № 2. С. 287–302.
Рудаков В.О., Рудаков О.Л. Природа почвенных фитоксикозов и проблема защиты растений // Агр-о ХХl. 2009. № 1–3. С. 11–13.
Сечняк Л.К., Киндрук Н.А., Слюсаренко О.К., Иващенко В.Г., Кузнецов Е.Д. Экология семян пшеницы. М.: Колос, 1983. 349 с.
Симагина Н.О. Аллелопатический потенциал древесных растений // Ученые записки Таврического национального университета им. В.И. Вернадского. Сер. Биология, химия. 2013. Т. 26(65). № 1. С. 186–193.
Федотов Г.Н., Шоба С.А., Поздняков А.И., Пузанова А.Е. Структурный переход в гумусовой матрице почвенных гелей и его влияние на свойства почв // Почвоведение. 2014. № 9. С. 1056–1067.
Федотов Г.Н., Шоба С.А., Федотова М.Ф., Горепекин И.В. Влияние аллелотоксичности почв на прорастание семян зерновых культур // Почвоведение. 2019. № 4. С. 489–496.
Шутко А.П. Биологическое обоснование оптимизации системы защиты озимой пшеницы от болезней в Ставропольском крае. Автореф. дис. … докт. с.-х. наук. СПб., 2013. 41 с.
Allelopathy. A Physiological Process with Ecological Implications / Eds. Reigosa M.J., Pedrol N., Gonzalez L. Springer, 2006. 637 p.
Blum U. Allelopathy: A Soil System Perspective // Allelopathy. A Physiological Process with Ecological Implications / Eds. Reigosa M.J., Pedrol N., Gonzalez L. Springer, 2006. P. 299–340.
Cheng F., Cheng Z. Research Progress on the use of Plant Allelopathy in Agriculture and the Physiological and Ecological Mechanisms of Allelopathy // Frontiers in Plant Science. 2015. V. 6. Article 1020.
Ghulam J., Shaukat M., Arshad N.C., Imran H., Muhammad A. Allelochemicals: sources, toxicity and microbial transformation in soil – a review // Annals of Microbiology. 2008. V. 58. № 3. P. 351–357.
Lear G., Harbottle M.J., van der Gast C.J. et al. The e-ffect of electrokinetics on soil microbial communities // Soil Biol. Biochem. 2004. V. 36. P. 1751–1760.
Lehmann J., Kleber M. The contentious nature of soil organic matter // Nature. 2015. V. 528. P. 60–68.
Li Y.P., Feng Y.L., Chen Y.J., Tian Y.H. Soil microbes alleviate allelopathy of invasive plants // Sci. Bull. 2015. V. 60. P. 1083–1091.
McCalla T.M., Haskins F.A. Phytotoxic Substances from Soil Microorganisms and Crop Residues // Bacteriological Reviews. 1964. V. 28. P. 181–207.
Norouzi Y., Mohammadi G.R., Nosratti I. Soil factors a-ffecting the allelopathic activities of some plant species // J. Appl. Environ. Biol. Sci. 2015. V. 5. P. 285–290.
Piccolo A. The Supramolecular Structure of Humic Substances // Soil Science. 2001. V. 166. P. 810–832.
Rice E.L. Allelopathy. New York: Academic Press, 1984. 422 p.
Šerá B. et al. New physicochemical treatment method of poppy seeds for agriculture and food industries // Plasma Science and Technology. 2013. V. 15. № 9. P. 935.
Schaumann G.E. Review Article Soil organic matter beyond molecular structure Part I: Macromolecular and supramolecular characteristics // J. Plant Nutr. Soil Sci. 2006. V. 169. P. 145–156.
Vokou D., Chalkos D., Karamanoli K. Microorganisms and Allelopathy: A One-Sided Approach Allelopathy // A Physiological Process with Ecological Implications / Eds. Reigosa M.J., Pedrol N., Gonzalez L. Springer, 2006. P. 341–371.
Дополнительные материалы отсутствуют.


