Почвоведение, 2020, № 10, стр. 1206-1219
Механизмы стабилизации продуктов разложения растительных остатков денсиметрическими фракциями суглинка
А. Н. Мальцева a, *, Д. Л. Пинский a
a Институт физико-химических и биологических проблем почвоведения РАН
142290 Московская область, Пущино, ул. Институтская, 2, Россия
* E-mail: ansmalc@mail.ru
Поступила в редакцию 11.03.2020
После доработки 31.03.2020
Принята к публикации 30.04.2020
Аннотация
В контролируемых условиях изучено распределение продуктов разложения растительных остатков кукурузы и клевера между денсиметрическими фракциями бескарбонатного покровного суглинка. С использованием поливольфрамата натрия выделено две легких (<1.4 г/см3 (ЛФ-1) и 1.4–2.2 г/см3 (ЛФ-2)) и тяжелая (>2.2 г/см3 (ТФ)) фракции. ЛФ-1 включает, в основном, не полностью разложившиеся растительные остатки; ЛФ-2 – соединения продуктов разложения с глинистыми минералами почв (каолинитом, иллитом, смектитами); ТФ – органическое вещество, дискретно сорбированное на поверхности крупных зерен кварца и полевых шпатов. Показано, что при стабилизации новообразованных ОВ разными денсиметрическими фракциями происходит их сепарация в результате избирательной специфической адсорбции. При этом ЛФ-2 обогащается соединениями, не содержащими азот, а ТФ – соединениями, содержащими азот, в том числе микробной природы. В результате отношение C/N уменьшается в ряду: ЛФ-1 > ЛФ-2 > ТФ. Рассчитаны размеры пулов ОВ свободного и связанного с минеральными частицами. Предложена схема, описывающая механизмы стабилизации продуктов разложения разными денсиметрическими фракциями органо-минерального субстрата.
ВВЕДЕНИЕ
Почвенное органическое вещество (ОВ) является сложным неоднородным по составу и свойствам компонентом почвы и играет исключительно важную роль в почвообразовании и функционировании почв. Физические методы фракционирования позволяют разделить почвенное ОВ на более или менее однородные пулы по какому-либо показателю: морфологическим признакам, плотности, доступности к разложению микроорганизмами и другим [3, 23, 46, 55]. В регулировании динамики почвенного ОВ важным является исследование процессов, влияющих на способность почв разлагать поступающие органические остатки и сохранять вновь образованное ОВ в форме гумусовых веществ. Процессы трансформации попадающих в почву растительных остатков (РО) в соответствии с законами термодинамики приводят к образованию наиболее устойчивых продуктов в результате стабилизации в почвах, в том числе благодаря образованию органо-минеральных соединений [1, 9, 12, 14]. При этом происходит перераспределение ОВ между почвенными минеральными компонентами различной плотности. Под процессами стабилизации ОВ в почве, включающими и гумификацию, понимаются процессы, ведущие к повышению устойчивости ОВ к абиотическим и биотическим воздействиям [12].
Одним из эффективных методов исследования трансформации и стабилизации ОВ почв является последовательное денсиметрическое фракционирование. Метод получил широкое распространение в почвоведении в последние годы в связи с использованием водных растворов поливольфрамата натрия (Na6O39W12 ⋅ H2O) в качестве тяжелой жидкости [4–6, 8, 32, 34, 35, 54, 56, 59]. Поливольфрамат натрия нетоксичен, относительно безопасен, не содержит углерод и позволяет получать растворы плотностью до 3.1 г/см3 [54]. Однако он растворяет определенную долю органического углерода (Сорг), которая может перераспределяться между фракциями или теряться в супернатанте [8, 26, 56].
Фракционирование почвенного ОВ по плотности в отличие от химических экстракций позволяет выделить фракции органического и органо-минерального веществ в наиболее неповрежденной форме, оценить их связь с определенными группами минералов и, таким образом, лучше понять механизмы взаимодействия органических и минеральных компонентов почвы [2–4, 6, 14, 18, 22]. Принцип метода последовательного денсиметрического фракционирования состоит в разделении свободного и связанного с минеральными частицами почвы ОВ, исходя из их удельных плотностей. При этом использование поливольфрамата натрия позволяет легко варьировать тяжелые жидкости по плотности в широких пределах [51, 52, 55, 59].
Денсиметрические фракции (ДФ) с разной плотностью можно рассматривать как пулы ОВ с различным временем оборота и различной функциональной ролью в динамике органического углерода и других элементов [6, 12, 26, 46]. Растительные остатки могут быть отделены в виде твердых органических частиц путем флотации в плотном растворе, тогда как органо-минеральные комплексы остаются в более тяжелых фракциях. Легкие фракции, включающие свободное и окклюдированное ОВ, в основном состоят из недавно поступивших в почву слабо трансформированных остатков и растительного материала, находящегося на различных стадиях разложения и гумификации, и характеризуются временем оборота от нескольких лет до нескольких десятилетий [6, 29, 58]. В тяжелых фракциях ОВ, стабилизированное за счет адсорбционного взаимодействия с поверхностью минералов, характеризуется временем оборота от десятилетий до тысячелетий [19]. Легкие и тяжелые фракции представляют собой крайние точки континуума продуктов разложения. Поэтому характеристика динамики денсиметрических фракций, их химического и минералогического состава необходима для понимания процессов, происходящих при трансформации и стабилизации почвенного ОВ в различных типах почв [48].
Цель работы – исследование закономерностей процессов стабилизации ОВ, образующихся при разложении контрастных по биохимическому составу РО, минеральными компонентами покровного суглинка методом последовательного денсиметрического фракционирования в контролируемых условиях.
ОБЪЕКТЫ И МЕТОДЫ
В инкубационных экспериментах исследовали перераспределение продуктов разложения надземной части кукурузы (Zéa máys) и клевера (Trifolium praténse) между различными денсиметрическими фракциями покровного суглинка. Биохимический анализ растительной биомассы выполнен в соответствии со схемой определения состава органической части органогенных материалов, включающую сернокислотный метод определения лигнина [1]. Содержание “сырой” золы в растительной биомассе определяли методом сухого сжигания при температуре 500–600°С. Характеристика состава РО представлена в табл. 1.
Таблица 1.
Содержание основных компонентов в надземной массе клевера и кукурузы
| Остатки | Зола, % | Группы органических веществ, % от беззольного вещества | ||||
|---|---|---|---|---|---|---|
| воскосмолы | протеины | гемицеллюлоза | целлюлоза | лигнин | ||
| Клевер | 13 | 6.0 | 14.8 | 23.8 | 20.4 | 8.2 |
| Кукуруза | 18 | 19.1 | 4.9 | 32.6 | 26.0 | 10.8 |
Предварительно высушенные на воздухе до постоянной массы листья и стебли растений кукурузы (C/N 62) и клевера (C/N 12) измельчали до размеров 3–5 мм и смешивали с суглинком в соотношении 1 : 10 по массе. Используемый в эксперименте бескарбонатный покровный суглинок являлся почвообразующей породой серой лесной почвы (Eutric Retisol (Loamic, Cutanic, Ochric)) опытно-полевой станции ИФХиБПП РАН (Московская область). Минералогический состав суглинка, %: кварц – 59, каолинит – 16, слюда – 13, полевые шпаты – 10, смектит – 2. Гранулометрический состав суглинка представлен фракциями, %: песка – 11, пыли – 63, ила – 26. Содержание фракции физической глины 43%. Гранулометрический состав определяли классическим методом пипетки с пирофосфатным диспергированием образца. В составе суглинка обнаружены следовые количества Сорг 0.07 ± 0.02%.
Органо-минеральные смеси помещали в стеклянные сосуды объемом 200 см3 и инокулировали микроорганизмами путем внесения 1 мл 1%-ной почвенной суспензии, приготовленной их верхнего горизонта серой лесной почвы. Инкубацию субстратов осуществляли в термостатированном шкафу при температуре 20°С и влажности 60% полной влагоемкости органо-минеральных субстратов. Продолжительность эксперимента с РО кукурузы и клевера – 6 месяцев. Для фракционирования из проинкубированной органо-минеральной массы, высушенной при комнатной температуре и просеянной через сито 3 мм, отбирали среднюю пробу. Фракционирование выполняли в трех повторностях.
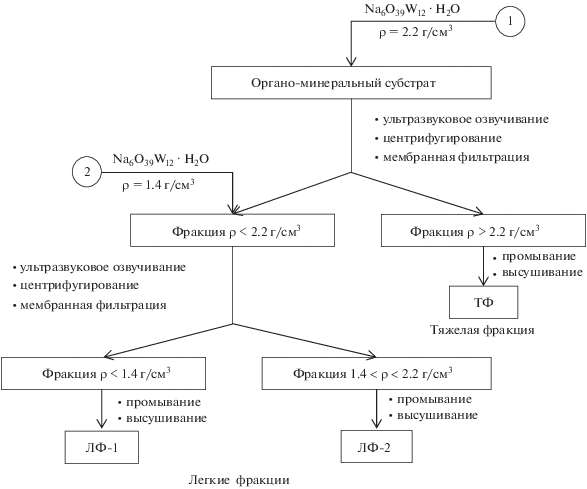
Следует отметить, что в настоящее время процедура денсиметрического разделения почвенных гетерогенных масс не стандартизирована [30]. Однако сравнительное влияние различных комбинаций граничных плотностей и энергии ультразвукового диспергирования на количество и качество выделяемых денсиметрических фракций представлено в работах [22, 30]. За основу последовательного денсиметрического фракционирования суглинистых субстратов в данном исследовании принят метод, описанный в работе [50] и методическом руководстве, подготовленном EPA USA (Агентство по охране окружающей среды США) для оценки состояния ОВ почв денсиметрическим методом [6, 41]. Схема фракционирования изображена на рис. 1.
Для разделения субстратов на легкие и тяжелые фракции использовали растворы поливольфрамата натрия с плотностью 1.4 и 2.2 г/см3. Выбор плотностей раствора поливольфрамата натрия обусловлен пограничными значениями плотностей для органических и минеральных компонентов почвы. Большинство первичных и вторичных минералов почв обладает плотностью в интервале 2.2–2.8 г/см3. Почвенное ОВ характеризуется плотностью менее 1.4 г/см3 [36, 42]. Для диспергирования образцов применяли слабое ультразвуковое озвучивание мощностью 60 Дж/мл, достаточное для разрушения макроагрегатов и выделения окклюдированного почвенного ОВ [31]. Чрезмерное механическое воздействие может привести к удалению воздуха из клеточных полостей неразложившихся РО, их утяжелению, способствуя искажению результатов фракционирования [27]. Окклюдированное ОВ представляет собой органический материал легкой фракции, который находится внутри сформировавшихся агрегатов, но еще не прочно связанный с почвенными минералами [12, 30].
На первом этапе фракционирования выделяли тяжелую фракцию плотностью >2.2 г/см3. Воздушно-сухую навеску 10 г органо-минерального субстрата помещали в центрифужную пробирку объемом 50 см3. Для фракционирования к навеске образца добавляли 10 мл раствора Na6O39W12 ⋅ H2O плотностью 2.2 г/см3. Содержимое пробирки слегка взбалтывали до полного смачивания образца жидкостью и подвергали ультразвуковому озвучиванию в течение 15 мин. Для отделения фаз различной плотности обработанные ультразвуком суспензии центрифугировали в течение 10 мин при 10 000 об./мин на центрифуге Sorvall RC 6 Plus (Thermo Scientific). Затем надосадочную жидкость плотностью <2.2 г/см3 подвергали вакуумной ультрафильтрации с использованием мембранных фильтров Millipore 0.45 µm. Оставшийся на дне пробирки осадок, представляющий собой тяжелую фракцию >2.2 г/см3, промывали дистиллированной водой и извлекали для последующего высушивания. На втором этапе фракционирования органо-минеральную фракцию <2.2 г/см3 переносили с мембранного фильтра в центрифужную пробирку и добавляли раствор Na6O39W12 ⋅ H2O плотностью 1.4 г/см3. Данная плотность тяжелой жидкости выбрана для исключения попадания неорганических частиц в не полностью разложившийся за время инкубации растительный материал. Аналогично первому этапу фракционирования суспензию подвергали ультразвуковому озвучиванию, центрифугированию и мембраной ультрафильтрации. В результате фракция <2.2 г/см3 была разделена на две легкие ДФ. Фракция плотностью <1.4 г/см3 собрана на мембранном фильтре, фракция промежуточной плотности 1.4–2.2 г/см3 осаждалась на дне центрифужной пробирки. Обработку одной навески раствором поливольфрамата натрия соответствующей плотности (2.2 или 1.4 г/см3) производили несколько раз (не менее трех) до полного разделения фаз. Выделенные фракции многократно промывали дистиллированной водой до достижения промывными водами плотности воды. Отмытые от тяжелой жидкости фракции высушивали при температуре 40°С.
Элементный состав (содержание С, N) ДФ суглинка определяли на CHNS-анализаторе Vario EL III (Elementar, Германия). Анализ супернатанта не проводили вследствие мешающего влияния поливольфрамата натрия. Структурный состав ОВ фракций исследовали методом твердофазной 13С ЯМР-спектроскопии на спектрометре Avance-II NMR 400 (Bruker, Германия) на химическом факультете МГУ имени М.В. Ломоносова. Расшифровку ЯМР-спектров проводили согласно работам [7, 16, 17, 20, 21, 24, 39]. Минералогический состав определяли методом рентгеновской дифрактометрии на установке ДРОН-3 (Cu-излучение, Ni-фильтр) с последующей диагностикой минералов по полученным рентгенограммам [15]. Морфологические особенности образцов исследовали с помощью сканирующего электронного микроскопа Vega III LSU (Tescan, Чехия) в ЦКП “Физико-химические методы исследования почв и экосистем” ИФХиБПП РАН.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Содержание, морфологические особенности и минералогический состав денсиметрических фракций. В процессе трансформации органических остатков происходит формирование органо-минеральных частиц и агрегатов, обладающих отличной от исходных минералов и растительного материала плотностью и различной прочностью. В результате фракционирования выделено три фракции: легкая с плотностью <1.4 г/см3 (ЛФ-1), легкая с плотностью 1.4–2.2 г/см3 (ЛФ-2) и тяжелая с плотностью более 2.2 г/см3 (ТФ).
Выделенные фракции четко различаются по морфологическим признакам (рис. 2). Видно, что фракция ЛФ-1 состоит из хорошо различимых визуально остатков не полностью разложившегося растительного материала. В естественных условиях легкая фракция (свободное и окклюдированное ОВ) почв содержит, в основном, растительный опад (листья, ветви и корни), а также остатки почвенных животных, древесный уголь, семена, пыльцу и микроорганизмы, колонизирующие органические остатки [29, 57]. Фракция ЛФ-2 представляет собой рыхлую тонкодисперсную, темноокрашенную массу, в отличие от более светлой, рассыпчатой тяжелой фракции. Считается, что легкие органо-минеральные фракции плотностью <2.0–2.4 г/см3 состоят из агрегатов с преобладанием в минералогическом составе глинистых минералов, а тяжелые фракции >2.2–2.6 г/см3 включают отдельные минеральные зерна первичных минералов (кварц, полевые шпаты), а также оксиды железа, с небольшим количеством ОВ [33, 35, 45, 59].
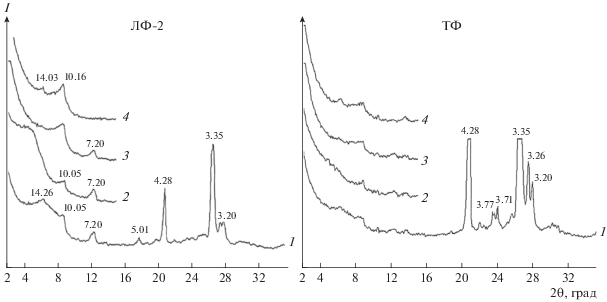
Методом рентгеновской дифрактометрии выявлены особенности минералогического состава органо-минеральных ДФ (рис. 3). В составе выделенных фракций диагностируются следующие минералы: кварц, полевые шпаты, каолинит, гидрослюда (иллит), смектит. В соответствии с представленными дифрактограммами в минералогическом составе ТФ доминируют кварц и полевые шпаты, а в ЛФ-2 – преобладают глинистые минералы.
Рис. 3.
Рентгендифрактограммы денсиметрических фракций. Условные обозначения: 1 – исходный образец, 2 – насыщение этиленгликолем, 3 – прокаливание образца при 350°C, 4 – прокаливание образца при 550°C. Числа у пиков – величины отражений в ангстремах.
После 6 мес. инкубации было извлечено (% от массы органо-минерального субстрата) в варианте с РО кукурузы: ТФ (91.4%) $ \gg $ ЛФ-2 (3.2%) ≥ ЛФ-1 (3.0%); в эксперименте с остатками клевера: ТФ (80.0%) $ \gg $ ЛФ-2 (10.2%) $ \gg $ ЛФ-1 (0.3%). Суммарное извлечение фракций из образца с кукурузой составило ~98%, а с клевером ~91%. Дисбаланс массового выхода фракций в пределах 10–15% является характерным для денсиметрического анализа почв и не ставит под угрозу достоверность фракционирования [54]. Балансовый расчет содержания органического углерода в ходе фракционирования показал, что потери Сорг составили 16 и 26% в вариантах с РО кукурузы и клевера соответственно. Следует отметить, что потери растворенного и коллоидного ОВ вследствие его солюбилизации раствором поливольфрамата натрия, а также при промывке выделенных фракции водой являются неизбежной особенностью метода [54].
Общее содержание легких фракций в исследуемых образцах составило 6–10%. Наименьшее количество фракции ЛФ-1, после 6 мес. инкубации, характерно для варианта с биомассой клевера и составляет 0.30 ± 0.02%. В опытах с кукурузой содержание ЛФ-1 составляет 3.0 ± 0.2%. Это свидетельствует о более быстрой и глубокой трансформации РО клевера по сравнению с РО кукурузы. Наоборот, выход фракции ЛФ-2 в ходе инкубации РО клевера существенно выше – 10.2 ± 0.4%, чем в варианте с кукурузой – 3.2 ± 0.3%. В процессе формирования ОВ из остатков клевера происходит физический перенос частиц из фракций высокой плотности во фракции более низкой плотности. По-видимому, процессы стабилизации новообразованных продуктов трансформации РО клевера за счет взаимодействия с минеральными компонентами суглинка происходят значительно интенсивней, чем в варианте с кукурузой.
Элементный и структурный состав ОВ денсиметрических фракций. Анализ элементного состава выделенных ДФ показал, что максимальное содержание С и N характерно для ЛФ-1 (рис. 4). В обоих вариантах в составе ОВ этой фракции содержится около 40% углерода. Фракции ЛФ-1 и ЛФ-2 в вариантах с клевером содержат больше азота, чем легкие фракции, выделенные из субстрата с биомассой кукурузы. Особенно это характерно для фракций ЛФ-1, что соответствует биохимическому составу исходных РО. После инкубации суглинка с РО кукурузы во фракции ЛФ-2 концентрация углерода почти в 2 раза больше, чем во фракции с РО клевера. Минимальное содержание углерода (в среднем 0.4%) и азота (0.06–0.07%) обнаружено в ТФ независимо от состава разлагающегося материала. Аналогичный результат получен ранее в ходе десятилетнего полевого эксперимента, в котором показано, что вид растительного материала (хвоя и корни) не повлиял на количество углерода и азота в тяжелых фракциях [34].
Рис. 4.
Элементный состав, показатель C/N денсиметрических фракций в вариантах с РО кукурузы (1) и клевера (2). Показаны средние значения из трех измерений ± стандартное отклонение при P = 0.95.
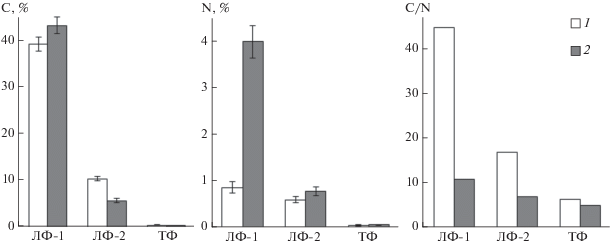
Отношение С/N в ОВ почв может служить показателем степени его биохимической трансформации. Уменьшение C/N является признаком возрастающего микробного характера ОВ [33]. Установлено, что во всех денсиметрических фракциях отношение С/N в варианте с клевером меньше, чем в варианте с кукурузой, что связано, прежде всего, с исходным биохимическим составом растений (табл. 1). Распределение органических углерода и азота между денсиметрическими фракциями и отношение С/N в них обусловлено тремя основными факторами: исходным биохимическим составом РО, присутствием в системе ОВ микробного происхождения обогащенного азотом и особенностями взаимодействия новообразованных ОВ с минеральными компонентами почв. Последний фактор играет определяющую роль в стабилизации ОВ в минеральных субстратах и перераспределении содержащих и не содержащих азот ОВ между минеральными матрицами денсиметрических фракций.
Во всех вариантах показатель С/N уменьшался в ряду: ЛФ-1 > ЛФ-2 > ТФ. Причем во фракциях, выделенных из субстрата с кукурузой, скорость и величина уменьшения данного показателя значительно больше, чем во фракциях, выделенных из субстрата с клевером (рис. 4). Следовательно, на фоне более быстрой деградации РО клевера стабилизация новообразованных азотсодержащих соединений происходила в форме более прочных органо-минеральных соединений по сравнению с соединениями, не содержащими азот. Наибольшие значения С/N характерны для ЛФ-1 (С/N 45 в варианте с РО кукурузы, С/N 11 – с РО клевера). Показатель С/N органического вещества в составе ЛФ-2 характеризуется величинами 17 и 7 для РО кукурузы и клевера соответственно. Минимальное значение показателя С/N 5–6 характерно для тяжелых фракций, выделенных при разложении РО обоих видов. Закономерное уменьшение отношения C/N с увеличением плотности фракций наблюдалось и ранее при последовательном денсиметрическом фракционировании [4, 19, 51, 52, 56, 59].
Кварц и полевые шпаты, составляющие основную часть минеральной массы ТФ, являются носителями кислотных центров (по Бренстеду) и, следовательно, в основном отрицательно заряженной поверхности. Их доля в этой фракции больше, чем в легких фракциях. В то же время азотсодержащие органические соединения относятся к категории оснований и в области слабокислых-щелочных рН являются носителями положительного заряда. Это обусловливает энергичное взаимодействие азотсодержащих соединений с компонентами ТФ, концентрирование азота в тяжелой фракции и более низкое отношение C/N на фоне общего незначительного содержания ОВ в этой фракции. Фракция ЛФ-2 занимает промежуточное положение, а ЛФ-1 в наибольшей степени сохраняет черты исходного органического материала.
Плотность органо-минеральных частиц определяется количественным соотношением минеральных и органических соединений и их упаковкой в агрегатах, а также плотностью минеральных компонентов. Поэтому в процессе взаимодействия продуктов разложения РО и новообразованных ОВ с компонентами минерального субстрата происходит перераспределение минералоорганических частиц между ДФ. В варианте с клевером масса фракции ЛФ-2 в 3 раза больше, чем в варианте с кукурузой, в то время как концентрация углерода в ней меньше примерно в 2 раза. Таким образом, фракция ЛФ-2, образующаяся при биодеградации клевера, содержит больше азотсодержащих соединений и связанных с ними тяжелых минеральных частиц. Более высокая концентрация углерода в ЛФ-2 в случае с остатками кукурузы может быть связана с сохранением неглубоко трансформированных мелких фрагментов растительных тканей и структурных компонентов внутри агрегатов, по сравнению с изначально легкоразлагаемой биомассой клевера.
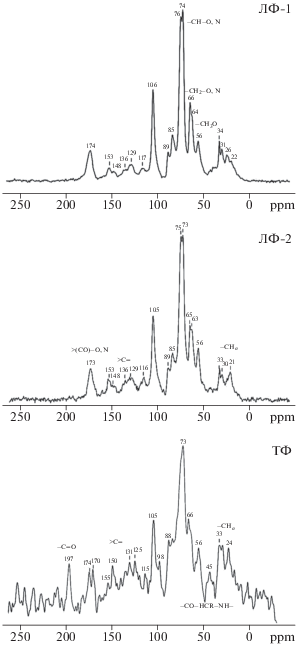
Для характеристики органических компонентов, содержащихся в выделенных фракциях, использована твердофазная 13С ЯМР-спектроскопия. ЯМР-спектры ДФ характеризуются близким набором структурных фрагментов: содержатся ароматические, замещенные и незамещенные алкильные фрагменты, карбоксильные, карбонильные, метоксильные, амидные и другие функциональные группы (рис. 5). Анализ интегральных интенсивностей диапазонов характеристических сигналов выявил отличия фрагментарного состава ОВ фракций в зависимости от их плотности (табл. 2).
Таблица 2.
Структурный состав органических компонентов денсиметрических фракций по данным твердофазной 13С ЯМР-спектроскопии
| Фракция | Химический сдвиг, ppm | ||||
|---|---|---|---|---|---|
| 0–45 | 45–110 | 110–160 | 160–190 | 190–210 | |
| СAlk | СAlk-O | СAr | CCOOH, CCOOR | CC=O | |
| Кукуруза | |||||
| ЛФ-1 | 14.8 | 67.0 | 11.5 | 7.2 | 0.6 |
| ЛФ-2 | 11.9 | 65.5 | 15.6 | 6.3 | 0.7 |
| ТФ | 20.0 | 56.4 | 17.6 | 3.5 | 2.5 |
| Клевер | |||||
| ЛФ-1 | 25.7 | 52.9 | 11.3 | 9.5 | 0.7 |
| ЛФ-2 | 24.4 | 51.5 | 13.6 | 9.5 | 1.1 |
| ТФ | 35.9 | 37.8 | 16.8 | 6.4 | 3.1 |
Сигналы в интервале 0–45 ppm связаны с незамещенными алкильными фрагментами СAlk, которые могут принадлежать липидам, воскам, белкам, аминокислотам и др. Интенсивность сигналов СAlk в ТФ выше по сравнению с легкими фракциями. Спектр ТФ характеризуется появлением пика в области 40–50 ppm, который отсутствует в ЛФ-1 и ЛФ-2. Данный сигнал может принадлежать ядрам атомов азотсодержащего алкильного углерода, входящего в состав аминокислот, аминосахаров и аминоспиртов [21]. В составе ОВ денсиметрических фракций преобладают фрагменты, обусловленные углеродом, связанным простой связью с гетероатомами (СAlk-O). Сигналы в области 45–110 ppm указывают на присутствие полисахаридов. Отчетливые пики в спектрах РО при 65, 72, 85, 89 ppm обусловлены резонансными колебаниями атомов углерода целлюлозы и гемицеллюлозы. ДФ характеризуются более низким содержанием доли СAlk-O. Сигнал при 63–65 ppm, соответствующий ядрам первичных атомов углерода (СН2–O, СН2–N), интенсивнее проявился в спектрах легких фракций. В данной области (45–100 ppm) во всех спектрах наблюдается сигнал при 56 ppm, связанный либо с колебаниями метоксильного углерода лигниновых фрагментов R–O–CH3, либо с углеродом, связанным с азотом –CO–HCR–NH– в составе белковых соединений [39]. В ТФ данный пик более отчетливо выражен и немного уширен, что может указывать на присутствие замещенных алифатических аминов [21]. Содержание ароматических компонентов в составе органо-минеральных фракций больше (15–17%), чем в ЛФ-1 (12%), возможно, за счет синтеза новых ОВ, содержащих ароматические кольца.
В составе ароматических фрагментов преобладает замещенный СAr-O, вероятно обусловленный преимущественно фенольными соединениями. Фракции ЛФ-2 отличаются существенно бóльшим по интенсивности сигналом около 170 ppm, принадлежащим в основном карбоксильным и эфирным группам, по сравнению с ТФ, что свидетельствует о слабом взаимодействии этих групп с минеральными компонентами ТФ. Сигнал, обусловленный карбонильными группами при 197 ppm, слабо выражен в легких фракциях, в то время как в ТФ имеет значительную интенсивность. По мнению некоторых авторов, этот сигнал (190–220 ppm) обусловлен, главным образом, С=О-группами амидов, полипептидов [38]. Таким образом, отчетливо выраженные сигналы при 45, 56 и 197 ppm ЯМР-спектров тяжелой фракции указывают на более высокое содержание в ее составе азотсодержащих компонентов белковой природы.
Основным отличием структурного состава органических компонентов легких и тяжелых фракций является разное соотношение алкильных групп. В спектрах обеих фракций высокое содержание замещенных алкильных структур. Однако СAlk-O может иметь различное происхождение. Спектр ЛФ-2 характеризуется более широким набором четких сигналов в диапазоне 50–110 ppm, что может указывать на растительное происхождение замещенного алкильного углерода в составе ОВ. По мере разложения растительных полисахаридов полное исчезновение СAlk-O компонентов маловероятно, поскольку в процессе ассимиляции Сорг бактериями и грибами формируются фрагменты СAlk-O уже микробного происхождения [20]. Наличие дополнительных сигналов в ТФ, отвечающих азотсодержащим фрагментам, позволяет предположить, что в составе ТФ преобладает ОВ микробного происхождения, что согласуется со значениями показателя С/N. Таким образом, изменения в составе ОВ фракций с увеличением их плотности сопровождается уменьшением относительной доли кислородсодержащих фрагментов и групп принадлежащих полисахаридам растительного происхождения, производным лигнина и увеличением относительной доли алкильных и азотсодержащих компонентов преимущественно микробной природы.
Оценка вклада денсиметрических фракций в общий углеродный пул. Данные по кинетике трансформации РО в минеральных субстратах разного состава показывают, что деструкция РО клевера идет быстрее и глубже, чем кукурузы [11]. Однако в контроле динамики Сорг более важным является не общее содержание ОВ, а установление пулов, в которых концентрируется стабилизированное ОВ.
Долевое участие фракций в распределении общего углерода суглинистого субстрата рассчитывали по формуле:
(1)
${{P}_{{{\text{фр}}}}} = {{{{m}_{{{\text{фр}}}}}{{{\text{С}}}_{{{\text{фр}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{фр}}}}}{{{\text{С}}}_{{{\text{фр}}}}}} {{{{\text{С}}}_{{{\text{общ}}}}}}}} \right. \kern-0em} {{{{\text{С}}}_{{{\text{общ}}}}}}}{\kern 1pt} ,$Таблица 3.
Вклад фракций в общий углеродный пул суглинистого субстрата после инкубации РО кукурузы или клевера (% от Собщ в субстрате)*
| Остатки | Фракция | ||
|---|---|---|---|
| ЛФ-1 | ЛФ-2 | ТФ | |
| Кукуруза | 51.8 ± 2.5 | 15.2 ± 1.4 | 17.0 ± 0.7 |
| Клевер | 9.8 ± 0.3 | 42.8 ± 3.3 | 21.4 ± 1.0 |
К концу эксперимента долевое участие ТФ в общем пуле углерода суглинистого субстрата для РО кукурузы и клевера составило 17 и 21% соответственно. Существенная разница между вариантами проявляется в распределении углерода между легкими фракциями суглинка. В эксперименте с кукурузой в составе ЛФ-1 остается 52% общего углерода, а в ЛФ-2 – 15%. В то же время при трансформации РО клевера 10% от Собщ содержится в ЛФ-1, а 43% в ЛФ-2. Таким образом, минералогический состав ДФ, так же как биохимический состав РО оказывает большое влияние на вклад каждой фракции в общий углеродный пул. Причем сохранность продуктов разложения РО кукурузы обусловлена в значительной степени собственной биохимической устойчивостью тканей растения к разложению, а в случае с клевером – стабилизацией продуктов разложения в ЛФ-2.
Механизмы формирования денсиметрических фракций почв. Стабилизация продуктов разложения РО в минеральной среде сопровождается формированием различных видов органо-минеральных частиц [51]. Однако наиболее универсальным механизмом стабилизации новообразованных ОВ, очевидно, является специфическая селективная адсорбция органических веществ минеральными матрицами почв из водных растворов [11, 37, 49].
Жидкая фаза почв (почвенный раствор) является необходимым компонентом процесса разложения РО микроорганизмами-деструкторами и физико-химической стабилизации продуктов разложения. Она не только способствует переходу растворимых органических соединений, ферментов и метаболитов микроорганизмов в подвижное состояние, но и обеспечивает биогеохимическую взаимосвязь всех компонентов почвы, в том числе стабилизацию ОВ минеральными компонентами почв [10, 37]. В работах [25, 43] отмечается важная роль растворимого ОВ в обеспечении быстрого и долгосрочного сохранения C и N в почвах. Присутствие ОВ, стабилизированного в форме органо-минеральных соединений при разложении высококачественных остатков травянистой растительности в течение 95 дней инкубации, в работе [43] связывают с переходом лабильных компонентов из растений в раствор. Растворимое ОВ адсорбируется непосредственно на поверхности минеральных частиц, либо используется с высокой эффективностью почвенными микроорганизмами, обеспечивая поступление биохимически преобразованных растительных продуктов в почву, где они связываются с минералами [37, 43]. Растворимые продукты разложения ЛФ-1 являются источником ОВ более тяжелых фракций [49, 57].
Специфическая адсорбция вещества осуществляется за счет короткодействующих связей донорно-акцепторного или координационного типа в плотной части двойного электрического слоя с образованием прочных поверхностных внутрисферных комплексов [10, 13]. Избирательность адсорбции обеспечивается, прежде всего, величиной, знаком заряда и конфигурацией поверхностных функциональных групп минеральных матриц, а также характером поверхности и конфигурацией органических молекул.
Следует учесть, что точки нулевого заряда глинистых минералов и соединений Al и Fe, слагающих минералогическую основу ЛФ-2, лежат в области pH 4.7–9.2, а соединений кремния, составляющих минералогическую основу ТФ – в области рН 1–3.5 [10, 13]. Это обстоятельство имеет очень важное значение для стабилизации ОВ. Оно означает, что при близких к нейтральным значениях рН более 50% поверхности минеральных частиц в ЛФ-2 заряжено положительно за счет протонирования и они являются анионитами. В то же время более 50% минеральной поверхности ТФ в этих условиях заряжено отрицательно и минералы являются катионитами. Таким образом, почву, как и исследуемый суглинок, можно рассматривать как адсорбент смешанного типа. В этом случае в ЛФ-2 будут аккумулироваться преимущественно ОВ с отрицательно заряженными функциональными группами: липиды, карбоновые кислоты, фенолы, углеводы. Напротив, ТФ будет в большей степени аккумулировать ОВ с положительно заряженными функциональными группами: белки, аминоспирты, аминокислоты, амиды и другие содержащие аммонийный азот соединения. При этом в системе одновременно осуществляется два противоположно направленных процесса: 1) минерализация свободных или слабосвязанных ОВ до элементарных продуктов разложения, которые затем уходят за пределы системы и 2) стабилизация растворенных ОВ на поверхности минеральных частиц (минеральных матриц). На рис. 6 представлена концептуальная схема перераспределения продуктов трансформации растительных остатков между денсиметрическими фракциями суглинка.
Рис. 6.
Концептуальная схема перераспределения продуктов трансформации растительных остатков между денсиметрическими фракциями суглинка (выделены доминирующие компоненты).
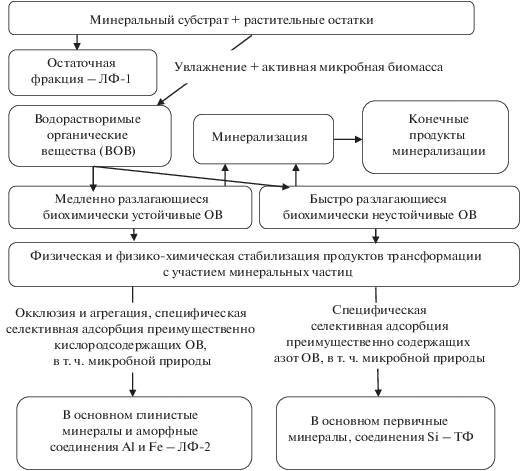
Стабилизация ОВ с участием минеральной фазы обусловлена образованием прочных органо-минеральных соединений сорбционного типа и/или пространственной недоступностью микроорганизмам вследствие окклюзии ОВ внутри агрегатов, формирующихся в результате органо-минеральных взаимодействий. При этом происходит сепарация новообразованных ОВ, с преимущественной аккумуляцией азота в более тяжелых ДФ. Единственным защитным механизмом свободного ОВ (фракция ЛФ-1) является его собственная биохимическая устойчивость к разложению [28].
Физическая защита ОВ, обусловливающая пространственную недоступность ОВ микроорганизмам, является одним из важных механизмов стабилизации Сорг [12, 37]. На электронной микрофотографии фракции ЛФ-2 суглинистого субстрата после инкубации с РО видно, что частицы агрегированы в беспорядочно ориентированную неоднородную по размерам частиц массу (рис. 7, А). В то же время на микрофотографиии ТФ (рис. 7, Б) видно, что распределение адсорбированного на поверхности минеральных частиц ОВ носит локальный “островной” характер и приурочено к ребрам, вершинам и другим дислокациям на поверхности минеральных зерен.
Рис. 7.
Растровые электронные микрофотографии денсиметрических фракций ЛФ-2 (А) и ТФ (Б) суглинка на примере РО кукурузы.

На основе микроскопических исследований в работе [33] сделан вывод о том, что фракции плотностью 1.6–2.4 г/см3 состоят в основном из ОВ, адсорбированного на поверхности минералов или захваченного внутрь микроагрегатов. Эти фракции содержат агрегаты, в которых доля неагрегированных минеральных частиц увеличивается от 10 до 60% по мере увеличения их плотности [44]. В процессе стабилизации продуктов разложения РО, новообразованного ОВ и мортмассы микроорганизмов на минеральных матрицах суглинка происходит агрегация вновь образованных органо-минеральных частиц и изменяется их плотность. Таким образом, процессы агрегатообразования во фракции ЛФ-2 обеспечивают не только физическую защиту слаботрансформированного ОВ и сохранение ОВ, связанного с минеральной поверхностью физико-химическими взаимодействиями [45], но и обусловливают перераспределение вновь образованных органо-минеральных соединений по плотности и размерам между ДФ.
Существенную роль в формировании состава новообразованного ОВ почв играют микроорганизмы-деструкторы. Продукты их метаболизма и микробная некромасса являются составной частью органического вещества с высоким содержанием азота. Среднее отношение С/N в органическом веществе микробного происхождения составляет ∼3–10 [53]. Анализ состава ОВ денсиметрических фракций, выполненный разными авторами, показал, что относительный вклад ОВ микробного происхождения возрастает с увеличением плотности фракций [32, 40, 47, 51]. Наши данные 13С ЯМР-спектроскопии и показатель C/N 5–6 также указывают на преимущественно микробиологическую природу ОВ тяжелой фракции. Возможно, именно поэтому элементный состав ОВ тяжелых фракций практически не зависит от природы разлагаемого растительного материала. Полученные нами результаты свидетельствуют о том, что содержание тяжелой фракции и количество углерода и азота, включенного в ее состав, в большей степени определяются процессами избирательной адсорбции на поверхности минеральных частиц, а места стабилизации приурочены к краям и дефектам поверхности, что соответствует данным работы [36].
ЗАКЛЮЧЕНИЕ
Методом денсиметрического фракционирования органо-минерального субстрата, полученного в ходе инкубации покровного суглинка с надземной биомассой кукурузы или клевера в течение 6 месяцев при контролируемых температуре и влажности, выделены тяжелая фракция (ТФ) плотностью >2.2 г/см3 и две легких фракции с плотностями: <1.4 г/см3 (ЛФ-1) и 1.4–2.2 г/см3 (ЛФ-2). Показано, что в состав ЛФ-1 входят, в основном, остатки не полностью разложившегося растительного материала, а также окклюдированное ОВ. Фракции ЛФ-2 и ТФ представляют собой органо-минеральные соединения, отделенные от свободного ОВ.
Рентгеноструктурный анализ и электронно-микроскопические исследования ДФ показали, что ЛФ-2 состоит, в основном, из гетерогенных агрегатов органо-минеральных соединений, минералогическую основу которых составляют высокодисперсные глинистые минералы. Тяжелая фракция включает ОВ, дискретно сорбированное на поверхности крупных зерен кварца и полевых шпатов в виде пленок, приуроченных к различного рода дислокациям.
Установлено, что содержание денсиметрических фракций, элементный и структурный состав их органических компонентов зависят как от происхождения РО, так и от минералогического состава субстрата. С увеличением плотности выход ДФ (по массе) увеличивается, а содержание С, N и отношение C/N уменьшаются. Отношение C/N уменьшается в ряду: ЛФ-1 >ЛФ-2 >ТФ в результате увеличения доли ОВ микробного происхождения с более высоким содержанием азота в составе ДФ.
Увеличение содержания ароматических компонентов в составе органо-минеральных фракций до 15–17% по сравнению с ЛФ-1 (12%) свидетельствует о возможном синтезе новых ОВ. В составе органических компонентов ЛФ-2 доминируют кислородсодержащие фрагменты ОВ.
Определены размеры пулов ОВ свободного и связанного с минеральными матрицами суглинка. Установлена взаимосвязь механизмов аккумуляции продуктов разложения РО различного биохимического качества с минералогическим составом ДФ. В эксперименте с кукурузой после 6 мес инкубации в состав ЛФ-1 входит 52% общего углерода суглинистого субстрата, а в ЛФ-2 – 15%. При трансформации РО клевера в состав ЛФ-1 входит всего 10%, а во фракцию ЛФ-2 – 43% общего углерода. Долевое участие тяжелой фракции в распределении органического углерода субстратов составило для РО кукурузы и клевера 17 и 21% соответственно.
Разработана концептуальная схема, описывающая механизмы перераспределения новообразованного ОВ между денсиметрическими фракциями органо-минерального субстрата. В основе схемы лежит учет состава и свойств органических и минеральных компонентов органо-минерального субстрата. Рассматриваются два противоположно направленных процесса: минерализация и стабилизация ОВ. Физико-химическая стабилизация ОВ в денсиметрических фракциях различного минералогического состава осуществляется путем специфической селективной адсорбции. В процессе стабилизации происходит сепарация новообразованных органических соединений по ДФ.
Список литературы
Александрова Л.Н. Органическое вещество почвы и процессы его трансформации. Л.: Наука, 1980. 288 с.
Артемьева З.С. Органическое вещество и гранулометрическая система почвы. М: ГЕОС, 2010. 240 с.
Артемьева З.С., Кириллова Н.П. Роль продуктов органо-минерального взаимодействия в структурообразовании и гумусообразовании основных типов почв центра Русской равнины // Бюл. Почв. ин-та им. В.В. Докучаева. 2017. Вып. 90. С. 73–95. https://doi.org/10.19047/0136-1694-2017-90-73-95
Дымов А.А., Милановский Е.Ю., Холодов В.А. Состав и гидрофобные свойства органического вещества денсиметрических фракций почв Приполярного Урала // Почвоведение. 2015. № 11. С. 1335–1345. https://doi.org/10.1134/S1064229315110058
Дымов А.А., Михайлова Е.Н. Свойства лесных и постагрогенных почв, развивающихся на песчаных и суглинистых отложениях Республики Коми // Известия Коми научного центра УрО РАН. 2017. № 3(31). С. 24–33.
Ларионова А.А., Золотарева Б.Н., Квиткина А.К., Евдокимов И.В., Быховец С.С., Стулин А.Ф., Кузяков Я.В., Кудеяров В.Н. Оценка устойчивости почвенного органического вещества на основе различных видов фракционирования и изотопных методов 13С // Почвоведение. 2015. № 2. С. 175–187. https://doi.org/10.7868/S0032180X15020070
Лодыгин Е.Д., Безносиков В.А., Чуков С.Н. Структурно-функциональные параметры гумусовых веществ подзолистых и болотно-подзолистых почв. СПб.: Наука, 2007. 145 с.
Моргун Е.Г., Макаров М.И. Использование поливольфрамата натрия при грануло-денсиметрическом фракционировании почвенного материала // Почвоведение. 2011. № 4. С. 433–438. https://doi.org/10.1134/S1064229311040077
Орлов Д.С. Химия почв. М.: Изд-во Моск. ун-та, 1992. 400 с.
Пинский Д.Л. Ионообменные процессы в почвах. Пущино, 1997. 166 с.
Пинский Д.Л., Мальцева А.Н., Золотарева Б.Н., Дмитриева Е.Д. Кинетика трансформации растительных остатков кукурузы и клевера в минеральных субстратах различного состава // Почвоведение. 2017. № 6. С. 690–697. https://doi.org/10.1134/S1064229317060096
Семенов В.М., Когут Б.М. Почвенное органическое вещество. М.: ГЕОС, 2015. 233 с.
Соколова Т.А., Трофимов С.Я. Сорбционные свойства почв. Адсорбция. Катионный обмен. Тула: Гриф и К, 2009. 172 с.
Травникова Л.С. Органоминеральные взаимодействия: роль в процессах формирования почв, их плодородия и устойчивости к деградации. М.: Почв. ин-т им. В.В. Докучаева, 2012. 296 с.
Трофимов С.Я., Соколова Т.А., Дронова Т.Я., Толпешта И.И. Минеральные компоненты почв. Тула: Гриф и К, 2007. 104 с.
Чуков С.Н. Структурно-функциональные параметры органического вещества почв СПб.: Изд-во СПбГУ, 2001. 216 с.
Чуков С.Н., Лодыгин Е.Д., Абакумов Е.В. Использование 13С ЯМР-спектроскопии в исследовании органического вещества почв (обзор) // Почвоведение. 2018. № 8. С. 952–964. https://doi.org/10.1134/S0032180X18080026
Шаймухаметов М.Ш., Титова Н.А., Травникова Л.С., Лабенец Е.М. Применение физических методов фракционирования для характеристики органического вещества почв // Почвоведение. 1984. № 8. С. 131–141.
Baisden W.T., Amundson R., Cook A.C., Brenner D.L. Turnover and storage of C and N in five density fractions from California annual grassland surface soils // Global Biogeochem. Cycles. 2002. V. 16. № 4. P. 64-1–64-16. https://doi.org/10.1029/2001gb001822
Baldock J.A., Skjemstad J.O. Role of the soil matrix and minerals in protecting natural organic materials against biological attack // Org. Geochem. 2000. V. 31. P. 697–710. https://doi.org/10.1016/S0146-6380(00)00049-8
Baldock J.A., Oades J.M., Nelson P.N., Skene T.M., Golchin A., Clarke P. Assessing the extent of decomposition of natural organic materials using solid-state 13C NMR spectroscopy // Aust. J. Soil Res. 1997. V. 35. P. 1061–1083. https://doi.org/10.1071/S97004
Cerli C., Celi L., Kalbitz K., Guggenberger G., Kaiser K. Separation of light and heavy organic matter fractions in soil – Testing for proper density cut-off and dispersion level // Geoderma. 2012. V. 170. P. 403–416. https://doi.org/10.1016/j.geoderma.2011.10.009
Christensen B.T. Physical fractionation of soil and organic matter in primary particle size and density separates. // Advances in Soil Science. V. 20. Ed. B.A. Stewart. New York, Springer-Verlag, 1992. P. 1–90. https://doi.org/10.1007/978-1-4612-2930-8_1
Conte P., De Pasquale C., Novotny E.H., Caponetto G., Laudicina V.A., Ciofalo M., Panno M., Palazzolo E., Badalucco L., Alonzo G. CPMAS 13C NMR Characterization of Leaves and Litters from the Reafforestated Area of Mustigarufi in Sicily (Italy) // The Open Magnetic Resonance J. 2010. V. 3. P. 89–95. https://doi.org/10.2174/1874769801003010089
Cotrufo M.F., Soong J.L., Horton A.J., Campbell E.E., Haddix M.L., Wall D. H., Parton W.J. Formation of soil organic matter via biochemical and physical pathways of litter mass loss // Nature Geoscience. 2015. V. 8. P. 776–779. https://doi.org/10.1038/ngeo2520
Crow S.E., Swanston C.W., Lajtha K., Brooks J.R., Keirstead H. Density fractionation of forest soils: methodological questions and interpretation of incubation results and turnover time in an ecosystem context // Biogeochemistry. 2007. V. 85. № 1. P. 69–90. https://doi.org/10.1007/s10533-007-9100-8
Diochon A., Gillespie A.W., Ellert B.H., Janzen H.H., Gregorich E.G. Recovery and dynamics of decomposing plant residue in soil: an evaluation of three fractionation methods // Eur. J. Soil Sci. 2016. V. 67. № 2. P. 196–205. https://doi.org/10.1111/ejss.12316
Golchin A., Baldock J.A., Oades J.M. A model linking organic matter decomposition, chemistry, and aggregate dynamics // Soil Processes and The Carbon Cycle / Eds R. Lal et al. CRC Press, 1998. P. 245–266. https://doi.org/10.1201/9780203739273
Golchin A., Oades J.M., Skjemstad J.O., Clarke P. Study of free and occluded particulate organic matter in soils by solid-state 13C CP/MAS NMR spectroscopy and scanning electron microscopy // Aust. J. Soil Res. 1994. V. 32. № 2. P. 285–309. https://doi.org/10.1071/SR9940285
Griepentrog M., Schmidt M.W. Discrepancies in utilization of density fractionation along with ultrasonic dispersion to obtain distinct pools of soil organic matter // J. Plant Nutr. Soil Sci. 2013. V. 176. № 4. P. 500–504. https://doi.org/10.1002/jpln.201200469
Grüneberg E., Schöning I., Hessenmöller D., Schulze E.-D., Weisser W.W. Organic layer and clay content control soil organic carbon stocks in density fractions of differently managed German beech forests // Forest Ecology and Management. 2013. V. 303. P. 1–10. https://doi.org/10.1016/j.foreco.2013.03.014
Hatton P.-J., Bodé S., Angeli N., Boeckx P., Zeller B., Boiry S., Gelhaye L., Derrien D. Assimilation and accumulation of C by fungi and bacteria attached to soil density fractions // Soil Biol. Biochem. 2014. V. 79. P. 132–139. https://doi.org/10.1016/j.soilbio.2014.09.013
Hatton P.-J., Kleber M., Zeller B., Moni C., Plante A.F., Townsend K., Gelhaye L., Lajtha K., Derrien D. Transfer of litter-derived N to soil mineral–organic associations: Evidence from decadal 15N tracer experiments // Org. Geochem. 2012. V. 42. № 12. P. 1489–1501. https://doi.org/10.1016/j.orggeochem.2011.05.002
Hicks Pries C.E., Bird J.A., Castanha C., Hatton P.-J., Torn M.S. Long term decomposition: the influence of litter type and soil horizon on retention of plant carbon and nitrogen in soils // Biogeochemistry. 2017. V. 134. № 1–2. P. 5–16. https://doi.org/10.1007/s10533-017-0345-6
Jones E., Singh B. Organo-mineral interactions in contrasting soils under natural vegetation // Frontiers Environ. Sci. 2014. V. 2. Article 2. P. 1–15. https://doi.org/10.3389/fenvs.2014.00002
Kaiser K., Guggenberger G. Mineral surfaces and soil organic matter // Eur. J. Soil Sci. 2003. V. 54. № 4. P. 219–236. https://doi.org/10.1046/j.1365-2389.2003.00544.x
Kleber M., Eusterhues K., Keiluweit M., Mikutta C., Mikutta R., Nico P.S. Mineral–organic associations: formation, properties, and relevance in soil environments // Adv. Agron. 2015. V. 130. P. 1–140. https://doi.org/10.1016/bs.agron.2014.10.005
Knicker H., Lüdemann H.D. N-15 and C-13 CPMAS and solution studies of N-15 enriched plant material during 600 days of microbial degradation // Org. Geochem. 1995. V. 23. P. 329–341. https://doi.org/10.1016/0146-6380(95)00007-2
Kögel-Knabner I. The macromolecular organic composition of plant and microbial residues as inputs to soil organic matter // Soil Biol. Biochem. 2002. V. 34. P. 139–162. https://doi.org/10.1016/S0038-0717(01)00158-4
Ludwig M., Achtenhagen J., Miltner A., Eckhardt K.-U., Leinweber P., Emmerling C., Thiele-Bruhn S. Microbial contribution to SOM quantity and quality in density fractions of temperate arable soils // Soil Biol. Biochem. 2015. V. 81. P. 311–322. https://doi.org/10.1016/j.soilbio.2014.12.002
Lukach M., Simmons R., Johnson M., Catricala C., Monte M. Standard operating procedure for the physical fractionation procedure to determine soil organic matter quality. EPA, 2003. 25 p.
Mayer L.M., Schick L.L., Hardy K.R., Wagai R., McCarthy J. Organic matter in small mesopores in sediments and soils // Geochim. Cosmochim. Acta. 2004. V. 68. № 19. P. 3863–3872. https://doi.org/10.1016/j.gca.2004.03.019
Mitchell E., Scheer C., Rowlings D., Conant R.T., Cotrufo M.F., Grace P. Amount and incorporation of plant residue inputs modify residue stabilisation dynamics in soil organic matter fractions // Agriculture, Ecosystems and Environment. 2018. V. 256. P. 82–91. https://doi.org/10.1016/j.agee.2017.12.006
Moni C., Derrien D., Hatton P.-J., Zeller B., Kleber M. Density fractions versus size separates: does physical fractionation isolate functional soil compartments? // Biogeosciences. 2012. V. 9. № 12. P. 5181–5197. https://doi.org/10.5194/bg-9-5181-2012
Plaza C., Courtier-Murias D., Fernández J.M., Polo A., Simpson A.J. Physical, chemical, and biochemical mechanisms of soil organic matter stabilization under conservation tillage systems: A central role for microbes and microbial by-products in C sequestration // Soil Biol. Biochem. 2013. V. 57. P. 124–134. https://doi.org/10.1016/j.soilbio.2012.07.026
Poeplau C., Don A., Six J., Kaiser M., et al. Isolating organic carbon fractions with varying turnover rates in temperate agricultural soils – A comprehensive method comparison // Soil Biol. Biochem. 2018. V. 125. P. 10–26. https://doi.org/10.1016/j.soilbio.2018.06.025
Poirier N., Sohi S.P., Gaunt J.L., Mahieu N., Randall E.W., Powlson D.S., Evershed R.P. The chemical composition of measurable soil organic matter pools // Org. Geochem. 2005. V. 36. № 8. P. 1174–1189. https://doi.org/10.1016/j.orggeochem.2005.03.005
Rumpel C., Rodríguez-Rodríguez A., González-Pérez J.A., Arbelo C., Chabbi A., Nunan N., González-Vila F.J. Contrasting composition of free and mineral-bound organic matter in top- and subsoil horizons of Andosols // Biol. Fertil. Soils. 2012. V. 48. № 4. P. 401–411. https://doi.org/10.1007/s00374-011-0635-4
Schrumpf M., Kaiser K., Guggenberger G., Persson T., Kogel-Knabner I., Schulze E.D. Storage and stability of organic carbon in soils as related to depth, occlusion within aggregates, and attachment to minerals // Biogeosciences. 2013. V. 10. P. 1675–1691. https://doi.org/10.5194/bg-10-1675-2013
Sollins P., Glassman C.A., Paul E.A., Swanston C., Lajtha K., Heil J.W., Elliott E.T. Soil carbon and nitrogen: Pools and fractions // Standard soil methods for long-term ecological research / Eds. G.P. Robertson et al. N.Y.: Oxford University Press, 1999. P. 89–105.
Sollins P., Kramer M., Swanston C., Lajtha K., Filley T., Aufdenkampe A.K., Wagai R., Bowden R.D. Sequential density fractionation across soils of contrasting mineralogy: evidence for both microbial- and mineral-controlled soil organic matter stabilization // Biogeochemistry. 2009. V. 96. № 1–3. P. 209–231. https://doi.org/10.1007/s10533-009-9359-z
Sollins P., Swanston C., Kleber M., Filley T., Kramer M., Crow S., Cadwell B.A., Lajtha K., Bowden R. Organic C and N stabilization in a forest soil: Evidence from sequential density fractionation // Soil Biol. Biochem. 2006. V. 38. № 11. P. 3313–3324. https://doi.org/10.1016/j.soilbio.2006.04.014
Strickland M.S., Rousk J. Considering fungal:bacterial dominance in soils–Methods, controls, and ecosystem implications // Soil Biol. Biochem. 2010. V. 42. № 9. P. 1385–1395. https://doi.org/10.1016/j.soilbio.2010.05.007
Viret F., Grand S. Combined size and density fractionation of soils for investigations of organo-mineral interactions // J. Vis. Exp. 2019. V. 144. e58927. https://doi.org/10.3791/58927
von Lutzow M., Kögel-Knabner I., Ekschmitt K., Flessa H., Guggenberger G., Matzner E., Marschner B. SOM fractionation methods: relevance to functional pools and to stabilization mechanisms // Soil Biol. Biochem. 2007. V. 39. P. 2183–2207. https://doi.org/10.1016/j.soilbio.2007.03.007
Wagai R., Kajiura M., Asano M., Hiradate S. Nature of soil organo-mineral assemblage examined by sequential density fractionation with and without sonication: Is allophanic soil different? // Geoderma. 2015. V. 241–242. P. 295–305. https://doi.org/10.1016/j.geoderma.2014.11.028
Wagai R., Mayer L.M., Kitayama K. Nature of the “occluded” low-density fraction in soil organic matter studies: A critical review // Soil Sci. Plant Nutrition. 2009. V. 55. № 1. P. 13–25. https://doi.org/10.1111/j.1747-0765.2008.00356.x
Yamashita T., Flessa H., John B., Helfrich M., Ludwig B. Organic matter in density fractions of water-stable aggregates in silty soils: Effect of land use // Soil Biol. Biochem. 2006. V. 38. № 11. P. 3222–3234. https://doi.org/10.1016/j.soilbio.2006.04.013
Yeasmin S., Singh B., Johnston C.T., Sparks D.L. Organic carbon characteristics in density fractions of soils with contrasting mineralogies // Geochim. Cosmochim. Acta. 2017. V. 218. P. 215–236. https://doi.org/10.1016/j.gca.2017.09.007
Дополнительные материалы отсутствуют.