Почвоведение, 2020, № 11, стр. 1383-1392
Сукцессия бактериальных сообществ при разложении соломы овса в двух разных типах почв
О. В. Орлова a, *, А. А. Кичко a, Е. В. Першина a, А. Г. Пинаев a, Е. Е. Андронов a, b, c
a Всероссийский НИИ сельскохозяйственной микробиологии
196608 Санкт-Петербург, ш. Подбельского, 3, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
c Почвенный институт им. В.В. Докучаева
397463 Москва, Пыжевский пер., 7, стр. 2, Россия
* E-mail: falenki@hotmail.com
Поступила в редакцию 22.10.2019
После доработки 13.02.2020
Принята к публикации 26.02.2020
Аннотация
Исследовали сукцессии бактериальных сообществ при разложении соломы в образцах гумусовых горизонтов дерново-подзолистой почвы (Albic Retisoils Abruptic) и чернозема (Haplic Chernozem (Pachic)) в условиях лабораторного эксперимента. На раннем, среднем и позднем этапах сукцессии определяли состав бактериальных сообществ методом высокопроизводительного секвенирования библиотек по вариабельному участку V4 гена 16S рРНК. Филогенетический анализ показал, что разнообразие бактериального сообщества соломы по мере ее разложения в черноземе и дерново-подзолистой почве увеличивалось от 51 и 79 филотипов на третий день сукцессии, до 213 и 310 филотипов к концу эксперимента. На ранних этапах сукцессии (третий день) состав бактериального сообщества был представлен Proteobacteria, Firmicutes и Bacteroidetes, на более поздних этапах (161 день) к ним добавились Actinobacteria. Для обоих типов почв бактериальная сукцессия при разложении соломы имела общие черты: начинают разложение соломы представители родов Pseudomonas, Stenotrophomonas из семейства Xanthomonaceae и рода Chitinophaga (Bacteroidia). На последующих этапах сукцессии, помимо актинобактерий, обнаруживались Firmicutes и Bacteroidetes. Следует отметить, что на протяжении всего периода разложения соломы в микробном сообществе присутствовали бактерии семейства Rhizobiaceae.
ВВЕДЕНИЕ
Процесс разложения растительных остатков в почвах является одной из важнейших статей глобального круговорота углерода и по количеству циркулирующего углерода уступает только процессу фотосинтеза. Поэтому не удивительно, что деструкция растительных остатков остается в центре внимания исследователей, несмотря на то, что основные факторы, контролирующие разложение, были выявлены в 1929 г. [27]. Однако понимание роли почвенных микробных сообществ в связи с функциями экосистем развивается только сейчас благодаря разработке новых методов для изучения структуры сообществ и метаболической активности [14, 23]. Лучшее знание микробных популяций и видов деятельности, связанных с деградацией органического углерода и структурированием почвенных сообществ в соответствии с источником углерода, может послужить концептуальной основой, помогающей определить связь между структурой сообществ почвенных бактерий и их функцией в агроэкосистеме [15].
В процессах разложения растительных остатков в пахотных почвах, в отличие от естественных, главную роль зачастую играют бактерии, а не грибы. Более того, использование современных методов выявило значительный вклад бактерий даже в разложение лигнина и лигноцеллюлозных комплексов древесины, в сравнении с предшествующим убеждением о главенстве грибной микрофлоры в этих процессах [29]. Поэтому было важно изучить структуру бактериальных сообществ при трансформации соломы.
Влияние структуры сообщества почвенных микроорганизмов на результаты трансформации растительных остатков изучено недостаточно. Возможно, это связано с тем, что на состав и функционирование почвенного микробиома влияет множество факторов (например, влажность почвы, температура, pH, содержание органического вещества и наличие питательных веществ, состав растительности и т. д.) и их сочетание [10, 13]. Поэтому не так просто вычленить из общей наблюдаемой картины особенности, связанные непосредственно с различиями в составе сообществ. Так, на биотрансформацию органического вещества структура микробного сообщества оказывает меньшее воздействие, чем изменения климата и/или изменение качества подстилки [13]. Один из способов – постановка экспериментов в строго контролируемых условиях, причем с использованием физического разделения субстрата от почвы. Очень важным стимулом к проведению этих экспериментов сегодня является доступность принципиально новых подходов, связанных с использованием высокопроизводительного секвенирования, позволяющего оценить динамику микробиоты во всей ее полноте [2, 14, 23].
Одним из множества факторов, определяющих характер разложения растительных остатков и структуру микробных сообществ в экологических нишах, связанных с растением, например, в ризосфере, является тип почвы [2, 19]. Относительно этого меньше влияние на структуру микробного сообщества вида биома [18] или землепользования [22]. Это связано с различиями в таких ключевых физико-химических свойствах почвы как рН [18, 22, 28], количество и качество органического вещества [14, 17]. Однако в опытах с насыпными почвами, перемещенными в другие климатические условия, было показано, что тип почвы может быть и не главным фактором, влияющим на структуру микробного сообщества [26]. С одной стороны, это влияние существенно затрудняет понимание особенностей процесса, так как фактор почвы, как уже указывалось ранее, наиболее существенен. Однако в том случае, когда для эксперимента взяты разные почвы, это позволяет вычленить общие для разных типов почв элементы динамики почвенного микробиома.
Солома зерновых культур, является важным возобновляемым источником органического вещества, ее внесение в пахотные почвы получает все большее распространение. На микробные процессы разложения соломы в почве влияют многие абиотические факторы, включая содержание влаги [10], засоление [23], качество и размер соломы [8] и так далее. Эти факторы могут повлиять на доступность соломы почвенным микроорганизмам и, таким образом, изменить скорость колонизации и характер разложения. Почвы являются своеобразным резервуаром микробного разнообразия. Любой субстрат, поступивший в почву, будет инициировать развитие микроорганизмов с учетом состава субстрата и исходя из набора таксонов в окружающей почве. Это должны быть в основном микроорганизмы, которые способны перерабатывать данный субстрат, однако для разных почв это могут быть разные, но выполняющие одинаковые функции организмы.
Изучение состава микробных сообществ, участвующих в деструкции свежего органического вещества в пахотных почвах затруднено в случае перемешивания почвы и субстрата. Наиболее четко наличие сукцессии микробных сообществ при разложении растительных остатков было выявлено при анализе самих остатков, а не для дейтритосферы или основной почвы [6, 24]. С пространственной точки зрения разлагающиеся растительные остатки увеличивают гетерогенность почвы, создавая специфическую генетическую структуру микробных сообществ с образованием градиента от разлагаемого субстрата к почве без органического вещества [24]. Сделан вывод, что детритосфера и разлагающаяся биомасса соответствуют различным трофическим и функциональным нишам для микроорганизмов. В целом эти результаты свидетельствуют, что растительные остатки, как и живые корни, представляют “горячие точки” легкодоступного источника углерода и энергии, которые приводят к важной динамике сообщества, особенно когда почвенная система ограничена субстратом в отношении роста микроорганизмов. Растительные остатки, в том числе и солома, всегда обсеменены микроорганизмами, многие из которых могут обладать способностью к деградации сложных органических субстратов. Эти “нативные” микроорганизмы получают преимущество за счет своего физического положения на субстрате при внесении соломы в почву и могут существенно исказить влияние типа почвы на состав микробного сообщества. Следовательно, одним из способов более четкого выявления различий между типами почв по составу микробного деструктивного сообщества, может стать анализ его динамики во внесенных стерильных растительных остатках, помещаемых в почву в нейлоновых мешочках с отверстиями, позволяющими микроорганизмам свободно достигать разлагаемого субстрата. Подобный подход со стерильным субстратом был применен при определении целлюлозоразлагающего метагенома в рубце коров [20], и с нестерильной соломой кукурузы [26].
Цель работы: исследование сукцессии структуры бактериальных сообществ при разложении соломы овса в разных типах почв.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В модельном эксперименте изучали разложение соломы в образцах гумусовых горизонтов чернозема (Haplic Chernozem (Pachic) по WRB, Собщ 4.86 ± 0.12%; рНсол 6.40 ± 0.08; Nобщ 0.533 ± ± 0.02) и дерново-подзолистой почвы (Albic Retisol (Abruptic, Ochric) по WRB, Собщ 1.01 ± 0.02%; рНсол 5.47 ± 0.02; Nобщ 0.212 ± 0.01). Почвы: чернозем типичный (Каменная степь, Воронежская обл.) и дерново-подзолистая почва (Псковская обл., ОПХ “Родина”) отобраны в 2018 г. с залежных участков с глубины 5–20–25 см. В опыте использовали измельченную солому овса (фракция 0–2 мм) со следующими показателями: зольность 9.98 ± 2.04, Nобщ 1.897 ± 0.012, С : N 23.5, содержание водорастворимого углерода 11.8 ± 0.50 г/кг. Навески соломы (1 г) в мешочках размером 3 × 5 см, сшитых из нейлоновой ткани, были стерилизованы в отдельном полиэтиленовом пакете для каждого сосуда эксперимента с использованием электронно-лучевой стерилизации (18 кГр) в ООО “РАД” (г. Санкт-Петербург).
Для эксперимента использовали квадратные пластиковые сосуды объемом 2.3 л. Навески подготовленных почв (усредненных и просеянных через сито с диаметром отверстий 5 мм), увлажняли до 60% от полной влагоемкости (полная влагоемкость насыпных образцов для чернозема и дерново-подзолистой почвы 74.52 ± 1.66 и 42.48 ± 0.95% соответственно) и оставляли инкубироваться в условиях эксперимента на 2 нед. для установления равновесия. Этим приемом исключали влияние накладки эффекта временного увеличения эмиссии СО2 из почвы после ее размалывания и увлажнения на рост дыхания после внесения соломы [11, 30]. Предварительно смоченные стерильной водой мешочки с соломой (по 15 штук на сосуд) помещали в почву вертикально на глубину 0.5–4 см. Повторность опыта – по 5 сосудов контроли и по 7 сосудов в вариантах с внесением соломы (в двух дополнительных сосудах отбор проб не производился, заложены для измерения дыхания в конце опыта, когда количество мешочков, попадающее под изолирующую камеру в основных сосудах, уменьшится). Расположение сосудов рендомизированное. Влажность поддерживалась на постоянном уровне бидистиллированной водой (сверху неплотно прикрыты пленкой для пищевых продуктов для уменьшения скорости высыхания и добавление воды по весу из пульверизатора два раза в неделю). Температура поддерживалась на уровне 28 ± 1°С.
Отбор образцов соломы осуществляли путем изъятия одного мешочка из каждого сосуда варианта (кроме дополнительных сосудов), при длительности опыта 6 мес. отобрано 15 проб через 3–21 суток. Отобранные образцы замораживали и хранили при –70°C. Анализы соломы и почвы проводили общепринятыми методами [1] в 3–5-кратной повторности. На всем протяжении эксперимента еженедельно измеряли уровень эмиссии CO2 абсорбционным методом [4].
Выделение ДНК производили с использованием набора реактивов Macherey-Nagel NucleoSpin Soil (“Macherey-Nagel”, Германия) в соответствии с рекомендациями производителя. Механическое разрушение образца осуществлялось с помощью гомогенизатора Precellys 24 (“Bertin Technologies”, Франция). Для оценки качества полученной ДНК проводился электрофорез в 1%-ном агарозном геле в ×0.5 TAE буфере. Средняя концентрация ДНК в пробе составляла 50 нг/мкл. В дальнейшем матрицу использовали для создания библиотеки ампликонов, полученную методом ПЦР с применением универсальных праймеров на вариабельный участок V4 гена 16S рРНК: F515 – GTGCCAGCMGCCGCGGTAA/R806 – GGACTACVSGGGTATCTAAT [7], включающих служебные последовательности и баркоды Illumina. Дальнейшие подготовка библиотек и секвенирование проводились в соответствии с рекомендациями производителя на платформе Illumina MiSeq (“Illumina”, США) с использованием набора реактивов MiSeq® ReagentKit v3 (600 cycle) с двусторонним чтением (2*300 н).
Первичная обработка нуклеотидных последовательностей, в частности демультиплексирование образцов и обрезание баркодов, выполнена ПО Illumina. Дальнейший анализ проводился в программной среде R с помощью пакета dada2, который использует денойзинг с последующим объединением прямых и обратных прочтений и восстановлением исходных филотипов (Amplicon Sequence Variant, ASV), также в нем осуществлялось устранение химер и таксономическая идентификация полученных ASV при помощи классификатора, обученного на базе данных SILVA [25]. Для уточнения таксономической принадлежности филотипов была проведена дополнительная проверка части последовательностей при помощи алгоритма blast-n [5] по базе данных GenBank [12], которая затронула только ASV с высокой частотой встречаемости. В результате данной проверки были удалены филотипы, относящиеся к рРНК пластид и митохондрий, а также для нескольких ASV удалось уточнить таксономию до уровня типа, класса, порядка или семейства. Для филогенетического анализа и построения филогенетических деревьев использовались программные пакеты MEGA7 с применением метода neighbour-joining и плагин fragment-insertion sepp в рамках пакета QIIME2 [9], также в QIIME2 проводилась оценка таксономического разнообразия сообществ (α- и β-разнообразие). Результаты анализа β-разнообразия представлены с помощью методов многомерной статистики (анализ главных компонент, PCA), а также в программе Emperior c использованием метрики UniFrac. Для оценки вклада отдельных филотипов в различия между сообществами, основанного на частотах ASV, использовался статистический метод SIMPER (Similarity Percentage) [12], входящий в программный пакет PAST.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Использованная для модельного эксперимента солома овса за счет узкого соотношения С : N (23.5), измельчения и значительного содержания водорастворимого углерода (2.6% от общего углерода) является доступным для микроорганизмов субстратом. Поэтому динамика скорости выделения углекислого газа в вариантах с внесением соломы для обеих почв характерна скорее для легкоразлагаемых субстратов, например, глюкозы [3]: быстрое разложение в начале опыта, дающее узкий пик прироста эмиссии углекислоты (3 день) и далее спад. Одновременно, с первых дней, идет медленное нарастание дыхания вследствие разложения более трудноразлагаемых веществ (целлюлозы, гемицеллюлозы и др.). При анализе динамики уровня эмиссии CO2 за счет внесения соломы, используя показания контрольных почв в качестве базового уровня, выявлено, что суммарные потери углерода из дерново-подзолистой почвы больше, чем из чернозема: соответственно 3913 ± 668 и 2981 ± 297 СО2 мг/м2 сутки (рис. 1). Особенно это заметно к концу опыта, когда в черноземе были более низкие значения эмиссии углекислоты в вариантах с соломой по сравнению с контролем. Следует отметить, что уровень выделения углекислого газа выше в среднем на 100 мг/м2 сутки в течение всего срока наблюдений в контрольных вариантах для чернозема, чем для дерново-подзолистой почвы. Вероятно, большая эмиссия СО2 при минерализации соломы в дерново-подзолистой почве связана с тем, что чернозем относится к числу более устойчивых экосистем с высоким уровнем гумификации.
Рис. 1.
Динамика приращения эмиссии CO2 из чернозема (ЧЗ) и дерново-подзолистой (ДП) почвы за счет внесения соломы; уровень в контрольных почвах (без субстрата) принят за ноль.
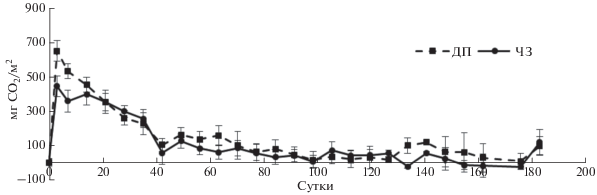
На основании кривых дыхания почв были выбраны точки для определения состава микробного сообщества путем выделения этапов разложения соломы: ранний (3 и 28 дни), средний (91 день) и поздний (161 день). Оценка состава бактериального микробного сообщества в соломе осуществлялась с использованием высокопроизводительного секвенирования библиотек гена 16S рРНК.
По результатам секвенирования ампликонных библиотек участка гена 16S рРНК было получено 575597 прочтений, 295593 из которых вошли в последующий анализ. Филогенетический анализ показал высокое разнообразие бактериального сообщества соломы, в последний срок было идентифицировано соответственно для чернозема и дерново-подзолистой почвы 213 и 310 филотипов из 17 фил. Почва была единственным источником микроорганизмов, участвующих в разложении соломы в опыте, поэтому состав микробного сообщества соломы по основным филам близок к таковому для почв. Наиболее представленные бактериальные филы на 3 день были Proteobacteria, Firmicutes, Bacteroidetes, на 161 день к ним добавились Actinobacteria (рис. 2). Стимуляцию таксона Actinobacteria к концу разложения отмечают многие исследователи [6, 24]. Можно отметить не только наличие, но и постепенное нарастание представленности неидентифицированных последовательностей в динамике. Для соломы, в отличие от почв, выявлено низкое обилие филы Acidobacteria, которая обычно является одной из наиболее распространенных таксономических групп почвенных бактерий. Аналогично отмечали уменьшение их доли для соломы пшеницы [6], также наблюдали отрицательную связь между уровнем внесения органических веществ в почве и обилием Acidobacteria [17]. Это позволяет сделать вывод о неучастии ацидобактерий в разложении соломы. Низкая представленность, главным образом на поздних этапах разложения, отмечается и для архей.
Рис. 2.
Динамика представленности основных фил бактериального сообщества соломы в динамике в зависимости от почвы. Обозначения: 1 – Archaea; Thaumarchaeota, 2 – Acidobacteria, 3 – Actinobacteria, 4 – Bacteroidetes, 5 – Firmicutes, 6 – Planctomycetes, 7 – Proteobacteria, 8 – Verrucomicrobia, 9 – Bacteria; Other (филы с низкой долей), 10 – unclassified Bacteria, 11 – Unclassified; Other.
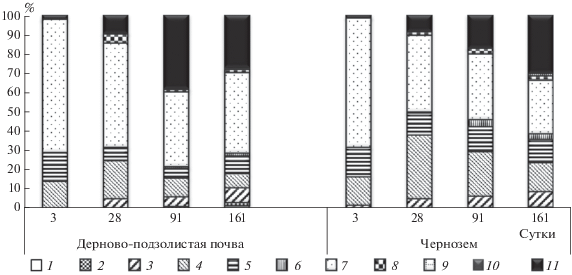
Состав микробиома соломы, начиная с 28 дня, имеет явные отличия в зависимости от источника микрофлоры (типа почв). Следовательно, наблюдаемые различия в функционировании микробных сообществ (по дыханию), происходящих из разных почв, нашли свое отражение в их составе. Роль типа почв, как источника бактерий, определялась, вероятно, как величиной рН, так и качеством и количеством органического вещества в них [14, 17, 18, 22, 28]. Для дерново-подзолистой почвы, по сравнению с черноземом, в среднем выше доля Proteobacteria и меньше Bacteroidetes, больше вклад неидентифицированных бактерий. Стоит отметить, что в соломе, разлагающейся в черноземе, практически нет ни архей, ни ацидобактерий. Для более кислой дерново-подзолистой почвы в соломе отмечено появление Acidobacteria начиная с 28 дня и большая их представленность на 161 день (1.63 против 0.15%).
Соотношение грамположительных и грамотрицательных бактерий характеризует олиготрофность почвенных процессов. Известно, что грамотрицательные бактерии требуют более богатого субстрата и на первых сроках при разложении соломы пшеницы [6] или соломы кукурузы [26] их количество увеличивается. В нашем опыте при биодеструкции соломы овса также наблюдали, что соотношение грамположительных и грамотрицательных бактерий увеличивается с 0.18–0.21 на 3 день до 0.31–0.41 на 161 день, то есть доля грамотрицательных бактерий постепенно уменьшается к поздним этапам разложения и олиготрофность микробного сообщества растет.
Наблюдали усложнение состава микробных сообществ соломы во времени после начала разложения. Наиболее вероятно, что параллельно идут два процесса: постепенное заселение соломы микроорганизмами из почвы через нейлоновую ткань и увеличение количества видов, задействованных в разложении труднодоступных соединений соломы. Обогащение стерильной соломы микроорганизмами происходило быстро – на третий день количество обнаруживаемых филотипов составило 46 в черноземе и 79 в дерново-подзолистой почве (табл. 1). Основной рост биоразнообразия произошел в течение первого месяца разложения, далее изменения слабее. Более сложные для деградации субстраты (например, лигнин), оставшиеся к последним этапам разложения, могут привести к стимуляции более разнообразного бактериального консорциума, способного их разлагать [24]. Особенностью нашего подхода, помимо стерильного субстрата, является изучение разложения соломы в “концентрированной” и физически отделенной от основной почвы экологической нише (мешочек с соломой), поэтому часть микробиоты поздних стадий разложения, плохо изученная и идентифицированная из-за меньшего обилия, нами была учтена. Рост обилия отдельных, мало представленных в сообществе исходной почвы, видов в 100–350 раз был отмечен для консорциумов, сформировавшихся на поздних стадиях разложения различных растительных остатков [21]. Стохастический фактор – “first come, first bite” также мог повлиять на процесс и таким образом стимулировать микробное разнообразие, как это было показано для консорциумов, отобранных с предварительно разлагавшихся остатков [21].
Таблица 1.
Индексы, характеризующие биоразнообразие микробных сообществ соломы
| Показатель | Дерново-подзолистая почва | Чернозем | ||||||
|---|---|---|---|---|---|---|---|---|
| 3 день | 28 день | 91 день | 161 | 3 | 28 | 91 | 161 | |
| Количество ОТЕ* (филотипов) | 79.0 ± 8.0 | 253.8 ± 61.8 | 300.1 ± 35.5 | 313.0 ± 41.3 | 46.3 ± 15.7 | 154.4 ± 38.4 | 170.3 ± 18.7 | 212.5 ± 40.6 |
| Индекс Шеннона | 5.07 ± 0.31 | 6.86 ± 0.38 | 7.01 ± 0.18 | 7.23 ± 0.28 | 4.39 ± 0.66 | 5.75 ± 0.50 | 5.98 ± 0.46 | 6.69 ± 0.33 |
| Индекс Пиелу | 0.81 ± 0.04 | 0.87 ± 0.01 | 0.86 ± 0.01 | 0.88 ± 0.02 | 0.80 ± 0.06 | 0.82 ± 0.04 | 0.87 ± 0.06 | 0.87 ± 0.02 |
| Индекс Фейта | 9.9 ± 0.8 | 33.4 ± 5.0 | 41.9 ± 4.3 | 42.9 ± 4.4 | 5.8 ± 1.3 | 18.0 ± 2.8 | 23.2 ± 3.0 | 30.7 ± 4.1 |
Аналогично меняются и все другие показатели биоразнообразия (индекс Фейта, индекс Шеннона), свидетельствуя о его росте с увеличением срока разложения соломы и недоступности субстрата. Необходимо отметить большее разнообразие бактериального сообщества разлагающейся соломы в дерново-подзолистой почве по сравнению с черноземом. Это противоречит данным, что микробные сообщества кислых почв менее разнообразны [16], но, возможно, причина в том, что в данном случае объектом исследования является не все микробное сообщество почв, а только его часть.
Метод главных компонент позволил выявить влияние типа почвы и времени разложения соломы на состав микробных сообществ (рис. 3). При анализе как невзвешенных данных (показывающем различия по качественному составу микробных сообществ, таксономическому разнообразию), так и взвешенных (включая представленность или долю каждого таксона), наиболее значительные различия видны в зависимости от типа почв. Следовательно, при постоянных гидротермических условиях, созданных в лаборатории, более существенным фактором, влияющим на состав микробиома соломы, а через него и на результат разложения оказался тип почвы, а не длительность разложения. В естественных условиях с перемещением типовых почв по климатическим зонам [26], фактор типа почв оказался слабее, чем климат. Хоть и слабее, но сроки отбора влияли на состав бактериального сообщества соломы. Наиболее существенное различие в динамике для каждой почвы наблюдали между микробиомом, начинающим разложение соломы (третий день) и 28 днем, аналогично индексам, характеризующим биоразнообразие. Возможно, что это вызвано не только сукцессией микробных сообществ, но и влиянием на результаты третьего дня ДНК мертвого (как результата стерилизации) микробного сообщества соломы, резко отличающегося от такового в обеих почвах. Различия по составу бактериального сообщества чернозема сохраняются для всех сроков анализа, тогда как для дерново-подзолистой почвы последние два срока очень близки, особенно по таксономическому составу.
Рис. 3.
Различия состава микробных сообществ по метрике UniFrac в координатах первых двух главных компонент (метод PCA). Обозначения: А – невзвешенные данные; Б – взвешенные данные. Форма: звезда – дерново-подзолистая почва; квадрат – чернозем. Цвет: красный – срок 3 дня; синий – срок 28 дней; зеленый – срок 91 день; фиолетовый – срок – 161 день.
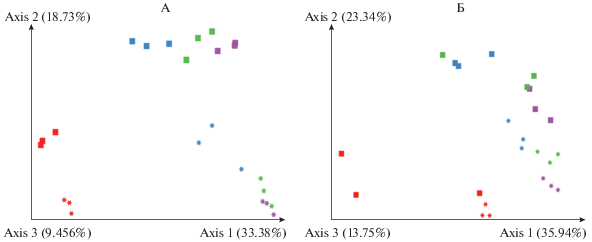
Обнаруживаются не только различия по составу микроорганизмов, ведущих разложение соломы в разных почвах, но и общие черты для обеих почв, что свидетельствует о едином направлении сукцессии микроорганизмов при разложении соломы, независимо от почвы. Наблюдаемая общепринятая динамика структуры микробного сообщества, по-видимому, связана с изменениями в наличии и качестве углеродных ресурсов, происходящими в процессе деградации соломы. В соответствии с экологическими характеристиками копиотрофных и олиготрофных популяций (упрощенно r- и K-стратегов), на ранних стадиях микробной сукцессии на свежих растительных остатках, поступивших в почву, будут доминировать копиотрофы и r-стратеги, при этом количество олиготрофов (K-стратегов) возрастает в относительном количестве при увеличении степени разложения субстрата. Так, различные представители рода Pseudomonas преобладающие на третий день (Proteobacteria, относимые к r-стратегам), постепенно сокращают свое участие в деструкционных процессах. В то же время представители филы Actinobacteria начинают появляться в сообществах разлагающих солому с 28-го дня, и их разнообразие постоянно увеличивается для обеих почв.
При оценке вклада каждого из таксонов в суммарное различие между бактериальными сообществами были выявлены филотипы, которые отвечают за расхождение сообществ на различных сроках проведения эксперимента. В эту категорию вошли только те ASV, вклад которых в различия между оцениваемыми сообществами составил не менее 1% по результатам статистического теста SIMPER (Similarity Percentage). Для дерново-подзолистой почвы и чернозема их число составило 42 и 46 филотипов соответственно (рис. 4). Рисунок позволяет наглядно показать сходство и различия в сукцессии при разложении соломы в разных типах почвы. В большинстве случаев почвы различаются по наличию и/или представленности (в процентах), динамике (уменьшается их доля или увеличивается) отдельных филотипов (виды, штаммы). Фактически, для каждого типа почв характерен набор разных филотипов, даже при сходном их филогенетическом положении. Наиболее значительные различия по набору филотипов в разных типах почв отмечены для Xanthomonaceae, Chitinophagaceae и Pseudomonadaceae.
Рис. 4.
Разнообразие и численность филотипов, наибольшим образом повлиявших на расхождение сообществ прокариот, разлагающих солому в дерново-подзолистой почве и черноземе на различных сроках инкубации по результатам статистического теста SIMPER. Обозначения: ДП – дерново-подзолистая почва, ЧЗ – чернозем; сроки: 01 – 3 дня; 05 – 28 дней; 10 – 91 день; 14 – 161 день. Значения в тепловой карте соответствуют процентной доле филотипа в сообществе. Шкала дендрограммы отражает процент различающихся нуклеотидов в последовательностях, указана статистическая поддержка кластеров (bootstrap).
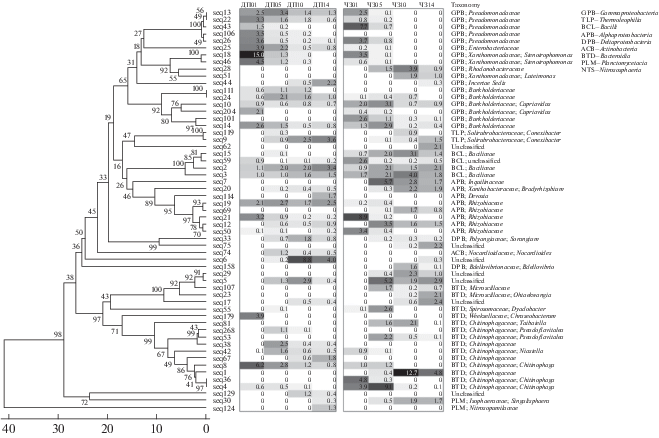
Наибольший вклад на ранних стадиях разложения соломы отмечен для Gammaproteobacteria и отдельных филотипов Bacteroidetes. Начинают разложение легкодоступных органических соединений соломы представители рода Pseudomonas, рода Stenotrophomonas из семейства Xanthomonaceae и род Chitinophaga (Bacteroidia). Известно, что различные штаммы Pseudomonas sp. способны расщеплять органические материалы на более простые соединения, они являются копиотрофными организмами [6]. В черноземе они играют значительную роль только в первый срок, тогда как для дерново-подзолистой почвы их вклад остается заметен и в последний срок. Pseudomonas spp. и Neurospora sp. были доминирующими на ранней стадии при разложении соломы пшеницы [6]. Bacteroidetes включают бактерии, широко распространенные в биосфере и выделенные из многих различных мест обитания, включая не только почву, но и кишечник животных. Возможно, что высокое их обилие связано с особенностями закладки эксперимента, когда создается высокая концентрация растительной биомассы. Филотипы этого таксона были обильны на всех этапах разложения, однако часто это были разные представители не только в зависимости от типа почвы, но и срока. На третий день преобладали филотипы рода Chitinophaga, причем для чернозема 4, для дерново-подзолистой почвы – 2. Даже совпавшие филотипы в разных почвах имели неодинаковое обилие либо зеркальную динамику. Чаще бактероиды имели заметную (более 1%) представленность на средних и последних сроках анализа; помимо семейства Chitinophagaceae (рода: Chitinophaga, Flavitalea, Niastella, Pseudoflavitalea, Taibaiella и неидентифицированных представителей семейства) в разложении соломы принимали участие Microscillaceae (Ohtaekwangia, более характерны для чернозема), Spirosomaceae (род Dyadobacter). Аналогично вели себя и бактерии из филы Bacilli, то есть их состав и динамика сильно зависели от типа почвы. Интересно, что актинобактерии, вносящие существенный вклад в разложение соломы, практически не попали в число филотипов, существенно влияющих на различия между сообществами.
Однако не все обнаруженные филотипы были способны к деструкции растительных остатков. Данные, приведенные на рисунке 4, свидетельствуют о значительном вкладе семейства Rhizobiaceae, к которому, в частности, относятся клубеньковые бактерии, в состав микробных сообществ соломы для обеих почв. Вероятно, образующихся легкодоступных органических соединений при интенсивном разложении соломы в течение всего периода наблюдений достаточно для обеспечения существенного вклада данных микроорганизмов в состав микробиома соломы.
ЗАКЛЮЧЕНИЕ
Благодаря использованию стерильной соломы удалось выявить существенное влияние микробоценозов исследуемых типов почв на состав микробных сообществ разлагающейся соломы овса. Это может быть связано с тем, что обычно на соломе (или других растительных остатках) присутствуют микроорганизмы, которые, включаясь в ее деструкцию, “маскируют” влияние других факторов. Различия в таксономическом составе сообществ за счет типа почв, приводили к тому, что зачастую одинаковые функции выполняли разные филотипы при близком их таксономическом положении (принцип дублирования). Зафиксировано увеличение с ростом разложения соломы доли и разнообразия неидентифицированных последовательностей в обеих почвах. Возможно, обнаруженные нами неидентифицированные последовательности принадлежат нативной почвенной микрофлоре, как медленно растущей на сложных субстратах (нет возможности повторить в лабораторных средах), так и растущей только в ассоциациях (не способны расти в отсутствии партнеров). В обоих случаях микроорганизмы являются некультивируемыми, чем объясняется их отсутствие в базах данных. Сукцессия микробных сообществ, при использованной нами методике проведения опыта, была четко видна и имела общие черты в обоих типах почв.
Список литературы
Агрохимические методы исследования почв / Под ред. Соколова А.В. М.: Наука, 1975. 656 с.
Зверев А.О., Першина Е.В., Проворов Н.А., Андронов Е.Е., Серикова Е.Н. Метагеномная характеристика ризосферного эффекта при выращивании злаковых культур в черноземной и дерново-подзолистой почвах // Сельскохозяйственная биология. 2016. Вып. 51(5). С. 654–663. https://doi.org/10.15389/agrobiolody.2016.5.654rus
Паников Н.С. Кинетические механизмы процессов разложения органического вещества в почве // Проблемы почвоведения. М., 1990. С. 95–101.
Шарков И.Н. Сравнительная характеристика двух модификаций абсорбционного метода определения дыхания почв // Почвоведение. 1987. № 10. С. 153–157.
Altschul S.F., Gish W., Miller W., Myers E.W., Lipman D.J. Basic local alignment search tool // J. Mol. Biol. 1990. V. 215. P. 403–410. https://doi.org/10.1016/S0022-2836(05)80360-2
Bastian F., Bouziri L., Nicolardot B., Ranjard L. Impact of wheat straw decomposition on successional patterns of soil microbial community structure // Soil Biol. Biochem. 2009. V. 41. № 2. P. 262–275. https://doi.org/10.1016/j.soilbio.2008.10.024
Bates S.T., Berg-Lyons J.G., Caporaso W.A., Walters W.A., Knight R., Fierer N. Examining the global distribution of dominant archaeal populations in soil // ISME J. 2010. № 5. P. 908–917. https://doi.org/10.1038/ismej.2010.171
Bending G.D., Turner M.K., Jones J.E. Interactions between crop residue and soil organic matter quality and the functional diversity of soil microbial communities // Soil Biol. Biochem. 2002. V. 34. № 8. P. 1073–1082. https://doi.org/10.1016/S0038-0717(02)00040-8
Bolyen E., Rideout J.R., Dillon M.R., Bokulich N.A., Abnet C.C., Al-Ghalith G.A., Alexander H. et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2 // Nat. Biotechnol. 2019. № 37. P. 852–857. https://doi.org/10.1038/s41587-019-0209-9
Brockett B.F., Prescott C.E., Grayston S.J. Soil moisture is the major factor influencing microbial community structure and enzyme activities across seven biogeoclimatic zones in western Canada // Soil Biol. Biochem. 2012. V. 44. № 1. P. 9–20. https://doi.org/10.1016/j.soilbio.2011.09.003
Carbone M.S., Still C.J., Ambrose A.R., Dawson C.J., Still A.R., Ambrose T.E., Dawson A.P., Williams C.M., Boot S.M., Schaeffer J., Schimel P. Seasonal and episodic moisture controls on plant and microbial contributions to soil respiration // Oecologia. 2011. V. 167. № 1. P. 265–278. https://doi.org/10.1007/s00442-011-1975-3
Clark K., Karsch-Mizrachi I., Lipman D.J., Ostell J., Sayers E.W. GenBank // Nucleic Acids Res. 2016. V. 44(D1). P. D67–D72. https://doi.org/10.1093/nar/gkv1276
Cleveland C.C., Reed S.C., Keller A.B., Nemergut D.R., O’Neill S.P., Ostertag R., Vitousek P.M. Litter quality versus soil microbial community controls over decomposition: a quantitative analysis // Oecologia. 2014. V. 174. № 1. P. 283–294. https://doi.org/10.1007/s00442-013-2758-9
Crecchio C., Curci M., Pellegrino A., Ricciuti P., Tursi N., Ruggiero P. Soil microbial dynamics and genetic diversity in soil under monoculture wheat grown in different long-term management systems // Soil Biol. Biochem. 2007. V. 39. № 6. P. 1391–1400. https://doi.org/10.1016/j.soilbio.2006.12.016
Drenovsky R.E., Feris K.P., Batten K.M., Hristova K. New and current microbiological tools for ecosystem ecologists: towards a goal of linking structure and function // Am. Midland Natur. 2008. V. 160. № 1. P. 140–160. https://doi.org/10.1674/0003-0031(2008)160[140: NACMTF]2.0.CO;2
Fierer N., Jackson R.B. The diversity and biogeography of soil bacterial communities // Proc. Nation. Acad. Sci. 2006. V. 103. № 3. P. 626–631. https://doi.org/10.1073/pnas.0507535103
Fierer N., Bradford M.A., Jackson R.B. Toward an ecological classification of soil bacteria // Ecology. 2007. V. 88. № 6. P. 1354–1364. https://doi.org/10.1890/05-1839
Fierer N., Strickland M.S., Liptzin D., Bradford M.A., Cleveland C.C. Global patterns in belowground communities // Ecol. letters. 2009. V. 12. № 11. P. 1238–1249. https://doi.org/10.1111/j.1461-0248.2009.01360.x
Girvan M.S., Bullimore J., Pretty J.N., Osborn A.M., Ball A.S. Soil type is the primary determinant of the composition of the total and active bacterial communities in arable soils // Appl. Environ. Microbiol. 2003. V. 69. № 3. P. 1800–1809. https://doi.org/10.1128/AEM.69.3.1800-1809.2003
Hess M., Sczyrba A., Egan R., Kim T.W., Chokhawala H., Schroth G., Luo S. et al. Metagenomic discovery of biomass-degrading genes and genomes from cow rumen // Sci. 2011. V. 331. (6016). P. 463–467. https://doi.org/10.1126/science.1200387
Jiménez D.J., de Lima Brossi M.J., Schückel J., Kra-čun S.K., Willats W.G. T., van Elsas J.D. Characterization of three plant biomass-degrading microbial consortia by metagenomics-and metasecretomics-based approaches // Appl. Microbial. Biotech. 2016. V. 100. № 24. P. 10463–10477. https://doi.org/10.1007/s00253-016-7713-3
Lauber C.L., Strickland M.S., Bradford M.A., Fierer N. The influence of soil properties on the structure of bacterial and fungal communities across land-use types // Soil Biol. Biochem. 2008. V. 40 № 9. P. 2407–2415. https://doi.org/10.1016/j.soilbio.2008.05.021
Muhammad S., Müller T., Joergensen R.G. Decomposition of pea and maize straw in Pakistani soils along a gradient in salinity // Biol. Fert. Soils. 2006. V. 43. № 1. P. 93–101. https://doi.org/10.1007/s00374-005-0068-z
Nicolardot B., Bouziri L., Bastian F., Ranjard L. A microcosm experiment to evaluate the influence of location and quality of plant residues on residue decomposition and genetic structure of soil microbial communities // Soil Biol. Biochem. 2007. V. 39. № 7. P. 1631–1644. https://doi.org/0.1016/j.soilbio.2007.01.012
Quast C., Pruesse E., Yilmaz P., Gerken J., Schweer T., Yarza P., Peplies J., Glöckner F.O. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools // Nucl. Acids Res. 2013. V. 41 (D1). P. D590–D596. https://doi.org/10.1093/nar/gks1219
Sun B., Wang X., Wang F., Jiang Y., Zhang X.X. Assessing the relative effects of geographic location and soil type on microbial communities associated with straw decomposition // Appl. Environ. Microbiol. 2013. V. 79. № 11. P. 3327–3335. https://doi.org/10.1128/AEM.00083-13
Tenney F.G., Waksman S.A. Composition of natural organic materials and their decomposition in the soil: IV. The nature and rapidity of decomposition of the various organic complexes in different plant materials, under aerobic conditions // Soil Sci. 1929. V. 28. № 1. P. 55.
Wakelin S.A., Macdonald L.M., Rogers S.L., Gregg A.L., Bolger T.P., Baldock J.A. Habitat selective factors influencing the structural composition and functional capacity of microbial communities in agricultural soils // Soil Biol. Biochem. 2008. V. 40. № 3. P. 803–813. https://doi.org/10.1016/j.soilbio.2007.10.015
Wilhelm R.C., Singh R., Eltis L.D., Mohn W.W. Bacterial contributions to delignification and lignocellulose degradation in forest soils with metagenomic and quantitative stable isotope probing // The ISME J. 2019. V. 13. № 2. P. 413. https://doi.org/10.1038/s41396-018-0279-6
Wu H.J., Lee X. Short-term effects of rain on soil respiration in two New England forests // Plant and Soil. 2011. V. 338. № 1–2. P. 329–342. https://doi.org/10.1007/s11104-010-0548-2
Дополнительные материалы отсутствуют.


