Почвоведение, 2020, № 12, стр. 1508-1520
Оценка влияния технологии no-till и вспашки на микробиом южных агрочерноземов
Д. А. Никитин a, *, Е. А. Иванова a, А. Д. Железова a, М. В. Семенов a, Р. Г. Гаджиумаров b, А. К. Тхакахова a, Т. И. Чернов a, Н. А. Ксенофонтова a, О. В. Кутовая a
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
b Северо-Кавказский федеральный научный аграрный центр
356241 Ставропольский край, Михайловск, ул. Никонова, 49, Шпаковский р-н, Россия
* E-mail: dimnik90@mail.ru
Поступила в редакцию 03.05.2020
После доработки 02.06.2020
Принята к публикации 27.06.2020
Аннотация
Проведена оценка значений количественных характеристик микробного сообщества в южных агрочерноземах Ставропольского края, обрабатываемых по технологии no-till и традиционной вспашке с оборотом пласта, для вариантов с различными сельскохозяйственными культурами и при внесении/отсутствии минеральных удобрений. Численность эколого-трофических групп микроорганизмов (азотфиксаторов, аммонификаторов, денитрификаторов, амилолитиков, целлюлолитиков) оценивали с помощью классического метода посева на элективные среды, а количество копий рибосомальных генов архей, бактерий и грибов – с использованием полимеразной цепной реакции (ПЦР) в реальном времени. При вспашке увеличивается численность культивируемых аэробных аммонификаторов, денитрификаторов, аэробных целлюлолитиков, актиномицетов и микромицетов; при прямом посеве (no-till) – численность анаэробных целлюлолитиков и азотфиксаторов, аэробных диазотрофов и амилолитиков. Кукуруза стимулирует развитие аммонификаторов и амилолитиков в микробном сообществе почвы; соя – аэробных азотфиксаторов и аэробных целлюлолитиков; подсолнечник – денитрификаторов и анаэробных целлюлолитиков. Наибольшее количество копий генов бактерий и грибов обнаружено на делянках no-till и в залежи, а архей – только в залежи. Полученные данные свидетельствуют о разной степени выраженности и направленности почвенно-биологических процессов агрочерноземов в условиях применения технологии no-till при выращивании основных сельскохозяйственных культур.
ВВЕДЕНИЕ
Тип сельскохозяйственной обработки во многом определяет физические и химические характеристики почвы, рост и развитие растений и, в целом, продуктивность агроценозов [7, 29, 51]. Вследствие сельскохозяйственной обработки существенно меняется состав и функционирование сообществ микроорганизмов, населяющих почву и ризосферу [25, 48]. Преобладание патогенных или симбиотических микроорганизмов также зависит от физических свойств почвы – плотности, порозности, аэрированности, водно-воздушного и теплового режимов [6]. Существует большой объем данных о влиянии типа обработки почвы на сельскохозяйственные растения [1, 7, 17, 29, 44]. Однако информация о микробиологическом состоянии почв, возделываемых различными способами, носит фрагментарный характер [12, 43, 44].
В последнее время отмечается тенденция перехода многих хозяйств юга России с традиционной обработки почвы на минимальную с целью сохранения влаги в полях, уменьшения эрозии и снижения энергетических (топливных и трудовых) затрат [7, 14, 16, 22, 37]. Одним из вариантов минимальной является нулевая обработка (no-till), или прямой посев, при котором воздействие орудий земледелия на почву сведено к минимуму, а на поверхности полей сохраняется слой растительных остатков культуры-предшественника [8, 47]. Применение технологии no-till подвергается критике со стороны специалистов по ряду причин, одной из которых являются частые вспышки фитопатогенных инфекций на полях с данным типом обработки почвы [4, 7, 53]. При этом остается неясным, как совокупное влияние факторов (типа обработки почвы, внесение удобрений и вида сельскохозяйственной культуры) оказывает более существенное действие на формирование почвенного микробиома сельскохозяйственных полей [7, 56].
Цель работы – оценить количественные изменения основных таксономических групп микробного сообщества при длительном применении технологии прямого посева (no-till) в южных агрочерноземах Ставропольского края.
ОБЪЕКТЫ И МЕТОДЫ
Изучали образцы почв опытных полей чернозема обыкновенного среднемощного слабогумусированного тяжелосуглинистого на лёссовидных карбонатных суглинках [2, 13] в пределах опытного хозяйства ФГБНУ Северо-Кавказский ФНАЦ (45°07′48″ N, 42°01′39″ E), Шпаковский район Ставропольского края. Пахотный горизонт данной слабокислой (рН 6.32) почвы под традиционной обработкой содержал 2.24% Cорг и 11.9 мг/кг N–NO3, а также 18.7 мг/кг почвы лабильных форм фосфора (определено по методике Мачигина) и 245 мг/кг обменного калия. С увеличением глубины по почвенному профилю значения всех указанных параметров уменьшались. Горизонт С, выделенный на глубине 126–175 см, характеризовался следующими параметрами: Cорг – 0.38%; N–NO3 – 0.5 мг/кг; Р2О5 – 3.4 мг/кг; К2О – 155 мг/кг; рН 8.3. Длительность применения сельскохозяйственных обработок на изучаемых почвах составляет 7 лет. Повторность полевого опыта трехкратная (рис. 1). Площадь делянок опытных полей – 300 м2 (50 × 6 м), учетная – 90 м2. На половине делянок применяли минеральные удобрения перед посевом в расчетных дозах (озимая пшеница – N160P90K60; подсолнечник – N72P58K32; кукуруза – N80P48K48; соя – N60P60K60) с помощью сеялки при посеве.
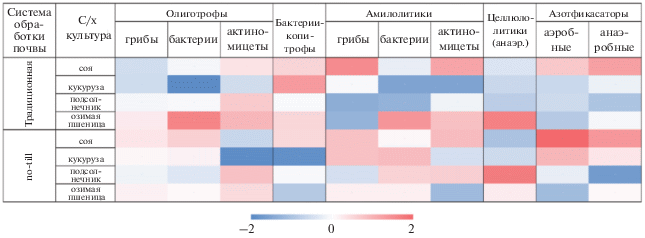
Рис. 1.
Поля опытного хозяйства ФГБНУ Северо-Кавказский ФНАЦ. Примечание: цифрами и буквами обозначены следующие варианты делянок: I – no-till; II – вспашка; 1 – озимая пшеница; 2 – подсолнечник; 3 – кукуруза; 4 – соя; a – без удобрений; b – с удобрениями.

Плотность почвы полей перед уборкой урожая в слое 0–10 см с традиционной обработкой составляла 1.23 г/см3, а для полей no-till – 1.24 г/см3 [13]. Сельскохозяйственные культуры, возделываемые в севообороте: кукуруза (Zea mays L.), соя (Glycine max L.), озимая пшеница (Triticum aestivum L.) и подсолнечник (Helianthus annuus L.). В качестве контроля выбрали необрабатываемую залежную почву вблизи опытных полей. Отбор образцов проводили в трехкратной повторности из слоя 0–10 см в октябре 2018 г. с возможными мерами по предотвращению контаминации. До анализов образцы для классических микробиологических анализов хранили при температуре +4°С, а для молекулярно-биологических исследований – при –70°С. Список образцов приведен в табл. 1.
Таблица 1.
Список образцов, отобранных для микробиологических исследований
| Номер варианта | Культура | Удобрения |
|---|---|---|
| No-till | ||
| 1 | Соя | – |
| 2 | + | |
| 3 | Кукуруза | – |
| 4 | + | |
| 5 | Подсолнечник | – |
| 6 | + | |
| 7 | Озимая пшеница | – |
| 8 | + | |
| Традиционная (вспашка с оборотом пласта) | ||
| 9 | Соя | – |
| 10 | + | |
| 11 | Кукуруза | – |
| 12 | + | |
| 13 | Подсолнечник | – |
| 14 | + | |
| 15 | Озимая пшеница | – |
| 16 | + | |
| Залежь | ||
| 17 | Разнотравье | – |
Микробиологический посев. Учет экологических групп микроорганизмов осуществляли в пятикратной повторности методом посева почвенной суспензии на твердые элективные среды: мясопептонный агар (МПА – бактерии-аммонификаторы), крахмалоаммиачный агар (КАА – амилолитики), голодный агар (ГА – олиготрофные бактерии, актиномицеты и микромицеты), среду Чапека (ЧА – микроскопические грибы), среду Гетчинсона с целлюлозными дисками (аэробные целлюлолитики) [21]; среду Эшби (аэробные азотфиксаторы); методом предельных разведений [17] на жидких средах учитывали: анаэробных диазотрофов (среда Виноградского), группу нитратного дыхания (среда ГНД), а также анаэробных целлюлолитиков (среда Гетчинсона с бумажными полосками фильтровальной беззольной бумаги) [6]. Для ЧА, ГА и КАА показатели разведения посева составляли 1 : 1000, 1 : : 10 000, 1 : 100 000, а для ГЕ – 1 : 10, 1 : 100, 1 : 1000. Аликвоту почвенной суспензии объемом 100 мкл помещали на поверхность стерильных агаризованных сред в чашках Петри диаметром 90 мм. Для подавления роста бактерий в питательные среды Чапека и Гетчинсона добавляли порошок стрептомицина (100 мг/л). Перед посевом почвенную суспензию обрабатывали на вортексе MSV-3500 (Латвия) при скорости 3500 об./мин в течение 10 мин для десорбции клеток микроорганизмов с почвенных частиц [15].
Учет численности выросших колониеобразующих единиц (КОЕ) микромицетов осуществляли на 7, 14 и 20-е сутки. Из посевов в чистые культуры выделяли морфотипы по макро- и микрокультуральным признакам (микроскоп “Биомед-5”). Для всех изолятов микроскопических предварительно проводили идентификацию по культурально-морфологическим [28] или молекулярно-биологическим признакам (по анализу участков ITS1–ITS2 рДНК). ДНК из чистых культур микромицетов выделяли по методике Глушаковой с соавт. [35]: биомассу 5–6-суточной культуры переносили в 2 мл эппендорфы, добавляли 400 мкл стеклянных шариков (300–500 мкм диаметром) и 500 мкл лизирующего буфера (TrisBase 50 мM, NaCl 250 мM, ЭДТА 50 мM, SDS0.3%, pH 8). Приготовленную смесь взбалтывали на вортексе на скорости 3500 об./мин в течение 15 мин, затем инкубировали 1 ч при температуре 65°С, после снова трясли на вортексе 15 мин и центрифугировали (13.4 rpm) 10 мин, отбирали надосадочную жидкость. Для амплификации региона рДНК, содержащего D1/D2 домен региона 26S рДНК, использовали праймеры ITS1f (5' CTTGGTCATTTAGAGGAAGTA) и NL4 (5' GGTCCGTGTTTCAAGACGG) и смеси для ПЦР ScreenMix (ЗАО “Евроген”, Москва). Амплификатор использовали по следующей программе: начальная денатурация – 2 мин при температуре 96°С; затем 35 циклов: денатурация – 20 с при температуре 96°С, отжиг праймеров – 50 с при температуре 52°С, синтез ДНК – 1.5 мин при температуре 72°С; конечная достройка 7 мин при температуре 72°С. ПЦР-продукт очищали с использованием набора BigDye XTerminator Purification Kit (Applied Biosystems, USA). Для секвенирования использовали праймер NL4. Секвенирование ДНК проводили с помощью набора реактивов BigDye Terminator V3.1 Cycle Sequencing Kit (Applied Biosystems, USA) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130xl Genetic Analyzer в Научно-производственной компании “Синтол” (Москва). Идентификацию по полученным хроматограммам проводили используя данные генбанка NCBI и СABI Bioscience Database Index Fungorum.
Экстракция тотальной ДНК из почв. Тотальную ДНК экстрагировали из почвенных образцов массой 0.2 г с помощью набора PowerSoil DNA Isolation Kit (MO BIO Laboratories, США) согласно протоколу производителя. До выделения ДНК образцы хранили при −70°C. Первичную обработку почвенных образцов проводили с использованием гомогенизатора Precellys 24 (BertinTechnologies, Франция).
Количественную оценку содержания рибосомальных генов бактерий, архей и грибов осуществляли методом полимеразной цепной реакции (ПЦР) в реальном времени. Для учета архей и бактерий использовали праймеры на ген 16S рРНК, для учета грибов – на регион ITS. Реакцию проводили в амплификаторе Real-Time CFX96 Touch (“Bio-Rad”). Реакционную смесь готовили из препарата SuperMix Eva Green (“Bio-Rad”). В качестве количественных стандартов концентрации генов 16S рРНК для бактерий использовали растворы клонированных фрагментов рибосомального оперона штамма Escherichia coli К12, для архей – штамма Halobacterium salinarum FG-07, для грибов – штамма дрожжей Saccharomyces cerevisiae Meyen 1B-D1606. Для каждого образца реакцию проводили в трех повторностях. Концентрацию генов рассчитывали с помощью программного обеспечения CFX Manager. Концентрацию генов в препаратах ДНК пересчитывали в количество генов на 1 г почвы с учетом разведений и массы навески.
Статистическую обработку результатов проводили в программах Statistica 10.0 и Microsoft Excel 2016. Визуализацию данных посевов на элективные среды осуществляли при помощи метода теплокарты (heat map). Данные представлены в виде значений lgN (где N – количество КОЕ/г почвы микроорганизмов определенной эколого-трофической группы), нормализованных по принципу Z-трансформации. Шкалирование образцов по количеству копий рибосомальных генов бактерий, архей и грибов проводили с использованием метода главных компонент (Principal Component, PC) в рамках программного пакета past 3.25 [41].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Микробиологические посевы. Наименьшая численность аэробных азотфиксаторов (25–30% обрастания почвенных комочков на среде Эшби) выявлена в образцах почвы под озимой пшеницей и подсолнечником (рис. 2), что характерно для зерновых культур [9]. Наибольшее количество азотфиксаторов (81–84% обрастания) определено под соей – представителем бобовых, в ризосфере которых всегда обнаруживают высокое обилие диазотрофов [3, 33], увеличивающих количество доступных для растений форм азота. Для залежной почвы отмечали среднюю активность Azotobacter – 38% обрастания. В образцах почв с обработкой no-till (за исключением вариантов удобренной озимой пшеницы и подсолнечника без удобрений) выявлено большее (на 10–35% обрастания комочков) количество культивируемых азотфиксаторов по сравнению с пахотной почвой. Таким образом, технология прямого сева приближает сельскохозяйственные почвы к нативным/фоновым [40], где велика численность аэробных азотфиксаторов [26].
Рис. 2.
Теплокарта влияния исследуемых факторов (тип обработки почвы и сельскохозяйственной культуры) на развитие культивируемых микроорганизмов. Данные представлены в виде значений lgN (где N – количество КОЕ/г почвы микроорганизмов определенной эколого-трофической группы), нормализованных по принципу Z-трансформации.
Наименьшая численность анаэробных азотфиксаторов выявлена для вариантов удобренных полей no-till под подсолнечником 8.9 × 102 КОЕ/г почвы. Эта сельскохозяйственная культура имеет развитую (до 3 м длиной) корневую систему, которая обеспечивает значительную аэрацию [27, 39]. Наибольшее количество анаэробных азотфиксаторов (8.3 × 106 КОЕ/г почвы) обнаружено под культурами сои и кукурузы вне зависимости от обработки почвы и наличия удобрений. Обилие анаэробных диазотрофов больше (кроме варианта с подсолнечником) для делянок no-till, где почва относительно уплотнена и содержит меньше кислорода [36].
Наибольшую долю среди микроорганизмов азотного цикла занимает неспецифическая группа аммонификаторов, обилие которых является показателем интенсивности минерализации органического вещества и высвобождения азота из почвы [26, 46, 54]. Количество их КОЕ на среде МПА минимально (4.9 × 106/г почвы) для полей no-till под неудобренными кукурузой и подсолнечником, что показано и для других черноземных почв [12, 23]; максимально (7.2 × 107/г почвы) – для вспахиваемых полей под неудобренными кукурузой и озимой пшеницей (рис. 2). Для залежи и всех вариантов no-till обнаружено снижение численности аммонификаторов, что сближает их с фоновыми почвами, где почвообразующие процессы направлены на накопление гумусовых веществ [24]. В то же время на полях под соей (культурой с повышенным содержанием белка [46] и являющейся хорошим субстратом для данной группы микроорганизмов) технология обработки почвы не влияла на численность бактерий, вырастающих на МПА. Фактор удобрения не оказывал положительного или отрицательного влияния на количество КОЕ аммонификаторов, кроме вариантов no-till под соей и подсолнечником, где численность микроорганизмов увеличивалась при наличии дополнительного источника NPK.
Ни один из рассматриваемых факторов (тип обработки почвы, удобрения и сельскохозяйственная культура) не оказывал воздействия на относительно высокую численность денитрификаторов во всех рассматриваемых образцах, что соответствует ранее полученным данным для других подтипов черноземов [11]. Наибольшая численность культивируемых денитрификаторов выявлена для делянок no-till с подсолнечником без удобрений. Для остальных вариантов с обработкой no-till количество денитрификаторов меньше, чем для вспаханных делянок.
Численность КОЕ олиготрофных микроорганизмов на среде ГА практически не зависела от типа обработки почвы, наличия/отсутствия удобрений или вида растения, составляя от 9.8 × 104 до 5.7 × 106/г почвы, что типично для черноземных почв [11]. В то же время для вариантов как удобренной, так и неудобренной озимой пшеницы, сои и кукурузы количество колоний микроорганизмов больше для вспаханных делянок, чем для no-till. Это может быть связано со спецификой метода исследования, при которой учитываются модульные элементы микроорганизмов. Их количество может возрастать в поле после его механической обработки. Микроорганизмы (в первую очередь, грибы и актиномицеты) являются модульными организмами, что предопределяет их размножение не только специализированными, но и вегетативными клетками (в том числе частями мицелия). При вспашке происходит рыхление и перемешивание почвы с разрушением почвенных агрегатов, и, как следствие, разрывом колоний и гиф микробиоты. Часть из них способна к активному росту, этому способствуют оптимальные лабораторные условия на питательных средах. Поэтому метод микробиологического посева обычно выявляет существенно увеличение численности КОЕ микромицетов в почвах вспахиваемых полей по сравнению с теми, где земля механически не обрабатывается сельскохозяйственной техникой [28].
Мицелиальная организация тела некоторых микроорганизмов позволяет им занимать лидирующие позиции в экосистемах с низким содержанием органического вещества [5, 28], что, вероятно, предопределило доминирование актиномицетов и грибов именно на среде ГА. Численность олиготрофных актиномицетов составила от 104 КОЕ/г почвы под кукурузой в системе no-till без удобрений до 107 КОЕ/г почвы под неудобренными делянками no-till сои. Согласно результатам дисперсионного анализа, количество КОЕ этой группы мицелиальных микроорганизмов было одинаковым в вариантах под подсолнечником вне зависимости от типа обработки почвы и наличия/отсутствия удобрений. В вариантах под соей и кукурузой максимальные значения мицелиальных микроорганизмов обнаружены в варианте no-till без удобрений.
Олиготрофные микромицеты – доминанты на ГА, поскольку количество их пропагул для большинства образцов, посеянных на этой элективной среде, достигало 105–106 КОЕ/г почвы. В то же время численность микроскопических грибов в образцах традиционно обработанной делянки под кукурузой не превышала 102 КОЕ/г почвы, независимо от присутствия удобрений, что показано ранее [42, 50]. Для вариантов с озимой пшеницей на численность микромицетов значимо влияет только фактор внесения удобрений. В случаях их отсутствия количество КОЕ микроскопических грибов уменьшается, что согласуется с другими исследованиями [30, 32]. В образцах почвы с полей no-till под соей выявлено достоверное увеличение численности микромицетов, что, вероятно, связано с обилием азота, продуцируемого бактериальными симбионтами бобовых [46].
Микроскопические грибы учитывали также на среде Чапека со стрептомицином для ингибирования бактерий. Количество их КОЕ очень низко – от 1.1 × 102 КОЕ/г почвы для традиционно обработанных полей удобренной пшеницы и подсолнечника до 3.2 × 103 КОЕ/г почвы – для вспаханных полей сои вне зависимости от внесения удобрений и кукурузы без удобрений. Такую низкую численность можно объяснить слишком высокой концентрацией сахаров в среде Чапека для большинства почвенных микромицетов [28]. Не исключено, что именно культура-предшественник является главным фактором интенсивности развития микроскопических грибов на вспахиваемых полях [32, 52]. Предшественники указанных растений в данном случае – пропашные культуры, после уборки которых остается много надземных частей, являющихся хорошим субстратом для развития микромицетов [38]. Кроме того, отсутствие удобрений способствовало увеличению численности микромицетов под всеми культурами на традиционно обработанных полях.
Сапротрофные микромицеты являются неспециализированной микобиотой, минерализующей почвенное органическое вещество и активно участвующей в гумусообразовании [32, 42, 52]. Как для no-till, так и для вспаханных делянок таксономическая структура сообществ микромицетов сложна и представлена рядом родов, доминантами среди которых являются: Acremonium, Aspergillus, Aureobasidium, Cadophora, Coniothyrium, Cuninghamella, Epicoccum, Eurotium, Geotrichum, Metarhizium, Monilia, Mortierella, Mucor, Paecilomyces, Penicillium, Pseudogymnoas, Rhizopus, Sarocladium, Talaromyces, Trichoderma, Umbellopsis. Все они – типичные обитатели почв умеренного климата, но многие виды (Alternaria tenuissima, Cladosporium spp., Cochliobolus lunatus, Fusarium poae, F. solani, Humicola fuscoatra, Phoma exhigua, Ph. herbarum, Stachybotrytis chartarum, Verticillium tenerum) значатся в реестрах как потенциальные фитопатогены [28]. В то же время численность патогенных для растений микроскопических грибов в наших объектах исследования невелика (от 2.0 × 101 до 8.0 × 101 КОЕ/г почвы), что исключает возможность массового заражения растений и потери урожая в ближайшее время.
Минимальные значения для амилолитических бактерий, играющих важную роль в разложении растительных остатков с обилием крахмала [55], выявлены в образцах залежи (8.1 × 105 КОЕ/г почвы), а также традиционно обрабатываемых и удобренных полей под соей, подсолнечником и кукурузой (1.3 × 106 КОЕ/г почвы). Факторы, влияющие на скорость разложения растительных остатков для агрочерноземов с разными типами обработками почвы, не вполне ясны [16, 18]. Однако уменьшение количества представителей данной эколого-трофической группы может быть обусловлено токсическим действием минеральных удобрений [34]. Максимальная численность КОЕ (3.6 × 107 КОЕ/г почвы) отмечена в варианте вспахиваемого неудобренного поля под кукурузой. Значительное внесение минеральных солей угнетало амилолитиков на полях no-till под всеми культурами, кроме пшеницы. Это подтверждают другие исследования, сравнивающие влияние минеральных удобрений на таксономическую структуру почвенных микроорганизмов сельскохозяйственных полей [34]. Достоверно максимальная численность амилолитических бактерий выявлена в почве пашни под кукурузой без удобрений и в удобренной почве с no-till также под кукурузой, что можно объяснить повышенным содержанием полисахаридов в корневых выделениях культуры, а также обилием пожнивных остатков на делянках [55].
Большинство учитываемых амилолитических бактерий относится к мицелиальным формам – актиномицетам, зачастую улучшающим структуру почвы с агрономической точки зрения [3, 5]. Количество КОЕ этих микроорганизмов на среде КАА составляет от 1.0 × 104 КОЕ/г почвы в образцах неудобренных полей сои вне зависимости от типа обработки почвы до 4.4 × 107 КОЕ/г почвы на удобренных делянках под соей. Наличие удобрений на полях no-till с подсолнечником и вспаханных делянках под озимой пшеницей существенно увеличивает численность актиномицетов. Растительная мульча во многих случаях способствует развитию актинобактерий в почве [30]. Однако на кукурузных полях, независимо от способа обработки почвы, а также на вспаханных делянках с подсолнечником количество КОЕ актиномицетов уменьшалось. Не было выявлено четкой корреляции между численностью микроорганизмов и типом обработки почвы или наличием удобрений, что согласуется с ранее полученными результатами для серых лесных почв, находящихся в сельскохозяйственном использовании [20]. Дисперсионный анализ показал отсутствие зависимости обилия актиномицетов от вида растения. Тем не менее, отмечены тенденции к росту количества актиномицетных КОЕ на вспаханных и неудобренных полях под соей, подсолнечником и озимой пшеницей, а также на неудобренных делянках no-till под кукурузой, как и в образцах удобренных делянок под кукурузой и подсолнечником.
Для большей части исследованных образцов количество КОЕ микроскопических грибов на среде КАА незначительно – 102 КОЕ/г почвы. Тем не менее, для неудобренных полей no-till с кукурузой, богатой крахмалом [55], численность амилолитических микромицетов возрастает до 103–104 КОЕ/г почвы. В образцах удобренных полей no-till под соей, подсолнечником и озимой пшеницей увеличивается численность микромицетов, что может быть связано с обилием растительных остатков при данной обработке почвы [10, 30]. В образцах залежи микроскопических грибов при высевах на среде КАА не обнаружено. Так же, как для других амилолитических мицелиальных микроорганизмов (актиномицетов), дисперсионный анализ не выявил достоверной разницы между численностью микромицетов для всех исследуемых вариантов. Таким образом, тип обработки почвы, наличие удобрений и вид растения не влияли на обилие микромицетов данной эколого-трофической группы, что соответствует ранее полученным данным [11]. Исключением является лишь резкое увеличение количества КОЕ микромицетов-амилолитиков в варианте вспахиваемого поля под озимой пшеницей вне зависимости от фактора удобрения.
Микроскопические грибы Chaetomium globosum, Doratomyces stemonitis, Oidiodendron sp., Rhizopus stolonifer, Trichoderma spp. являлись доминирующими аэробными целлюлолитиками на среде Гетчинсона в исследованных образцах несмотря на то, что их численность не превышала 3.0 × 102 КОЕ/г почвы. Наибольшее количество КОЕ микромицетов данной эколого-трофической группы присутствует в образцах неудобренных полей под подсолнечником вне зависимости от системы обработки почвы и в почвах вспахиваемых делянок под соей, несмотря на наличие/отсутствие удобрений. Низкая численность культивируемых аэробных целлюлолитиков может быть связана с обилием доступных органических веществ в прикорневой зоне растений [20], потребление которых микромицетами более эффективно, чем разложение целлюлозы. Эта гипотеза подтверждается более низкой численностью микроскопических грибов на среде Гетчинсона (в среднем от 0.6 × 102/г почвы), чем на среде Чапека (в среднем 7.1 × 102 КОЕ/г почвы).
Численность аэробных целлюлолитических микроорганизмов существенно выше (2.7 × 104 КОЕ/г почвы), чем анаэробных (6.5 × 102 КОЕ/г почвы). Особенно ярко это проявилось для полей no-till всех культур, кроме озимой пшеницы, поскольку верхний слой почвы полей с минимальной обработкой почвы уплотнен и содержит меньше кислорода [7, 12]. Наименьшая же целлюлолитическая активность наблюдалась в анаэробных условиях для образцов вспаханных полей под соей и кукурузой, где количество растительных остатков, а значит, и целлюлозы после уборки урожая, ниже, чем для других исследованных растений [46]. В противоположность этому, высокая активность анаэробных целлюлолитиков выявлена в образцах под подсолнечником, обильные пожнивные остатки которого могут стимулировать разложение целлюлозы микроорганизмами [30].
Численность копий рибосомальных генов прокариот и грибов. Численность копий рибосомальных генов бактерий в полях без внесения удобрений колебалась от 7.0 × 1010 до 2.3 × 1011 копий генов/г почвы (рис. 3). Минимальные значения выявлены в образцах почвы с традиционной обработкой под культурами сои и кукурузы, а максимальные – при обработке no-till под озимой пшеницей и в залежи. В целом наблюдалось увеличение численности копий генов бактерий и грибов в вариантах no-till по сравнению с традиционной обработкой вне зависимости от применения удобрений. Сходные тенденции обнаружены в других исследованиях [11, 12, 43], в которых отмечалось увеличение численности микроорганизмов в почвах при минимальной обработке. Содержание копий генов бактерий значительно выше в залежи, чем в почвах под сельскохозяйственными культурами. Это может быть связано с постепенным восстановлением невозделываемых земель до естественного состояния биоценозов, где обычно разнообразие и обилие микроорганизмов больше, чем в агроценозах [43, 50]. Практически полное отсутствие влияния фактора удобрений на количество копий рибосомальных генов, как прокариот, так и грибов (рис. 3–5), может быть связано с высокой буферностью черноземов из-за большого содержания гумусовых веществ. Численность копий генов бактерий почти в 2 раза больше под озимой пшеницей, чем под соей и кукурузой, как для варианта традиционной обработки, так и для no-till. Такая закономерность, по-видимому, связана с большей разветвленностью корневой системы, а значит и большим объемом ризосферы пшеницы по сравнению с другими рассматриваемыми сельскохозяйственными культурами [19, 31].
Рис. 3.
Количество копий генов 16S рДНК бактерий для делянок, обработанных традиционно (вспашка с оборотом пласта) и по технологии no-till. Здесь и далее: б/у – без удобрений; удобр. – с минеральными удобрениями.
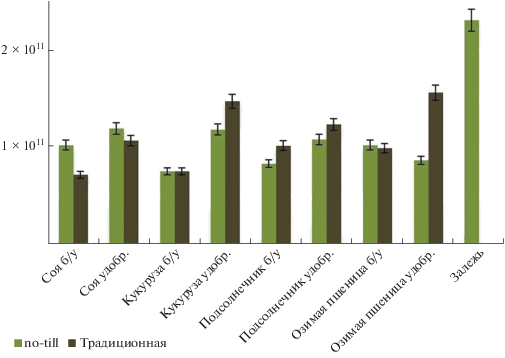
Рис. 4.
Количество копий генов 16S рДНК архей для делянок, обработанных традиционно (вспашка с оборотом пласта) и по технологии no-till.
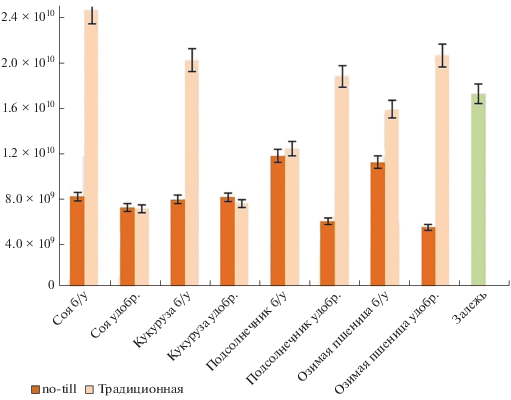
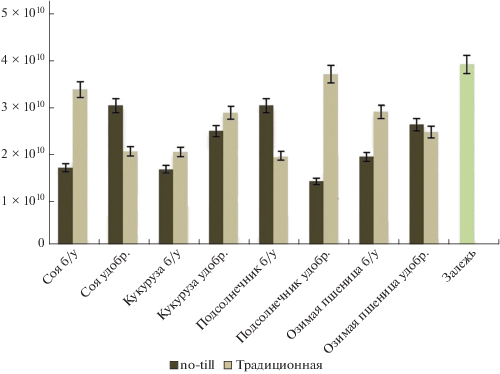
Рис. 5.
Количество копий генов ITS рДНК грибов для делянок, обработанных традиционно (вспашка с оборотом пласта) и по технологии no-till.
Диапазон полученных значений численности копий рибосомальных генов бактерий в исследованных образцах удобренных почв варьирует от 6.0 × 1010 до 2.3 × 1011 копий генов/г почвы. Наименьшее количество бактериальных генов выявлено в вариантах почв с традиционной обработкой под кукурузой и подсолнечником, а максимальные – на делянке no-till под озимой пшеницей и в залежи. Такая закономерность показывает мощное влияние обработки почвы на развитие микроорганизмов: микробное сообщество лучше развивается в почвах близких к нативным [12, 49].
Количество копий генов архей на порядок ниже бактериальных и варьировало от 7.0 × 109 до 1.7 × 1010 генов/г почвы (рис. 4). В большинстве почв умеренного климата сохраняется такое соотношение для прокариот [4, 19]. Минимальные значения характерны для вариантов no-till под подсолнечником и традиционно обработанной делянки под озимой пшеницей вне зависимости от наличия удобрений. Такое явление связано со специфичностью экологических ниш, занимаемыми археями [11, 12, 43]. Так же, как для бактерий, обилие архей максимально в залежи и существенно больше, чем в делянках под сельскохозяйственными культурами, что можно объяснить приближенностью залежи к фоновым почвам [40], где архей практически всегда больше, чем в агроценозах [19]. Наибольшая численность архей, как и бактерий, среди вариантов с сельскохозяйственными культурами отмечена в образцах поля no-till под озимой пшеницей. Это может быть связано со значительным объемом ризосферы этого растения по сравнению с другими рассматриваемыми растениями [11, 12, 31, 43, 50]. В то же время практически идентичные значения выявлены в почве с традиционной обработкой под соей. Причина такого явления может заключаться в том, что эта культура относится к бобовым, которые с помощью симбиотических прокариот увеличивают содержание азота в прикорневой почве [46]. В ризосфере бобовых могут развиваться представители архей, принимающие участие в трансформации азота и проводящие процессы нитрификации и денитрификации. Для вариантов с удобрениями разница между значениями в полях без и с сельскохозяйственными культурами достигает порядка, что свидетельствует о значимости этого фактора для развития микроорганизмов, показанного во многих работах [20, 45].
Численность копий рибосомальных генов грибов в исследованных образцах варьирует в менее широком диапазоне, чем для прокариот – от 1.7 × × 1010 до 4.1 × 1010 генов/г почвы. Порядок этих значений соответствует величинам, полученным в предыдущих исследованиях для черноземных почв [4, 11, 12, 19]. Минимальные значения численности копий рибосомальных генов грибов обнаружены в образцах почвы с традиционной обработкой, вне зависимости от присутствия удобрений и сельскохозяйственной культуры (рис. 5). Такая ситуация представляется типичной для данной группы микроорганизмов [12, 43], что может быть связано с меньшим содержанием органического вещества, в частности, растительных остатков в пахотной почве, а также повреждением мицелия при механической обработке почвы. Согласно полученным данным, традиционная обработка почвы существенно подавляет рост микобиоты вне зависимости от сельскохозяйственной культуры и удобрений. Соответственно, максимум микобиоты выявлен на делянках no-till и залежи. Характерно, что количество копий генов грибов в последних из перечисленных вариантов находится примерно на одном уровне, что может свидетельствовать о первостепенном значении растительных остатков и минимизации повреждений мицелия для развития грибов [28].
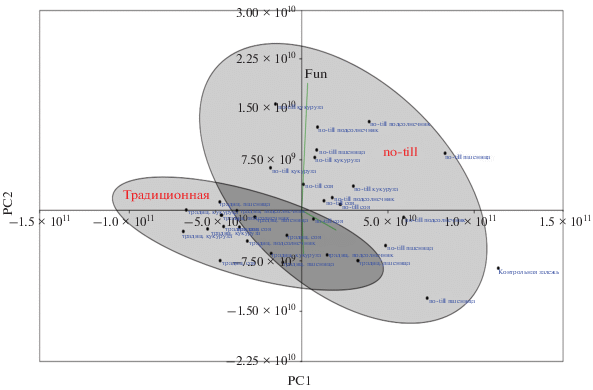
Таким образом, после проведения шкалирования образцов по количеству копий рибосомальных генов бактерий, архей и грибов с использованием метода главных компонент можно сделать следующие выводы. По эколого-функциональному составу микробиома залежь в значительной степени отличается от всех вариантов обрабатываемых делянок (рис. 6). Судя по методу количественной ПЦР (в противоположность результатам по микробиологическому посеву), технология обработки почвы no-till не приближает состав микробиома к таковому на залежи. По-видимому, это связано с определяющим фактором растительности, которая коренным образом отличается на залежи и возделываемых делянках [13]. Отметим, что ось PC1 положительно коррелирует с численностью рибосомальных генов 16S рДНК бактерий, в то время как ось PC2 – с количеством рибосомальных генов ITS рДНК грибов. Это означает, что обилие генов бактерий в первую очередь определялось фактором культуры возделываемого на делянке растения, а численность генов грибов – типом обработки почвы. Кроме того, судя по результатам шкалирования, традиционная обработка уменьшает количество копий рибосомальных генов всех групп микроорганизмов, однако в отношении архей данный эффект прослеживается лишь на уровне тенденции.
Рис. 6.
Шкалирование образцов по количеству копий рибосомальных генов бактерий, архей и грибов с использованием метода главных компонент: bac – бактерии; arc – археи; fun – грибы. Статистические параметры PC-осей предcтавлены в табл. S1 .
Построение параметрической модели показало, что исследуемые типы обработки почвы достоверно изменяют численность лишь бактерий и грибов, но не архей (рис. S1 ). Вероятно, такой факт связан с доминированием бактерий среди прокариот черноземных почв [19].
ЗАКЛЮЧЕНИЕ
Фактор обработки почвы оказал влияние на численность отдельных таксономических и эколого-трофических групп микроорганизмов. Традиционная обработка изученных агрочерноземов приводит к росту активности аэробных аммонификаторов, денитирификаторов, аэробных целлюлолитиков, актиномицетов и микромицетов. В свою очередь при обработке no-till повышается общая численность грибов и бактерий (как по численности копий рибосомальных генов, так и по количеству КОЕ/г почвы), количество архей, активность анаэробных целлюлолитиков, азотфиксаторов, аэробных диазотрофов и амилолитиков.
Фактор удобрения практически не оказывал влияния на количественные показатели микроорганизмов в исследуемых почвах, видимо, из-за неравномерного внесения минеральных веществ и буферных свойств чернозема.
Фактор возделываемой сельскохозяйственной культуры существенно влияет на структуру почвенного микробиома. Численность копий генов бактерий и архей почти в 2 раза больше под озимой пшеницей, чем под соей и кукурузой. Кукуруза стимулирует развитие аммонификаторов и амилолитиков; соя увеличивает количество аэробных азотфиксаторов и аэробных целлюлолитиков; подсолнечник вызывает обильный рост денитрификаторов и анаэробных целлюлолитиков; на присутствие озимой пшеницы рассматриваемые эколого-трофические группы микроорганизмов не реагируют.
Количество копий генов прокариот, в первую очередь, определялось фактором культуры возделываемого на делянке растения, а численность генов грибов – типом обработки почвы. Содержание копий генов всех рассматриваемых таксономических групп микроорганизмов (бактерии, археи, грибы) значительно больше в залежи, чем в почвах под сельскохозяйственными культурами.
Таким образом, соотношения групп микроорганизмов показали свой потенциал при биоиндикации, в том числе при оценке степени аэробных/анаэробных условий среды обитания почв степной зоны в условиях минимизации обработки почвы полученные результаты свидетельствуют о значительных различиях состава и структуры почвенного микробиома при переходе от вспашки к технологии no-till. Поэтому микроорганизмы можно использовать как маркер степени экологизации земледелия в черноземной полосе.
Список литературы
Беляева О.Н. Система no-till и ее влияние на доступность азота почв и удобрений: обобщение опыта // Земледелие. 2013. № 7. С. 16–18.
Гаджиумаров Р.Г., Жукова М.П. Влияние технологий возделывания и удобрений на рост, развитие и урожайность сои в зоне неустойчивого увлажнения Центрального Предкавказья // Вестник АПК Ставрополья. 2018. № 1(29). С. 81–85.
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А., Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1096. https://doi.org/10.7868/S0032180X15090038
Железова А.Д., Пассова Д.И., Никитин Д.А., Яшин М.А., Железова С.В. Влияние способа сельскохозяйственной обработки на микробиологические характеристики дерново-подзолистой почвы // Бюл. Почв. ин-та им. В.В. Докучаева. 2019. № 99. С. 117–144. https://doi.org/10.19047/0136-1694-2019-99-117-144
Зенова Г.М., Манучарова Н.А., Звягинцев Д.Г. Экстремофильные и экстремотолерантные актиномицеты в почвах разных типов // Почвоведение. 2011. № 4. С. 457–478.
Ильина Т.К., Фомина О.М. Автор. св-во № 113328а от 30.06.83. “Питательная среда для культивирования почвенных микроорганизмов”.
Кирюшин В.И. Проблема минимизации обработки почвы: перспективы развития и задачи исследований // Земледелие. 2013. № 7. С. 3–6.
Кирюшин В.И. Наследие В.Р. Вильямса и современные проблемы агропочвоведения // Известия Тимирязевской сельскохозяйственной академии. 2014. № 1. С. 5–15.
Кожемяков А.П., Проворов Н.А., Завалин А.А., Шотт П.Р. Оценка взаимодействия сортов ячменя и пшеницы с ризосферными ростстимулирующими бактериями на различном азотном фоне // Агрохимия. 2004. № 3. С. 33–40.
Кузнецов Ю.Г., Васильченко А.П. Влияние предшественника и способа основной обработки почвы на биоэнергетическую эффективность выращивания озимой пшеницы на эродированных склонах чернозёмов обыкновенных Ростовской области // Известия Оренбургского государственного аграрного университета. 2017. № 5(67). С. 39–41.
Кутовая О.В., Тхакахова А.К., Чевердин Ю.И. Влияние поверхностного переувлажнения на биологические свойства лугово-черноземных почв Каменной Степи // Бюл. Почв. ин-та им. В.В. Докучаева. 2016. № 82. С. 56–70. https://doi.org/10.19047/0136-1694-2016-82-56-70
Кутовая О.В., Гребенников А.М., Тхакахова А.К., Исаев В.А., Гармашов В.М., Беспалов В.А., Чевердин Ю.И., Белобров В.П. Изменение почвенно-биологических процессов и структуры микробного сообщества агрочерноземов при разных способах обработки почвы // Бюл. Почв. ин-та им. В.В. Докучаева. 2018. № 92. С. 35–61. https://doi.org/10.19047/0136-1694-2018-92-35-61
Кутовая О.В., Тхакахова А.К., Семенов М.В., Чернов Т.И., Ксенофонтова Н.А., Железова А.Д., Гаджиумаров Р.Г., Стукалов Р.С., Иванова Е.А., Никитин Д.А. Сравнительная оценка влияния нулевой и традиционной обработки на биологическую активность агрочерноземов Ставропольского края // Бюл. Почв. ин-та им. В.В. Докучаева. 2019. № 100. С. 92–116. https://doi.org/10.19047/0136-1694-2019-100-92-116
Мельников А.В., Железова С.В. Традиционная вспашка или нулевая технология – что выгоднее для производства озимой пшеницы в нечерноземной зоне России? // Theor. Appl. Problems Agro-industry. 2019. № 39(1). С. 35–40.
Методы почвенной микробиологии и биохимии / Под ред. Звягинцева Д.Г. М.: Изд-во Моск. ун-та, 1991. С. 304.
Орлова Л.В., Шакиров Ф.К., Парвицкий С.А. Инновационные технологии в земледелии: опыт применения, оценка эффективности // Экономика сельскохозяйственных и перерабатывающих предприятий. 2009. № 1. С. 19–21.
Практикум по микробиологии / Под ред. Егорова Н.С. М.: Изд-во Моск. ун-та, 1976. С. 307.
Семенов В.М., Когут Б.М. Почвенное органическое вещество. М., 2015. 233 с.
Семенов М.В., Манучарова Н.А., Краснов Г.С., Никитин Д.А., Степанов А.Л. Биомасса и таксономическая структура микробных сообществ в почвах правобережья р. Оки // Почвоведение. 2019. № 8. С. 974–985.
Семенов М.В., Никитин Д.А., Степанов А.Л., Семенов В.М. Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019. № 3. С. 355–369. https://doi.org/10.1134/S0032180X19010131
Теппер Е.З., Шильникова В.К., Переверзева Г.И. Практикум по микробиологии. М.: Дрофа, 2005. 256 с.
Турусов В.И., Гармашов В.М., Нужная Н.А. Засоренность посевов при разных приемах и системах основной обработки почвы в севообороте // Защита и карантин растений. 2017. № 9. С. 19–21.
Фаизова В.И., Цховребов В.С., Калугин Д.В., Никифорова А.М. Влияние распашки черноземов Центрального Предкавказья на численность аммонификаторов // Вестник АПК Ставрополья. 2013. № 4. С. 198–202.
Шарков И.Н. Концепция воспроизводства гумуса в почвах // Агрохимия. 2011. № 12. С. 21–27.
Berendsen R.L., Pieterse C.M., Bakker P.A. The rhizosphere microbiome and plant health // Trends Plant Science. 2012. V. 17(8). P. 478–486. https://doi.org/10.1016/j.tplants.2012.04.001
De Bruijn F.J. Biological nitrogen fixation // Principles of Plant-Microbe. Springer, Cham. 2015. P. 215–224. https://doi.org/10.1007/978-3-319-08575-3_23
Delgado A., Gómez J.A. The soil. Physical, chemical and biological properties // Principles of Agronomy for Sustainable Agriculture. Springer, Cham. 2016. P. 15–26. https://doi.org/10.1007/978-3-319-46116-8_2
Domsch K.H., Gams W., Anderson T.-H. Compendium of soil fungi. Ed. Gams W. Eching: IHW-Verlag, 2007. P. 627.
Fernandez A.L., Fabrizzi K.P., Tautges N.E., Lamb J.A., Sheaffer C.C. Cutting management and alfalfa stand age effects on organically grown corn grain yield and soil N availability // Renewable Agriculture and Food Systems. 2019. V. 34(2). P. 144–154. https://doi.org/10.1017/S1742170517000394
Fu X., Wang J., Sainju U.M., Zhao F., Liu W. Soil microbial community and carbon and nitrogen fractions responses to mulching under winter wheat // Appl. Soil Ecol. 2019. V. 139. P. 64–68. https://doi.org/10.1016/j.apsoil.2019.03.018
Gardener B.B.M., Weller D.M. Changes in populations of rhizosphere bacteria associated with take-all disease of wheat // Appl. Environ. Microbiol. 2001. V. 67(10). P. 4414–4425. https://doi.org/10.1128/AEM.67.10.4414-4425.2001
Garrett S.D. Soil fungi and soil fertility: an introduction to soil mycology. Elsevier: Pergamon press, 2016. 147 p.
Geddes B.A., Ryu M.H., Mus F., Costas A.G., Peters J.W., Voigt C.A., Poole P. Use of plant colonizing bacteria as chassis for transfer of N2-fixation to cereals // Current Opinion in Biotechnology. 2015. V. 32. P. 216–222. https://doi.org/10.1016/j.copbio.2015.01.004
Geisseler D., Scow K.M. Long-term effects of mineral fertilizers on soil microorganisms – A review // Soil Biol. Biochem. 2014. V. 75. P. 54–63. https://doi.org/10.1016/j.soilbio.2014.03.023
Glushakova A.M., Kachalkin A.V., Chernov I.Yu. Specific features of the dynamics of epiphytic and soil yeast communities in the thickets of Indian balsam on mucky gley soil // Eurasian Soil Science. 2011. V. 44. P. 886–892. https://doi.org/10.1134/S1064229311080059
Graf D.R., Zhao M., Jones C.M., Hallin S. Soil type overrides plant effect on genetic and enzymatic N2O production potential in arable soils // Soil Biol. Biochem. 2016. V. 100. P. 125–128. https://doi.org/10.1016/j.soilbio.2016.06.006
Gras C., Hernandez V. Development models and technological innovation. A conservative revolution // Mundo Agrario. 2016. P. 17(36).
Grebenikova N., Korshunov A., Savchenko I., Marques M. Root rot grain crops on Cereals caused by the phytopathogenic fungi // MATEC Web of Conferences. EDP Sciences. 2018. V. 245. P. 11006. https://doi.org/10.1051/matecconf/201824511006
Gregory P. Plant roots. John Wiley & Sons, Limited, 2007. https://doi.org/10.1002/9780470995563
Grigar J., Hatfield J.L., Reeder R. Transitional no-till: What is it and how does it differ from ‘true’ no-till? // Crops and Soils. 2018. V. 51(6). P. 28–36. https://doi.org/10.2134/cs2018.51.0603
Hammer O., Harper A.T.D., Ryan P.D. PAST: Paleontological Statistics Software Package for Education and Data Analysis // Palaeontologia Electronica. 2001. V. 4(1). P. 1–9.
Irawan B., Afandi A., Hadi S. Effects of saprophytic microfungi application on soil fertility based on their decomposition properties // J. Appl. Biol. Sci. 2017. V. 2. P. 15–19.
Korvigo I.O., Pershina E.V., Ivanova E.A., Matyuk N.S., Savos’kina O.A., Chirak E.L. et al. Effect of long-term application of agrotechnical techniques and crops on soil microbial communities // Microbiology. 2016. V. 85(2). P. 231–242. https://doi.org/10.1134/S0026261716020107
Legrand F., Picot A., Cobo-Díaz J.F., Carof M., Chen W., Le Floch G. Effect of tillage and static abiotic soil properties on microbial diversity // Appl. Soil Ecol. 2018. V. 132. P. 135–145. https://doi.org/10.1016/j.apsoil.2018.08.016
Lourenço K.S., Rossetto R., Vitti A.C., Montezano Z.F., Soares J.R., de Melo Sousa R. et al. Strategies to mitigate the nitrous oxide emissions from nitrogen fertilizer applied with organic fertilizers in sugarcane // Sci. Total Environ. 2019. V. 650. P. 1476–1486. https://doi.org/10.1016/j.scitotenv.2018.09.037
Marinkovic J., Bjelic D., Tintor B., Miladinovic J., Dukic V., Dorđevic V. Effects of soybean co-inoculation with plant growth promoting rhizobacteria in field trial // Romanian Biotechnol. Lett. 2018. V. 23(2). P. 13401.
Rainbow R., Derpsch R. Advances in no-till farming technologies and soil compaction management in rainfed farming systems // Rainfed Farming Systems. Springer, Dordrecht, 2011. P. 991–1014. https://doi.org/10.1007/978-1-4020-9132-2_39
Sasse J., Martinoia E., Northen T. Feed your friends: do plant exudates shape the root microbiome? // Trends Plant Sci. 2018. V. 23(1). P. 25–41. https://doi.org/10.1016/j.tplants.2017.09.003
Schmidt R., Mitchell J., Scow K. Cover cropping and no-till increase diversity and symbiotroph: saprotroph ratios of soil fungal communities // Soil Biol. Biochem. 2019. V. 129. P. 99–109. https://doi.org/10.1016/j.soilbio.2018.11.010
Semenov M., Blagodatskaya E., Stepanov A., Kuzyakov Y. DNA-based determination of soil microbial biomass in alkaline and carbonaceous soils of semi-arid climate // J. Arid Environ. 2018. V. 150. P. 54–61. https://doi.org/10.1016/j.jaridenv.2017.11.013
Shukla S.K., Yadav R.L., Awasthi S.K., Gaur A. Soil microbial biomass nitrogen, in situ respiration and crop yield influenced by deep tillage, moisture regimes and N nutrition in sugarcane-based system in subtropical India // Sugar Tech. 2017. V. 19(2). P. 125–135. https://doi.org/10.1007/s12355-016-0442-1
Teotia P., Kumar V., Kumar M., Shrivastava N., Varma A. Rhizosphere Microbes: Potassium Solubilization and Crop Productivity–Present and Future Aspects // Potassium solubilizing microorganisms for sustainable agriculture. Springer, New Delhi, 2016. P. 315–325. https://doi.org/10.1007/978-81-322-2776-2_22
Van Agtmaal M., Straathof A.L., Termorshuizen A., Lievens B., Hoffland E., de Boer W. Volatile-mediated suppression of plant pathogens is related to soil properties and microbial community composition // Soil Biol. Biochem. 2018. V. 117. P. 164–174. https://doi.org/10.1016/j.soilbio.2017.11.015
Vlasova O.I., Perederieva V.M., Volters I.A., Tivikov A.I., Trubacheva L.V. Change in microbiological activity under the effect of biological factors of soil fertility in the Central Fore-Caucasus chernozems // Biol. Medicine. 2015. V. 7(5). P. 2.
Wang S., Li C., Copeland L., Niu Q., Wang, S. Starch retrogradation: A comprehensive review // Comprehensive Rev. Food Sci. Food Safety. 2015. V 14(5). P. 568–585. https://doi.org/10.1111/1541-4337.12143
Yin C., Mueth N., Hulbert S., Schlatter D., Paulitz T.C., Schroeder K. et al. Bacterial communities on wheat grown under long-term conventional tillage and no-till in the Pacific Northwest of the United States // Phytobiomes. 2017. V. 1(2). P. 83–90. https://doi.org/10.1094/PBIOMES-09-16-0008-R
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Процент вариации, объясненный каждой из PC-осей.
Рис. S1. Параметрическая модель влияния фактора обработки почвы на структуру микробиома.


