Почвоведение, 2020, № 2, стр. 178-187
Оценка комплексообразования органического вещества почв с медью методом аффинной хроматографии
А. А. Дымов a, *, Е. Ю. Милановский b, c
a Институт биологии Коми научного центра УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
c Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, Россия
* E-mail: aadymov@gmail.com
Поступила в редакцию 17.05.2019
После доработки 13.06.2019
Принята к публикации 20.09.2019
Аннотация
Аффинная хроматография с иммобилизированными ионами металлов (IMAC-хроматография) использована для фракционирования органических соединений щелочного экстракта из лесных почв Республики Коми по критерию их способности образовывать комплексные соединения с ионами меди. На основе подбора условий разделения предложен алгоритм хроматографического фракционирования веществ на группы молекулярно гомогенных соединений, основанный на последовательном изменении рН и ионной силы элюента. Показано, что соединения щелочного экстракта содержат три фракции, компоненты которых различаются способностью образовывать комплексные соединения с медью. Установлено, что гумусовые вещества подзолов (Albic Podzol), подзолистых (Glossic Retisol) и торфянисто-подзолисто-глееватых почв (Histic Retisol) различаются по относительному содержанию лигандообразующих органических соединений. Максимальное содержание (по Сорг) комплексонов меди, характерно для органического вещества лесных подстилок рассматриваемых почв (14–21 г/кг). Соответствующие значения содержания органического вещества элювиальных горизонтах составляют 0.5–1.5 г/кг. Наиболее высокое содержание соединений углерода, способных связывать ионы меди, характерно для подзолистых почв, в то время как компоненты органического вещества из подзолов и торфянисто-подзолисто-глееватых почв характеризуются несколько меньшей аффинностью к меди. Представленный алгоритм может быть использован для оценки устойчивости почв к загрязнению тяжелыми металлами.
ВВЕДЕНИЕ
Почвы являются мощнейшим геохимическим барьером для загрязняющих компонентов. Одними из приоритетных загрязнителей служат тяжелые металлы (ТМ). Поступление поллютантов в окружающую среду связано с различными типами антропогенной деятельности [13, 19]. От свойств почв зависит дальнейшая судьба загрязнителей – аккумуляция в почве, либо миграция в геохимически подчиненные ландшафты и водоемы. Лидирующую роль в закреплении ТМ играет почвенное органическое вещество [1, 3, 7, 16, 30]. В настоящее время механизмы аккумуляции и миграции тяжелых металлов в почвах и геохимически сопряженных ландшафтах в основном исследованы методами потенциометрического титрования (рН-эффект) и ионообменного равновесия [15]. Показано существенное влияние форм нахождения тяжелых металлов в почвах на их современное состояние [9, 14]. Разработка хроматографических методов, позволяющих проводить фракционирование органических соединений по критерию их комплексообразующей способности, позволяет существенно расширить понимание механизмов природной химической дифференциации профиля, аккумуляции и миграции загрязняющих компонентов для дальнейшего регулирования и нормирования их содержания.
Развитие инструментальных возможностей аналитической химии определяет постепенное переосмысление роли и функций, индивидуальных органических соединений и групп, обладающих близкими функциональными свойствами. Одним из перспективных методов изучения функциональных свойств органического вещества является металл-аффинная хроматография [11, 25].
Термин “лиганоднообменная хроматография” был введен в 1961 г. в коротком сообщении Гельфериха [24]. Концепция металл-аффинной хроматографии (IMAX immobilized-metal affinity chromatography) сформулирована и опубликована Поратом [31]. В данном подходе используется свойство биологических макромолекул связываться с иммобилизованными на хроматографической матрице ионами металлов, таких как Сu2+, Zn2+, Ni2+, Co2+, Fe2+. Специфическое связывание осуществляется за счет наличия на поверхности молекул свободных электронодонорных групп. В условиях IMAX (нейтральные значения pH и высокие концентрации соли) в качестве потенциальных лигандов в органической молекуле могут выступать имидазольная группа гистидина (pK ~ 6.7), тиольная группа цистеина (pK ~ 8.5) и индольная группа триптофана (pK ~ 9.41). В таких взаимодействиях могут принимать участие C-концевые аминокислоты (pK ~ 7.7), а также остатки аспарагиновой и глютаминовой кислот (pK ~ 3.9). По прочности образуемых комплексов аминокислоты располагаются в ряд: His, Cys > Asp, Glu $ \gg $ другие аминокислоты. Взаимодействие между сорбентом и аналитом pH-зависимое. В связи с этим связанные вещества можно элюировать, уменьшая ионную силу буфера, изменяя рН, или использовать другие хелатирующие агенты (ЭДТА и др.) [20, 21, 31].
В настоящее время IMAC-хроматографию используют при проведении предварительной обработки образцов для обнаружения наркотиков [10], для оценки комплексообразующих свойств органических соединений морских вод [27], фракционирования и очистки белков и аминокислот при биохимических исследованиях [2, 8, 18, 32]. В последние десятилетия в международных журналах появились первые публикации использования металл-аффинной хроматографии при оценке комплексообразующих свойств смесей органических соединений водных объектов, гумусовых веществ (ГВ) и экстрактов из почв [23, 25, 28, 29].
Цель работы – оценка возможностей аффинной хроматографии с иммобилизованными металлами для изучения комплексообразующих свойств органического вещества лесных почв Европейского Севера.
В задачи исследования входило: оценить возможности аффинной хроматографии с иммобилизованными ионами металлов для идентификации комплексообразующих органических соединений в составе лабильного почвенного органического вещества; охарактеризовать особенности молекулярно гомогенных фракций органического вещества с использованием индивидуальных органических соединений с различными ионогенными группами; выявить особенности комплексообразующих свойств ГВ преобладающих почв таежной зоны методом IMAC-хроматографии.
ОБЪЕКТЫ И МЕТОДЫ
Объектом исследования были верхние генетические горизонты типичных почв Республики Коми: I – подзол иллювиально-железистый развивающийся на песчаных отложениях под сосняком лишайниковым, средняя тайга [22]; II – подзолистая почва, развивающаяся на покровных суглинках под ельником кустарничковым, средняя тайга, Южный Тиман [5]; III – торфянисто-подзолисто-глееватая почва, формирующаяся на моренных суглинках, под ельником чернично-сфагновым в северной тайге Приполярного Урала [4].
ГВ экстрагировали из почв 0.1 моль/дм3 NaOH при соотношении почва : раствор 1 : 10 в течение 20–24 ч. Экстракт ГВ очищали от минеральных примесей центрифугированием (10 000 об./мин, 20 мин). К 0.5 см3 супернатанта добавляли 1.0 см3 стартового раствора (0.02 моль/дм3 фосфатный буфер с 0.5 моль/дм3 NaCl, pH 7.0).
Хроматографическое фракционирование ГВ проводили на геле агарозы (рис. 1) c ковалентно-сшитыми хелатными группами (IMAC Sepharose 6 FF, GE Healhtcare) на колонке 1 × 10 см (Bio-Rad). Динамическая связывающая емкость геля – 25 мг (Cu2+)/см3 геля [26]. Реакцию комплексообразования можно представить в виде схемы (рис. 1Б).
Рис. 1.
Структура геля агарозы быстрого потока (А) и схема взаимодействия (зарядки) колонки с ионами меди (Б).

Для иммобилизации ионов меди на хроматографической матрице через колонку 1 × 10 см (Bio-Rad) с гелем IMAC Sepharose 6 FF прокачивали при помощи перистальтического насоса (Econopump) 10 см3 0.5 моль/дм3 раствора CuSO4. Равномерная голубая окраска геля позволяла визуально контролировать качественное состояние колонки (рис. 2).
Для удаления ионов меди, не прореагировавших с гелем, колонку промывали 40 см3 дистиллированной воды и 20 см3 стартового буфера (0.02 моль/дм3 фосфатный буфер с 0.5 моль/дм3 NaCl, рН 7.0). Повышение ионной силы буфера за счет NaCl минимизирует неспецифические ионные взаимодействия гумусовых веществ с аффинной матрицей. Разделение проводили на хроматографической системе BioLogic LP (USA). Детектирование оптической плотности при 280 нм. Скорость подачи элюэнтов – 2 см3/мин.
В колонку, уравновешенную стартовым раствором, вводили 440 мкл раствора ГВ. Компоненты пробы, не вступающие в реакцию взаимодействия с ионами меди, элюируются в составе первой хроматографической фракции. Ослабление аффинных взаимодействий органических соединений с матрицей геля осуществляли понижением рН элюента. Фракцию 2 слабосвязанных органических соединений элюировали раствором 0.05 моль/дм3 ацетатного буфера с 0.5 моль/дм3 NaCl (рН 4). Фракцию 3 (прочносвязанные органические соединения) элюировали раствором 0.2 моль/дм3 NaOH с 0.5 моль/дм3 NaCl (pH 12). После завершения фракционирования ионы меди Cu2+ удаляли с колонки 0.2 моль/дм3раствором ЭДТА.
Для регенерации гель переносили на воронку Бюхнера и промывали последовательно 15–20 мл: дистиллированная вода, 25% пропанол → 50% пропанол → 100% пропанол → 100% бутанол → 50% пропанол → 25% пропанол → дистиллированная вода. Регенерированный гель загружали в хроматографическую колонку и насыщали ионами меди. Все используемые растворы фильтровали через мембранные фильтры с размером пор 0.22 мкм, на установках Millipor, дегазировали и контролировали значения рН. В качестве стандартов использовали ряд индивидуальных соединений: глицин (0.5 моль/дм3), щавелевую кислоту (0.5 моль/дм3), гистидин солянокислый (0.1 моль/дм3), аспарагиновую кислоту (0.1 моль/дм3), фенилаланин (0.1 моль/дм3) и др. Интегрирование и вычисление площадей хроматографических фракций осуществляли в программе Мультихром 2.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Подробные описания морфологических и физико-химических свойств почв опубликованы ранее [4, 5, 22]. В табл. 1 приведены наиболее общие физико-химические свойства исследуемых почв. Для рассматриваемых почв характерны близкие физико-химические свойства. Почвы кислые – значения pH водных вытяжек изменяются от 3.3 в органогенном горизонте торфянисто-подзолисто-глееватой почвы до 4.3 в подстилке подзола. Для почв характерна низкая степень насыщенности основаниями. В органогенных горизонтах характерно накопление грубогумусированного органического вещества. При этом органическое вещество подзолистых и торфянисто-подзолисто-глееватых почв в большей степени обогащено азотом по сравнению с иллювиально-железистыми подзолами. Содержание соединений углерода, извлекаемых децинормальным раствором щелочи, изменяется от 67–102 г/кг почвы в органогенных горизонтах до 1.3–4.5 г/кг почвы в минеральных горизонтах. Доля щелочнорастворимых соединений от Собщ составляет 17–25% в подстилках и 18.4–32.5% в верхних минеральных горизонтах. Максимальная доля Сщел (относительно Собщ) характерна для горизонтов с морфологическими признаками миграции органического вещества в торфянисто-подзолисто-глееватой почве. Согласно ранее проведенным исследованиям [6], запасы углерода в рассматриваемых почвах на глубину 1 м составляют, кг/м2: 2.9 для подзолов; 9.2 для подзолистых почв; 12.1 для торфянисто-подзолисто-глееватых почв. Несмотря на принадлежность к бореальным лесам, рассматриваемые почвы имеют ряд различий по условиям формирования, аккумуляции и разложения органического вещества. В качестве опорных были выбраны по два горизонта (нижняя часть подстилки и верхний минеральный горизонт), поскольку в большинстве случаев именно они подвергаются наиболее интенсивному воздействию при химическом загрязнении.
Таблица 1.
Физико-химические и химические свойства исследуемых почв
| Горизонт | Глубина, см | рН | Нг* | Обменные катионы | V** | Cобщ | Nобщ | $\frac{{\text{C}}}{{\text{N}}}$ | Сщел, % | $\frac{{{{{\text{C}}}_{{{\text{щел}}}}}}}{{{{{\text{C}}}_{{{\text{орг}}}}}}},\,\,\% $ | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Са2+ | Mg2+ | |||||||||||
| H2O | KCl | смоль (экв)/кг | % | |||||||||
| Подзол (I) | ||||||||||||
| O(H) | 1–3 | 4.3 | 3.3 | 45.9 | 8.8 | 1.4 | 18 | 43.7 | 0.69 | 54 | 7.48 | 17.1 |
| E | 3–13 | 4.2 | 3.3 | 3.6 | 0.3 | 0.1 | 10 | 0.87 | 0.02 | 37 | 0.16 | 18.4 |
| Подзолистая (II) | ||||||||||||
| O(H) | 6–8 | 4.0 | 2.9 | 73.7 | 11.4 | 3.0 | 16 | 35.8 | 1.58 | 26 | 6.67 | 18.6 |
| EL | 8–11 | 3.9 | 2.9 | 14.9 | 0.6 | 0.3 | 6 | 2.2 | 0.15 | 17 | 0.45 | 20.4 |
| Торфянисто-подзолисто-глееватая (III) | ||||||||||||
| O(H) | 7–13 | 3.3 | 4.2 | 82.5 | 2.1 | 1.2 | 4 | 40.2 | 1.56 | 29 | 10.2 | 25.4 |
| ELhi,g | 13–30 | 3.8 | 5.0 | 7.8 | 0.3 | 0.1 | 5 | 0.4 | 0.03 | 15 | 0.13 | 32.5 |
Методическая работа по выбору алгоритма фракционирования носила поисковый характер. Использовали различные комбинации условий фракционирования ГВ щелочного экстракта на молекулярно гомогенные фракции, в основе которых лежали приемы, используемые в лиганднообменной хроматографии белков:
– лигандный обмен при помощи гистидина, имидазола, хлорида аммония, или другими веществами, образующими более устойчивые комплексы с ионами металла (т.е. имеющими сродство к хелатированным ионам металла);
– разрушение хелатных соединений сильным хелатирующим агентом (ЭДТА), приводящее к освобождению соединений и десорбции металла;
– градиент рН элюента (линейный или ступенчатый), обеспечивающий протонирование донорных групп ГВ.
Для сложных смесей, которыми являются щелочные экстракты ГВ, в случае первых двух вариантах фракционирования наблюдалась низкая воспроизводимость и неоднозначность интерпретации результатов. Вероятно, подходы с лигандным обменом и разрушением хелатных соединений ЭТДА применимы к более однородным по молекулярному составу смесям и требуют предварительной очистки и удаления низкомолекулярных органических соединений.
Высокую воспроизводимость результатов показал вариант разделения ГВ c градиентом рН: 10 мин буфер 1 – 0.02 моль/дм3 фосфатный буфер с 0.5 моль/дм3 NaCl, pH 7; 15 мин буфер 2 – 0.05 моль/дм3 ацетатный буфер с 0.5 моль/дм3 NaC-l, рН 4; 20 мин буфер 3 – 0.2 моль/дм3 NaOH с 0.5 моль/дм3 NaCl, pH 12. Примеры хроматограмм приведены на рис. 3 и 4.
Рис. 3.
Условия IMAC фракционирования 0.1 моль/дм3 NaOH экстракта ГВ: 1 – оптическая плотность, 2 – рН элюента; А – 0.02 моль/дм3 фосфатный буфер с 0.5 моль/дм3 NaCl, pH 7; B – 0.05 моль/дм3 ацетатный буфер с 0.5 моль/дм3 NaCl, рН 4; С – 0.2 моль/дм3 NaOH с 0.5 моль/дм3 NaCl, pH 12.
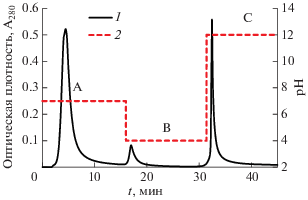
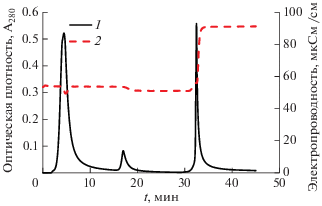
Рис. 4.
Зависимость сигнала детекторов от времени: оптическая плотность (1), электропроводность (2) элюата.
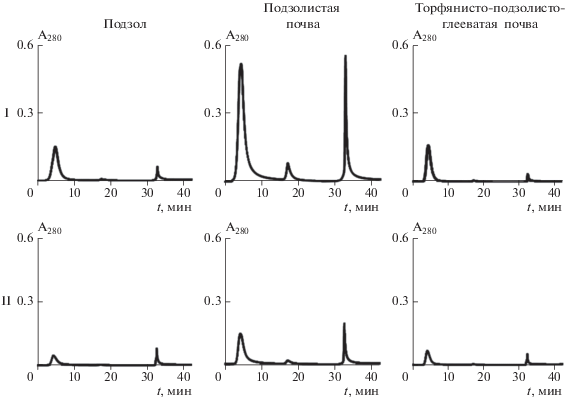
С помощью выбранного алгоритма проведено фракционирование щелочнорастворимого органического вещества исследуемых почв (рис. 5) и выполнена оценка относительной доли отдельных фракций (табл. 2). Предложенный алгоритм позволил разделить ГВ на три молекулярно гомогенные фракции по их способности вступать во взаимодействия с ионами меди. По содержанию относительной доли было установлено, что минимальной способностью связывать ионы меди в органогенном горизонте характеризовалась торфяно-подзолисто-глееватая почва, а максимальной – подзолистая почва. Для минеральных горизонтов, наибольшая доля органических соединений, вступающих в реакцию с ионами меди, выявлена для ГВ торфянисто-подзолисто-глееватой почвы, минимальная – для подзолистой почвы.
Таблица 2.
Относительное содержание фракций в составе 0.1 моль/дм3 NaOH экстракта органогенного и минерального горизонтов (среднее из трех измерений), %
| Тип почв | Хроматографическая фракция* | Сумма 2–3 | ||
| 1 | 2 | 3 | ||
| Подстилка | ||||
| I | 81 ± 6 | 3.2 ± 0.4 | 16 ± 5 | 19.2 |
| II | 68.7 ± 0.9 | 5.6 ± 0.6 | 25.8 ± 1.4 | 31.4 |
| III | 86 ± 3 | 4.4 ± 0.9 | 10.0 ± 2.4 | 14.4 |
| Элювиальный горизонт | ||||
| I | 60.8 ± 3.0 | 3.0 ± 0.9 | 36.3 ± 2.0 | 39.3 |
| II | 65.9 ± 3.5 | 5.5 ± 0.5 | 27 ± 3 | 32.5 |
| III | 60 ± 7 | 10 ± 4 | 30 ± 3 | 40 |
Примечание. Здесь и в табл. 3: 1 – слабосвязанные органические соединения; 2 – связанные органические соединения; 3 – прочносвязанные с ионами меди органические соединения; почвы: I – подзол иллювиально-железистый; II – подзолистая; III– торфянисто-подзолисто-глееватая.
Оценка содержания отдельных фракций с учетом содержания углерода в щелочной вытяжке и относительного содержания хроматографических фракций приведена в табл. 3. Среди органогенных горизонтов минимальным содержанием второй и третьей фракций характеризовался подзол – 14.4 г/кг почвы, близкие значения получены для подстилки торфянисто-подзолисто-глееватой почвы. Содержание углерода cвязаных и прочносвязанных соединений в подзолистой почве составляет 21 г/кг почвы, при минимальном содержании углерода, извлекаемого щелочной вытяжкой. На первый взгляд комплексообразующая способность компонентов ГВ из минеральных горизонтов существенно меньше. Максимальное содержание соединений второй и третьей фракции выявлено для подзолистой почвы, в то время как для подзола и торфянисто-подзолисто-глееватой почвы оно в 2–3 раза меньше. Отчасти это связано с меньшим количеством органического углерода в горизонте. С другой стороны, необходимо учитывать, что в составе щелочного экстракта из элювиальных горизонтов подзолов до 50% ГВ находится в составе устойчивых комплексных соединений с железом и алюминием [6, 12], не способных вступать во взаимодействия с иммобилизованной матрицей геля.
Таблица 3.
Содержание углерода в составе 0.1 моль/дм3 NaOH экстракта и хроматографических фракциях, г/кг
| Тип почв | С0.1NaOH | Хроматографическая фракция | Сумма 2–3 | ||
|---|---|---|---|---|---|
| 1 | 2 | 3 | |||
| Подстилка | |||||
| I | 75 | 60.8 | 2.4 | 12.0 | 14.4 |
| II | 67 | 46.0 | 3.8 | 17.3 | 21.0 |
| III | 102 | 87.7 | 4.5 | 10.2 | 14.7 |
| Элювиальный горизонт | |||||
| I | 1.6 | 1.0 | 0.0 | 0.6 | 0.6 |
| II | 4.5 | 3.0 | 0.2 | 1.2 | 1.5 |
| III | 1.3 | 0.8 | 0.1 | 0.4 | 0.5 |
Для возможной аппроксимации результатов на свойства почв в табл. 4 представлены константы устойчивости (pKa) с ионами меди индивидуальных соединений с различными функциональными группами. Исходя из полученных хроматограмм и приведенных логарифмов констант устойчивости, можно предположить, что в первый хроматографический пик попадают вещества, которые либо не вступают во взаимодействие с ионами меди на поверхности геля, либо слабо взаимодействуют с иммобилизованным на матрице лигандом. Вследствие чего они элюируются во время прохождения через систему стартового буфера. Диапазон значений pKa индивидуальных соединений, которые элюировались со временем удерживания, попадающим в значения интервала первой фракции, составляет pKa 4.4–8.6 (табл. 3). При этом индивидуальные соединения, попадающие в первую фракцию, несколько отличаются по времени удерживания (рис. 6). Можно предположить, что в первый пик входят вещества со свойствами, схожими с щавелевой, аспарагиновой кислотами и глицином. В эту фракцию преимущественно входят низкомолекулярные соединения с амино- (–NH2) и карбоксильными (–COOH) функциональными группами. Время элюирования фракций органических соединений, которые не вступали во взаимодействие с ионами меди, соответствовало времени элюирования модельных веществ.
Таблица 4.
Органические вещества, используемые в работе, и их константа устойчивости, при рН 7 и 25°С (по [17])
| Вещество | Структурная формула | рКа комплексных соединений с ионами меди | Время элюирования, мин |
|---|---|---|---|
| ЭДТА | 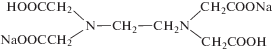 |
18.8 15.5 16.5 |
– |
| 8-Оксихинолин |  |
12.2 23.4 |
19.0 32.5 |
| Гистидин солянокислый | 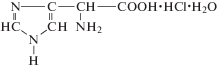 |
10.2 18.3 |
18.2 32.6 |
| Аспарагиновая кислота | 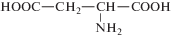 |
8.6 15.4 |
5.3 32.4 |
| Фенилаланин | 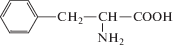 |
8.3 14.7 |
6.0 32.5 |
| Глицин | 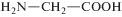 |
8.1 15.2 |
4.5 32.3 |
| Щавелевая кислота |  |
4.4 | 4.4 |
Рис. 6.
IMAC-хроматограммы индивидуальных органических соединений по используемому в работе алгоритму фракционирования.

Вторая хроматографическая фракция содержит органические соединения, связанные с медью, элюирование которых с колонки происходит в присутствии ацетатного буфера с низким рН. Диапазон значений логарифмов констант устойчивости таких индивидуальных соединений можно оценить от 8.6 до 10.2 (рис. 7). Время элюирования второй фракции ГВ щелочного экстракта из почвы также совпадает со временем элюирования индивидуальных веществ: гистидина солянокислого и 8-оксихинолина. Возможно, в этой фракции присутствуют соединения, содержащие N-гетероциклические ароматические структуры.
Рис. 7.
IMAC-хроматограмма 0.1 моль/дм3 NaOH экстракта из подстилки подзолистой почвы: 1 – слабосвязанные органические соединения, 2 – связанные органические соединения, 3 – прочносвязанные с ионами меди органические соединения.
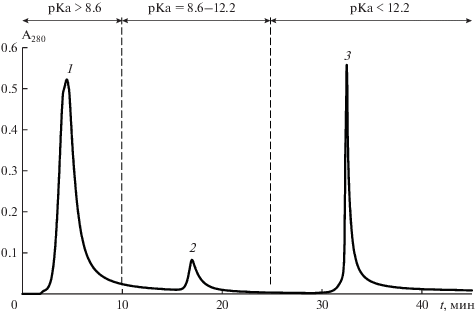
На основании времени элюирования пика 8-оксихинолина, можно предположить, что диапазон значений pKa органических соединений прочносвязанных с ионами меди составляет более 12.2. Учитывая, что катионы меди полностью элюируются с колонки раствором 0.2 моль/дм3 ЭДТА, верхний предел их константы устойчивости, вероятно, ограничен 18. На основании исследования хроматографического поведения индивидуальных органических соединений можно предположить, что по комплексообразующим характеристикам (схожесть ионогенных групп) они аналогичны ГВ почв. Третий пик на хроматограммах модельных соединений связан со вторыми константами устойчивости, которые описаны для большинства исследуемых индивидуальных веществ. Вероятно, именно соединения, входящие в третью фракцию, играют наиболее существенную роль в длительной стабилизации катионов меди. Возможно, это наиболее сложные молекулярные структуры, содержащие в основе как ароматические структуры, так и карбоксильные группы. Можно предположить, что компоненты данной фракции представлены наиболее высокомолекулярными специфичными для почв биополимерами.
По сравнению с модельными органическими веществами хроматограммы образцов почвенного раствора демонстрировали более широкие пики, что указывает на смешанный состав близкородственных лигандов с очень схожим сродством к меди.
Необходимо отметить, что градация соединений, входящих в отдельные фракции, с логарифмами констант устойчивости (pKa) является условной, поскольку в зависимости от значений рН и электропроводности числовые значения констант могут несколько изменяться. Ранее проведенные работы [28] показали, что pKa соединений металлов с индивидуальными веществами имеют незначительное влияние на удерживающую способность.
ЗАКЛЮЧЕНИЕ
Опробованы различные приемы разделения гумусовых веществ на молекулярно гомогенные фракции по сродству к взаимодействию с ионами меди. Наиболее эффективным приемом IMAC признано последовательное изменение pH элюента, приводящее к протонированию донорных групп. Предложенный алгоритм разделения щелочного экстракта ГВ позволяет выделить три фракции ГВ, компоненты которых различаются по способности связывать ионы меди (слабосвязанные органические соединения; связанные органические соединения; прочносвязанные с ионами меди органические соединения). На основании использования индивидуальных веществ с известными функциональными группами и значениями pKa с ионами меди выявлено, что в первую фракцию ГВ попадают низкомолекулярные соединения не связывающие ионы меди, а также характеризуемые низкими показателями pKa (до 8.6), обусловленными низкомолекулярными соединениями с амино- и карбоксильными функциональными группами, во вторую фракцию – соединения, содержащие N-гетероциклические ароматические структуры. К третьей фракции прочносвязанных органических соединений отнесены наиболее высокомолекулярные соединения с pKa > 12.2.
По данному алгоритму фракционирования проанализированы ГВ подстилок и элювиальных горизонтов подзолов иллювиально-железистых, подзолистых почв и торфянисто-подзолисто-глееватых. Количественная оценка вклада углерода отдельных фракций показала, что наибольшей способностью связывать ионы меди, обладают ГВ подзолистой почвы. Опробованный вариант фракционирования может быть использован для оценки устойчивости почв к загрязнению тяжелыми металлами.
Список литературы
Безносиков В.А., Лодыгин Е.Д., Чуков С.Н. Ландшафтно-геохимическая оценка фонового содержания тяжелых металлов в почвах таежной зоны // Вестник Санкт-Петербургского университета. Сер. 3. Биология. 2010. № 2. С. 114-128.
Даванков В.А., Навратил Дж., Уолтон Х. Лиганднообменная хроматография: пер. с англ. М.: Мир, 1990. 294 с.
Дымов А.А., Лаптева Е.М., Калашников А.В., Денева С.В. Фоновое содержание тяжелых металлов, мышьяка и углеводородов в почвах Большеземельской тундры // Теоретическая и прикладная экология. 2010. № 4. С. 43–48.
Дымов А.А., Жангуров Е.В., Старцев В.В. Почвы северной части Приполярного Урала: морфология, физико-химические свойства, запасы углерода и азота // Почвоведение. 2013. № 5. С. 507–516.
Дымов А.А., Милановский Е.Ю. Изменение органического вещества таежных почв в процессе естественного лесовозобновления растительности после рубок (средняя тайга Республики Коми) // Почвоведение. 2014. № 1. С. 39–47.
Дымов А.А. Почвы послерубочных, постпирогенных ипостагрогенных лесных экосистем северо-востока европейской части России. Автореф. дис. … докт. биол. наук. М., 2018. 48 с.
Кабата-Пендиас А., Пендиас Х. Микроэлементы в почвах и растениях: пер. с англ. М.: Мир, 1989. 439 с.
Кельциева О.А., Гладилович В.Д., Подольская Е.П. Металл-аффинная хроматография. Основы и применение // Научное приборостроение. 2013. Т. 23. № 1. С. 74–85.
Ладонин Д.В. Соединения тяжелых металлов в почвах – проблемы и методы изучения // Почвоведение. 2002. № 6. С. 682–692.
Луговской А.А., Яковлева А.С., Щербаков А.В. Синтез сорбента для металл-хелатной аффинной хроматографии и его применение для выделения рекомбинантных белков // Труды федерального центра охраны здоровья животных. 2007. Т. 5. С. 248–255.
Милановский Е.Ю. Амфифильные компоненты гумусовых веществ почв // Почвоведение. 2000. № 6. С. 706–7015.
Милановский Е.Ю. Гумусовые вещества почв как природные гидрофобно-гидрофильные соединения. М.: ГЕОС, 2009. 186 с.
Минкина Т.М., Мотузова Г.В., Назаренко О.Г., Крыщенко В.С., Манджиева С.С. Формы соединений тяжелых металлов в почвах степной зоны // Почвоведение. 2008. № 7. С. 810–818.
Орлов Д.С., Минько О.И., Демин В.В., Сальников В.Г., Измайлова Н.Б. О природе и механизмах образования металл-гумусовых комплексов // Почвоведение. 1988. № 9. С. 43–52.
Пинский Д.Л. Ионообменные процессы в почвах. Пущино: Ин-т почвоведения и фотосинтеза РАН, 1997. 166 с.
Семенов В.М., Когут Б.М. Почвенное органическое вещество. М.: ГЕОС, 2015. 233 с.
Справочник биохимика: пер. с англ. М.: Мир, 1991. 544 с.
Andersson L., Porath J. Isolation of phosphoproteins by immobilized metal (Fe3+) affinity chromatography // Analytical Biochemistry 1986. V. 154. P. 250–254.
Bauer T., Pinskii D., Minkina T., Nevidomskaya D., Mandzhieva S., Chaplygin V., Popileshko Y. Time effect on the stabilization of technogenic copper compounds in solid phases of Haplic Chernozem // Sci. Total Environ. 2018. V. 626. P. 1100–1107. https://doi.org/10.1016/j.scitotenv.2018.01.134
Block H., Maertens B., Spriestersbach A., Brinker N., Kubicek J., Fabis R., Labhan J, Schäfer F. Immobilized-metal affinity chromatography (IMAC): a review // Methods Enzymol. 2009. V. 463. P. 439–473. https://doi.org/10.1016/j.pep.2007.09.019
Cheung R.C.F., Wong J.H., Ng T.B. Immobilized metal ion affinity chromatography: a review on its applications // Appl. Microbiol. Biotechnol. 2012. V. 96. P. 1411–1420. https://doi.org/10.1007/s00253-012-4507-0
Dymov A.A., Gabov D.N. Pyrogenic alterations of Podzols at the North-East European part of Russia: morphology, carbon pools, PAH content // Geoderma. 2015. V. 241–242. P. 230–237. https://doi.org/10.1016/j.geoderma.2014.11.021
Halko R., Neurocny T., Huttai M. Utilization of immobilized aluminium(III) metall ion affinity chromatography for analysis of humic acids // Polish J. Soil Sci. 2009. V. XLII/2. P. 149–157.
Helfferich F.T. Ligand exchange: A novel separation technique // Nature. 1961. V. 189. P. 1001–1002. https://doi.org/10.1038/1891001a0
Hutta M., Gora R., Halko R., Chalanyova M. Some theoretical and practical aspects in separation of humic substances by combined liquid chromatography methods // J. Chromatography A. 2011. V. 1218. P. 8946–8957. https://doi.org/10.1016/j.chroma.2011.06.107
Instruction 28-4046-21 AD affinity media IMAC Sepharose TM 6 Fast Flow. 22 p.
Nixon R.L., Ross A.R. Evaluation of Immobilized Metal-Ion Affinity Chromatography and Electrospray Ionization Tandem Mass Spectrometry for Recovery and Identification of Copper(II)-Binding Ligands in Seawater Using the Model Ligand 8-Hydroxyquinoline // Frontiers in Marine Science. 2016. V. 3.246. https://doi.org/10.3389/fmars.2016.00246
Paunovic I., Schulin R., Nowack B. Fractionation of dissolved organic carbon from solution with immobilized metal ion affinity chromatography // European J. Soil Sci. 2008. № 4. V. 59. P. 198–207. https://doi.org/10.1111/j.1365-2389.2007.00975.x
Paunovic I., Schulin R., Nowack B. Evaluation of immobilized metal-ion affinity chromatography for the fractionation of natural Cu complexing ligands // J. Chromatography A. 2005. V. 1100. P. 176–184. https://doi.org/10.1016/j.chroma.2005.09.055
Piccolo A. The Supramolecular Structure of Humic Substances: a Novel Understanding of Humus Chemistry and Implications in Soil Science // Adv. Agronomy. 2002. V. 75. P. 57–134. https://doi.org/10.1097/00010694-200111000-00007
Porath J., Carlsson J., Olsson I., Belfrage G. Metal chelate affinity chromatography a new approach to protein fractionation // Nature. 1975. V. 258. P. 598–599. https://doi.org/10.1038/258598a0
Protein purification: Principles, High Resolution Methods, and Application / Eds. Janson J.Ch., Ryden L. N.Y., 1998. 695 p.
Дополнительные материалы отсутствуют.