Почвоведение, 2020, № 4, стр. 444-462
Микробная биомасса, запасы углерода и эмиссия СО2 в почвах Земли Франца-Иосифа: высокоарктические тундры или полярные пустыни?
Д. А. Никитин a, *, Л. В. Лысак b, Н. С. Мергелов c, А. В. Долгих c, Э. П. Зазовская c, С. В. Горячкин c
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
c Институт географии РАН
119017 Москва, Старомонетный пер., 29, Россия
* E-mail: dimnik90@mail.ru
Поступила в редакцию 23.07.2019
После доработки 20.08.2019
Принята к публикации 27.11.2019
Аннотация
В мерзлотных почвах архипелага Земля Франца-Иосифа – псаммоземах (Cryosols (Arenic)), пелоземах (Cryosols (Loamic)), криоземах (Oxyaquic Cryosols), литоземах (Leptosols (Loamic)) и серогумусовых (Cryosols (Loamic, Humic)) – проведено исследование биомассы прокариот и грибов, запасов общего органического углерода, а также эмиссии CO2. Больше всего запасы углерода оказались в литоземах грубогумусированных в условиях защиты от сильных ветров (23.2 кг С/м2 в верхнем полуметровом слое), а также в пелоземах и псаммоземах, содержащих погребенное криотурбациями органическое вещество (13.7 и 20.7 кг С/м2 соответственно). Численность прокариот в исследованных почвах Земли Франца-Иосифа составляет от 0.14 до 2.10 млрд кл./г почвы. Максимальные значения биомассы прокариот характерны для подстилочно-торфяных горизонтов. В 80% случаев доля спор составляет более половины суммарной биомассы грибов. Споры и мицелий преимущественно представлены мелкими формами диаметром до 2–3 мкм. Длина грибного мицелия в образцах колеблется от 4 до 272 м/г почвы. Максимальное развитие грибов отмечено в лишайниковых корочках и моховых очесах, экспоненциально снижаясь с увеличением глубины горизонта. Одновременно с глубиной в микробной биомассе в несколько раз возрастает и доля прокариот. В почвах наиболее экстремальных экосистем высокоарктических пустошей на микробную биомассу приходится бóльшая доля в общем углероде по сравнению с почвами местных высокоарктических тундр (12.7 против 2.5%). Уровни эмиссии СО2 с поверхности ненарушенных почв варьируют в диапазоне 1.6–91.7 мг C–CO2/(м2 ч) и различаются между высокоарктическими тундрами и пустошами в десятки раз. По запасам углерода и эмиссии CO2 исследованные почвы близки к почвам арктических тундр, а по некоторым характеристикам концентрации и распределения прокариот и грибов близки к почвам Антарктиды и жарких пустынь.
ВВЕДЕНИЕ
В исследовании природы полярных регионов существует немало вопросов. Один из них – проблема зональности Арктики [4]. Разные подходы к зональности воплотились и в недавно изданном Национальном атласе Арктики [27]. Если самая высокоширотная зона на карте почвенно-географического районирования названа “арктической зоной (высокоарктической тундропустошью)”, то на карте растительности она уже определена как “высокоарктические тундры”, а на карте зон и типов поясности она отнесена к зоне тундр и названа “подзоной высокоарктических тундр (полярных пустынь)”. При оценке ландшафтной структуры территории Российской Арктики самая высокоширотная область делимитирована так же, как и на предыдущих картах, но отнесена она к “арктическим (полярным) пустыням”. Такая разница в подходах и представлениях и решение проблемы зональности Арктики требует современных и глубоких исследований всех компонентов экосистем, особенно биологической составляющей почв.
Почвы самого северного в России и в восточном полушарии архипелага Земля Франца-Иосифа (ЗФИ), которые всеми исследователями однозначно отнесены к самой высокоширотной области Арктики, практически не изучались на протяжении шести десятилетий (с 1950 по 2010 гг.). После фундаментальных исследований Говорухи и Михайлова [25, 26] наступил длительный перерыв вплоть до организации Национального парка “Русская Арктика” и проекта “Арктический плавучий университет”, которые создали инфраструктуру для всестороннего изучения различных компонентов экосистем ЗФИ, включая почвы и микроорганизмы, населяющие их [1, 3, 4, 20, 29, 48, 56].
Несмотря на интенсификацию работ, почвы ЗФИ остаются новыми объектами для изучения специалистами практически любого направления почвоведения и экологии. Актуальность их исследования постоянно возрастает из-за обостренной реакции полярных экосистем ЗФИ на глобальные изменения климата. Целостная картина строения почвенного покрова архипелага, так же, как и всей высокоширотной части Арктики, еще не составлена [4]. Недавние исследования в рамках экспедиций “Арктического плавучего университета” показали, что почвенный покров островов Алджер, Гукера, Земля Александры, Ферсмана и Хейса имеет мозаичное строение [6], которое определяется не столько широтным положением островов, сколько сложившимися на них местными условиями. На изученных участках соседствуют почвы высокоарктических тундр с развитыми подстилками и/или гумусовыми горизонтами и почвы высокоарктических пустошей, с органогенными горизонтами в виде тонкой криптогамной биопочвенной корки (biological soil crust [56]) с редким присутствием сосудистых растений, обладающих очень разреженными корневыми системами. Почвы ЗФИ часто переувлажнены, иногда криотурбированы, а процессы аридного почвообразования в них пока не обнаружены. В связи с этим мы предложили использовать термин “пустошь” и отказаться от термина “полярная пустыня” в данном конкретном случае [4].
Из-за малой мощности растительного покрова в высокой Арктике, микроорганизмы могут выступать в роли биоты, наиболее активно участвующей в биогеохимических циклах и почвообразовании [42, 51]. Полярные экосистемы характеризуются относительно небольшим количеством компонентов, поэтому удобны для изучения почвенного микробиома [44]. По нашим данным, микробиологические исследования на ЗФИ касались лишь микобиоты и носили эпизодический характер [15, 24, 29]. Причем внимание микологов на архипелаге уделялось в основном лишайникам и макромицетам [9, 24], а по микроскопическим грибам опубликовано всего три работы [15, 16, 39]. На настоящий момент нам не известны работы по оценке реальной численности микроорганизмов в почвах ЗФИ на основе прямых микробиологических методов.
Задача настоящей работы – охарактеризовать на различных островах ЗФИ состояние таких почвенных параметров, как запасы и структура микробной биомассы, общее содержание органического углерода, а также почвенное дыхание (эмиссия СO2 c поверхности почвы). Эти характеристики часто взаимосвязаны и весьма чувствительны к климатическим изменениям, активно затрагивающим экосистемы островов ЗФИ, поэтому важно зафиксировать их текущее состояние. Кроме того, значения таких параметров, как запасы органического вещества и почвенное дыхание важны для решения указанной выше проблемы зональности Арктики.
ОБЪЕКТЫ И МЕТОДЫ
Полевые исследования почвенного покрова и отбор образцов проводили во второй половине июля 2017 г. в рамках экспедиции Арктического плавучего университета. Расположение островов, координаты разрезов, морфологический облик и классификационный статус почв [6, 45] представлены на рис. 1. Подробное описание разрезов приведено в нашей предыдущей публикации [6]. Почвенный покров на ключевых участках пяти островов ЗФИ представлен чередованием псаммоземов глееватых/Turbic Cryosol (Arenic) (пустоши на о. Алджер), псаммоземов криотурбированных мерзлотных/Turbic Cryosol (Humiс) и серогумусовых грубогумусированных мерзлотных почв/ Haplic Cryosol (Humic) (тундры о. Ферсмана), псаммоземов глеевых/Reductaquic Cryosol (Arenic), псаммоземов мерзлотных брюнифицированных/Haplic Cryosol (Arenic) и криоземов глееватых/Oxyaquic Cryosol (Arenic) (тундры и пустоши о. Хейса), литоземов грубогумусированных/Eutric Leptosol (Loamic, Humic) и серогумусовых почв/ Skeletic Leptosol (Loamic, Humic) (тундры о. Гукера), литоземов грубогумусовых мерзлотных/Skeletic Oxyaquic Cryosol (Loamic, Humic), серогумусовых мерзлотных/Oxyaquic Cryosol (Loamic, Humic) и серогумусовых перегнойно-грубогумусированных почв/Oxyaquic Cryosol (Loamic, Humic), а также пелоземов перегнойных криотурбированных/Oxyaquic Turbic Cryosol (Loamic, Humic) (тундры о. Земля Александры).
Рис. 1.
Объекты исследования: A – расположение точек исследования на пяти островах ЗФИ; Б – о. Алджер, разрез ZFI-A-01, 80°21′34.5″ N, 56°13′20.2″ E, псаммозем глееватый/Turbic Cryosol (Arenic); В – о. Ферсмана, разрез ZFI-F-02, 80°37′43.4″ N, 57°58′42.4″ E, серогумусовая грубогумусированная мерзлотная/Haplic Cryosol (Humic); Г – о. Ферсмана, разрез ZFI-F-03, 80°37′46.9″ N, 57°58′40.4″ E, псаммозем криотурбированный мерзлотный/Turbic Cryosol (Humiс); Д– о. Хейса. мыс Зенит, разрез ZFI-H-04, 80°36′47.6″ N, 57°29′45.9″ E, псаммозем глеевый мерзлотный/Reductaquic Cryosol (Arenic); Е – о. Хейса, мыс Зенит, разрез ZFI-H-05, 80°36′47.4″ N, 57°29′38.4″ E, криозем глееватый/Oxyaquic Cryosol (Arenic); Ж – о. Хейса, мыс Зенит, разрез ZFI-H-06, 80°36′42.4″ N, 57°29′37.5″ E, псаммозем мерзлотный (брюнифицированный)/Haplic Cryosol (Arenic); З – о. Гукера, Бухта Тихая, разрез ZFI-HK-08, 80°20′18.1″ N, 52°47′07.9″ E, литозем грубогумусированный/Eutric Leptosol (Loamic, Humic); И – о. Гукера, Бухта Тихая, разрез ZFI-HK-09, 80°20′18.5″ N, 52°47′09.4″ E, серогумусовая/Skeletic Leptosol (Loamic, Humic); К – о. Земля Александры, мыс Мелехова, разрез ZFI-AX-10, 80°42′59.9″ N, 47°53′33.8″ E, литозем грубогумусовый мерзлотный/Skeletic Oxyaquic Cryosol (Loamic, Humic); Л – о. Земля Александры, мыс Мелехова, разрез ZFI-AX-11, 80°43′01.5″ N, 47°53′28.2″ E, серогумусовая мерзлотная/Oxyaquic Cryosol (Loamic, Humic); М – о. Земля Александры, мыс Мелехова, разрез ZFI-AX-12, 80°43′03.3″ N, 47°53′45.3″ E, пелозем перегнойный криотурбированный/Oxyaquic Turbic Cryosol (Loamic, Humic).

Образцы в полевых условиях отбирали методом усреднения пяти единичных проб. Предназначенные для микробиологических исследований образцы хранились в стерильных емкостях при температуре –18°С сначала в морозильной камере на судне “Профессор Молчанов”, а затем в лаборатории. Содержание и запасы углерода определяли для всех разрезов, представленных на рис. 1. Материал для микробиологических исследований отобрали из меньшего числа разрезов: ZFI-A-01 (псаммозем глееватый, о. Алджер), ZFI-F-02 (серогумусовая грубогумусированная мерзлотная почва, о. Ферсмана), ZFI-F-03 (псаммозем криотурбированный мерзлотный, о. Ферсмана), ZFI-H-04 (псаммозем глеевый мерзлотный, о. Хейса), ZFI-H-05 (криозем глееватый, о. Хейса), ZFI-HK-08 (литозем грубогумусированный, о. Гукера), ZFI-AX-10 (литозем грубогумусовый мерзлотный, о. Земля Александры). Эмиссию диоксида углерода с поверхности почвы измеряли для каждой ландшафтной фации, в рамках которой закладывался разрез.
Содержание углерода и азота определяли методом сухого сжигания на CNSH-анализаторе Vario Isotope.
Запасы углерода рассчитывали для каждого горизонта отдельно с учетом его мощности и объемной плотности. При подсчете суммарных запасов элемента в педоне результаты складывали по горизонтам. Для стандартизации результатов, а также учитывая среднюю мощность почвенного профиля на островах ЗФИ, запасы пересчитывали на глубину 50 см. Запасы азота не рассчитывали, так как при относительно низком содержании элемента это может привести к искажению результатов.
Почвенную эмиссию диоксида углерода измеряли прямоточным методом закрытых камер с помощью портативного инфракрасного СО2-газоанализатора, выполненных на основе датчиков AZ 77532 (Temp-CO2) (Тайвань), калиброванного по портативному инфракрасному СО2-анализатору Li-8100 (LiCor Corp, США). Для проведения замеров почвенной эмиссии на каждом изучаемом объекте в почву на глубину 2–4 см вкапывали по 5–10 цилиндрических ПВХ-оснований, площадью 90 см2 объемом около 1–2 л, на расстоянии от 3 до 10 м друг от друга. При установке избегали попадания внутрь оснований крупной растительности (кустарничков), а также удаляли надземные части травянистых растений и верхнюю часть мохово-лишайникового покрова. Для перемешивания воздуха внутри камер использовали встроенные вентиляторы. Основания врезали на глубину 2–3 см за 1 ч до начала измерений, после чего проводили замер эмиссии СО2 в течение 3 мин на каждом из оснований. Всего за период исследований было проведено 70 единичных измерений почвенного дыхания на 16 ключевых участках. Одновременно проводили измерение температуры приземного слоя воздуха и почв на глубинах 1 и 10 см карманным электронным термометром с датчиком на кабеле HI98509 Checktemp-1 (Hanna Instruments, США), а также влажности почв влагомером HH-2 ML3-Kit Thetakit (Delta-T, Великобритания). Статистическую обработку данных и расчеты проводили с помощью пакета Microsoft Excel.
Биомасса прокариот. Общую численность прокариот определяли с помощью метода прямой микроскопии с использованием люминесцентного микроскопа Zeiss Axioskop 2 plus (Германия) (объектив ×100, масляная иммерсия).
Данный метод сводится к тому, что приготовленные из почвенной суспензии препараты окрашиваются красителем акридином оранжевым [30]. Пробу почвы (растительного материала) массой 1 г помещали в колбу со 100 мл стерильной воды. Для десорбции клеток с поверхности почвенных частиц почвенную суспензию обрабатывали ультразвуком, используя прибор УДНЗ-1 (2 мин, 22 кГц, 0.44 А).
Последующую окраску препаратов акридином оранжевым проводили по следующей методике [10]: на стекло наносили 10 мкл суспензии и распределяли по площади 2 × 2 см2, затем стекло фиксировали в пламени горелки и окрашивали акридином оранжевым (в соотношении красителя и воды 1 : 10 000, 2–4 мин) непосредственно перед просмотром под микроскопом с УФ-источником света. Из каждого образца готовили 6 препаратов, в каждом из которых подсчитывали клетки в 30 полях зрения. Расчет количества бактериальных клеток на 1 г субстрата производили по формуле:
Биомасса грибов. Численность грибных пропагул и длину грибного мицелия определяли методом люминесцентной микроскопии на микроскопе Zeiss Axioskop 2 plus (Германия) при увеличении 400.
Препараты почвенной суспензии (разведение 1 : 100) окрашивали флуоресцентным красителем калькофлуором белым (КБ) [30]. Десорбцию клеток с почвы проводили при помощи вортекса MSV-3500 (Латвия) при скорости 3500 об./мин в течение 10 мин.
На стекло наносили 10 мкл суспензии и распределяли по площади 2 × 2 см2, затем стекло фиксировали в пламени горелки и окрашивали КБ (в соотношении красителя и воды 1 : 10 000, 15–20 мин) непосредственно перед просмотром под микроскопом с УФ-источником света. Из каждого образца готовили три препарата, на каждом из которых подсчитывали клетки в 90 полях зрения. Расчет количества грибных клеток на 1 г субстрата производили по формуле:
Длину грибного и актиномицетного мицелия в 1 г образца определяли по формуле:
Расчет грибной биомассы (мг/г почвы) проводили, полагая, что плотность спор равна 0.837 г/см3, а плотность мицелия – 0.628 г/см3 [30].
Содержание грибной биомассы на грамм сухой почвы рассчитывали с учетом ее влажности. Статистическую обработку данных осуществляли с помощью программ Microsoft Оffice Excel 2016 и Stаtistica 8.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Почвенный углерод и азот. В исследованных псаммоземах, пелоземах, криоземах, литоземах и серогумусовых почвах пяти островов самого северного в восточном полушарии архипелага содержится значительное количество углерода (табл. 1), что, в целом, соответствует их морфологическому портрету (цвету и мощности органогенных горизонтов, наличию погребенного органического вещества) и контрастирует с имеющимися ранее представлениями – в Национальном атласе Арктики (2017) на карте “Запасы органического углерода в почвах и торфах” запасы на всей ЗФИ для глубины 0–100 см, то есть в 2 раза глубже, чем наши расчеты, оценены как менее 40 т/га, что соответствует <4 кг С/м2. Распределение содержания углерода по профилю чаще имеет аккумулятивный характер с максимальными значениями в поверхностных органогенных горизонтах и варьирует в очень широком диапазоне 0.42−30.66%. Варьирование в наибольшей степени связано с неоднородностью растительного покрова как внутри отдельных островов, так и между ними: от тонких лишайниковых, водорослевых и цианобактериальных корочек (0.42−3.22% С) до мощных моховых покровов или парцелл с преобладанием злаков (2.73−30.66% С). В минеральных горизонтах содержится от сотых долей до нескольких процентов углерода (максимальное значение 5.87%). В пяти из 12 изученных разрезов аккумулятивное распределение нарушается, и вторые пики в содержании углерода приходятся либо на центральную, либо на надмерзлотную части профиля, что объясняется активными процессами криогенного массообмена. Кроме того, наблюдаются закономерности в латеральном распределении углерода характерные для тундр в связи с комплексностью их почвенного покрова (повышенное накопление углерода в мерзлотных трещинах). Содержание углерода между полигоном и трещиной может отличаться на порядок, например, в пелоземе перегнойном криотурбированном в высокоарктической тундре на о. Земля Александры (разрез ZFI-AX-12) или на два порядка – в псаммоземе глееватом в высокоарктической пустоши на о. Алджер (разрез ZFI-A-01).
Таблица 1.
Углерод и азот в почвах некоторых островов ЗФИ
| Горизонт | Глубина, см | C, % | N, % | C/N | Плотность почвы, г/см3 | Запасы С, кг/м2 |
|---|---|---|---|---|---|---|
| О. Алджер. Разрез ZFI-A-01. Псаммозем глееватый | ||||||
| W, трещина | 0–1 | 1.54 | 0.08 | 19 | 0.8 | 0.1 |
| WCf, полигон | 0–2 | 0.19 | 0.02 | 10 | 0.8 | <0.1 |
| Сf, полигон | 2–13 | 0.08 | 0.01 | 8 | 1.3 | 0.1 |
| Cf, трещина | 20–22 | 1.03 | 0.03 | 34 | 1.3 | 1.6 |
| Cg, трещина | 13–45 | 0.08 | 0.01 | 8 | 1.4 | 0.4 |
| Cg, трещина | 13–45 | 0.06 | 0.01 | 12 | 1.4 | 0.3 |
| О. Ферсмана. Разрез ZFI-F-02. Серогумусовая грубогумусированная мерзлотная почва | ||||||
| Корка лишайника | 0.3–0 | 6.29 | 0.41 | 15 | 1.0 | 0.2 |
| AY | 0–5 | 1.04 | 0.07 | 15 | 0.7 | 0.4 |
| AC | 5–17 | 0.87 | 0.06 | 15 | 1.0 | 1.0 |
| С | 17–40 | 1.11 | 0.07 | 16 | 1.2 | 3.1 |
| О. Ферсмана. Разрез ZFI-F-03. Псаммозем криотурбированный мерзлотный | ||||||
| Oao | 0–2 | 27.9 | 1.13 | 25 | 0.6 | 3.4 |
| Kорка | 0–5 | 3.18 | 0.28 | 11 | 1.0 | 1.6 |
| W | 2–5 | 1.29 | 0.13 | 10 | 1.0 | 0.4 |
| W@ | 2–5(10) | 1.55 | 0.15 | 10 | 0.9 | 0.8 |
| [AO1]@ | 10–30(35) | 3.76 | 0.35 | 11 | 0.9 | 7.5 |
| BC@,h | 5–35(45) | 0.79 | 0.08 | 10 | 0.9 | 2.5 |
| [AO2]@ | 35–48 | 5.87 | 0.55 | 11 | 1.0 | 7.6 |
| D | 46–48 | 0.80 | 0.05 | 16 | 1.2 | 0.2 |
| О. Хейса. Разрез ZFI-H-04. Псаммозем глеевый мерзлотный | ||||||
| W | 0–5 | 0.49 | 0.10 | 5 | 0.9 | 0.2 |
| Корка лишайника | 0–3 | 3.22 | 0.21 | 15 | 1.0 | 1.0 |
| W | 1–2 | 1.34 | 0.13 | 10 | 1.0 | 0.1 |
| Cg | 20–25 | 0.06 | 0.01 | 6 | 1.2 | <0.1 |
| C2g | 40–50 | 0.09 | 0.01 | 6 | 1.2 | 0.1 |
| О. Хейса. Разрез ZFI-H-05. Криозем глееватый | ||||||
| Oao | 3–0 | 3.07 | 0.21 | 14 | 0.6 | 0.6 |
| W | 0–5 | 0.44 | 0.05 | 10 | 0.9 | 0.2 |
| Bg | 5–15 | 0.13 | 0.04 | 3 | 1.2 | 0.2 |
| CR | 15–20 | 0.08 | 0.01 | 9 | 1.2 | <0.1 |
| 2CR | 20–50 | 0.09 | 0.01 | 6 | 1.1 | 0.3 |
| О. Хейса. Разрез ZFI-H-06. Псаммозем мерзлотный (брюнифицированный) | ||||||
| WC | 0–2 | 0.20 | 0.02 | 10 | 0.9 | <0.1 |
| С1 | 2–10 | 0.99 | 0.01 | 99 | 1.2 | 1.0 |
| С2 | 10–(20) | 1.82 | 0.01 | 364 | 1.2 | 2.2 |
| О. Гукера. Разрез ZFI-HK-08. Литозем грубогумусированный | ||||||
| O | 0–5 | 30.66 | 1.69 | 18 | 0.6 | 9.2 |
| AYao | 5–6(10) | 3.69 | 0.36 | 10 | 0.9 | 1.0 |
| BC | 6(10)–15 | 1.46 | 0.17 | 8 | 1.2 | 1.2 |
| BC2 | 15–30 | 1.27 | 0.12 | 11 | 1.3 | 2.5 |
| О. Гукера. Разрез ZFI-HK-09. Серогумусовая почва | ||||||
| AY | 0–5 | 2.73 | 0.25 | 11 | 0.8 | 1.1 |
| BC2 | 2–5 | 0.61 | 0.06 | 10 | 1.1 | 0.2 |
| BC1 | 5–20 | 0.63 | 0.06 | 10 | 1.1 | 1.0 |
| BC3 | 40–60 | 0.35 | 0.03 | 11 | 1.2 | 0.8 |
| О. Земля Александры. Разрез ZFI-AX-10. Литозем грубогумусовый мерзлотный | ||||||
| О | 0–2 | – | – | – | – | – |
| AO | 2–8 | 1.11 | 0.09 | 12 | 0.8 | 0.5 |
| BC | 8–15 | 0.63 | 0.06 | 11 | 1.2 | 0.5 |
| BC | 15–25 | 0.45 | 0.04 | 11 | 1.3 | 0.6 |
| О. Земля Александры. Разрез ZFI-AX-11. Серогумусовая мерзлотная почва | ||||||
| O | 0–1 | – | – | – | – | – |
| AY | 1–5 | 0.42 | 0.04 | 11 | 0.8 | 0.1 |
| BC | 5(10)–20 | 0.19 | 0.02 | 10 | 1.3 | 0.3 |
| BC | 20–35 | 0.19 | 0.02 | 10 | 1.3 | 0.4 |
| О. Земля Александры. Разрез ZFI-AX-12. Пелозем перегнойный криотурбированный, полигон |
||||||
| Oao | 0–2 | 27.85 | 1.56 | 18 | 0.7 | 3.9 |
| AОw | 2–3 | 1.79 | 0.14 | 13 | 0.9 | 0.2 |
| BC1 | 3–15 | 0.67 | 0.07 | 10 | 1.3 | 1.0 |
| BС2 | 15–30 | 0.51 | 0.05 | 10 | 1.3 | 1.0 |
| О. Земля Александры. Разрез ZFI-AX-12. Пелозем перегнойный криотурбированный, трещина |
||||||
| O | 0–2 | – | – | – | – | – |
| OT(AO) | 2–5 | 4.37 | 0.48 | 9 | 0.6 | 0.8 |
| AT1@ | 5–15 | 3.55 | 0.31 | 11 | 0.8 | 2.8 |
| AT2@ | 15–50 | 3.38 | 0.32 | 11 | 0.8 | 4.1 |
Абсолютные значения содержания азота невысокие, но соотношение C/N за редким исключением (разрез ZFI-H-06, о. Хейса) остается в узком интервале: <25 − для поверхностных органогенных горизонтов, 3–16 − для минеральных и 11–34 − для погребенных горизонтов и линз, обогащенных органическим веществом вследствие процессов криогенного массообмена.
Значения запасов углерода в минеральной толще часто превышают таковые в поверхностных органогенных горизонтах (то есть тенденция обратна содержанию элемента). Это является объективным следствием как особенностей расчета − минеральная толща имеет бóльшую мощность, а ее горизонты, как правило, обладают бóльшей объемной плотностью, так и природных процессов, например, поступления органического вещества в минеральные горизонты за счет криогенных механизмов.
Для всех разрезов на пяти островах ЗФИ рассчитаны суммарные запасы углерода, стандартизированные на глубину 50 см (рис. 2). Больше всего углерода содержат литоземы грубогумусированные на о. Гукера (23.2 кг С/м2). Также высокие значения запасов углерода характерны для почв максимально подверженных процессам криогенного массообмена, а именно пелоземов перегнойных криотурбированных на о. Земля Александры и псаммоземов криотурбированных мерзлотных на о. Ферсмана, которые содержат в полуметровом деятельном слое 13.7 и 20.7 кг С/м2 соответственно. Это указывает на то, что даже в таких высокоширотных ландшафтах, как ЗФИ, возможен важный в экологическом смысле процесс накопления почвенного углерода в подповерхностных горизонтах, в том числе его глубокое захоронение в результате криогенного массообмена. Данные по запасам углерода подтверждают наши полевые мезоморфологические наблюдения, зафиксировавшие многочисленные темноцветные линзы погребенного органического вещества, представленного преимущественно криогенно-измельченным детритом. Кроме того, высокие значения запасов почвенного углерода служат дополнительным аргументом в пользу отнесения многих ландшафтов ЗФИ к высокоарктическим тундрам, а не к арктическим пустыням. Как было сказано выше, на ЗФИ участки тундр чередуются с участками пустошей, а почвенный покров приобретает мозаичное строение. Примером почв пустошей служат псаммоземы глееватые на о. Алджер, в которых запасы углерода в полуметровом слое уже на порядок меньше – всего 2.0 кг С/м2. Это во многом связано с локальными факторами, а именно с влиянием расположенного на острове ледника и регулярной денудацией песчаного материала на незащищенных от ветра обширных морских террасах (рис. 2). Последнее препятствует формированию органогенных горизонтов на поверхности за исключением тонких криптогамных корочек.
Рис. 2.
Углерод и азот в почвах высокоарктических тундропустошей ЗФИ (приведены средние значения содержания азота и отношения C/N в почве, запасы азота не рассчитывались, так как при низком содержании элемента это может привести к искажению результатов).
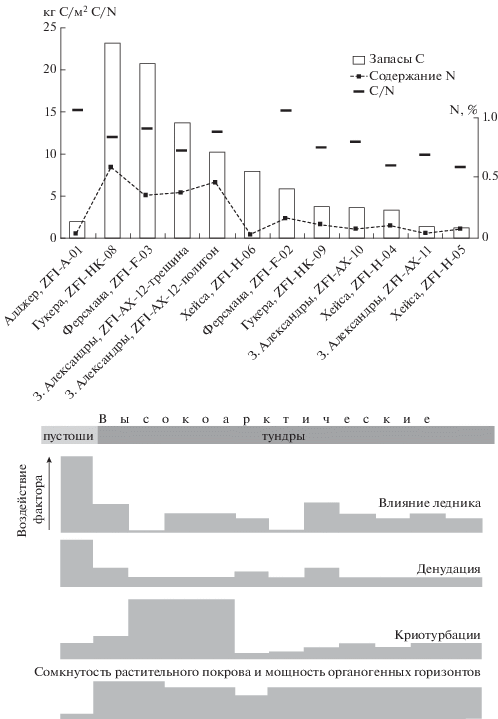
Таким образом, значения содержания и запасов углерода, а также содержания азота и соотношения С/N характеризуют пул этих элементов в почвах ЗФИ как, в целом, благоприятный для функционирования биоты, в том числе прокариот и грибов. Для почв ЗФИ этот ресурсный фактор, видимо, не является в значительной мере лимитирующим (локально – да). Скорее ограничения связаны с доступностью элементов при их достаточном общем количестве, а также с низкими температурами и неравномерным увлажнением субстрата.
Биомасса прокариот. Бактерии и археи дают значимый вклад в запасы органического вещества некоторых почв полярных регионов [18], поэтому учет почвенных прокариот необходим для характеристики пула углерода и азота наземных арктических экосистем. Прокариоты являются неотъемлемым компонентом последних и участвуют во всех стадиях: от биогеохимических циклов углерода, азота и других химических элементов, до формирования гумусовых веществ и структуры почвы [7].
Численность и биомасса прокариот почв ЗФИ (табл. 2) в некоторых случаях отличается более чем на порядок, что в значительной мере связано с локальными экологическими условиями. Минимальные значения прокариотной биомассы выявлены в минеральных горизонтах псаммозема глееватого на о. Алджер (0.0029 мг/г в горизонте Сf и 0.0033 мг/г в горизонте Cg), а максимальные (0.0434 мг/г) − в мохово-лишайниковой подстилке литозема грубогумусового мерзлотного на о. Земля Александры.
Таблица 2.
Общая численность и биомасса прокариот, длина актиномицетного мицелия в почвах ЗФИ (± погрешность, доли %)
| Горизонт | Глубина, см | Общая численность прокариот, млрд кл./г почвы | Биомасса прокариот, мг/г почвы | Длина актиномицетного мицелия, м/г почвы |
|---|---|---|---|---|
| О. Алджер. Разрез ZFI-A-01. Псаммозем глееватый | ||||
| W | 0–1 | 0.67 ± 0.03 | 0.0140 ± 0.0016 | 100 ± 14 |
| Сf | 2–13 | 0.14 ± 0.01 | 0.0029 ± 0.0003 | 100 ± 13 |
| Cf | 20–22 | 0.30 ± 0.02 | 0.0062 ± 0.0006 | 50 ± 7 |
| Cg | 13–45 | 0.16 ± 0.01 | 0.0033 ± 0.0003 | 25 ± 3 |
| О. Ферсмана. Разрез ZFI-F-02. Серогумусовая грубогумусированная мерзлотная почва | ||||
| Корка лишайника | 0.3–0 | 0.73 ± 0.03 | 0.0151 ± 0.0017 | 40 ± 6 |
| AY | 0–5 | 0.45 ± 0.02 | 0.0093 ± 0.0011 | 100 ± 15 |
| AC | 5–17 | 0.26 ± 0.02 | 0.0054 ± 0.0006 | 0 |
| С | 17–40 | 0.23 ± 0.01 | 0.0048 ± 0.0005 | 70 ± 9 |
| О. Ферсмана. Разрез ZFI-F-03. Псаммозем криотурбированный мерзлотный | ||||
| Oao | 0–2 | 0.59 ± 0.03 | 0.0122 ± 0.0014 | 230 ± 33 |
| W | 2–5 | 0.66 ± 0.03 | 0.0136 ± 0.0016 | 25 ± 2 |
| W@ | 2–5(10) | 0.31 ± 0.02 | 0.0064 ± 0.0006 | 25 ± 3 |
| О. Хейса. Разрез ZFI-H-04. Псаммозем глеевый мерзлотный | ||||
| W | 0–5 | 1.20 ± 0.05 | 0.0248 ± 0.0029 | 0 |
| Корка лишайника | 0–3 | 1.96 ± 0.09 | 0.0405 ± 0.0047 | 0 |
| W | 1–2 | 1.30 ± 0.06 | 0.0268 ± 0.0031 | 0 |
| Cg | 20–25 | 0.44 ± 0.02 | 0.0091 ± 0.0011 | 25 ± 3 |
| C2g | 40–50 | 0.72 ± 0.03 | 0.0149 ± 0.0017 | 0 |
| О. Гукера. Разрез ZFI-HK-08. Литозем грубогумусированный | ||||
| O | 0–5 | 0.74 ± 0.03 | 0.0153 ± 0.0018 | 220 ± 31 |
| AYao | 5–6(10) | 0.58 ± 0.02 | 0.0112 ± 0.0013 | 80 ± 11 |
| BC | 6(10)–15 | 0.95 ± 0.04 | 0.0197 ± 0.0023 | 24 ± 2 |
| BC2 | 15–30 | 0.34 ± 0.02 | 0.0070 ± 0.0008 | 25 ± 3 |
| О. Земля Александры. Разрез ZFI-AX-10. Литозем грубогумусовый мерзлотный | ||||
| О | 0–2 | 2.10 ± 0.09 | 0.0434 ± 0.0051 | 0 |
| AO | 2–8 | 1.28 ± 0.05 | 0.0265 ± 0.0031 | 0 |
| BC | 8–15 | 0.72 ± 0.03 | 0.0148 ± 0.0017 | 16 ± 2 |
| BC | 15–25 | 0.70 ± 0.03 | 0.0144 ± 0.0016 | 0 |
В целом, прокариотные сообщества исследованных почв ЗФИ характеризуются низкими показателями общей численности клеток (0.14–2.10 млрд кл./г) и длины актиномицетного мицелия (<230 м/г). Максимальные значения этих показателей приурочены к верхним гумусированным горизонтам и моховым/лишайниковым подстилкам. Также наблюдается некоторое увеличение обоих показателей в нижних горизонтах. Общая численность прокариот в исследованных образцах на порядок меньше, чем в почвах умеренного пояса [30, 33], однако в большинстве случаев сопоставима со значениями в почвах Восточной Антарктиды [28, 31], а также в верхних горизонтах почв пустынь Гибсона, Мохаве, Сахара [2, 34, 37, 38]. Лишь в органогенных горизонтах псаммозема глеевого мерзлотного на о. Хейса и литозема грубогумусового мерзлотного на о. Земля Александры численность прокариот существенно возрастает и находится в диапазоне 1.2–2.1 млрд кл./г, что ближе к показателям более развитых почв (значения на ЗФИ ниже в 2–4 раза, но не на порядок), например, в арктической тундре на полуострове Таймыр [50] или на полуострове Рыбачьем [8].
Характерно, что численность и биомасса прокариот в почвах как Арктики (ЗФИ), так и Антарктики (например, оазис Холмы Ларсеманн) не всегда уменьшается вглубь по профилю [22, 28]. Для некоторых минеральных подповерхностных горизонтов отмечен максимум прокариот, что может быть связано как с накоплением в них органического вещества в результате криогенного массообмена и нисходящей миграции растворов, так и с протекторной функцией поверхности от ионизирующих излучений и перепадов температур [18, 28, 31]. Прокариоты почв жарких аридных регионов преобладают в поверхностных биопленках и криптогамных корках или в их неглубоких подповерхностных вариантах, экранированных пустынными мостовыми (до 90% всех микроорганизмов в профиле), их численность значительно снижается в глубоких минеральных горизонтах [35, 36, 49]. В арктической тундре возможно появление второго максимума численности прокариот в надмерзлотных горизонтах, что объясняется ретинизацией органического вещества [21].
Значительная доля клеток прокариот в исследованных образцах представлена мелкими фильтрующимися формами, что характерно для почв экстремально холодного климата Антарктиды [22] и, по-видимому, является адаптацией для переживания неблагоприятных условий.
Биомасса грибов. К настоящему моменту нет данных о запасах и структуре биомассы грибов в почвах ЗФИ за исключением о. Нортбрук [29], а информация об обилии микобиоты субстратов архипелага ограничивается данными о количестве КОЕ (колониеобразующие единицы) на агаризованных средах [15, 16, 39]. Между тем грибы, в том числе в арктических экосистемах, участвуют в таких процессах, как разложение органического вещества, создание гумусоподобных соединений и оструктуривание почвы [1, 7, 42, 55]. Биомасса микобиоты в некоторых почвах составляет до 80% от общей микробной биомассы [30], поэтому вклад грибов в круговорот углерода гораздо больше бактериального в аэробных условиях [47]. Кроме того, большая часть эмиссии углекислого газа из почвы происходит благодаря жизнедеятельности грибов [33, 47].
В разных типах исследованных почв отмечается широкая вариабельность в запасах и структуре биомассы грибов (табл. 3). Минимальные значения (0.012 мг/г почвы) отмечены в минеральном горизонте 2CR криозема глееватого о. Хейса, а максимальные (до 0.861 мг/г почвы) – в черной лишайниковой корке псаммозема глееватого с о. Ферсмана. Эти результаты по порядку значений согласуются с нашими данными по о. Нортбрук [30]. Видимо, столь большие значения могут быть объяснены значительным вкладом лишайников [44], микобионты которых неотличимы по морфологии от несимбиотических грибов. Грибная биомасса во всех проанализированных профилях экспоненциально уменьшается от поверхностных к глубинным горизонтам, что может быть обусловлено активным развитием эккрисотрофной микобиоты в зоне ризоидов мхов и около лишайников [44]. В одном или двух верхних органогенных горизонтах в пределах 5 см сконцентрировано 67–91% запасов общей грибной биомассы почвенного профиля. Такое распределение характерно для многих зональных почв умеренного климата [33], но не почв Восточной Антарктиды, где большая часть микобиоты развивается в подповерхностных горизонтах [22, 23, 28], избегая неблагоприятных условий на поверхности. В почвах ЗФИ не отмечены вторые максимумы грибной биомассы в отдельных подповерхностных слоях, а также значительная численность дрожжеподобных клеток в глеевых горизонтах, что отличает эти почвы Арктики от антарктических.
Таблица 3.
Структура грибной биомассы почв ЗФИ (± погрешность, доли %)
| Гори-зонт | Глубина, см | Мицелий (преимущественно d = 3 мкм) | Споры (диаметр, мкм) | Общая биомасса спор | Суммарная биомасса грибов | Средняя биомасса грибов в профиле | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| биомасса, мг/г | длина, м | доля мицелия в общей биомас-се, % | 2 | 3 | 5 | ||||||||
| числен- ность шт./г × 105 | масса, мг/г | числен-ность, шт./г × 104 | масса, мг/г | числен-ность, шт./г × 103 | масса, мг/г | мг/г почвы | |||||||
| О. Алджер. Разрез ZFI-A-01. Псаммозем глееватый | |||||||||||||
| W | 0–1 | 0.344 ± 0.041 | 272 ± 32 | 41 | 1.86 ± 0.28 | 0.062 ± 0.012 | 15.32 ± 2.31 | 0.178 ± 0.034 | 47.4 ± 7.2 | 0.255 ± 0.049 | 0.495 ± 0.095 | 0.839 ± 0.161 | 0.270 ± 0.052 |
| Сf | 2–13 | 0.055 ± 0.007 | 44 ± 5 | 19 | 1.41 ± 0.21 | 0.047 ± 0.009 | 8.43 ± 1.27 | 0.098 ± 0.019 | 15.8 ± 2.4 | 0.085 ± 0.016 | 0.230 ± 0.044 | 0.285 ± 0.054 | |
| Cf | 20–22 | 0.023 ± 0.003 | 18 ± 2 | 29 | 1.32 ± 0.20 | 0.044 ± 0.008 | 0.95 ± 0.14 | 0.011 ± 0.002 | Нет | – | 0.055 ± 0.011 | 0.078 ± 0.015 | |
| Cg | 13–45 | 0.035 ± 0.004 | 28 ± 3 | 36 | 0.99 ± 0.15 | 0.033 ± 0.006 | 2.50 ± 0.36 | 0.029 ± 0.005 | Нет | – | 0.062 ± 0.012 | 0.097 ± 0.019 | |
| Cg | 13–45 | 0.009 ± 0.001 | 7 ± 1 | 17 | 0.84 ± 0.13 | 0.028 ± 0.005 | 1.29 ± 0.18 | 0.015 ± 0.003 | Нет | – | 0.043 ± 0.008 | 0.052 ± 0.010 | |
| О. Ферсмана. Разрез ZFI-F-02. Серогумусовая грубогумусированная мерзлотная почва | |||||||||||||
| Корка лишайника | 0.3–0 | 0.341 ± 0.040 | 270 ± 32 | 40 | 1.68 ± 0.22 | 0.056 ± 0.010 | 10.58 ± 1.48 | 0.123 ± 0.025 | 44.8 ± 6.8 | 0.241 ± 0.045 | 0.420 ± 0.078 | 0.861 ± 0.165 | 0.395 ± 0.076 |
| AY | 0–5 | 0.187 ± 0.022 | 148 ± 18 | 37 | 1.98 ± 0.29 | 0.066 ± 0.013 | 9.98 ± 1.40 | 0.116 ± 0.024 | 25.3 ± 3.8 | 0.136 ± 0.025 | 0.318 ± 0.049 | 0.505 ± 0.09 | |
| AC | 5–17 | 0.018 ± 0.002 | 14 ± 2 | 14 | 1.29 ± 0.20 | 0.043 ± 0.008 | 5.59 ± 0.78 | 0.065 ± 0.013 | Нет | – | 0.108 ± 0.059 | 0.126 ± 0.023 | |
| С | 17–40 | 0.008 ± 0.001 | 21 ± 3 | 9 | 1.23 ± 0.19 | 0.048 ± 0.009 | 7.22 ± 1.01 | 0.032 ± 0.006 | Нет | – | 0.080 ± 0.015 | 0.088 ± 0.016 | |
| О. Ферсмана. Разрез ZFI-F-03. Псаммозем криотурбированный мерзлотный | |||||||||||||
| Oao | 0–2 | 0.293 ± 0.035 | 232 ± 28 | 72 | 1.04 ± 0.16 | 0.034 ± 0.006 | 6.88 ± 0.96 | 0.080 ± 0.017 | Нет | – | 0.114 ± 0.021 | 0.407 | 0.182 ± 0.035 |
| W | 2–5 | 0.037 ± 0.004 | 29 ± 5 | 41 | 0.51 ± 0.08 | 0.017 ± 0.003 | 3.10 ± 0.43 | 0.036 ± 0.007 | Нет | – | 0.053 ± 0.011 | 0.090 ± 0.002 | |
| W@ | 2–5(10) | 0.008 ± 0.001 | 6 ± 1 | 17 | 0.24 ± 0.04 | 0.008 ± 0.001 | 2.76 ± 0.38 | 0.032 ± 0.006 | Нет | – | 0.040 ± 0.007 | 0.048 ± 0.008 | |
| О. Хейса. Разрез ZFI-H-04. Псаммозем глеевый мерзлотный | |||||||||||||
| W | 0–5 | 0.311 ± 0.037 | 246 ± 30 | 56 | 1.41 ± 0.21 | 0.047 ± 0.009 | 5.33 ± 0.73 | 0.062 ± 0.012 | 24.53 ± 3.70 | 0.132 ± 0.024 | 0.241 ± 0.042 | 0.552 ± 0.110 | 0.413 ± 0.072 |
| Корка лишайника | 0–3 | 0.392 ± 0.047 | 311 ± 37 | 48 | 1.50 ± 0.24 | 0.050 ± 0.010 | 9.37 ± 1.28 | 0.109 ± 0.023 | 48.69 ± 7.34 | 0.262 ± 0.048 | 0.421 ± 0.078 | 0.813 ± 0.014 | |
| W | 1–2 | 0.257 ± 0.031 | 204 ± 24 | 45 | 2.04 ± 0.30 | 0.068 ± 0.013 | 8.17 ± 1.11 | 0.095 ± 0.018 | 28.43 ± 4.29 | 0.153 ± 0.028 | 0.316 ± 0.049 | 0.573 ± 0.100 | |
| Cg | 20–25 | 0.018 ± 0.002 | 14 ± 2 | 21 | 0.96 ± 0.15 | 0.032 ± 0.006 | 3.10 ± 0.43 | 0.036 ± 0.007 | Нет | – | 0.068 ± 0.013 | 0.086 ± 0.015 | |
| C2g | 40–50 | 0.008 ± 0.001 | 6 ± 1 | 19 | 0.72 ± 0.11 | 0.024 ± 0.004 | 0.95 ± 0.14 | 0.011 ± 0.002 | Нет | – | 0.035 ± 0.006 | 0.043 ± 0.007 | |
| О. Хейса. Разрез ZFI-H-05. Криозем глееватый | |||||||||||||
| Oao | 3–0 | 0.490 ± 0.059 | 388 ± 46 | 84 | 1.38 ± 0.20 | 0.046 ± 0.008 | 2.25 ± 0.33 | 0.026 ± 0.005 | 4.46 ± 0.67 | 0.024 ± 0.004 | 0.096 ± 0.058 | 0.586 ± 0.010 | 0.179 ± 0.108 |
| W | 0–5 | 0.032 ± 0.004 | 25 ± 3 | 36 | 1.11 ± 0.17 | 0.037 ± 0.007 | 1.73 ± 0.25 | 0.020 ± 0.004 | Нет | – | 0.057 ± 0.011 | 0.089 ± 0.016 | |
| CR | 15–20 | 0.011 ± 0.001 | 9 ± 1 | 38 | 0.45 ± 0.07 | 0.015 ± 0.003 | 0.26 ± 0.04 | 0.003 | Нет | – | 0.018 ± 0.004 | 0.029 ± 0.005 | |
| 2CR | 20–50 | – | Нет | – | 0.30 ± 0.06 | 0.010 ± 0.001 | 0.17 ± 0.03 | 0.002 | Нет | – | 0.012 ± 0.003 | 0.012 ± 0.003 | |
| О. Гукера. Разрез ZFI-HK-08. Литозем грубогумусированный | |||||||||||||
| O | 0–5 | 0.224 ± 0.027 | 178 ± 21 | 63 | 0.96 ± 0.15 | 0.032 ± 0.006 | 3.65 ± 0.64 | 0.043 ± 0.008 | 10.78 ± 1.62 | 0.058 ± 0.009 | 0.133 ± 0.033 | 0.357 ± 0.066 | 0.151 ± 0.037 |
| AYao | 5–6(10) | 0.061 ± 0.007 | 48 ± 6 | 47 | 0.45 ± 0.07 | 0.015 ± 0.003 | 1.73 ± 0.25 | 0.020 ± 0.004 | 6.32 ± 0.95 | 0.034 ± 0.005 | 0.069 ± 0.013 | 0.130 ± 0.024 | |
| BC | 6(10)–15 | 0.012 ± 0.002 | 10 ± 1 | 12 | 0.27 ± 0.05 | 0.009 ± 0.001 | 0.43 ± 0.08 | 0.005 | 13.38 ± 2.01 | 0.072 ± 0.011 | 0.086 ± 0.016 | 0.098 ± 0.018 | |
| BC2 | 15–30 | 0.009 ± 0.001 | 7 ± 1 | 53 | 0.18 ± 0.04 | 0.006 | 0.17 ± 0.03 | 0.002 | Нет | – | 0.008 ± 0.001 | 0.017 ± 0.004 | |
| О. Земля Александры. Разрез ZFI-AX-10. Литозем грубогумусовый мерзлотный | |||||||||||||
| О | 0–2 | 0.261 ± 0.031 | 207 ± 24 | 51 | 1.17 ± 0.18 | 0.039 ± 0.008 | 7.22 ± 1.01 | 0.084 ± 0.017 | 22.86 ± 3.43 | 0.123 ± 0.019 | 0.246 ± 0.038 | 0.507 ± 0.093 | 0.215 ± 0.033 |
| AO | 2–8 | 0.121 ± 0.014 | 96 ± 11 | 54 | 0.81 ± 0.12 | 0.027 ± 0.005 | 6.53 ± 0.91 | 0.076 ± 0.016 | Нет | – | 0.103 ± 0.016 | 0.224 ± 0.041 | |
| BC | 8–15 | 0.005 ± 0.001 | 4 | 6 | 1.56 ± 0.23 | 0.052 ± 0.007 | 2.15 ± 0.30 | 0.025 ± 0.005 | Нет | – | 0.077 ± 0.012 | 0.082 ± 0.015 | |
| BC | 15–25 | Нет | – | – | 0.90 ± 0.13 | 0.030 ± 0.007 | 1.55 ± 0.22 | 0.018 ± 0.004 | Нет | – | 0.048 ± 0.007 | 0.048 ± 0.007 | |
Однако некоторые количественные показатели микобиоты почв ЗФИ имеют общие черты с почвами Восточной Антарктиды. Например, относительно мала доля крупных пропагул, мицелия с большим диаметром и доля мицелия в биомассе [22, 23, 28].
Исследования численности и биомассы грибов в почвах жарких пустынь носят эпизодический характер. Известно, что локализация микобиоты в этих ландшафтах происходит в эндолитных, эпилитных и гиполитных микробных сообществах [35, 49]. Грибы данных локусов имеют ряд адаптаций к повышенному уровню ультрафиолетового излучения и перепаду температуры и влажности, однако, в более глубоких горизонтах пустынных почв, по-видимому, в наименьшей степени [19, 35]. В жарких пустынях биомасса грибов (как и прокариот) сильно зависит от количества осадков в течение года и может возрастать в разы во влажный сезон [57]. Концентрация биомассы грибов в почвах ЗФИ выше, чем в почвах жарких пустынь и оазисов Восточной Антарктиды [19, 28, 29, 53, 57]. При сравнении с почвами тундр сопоставимые значения концентрации биомассы обнаруживаются, например, в почвах полуострова Таймыр [50] на 74° N, и существенно большие значения в почвах более южных вариантов тундр – в 2–3 раза выше на полуострове Рыбачьем на 69° N [8] и на 1–2 порядка выше на Аляске на 68° N [46, 52].
Мицелий является вегетативным телом многоклеточных грибов, составляющим иногда до 100% массы их организма. Однако в полярных экосистемах доля мицелия может быть очень мала в силу сурового климата [44]. Наибольшее содержание грибного мицелия – 272.48 м/г почвы – выявлено в черной лишайниковой корке псаммозема глееватого с о. Алджер. Меньше всего мицелия (<10 м/г почвы) содержится в наиболее глубоких минеральных горизонтах большинства почв, а в двух образцах (также глубокие минеральные горизонты) мицелий вовсе не обнаружен. Около 70% мицелия представлено тонкими формами до 3 мкм в диаметре, что, вероятно, является следствием воздействия сурового климата Арктики [23]. Споры и дрожжи полностью представлены мелкими формами диаметром до 5 мкм, что характерно для биотопов с экстремальными условиями [54].
Более половины биомассы (51–84%) приходится на мицелий только в семи образцах преимущественно из самых верхних органогенных горизонтов, тогда как в остальных случаях преобладают споры и дрожжи, а доля грибного мицелия составляет от 6 до 47%.
Численность грибных спор в изученных образцах составляет около нескольких сотен тысяч на грамм почвы, причем большая часть всей биомассы приходится на пропагулы диаметром в 2 и 3 мкм. Вклад крупных спор в общую численность пропагул невелик и составляет не более 10–15% для каждого из профилей. Однако суммарная масса крупных спор часто больше, чем мелких пропагул. Особенно это касается верхних горизонтов на глубине до 5 см от поверхности с обильным содержанием органического вещества, которое является основным пищевым субстратом для грибов и, вероятно, протектором от негативных абиотических факторов. Отметим, что во всех глубоких минеральных горизонтах присутствуют только мелкие – 2–3 мкм, а не крупные споры ≥5 мкм. Важно сказать, что крупных спор не было выявлено в образцах с низким содержанием органического углерода.
Форма грибных спор является специфическим маркером, по которому можно определить принадлежность микобиоты к тому или иному таксону. Среди мелких спор нами не встречены те, что имели бы специфические морфологические особенности. Все они имели сферическую или овальную форму без заметных неровностей. Базидии и аски не выявлены. Среди крупных спор периодически (в 8% случаев от встречаемости всех крупных спор) попадались дидимоспоры и диктиоспоры, септы которых ярко светились в препаратах под люминесцентным микроскопом после их окраски калькофлуором белым. В 2% случаев от встречаемости всех спор, отмечали большие (до 30 мкм в диаметре) и плохо светящиеся сферические или грушевидные образования с мелкими округлыми частицами – предположительно это пикниды со спорами. В оглеенных горизонтах достаточно часто (в 35% случаев от встречаемости всех спор) попадались дрожжеподобные и почкующиеся клетки, что дает основание полагать о высокой активности микобиоты в переувлажненных почвах, и отмечено исследователями для аналогичных полярных биотопов [22]. Очень редко (в 1% случаев от встречаемости всех крупных спор) удавалось увидеть большие (диаметр 5–7 мкм) сферические и хорошо светящиеся клетки, по-видимому, с плотной оболочкой. Предполагаем, что это хламидоспоры.
Нами не обнаружены пряжки на мицелии грибов, что косвенно свидетельствует о низком содержании в этих арктических почвах отдела Basidiomycota. Этот факт подтверждается и другими исследователями [29]. Также не выявлены ризоморфы и склероции, которые могли разрушиться на отдельные гифы при механической обработке почвенных образцов на вортексе.
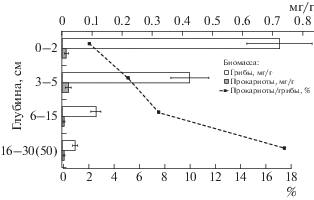
Пространственное распределение микробной биомассы. Вертикальное распределение биомассы прокариот и грибов по профилю имеет разные тенденции (рис. 3). Если биомасса грибов демонстрирует ярко выраженный аккумулятивный характер распределения, то биомасса прокариот распределена более равномерно. При этом с глубиной доля прокариот в микробной биомассе возрастает. Аккумулятивное распределение микобиоты традиционно объясняется тем, что микоризные грибы приурочены к корнеобитаемому слою, а численность сапротрофных грибов низка в глубоких минеральных горизонтах. Эккрисотрофная микобиота также сконцентрирована в наиболее биогенном слое. Но в криогенных почвах, содержащих погребенное органическое вещество, по-видимому, следует дополнительно учитывать следующие факторы: разную зависимостью грибов и бактерий от количества доступного кислорода, углерода и азота, а также нисходящую миграцию бактерий с растворами и их накопление в минеральных горизонтах, что характерно для мерзлотных почв тундр и редколесий [10, 21]. Как отмечалось выше, значительная доля клеток прокариот в почвах ЗФИ представлена мелкими фильтрующимися формами. Увеличение доли прокариот в микробной биомассе с глубиной известно также для почв жарких пустынь. Например, в почвах пустыни Негев [57] эта тенденция очень яркая: во влажный сезон в верхних 10 см преобладает биомасса грибов, а уже на глубине 11–20 см – бактериальная биомасса.
Рис. 3.
Вертикальное распределение биомассы грибов и прокариот в почвах ЗФИ (использованы средние и отклонения для всех разрезов, для которых выполнялся подсчет биомассы).
Наиболее явная закономерность в ряду “высокоарктические пустоши и тундры” проявляется в соотношении углерода микробной биомассы (Смик) и содержания общего органического углерода (Сорг), рассчитанном по горизонтам, а затем усредненном для всего профиля (рис. 4). В почвах пустошей на микробную биомассу приходится большая доля в общем углероде. Различия между тундрами и пустошами в среднем в 5 раз – 12.7% против 2.5%. Значения показателя Смик/Сорг, полученные нами ранее для почв оазисов Восточной Антарктиды [28], варьировали в схожем диапазоне (0.2–15.0%). Причем доля углерода микробной биомассы возрастала в наиболее бедных органическим веществом горизонтах. Повышенная доля углерода микробной биомассы в почвах пустошей ЗФИ и Восточной Антарктиды отличает их от большинства полноразвитых почв, в том числе антропогенно-преобразованных разностей, в которых показатель Смик/Сорг, как правило, составляет первые проценты [34, 58]. Высокая доля микробного углерода, по-видимому, является отличительной чертой почв наиболее экстремальных условий (микробоземов), в которых развитие макробиоты, в особенности растений с корневыми системами лимитировано. Глобальные расчеты [58] показали, что в почвах пустынь Смик/Сорг повышается в среднем до 5.02%, тогда как в тундре это показатель составляет 1.66%.
Эмиссия диоксида углерода с поверхности почвы. Этот показатель зависит от большого набора факторов, в том числе температуры и влажности субстрата, но будучи измеренным непосредственно в полевых условиях, он выступает в качестве динамической характеристики как функционирования экосистемы в целом, так и интенсивности декомпозиции органического вещества, дает “моментальное” представление о функционировании почвы на коротком отрезке времени. Почвенная эмиссия диоксида углерода косвенно отражает связь того пула органического вещества (преимущественно его лабильной части), который содержится в почве, и микробной составляющей. Особенно это ярко проявляется в ландшафтах, где доля высших сосудистых растений незначительна, и вследствие этого корневое дыхание минимально [11].
Эмиссия СО2 с поверхности ненарушенных почв ЗФИ варьировала в диапазоне 1.6–91.7 мг C–CO2/(м2 ч) (рис. 5) и проявила явные различия между высокоарктическими тундрами и пустошами. В псаммоземах глееватых высокоарктических пустошей на о. Алджер эмиссия оказалась на порядок меньше (1.5–8.4 мг C–CO2/(м2 ч)), чем в псаммоземах, пелоземах, криоземах, литоземах и серогумусовых почвах тундр (10.0–89.4 мг C‒CO2/(м2 ч)). Последние величины в целом соответствуют уровню эмиссии диоксида углерода из почв более южных архипелагов, чья принадлежность к арктических тундрам однозначна. Например, эмиссия СО2 из криоземов грубогумусовых (Turbic Cryosol (Fluvic, Humic)) полигональных тундр долине Грендален на о. Западный Шпицберген (15–79 мг C–CO2/(м2 ч)) [13]. Выявлено, что участкам с наибольшим развитием злаковых ассоциаций соответствуют максимальные значения эмиссии диоксида углерода, что связано с увеличением вклада корневого дыхания. Уровни почвенной эмиссии СO2 на участках высокоарктических пустошей ЗФИ (о. Алджер) сопоставимы с таковыми в оазисах Восточной Антарктиды [40, 41, 43]. Максимальные значения эмиссии на участках тундр ЗФИ (острова Гукера, Земля Александры, Ферсмана, Хейса) в несколько раз выше максимумов в типичных ландшафтах антарктических оазисов.
Рис. 4.
Величина микробной биомассы и ее отношение к содержанию общего органического углерода в почвах на различных островах ЗФИ (отношение углерода микробной биомассы от содержания общего углерода рассчитано по горизонтам, а затем усреднено для всего профиля).

Рис. 5.
Эмиссия СO2 с поверхности почв пяти островов ЗФИ на ключевых участках (16 участков, n = 70) в районе разрезов: ZFI-A-01, псаммозем глееватый (1 – полигон, 2 – трещина, 3 – задернованный полигон); ZFI-F-03, псаммозем криотурбированный мерзлотный (4 – полигон, мезоповышение, 5 – трещина, мезоповышение, 6 – полигон, мезопонижение, 7 – трещина, мезопонижение); ZFI-F-02, серогумусовая грубогумусированная мерзлотная (8); ZFI-H-05, криозем глееватый (9); ZFI-H-04, псаммозем глеевый мерзлотный (10); ZFI-HK-08, литоземы грубогумусированные (11, 12 – антропогенно-нарушенные участки, 13 – ненарушенные участки); ZFI-AX-12, пелозем перегнойный криотурбированный (14); ZFI-AX-11, серогумусовая мерзлотная (15 – нарушенный участок, вездеходная колея, 16 – ненарушенный участок); криозем грубогумусовый полигональной тундры в долине Грендален на о. Западный Шпицберген (17 – полигон, 18 – трещина), значения приведены в качестве примера эмиссии CO2 с поверхности почв арктической тундры на близкой к ЗФИ широте [14]; пунктиром – средние значения эмиссии CO2 ненарушенных почв.
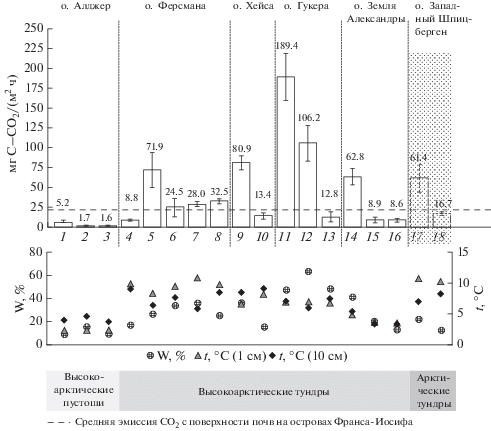
Полевые измерения также продемонстрировали известный феномен увеличения уровня эмиссии диоксида углерода при антропогенном воздействии [12]. Влияние человека здесь привело к изменению температурного и гидрологического режимов, стало происходить снегозадержание у стен домов, предположительно увеличился период с положительными температурами как на поверхности, так и на глубине почв. Вследствие этого, на территории полярной станции активно распространились злаковые ассоциации, где увеличилась как роль корневого дыхания, так и в целом почвенная эмиссия CO2. Также локальные нарушения в пределах полярной станции в бухте Тихой на о. Гукера привели к вовлечению в актуальный цикл большего количества почвенного углерода и интенсификации эмиссии СО2, уровни которой оказались в 5–20 раз выше, чем в ненарушенных почвах. Например, эмиссия с антропогенно-нарушенных задернованных участков составляла 53.3–237.9 мг C–CO2/(м2 ч), а в фоновых ненарушенных литоземах грубогумусированных под моховыми сообществами – 12.8 ± 5.7 мг C–CO2/(м2 ч). Исследование свежих треков от проезда вездеходной техники на о. Земля Александры показывает, что, несмотря на близкие средние значения эмиссии диоксида углерода на естественных и нарушенных участках, 8.6 ± 1.9 и 8.9 ± 3.8 мг C–CO2/(м2 ч) соответственно, увеличивается дисперсия значений эмиссии в нарушенных участках. В случае полного разрушения растительного покрова и верхних сантиметров исходной почвы дыхание угнетено, а в случае частичного нарушения – дыхание активизируется за счет микробиологического разложения почвенного органического вещества верхнего горизонта почвы.
ЗАКЛЮЧЕНИЕ
Почвенный покров ЗФИ на островах Алджер, Ферсмана, Хейса, Гукера, Земля Александры состоит из чередующихся участков высокоарктических тундр, где развиты серогумусовые почвы, литоземы, криотурбированные псаммоземы на песках и криотурбированные пелоземы на дресвянисто-суглинистых породах с выраженными процессами криогенного погребения органического вещества, а также участков высокоарктических пустошей с преобладанием псаммоземов мерзлотных под лишайниковыми корками с разреженным покровом сосудистых растений. Почвы высокоарктических тундр имеют на порядок больше запасов углерода по сравнению с почвами пустошей и имеют уровни эмиссии CO2, сопоставимые с почвами арктических тундр. Почвы высокоарктических пустошей ЗФИ по запасам углерода и эмиссии диоксида углерода имеют переходный характер между почвами местных высокоарктических тундр и почвами Восточной Антарктиды.
Биомасса почвенных микроорганизмов в исследованных почвах ЗФИ, как высокоарктических тундр, так и пустошей, сильно не различается. Она сконцентрирована преимущественно в органогенных горизонтах (подстилочно-торфяных горизонтах, лишайниковых корках, оторфованном моховом очесе). С глубиной численность, биомасса и длина мицелия как прокариот, так и грибов снижается. Одновременно с увеличением глубины доля прокариот в микробной биомассе возрастает, что объясняется преимущественно фильтрацией прокариот. В почвах высокоарктических пустошей вклад микробной биомассы в содержание общего органического углерода выше в несколько раз по сравнению с почвами местных тундр. По ряду микробиологических характеристик исследованные почвы ЗФИ ближе к почвам Антарктиды, а по некоторым показателям – даже к почвам жарких пустынь. В целом, можно сказать, что в микробиологическом отношении почвы ЗФИ занимают место в следующем ряду: почвы арктических тундр – почвы ЗФИ – почвы Восточной Антарктиды – почвы жарких пустынь.
Список литературы
Бабьева Е.Н., Сизова Т.П. Микромицеты в почвах арктотундровых экосистем // Почвоведение. 1983. № 10. С. 98.
Воробьева Е.А., Белов А.А., Чепцов В.С., Соина В.С., Крючкова М.О., Капаевская Е.С., Иванова А.Е. Устойчивость микроорганизмов экстремальных ксерофитных экотопов к воздействию инактивирующих факторов // Известия Тимирязевской сельскохозяйственной академии. 2018. № 4. С. 111–127. https://doi.org/10.26897/0021-342X-2018-4-111-127
Вишневая Ю.С., Попова Л.Ф. Оценка экологического состояния и степени загрязнения тяжелыми металлами почв Арктики // Вестник Московского государственного областного университета. Сер. Естественные науки. 2016. № 2. С. 96–104. https://doi.org/10.18384/2310-7189-2016-2-96-104
Горячкин С.В. Почвенный покров Севера (структура, генезис, экология, эволюция). М.: ГЕОС, 2010. 414 с.
Горячкин С.В., Любова С.В., Левандовская Т.В. Почвенно-геохимические особенности береговых и островных геосистем в экстремальных условиях Арктики // Комплексная научно-образовательная экспедиция “Арктический плавучий университет – 2015”: материалы экспедиции [Электронный ресурс] / Отв. ред.: Зайков К.С., Поликин Д.Ю., Драчкова Л.Н. САФУ, 2015. С. 35–59. https://narfu.ru/university/ library/books/2810.pdf
Горячкин С.В., Долгих А.В., Мергелов Н.С. Почвы островов Земли Франца Иосифа: география, морфогенетические особенности, классификация и роль в углеродном цикле // Комплексная научно-образовательная экспедиция “Арктический плавучий университет – 2017” [Электронный ресурс]: материалы экспедиции. Архангельск: КИРА. 2017. С. 15–36. https://narfu.ru/university/library/books/
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А., Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1096. https://doi.org/10.7868/S0032180X15090038
Евдокимова Г.А., Мозгова Н.П., Мязин В.А. Физико-химические и микробиологические характеристики почв тундры полуострове Рыбачий // Почвоведение. 2018. № 1. С. 78–85. https://doi.org/10.7868/S0032180X17010087
Ежов О.Н., Гаврило М.В., Змитрович М.В. Грибы архипелага Земля Франца-Иосифа // Труды Кольского научного центра РАН. 2014. № 4. С. 23.
Иванова Т.И., Кузьмина Н.П., Исаев А.П. Микробиологическая характеристика мерзлотных почв острова Тит-Ары (Якутия) // Сибирский экологический журнал. 2012. № 6. С. 831–840.
Карелин Д.В., Замолодчиков Д.Г. Углеродный обмен в криогенных экосистемах. М.: Наука, 2008. 344 с.
Карелин Д.В., Горячкин С.В., Замолодчиков Д.Г., Долгих А.В., Зазовская Э.П., Шишков В.А., Краев Г.Н. Влияние различных видов антропогенного воздействия на эмиссию парниковых газов в мерзлотных экосистемах // Доклады РАН. 2017. № 477(5). С. 610–612. https://doi.org/10.7868/S0869565217350225
Карелин Д.В., Зазовская Э.П., Шишков В.А., Долгих А.В., Сирин А.А., Суворов Г.Г., Азовский А.И., Осокин Н.И. Наблюдения за потоками СО2 на архипелаге Шпицберген: использование территории человеком меняет газообмен арктической тундры // Известия РАН. Сер. географическая. 2019. № 5.https://doi.org/10.31857/S2587-55662019556-66
Кирцидели И.Ю. Микромицеты из почв и грунтов о. Северо-Восточная Земля (Архипелаг Шпицберген) // Микология и фитопатология. 2010. Т. 44. № 2. С. 116–125.
Кирцидели И.Ю. Микроскопические грибы в почвах островах Хейса (Земля Франца Иосифа) // Новости сист. низш. раст. 2015. Т. 49. С. 151–160.
Кирцидели И.Ю., Абакумов Е.В., Тешебаев Ш.Б., Зеленская М.С., Власов Д.Ю., Крыленков В.А., Соколов В.Т., Баранцевич Е.П. Микробные сообщества в районах арктических поселений // Гигиена и санитария. 2016. Т. 95. № 10. С. 923–929. https://doi.org/10.1882/0016-9900-2016-10-923-929
Классификация и диагностика почв России–Смоленск: Ойкумена, 2004. 342 с.
Кудинова А.Г., Лысак Л.В., Соина В.С., Мергелов Н.С., Долгих А.В., Шоркунов И.Г. Бактериальные сообщества в почвах криптогамных пустошей Восточной Антарктиды (оазисы Ларсеманн и Холмы Тала) // Почвоведение. 2015. № 3. С. 317–317. https://doi.org/10.7868/S0032180X15030077
Кутовая О.В., Василенко Е.С., Лебедева М.П. Микробиологическая и микроморфологическая характеристика крайнеаридных пустынных почв Илийской впадины (Казахстан) // Почвоведение. 2012. № 12. С. 1297–1297.
Любова С.В., Любова Н.В. Химические свойства почв арктических островов Архангельской области // Биодиагностика состояния природных и природно-техногенных систем. Мат-лы ХIV Всерос. научн.-пр. конф. 2016. С. 294–298.
Лысак Л.В., Добровольская Т.Г. Бактерии в почвах тундры Западного Таймыра // Почвоведение. 1982. № 9. С. 74–78.
Лысак Л.В., Максимова И.А., Никитин Д.А., Иванова А.Е., Кудинова А.Г., Соина В.С., Марфенина О.Е. Микробные сообщества почв восточной Антарктиды // Вестник Моск. ун-та. Сер. 16. Биология. 2018. Т. 73. № 3. С. 132–140.
Марфенина О.Е., Никитин Д.А., Иванова А.Е. Структура грибной биомассы и разнообразие культивируемых микромицетов в почвах Антарктиды (станции Прогресс и Русская) // Почвоведение. 2016. № 8. С. 991–999. https://doi.org/10.7868/S0032180X16080074
Матвеева Н.В., Заноха Л.Л., Афонина О.М., Потемкин А.Д., Патова Е.Н., Давыдов Д.А., Андреева В.М., Журбенко М.П., Конорева Л.А., Змитрович И.В., Ежов О.Н., Ширяев А.Г., Кирцидели И.Ю. Растения и грибы полярных пустынь Северного полушария. Российская академия наук, Ботанический институт им. В.Л. Комарова. СПб, 2015.
Михайлов И.С. Почвы // Советская Арктика. М.: Наука, 1970. С. 236–249.
Михайлов И.С., Говоруха Л.С. Почвы Земли Франца-Иосифа // Вестник Моск. ун-та. Сер. географическая. 1962. № 6. С. 42–48.
Национальный атлас Арктики. М.: АО “Роскартография”, 2017. 496 с.
Никитин Д.А., Марфенина О.Е., Кудинова А.Г., Лысак Л.В., Мергелов Н.С., Долгих А.В., Лупачев А.В. Микробная биомасса и биологическая активность почв и почвоподобных тел береговых оазисов Антарктиды // Почвоведение. 2017. № 9. С. 1122–1133. https://doi.org/10.7868/S0032180X17070073
Никитин Д.А., Семенов М.В., Семиколенных А.А., Максимова И.А., Качалкин А.В., Иванова А.Е. Биомасса грибов и видовое разнообразие культивируемой микобиоты почв и субстратов о. Нортбрук (Земля Франца-Иосифа) // Микология и фитопатология. 2019. Т. 53. № 4. С. 219–231.
Полянская Л.М., Звягинцев Д.Г. Содержание и структура микробной биомассы как показатель экологического состояния почв // Почвоведение. 2005. № 6. С. 706–714.
Соина В.С., Газимуллина А.Г., Мергелов Н.С., Лысак Л.В., Лапыгина Е.В. Бактериальные комплексы в почвах влажных долин оазиса Ларсеманн (Восточная Антарктида) // Альманах современной науки и образования. 2012. № 9. С. 195–200.
Чепцов В.С., Воробьева Е.А., Полянская Л.М., Горленко М.В., Павлов А.К., Ломасов В.Н. Устойчивость почвенного микробного сообщества к воздействию физических факторов поверхностного слоя марсианского реголита // Микробные сообщества в эволюции биосферы с древнейших времен до наших дней. М., 2017. С. 179–191.
Ananyeva N.D., Castaldib S., Stolnikova E.V., Kudeyarova V.N., Valentini R. Fungi-to-bacteria ratio in soils of European Russia // Archives of Agronomy and Soil Science. 2014. 61. № 4. P. 427–446. https://doi.org/10.1080/03650340.2014.940916
Anderson T.H., Domsch K.H. Ratios of microbial biomass carbon to total organic carbon in arable soils // Soil Biol. Biochem. 1989. V. 21. № 4. P. 471–479.
Ayuso S.V., Silva A.G., Nelson C., Barger N.N., Garcia-Pichel F. Microbial nursery production of high-quality biological soil crust biomass for restoration of degraded dryland soils // Appl. Environ. Microbiol. 2017. V. 83. № 3. P. e02179-16. https://doi.org/10.1128/AEM.02179-16
Bay S., Ferrari B., Greening C. Life without water: how do bacteria generate biomass in desert ecosystems? // Microbiology Australia. 2018. P. 28–32. https://doi.org/10.1071/MA18008
Belov A.A., Cheptsov V.S., Vorobyova E.A. Soil bacterial communities of Sahara and Gibson deserts: Physiological and taxonomical characteristics // AIMS Microbiology. 2018. V. 4. № 4. P. 685–710. https://doi.org/10.3934/microbiol.2018.4.685
Belov A.A., Cheptsov V.S., Vorobyova E.A., Manucharova N.A., Ezhelev Z.S. Stress-Tolerance and Taxonomy of Culturable Bacterial Communities Isolated from a Central Mojave Desert Soil Sample // Geosciences. 2019. V. 9. P. 166–190. https://doi.org/10.3390/geosciences9040166
Bergero R., Girlanda M., Varese G.C., Intili D., Luppi A.M. Psychrooligotrophic fungi from Arctic soils of Franz Joseph Land // Polar Biol. 1999. V. 21. № 6. P. 361–368.
Dolgikh A., Mergelov N., Ivaschenko A., Shorkunov I., Pochikalov A., Karelin D. Carbon dioxide emission and carbon stocks in natural and anthropogenically-changed soils of the Larsemann Hills oasis, East Antarctica // Program and conference materials of the International Conference “Earth’s Cryosphere: Past, Present and Future” (June 4–8, 2017, Pushchino, Russia). P. 150–151.
Elberling B., Gregorich E.G., Hopkins D.W., Sparrow A.D., Novis P., Greenfield L.G. Distribution and dynamics of soil organic matter in an Antarctic dry valley // Soil B-iol. Biochem. 2006. V. 38. P. 3095–3106. https://doi.org/10.1016/j.soilbio.2005.12.011
Frisvad J.C. Fungi in cold ecosystems. In Psychrophiles: from biodiversity to biotechnology. Berlin Heidelberg. Springer, 2008. 137–156 p.
Gregorich E.G., Hopkins D.W., Elberling B., Sparrow A.D., Novis P., Greenfield L.G., Rochette P. Emission of CO2, CH4 and N2O from lakeshore soils in an Antarctic dry valley // Soil Biol. Biochem. 2006. V. 38(10). P. 3120-3129. https://doi.org/10.1016/j.soilbio.2006.01.015
Hassan N., Rafiq M., Hayat M., Shah A.A., Hasan F. Psychrophilic and psychrotrophic fungi: a comprehensive review // Rev. Environ. Sci. Bio/Technol. 2016. V. 15. № 2. P. 147–172. https://doi.org/10.1007/s11157-016-9395-9
IUSS Working Group WRB. World Reference Base for Soil Resources 2014, update 2015 International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No. 106. 2015. FAO, Rome.
Koyama A., Wallenstein M.D., Simpson R.T., Moore J.C. Soil bacterial community composition altered by increased nutrient availability in Arctic tundra soils // Frontiers in microbiology. 2014. V. 5. P. 516. https://doi.org/10.3389/fmicb.2014.00516
Malik A.A., Chowdhury S., Schlager V., Oliver A., Puissant J., Vazquez P.G., Bergen M., Jehmlich N., Griffis R., Gleixner G. Soil fungal: bacterial ratios are linked to altered carbon cycling // Frontiers in Microbiology. 2016. V. 7. P. 1247. https://doi.org/10.3389/fmicb.2016.01247
Nikitina M., Popova L., Korobitcina J., Efremova O., Trofimova A., Nakvasina E., Volkov A. Environmental status of the arctic soils // J. Elementology. 2015. V. 20. № 3. P. 643–651. https://doi.org/10.5601/jelem.2014.19.4.743
Pointing S.B., Belnap J. Microbial colonization and controls in dryland systems // Nature Rev. Microbiol. 2012. V. 10(8). P. 551–562. https://doi.org/10.1038/nrmicro2831
Schmidt N., Bölter M. Fungal and bacterial biomass in tundra soils along an arctic transect from Taimyr Peninsula, central Siberia // Polar Biology. 2002. V. 25(12). P. 871–877. https://doi.org/10.1007/s00300-002-0422-7
Selbmann L., De Hoog G.S., Zucconi L., Isola D., Onofri S. Black yeasts in cold habitats. Berlin Heidelberg. Springer-Verlag, 2014. 173–190 p. https://doi.org/10.1007/978-3-642-39681-6_8
Sistla S.A., Moore J.C., Simpson R.T., Gough L., Sha-ver G.R., Schimel J.P. Long-term warming restructures Arctic tundra without changing net soil carbon storage // Nature. 2013. V. 497(7451). P. 615. https://doi.org/10.1038/nature12129
Steinberger Y., Sarig S. Response by soil nematode populations and the soil microbial biomass to a rain episode in the hot, dry Negev Desert // Biology and Fertility of Soils. 1993. V. 16. P. 188–192. https://doi.org/10.1007/BF00361406
Sterflinger K., Tesei D., Zakharova K. Fungi in hot and cold deserts with particular reference to microcolonial fungi // Fungal Ecology. 2012. V. 5. № 4. P. 453–462. https://doi.org/10.1016/j.funeco.2011.12.007
Timling I., Walker D.A., Nusbaum C., Lennon N.J., Taylor D.L. Rich and cold: diversity, distribution and drivers of fungal communities in patterned-ground ecosystems of the North American Arctic // Molecular Ecology. 2014. V. 23. № 13. P. 3258–3272. https://doi.org/10.1111/mec.12743
Walker D.A., Frost S.M., Timling I., Raynolds M.K., Matyshak G.V., Frost G.V., Epstein H.E., Zhurbenko M., Afonina O. Biological soil crusts of Hayes Island, Franz Josef Land, Russia: High cover, biomass and NDVI // Proceedings of the Tenth International Conference on Permafrost Salekhard, Yamal-Nenets Autonomous District, Russia June 25–29. 2012. V. 4. P. 634-635.
Vishnevetsky S., Steinberger Y. Bacterial and fungal dynamics and their contribution to microbial biomass in desert soil // J. Arid Environ. 1997. V. 37(1). P. 83–90. https://doi.org/10.1006/jare.1996.0250
Xu X., Thornton P.E., Post W.M. A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems // Global Ecology and Biogeography. 2013. V. 22(6). P. 737–749. https://doi.org/10.1111/geb.12029
Дополнительные материалы отсутствуют.


