Почвоведение, 2020, № 5, стр. 639-650
Влияние пестицидной нагрузки на микробное сообщество агродерново-подзолистой почвы
А. А. Астайкина a, b, *, Р. А. Стрелецкий a, М. Н. Маслов a, А. А. Белов a, В. С. Горбатов b, А. Л. Степанов a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Всероссийский научно-исследовательский институт фитопатологии
143050 Московская область, Одинцовский район, р.п. Большие, Вяземы, ул. Институт, вл. 5, Россия
* E-mail: astaikina-anzhel@mail.ru
Поступила в редакцию 13.06.2019
После доработки 31.07.2019
Принята к публикации 27.12.2019
Аннотация
Методом высокопроизводительного секвенирования (NGS) проведена оценка влияния трех пестицидов (гербицида метрибузина, инсектицида имидаклоприда и фунгицида беномила) при раздельном и совместном внесении в одно- и десятикратной нормах применения на структуру микробных комплексов и показатели биологической активности почвы. Установлено, что пестициды оказывают наибольшее влияние на грибное сообщество по сравнению с прокариотным, для которого показано изменение только обилия филумов актинобактерий и протеобактерий. Исследование грибных сообществ по результатам молекулярно-генетического анализа во всех почвенных образцах выявило два доминирующих отдела грибов: Ascomycota (72.6 ± 8.0%) и Basidiomycota (26.0 ± 7.7%). При этом в образцах с 10-кратными нормами применения пестицидов (как в смеси, так и по отдельности) обнаружено увеличение численности представителей отдела Basidiomycota. Внесение пестицидов оказывает краткосрочное стимулирующее действие на содержание углерода микробной биомассы. Показано, что инсектицид имидаклоприд стимулирует азотфиксацию, в то время как другие пестициды не оказывают влияния на этот показатель.
ВВЕДЕНИЕ
На современном этапе развития сельского хозяйства получение устойчиво высоких уровней урожая невозможно без применения пестицидов, т.е. веществ химической или биологической природы, используемых для уничтожения или отпугивания вредителей. Несмотря на то, что большинство пестицидов применяется для опрыскивания вегетирующих растений, они могут проникать в почвенную среду при использовании в начале вегетационного сезона или после сбора урожая, при выщелачивании из растительных остатков [50]. Основная проблема, связанная с загрязнением почвы пестицидами, заключается в их воздействии на структуру и активность микробных сообществ [7, 18].
Ранее установлено, что микробные сообщества почвы в целом могут быть устойчивыми к пестицидной нагрузке [35], хотя результаты исследований противоречивы. Существенные различия в оценке влияния пестицидов на почвенную микробиоту характерны даже для одного из самых изученных действующих веществ гербицидов – глифосата. С одной стороны, установлено отсутствие значимого воздействия на биоразнообразие микробного сообщества лесных и окультуренных почв, или выявлены только кратковременные эффекты – обеднение видового состава [12, 39]. Исследование хронической токсичности глифосата не показало значимых различий физиологического профиля бактериальных сообществ почв контрольных участков и полей с многолетним применением глифосата и контрольных участков [5]. С другой стороны, при изучении влияния глифосата на ризосферные бактерии кукурузы и генномодифицированной сои зафиксировано уменьшение числа псевдомонад, бактерий, окисляющих марганец и ауксин-продуцирующих ризобактерий [9, 50].
Для других действующих веществ пестицидов также имеется противоречивая информация об их влиянии на почвенную микробиоту. Например, при помощи градиентного гель-электрофореза в денатурирующих условиях (DDGE) показано влияние диурона, линурона, хлоротолурона на структуру микробного сообщества почвы в случае их длительного применения (10 лет), проявляющегося в уменьшении биоразнообразия [39]. В двухнедельном эксперименте обнаружено воздействие хлороталонила на почвенные бактерии родов Cytophaga, Flavobacterium, Bacteroides и грибы из классов аскомицетов и зигомицетов [44]. Бутахлор и карбофуран при содержании 2 мкг/г оказывали негативное воздействие на анаэробных азотфиксаторов в рисовых чеках, однако при более высоком содержании был зафиксирован положительный эффект [28]. Для атразина показано, что высокие нормы применения (10–1000 мг/кг) вызывают обеднение видового состава бактерий, при одновременном увеличении числа культивируемых форм [41].
Для грибных сообществ почвы наибольшее количество данных получено для арбускулярной микоризы, жизненно важной для роста и развития большинства сельскохозяйственных растений. Наиболее существенно влияние фунгицидов, которые воздействуют не только на фитопатогенные, но и на сапротрофные почвенные грибы [33]. Методом ПЦР-анализа и DGGE установлено, что карбендазим практически полностью подавляет рост арбускулярной микоризы в лабораторных экспериментах, но в полевых условиях этот эффект имеет лишь временный характер [24]. Выявлено, что такие фунгициды, как манкоцеб и беномил, ингибируют рост и образование спор Rhizophagus fasciculatus, являющегося доминантом среди микоризных грибов, ассоциированных с просом [14]. Беномил может ингибировать микоризные грибы гороха Glomus etunicaturn и Gigaspora rosea [43], причем ингибирующий эффект наблюдается вплоть до 82 сут после применения пестицида. Имеются данные [18], указывающие на то, что применение глифосата снижает жизнеспособность спор арбускулярной микоризы и уменьшает колонизацию корней уже при низких нормах применения. С помощью пиросеквенирования показано, что такие пестициды, как каптан, металаксил, флудиоксонил, тирам и трифлоксистробин, вызывают обеднение видового разнообразия микоризных грибов гороха и нута в условиях тепличного эксперимента [29].
Внесение пестицидов может влиять на микробный метаболизм [7], воздействуя на процесс утилизации углеродных субстратов и нитрификацию [26]. Большинство исследований свидетельствует о том, что пестициды оказывают минимальное влияние на микробную активность почвы в полевых условиях [11, 12], что может быть связано с комплексностью и избыточностью пула почвенных микроорганизмов, т.е. потери функций не происходит из-за высоких темпов физиологической адаптации микроорганизмов к нарушениям. С другой стороны, существует вероятность того, что незначительные изменения в структуре или функционировании сообщества могут все же уменьшить способность к дальнейшей адаптации или устойчивости к другим стрессовым воздействиям [42]. Этот факт, в частности, указывает на необходимость более тщательного изучения влияния пестицидов на показатели биоразнообразия микробных сообществ, в том числе с применением современных методов. В целом несмотря на то, что сам факт негативного воздействия пестицидов на бактерии и грибы установлен, масштабы этого явления, наличие и длительность хронических эффектов, последствия системного применения пестицидов для микробного сообщества почв, так и не определены [33]. На данный момент задача оценки влияния пестицидов на почвенную микробиоту осложнена тем, что классические культуральные методы не в состоянии зафиксировать происходящие изменения. Поэтому необходимы исследования с привлечением молекулярно-генетических и биомаркерных методов в сочетании с классическими [23, 33]. В данной работе проведена оценка влияния пестицидов на микробиоту с помощью высокопроизводительного секвенирования (NGS), а также методов оценки биологической активности почвенных микроорганизмов.
ОБЪЕКТЫ И МЕТОДЫ
Образцы агрогумусового горизонта агродерново-подзолистой типичной почвы [2] (Albic Retisols (Aric, Cutanic, Ochric) [49]) отбирали на экспериментальном участке в Одинцовском районе Московской области (55°34′42″ N, 36°34′32″ E). В течение последних пяти лет данный участок находился под паром и не обрабатывался пестицидами и агрохимикатами. Содержание Сорг в почве составляет 1.5%, рН водной вытяжки 5.6, плотность почвы – 1.13 г/см3, по гранулометрическому составу исследуемая почва относится к среднему суглинку. Образцы почвы высушивали на воздухе и просеивали через сито 1 мм.
В лабораторном инкубационном эксперименте использовали три препарата пестицидов: Лазурит, СП (700 г/кг метрибузина) – гербицид, Танрек, ВРК (200 г/л имидаклоприда) – инсектицид и Бенорад, СП (500 г/кг беномила) – фунгицид. Все препараты любезно предоставлены компанией АО “Август”. Метрибузин отличается низкой сорбционной способностью (константа сорбции органическим веществом, Koc = 38) и высокой растворимостью (~5 г/л), что обусловливает его потенциально высокую биодоступность. Имидаклоприд и основной метаболит беномила – карбендазим из-за своей высокой устойчивости в почве (период полуразложения, DT50 > 60–120 сут) могут длительно воздействовать на почвенные микроорганизмы.
Препараты пестицидов вносили в соответствии со средней рекомендованной для применения в Российской Федерации и 10-кратной нормой применения. Норма применения составила для гербицида – 1.4 л/га (0.98 кг/га метрибузина), для инсектицида – 0.1 л/га (0.02 кг/га имидаклоприда), для фунгицида 3 кг/га (1.5 кг/га беномила). Перед началом инкубационного эксперимента образцы почвы (100 г) перемешивали в ступке с 20 мл дистиллированной воды (контрольный вариант) или с 20 мл водного раствора препарата. Подготовленные образцы помещали в стеклянные сосуды объемом 250 мл, закрывали пленкой Parafilm® M, препятствующей испарению воды, и инкубировали в термостате при температуре +25°С. Для активизации гидролитического комплекса почвенных микроорганизмов одну из серий эксперимента проводили с внесением в почву крахмало-минеральной смеси (5 г/кг крахмала + 1 г/кг K2HPO4 и (NH4)2SO4). Все этапы лабораторного эксперимента проводили в трехкратной повторности. Схема инкубационного опыта приведена в табл. 1.
Таблица 1.
Схема проведения инкубационного эксперимента
| Рекомендованная норма | Внесение крахмало-минеральной смеси | Срок инкубации, сут |
|---|---|---|
| Индивидуальное внесение пестицидов | ||
| Контроль | – | 7, 14, 28, 56 |
| 1-кратная | – | 14 |
| 10-кратная | – | 14 |
| 1-кратная | + | 14 |
| 10-кратная | + | 14 |
| Смесь пестицидов | ||
| Контроль | + | 7, 14, 28, 56 |
| 1-кратная | – | 7, 14, 28, 56 |
| 10-кратная | – | 7, 14, 28, 56 |
| 1-кратная | + | 7, 14, 28, 56 |
| 10-кратная | + | 7, 14, 28, 56 |
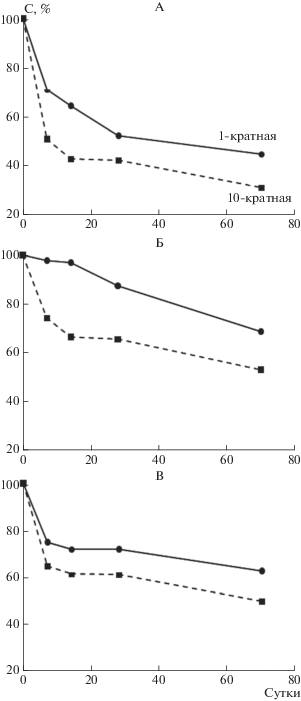
Для определения динамики разложения действующих веществ в образцах почвы определяли содержание их остаточных количеств на 0, 7, 14, 28, 56 сут инкубации. Экстракцию пестицидов проводили смесью ацетонитрила и воды (95 : 5) в течение 15 мин на вибрационной платформе (скорость 2400 об./мин, амплитуда – 4 мм), и далее в течение 5 мин в ультразвуковой ванне (160 Гц). Для повышения эффективности экстракции на платформе в пробирки добавляли три металлических шарика диаметром 5 мм. Далее экстракты центрифугировали в течение 5 мин при 13 400 g, надосадочную жидкость дополнительно пропускали через фильтр с диаметром пор 0.45 мкм. Экстракцию проводили дважды, экстракты объединяли, общий объем доводили до 40 мл ацетонитрилом, затем 10 мл экстракта упаривали на роторном испарителе (40°С) до объема <0.5 мл. Остаток почвы переносили в хроматографические виалы и обрабатывали двумя порциями ацетонитрила по 0.5 мл в ультразвуковой ванне в течение 30 с. Объем экстракта в виалах доводили до 1.5 мл ацетонитрилом, если это было необходимо. Анализ проводили при помощи ВЭЖХ Agilent 1200 series c квадруполь-времяпролетным масс-спектрометрическим детектором (6520 Accurate-Mass Q-TOF LC/MS Agilent Technologies, источник ионизации – электроспрей (+), колонка Phenomenex Hydro-RP C18 4 мкм 4.6 × 100 мм, подвижная фаза – вода и метанол с добавкой муравьиной кислоты (10 мМ), объем вводимой пробы – 5 мкл). Наиболее активное разложение пестицидов происходит в течение первых 7 сут (рис. 1), что связано с повышением активности микробиоты после увлажнения высушенной почвы. В последующий период скорость разложения пестицидов замедляется, что может быть объяснено их сорбцией органическим веществом и минеральной матрицей почвы. Таким образом, влияние пестицидов в проведенных экспериментах со временем ослабевает из-за перехода действующих веществ в недоступную для микроорганизмов форму.
Рис. 1.
Динамика разложения метрибузина (А), имидаклоприда (Б) и беномила (по карбендазиму) (В) в образцах почвы за период инкубации.
Для проведения анализа нуклеотидных последовательностей 16S рРНК почвенную микроколонку (0.3–0.4 г) извлекали при помощи бура и хранили до анализа при температуре –70°С. Тотальную ДНК выделяли при помощи набора реагентов FastDNA® SPIN Kit for Soil (MP Biomedicals, Irvine, CA) согласно рекомендациям производителя. Образцы выделенной ДНК разбавляли 500-кратно. Амплификацию вариабельного участка V4 гена 16S рРНК проводили в 1 раунд с использованием системы праймеров с двухиндексным мультиплексированием образцов, описанной в [20]. Амплификацию вариабельного участка ITS1 проводили с использованием следующих праймеров: BITS (5'–CTACCTGCGGARGGATCA–3') и B58S3 (5'–GAGATCCRTTGYTRAAAGTT–3') как описано в [36]. ПЦР продукты очищали с помощью набора Cleanup Mini kit (ЗАО Евроген, Россия) для выделения ДНК из реакционных смесей. Концентрацию полученных библиотек 16S рРНК и ITS-1 в растворе измеряли с помощью флуориметра Qubit® (Invitrogen, USA) с применением Quant-iT™ dsDNA High-Sensitivity Assay Kit. Очищенные ампликоны смешивали эквимолярно в соответствии с полученными концентрациями. Качество полученной библиотеки, подготовленной для секвенирования, оценивали с помощью электрофореза в агарозном геле. Дальнейшую пробоподготовку и секвенирование пулированного образца проводили с помощью MiSeq Reagent Kit v2 (500 циклов) и секвенатора MiSeq (Illumina, USA). Первичный анализ (демультиплексирование) проводили в соответствии с описанием в [20] с использованием программы QIIME версии 1.9.1. Итоговая длина ридов составила 252 пар нуклеотид. Анализ состава грибного сообщества проводили только для вариантов обработки почвы фунгицидом беномилом, а также смесью пестицидов.
Биоинформатический и статистический анализы проводили в онлайн-системе для обработки метагеномных данных Knomics-Biota [19]. Таксономический состав образцов оценивали путем классификации по базе данных последовательностей гена 16S и ITS-1 рРНК Greengenes версии 13.5 с помощью классификатора RDP. α-Разнообразие (таксономическое богатство сообществ) оценивали с помощью программы QIIME версии 1.9.1. Для определения достоверности попарного различия сообществ по составу микробиоты и вклада исследуемых факторов в данное различие использовали непараметрический дисперсионный анализ (функция ADONIS пакета VEGAN языка R) с оценкой достоверности.
Углерод микробной биомассы почвы (Смикр) рассчитывали методом субстрат-индуцированного дыхания согласно [8]. Скорость субстрат-индуцированного дыхания определяли по продукции С–CO2 через 3 ч после внесения в почву 0.2 мл 10%-ного раствора глюкозы. Для определения нитрогеназной активности использовали метод восстановления ацетилена в этилен с пересчетом количества образовавшегося этилена в количество фиксированного азота в соотношении 1 : 3. Скорость образования закиси азота оценивали в анаэробных условиях (после продувки флаконов аргоном) с внесением ацетилена в качестве ингибитора редуктазы закиси азота. Все измерения проводили в пятикратной повторности. Суммарную потенциальную продукцию азотфиксации и денитрификации рассчитывали для всего периода инкубации образцов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структура почвенных прокариотных сообществ. В контрольной почве среди прокариот доминируют представители филогенетических групп Proteobacteria и Actinobacteria (рис. 2). Представители других филумов составляют не более 15% от общей численности прокариот. В вариантах опыта с внесением гербицида, инсектицида и фунгицида по отдельности наблюдается возрастание доли актинобактерий. Наиболее массовое развитие представителей этого филума отмечено при внесении 10-кратной нормы фунгицида. Эта тенденция прослеживается на протяжении всего инкубационного эксперимента, что позволяет предполагать значимое участие актинобактерий в разложении пестицидов в исследованной почве. Изменения относительного обилия представителей других филумов (Verrucomicrobia, Planctomycetes, Cyanobacteria, Bacteroidetes, Gemmatimonadetes, Firmicutes, Crenarchaeota, Acidobacteria и кандидатов групп AD3,WPS-2) носят статистически недостоверный характер. В варианте опыта с совместным внесением трех пестицидов и без добавления крахмало-минеральной смеси во всех образцах наблюдается доминирование представителей филогенетической группы Proteobacteria (рис. 3). В то же время возрастание доли актинобактерий в составе сообществ по мере увеличения времени инкубации достоверно не отличается от контрольного варианта.
Рис. 2.
Структура прокариотных сообществ в почвах на 14-е сут после индивидуального внесения пестицидов. Обозначения здесь и далее: 1 – 1-кратная норма внесения препаратов, 10 – 10-кратная норма внесения препаратов.
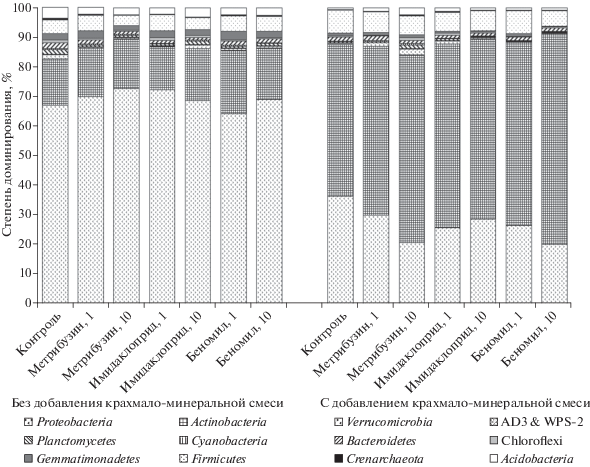
Рис. 3.
Структура прокариотных сообществ в почвах после внесения смеси из трех пестицидов (через дробь указаны сутки сукцессии).
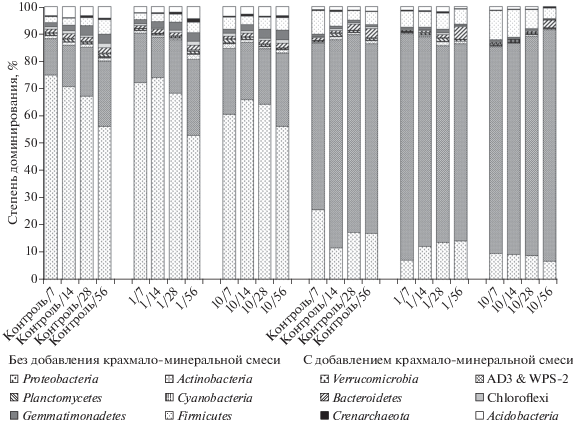
В варианте опыта с добавлением крахмала и смеси пестицидов выявлено увеличение относительного обилия актинобактерий уже на самых ранних стадиях сукцессии. При единовременном внесении трех пестицидов в 1-кратной норме происходит резкое сокращение относительного обилия представителей филума Proteobacteria, численность, которых постепенно возрастает на более поздних сроках сукцессии. При внесении однократной нормы смеси трех пестицидов установлено увеличение доли актинобактерий в составе прокариотных сообществ на 15% по сравнению с контрольным вариантом на седьмые сутки инкубирования, но в последующем рост численности этой группы замедляется и на 28- и 56-е сут сукцессии уже не отличается от контроля. Внесение 10-кратной дозы смеси пестицидов приводит к проявлению тех же перестроек в структуре прокариотного сообщества, за исключением поздних сроков сукцессии: на 56-е сут инкубации актинобактерии составляют более 80% всего регистрируемого бактериального сообщества.
Оценка α-разнообразия бактериального сообщества выявила различия по вариантам опыта. Интересным является тот факт, что при внесении 10-кратной нормы применения пестицидов, как в смеси из трех препаратов, так и по отдельности, в почву без крахмала отмечается сходство индекса Шеннона бактериального сообщества. В целом, общее разнообразие прокариот по индексу Шеннона выше в почвенных образцах без добавления крахмала (табл. 2). При внесении 10-кратной нормы применения пестицидов отмечается снижение α-разнообразия бактериального комплекса агродерново-подзолистой почвы, что указывает на развитие специфической микробной группировки, специализирующейся на разложении внесенных ксенобиотиков. Установлено, что на структуру бактериального сообщества статистически значимое воздействие (p < 0.05) оказывает только внесение крахмало-минеральной смеси. Увеличение относительного обилия представителей филума Actinobacteria во всех почвах на 56-е сут инкубации, с добавлением дополнительного источника углерода в виде крахмала, вероятно, обусловлено преимущественной ассимиляцией этого источника углерода данной группой бактерий, из-за широко распространенной среди них способности к гидролизу различных полимерных соединений [3]. Увеличение доли актинобактерий, особенно в вариантах без добавления дополнительного источника углерода может быть обусловлено ассимиляцией бактериями данного филума внесенных препаратов, что было показано ранее [6].
Таблица 2.
Показатели α-разнообразия бактериального сообщества
| Вариант опыта* | Количество ОТЕ | Индекс Шеннона | Индекс Chao 1 |
|---|---|---|---|
| Без добавления крахмало-минеральной смеси | |||
| Контроль | 784 | 5.20 | 774 |
| Метрибузин, 1 | 396 | 4.29 | 397 |
| Метрибузин, 10 | 264 | 4.00 | 265 |
| Имидаклоприд, 1 | 368 | 3.86 | 369 |
| Имидаклоприд, 10 | 198 | 3.89 | 198 |
| Беномил, 1 | 383 | 4.33 | 382 |
| Беномил, 10 | 415 | 4.36 | 417 |
| Смесь, 1 | 1131 | 4.34 | 1084 |
| Смесь, 10 | 1240 | 4.86 | 1168 |
| С добавлением крахмало-минеральной смеси | |||
| Контроль | 997 | 4.43 | 895 |
| Метрибузин, 1 | 608 | 4.42 | 608 |
| Метрибузин, 10 | 500 | 4.33 | 488 |
| Имидаклоприд, 1 | 391 | 4.08 | 399 |
| Имидаклоприд, 10 | 420 | 4.22 | 418 |
| Беномил, 1 | 428 | 4.11 | 426 |
| Беномил, 10 | 391 | 3.84 | 395 |
| Смесь, 1 | 454 | 3.58 | 453 |
| Смесь, 10 | 598 | 3.20 | 518 |
Таблица 3.
Показатели α-разнообразия грибного сообщества
| Вариант опыта* | Количество ОТЕ | Индекс Шеннона | Индекс Chao 1 |
|---|---|---|---|
| Без добавления крахмало-минеральной смеси | |||
| Контроль | 204 | 4.12 | 205 |
| Беномил, 1 | 132 | 3.28 | 132 |
| Беномил, 10 | 205 | 3.67 | 207 |
| Смесь, 1 | 141 | 3.09 | 142 |
| Смесь, 10 | 164 | 3.53 | 168 |
| С добавлением крахмало-минеральной смеси | |||
| Контроль | 33 | 0.73 | 33 |
| Беномил, 1 | 118 | 2.24 | 118 |
| Беномил, 10 | 308 | 4.00 | 309 |
| Смесь, 1 | 51 | 0.85 | 53 |
| Смесь, 10 | 38 | 2.61 | 38 |
Резкое сокращение относительного обилия протеобактерий в варианте опыта с одновременным применением трех препаратов, независимо от внесения дополнительного источника углерода, а также сокращение доли бактерий данной группы во всех остальных вариантах опыта, особенно при применении 10-кратных доз препаратов, хорошо согласуется с ранее проведенными исследованиями [26, 30]. Наблюдаемое восстановление популяции бактерий данной группы на поздних сроках сукцессии свидетельствует о компенсаторных перестройках в сообществе, возможно, при участии видов, способных к гидролизу внесенных препаратов [13].
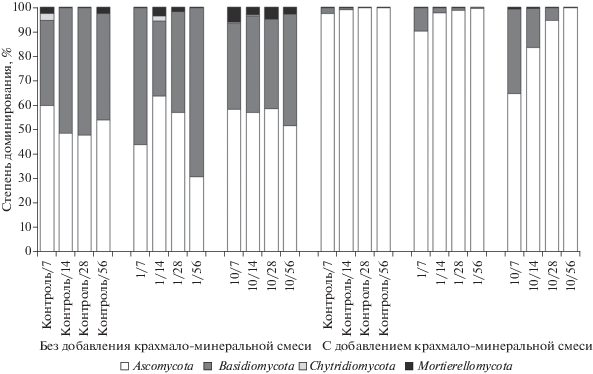
Структура почвенных грибных сообществ. Исследование грибных сообществ по результатам молекулярно-генетического анализа во всех почвенных образцах выявило два доминирующих отдела грибов: Ascomycota (72.6 ± 8.0%) и Basidiomycota (26.0 ± 7.7%), остальные отделы занимают минорные позиции (рис. 4). Представители отделов Ascomycota и Basidiomycota являются важными деструкторами в углеродном цикле почв, выделяющими ферменты разрушающие органические полимеры. Показано [48], что увеличение доли представителей Basidiomycota способствует более быстрому разложению растительных остатков в почве. При внесении 10-кратной нормы пестицидов без добавления крахмало-минеральной смеси происходит увеличение доли представителей отдела Mortierellomycota. В образцах без добавления крахмало-минеральной смеси численность Mortierellomycota увеличивается более, чем в 5 раз. Добавление крахмала и минеральных солей в почву приводит к увеличению численности представителей отдела Ascomycota, а при внесении смеси из трех пестицидов в 10-кратной норме применения на 7- и 14-е сут в структуре грибного сообщества появляется отдел Mortierellomycota. Кроме того, в образцах с 10-кратными нормами применения пестицидов (как в смеси, так и по отдельности) выявлено увеличение численности представителей отдела Basidiomycota.
Рис. 4.
Структура грибных сообществ в почвах после внесения смеси из трех пестицидов (через дробь указаны сутки сукцессии).
Общее разнообразие грибов по индексу Шеннона больше в почвенных образцах без добавления крахмала. Этот показатель возрастал в вариантах с 10-кратной нормой применения смеси пестицидов и отдельно фунгицида (табл. 3). Установлено, что внесение пестицидов оказывает на структуру грибного сообщества статистически значимое воздействие (p < 0.05). Увеличение доли представителей отделов Mortierellomycota и Basidiomycota при внесении 10-кратной нормы пестицидов независимо от наличия дополнительного источника углерода может быть обусловлено тем, что среди представителей этих отделов известны виды, характеризующиеся высокой гидролитической активностью, в частности, способные использовать составные компоненты ксенобиотиков в качестве питательного субстрата [32].
Углерод микробной биомассы и биологическая активность почвы. В контрольном варианте опыта без внесения пестицидов и крахмало-минеральной смеси содержание углерода микробной биомассы составляет 500–750 мг/кг (рис. 5). В варианте опыта без добавления крахмало-минеральной смеси при внесении суммы трех пестицидов как в 1-кратной, так и в 10-кратной норме применения зафиксировано увеличение содержания Смикр на ранних сроках инкубации (к 7–28 сут). В то же время к концу эксперимента (56-е сут) статистически значимого увеличения содержания Смикр по сравнению с контролем не установлено. Прирост углерода микробной биомассы в почве после обработки препаратами пестицидов связан с использованием микроорганизмами инертных компонентов и действующих веществ пестицидов (при их биодеградации), а также некромассы микромицетов (после обработки фунгицидом) в качестве источников углерода и энергии. Увеличение численности и биомассы микроорганизмов после обработки почвы пестицидами показано в работах [17, 22, 27] и связывается в первую очередь с увеличением численности бактерий [21, 39] и со способностью микроорганизмов ассимилировать продукты разложения составляющих компонентов препаратов пестицидов [46]. Чен с соавт. [15] показали, что обработка почвы фунгицидом приводит к гибели или ингибированию активности микромицетов, но способствует быстрому увеличению активности бактерий. При этом увеличение численности микроорганизмов возможно даже при относительно низком уровне внесения пестицидов. Эффект стимулирования численности микроорганизмов при содержании пестицидов в интервале 10–50 мг/кг показан после применения смеси фунгицидов и инсектицидов (циперметрин + манкоцеб и хлорпирифос + + карбендазим) на почвах томатных плантаций Эквадора [45]. Увеличение численности бактерий было показано при применении инсектицида профенофоса на суглинистой почве в норме 10–300 мг/кг [34], а также других инсектицидов [4, 16, 47]. Увеличение микробной биомассы почвы отмечено при внесении гербицида глифосата в соответствии с однократной рекомендованной нормой [21, 36, 48].
Рис. 5.
Содержание углерода микробной биомассы (А), потенциальная продуктивность азотфиксации (Б) и денитрификации (В) в образцах почвы после внесения пестицидов.
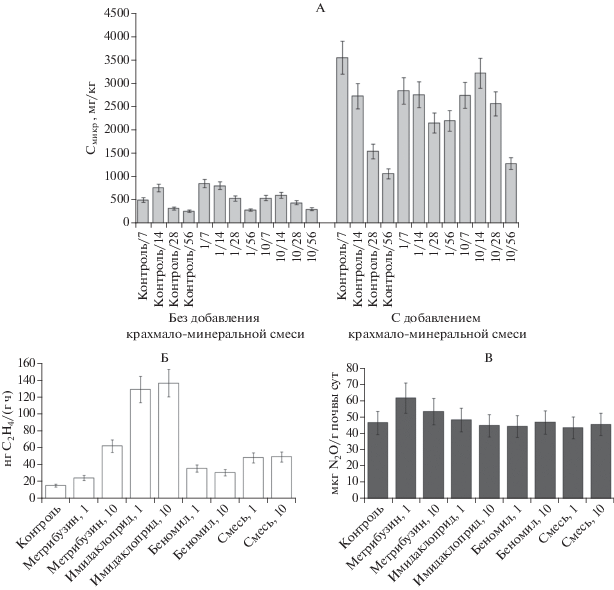
Внесение крахмало-минеральной смеси приводит к существенному увеличению содержания углерода микробной биомассы в образцах агродерново-подзолистой почвы. В этом случае внесение пестицидов не оказывает влияния на содержание Смикр, поскольку микроорганизмы переключаются на потребление крахмала как более легкодоступного источника углерода и энергии. Общей тенденцией является уменьшение содержания углерода микробной биомассы со временем, что связано с расходованием доступных источников органического углерода, необходимых для роста микроорганизмов. Минимальные значения Смикр характерны для образцов почвы через 56 дней после начала эксперимента.
Максимальная активность азотфиксации во всех вариантах опыта наблюдалась в первые сутки инкубации. При применении 1- и 10-кратной нормы расхода препаратов фунгицид, гербицид, а также сумма фунгицид + гербицид + инсектицид не оказывают значимого влияния на процесс связывания атмосферного азота. В то же время для инсектицида как при 1-кратной, так и при 10-кратной норме применения зафиксировано стимулирование азотфиксации. Из литературных данных известно разнонаправленное воздействие гербицидов на чистые культуры азотфиксаторов in vitro, а также азотфиксирующую активность клубеньковых бактерий сои [1]. В зависимости от вида и концентрации гербицида, срока применения (до- или послевсходовая обработка), а также почвенных условий возможно как увеличение азотфиксирующей активности, численности и массы клубеньков, так и уменьшение этих показателей. Ранее показано [31], что при применении гербицида глифосата на посевах устойчивых у глифосату сортов сои наблюдается уменьшение интенсивности симбиотической азотфиксации. Схожие результаты получены и другими исследователями [10, 52]. В то же время в условиях полевого эксперимента по применению глифосата ассимиляция атмосферного азота снижалась только при обработке высокими дозами гербицида [51]. Применение глифосата также не оказало воздействия на интенсивность симбиотической азотфиксации генномодифицированных растений сои [38]. Наши данные показывают, что свободноживущие азотфиксаторы in situ проявляют устойчивость к пестицидной нагрузке, не только по отношению к гербицидам, но и к другим группам препаратов. В то же время применение пестицидов как в 1-кратной, так в 10-кратной дозе препаратов не оказывает значимого воздействия на активность денитрификаторов.
ЗАКЛЮЧЕНИЕ
Показано, что внесение исследуемых препаратов (гербицида метрибузина, инсектицида имидаклоприда и фунгицида беномила) оказывает краткосрочное влияние на таксономическую структуру и активность почвенного микробного комплекса. Обнаружено стимулирующее действие пестицидов на содержание углерода микробной биомассы в первые недели после обработки, что свидетельствует об активной микробной трансформации пестицидов в почве. При этом наибольшие изменения наблюдались в грибном сообществе по сравнению с прокариотным, для которого показана динамика только обилия филумов актинобактерий и протеобактерий. Исследование грибных сообществ по результатам молекулярно-генетического анализа во всех почвенных образцах выявило два доминирующих отдела грибов: Ascomycota (72.6 ± 8.0%) и Basidiomycota (26.0 ± 7.7%). При этом в образцах с 10-кратными нормами применения пестицидов (как в смеси, так и по отдельности) обнаружено увеличение численности представителей отдела Basidiomycota. Свободноживущие азотфиксаторы in situ проявляют относительную устойчивость к пестицидной нагрузке, причем не только по отношению к гербицидам, но и к другим группам препаратов. Применение пестицидов как в 1-кратной, так и 10-кратной дозе препаратов, не оказывает значимого воздействия и на денитрификаторов, активность которых определяется концентрацией нитратов и легкодоступного органического вещества в почве.
Список литературы
Дряхлов А.И. Влияние почвенного гербицида трифлюрекса и ризоторфина на азотфиксирующую активность и урожай семян сои // Масличные культуры. 2012. Вып. 1(150). С. 1–5.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Манучарова Н.А. Гидролитические прокариотные комплексы наземных экосистем. М.: Университетская книга, 2014. 272 с.
Adebayo T.A., Ojo O.A., Olaniran O.A. Effects of two insecticides Karate1 and Thiodan1 on population dynamics of four different soil microorganisms // Res. J. Biologic. Sci. 2007. V. 2. P. 557–560.
Allegrini M., Zabaloy M.C., Gómez E. del V. Ecotoxicological assessment of soil microbial community tolerance to glyphosate // Sci. Total Environ. 2015. V. 533. P. 60–68. https://doi.org/10.1016/j.scitotenv.2015.06.096
Alvarez A., Saez J.M., Davila Costa J.S., Colin V.L., Fuentes M.S., Cuozzo S.A., Amoroso M.J. Actinobacteria: Current research and perspectives for bioremediation of pesticides and heavy metals // Chemosphere. 2017. V. 166. P. 41–62. https://doi.org/10.1016/j.chemosphere.2016.09.070
Alvarez-Martin A., Hilton S.L., Bending G.D., Rodriguez-Cruz M.S., Sanchez-Martin M.J. Changes in activity and structure of the soil microbial community after application of azoxystrobin or pirimicarb and an organic amendment to an agricultural soil // Appl. Soil Ecol. 2016. V. 106. P. 47–57. https://doi.org/10.1016/j.apsoil.2016.05.00
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. P. 215–221. https://doi.org/10.1016/0038-0717(78)90099-8
Barriuso J., Marin S., Mellado R.P. Effect of the herbicide glyphosate on glyphosate-tolerant maize rhizobacterial communities: a comparison with pre-emergency applied herbicide consisting of a combination of acetochlor and terbuthylazine // Environ. Microbiol. 2010. V. 12. № 4. P. 1021–1030. https://doi.org/10.1111/j.1462-2920.2009.02146.x
Bohm G.M.B., Alves B.J.R., Urquiaga S., Boddey R.M., Xavier G.R., Hax F., Rombaldi C.V. Glyphosate- and imazethapyr-induced effects on yield, nodule mass and biological nitrogen fixation in field-grown glyphosate-resistant soybean // Soil Biol. Biochem. 2009. V. 41. P. 420–422. https://doi.org/10.1016/j.soilbio.2008.11.002
Bromilow R.H., Evans A.A., Nicholls P.H., Todd A.D., Briggs G.G. The effect on soil fertility of repeated applications of pesticides over 20 years // Pesticide Science. 1996. V. 48. P. 63–72. https://doi.org/10.1002/(SICI)1096-9063(199609)48: 1<63::AID-PS442>3.0.CO;2-I
Busse M.D., Ratcliff A.W., Shestak C.J., Powers R.F. Glyphosate toxicity and the effects of long-term vegetation control on soil microbial communities // Soil Biol. Biochem. 2001. V. 33. P. 1777–1789. https://doi.org/10.1016/S0038-0717(01)00103-1
Chanika E., Georgiadou D., Soueref E., Karas P., Karanasios E., Tsiropoulos N.G., Karpouzas D.G. Isolation of soil bacteria able to hydrolyze both organophosphate and carbamate pesticides // Bioresource Technology. 2011. V. 102. P. 3184–3192. https://doi.org/10.1016/j.biortech.2010.10.145
Channabasava A., Lakshman H.C., Jorquera M.A. Effect of fungicides on association of arbuscular mycorrhiza fungus Rhizophagus fasciculatus and growth of Proso millet (Panicum miliaceum L.) // J. Soil Sci. Plant Nutrition. 2015. V. 15. № 1. Р. 35–45. https://doi.org/10.4067/S0718-95162015005000004
Chen S.K., Edwards C.A., Subler S. Effect of fungicides benomyl, captan and chlorothalonil on soil microbial activity and nitrogen dynamics in laboratory incubations // Soil Biol. Biochem. 2001. V. 33. P. 1971–1980.
Cycon M., Piotrowska-Seget Z., Kaczynska A., Kozdroj J. Microbiological characteristics of a loamy sand soil exposed to tebuconazole and λ-cyhalothrin under laboratory conditions // Ecotoxicol. 2006. V.15. № 8. P. 639–646.
Das A.C., Mukherjee D. Soil application of insecticides influences microorganisms and plant nutrients // Appl. Soil Ecol. 2000. V. 14. P. 55–62.
Druille M., Omacini M., Golluscio R.A., Cabello M.N. Arbuscular mycorrhizal fungi are directly and indirectly affected by glyphosate application // Appl. Soil Ecol. 2013. V. 72. P. 143–149. https://doi.org/10.1016/j.apsoil.2013.06.011
Efimova D., Tyakht A., Popenko A., Vasilyev A., Altukhov I., Dovidchenko N., Alexeev D. Knomics-Biota – a system for exploratory analysis of human gut microbiota data // BioData Mining. 2018. V. 11. P. 1–7. https://doi.org/10.1186/s13040-018-0187-3
Fadrosh D.W., Ma B., Gajer P., Sengamalay N., Ott S., Brotman R.M., Ravel J. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform // Microbiome. 2014. V. 2. P. 6. https://doi.org/10.1186/2049-2618-2-6
Haney R.L., Senseman S.A., Hons F.M. Effect of roundup ultra on microbial activity and biomass from selected soils // J. Environ. Quality. 2000. V. 31. P. 730–735. https://doi.org/10.2134/jeq2002.7300
Hussain S., Siddique T., Saleem M., Arshad M., Khalid A. Impact of pesticides on soil microbial diversity, enzymes, and biochemical reactions // Advances in Agronomy. Academic Press, 2009. P. 159–200.
Imfeld G., Vuilleumier S. Measuring the effects of pesticides on bacterial communities in soil: A critical review // Eur. J. Soil Biol. 2012. V. 49. P. 22–30. https://doi.org/10.1016/j.ejsobi.2011.11.010
Ipsilantis I., Samourelis C., Karpouzas D.G. The impact of biological pesticides on arbuscular mycorrhizal fungi // Soil Biol. Biochem. 2012. V. 45. P. 147–155. https://doi.org/10.1016/j.soilbio.2011.08.007
IUSS Working Group WRB. World reference base for soil resources. World Soil Resources Reports № 103. FAO, Rome, 2006.
Jacobsen C.S., Hjelmsø M.H. Agricultural soils, pesticides and microbial diversity // Current Opinion in Biotechnology. 2014. V. 27. P. 15–20. https://doi.org/10.1016/j.copbio.2013.09.003
Jana T.K., Debnath N.C., Basak R.K. Effect of insecticides on decomposition of organic matter, ammonification and nitrification in a fluventic Ustochrept // J. Indian Soc. Soil Sci. 1998. V. 46. P. 133–134.
Jena P.K., Adhya T.K., Rao R.V. Influence of carbaryl on nitrogenase activity and combinations of butachlor and carbofuran on nitrogen-fixing micro-organisms in paddy soils // Pest Management Science. 1987. V. 19. P. 179–184. https://doi.org/10.1002/ps.2780190303
Jin H., Germida J.J., Walley F.L. Suppressive effects of seed-applied fungicides on arbuscular mycorrhizal fungi (AMF) differ with fungicide mode of action and AMF species // Appl. Soil Ecol. 2013. V. 72. № 10. P. 22–30. https://doi.org/10.1016/j.apsoil.2013.05.013
Katayama A., Funasaka K., Fujie K. Changes in the respiratory quinone profile of a soil treated with pesticides // Biol. Fertility Soils. 2001. V. 33. P. 454–459. https://doi.org/10.1007/s003740100355
Kremer R.J., Means N.E. Glyphosate and glyphosate-resistant crop interactions with rhizosphere microorganisms // Eur. J. Agronomy. 2009. V. 31. P. 153–161. https://doi.org/10.1016/j.eja.2009.06.004
Li Y. Treating wheat seeds with neonicotinoid insecticides does not harm the rhizosphere microbial community // PloS One. 2018. V. 13. № 12. https://doi.org/10.1371/journal.pone.0205200
Lo C.-C. Effect of pesticides on soil microbial community // J. Environ. Sci. Health. Part B. 2010. V. 45. P. 348–359. https://doi.org/10.1080/03601231003799804
Martinez-Toledo M.V., Salmeron V., Gonzalez-Lopez J. Effect of an organophosphorus insecticide, profenofos, on agricultural soil microflora // Chemosphere. 1992. V. 24. P. 71–80.
Moorman T.B. A review of pesticide effects on microorganisms and microbial processes related to soil fertility // J. Production Agriculture. 1989. V. 2. P. 14–23. https://doi.org/10.2134/jpa1989.0014
Mukherjee P.K., Chandra J., Retuerto M., Sikaroodi M., Brown R.E., Jurevic R. et al. Oral mycobiome analysis of HIV-infected patients: identification of Pichia as an antagonist of opportunistic fungi // PLoS Pathog. 2014. V. 10. P. e1003996. https://doi.org/10.1371/journal.ppat.1003996
Panettieri M., Lazaro L., López-Garrido R., Murillo J.M., Madejón E. Glyphosate effect on soil biochemical properties under conservation tillage // Soil Tillage Res. 2013. V. 133. P. 16–24. https://doi.org/10.1016/j.still.2013.05.007
Powell J.R., Campbell R.G., Dunfield K.E., Gulden R.H., Hart M.M., Levy-Booth D.J., Antunes P.M. Effect of glyphosate on the tripartite symbiosis formed by Glomus intraradices, Bradyrhizobium japonicum, and genetically modified soybean // Appl. Soil Ecol. 2009. V. 41. P. 128–136. https://doi.org/10.1016/j.apsoil.2008.10.002
Ratcliff A.W., Busse M.D., Shestak C.J. Changes in microbial community structure following herbicide (glyphosate) additions to forest soils // Appl. Soil Ecol. 2006. V. 34. P. 114–124. https://doi.org/10.1016/j.apsoil.2006.03.002
Riah W., Laval K., Laroche-Ajzenberg E., Mougin C., Latour X., Trinsoutrot-Gattin I. Effects of pesticides on soil enzymes: a review // Environ. Chem. Lett. 2014. V. 12. P. 257–273. https://doi.org/10.1007/s10311-014-0458-2
Ros M., Goberna M., Moreno J.L., Hernandez T., Garcia C., Insam H., Pascual J.A. Molecular and physiological bacterial diversity of a semi-arid soil contaminated with different levels of formulated atrazine // App-l. Soil Ecol. 2006. V. 34. P. 93–102. https://doi.org/10.1016/j.apsoil.2006.03.010
Rose M.T., Cavagnaro T.R., Scanlan C.A., Rose T.J., Vancov T., Kimber S., Van Zwieten L. Impact of Herbicides on Soil Biology and Function // Advances in Agronomy. 2016. P. 133–220. https://doi.org/10.1016/bs.agron.2015.11.005
Schreiner R.P., Bethlenfalvay G.J. Mycorrhizae, biocides, and biocontrol 3. Effects of three different fungicides on developmental stages of three AM fungi // Bio-l. Fertil. Soils. 1997. V. 24. P. 18–26. https://doi.org/10.1007/BF01420215
Sigler W.V., Turco R.F. The impact of chlorothalonil a-pplication on soil bacterial and fungal populations as assessed by denaturing gradient gel electrophoresis // Appl. Soil Ecol. 2002. V. 21. P. 107–118. https://doi.org/10.1016/S0929-1393(02)00088-4
Srinivasulu M., Ortiz D.R. Effect of pesticides on bacterial and fungal populations in Ecuadorian tomato cultivated soils // Environ. Process. 2017. V. 4. P. 93–105.
Tyess D.L., Shea P.J., Parkhurst A.M. Mineralization potential of atrazine and degradation intermediates from clustered characteristics in inoculated soils // Soil Sed. Contam. 2006. V. 15. P. 87–102.
Wang M., Liu Y., Wang Q., Gong M., Hua X.Y.P., Hu S., Yang Y. Impacts of methamidophos on the biochemical, catabolic and genetic characteristics of soil microbial communities // Soil Biol. Biochem. 2008. V. 40. P. 778–788.
Wang R., Zhang H., Sun L., Qi G., Chen S., Zhao X. Microbial community composition is related to soil biological and chemical properties and bacterial wilt outbreak // Scientific Rep. 2017. V. 7. P. 1–10. https://doi.org/10.1038/s41598-017-00472-6
WRB I. W. G. World reference base for soil resources 2014, update 2015. World soil resources reports. 2015. V. 106. P. 192.
Zabaloy M.C. et al. Herbicides in the soil environment: linkage between bioavailability and microbial ecology // Herbicides, Theory and Applications / Eds. Soloneski S. and Larramendy M.L. Rijeka. 2011. P. 161–192.
Zablotowicz R.M., Reddy K.N. Nitrogenase activity, nitrogen content, and yield responses to glyphosate in glyphosate-resistant soybean // Crop Protection. 2007. V. 26. P. 370–376. https://doi.org/10.1016/j.cropro.2005.05.013
Zobiole L.H.S., Kremer R.J., Oliveira R.S., Constantin J. Glyphosate affects micro-organisms in rhizospheres of glyphosate-resistant soybeans // J. Appl. Microbiol. 2010. V. 110. P. 118–127. https://doi.org/10.1111/j.1365-2672.2010.04864.x
Zobiole L.H.S., Oliveira R.S., Kremer R.J., Constantin J., Yamada T., Castro C., Oliveira A. Effect of glyphosate on symbiotic N2 fixation and nickel concentration in glyphosate-resistant soybeans // Appl. Soil Ecol. 2010. V. 44. P. 176–180. https://doi.org/10.1016/j.apsoil.2009.12.003
Дополнительные материалы отсутствуют.
Инструменты
Почвоведение


