Почвоведение, 2020, № 5, стр. 601-609
Влияние лигногумата на биологическую активность почвы о. Бали, Индонезия
Л. А. Поздняков a, b, *, А. Л. Степанов a, М. Э. Гасанов a, М. В. Семенов c, О. С. Якименко a, А. К. Суада d, А. Н. Рай d, Н. М. Щеголькова a, e
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b ВНИИ мелиорированных земель
170530 Калининский р-н, Тверская область, п. Эммаусс, 27, Россия
c Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, Россия
d Университет Удаяна
80361 Денпасар, Бали, Индонезия
e Институт водных проблем РАН
117971 Москва, ул. Губкина, 3, Россия
* E-mail: APL-223@mail.ru
Поступила в редакцию 20.07.2019
После доработки 22.09.2019
Принята к публикации 27.12.2019
Аннотация
Оценено воздействие гуминового препарата “Лигногумат” на биологическую активность латосоли (Latosol) о. Бали (Индонезия), находящейся в длительном сельскохозяйственном использовании с применением пестицидов. В модельных экспериментах показано, что внесение лигногумата в градиенте концентраций от 0.025 до 2.5 мг/г почвы приводит к возрастанию интенсивности дыхания почвенного микробного сообщества на 10–30%, пропорционально дозе внесенного препарата. По мере роста дозы внесенного лигногумата значительно (в 3 раза) увеличивалась интенсивность азотфиксации, вызванная активацией бактерий семейства Oxalobacteriaceae. В целом бактериальное сообщество латосоли на 85% состояло из представителей четырех филумов: Proteobacteria, Firmicutes, Chloroflexi и Acidobacteria. Присутствие лигногумата также повышало активность метаногенеза и сокращало газообразные потери азота за счет денитрификации при дозировке >0.025 мг/г. Сделан важный в практическом отношении вывод о снижении токсического эффекта пестицидов в присутствии лигногумата и его положительном влиянии на биологическую активность и баланс азота в почве интенсивного сельскохозяйственного использования о. Бали.
ВВЕДЕНИЕ
Интерес к изучению действия коммерческих гуминовых продуктов (ГП) на биологическую активность почв определяется экологической безопасностью их использования (произведены из натурального сырья), низкой рыночной стоимостью и высокой эффективностью [17, 30].
На сегодняшний день опубликовано немало данных о позитивном влиянии гуминовых веществ на свойства почв, рост и развитие растений [9, 27, 28, 36]. В отношении почвенного микробного сообщества показано, что и коммерческие ГП, и природные гуминовые вещества, способны стимулировать его активность, что выражается в увеличении показателей численности почвенных микроорганизмов, активности ферментов, усилении эмиссии СО2, азотфиксации и денитрификации [5, 16, 34]. Эти эффекты особенно выражены в условиях загрязнения почв [2, 3, 6, 11].
Вместе с тем особенности проявления этих эффектов, их механизмы, и, как следствие, дозировки ГП для эффективного и безопасного применения окончательно не ясны. Например, Куликова c соавт. [22] подчеркивали, что сложность структуры ГП и разнообразие условий экспериментов приводят к широкому спектру наблюдаемых биологических эффектов. Известно, что в широком диапазоне концентраций ГП проявляют зависимость доза–эффект [13, 39] и потенциально могут оказывать как стимулирующее, так и ингибирующее воздействие на бактерии, грибы, почвенную фауну и иметь определенное влияние на биологическую активность почвы в целом [35].
Большой интерес представляет оценка эффективности применения ГП на почвах интенсивного сельскохозяйственного использования с внесением агрохимикатов (пестицидов и других средств защиты растений). В частности, показано, что ГП могут либо усиливать, либо уменьшать токсичность ксенобиотиков, оказывая синергетическое или антагонистическое воздействие на рост растений и устойчивость пестицидов в окружающей среде в зависимости от задействованных химических и физиологических механизмов [20, 23, 24, 31, 38].
Особую актуальность и перспективность эти исследования приобретают для стран Юго-Восточной Азии из-за высокой плотности населения в сельскохозяйственных районах, чрезвычайно малой посевной площади и, как следствие, необходимости использования интенсивных сельскохозяйственных технологий, предполагающих применение гербицидов, представляющих экологическую опасность их накопления в объектах окружающей среды, в почвах и сельскохозяйственной продукции.
На территории о. Бали (Индонезия) ранее проведен полевой опыт, показавший положительный эффект применения ГП на рост и развитие риса (Oryza sativa L.), а также продемонстрирован положительный эффект его совместного применения с пестицидами [10]. В этих исследованиях был использован гуминовый препарат марки “Лигногумат®” (ЛГ) (производство НПО “РЭТ”, Санкт-Петербург), химическая структура и некоторые проявления биологической активности которого частично охарактеризованы в предыдущих исследованиях [1, 5, 6, 13, 19, 33].
Цель настоящей работы – изучение влияния ЛГ в градиенте концентраций на процессы микробной трансформации углерода и азота в почве о. Бали, а также оценка его воздействия на эти процессы при совместном применении со средствами защиты растений в условиях модельного эксперимента.
ОБЪЕКТЫ И МЕТОДЫ
Объектом исследования являлась почва, отобранная в летний сезон 2016 г. на рисовом поле о. Бали (Индонезия). Рисовое поле находится в южной части острова в 15 км от побережья. На опытном поле во влажный сезон выращивается рис, а в сухой – кукуруза. Определение типа почвы проводили сотрудники почвенной лаборатории университета Удаяны. Они отнесли ее к латосоли (Latosol) [10].
Образцы почвы отбирали с участка поля методом конверта с глубины 0–20 см (координаты отбора проб: 8°34′45′′ S, 115°20′1′′ E). Все образцы почв высушивали до воздушно-сухого состояния, усредняли методом квартования, перетирали и просеивали через сито с размером ячеек 2 мм. Из полученных образцов готовили среднюю пробу для проведения дальнейших исследований. Химические свойства почвы: рН 6.5, 1.3% Cобщ, 0.13% Nобщ, удельная электропроводность водной вытяжки 84 мСм/см (соотношение почвы и воды – 1 : 4).
Дальнейшие исследования проводили в двух модельных экспериментах. В обоих опытах в качестве гуминового препарата использовали коммерческий препарат “Лигногумат®” производства НПО “РЭТ” (Санкт-Петербург), полученный методом искусственной гумификации лигносульфоната. Свойства и элементный состав ЛГ: рН 1%-ного раствора 9.0, зольность 40%, 37.3% Cобщ, 0.5% Nобщ, 9% K, содержание гуминовых кислот составляет 58% от органического вещества.
Опыт 1: оценка влияния ЛГ в градиенте концентраций. Для проведения модельного эксперимента в стеклянные сосуды объемом 100 мл помещали 20 г подготовленной почвы, вносили ЛГ в виде растворов в концентрации 0.01, 0.05, 0.1, 0.25 и 1%, что соответствовало 0.025, 0.125, 0.250, 0.625 и 2.5 мг/г почвы. Сосуды с почвой закрывали пленкой и помещали в термостат с температурой 28°С. Влажность почвы контролировали весовым методом. Для проведения микробиологических анализов на 1, 7, 14 и 28 сут инкубации отбирали навески почвы (2 г) и помещали в пенициллиновые флаконы в трехкратной повторности для каждого варианта опыта.
Опыт 2: оценка влияния ЛГ при внесении пестицидов. Для модельных опытов выбрали применяемые на рисовых полях о. Бали инсектициды, относящиеся к группе неоникотиноидов: имидаклоприд, фипронил и тиаметоксам. У официальных производителей инсектицидов приобретали коммерческие препараты, применяемые на острове: “Конфидор Экстра” (Имидаклоприд 700 г/кг), “Регент” (Фипронил 800 г/кг), “Актара” (Тиаметоксам 250 г/кг). При постановке опыта дозы внесения инсектицидов рассчитывали в соответствии с рекомендациями производителя по их применению для рисовых культур: 350 мкг/кг имидаклоприда, 0.35 мг/кг фипронила и 425 мг/кг тиаметоксама. Растворы инсектицидов для модельного опыта готовили путем растворения точной навески коммерческих инсектицидов в 50 мл дистиллированной воды. Из основных растворов готовили рабочий раствор смеси трех инсектицидов. Концентрацию инсектицидов в образцах исходной почвы определяли при помощи прибора Agilent 6520 Q-TOF LC/MS, она составила для тиаметоксама 0.001 мг/кг, имидаклоприда 0.018 мг/кг и фипронила 0.019 мг/кг.
Модельный эксперимент проводили в стеклянных сосудах объемом 100 мл, куда помещали по 20 г подготовленной почвы и вносили 5 мл раствора смеси инсектицидов. Контрольные образцы в опыте увлажняли 5 мл дистиллированной воды. Через 24 ч вносили 5 мл 0.25%-ного раствора ЛГ (эквивалентно 0.625 г/кг). Сосуды с почвой закрывали пленкой и помещали в термостат с температурой 28°С. Влажность почвы контролировали весовым методом. После 7, 14 и 28 сут инкубации снимали по три сосуда для каждого варианта опыта для проведения микробиологических анализов.
Оценка эффективности микробных процессов. В ходе обоих экспериментов определяли суммарную эффективность микробных процессов в соответствии с международной методикой, рекомендованной для изучения потенциального воздействия однократного внесения химических веществ на активность почвенных микроорганизмов [29] на основе оценки следующих микробиологических показателей: базального дыхания (БД), субстрат-индуцированного дыхания (СИД), активности метанообразования, азотфиксации и денитрификации. Наблюдение за динамикой показателей вели согласно протоколу в течение месяца, измерения проводили в первый день эксперимента, затем на 7, 14 и 28 сут. По окончании опыта вычисляли суммарную активность – общее количество выделившегося газа (СО2, СН4, N2O, C2H4) за весь период наблюдения (28 дней). На каждом сроке измерения оценку показателей биологической активности проводили в трехкратной повторности, общее число измерений для вычисления суммарной величины составляло 12.
Для определения СИД в образцы предварительно вносили 0.25 мл раствора глюкозы из расчета 2.5 мг глюкозы на 1 г почвы [4]. Флаконы закрывали резиновыми пробками и через 3 ч инкубации определяли концентрацию CO2 на газовом хроматографе Хроматэк Кристалл 5000.2 с детектором по теплопроводности. В качестве газа-носителя использовали аргон. Общая длина колонки составляла 2 м, внутренний диаметр 1 мм, наполнитель – Hayesep-D 80/100.
Для определения интенсивности образования метана во флаконы с почвой добавляли 2.5 мг глюкозы на 1 г почвы, после чего их закрывали резиновыми пробками и алюминиевыми зажимами, а газовую фазу флакона замещали на аргон [26]. Измерение концентрации выделившегося метана производили через сутки инкубации при температуре 28°C на газовом хроматографе Хроматэк Кристалл 5000.2 с пламенно-ионизационным детектором. Прочие параметры хроматографа идентичны используемым при определении CO2.
Интенсивность денитрификации оценивали по накоплению N2O в газовой фазе флакона в присутствии ацетилена, блокирующего работу редуктазы закиси азота [14]. В почву также вносили 2.5 мг глюкозы на 1 г почвы и дополнительно 0.3 мг/г KNO3. Воздух из флакона вытесняли аргоном, после чего шприцом вносили 1 мл ацетилена. Флаконы тщательно встряхивали и инкубировали сутки при температуре 28°C. Определение N2O производили на газовом хроматографе Хроматэк Кристалл 5000.2 с детектором электронного захвата. Газ-носитель – азот.
Для определения скорости азотфиксации образцы почв инкубировали сутки с добавлением 20 мг/г глюкозы, после чего флаконы закрывали резиновыми крышками и вводили 0.5 мл ацетилена. Образцы инкубировали 2 ч при 28°C. Нитрогеназа катализирует реакцию превращения ацетилена в этилен, поэтому по количеству образовавшегося этилена может быть оценена ее активность. Для пересчета на азот полученный результат делили на 3, поскольку соотношение между количеством образовавшегося этилена и соответствующим количеством азота составляет 3 : 1 [25]. Измерение концентрации C2H4 производили на газовом хроматографе Хроматэк Кристалл 2000 с пламенно-ионизационным детектором. Длина колонки составляла 1 м, диаметр – 3 мм, наполнитель – Porapak N 80/100. Температура колонки – 60°С, детектора – 160°С, испарителя – 100°С, расход газа-носителя (N2) – 50 мл/мин, воздуха – 280 мл/мин, водорода – 28 мл/мин.
ДНК-метабаркодинг. Почвенную ДНК экстрагировали с помощью набора MagNA Pure Compact Nucleic Acid Isolation Kit I (Roche), согласно инструкции производителя. Лизис клеток проводили с помощью MagNA Pure Bacteria Lysis Buffer (Roche), согласно инструкции для особенных образцов. Выделенные экстракты ДНК до анализа хранили при температуре –20°C.
Для анализа проводили амплификацию регионов V3–V4 гена 16S рРНК с использованием универсальных прямого и обратного праймеров 341F и 805R [21]. Результирующий пул библиотек проверяли на капиллярном электрофорезе и секвенировали на приборе Illumina MiSeq. Обработку данных, полученных в результате секвенирования ампликонов генов 16S рРНК, проводили при помощи программной среды QIIME [18]. Склеивание прямых и обратных нуклеотидных последовательностей осуществляли методом fastq-join. Операционные таксономические единицы идентифицировали с использованием алгоритма UCLUST на основе 97%-ного порога сходства сиквенсов по библиотеке реферативных сиквенсов базы данных Greengenes.
Построение таблиц и графиков осуществляли в программе Excel 2016 и при помощи пакета для анализа данных Plotly (Python 3.6). Финальные данные обрабатывали с применением метода главных компонент в программе Statistica 10 с учетом переменных: БД, СИД, интенсивность метаногенеза, азотфиксации и денитрификации.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследований показали тенденцию к увеличению базального дыхания, азотфиксации и метаногенеза при росте концентрации внесенного в почву ЛГ (рис. 1). Так, количество выделившегося за время эксперимента углекислого газа возросло при добавлении наиболее высоких доз препарата более чем на 30% (табл. 1). СИД, тесно связанное с показателем общей микробной биомассы, изменялось при добавлении гуминового препарата незначительно. Отсутствие влияния препарата на аэробные микроорганизмы в условиях избытка легкодоступного органического вещества заставляет предположить, что в данных почвах эффект ЛГ на микробное дыхание связан с его действием как питательного субстрата.
Рис. 1.
Зависимость базального дыхания (А), потенциальной активности азотфиксации (Б) и метанообразования (В) от концентрации лигногумата.
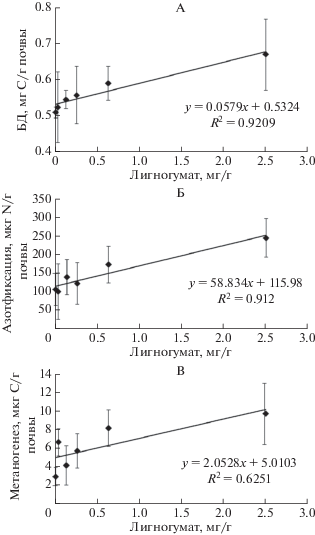
Таблица 1.
Продуктивность микробных процессов за все время эксперимента (28 сут) при внесении разных доз лигногумата (над чертой – абсолютные значения, под чертой – процент от контроля; ± стандартное отклонение)
| Процесс | Концентрация ЛГ, мг/г | |||||
|---|---|---|---|---|---|---|
| 0 (контроль) | 0.025 | 0.125 | 0.250 | 0.625 | 2.5 | |
| Базальное дыхание, мг C/г почвы | $\frac{{0.51 \pm 0.02}}{{100 \pm 2.9}}$ | $\frac{{0.52 \pm 0.10}}{{102.8 \pm 19.1}}$ | $\frac{{0.55 \pm 0.03}}{{107.1 \pm 5.0}}$ | $\frac{{0.56 \pm 0.08}}{{109.5 \pm 15.6}}$ | $\frac{{0.59 \pm 0.05}}{{116.0 \pm 9.2}}$ | $\frac{{0.67 \pm 0.10}}{{131.5 \pm 19.3}}$ |
| Субстрат-индуцированное дыхание, мг C/г почвы | $\frac{{1.50 \pm 0.11}}{{100 \pm 7.4}}$ | $\frac{{1.56 \pm 0.20}}{{104.4 \pm 13.1}}$ | $\frac{{1.31 \pm 0.14}}{{87.5 \pm 9.2}}$ | $\frac{{1.57 \pm 0.22}}{{105.0 \pm 14.5}}$ | $\frac{{1.47 \pm 0.10}}{{98.2 \pm 6.7}}$ | $\frac{{1.52 \pm 0.18}}{{101.2 \pm 11.7}}$ |
| Метаногенез, мкг С/г почвы | $\frac{{2.95 \pm 0.97}}{{100 \pm 32.8}}$ | $\frac{{6.64 \pm 1.45}}{{225.2 \pm 49.3}}$ | $\frac{{4.13 \pm 2.12}}{{140.1 \pm 71.8}}$ | $\frac{{5.72 \pm 1.84}}{{194.0 \pm 62.6}}$ | $\frac{{8.16 \pm 1.96}}{{276.6 \pm 66.3}}$ | $\frac{{9.70 \pm 3.30}}{{328.8 \pm 111.9}}$ |
| Азотфиксация, мкг N/г почвы | $\frac{{106.9 \pm 43.4}}{{100 \pm 40.6}}$ | $\frac{{99.6 \pm 74.5}}{{89.3 \pm 41.6}}$ | $\frac{{138.7 \pm 47.6}}{{148.1 \pm 44.5}}$ | $\frac{{122.4 \pm 56.5}}{{127.4 \pm 52.8}}$ | $\frac{{173.4 \pm 49.4}}{{200.4 \pm 46.2}}$ | $\frac{{244.7 \pm 51.8}}{{308.3 \pm 48.5}}$ |
| Денитрификация, мкг N/г почвы | $\frac{{915.6 \pm 102.4}}{{100 \pm 11.2}}$ | $\frac{{1222.4 \pm 90.0}}{{133.5 \pm 9.8}}$ | $\frac{{773.5 \pm 46.2}}{{84.5 \pm 5.0}}$ | $\frac{{854.4 \pm 190.4}}{{93.3 \pm 20.7}}$ | $\frac{{754.4 \pm 77.0}}{{82.4 \pm 8.4}}$ | $\frac{{814.2 \pm 104.9}}{{88.9 \pm 11.5}}$ |
Количество образуемого в почве метана при добавлении наиболее высоких доз препарата (2.5 мг/г) выросло более чем в 3 раза, однако потери углерода в составе метана в анаэробных условиях оставались на два порядка ниже, чем в составе углекислого газа. Поскольку метаногенез осуществляется исключительно археями, полученные данные указывают на низкую активность анаэробных архей в исследованной почве.
Важно отметить, что при внесении максимальной концентрации ЛГ в 3 раза увеличилось и общее количество азота, который потенциально может быть усвоен азотфиксаторами. Неожиданные результаты были получены при оценке активности денитрификации. Доза препарата 0.025 мг/г стимулировала функционирование денитрификаторов одновременно с небольшим, статистически не достоверным подавлением активности азотфиксаторов. При более высоких концентрациях азотфиксация возрастала по сравнению с контролем, а денитрифкация, напротив, уменьшалась. Наряду с общей низкой активностью анаэробных метаногенных архей это позволяет сделать вывод о подавлении анаэробных процессов трансформации азота и углерода препаратом ЛГ.
Таким образом, использование ЛГ в концентрации более 0.025 мг/г оказывает положительное влияние на азотный баланс почв. Недостаточное внесение препарата, напротив, несет опасность увеличения газообразных потерь азота. Расчеты показывают, что количество азота, внесенного в почву с препаратом даже при применении максимальной его концентрации, составляет всего 20 мкг. Поэтому влияние ЛГ на микроорганизмы азотного цикла следует считать связанным с проявлением его специфической физиологической активности. Следует отметить, что соотношение C : N в ЛГ превышает 70 : 1. Поэтому использование его микроорганизмами и включение в состав микробной биомассы требует использования дополнительных источников азота.
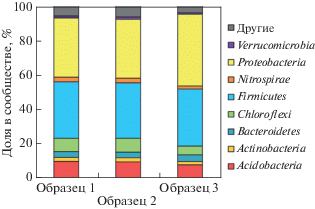
Бактериальное сообщество рассматриваемой латосоли по данным ДНК-метабаркодинга (рис. 2) состояло преимущественно из представителей четырех филумов: Proteobacteria, Firmicutes, Chloroflexi и Acidobacteria, на долю которых приходилось более 85% от сообщества. Главной особенностью бактериального сообщества почвы была очень высокая доля филума Firmicutes (33%) и значительный вклад Chloroflexi (8%), что сильно контрастирует со структурой микробиома почв России [7, 12, 37]. Несмотря на близкую к нейтральной реакцию среды (pH 6.7), латосоль характеризовалась значительной представленностью ацидобактерий (почти 10%). Таким образом, можно сделать вывод об отсутствии приверженности данного филума к кислым условиям среды. Значительное присутствие филума Acidobacteria также свидетельствует о высокой биологической активности [8, 15, 35].
Таблица 2.
Продуктивность микробных процессов за все время эксперимента (28 сут) при внесении лигногумата, пестицидов и их сочетания (над чертой – абсолютные значения, под чертой – процент от контроля; ± стандартное отклонение)
| Процесс | Вариант опыта | |||
|---|---|---|---|---|
| контроль | ЛГ | пестициды | ЛГ и пестициды | |
| Базальное дыхание, мг C/г почвы | $\frac{{0.23 \pm 0.04}}{{100 \pm 15.3}}$ | $\frac{{0.17 \pm 0.02}}{{75.6 \pm 7.9}}$ | $\frac{{0.17 \pm 0.01}}{{75.5 \pm 2.6}}$ | $\frac{{0.29 \pm 0.06}}{{127.2 \pm 27.2}}$ |
| Субстрат-индуцированное дыхание, мг C/г почвы | $\frac{{1.46 \pm 0.13}}{{100 \pm 9.1}}$ | $\frac{{2.15 \pm 0.05}}{{146.8 \pm 3.3}}$ | $\frac{{2.35 \pm 0.16}}{{160.1 \pm 10.9}}$ | $\frac{{1.06 \pm 0.07}}{{72.9 \pm 5.1}}$ |
| Метаногенез, мкг С/г почвы | $\frac{{0.061 \pm 0.005}}{{100 \pm 8.9}}$ | $\frac{{0.068 \pm 0.011}}{{111.5 \pm 17.7}}$ | $\frac{{0.065 \pm 0.019}}{{107.4 \pm 31.7}}$ | $\frac{{0.333 \pm 0.153}}{{550.0 \pm 253.3}}$ |
| Азотфиксация, мкг N/г почвы | $\frac{{5.59 \pm 1.13}}{{100 \pm 20.2}}$ | $\frac{{4.92 \pm 1.08}}{{88.2 \pm 19.4}}$ | $\frac{{5.04 \pm 0.32}}{{90.2 \pm 5.8}}$ | $\frac{{7.31 \pm 2.10}}{{130.8 \pm 37.6}}$ |
| Денитрификация, мкг N/г почвы | $\frac{{731.1 \pm 121.0}}{{100 \pm 16.6}}$ | $\frac{{866.6 \pm 129.7}}{{118.5 \pm 17.7}}$ | $\frac{{745.2 \pm 87.56}}{{101.9 \pm 12.0}}$ | $\frac{{739.5 \pm 24.0}}{{101.2 \pm 3.3}}$ |
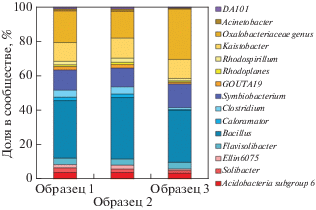
На уровне классов наиболее представленными таксонами являлись Bacilli (22%) и Clostridia (10%) среди фирмикут, а также α-, β- и δ-Proteobacteria. Наиболее представленной группой в составе Chloroflexi был класс Anaerolineae. На уровне рода (рис. 3) было выявлено 4 доминанта: Bacillus (19%), Oxalobacteriaceae gen. (12%), Symbiobacterium (7%) и Kaistobacter (6%). Представители Oxalobacteriaceae отличаются способностью к фиксации азота, поэтому большая их доля в составе сообщества латосоли указывает на высокий потенциал азотфиксации этих почв. С их активацией связано усиление нитрогеназной активности при внесении возрастающих доз ЛГ.
Рис. 3.
Доминирующие роды в составе бактериального сообщества латосоли о. Бали (данные для родов с представленностью больше 0.5%).
Указанные закономерности подтверждаются и анализом данных с применением метода главных компонент. Выявлено две главные компоненты с собственными значениями выше единицы. Главная компонента 1 объясняет 59% общей дисперсии и показывает факторные нагрузки более 0.7 для показателей БД, метаногенеза и азотфиксации, а главная компонента 2 – 32% общей дисперсии и дает сильную нагрузку по показателю СИД и денитрификации (рис. 4А).
Рис. 4.
Проекция переменных (А) и проекция наблюдений (Б) на первую и вторую главные компоненты. (А): 1 – базальное дыхание; 2 – субстрат-индуцированное дыхание; 3 – метаногенез; 4 – азотфиксация; 5 – денитрификация; (Б): К – контроль, ЛГ-1 – доза 0.025; ЛГ-2 – 0.125; ЛГ3 – 0.25; ЛГ-4 – 0.625 и ЛГ-5 – 2.5 мг/г.
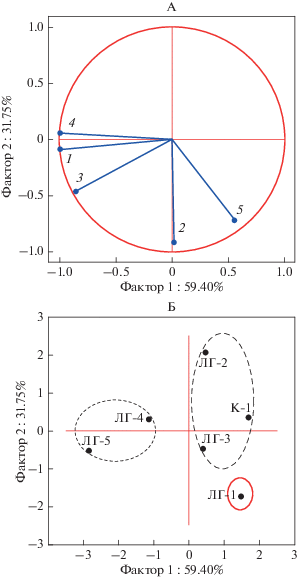
Проекция наблюдений в пространстве главных компонент показывает, что главная компонента 1 разделяет пробы по внесенной дозе препарата (рис. 4Б) и отражает способность ЛГ выступать в качестве питательного субстрата для микроорганизмов, что также требует фиксации дополнительного количества азота из атмосферы. По главной компоненте 2 сходными оказались контроль и варианты с дозировкой препарата 0.250–2.5 мг/г в отличие от относительно низких доз (0.025 и 0.125). Таким образом, главная компонента 2 отражает действие ЛГ в качестве физиологически активного вещества.
По совокупности данных пробы разделились на три кластера: контроль и средние дозы (0.125–0.250 мг/г почвы), высокие дозы (0.625 и 2.5 мг/г), наименьшая доза (0.025 мг/г) (рис. 4Б). Эти факты позволяют утверждать, что ЛГ оказывает наиболее существенное воздействие на показатели биологической активности в дозах свыше 0.25 мг/кг, а эффект более низких доз отличается не только количественно, но и по своему характеру.
Исследование действия ЛГ в эксперименте с применением пестицидов показало (табл. 3 ), что их совместное внесение благоприятно отражается на показателе базального дыхания. Следует отметить, что ЛГ в данном случае стимулирует интенсивность СИД. Следовательно, в эксперименте были созданы условия для реализации действия гуминового препарата как физиологически активного вещества, а не питательного органического субстрата.
Совместное внесение ЛГ и пестицидов привело к увеличению активности азотфиксации по сравнению с вариантом, где был внесен только пестицид, а величина денитрификации оставалась неизменной. Таким образом, препарат может быть рекомендован для снижения неблагоприятного воздействия пестицидов на почвенное микробное сообщество. Следует подчеркнуть, что увеличение дыхания, образования метана и азотфиксации в варианте с совместным внесением препаратов по сравнению с их отдельным внесением указывает на формирование благоприятных условий для микробного разложения пестицида под влиянием ЛГ.
ЗАКЛЮЧЕНИЕ
В целом для аэробных микроорганизмов гуминовый препарат ЛГ выступает скорее как источник органического вещества, повышая базальное дыхание почвы. В присутствии легкодоступных сахаров (глюкозы) он в большинстве случаев не оказывает никакого значимого эффекта. Аналогично ЛГ способствует активизации микроорганизмов в загрязненной пестицидами почве, и тем самым способствует их разложению.
ЛГ действует на микроорганизмы цикла азота: препарат благоприятно влияет на несимбиотических азотфиксаторов, усиливая их активность на большей части исследуемого диапазона концентраций. Стимулирование азотфиксации происходило и при внесении пестицидов в почву.
На денитрифицирующие микроорганизмы ЛГ оказывает неоднозначное воздействие, выступая в качестве физиологически активного вещества. При низких концентрациях и в неблагоприятных условиях (стресс, связанный с высушиванием образца) препарат способен усиливать газообразные потери азота посредством денитрификации. В прочих случаях препарат выступает ингибитором денитрификации.
В связи с этим ЛГ может рассматриваться как средство для улучшения азотного баланса почв, а также как препарат для активизации микробной составляющей агробиоценозов после стрессовых воздействий. Однако для определения эффективных доз препарата необходим учет конкретных почвенных условий, предварительное тестирование в лаборатории и дальнейшие исследования механизмов его воздействия на микроорганизмы. Следует также учитывать, что применение препарата может усиливать эмиссию из почв углекислого газа и метана, являющихся парниковыми газами, поэтому до внесения препарата необходимо проведение диагностики структуры и активности микробного сообщества почв.
Список литературы
Баканова Н.Г., Калабин Г.А., Подгорский В.В. Взаимосвязь молекулярного строения и рост стимулирующей активности гуминовых веществ из лигнина // Экология и безопасность жизнедеятельности. 2012. Т. 2. С. 13–18.
Козлова Е.Н., Степанов А.Л., Лысак Л.В. Применение бактериально-гумусовых препаратов в целях ремедиации почв, загрязненных дизельным топливом // Почвоведение. 2014. № 5. С. 580–583.
Козлова Е.Н., Степанов А.Л., Лысак Л.В. Влияние бактериально-гумусовых препаратов на биологическую активность почв, загрязненных нефтепродуктами и тяжелыми металлами // Почвоведение. 2015. № 4. С. 452–461.
Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1992. 255 с.
Пукальчик М.А., Панова М.И., Терехова В.А., Якименко О.С., Федосеева Е.В. Действие гуминовых препаратов на активность почвенных ферментов в модельном опыте // Агрохимия. 2017. № 8. С. 94–101.
Пукальчик М.А., Терехова В.А., Якименко О.С., Акулова М.И. Сравнение ремедиационных эффектов биочара и лигногумата на почвы при полиметаллическом загрязнении // Теоретическая и прикладная экология. 2016. № 2. С. 79–85.
Семенов М.В., Манучарова Н.А., Краснов Г.С., Никитин Д.А., Степанов А.Л. Биомасса и таксономическая структура микробных сообществ в почвах правобережья р. Оки // Почвоведение. 2019. № 8. С. 974–985.
Семенов М.В., Никитин Д.А., Степанов А.Л., Семенов В.М. Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019. № 3. С. 355–369.
Степанов А.А., Якименко О.С., Госсе Д.Д., Смирнова М.Е. Эффективность гуминового удобрения “Эдагум®СМ” как стимулятора роста и мелиоранта в полевых и вегетационных опытах с пшеницей // Агрохимия. 2018. № 6. С. 36–43. https://doi.org/10.7868/S0002188118060042
Суада К., Рай Н., Будиаса В., Сантоса Н.Г., Сунарта Н., Геде Менака А., Щеголькова Н.М., Полоскин Р.Б., Гладков О.А., Якименко О.С. Влияние гуминового препарата лигногумат на урожайность и качество зерна риса в условиях затопляемого культивирования на о. Бали, Индонезия // Вода: химия и экология. 2017. № 5. С. 3–11.
Цыганова Е.Н., Звягинцев Д.Г., Лысак Л.В., Степанов А.Л. Действие бактериально-гумусового препарата на биологическую активность почв // Почвоведение. 2013. № 7. С. 867–871.
Чернов Т.И., Тхакахова А.К., Иванова Е.А., Кутовая О.В., Турусов В.И. Сезонная динамика почвенного микробиома многолетнего агрохимического опыта на черноземах Каменной Степи // Почвоведение. 2015. № 12. С. 1483–1483.
Якименко О.С., Терехова В.А., Пукальчик М.А., Горленко М.В., Попов А.И. Сравнение двух интегральных биотических индексов при оценке эффектов гуминовых препаратов в модельном эксперименте // Почвоведение. 2019. № 7. С. 781–792.
Ananyeva N.D., Ivashchenko K.V., Stolnikova E.V., Stepanov A.L., Kudeyarov V.N. Specific features of determination of the net production of nitrous oxide by soils // Eurasian Soil Science. 2015. V. 48. № 6. P. 608–619.
Belov A.A., Cheptsov V.S., Vorobyova E.A. Soil bacterial communities of Sahara and Gibson deserts: Physiological and taxonomical characteristics // Aims Microbiol. 2018. V. 4. № 4. P. 685–710.
Bezuglova O.S., Gorovtsov A.V., Polienko E.A. et al. Effect of humic preparation on winter wheat productivity and rhizosphere microbial community under herbicide-induced stress // J. Soils Sediments. 2019. V. 19. P. 2665–2675. https://doi.org/10.1007/s11368-018-02240-z
Canellas L.P., Olivares F.L., Aguiar N.O., Jones D.L., Nebbioso A., Mazzei P., Piccolo A. Humic and fulvic acids as biostimulants in horticulture // Scientia Horticulturae. 2015. V. 196. P. 15–27.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peña A.G., Goodrich J.K., Gordon J.I., Huttley G.A. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. P. 335–336.
Ertani A., Francioso O., Tugnoli V., Righi V., Nardi S. Effect of commercial lignosulfonate-humate on Zea mays L. metabolism // J. Agric. Food Chem. 2011. V. 59. P. 11940–11948.
Genevini P.L., Saxxhi G.A., Borio D. Herbicide effect of atrazine, diuron, linuron and prometon after interaction with humic acids from coal // Humic substances in the global environment and implications on human health / Eds.: Senesi N., Miano T.M. Bari: HSS, 1994. P. 1291–1296.
Klindworth A., Pruesse E., Schweer T., Peplies J., Quast C., Horn M., Glöckner F.O. Evaluation of general 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies // Nucleic Acids Res. 2013. V. 41(1). P. e1–e1.
Kulikova N.A., Stepanova E.V., Koroleva O.V. Mitigating activity of humic substances: Direct influence on biota // Use of Humic Substances to Remediate Polluted Environments: From Theory to Practice. NATO Science Series (Series IV: Earth and Environmental Series) / Eds.: Perminova I.V., Hatfield K., Hertkorn N.V. Springer, 2005. P. 285–310.
Kulikova N.A., Perminova I.V. Binding of atrazine to humic substances from soil, peat, and coal related to their structure // Environ. Sci. Technol. 2002. V. 36. P. 720–724.
Loffredo E., Senesi N., Ferrara G. Anticlastogenic and antitoxic actions exerted by humic substances in seedlings of various plants // Soil mineral-microbe-organic interactions. theories and applications / Eds.: Q. Huang, P.M. Huang, A. Violante. Springer-Verlag, 2008. P. 281–301.
Manucharova N.A., Stepanov A.L., Umarov M.M. Microbial transformation of nitrogen in water-stable aggregates of various soil types // Eurasian Soil Science. 2001. V. 34. № 10. P. 1125–1131.
Manucharova N.A., Yaroslavtsev A.A., Senchenko D.V., Stepanov A.L., Zvyagintsev D.G. Microbial transformation of chitin in soil under anaerobic conditions // Biol. Bull. 2006. V. 33. № 2. P. 191–194.
Morard P., Eyheraguibel B., Morard M., Silvestre J. Direct effects of humic-like substance on growth, water, and mineral nutrition of various species // J. Plant. Nutr. 2011. V. 34. P. 46–59.
Nardi S., Pizzeghelloa D., Muscolo A., Vianello A. Physiological effects of humic substances on higher plants // Soil Biol. Biochem. 2002. V. 34. P. 1527–1536.
Oecd Guideline the Testing of Chemicals, 2000. www.oecd. org/chemicalsafety/risk-assessment/1948325.pdf
Olk D.C., Dinnes D.L., Scoresby R.J. et al. Humic products in agriculture: potential benefits and research challenges – a review // J. Soils Sediments. 2018. V. 18. № 8. P. 2881–2891. https://doi.org/10.1007/s11368-018-1916-4
Perminova I.V., Kulikova N.A., Zhilin D.M., Grechischeva N.Y., Kovalevskii D.V., Lebedeva G.F., Matorin D.N., Venediktov P.S., Konstantinov A.I., Kholodov V.A., Petrosyan V.S. Mediating effects of humic substances in the contaminated environments. Concepts, results, and prospects // Viable Methods of Soil and Water Pollution Monitoring, Protection and Remediation. Series IV: Earth and Environmental Sciences. Springer Netherlands, 2006. P. 249–274.
Pinchuk I.P., Polyanskaya L.M., Kirillova N.P., Stepanov A.L. Specific features of the microbial community development in soddy-podzolic soil in the course of barley (Hordeum vulgare L.) growing // Eurasian Soil Science. 2018. V. 51. № 12. P. 1480–1486.
Poloskin R.B., Gladkov O.A., Osipova O.A., Yakimenko O.S. Comparable evaluation of biological activity of new liquid and dry modifications of the humic product “Lignohumate” // Functions of Natural Organic Matter in Changing Environment / Eds.: Xu J., Wu J., He Y. Springer, Dordrecht. 2013. P. 1095–1099. https://doi.org/10.1007/978-94-007-5634-2_203
Puglisi E., Fragoulis G., Ricciuti P., Cappa F., Spaccini R., Piccolo A., Trevisan M., Crecchio C. Effects of a humic acid and its size-fractions on the bacterial community of soil rhizosphere under maize (Zea mays L.) // Chemosphere. 2009. V. 77. P. 829–837.
Pukalchik M., Kydralieva K., Yakimenko O., Fedoseeva E., Terekhova V. Outlining the Potential Role of Humic Products in Modifying Biological Properties of the Soil – A Review // Frontiers Environ. Sci. 2019. V. 7. Art. 80. https://doi.org/10.3389/fenvs.2019.00080t
Rose M.T., Patti A.F., Little K.R., Brown A.L., Jackson W.R., Cavagnaro T.R. Meta-analysis and review of plant-growth response to humic substances: Practical implications for agriculture // Adv. Agronomy. 2014. V. 124. P. 37–89.
Semenov M.V., Chernov T.I., Tkhakakhova A.K., Zhele-zova A.D., Ivanova E.A., Kolganova T.V., Kutovaya O.V. Distribution of prokaryotic communities throughout the Chernozem profiles under different land uses for over a century // Appl. Soil Ecol. 2018. V. 127. P. 8–18.
Senesi N., Loffredo E., Padovano G. Effects of humic acid-herbicide interactions on the growth of Pisum sativum in nutrient solution // Plant and Soil. 1990. V. 127. № 1. P. 41–47.
Yakimenko O.S., Terekhova V.A. Humic preparations and the assessment of their biological activity for certification purposes // Eurasian Soil Sci. 2011. V. 44. P. 1222–1230. https://doi.org/10.1134/S1064229319070159
Дополнительные материалы отсутствуют.