Почвоведение, 2020, № 5, стр. 610-617
Влияние нонилфенолов на биологическую активность дерново-подзолистой почвы
Т. Б. Зайцева a, *, С. В. Зиновьева a, И. Л. Кузикова a, А. Д. Руссу a, М. В. Чугунова a, Н. Г. Медведева a
a Санкт-Петербургский научно-исследовательский центр экологической безопасности РАН
197110 Санкт-Петербург, ул. Корпусная, 18, Россия
* E-mail: zaytseva.62@list.ru
Поступила в редакцию 09.07.2019
После доработки 29.09.2019
Принята к публикации 27.12.2019
Аннотация
В условиях модельных экспериментов изучено влияние гормоноподобного ксенобиотика нонилфенола на биологическую активность дерново-подзолистой суглинистой почвы (Eutric Albic Retisol (Abruptic, Loamic, Aric, Ochric)). Объектом исследования являлись верхние горизонты дерново-подзолистой суглинистой почвы, отобранные в Ленинградской области. Численность почвенной микробиоты, активность почвенных ферментов и почвенное дыхание определяли общепринятыми в почвенной микробиологии и биохимии методами. Содержание нонилфенола в почвенных образцах исследовали методом высокоэффективной жидкостной хроматографии. Установлено, что загрязнение почвы нонилфенолом вызывает время- и дозозависимые изменения в активности пула ферментов азотного, углеводного циклов и окислительно-восстановительных ферментов, приводит к усилению базального дыхания. Полученные результаты являются важным этапом, необходимым для прогнозирования состояния почв, загрязненных алкилфенолами, и могут быть использованы при разработке методологии ремедиации почв, контаминированных гормоноподобными соединениями.
ВВЕДЕНИЕ
Нонилфенолы (НФ) являются основными продуктами неполной деградации нонилфенолэтоксилатов – неионогенных поверхностно-активных веществ, широко используемых в промышленности и быту. В окружающую среду НФ попадают в основном с бытовыми и промышленными сточными водами и обнаруживаются во всех экосистемах: воде, воздухе, почве [9, 15]. Содержание НФ в почвах варьирует в широких пределах – от нанограммов до сотен миллиграммов в 1 кг почвы в зависимости от количества внесенных органических удобрений и осадков сточных вод [15, 16].
При попадании в почву НФ накапливаются в почвенных организмах и растениях, оказывают на них токсическое действие [15, 24, 25]. Продвигаясь по пищевой цепи, НФ попадают в организм человека, что представляет серьезную угрозу для здоровья, поскольку, являясь гормоноподобными соединениями, вызывают нарушения эндокринных функций организма, а также могут приводить к развитию онкологических заболеваний [20, 30, 31]. В силу этих причин в ряде стран (США, страны ЕС) введены ограничения на производство и использование НФ, их содержание в окружающей среде строго регламентируется [14, 18, 23]. Однако в Российской Федерации и ряде других стран, в частности в Китае, Индии и странах Южной Америки, ограничений на его производство и использование в настоящее время нет.
При загрязнении почв НФ происходят дозо- и времязависимые изменения численности основных физиологических групп почвенных микроорганизмов. В присутствии НФ наблюдается значительное увеличение количества гетеротрофных и олиготрофных микроорганизмов, а также бактерий, толерантных к НФ. Наиболее чувствительными к НФ являются актиномицеты и спорообразующие бактерии [2]. Под воздействием НФ отмечено уменьшение видового разнообразия бактериоценозов в почвах различных типов. В таксономической структуре микробного сообщества загрязненных НФ почв доминирующим филумом становится Proteobacteria, доля которого значительно возрастает по сравнению с контрольными незагрязненными почвами. Изменения филогенетической структуры почвенных микробоценозов сопровождаются снижением интенсивности минерализации азотсодержащих органических веществ, замедлением процессов иммобилизации азота, увеличением фитотоксичности почвы [2, 21].
При попадании в почву НФ могут имитировать функции природных микробных ауторегуляторов, вмешиваясь в процесс коммуникации микробных клеток в популяции, что может негативно сказываться на сукцессии и стабильности функционирования микробных сообществ [1].
Наряду с воздействием на микробные системы почв НФ могут оказывать определенное влияние и на происходящие в них биохимические процессы. Важнейшую роль в сохранении биохимического равновесия в почве при ее различных загрязнениях играют ферменты системы микроорганизмы–почва. Ферментный пул почв участвует на всех этапах трансформации поступающих в почву органических и неорганических веществ, является важнейшим регулятором биохимического гомеостаза почв. Благодаря ферментному пулу метаболизм почвы может сохраняться стабильным, даже если условия окружающей среды неблагоприятны для жизнедеятельности микроорганизмов.
Известно, что на ферментативную активность почв существенное влияние оказывают различные поллютанты как неорганической, так и органической природы: тяжелые металлы, нефтепродукты, пестициды и др. Воздействие поллютантов на активность почвенных ферментов разнонаправлено, характер и степень влияния зависят от типа фермента, природы поллютанта и его содержания в почве, типа почвы и продолжительности инкубирования контаминированных почв [3, 10, 12, 17, 32].
Однако вопрос о влиянии на активность почвенных ферментов алкилфенолов, в частности НФ, в настоящее время остается открытым.
Цель настоящего исследования – изучение влияния гормоноподобного ксенобиотика нонилфенола на биологическую активность дерново-подзолистой суглинистой почвы Ленинградской области.
ОБЪЕКТЫ И МЕТОДЫ
В работе использовали верхние горизонты (0–20 см) дерново-подзолистой суглинистой почвы (Eutric Albic Retisol (Abruptic, Loamic, Aric, Ochric)), отобранной с опытного поля Санкт-Петербургского государственного аграрного университета (г. Пушкин). Воздушно-сухую почву просеивали через сито с диаметром отверстий 2 мм и увлажняли до 60% от полной влагоемкости.
Для обработки почвенных образцов в модельном эксперименте технический нонилфенол (CAS: 84852-15-3, Sigma-Aldrich (США)) предварительно растворяли в ацетоне и добавляли к 10 г стерильного кварцевого песка. После выпаривания ацетона (в течение 1 ч) обработанный НФ кварцевый песок смешивали с увлажненной почвой (60% от полной влагоемкости), создавая концентрации НФ 30 и 300 мг/кг абсолютно сухой почвы (а. с. п.). В качестве контроля использовали дерново-подзолистую суглинистую почву с добавлением кварцевого песка (с предварительно выпаренным ацетоном, не содержащим НФ). Почвенные образцы инкубировали при комнатной температуре в течение 90 сут и влажности почвы 60% от полной влагоемкости.
Численность целлюлозоразрушающих бактерий и микромицетов определяли общепринятыми в почвенной микробиологии методами на стандартных питательных средах: Гетчинсона и Чапека соответственно [5]. Для десорбции микроорганизмов с почвенных частиц водно-почвенные суспензии обрабатывали ультразвуком (частота 40 КГц) в ультразвуковой ванне DA-963 (КНР) в течение 10 мин, а затем встряхивали на шейкере Certomat BS-1 (180 об./мин) в течение 10 мин.
Уреазную активность почвенных образцов определяли колориметрически по методу, основанному на измерении количества аммиака, образующегося при гидролизе мочевины за 24 ч. Интенсивность окраски образующихся продуктов реакции аммиака с реактивом Несслера определяли на спектрофотометре Genesys 10uv scanning (Thermo Spectronic, США) при длине волны 400 нм. В качестве контрольных вариантов использовали реактивы без почвы и с почвами без субстрата (мочевины). Уреазную активность выражали в миллиграммах N–NH4/г а. с. п. [8].
Уровень протеолитической активности оценивали методом, основанном на способности протеолитических ферментов почвы расщеплять белковый субстрат до аминокислот с последующим определением их количества с помощью нингидрина. В качестве субстрата использовали желатин. По количеству образующихся за 24 ч из желатина аминокислот судили о протеолитической активности почвы, которую выражали в мг глицина/г а. с. п. [8].
Уровень амилазной активности оценивали по количеству редуцирующих сахаров, образующихся при гидролизе крахмала в почве за 24 ч [8]. Содержание редуцирующих сахаров определяли антроновым методом [15] с использованием спектрофотометра Genesys 10uv scanning (Thermo Spectronic, США). Амилазную активность выражали в миллиграммах мальтозы/г а. с. п.
Целлюлазную активность определяли колориметрически по количеству глюкозы, образующейся при гидролизе целлюлозы в почве за 24 ч, и выражали в мг глюкозы/г а. с. п. [8].
Уровни дегидрогеназной активности определяли по интенсивности окрашивания трифенилформазана (ТФФ) при 540 нм на спектрофотометре Genesys 10uv scanning (Thermo Spectronic, США) и выражали в мг ТФФ/10 г а. с. п. [8].
Каталазную активность определяли с использованием пермангатометрического титрования и выражали в мл 0.1 н. KMnO4/г а. с. п. [8].
Почвенное дыхание определяли с использованием модифицированного адсорбционного метода по интенсивности выделения почвой углекислого газа и выражали в мг СО2/100 г а. с. п. [11].
Экстракцию НФ из лиофильно высушенных почвенных образцов проводили гексаном по методике, описанной ранее [2].
Анализ содержания НФ проводили методом высокоэффективной жидкостной хроматографии на приборе HP1090 (“Hewlett-Packard”, США) с диодно-матричным детектором при длине волны 278 нм с разрешением 1.2 нм. Условия хроматографирования: колонка Discovery HS C18 (7.5 см × × 2.1 мм, 3 мкм) производства Supelco (США), температура колонки – 35°С, скорость потока элюента – 0.4 мл/мин, объем пробы – 200 мкл. В качестве элюента использовали 70%-ный водный раствор ацетонитрила, содержащий 0.1% трифторуксусной кислоты. Степень извлечения НФ из почвенных образцов составляла 98 ± 1%.
Полученные данные представлены как среднее значение ± стандартное отклонение трех независимых повторов каждого варианта с тремя параллельными повторностями в каждом. Значимость различий между вариантами выявляли при использовании критерия Стьюдента. Различия считались значимыми при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Внесение НФ в почву вызывает время- и дозозависимые изменения в активности пула ферментов азотного (уреазной и протеазной активностей), углеводного (амилазной и целлюлазной активностей) циклов и окислительно-восстановительных ферментов (дегидрогеназной и каталазной активностей).
Через сутки после начала инкубирования в образцах почвы, загрязненных НФ в концентрации 30 и 300 мг/кг а. с. п., происходила стимуляция уреазной активности на 40% (рис. 1, А).
Рис. 1.
Влияние нонилфенола на активность гидролитических ферментов азотного цикла: А – уреазная активность, Б – протеазная активность. Исходное содержание НФ в почве: 1 – контроль, 2 – 30, 3 – 300 мг/кг а. с. п.
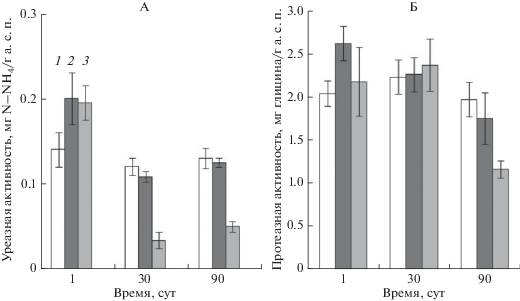
При дальнейшем инкубировании (до 30 сут) активность фермента в почвенных вариантах, содержащих 30 мг НФ/кг почвы, снизилась до уровня незагрязненной почвы и в дальнейшем не отличалась от контрольного варианта. Однако в варианте, загрязненном НФ в высокой концентрации 300 мг НФ/кг почвы, после 30 сут инкубирования происходило значительное – до 72% ингибирование активности фермента. Причем восстановление уреазной активности в этом варианте до контрольного уровня не происходило и после 90 сут эксперимента.
На протеолитическую активность почвы НФ в концентрации 30 мг/кг почвы оказывал аналогичное влияние: через сутки инкубирования НФ стимулировал протеазную активность на 30%, при последующем инкубировании – до 30 и далее до 90 сут активность протеаз в этом варианте не отличалась от таковой в контрольной, не обработанной ксенобиотиком почве. Внесение в почву повышенной дозы НФ (300 мг/кг почвы) в течение 30 сут не приводило к каким-либо изменениям в протеолитической активности. Однако через 90 сут инкубирования отмечалось значительное (в 1.7 раза) уменьшение активности протеаз по сравнению с контрольным вариантом (рис. 1, Б).
Характер и степень воздействия НФ на карбогидразы (амилазы, целлюлазы) – гидролитические ферменты, участвующие в круговороте углерода и расщепляющие углеводы различной природы – зависят от типа фермента и содержания НФ.
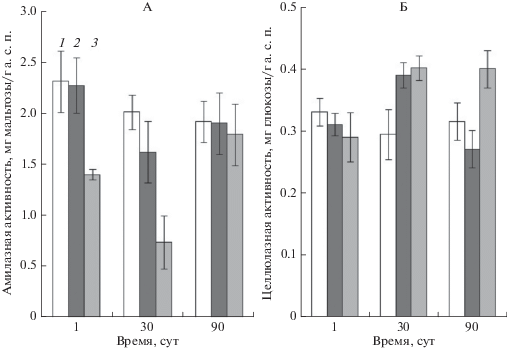
На активность амилаз, осуществляющих гидролиз крахмала, входящего в состав органических остатков, попадающих в почву, НФ в концентрации 30 мг/кг почвы не оказывал влияния на протяжении всего периода инкубирования. При загрязнении почвы НФ в дозе 300 мг/кг уже через сутки активность амилаз была ингибирована на 40%. Причем ингибирующий эффект нарастал с течением времени, достигая максимума 63% через 30 сут инкубирования. Однако через 90 сут наблюдалось восстановление амилазной активности до контрольного уровня (рис. 2А).
Рис. 2.
Влияние нонилфенола на активность почвенных карбогидраз: А – амилазная активность, Б – целлюлазная активность. Исходное содержание НФ в почве: 1 – контроль, 2 – 30, 3 – 300 мг/кг а. с. п.
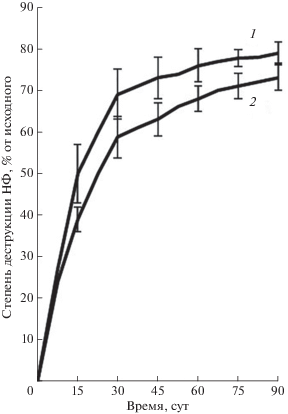
Следует отметить, что наибольшая степень ингибирования уреазной, протеолитической и амилазной активностей в загрязненных НФ образцах почвы выявлена после значительного (более чем на 50%) снижения содержания поллютанта вследствие его биодеструкции, а именно после 15 и 23 сут инкубирования – периодов полуразложения НФ в концентрации 30 и 300 мг/кг почвы соответственно (рис. 3).
Полученные результаты могут свидетельствовать о том, что ингибиторами уреазной, протеазной и амилазной активностей в почве является не только сам НФ, но и, возможно, продукты его деградации в почве, в частности алкилрезорцины. Известно, что алкилрезорцины, а именно гексилрезорцин, являющийся химическим аналогом ауторегуляторных факторов микроорганизмов, обладают свойствами посттрансляционной модификации структуры ферментных белков за счет образования межмолекулярных водородных связей, ионных и гидрофобных взаимодействий, что сопровождается ингибированием их каталитической активности [4, 6].
Изучение влияния НФ на целлюлазную активность показало, что в концентрации 30 и 300 мг/кг а. с. п. через 30 сут инкубирования он вызывал увеличение целлюлазной активности более чем на 30%, которое сохранялось в варианте, содержащем 300 мг/кг, до 90 сут (рис. 2Б).
Известно, что целлюлазная активность коррелирует с численностью грибной и бактериальной популяции в почве [22]. Возможно, повышение целлюлазной активности при содержании НФ в почве 30 и 300 мг/кг через 30 сут эксперимента связано со значительным (на 90 и 110% соответственно) увеличением численности целлюлозоразрушающих бактерий (рис. 4А), в то время как повышение целлюлозолитической активности после 90 сут инкубирования коррелирует с ростом числа микромицетов (в 1.4 раза по сравнению с контрольной почвой) (рис. 4Б).
Рис. 4.
Влияние нонилфенола на численность целлюлозоразрушающих бактерий (А) и микромицетов (Б) в дерново-подзолистой почве после инкубирования в течение: 1 – 1, 2 – 30, 3 – 90 сут.

В обмене веществ и энергии в почве важное место принадлежит окислительно-восстановительным ферментам. Известно, что ферменты окислительно-восстановительной системы вовлечены в процессы микробиологической деструкции алкилфенолов и являются элементом системы защиты клеток от алкилфенольного стресса [1, 28, 29].
Влияние НФ на активность окислительно-восстановительных ферментов дерново-подзолистой почвы – дегидрогеназную и каталазную активности – носит однотипный характер (рис. 5): под воздействием НФ в изученных концентрациях в течение 30 сут инкубирования не наблюдалось статистически достоверных различий. Однако через 90 сут при повышенном содержании ксенобиотика 300 мг/кг почвы выявлена стимуляция дегидрогеназой и каталазной активности на 66 и 14% соответственно.
Рис. 5.
Влияние нонилфенола на активность окислительно-восстановительных ферментов в дерново-подзолистой суглинистой почве: А – дегидрогеназная активность; Б – каталазная активность. Исходное содержание НФ в почве: 1 – контроль, 2 – 30, 3 – 300 мг/кг а. с. п.
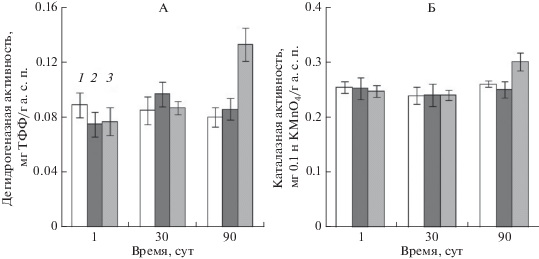
Так как дегидрогеназная и каталазная активности тесно связаны с общей численностью почвенных микроорганизмов и их активностью [13], повышение активности этих окислительно-восстановительных ферментов в варианте с 300 мг НФ/кг а. с. п. через 90 сут инкубирования, возможно, вызвано значительным (до 5 раз) увеличением численности гетеротрофных бактерий, в том числе толерантных к НФ, выявленным нами ранее [2], и ростом количества микромицетов.
В результате изменения активности ферментов и численности микроорганизмов в почве происходит изменение скорости эмиссии СО2 [27]. Так как скорость выделения CO2 с поверхности почвы интегрально характеризует интенсивность продукционных (дыхание автотрофов) и деструкционных (дыхание гетеротрофов) процессов, почвенное дыхание широко используется как для оценки продуктивности экосистем, так и для анализа активности почвенного микробоценоза [7].
Изучение влияния НФ на дыхание дерново-подзолистой почвы показало отсутствие достоверно значимых различий в интенсивности выделения СО2 между контрольным вариантом и загрязненными НФ образцами почвы (30 и 300 мг/кг) через сутки инкубирования. После 30 сут в почвах, загрязненных НФ, выявлено увеличение эмиссии СО2 на 30% по сравнению с контрольной почвой, сохранявшееся до конца эксперимента (90 сут).
Так как количество выделенного из почвы СО2 зависит от количества микроорганизмов и интенсивности обмена веществ, можно предположить, что установленное в нашем исследовании увеличение эмиссии углекислого газа в присутствии НФ связано со значительным (в 1.8–5 раз) ростом численности гетеротрофных микроорганизмов [2].
Увеличение эмиссии углекислого газа из почвы в присутствии НФ может указывать на снижение эффективности усвоения углерода почвенной микробиотой, так как микроорганизмам загрязненных ксенобиотиками почв в отличие от неконтаминированных почв требуется больше энергии для выживания в неблагоприятных условиях, вследствие чего большая часть потребляемого углерода выделяется в виде CO2, а меньшая – ассимилируется в органические компоненты [26].
ЗАКЛЮЧЕНИЕ
Загрязнение дерново-подзолистой почвы НФ приводит не только к значительным сдвигам в составе почвенного микробного сообщества, но и к существенным изменениям ее биологической активности.
Внесение НФ в почву вызывает время- и дозозависимые изменения в активности пула ферментов азотного, углеводного циклов и окислительно-восстановительных ферментов. Наибольшие изменения ферментативной активности выявлены при высоком содержании НФ в почве 300 мг/кг.
Через сутки после внесения НФ в загрязненных образцах почвы отмечена стимуляция активности ферментов азотного цикла (уреазной и протеазной активностей), а при дальнейшем инкубировании в почве, содержавшей 300 мг НФ/кг, наблюдалось уменьшение активности этих ферментов по сравнению с контрольной почвой до 3.6 и 1.7 раз соответственно.
Характер и степень воздействия НФ на карбогидразы – гидролитические ферменты, участвующие в круговороте углерода и расщепляющие углеводы различной природы – зависят от типа фермента и содержания НФ. На амилазную активность НФ в концентрации 30 мг/кг почвы не оказывал влияния, а в высокой концентрации (300 мг/кг почвы) вызывал ее уменьшение с максимальной степенью ингибирования – на 63% через 30 сут инкубирования. C течением времени (после 90 сут инкубирования) наблюдалось восстановление ферментативной активности до контрольного уровня.
В отличие от активностей ферментов азотного цикла и амилазной активности целлюлазная активность почвы при внесении НФ возрастала, что положительно коррелировало с увеличением в загрязненной почве численности целлюлозоразрушающих бактерий (после 30 сут инкубирования) и микромицетов (после 90 сут инкубирования).
Повышение дегидрогеназной и каталазной активности, а также базального дыхания загрязненных НФ почв, возможно, обусловлено поступлением дополнительного источника углерода и значительным (до 5 раз) увеличением численности гетеротрофных микроорганизмов за счет развития толерантных к НФ микроорганизмов.
Полученные результаты являются важным этапом, необходимым для прогнозирования состояния почв, загрязненных алкилфенолами, и могут быть использованы при разработке методологии ремедиации почв, контаминированных гормоноподобными соединениями.
Список литературы
Зайцева Т.Б., Медведева Н.Г. Молекулярные механизмы стрессового ответа цианобактерии Planktothrix agardhii на воздействие 4-трет-октилфенола // Микробиология. 2019. Т. 88. № 4. С. 417–425.
Кузикова И.Л., Зайцева Т.Б., Кичко А.А., Зиновьева С.В., Руссу А.Д., Маячкина Н.В., Медведева Н.Г. Влияние нонилфенолов на численность и таксономическую структуру почвенного микробного сообщества // Почвоведение. 2019. № 6. С. 724–735.
Новосёлова Е.И., Киреева Н.А. Ферментативная активность почв в условиях нефтяного загрязнения и ее биодиагностическое значение // Теоретическая и прикладная экология. 2009. № 2. С. 4–12.
Мартиросова Е.И., Карпекина Т.А., Эль-Регистан Г.И. Модификация ферментов естественными химическими шаперонами микроорганизмов // Микробиология. 2004. Т. 73. № 5. С. 708–715.
Методы почвенной микробиологии и биохимии / Под ред. Звягинцева Д.Г. М.: Изд-во Моск. ун-та, 1991. 303 с.
Николаев Ю.А., Лойко Н.Г., Степаненко И.Ю., Шаненко Е.Ф., Мартиросова Е.И., Плакунов В.К., Козлова А.Н., Борзенков И.А., Коротина О.А., Родин Д.С., Крупянский Ю.Ф., Эль-Регистан Г.И. Изменения физико-химических свойств белков, модифицированных алкилоксибензолами // Прикладная биохимия и микробиология. 2008. Т. 44. № 2. С. 159–167.
Сморкалов И.А., Воробейчик Е.Л. Почвенное дыхание лесных экосистем в градиентах загрязнения среды выбросами медеплавильных заводов // Экология. 2011. № 6. С. 429–435.
Хазиев Ф.Х. Методы почвенной энзимологии. М.: Наука, 2005. 252 с.
Acir I.-H., Guenther K. Endocrine-disrupting metabolites of alkylphenol ethoxylates – A critical review of analytical methods, environmental occurrences, toxicity, and regulation (Review) // Sci. Total Environ. 2018. V. 635. P. 1530–1546. https://doi.org/10.1016/j.scitotenv.2018.04.079
Akimenko Y.V., Chuvaraeva O.V., Kazeev K.S., Kolesnikov S.I. Assessment of changes in the biological indicators of brown forest soil when polluted with modern biocides // IJEAT. 2019. V. 8. P. 812–815.
Alef K. Soil respiration // Methods in applied soil microbiology and biochemistry. London: Academic Press Inc., 1995. P. 214–219.
Borowik A., Wyszkowska J., Kucharski J., Baćmaga M., Tomkiel M. Response of microorganisms and enzymes to soil contamination with a mixture of terbuthylazine, mesotrione, and S-metolachlor // Environ. Sci. Pollut. Res. 2017. V. 24. P. 1910–1925. https://doi.org/10.1007/s11356-016-7919-z
Breza-Boruta B., Lemanowicz J., Bartkowiak A. Variation in biological and physicochemical parameters of the soil affected by uncontrolled landfill sites // Environ Earth Sci. 2016. V. 75. P. 201. https://doi.org/10.1007/s12665-015-4955-9
Brooke L., Thursby G. Ambient aquatic life water quality criteria for nonylphenol. Washington DC, USA: Report for the United States EPA, Office of Water, Office of Science and Technology. 2005.
Careghini A., Mastorgio A.F., Saponaro S., Sezenna E. Bisphenol A, nonylphenols, benzophenones, and benzotriazoles in soils, groundwater, surface water, sediments, and food: a review // Environ. Sci. Pollut. Res. 2015. V. 22. P. 5711–5741. https://doi.org/10.1007/s11356-014-3974-5
Das K.C., Xia K. Transformation of 4-nonylphenol isomers during biosolids composting // Chemosphere. 2008. V. 70. P. 761–768. https://doi.org/10.1016/j.chemosphere.2007.07.039
Dotaniya M.L., Pipalde J.S. Soil Enzymatic Activities as Influenced by Lead and Nickel Concentrations in a Vertisol of Central India // Environ. Contam. Tox. 2018. V. 101. P. 80–385. https://doi.org/10.1007/s00128-018-2402-9
Feenstra L., Brignon J.M., Genty A., van Tongeren W., Lindeboom R., Oesterholt F., Vlaardingerboek A., Kru-panek J., Zielonka U., Ullrich S. An Inventory and Assessment of Options for Reducing Emissions: Nonylphenols. Work Package 3-D.3.1. 2009. 44 p.
Herbert D., Phipps P.J., Stange R.E. Chapter III. Chemical Analysis of Microbial Cells // Methods in Microbiology. 1971. V. 5. P. 209–344. https://doi.org/10.1016/S0580-9517(08)70641-X
Kim S.H., Nam K.H., Hwang K.A., Choi K.C. Influence of hexabromocyclododecane and 4-nonylphenol on the regulation of cell growth, apoptosis and migration in prostatic cancer cells // Toxicol. In Vitro. 2016. 32. P. 240–247. https://doi.org/10.1016/j.tiv.2016.01.008
Ma W., Nie C., Su F., Cheng X., Yan Y., Chen B., Lun X. Migration and biotransformation of three selected endocrine disrupting chemicals in different river-based aquifers media recharge with reclaimed water // Int. Biodeterior. Biodegradation. 2015. V. 102. P. 298–307. https://doi.org/10.1016/j.ibiod.2015.03.022
Ramgopal M., Balaji M., Sridevi A., Narasimha G. Microbiological and enzymatic properties of soil contaminated with hydrocarbon industrial waste // Biotechnol. (Rajkot). 2012. V. 6. № 8. P. 272–281.
REACH – Regulation concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency (ECHA) № 1907/2006. 18.12.2006.
Roberts P., Roberts J.P., Jones D.L. Behaviour of the endocrine disrupting chemical nonylphenol in soil: Assessing the risk associated with spreading contaminated waste to land // Soil Biol. Biochem. 2006. V. 38. P. 1812–1822. https://doi.org/10.1016/j.soilbio.2005.12.006
Silva A.L., Amorim M.J., Holmstrup M. Salinity changes impact of hazardous chemicals in Enchytraeus albidus // Environ. Toxicol. Chem. 2015. V. 34. № 9. P. 2159–2166. https://doi.org/10.1002/etc.3058
Šmejkalová M., Mikanová O., Borůvka L. Effects of heavy metal concentrations on biological activity of soil micro-organisms // Plant soil environ. 2003. V. 49. № 7. P. 321–326. https://doi.org/10.17221/4131-PSE
Song Y., Song C., Ren J., Ma X., Tan W., Wang X., Gao J., Hou A. Short-Term response of the soil microbial abundances and enzyme activities to experimental warming in a boreal peatland in Northeast China // Sustainability. 2019. V. 11. P. 590–606. https://doi.org/10.3390/su11030590
Szewczyk R., Sobon A., Pozalska S., Dzitko K., Waide-lich D., Dlugonski J. Intracellular proteome expression during 4-N–Nonylphenol biodegradation by the filamentous fungus Metarhizium robertsii // Int. Biodeterioration Biodegradation. 2014. V. 93. P. 44–53. https://doi.org/10.1016/j.ibiod.2014.04.026
Tuan N.N., Hsieh H.C., Lin Y.W., Huang S.L. Analysis of bacterial degradation pathways for long-chain alkylphenols involving phenol hydroxylase, alkylphenol monooxygenase and catechol dioxygenase genes // Bioresource Technology. 2011. V. 102. P. 4232–4240. https://doi.org/10.1016/j.biortech.2010.12.067
Uguz C., İşcan M., Togan İ. Alkylphenols in the environment and their adverse effects on living organisms // Kocatepe Vet. J. 2009. V. 2. № 1. P. 49–58.
Yang X., Huang H., Wang M., Zheng X., Xie M., Xu J. Nonylphenol promotes the proliferation of colorectal cancer COLO205 cells by upregulating the expression of protein kinase C ζ // Oncology Lett. 2019. V. 17. P. 2498–2506. https://doi.org/10.3892/ol.2018.9846
Zaborowska M., Kucharski J., Wyszkowska J. Biochemical and microbiological activity of soil contaminated with o-cresol and biostimulated with Perna canaliculus mussel meal // Environ. Monit. Assess. 2018. V. 190. P. 602. https://doi.org/10.1007/s10661-018-6979-6
Дополнительные материалы отсутствуют.