Почвоведение, 2020, № 6, стр. 726-737
Мобилизация, фитотоксичность и действие на микробное сообщество почв глифосата при внесении моноаммонийфосфата
Н. А. Куликова a, b, *, А. Д. Железова c, М. Г. Воропанов a, О. И. Филиппова a, И. В. Плющенко a, И. А. Родин a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт биохимии РАН им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Ленинский пр., 33, Россия
c Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
* E-mail: knat@darvodgeo.ru
Поступила в редакцию 03.09.2019
После доработки 09.11.2019
Принята к публикации 27.12.2019
Аннотация
В модельном лабораторном эксперименте установлено, что внесение моноаммонийфосфата приводит к мобилизации сорбированного почвой глифосата. Наиболее ярко этот эффект проявился на серой лесной почве (Haplic Phaeozem), где концентрация гербицида в присутствии удобрения была в 3.6 раза выше, чем при его отсутствии. Для дерново-подзолистой почвы (Albic Retisol) и чернозема выщелоченного (Luvic Chernic Phaeozem) это отношение составило 1.5 и 2.8 соответственно. Таким образом, внесение моноаммонийфосфата в почвы, загрязненные глифосатом, может сопровождаться увеличением риска миграции гербицида в сопредельные среды. Оценка количества функциональных генов бактерий, отвечающих за деградацию глифосата с разрывом связи C–P, показала, что статистически значимого изменения количества копий генов phnJ, кодирующих C–P-лиазу α‑ и γ-протеобактерий, под действием удобрения не обнаружено. Высвобождение глифосата не сопровождалось негативным влиянием на длину и биомассу растений пшеницы.
ВВЕДЕНИЕ
Глифосат (N-(фосфометил)-глицин) был веден в практику сельского хозяйства в 1974 г. в качестве неселективного гербицида под торговым названием раундап. Патент на исключительное производство раундапа за пределами США истек в 1991 г., а в США – в 2000 г. Это привело к резкому снижению цен на гербицид и росту количества производителей. Только в первый год после отмены патента цена на глифосат снизилась на 40%, и сейчас его производство существует в США, Европе, Австралии, Китае [54]. В России глифосат производит Кирово-Чепецкая химическая компания. Кроме того, компаниями “Группа Оргсинтез” запланировано к 2020 г. строительство завода по производству глифосата объемом выпуска до 30 тыс. т в год.
Глифосат обладает уникальным механизмом действия: он ингибирует 5-енолпирувилшикимат-3-фосфат синтазу – фермент, участвующий в синтезе ароматических аминокислот и присутствующий в растениях, бактериях и грибах, но отсутствующий у животных [24]. Это позволило долгое время позиционировать глифосат как безопасный пестицид [33], и его применение увеличивалось с каждым годом: только в США с 1974 г. по 1995 г. оно возросло с 0.36 до 12.5 тыс. т, т.е. почти в 35 раз [15]. Дополнительным стимулом стало введение в 1996 г. в сельскохозяйственную практику устойчивых к глифосату генно-модифицированных (ГМ) культур, и в настоящее время глифосат стал самым широко используемым гербицидом [24] с ежегодным потреблением (по данным на 2014 г.) около 826 тыс. т [15]. В России гербициды на основе глифосата разрешены для применения не только в сельском хозяйстве, но и в личных хозяйствах, что повышает риски его неправильного использования. Всего в 2019 г. в нашей стране рекомендовано к употреблению 86 гербицидов на основе глифосата (https://www. agroxxi.ru/goshandbook). Применение глифосата подразумевает опрыскивание вегетирующих растений, однако при такой обработке 70–95% пестицида поступает в почву [7]. Кроме того, глифосат попадает в почву вместе с растительными остатками. Это приводит к накоплению в почвах остаточных количеств глифосата, содержание которых может достигать величин более 1.5 мг/кг почвы [12, 52].
В почве глифосат быстро инактивируется вследствие сорбции и минерализации [7, 16]. Существует два основных пути биологической деградации глифосата: с разрывом связи C–N и образованием аминометилфосфоновой кислоты (АМФК) и глиоксилата или с разрывом связи C–P с образованием саркозина (N-метилглицин) и неорганического фосфата ${\text{PO}}_{4}^{{3--}}$ [9, 22]. В дальнейшем глиоксилат служит источником углерода, а фосфаты – фосфора. Деградация глифосата с образованием АМФК более распространена среди бактерий. Ее способны осуществлять бактерии, выделенные как из загрязненных глифосатом сред, так и из прежде не обрабатываемых гербицидом местообитаний. Разрушение связи C–N происходит с помощью фермента глифосат-оксидоредуктазы. Этот метаболический путь был обнаружен у бактерий филумов Bacteroidetes, Actinobacteria, Firmicutes и Proteobacteria [27, 60]. Разложение глифосата с разрывом C–P связи осуществляется с помощью C–P-лиаз. Такое разложение глифосата было выявлено у представителей родов филума протеобактерий, таких как α-протеобактерии Ochrobacterium anthropi, Rhizobium sp. [25], β‑протеобактерии Achromobacter sp. [26], Alcaligenes sp. и Comamonas sp. [61] и γ-протеобактерии Pseudomonas sp. [9] и Enterobacter sp. [38], реже у актинобактерий [46]. Установлено, что среди микроорганизмов, способных разлагать глифосат (бактерии, грибы, микромицеты и актиномицеты), ключевая роль принадлежит бактериям [61]. При этом из 26 описанных штаммов глифосат деградирующих бактерий 19 относятся к типу протеобактерий [61]. Поэтому поступление глифосата в почву часто приводит к увеличению относительного содержания протеобактерий [40], в частности, α-протеобактерий [19] и γ-протеобактерий [43].
C–P-лиазы участвуют в катаболизме фосфонатов; обычно в геноме бактерий присутствует один оперон (phn), кодирующий данный метаболический путь. В случае наличия данной ферментной системы, глифосат может служить единственным источником фосфора для бактерий при его дефиците, что редко встречается в естественных местообитаниях [9]. Многие бактерии не способны использовать глифосат как единственный источник фосфора, но в условиях низкой концентрации доступных фосфатов они осуществляют разрушение связи C–P глифосата [22]. Поэтому микробиологическая деградация глифосата в почвах напрямую зависит от присутствия легкодоступных источников фосфора – неорганических фосфатов.
Наряду с разложением, к инактивации глифосата в почве приводит его сорбция на почвенных частицах, так как он является сильным хелатирующим агентом благодаря наличию в молекуле карбоксильной, фосфонатной и аминогрупп, позволяющих глифосату связываться с глинистыми частицами и железом и алюминием в составе оксидов и гидроксидов [16, 44]. Несмотря на активную сорбцию глифосата почвами, этот процесс является обратимым. В частности, одной из нерешенных проблем остается оценка влияния на поведение глифосата удобрений, прежде всего, фосфорных. Это обусловлено тем, что фосфаты часто играют роль антагонистов гербицида с точки зрения сорбции, так как конкурируют с ним за места связывания [16, 41]. Для ряда почв установлено, что внесение фосфорных удобрений может приводить к высвобождению глифосата или его основного метаболита АМФК, также обладающей фитотоксичностью [17, 34]. Кроме того, показано, что высокое содержание фосфатов в почве может ингибировать разложение глифосата до саркозина – нефитотоксичного продукта деградации глифосата [39]. Вследствие растущего применения фосфорных удобрений в мире, с-оставляющего на 2016 г. около 48.6 млн т (http://www.fao.org/faostat/), в настоящее время большое количество исследований сосредоточено на взаимодействии фосфатов и глифосата в почве [16, 17, 21, 31, 32, 34, 37, 41]. Установлено, что в большинстве случаев фосфаты конкурируют с глифосатом за места связывания, однако в некоторых почвах этого не происходит [16, 31]. Поэтому часто данные о влиянии фосфорных удобрений на взаимодействие глифосата с почвой противоречивы, что обусловливает необходимость оценки этого взаимодействия в условиях конкретной почвы [16, 31]. Для почв России такие исследования отсутствуют. Процессы сорбции–десорбции глифосата, в свою очередь, влияют на скорость его микробиологической деградации: установлено, что сорбированный гербицид минерализуется почвенной микрофлорой в меньшей степени, чем гербицид в свободной форме [16].
Таким образом, в почвах инактивация глифосата определяется комплексом условий, среди которых ведущее место занимают адсорбционная способность почв по отношению к гербициду и особенности структуры микробного сообщества. Оба этих фактора в значительной степени зависят от присутствия легкодоступных фосфатов. Настоящее исследование было направлено на оценку возможности мобилизации глифосата в дерново-подзолистой, серой лесной почве и черноземе под действием фосфатов и влияние этого процесса на обилие функциональных генов бактерий, отвечающих за деградацию глифосата с разрывом связи C–P.
ОБЪЕКТЫ И МЕТОДЫ
Отбор и характеристика почвенных образцов. Отбор образцов почв проводили из гумусовых горизонтов почв с глубины 0–5 см. Из пяти индивидуальных образцов, отобранных методом конверта на площадке площадью около 1 м2, составляли объединенную пробу, из которой получали средний образец. Список исследованных почв приведен в табл. 1. Всего отобрали три почвенных образца из разных почвенно-географических зон: дерново-подзолистых почв (Albic Retisol) (Московская область, Солнечногорский район), серых лесных почв (Haplic Phaeozem) (Тульская область, Щекинский район) и выщелоченных черноземов (Luvic Chernic Phaeozem) (Липецкая область, Данковский район).
Таблица 1.
Список отобранных почвенных образцов и их основные агрохимические показатели (среднее ± стандартное отклонение, n = 3)
| Индекс | pH | Nмин | Pподв | С* | N* |
|---|---|---|---|---|---|
| мг/кг почвы | % | ||||
| Дерново-подзолистая почва на покровном суглинке, подстилаемом мореной**/Albic Retisol*** | |||||
| ДП | 4.4 ± 0.1 | 13.5 ± 0.2 | 1.5 ± 0.1 | 2.32 | 0.18 |
| Серая лесная почва на покровном суглинке, подстилаемом мореной**/Haplic Phaeozem*** | |||||
| СЛ | 4.9 ± 0.1 | 25.7 ± 0.3 | 5.8 ± 0.2 | 2.65 | 0.26 |
| Чернозем выщелоченный на лёссовидном суглинке**/Luvic Chernic Phaeozem*** | |||||
| ЧВ | 6.2 ± 0.1 | 5.3 ± 0.2 | 12.7 ± 0.9 | 4.05 | 0.34 |
Основные агрохимические характеристики. Актуальную кислотность почв определяли согласно [10]. Измерения проводили на приборе Hanna Microprocessor pH Meter pH 211, электрод HI 1230 (Hanna Instruments Inc., США). Содержание органического углерода (C) и азота (N) в почве определяли каталитическим сжиганием при 960°С [35] в токе кислорода на элементном анализаторе Vario Macro Cube (Elementar Analysen Systeme GmbH, Германия). Содержание подвижных форм фосфора в дерново-подзолистой (ДП) и серой лесной почве (СЛ) оценивали методом Кирсанова в модификации ЦИНАО [3], в черноземе выщелоченном (ЧВ) – методом Чирикова в модификации ЦИНАО [2]. При определении фосфора измерения оптической плотности растворов проводили на спектрофотометре PortLab512 (Portlab, Великобритания) при длине волны 710 нм. Содержание минерального азота рассчитывали как сумму свободных ионов ${\text{NH}}_{4}^{ + }$ и ${\text{NO}}_{3}^{--},$ определяемых, согласно [8], с помощью ион-селективных электродов ЭКОМ-NH4 и ЭКОМ-NO3 соответственно (НПП “Эконикс”, РФ). Основные агрохимические характеристики исследованных почв приведены в табл. 1.
Проведение модельных лабораторных экспериментов. Для оценки влияния моноаммонийфосфата (МАФ) на иммобилизацию глифосата поставили опыт, включающий четыре варианта: 1 – контроль (внесение дистиллированной воды); 2 – МАФ; 3 – глифосат; 4 – глифосат + МАФ. Повторность трехкратная. Инкубацию осуществляли в два этапа: на первом этапе проводили уравновешивание гербицида в почве, на втором – внесение МАФ и оценку высвобождения глифосата под его действием. Продолжительность этапов составила 7 и 14 сут соответственно.
К навескам воздушно-сухой почвы вариантов глифосат и глифосат + МАФ, предварительно пропущенной через сито с диаметром ячеек 2 мм, вносили растворы глифосата (Раундап ВР 360 г/л, АО “Август”, РФ) для создания содержания гербицида в почве 8 мг/кг. Согласно существующим представлениям, гербицид преимущественно задерживается верхним слоем почвы 0–5 см, поэтому при внесении глифосата в рекомендованных дозах 2–8 л/га в почве его концентрация составляет 2.4–9.6 мг/кг почвы [17]. Таким образом, использованная в работе концентрация глифосата соответствует дозе его внесения 6.7 л/га, рекомендованной при борьбе со злостными многолетними сорняками: вьюнком полевым, свинороем, бодяком полевым и др. (6–8 л/га). Для равномерности распределения гербицида в навеске почвы подбирали объем вносимого раствора таким образом, чтобы увлажнить почву до 70% полной влагоемкости. Масса воздушно-сухой почвы в стаканах была 100 г, объем стаканов 100 мл. В сосуды вариантов контроль и МАФ вносили аналогичное количество дистиллированной воды. На первом этапе инкубирования стаканы оставляли в вегетационной камере (день/ночь 12 ч/12 ч, температура 24°С, без полива) на 7 сут для уравновешивания гербицида в почве с последующим отбором проб на содержание глифосата, АМФК и микробиологические анализы. Повторность в данном случае была шестикратной, так как до внесения удобрения по обработке почвы не отличались в вариантах контроль и МАФ (внесение дистиллированной воды) и в вариантах глифосат и глифосат + + МАФ (внесение раствора гербицида).
На втором этапе инкубирования в стаканы вариантов МАФ и глифосат + МАФ вносили раствор МАФ (марка А, N : P 12 : 61, АО “Lifosa”, Литва) – водорастворимое азотно-фосфорное удобрение, рекомендуемое для применения на ранних стадиях развития растений, в период формирования корневой системы. Содержание МАФ в почве составляло 0.34 г P2O5/кг почвы, что приблизительно соответствует дозе внесения 120 кг/га по P2O5. Объем вносимого раствора подбирали таким образом, чтобы увлажнить почву до 70% полной влагоемкости. В сосуды вариантов контроль и глифосат вносили аналогичное количество дистиллированной воды.
Так как существуют данные, указывающие на почвенную фитоксичность глифосата при внесении фосфатов [17], нами была проведена оценка влияния гербицида на рост растений в этих условиях. Для этого проводили посадку наклюнувшихся семян пшеницы мягкой Triticum aestivum L. сорта Л-1, 5 шт./сосуд. Сосуды помещали в вегетационную камеру (день/ночь 12 ч/12 ч, температура 24°С) для выращивания растений пшеницы; полив проводили по мере необходимости. Через 14 сут выращивания второй этап инкубирования завершали, проводили учет длины и биомассы растений, отбирали почвенные пробы на определение глифосата, АМФК, микробиологические анализы и определение содержания подвижных форм фосфора и минерального азота в трехкратной повторности.
Определение содержания глифосата и АМФК в почве. Водную экстракцию гербицида и его основного метаболита проводили согласно [23], хроматографическое разделение и масс-спектрометрическое определение – согласно [57]. Навески почвы массой 1 г помещали в пластиковые пробирки и приливали 4 мл деионизованной воды, интенсивно встряхивали и оставляли на встряхивателе для экстракции на 30 мин. Далее проводили отделение экстракта от осадка путем центрифугирования в течение 10 мин при 17 000 g. Содержание глифосата и АМФК определяли методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием (ВЭЖХ-МС/МС). Система ВЭЖХ-МС/МС состояла из жидкостного хроматографа Ultimate 3000 (Dionex, США) с диодно-матричным детектором и гибридного тандемного тройного квадрупольного масс-спектрометра Qtrap 3200 (ABSciex, Канада), оснащенного источником ионизации электрораспылением. Хроматографическое разделение глифосата и АМФК проводили на колонке Shodex NH2P-50 2D (150 × 2.1 мм, 3 мкм) с предколонкой. Подвижная фаза А: водный раствор 5 мМ ацетата аммония, рН 11. Подвижная фаза В: ацетонитрил : вода 20 : 80. Разделение проводили в градиентном режиме при следующих соотношениях подвижных фаз A : B: 0–3 мин 0 : 100, 3–8 мин 50 : 50, 8–28 мин 0 : 100. Скорость потока 0.25 мл/мин, температура термостата колонки 35°С. Ионизацию осуществляли в отрицательном режиме. Детектирование проводили в режиме мониторинга выбранных реакций (МВР). Для глифосата в качестве основного перехода использовали m/z 168 → m/z 63, для АМФК – m/z 110 → → m/z 63. Дополнительными переходами для гербицида и его метаболита были m/z 168 → m/z 149.9 и m/z 110 → m/z 79 соответственно. МВР-переходов и параметров детектирования проводили в автоматическом режиме с помощью программного обеспечения, поставляемого вместе с оборудованием (Analyst 1.5.1).
Для учета влияния матричного эффекта (т.е. влияния матрицы образца на эффективность ионизации, степень и эффективность извлечения определяемого вещества) каждую пробу анализировали в двух параллельных измерениях, в ходе одного из них вносили в почву смесь глифосата и АМФК. Поправочный коэффициент k вычисляли, как отношение разницы площадей пиков анализируемого компонента после введения добавки в навеску и экстракта образца без добавки к площади пика анализируемого компонента в стандартном растворе с концентрацией, равной концентрации в экстракте с добавкой. В дальнейшем концентрацию глифосата и АМФК рассчитывали с учетом поправочного коэффициента. Пределы обнаружения глифосата в исследованных почвах с учетом матричного эффекта для ДП, СЛ и ЧВ составили: 0.60, 0.44 и 0.69 мг/кг. Для АМФК аналогичные величины были 25, 15 и 7 мг/кг. Без учета матричного эффекта пределы обнаружения глифосата и АМФК составили 0.08 и 0.14 мг/кг соответственно.
Молекулярно-биологические анализы были направлены на определение количества копий генов 16S рРНК бактерий, отражающих общее обилие бактерий в почве, генов phnJ α- и γ-протеобактерий, кодирующих C–P-лиазы, и генов phoC и phoD, кодирующих кислую и щелочную фосфатазу, соответственно (табл. 2). Выделение ДНК проводили с помощью набора SileksMagNA для почв согласно рекомендациям производителя с модификацией на этапе гомогенизации образца: использовали гомогенизатор Precellys 24 (Bertin Technologies, Франция), программа 5. Полимеразную цепную реакцию (ПЦР) осуществляли в амплификаторе C1000 Thermal Cycler с CFX96 Real-Time System (Bio-Rad Laboratories, USA). Олигонуклеотидные праймеры, использованные в работе, представлены в табл. 2. Для определения количества копий рибосомальных генов бактерий в образцах использовали методику, описанную в [4]. Протокол для количественной ПЦР на остальные гены брали из публикаций, представленных в табл. 2. Объем реакционной смеси для ПЦР составлял 20 мкл, включая 10 мкл BioMaster HS-qPCRSYBR Blue (Biolabmix, Россия), 1 мкл препарата почвенной ДНК и праймеры в концентрации 0.5–0.8 мкМ. Для оценки специфичности реакции анализировали кривые плавления. Количество копий генов оценивали в программе CFX Manager (Bio-Rad, CIF). Использовали стандарты в концентрациях от 103 до 109 копий гена/мкл. Стандарты для всех генов, кроме бактериального 16S рРНК, получали путем очистки продуктов ПЦР и количественного определения концентрации с помощью флуориметра Qubit3 (Thermo Fisher Scientific, США).
Таблица 2.
ПЦР-праймеры, использованные в работе
| Группа или процесс | Ген | Праймер | Нуклеотидная последовательность (F, R) | Ссылка |
|---|---|---|---|---|
| Бактерии | 16S рРНК | Eub338 Eub518 |
ACTCCTACGGGAGGCAGCAG ATTACCGCGGCTGCTGG |
[28] |
| Кислая фосфатаза | phoC | phoc‑A‑F1 phoc‑A‑R1 |
CGGCTCCTATCCGTCCGG CAACATCGCTTTGCCAGTG |
[29] |
| Щелочная фосфатаза | phoD | phoD‑F733 phoD‑R1083 |
TGGGAYGATCAYGARGT CTGSGCSAKSACRTTCCA |
[18, 48] |
| C–P-лиазы α-ПБ* | phnJ | phnJ‑F1 phnJ‑R1 |
ACbATCATCCAGACsCGbCA AGCTTsACrTGCATsAGvCC |
[58] с мод. |
| C–P-лиазы γ-ПБ** | phnJ | phnJF2 phnJR2 |
GATCGGCACyTGrTAGACsA tGCTCAAGGkCATCGAyCA |
[56] с мод. |
Статистическая обработка данных включала расчет среднего и стандартного отклонения. Оценку значимости различий между средними оценивали методом двухфакторного дисперсионного анализа с расчетом наименьшей существенной разницы (НСР). Выбранный уровень доверительной вероятности р = 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенные эксперименты показали, что в течение первых 7 сут инкубирования наиболее активно глифосат инактивировался в ЧВ: в почве обнаруживалось 1.3% гербицида от внесенного. Для ДП почвы этот показатель составил 4.4%, для СЛ – 4.9%. Наблюдаемая инактивация обусловлена как процессом сорбции гербицида, так и его деградации. При повышении рН в диапазоне 4–8 отрицательный заряд глифосата увеличивается вследствие диссоциации карбоксильной группы (pKa 5.44) и, следовательно, возрастание рН сопровождается снижением сорбционной способности почвы по отношению к гербициду [16]. С другой стороны, уменьшение связывания глифосата почвами наблюдается также при увеличении содержания в почве подвижного фосфора [21]. Поэтому можно предположить, что в данном случае высокая степень инактивации на ЧВ, характеризующемся максимальным рН и содержанием подвижного фосфора в ряду исследованных почв, обусловлена деградацией глифосата. На эту возможность указывает наибольшее обилие бактерий, о чем свидетельствует количество копий генов 16S рРНК (табл. 3).
Таблица 3.
Влияние глифосата на количество копий целевых генов в исследованных почвах через 7 сут инкубации (среднее ± стандартное отклонение, n = 6)
| Почва | Содержание, копий/г | ||||
|---|---|---|---|---|---|
| 16S, ×109 | α-ПБ* phnJ, ×104 | γ-ПБ** phnJ, ×104 | phoC, ×105 | phoD, ×105 | |
| Контроль | |||||
| ДП | 0.21 ± 0.05 | 0.14 ± 0.04 | – | 0.12 ± 0.6 | 0.03 ± 0.01 |
| СЛ | 1.2 ± 0.6 | 2.2 ± 0.4 | 2.6 ± 0.6 | 2.0 ± 0.5 | 8.1 ± 1.8 |
| ЧВ | 1.6 ± 0.2 | 2.3 ± 0.8 | 3.2 ± 0.7 | 2.3 ± 0.8 | 13 ± 1 |
| Глифосат | |||||
| ДП | 0.27 ± 0.05 | 0.19 ± 0.09 | – | 0.14 ± 0.05 | 0.06 ± 0.03 |
| СЛ | 0.7 ± 0.2↓ | 1.6 ± 0.5↓ | 2.2 ± 0.8↓ | 1.5 ± 0.6 | 4.5 ± 2.9↓ |
| ЧВ | 1.5 ± 0.4 | 3.2 ± 0.8↑ | 2.8 ± 0.5↓ | 2.7 ± 1.0 | 11 ± 4 |
| НСР0.05 | 0.4 | 0.5 | 0.4 | 0.7 | 3 |
АМФК – основной метаболит глифосата – не обнаружен ни в одном варианте. Это может быть связано с высокой связывающей способностью почв по отношению к этому соединению, в большинстве случае превышающую таковую по отношению к глифосату [51]. При исследовании сорбции глифосата и АМФК на 17 почвах установлено, что среднее значение константы Фрейндлиха для глифосата составляет 144, а для АМФК 164 мг/кг (л/мг)–nf и при этом в 11 случаях константа Фрейндлиха для АМФК была в 1.2–2.3 раза выше, чем для глифосата. С другой стороны, предел обнаружения АМФК в почве, обусловленным мешающим влиянием почвенной матрицы, также был значительно выше, чем для глифосата, превышая его в 10–40 раз. Наконец, отсутствие АМФК может объясняться преобладанием саркозинового пути деградации гербицида в выбранных условиях.
Внесение глифосата приводило к разнонаправленным изменениям количества копий функциональных генов в выбранных условиях. На ДП почве с наименьшим показателем рН и наиболее низким содержанием подвижного фосфора (табл. 1) обработка гербицидом не повлияла на количество исследуемых генов (табл. 3). В то же время на СЛ почве и ЧВ, характеризующихся более высокими значениями показателя актуальной кислотности и содержания подвижного фосфора, было отмечено снижение количества некоторых из исследованных целевых генов. Наиболее ярко влияние глифосата проявилось на СЛ почве, где в присутствии гербицида наблюдали снижение содержания всех исследованных целевых генов за исключением phoC, для которого изменение количества копий с 2.0 × 105 до 1.5 × 105 оказалось статистически незначимым. Полученные результаты согласуются с данными других исследователей, отмечавших снижение содержания бактерий после однократного применения глифосата в почве с высоким содержанием подвижного фосфора и отсутствие аналогичного эффекта на почве с низким значением этого показателя [14]. Интересно отметить, что как на СЛ почве, так и на ЧВ в вариантах с глифосатом было снижено количество копий гена, кодирующего C–P-лиазу у γ-протеобактерий. Можно предположить, что обилие γ-протеобактерий в варианте с глифосатом было снижено относительно контрольного варианта за счет менее активного развития прокариотного сообщества. В ЧВ в вариантах с глифосатом было выявлено увеличение содержания гена phnJ α-протеобактерий, кодирующего C–P-лиазу, отвечающую за деградацию глифосата по саркозиновому пути. Это наблюдение хорошо согласуется с ранее обнаруженной наибольшей деградации глифосата на ЧВ.
Сопоставление содержания 16S рРНК с остаточной концентрацией глифосата в почвах через первую неделю инкубирования показало, что между этими показателями существует значимая обратная корреляционная взаимосвязь (r = –0.97). По-видимому, это указывает на возможность частичного угнетения бактерий глифосатом в выбранных условиях или сниженную скорость разложения глифосата при низком обилии бактерий. Несмотря на то, что в большинстве исследований отмечается отсутствие выраженного негативного действия глифосата на микробное сообщество [60], рядом исследователей показано небольшое снижение количества бактерий [13, 50] в его присутствии или рост отношения углерода грибной биомассы к бактериальной [47]. В связи с тем, что деградация глифосата в почве в большинстве случаев является ко-метаболическим процессом [16], наблюдаемые разногласия свидетельствуют о необходимости проведения исследования сукцессионных изменений в почве под действием этого гербицида, а не однократных оценок.
Внесение МАФ привело к мобилизации глифосата во всех исследованных почвах: в конце инкубирования содержание гербицида в варианте глифосат + МАФ превышало не только значения варианта глифосат, но и содержание гербицида до начала второго этапа инкубирования (рис. 1). Это указывает на то, что в первую неделю инкубирования исчезновение глифосата из почв было обусловлено не только его деградацией, но и обратимой сорбцией, вызванной внесением фосфатов. Наиболее ярко этот эффект проявился в СЛ почве: концентрация глифосата в присутствии МАФ была в 3.6 раза выше, чем при его отсутствии. Для ПД почвы и ЧВ это отношение составило 1.5 и 2.8 соответственно.
Рис. 1.
Влияние МАФ на содержание глифосата в исследованных почвах. Планками показано стандартное отклонение (n = 3). Для каждой почвы одинаковые буквы указывают на принадлежность к одной группе по данным дисперсионного анализа.

Полученные результаты согласуются с данными других исследователей, отмечавших возможность высвобождения глифосата из почвы при внесении фосфорных удобрений [41, 45]. Как глифосат, так и фосфаты могут связываться на минеральных поверхностях с переменным зарядом, таких как глинистые минералы, оксиды и гидроксиды Al и Fe, с образованием связей Al–O–P или Fe–O–P [16]. Поэтому среди основных факторов, влияющих на сорбционно-десорбционное поведение глифосата в почвах, принято выделять содержание фосфатов, которые могут конкурировать за места связывания глифосата.
В ДП и СЛ почвах при отсутствии МАФ наблюдали уменьшение содержания глифосата по сравнению с его содержанием в почве после первого этапа инкубирования, что объясняется деградацией гербицида. В отличие от ДП и СЛ почв в ЧВ изменения концентрации гербицида в этих условиях не отмечено, это указывает, что в ЧВ полная инактивация глифосата, обусловленная его связыванием и деградацией, происходит в течение недели. Это хорошо согласуется с ранее установленным фактом, что в исследованном черноземе наблюдали самую высокую степень исчезновения гербицида. Об этом свидетельствует отсутствие возрастания обилия бактерий, оцениваемого на основании количества копий генов 16S рРНК, при дальнейшей инкубации как в присутствии, так и при отсутствии МАФ (табл. 4). В ДП и СЛ почвах, где продолжение инкубирования сопровождалось деградацией глифосата, наблюдали значимое увеличение обилия бактерий. Полученные результаты совпадают с данными исследователей, отмечавших возможность кратковременного возрастания количества бактерий в почве под действием глифосата [43, 60]. Принимая во внимание, что через первые 7 сут инкубирования после внесения глифосата для СЛ почвы отмечали снижение количества копий генов 16S рРНК, рост этого показателя при дальнейшем инкубировании может свидетельствовать о развитии бактерий при уменьшении концентрации глифосата и снижении его угнетающего воздействия.
Таблица 4.
Влияние МАФ и глифосата на содержание целевых генов в исследованных почвах через 14 сут инкубации после внесения МАФ (среднее ± стандартное отклонение, n = 3)
| Почва | Содержание, копий/г | ||||
|---|---|---|---|---|---|
| 16S, ×109 | α-ПБ* phnJ, ×107 | γ-ПБ** phnJ, ×104 | phoC, ×105 | phoD, ×105 | |
| Контроль | |||||
| ДП | 1.6 ± 0.3 | 0.8 ± 0.4 | – | 0.4 ± 0.2 | 4.5 ± 0.2 |
| СЛ | 2.7 ± 0.3 | 9 ± 4 | 9.8 ± 0.2 | 7 ± 4 | 26 ± 1 |
| ЧВ | 1.0 ± 0.3 | 3.4 ± 0.6 | 6 ± 2 | 3 ± 1 | 10 ± 4 |
| МАФ | |||||
| ДП | 2.4 ± 0.3↑ | 1.6 ± 0.8 | – | 0.9 ± 0.8 | 15 ± 2 |
| СЛ | 3.5 ± 0.2↑ | 7 ± 1 | 8 ± 4 | 5 ± 2 | 30 ± 2 |
| ЧВ | 1.3 ± 0.2 | 4.3 ± 0.7 | 7 ± 2 | 5 ± 1 | 19 ± 2 |
| Глифосат | |||||
| ДП | 2.2 ± 0.3↑ | 1.1 ± 0.3 | – | 4 ± 3↑ | 6.1 ± 0.6 |
| СЛ | 3.1 ± 0.1↑ | 7 ± 2 | 10 ± 6 | 3.9 ± 0.5 | 32 ± 8 |
| ЧВ | 0.9 ± 0.2 | 3.2 ± 0.9 | 8.0 ± 0.9 | 4 ± 1 | 19 ± 3 |
| Глифосат + МАФ | |||||
| ДП | 2.1 ± 0.2↑ | 1.7 ± 0.5 | – | 7 ± 2↑ | 12 ± 3 |
| СЛ | 3.2 ± 0.2↑ | 8 ± 2 | 11.9 ± 0.5 | 5 ± 2 | 32 ± 9 |
| ЧВ | 1.2 ± 0.4 | 4 ± 1 | 9 ± 3 | 5 ± 2 | 22 ± 9 |
| НСР0.05 | 0.4 | 3 | 5 | 3 | 14 |
В ДП почве внесение глифосата как при добавлении МАФ, так и при его отсутствии, способствовало увеличению содержания копий гена phoC (табл. 4), кодирующего кислую фосфатазу, несмотря на отмеченный рост содержания подвижного фосфора во всех вариантах с внесением МАФ в 2.4–4.2 раза (табл. 5). Это не соответствует ранее полученным данным о снижении активности фосфатаз при внесении глифосата [55]. Количество копий генов фосфатаз в почве зависит от pH и увеличивается в случае недостатка доступного фосфора и при внесении органических удобрений [18]. Внесение минеральных фосфорных удобрений может как уменьшать, так и увеличивать обилие генов phoC и phoD [48]. Наблюдаемое в эксперименте увеличение обилия гена phoC в присутствии глифосата может быть обусловлено неспецифичной активностью phoC с использованием глифосата или продуктов его разложения в качестве субстрата. Не было выявлено изменений обилия генов phnJ α- и γ-протеобактерий на втором этапе эксперимента после внесения МАФ. Для ДП и СЛ почв с низким содержанием подвижного фосфора следует отметить возросшее обилие бактерий во всех микрокосмах по сравнению с контрольным, что может свидетельствовать о более активном развитии сообщества в присутствии фосфорсодержащего субстрата. Это согласуется с ранее полученными данными об увеличении дыхательной активности микробного сообщества при внесении глифосата в некоторых почвах [5, 42].
Таблица 5.
Влияние МАФ и глифосата на содержание минерального азота и подвижного фосфора в исследованных почвах (среднее ± стандартное отклонение, n = 3)
| Почва | Содержание, мг/кг | ||
|---|---|---|---|
| N–${\text{NH}}_{4}^{ + }$ | N–${\text{NO}}_{3}^{ - }$ | P2O5 | |
| Контроль | |||
| ДП | 51 ± 9 | 18 ± 6 | 40 ± 7 |
| СЛ | 48 ± 7 | 8 ± 1 | 47 ± 2 |
| ЧВ | 2.3 ± 0.2 | 8.2 ± 0.7 | 46 ± 3 |
| МАФ | |||
| ДП | 77 ± 17↑ | 17 ± 4 | 171 ± 30↑ |
| СЛ | 77 ± 4↑ | 8.7 ± 0.1 | 111 ± 11↑ |
| ЧВ | 7 ± 2 | 13 ± 4↑ | 136 ± 34↑ |
| Глифосат | |||
| ДП | 26 ± 4↓ | 29 ± 2↑ | 58 ± 14 |
| СЛ | 49 ± 2 | 8 ± 1 | 51 ± 1 |
| ЧВ | 2.6 ± 0.9 | 15 ± 5↑ | 42.3 ± 0.6 |
| Глифосат + МАФ | |||
| ДП | 66 ± 9↑ | 15 ± 8 | 176 ± 30↑ |
| СЛ | 73 ± 5↑ | 8 ± 1 | 110 ± 5↑ |
| ЧВ | 5.3 ± 0.6 | 19 ± 2↑ | 156 ± 31↑ |
| НСР0.05 | 13 | 6 | 32 |
Наряду с увеличением содержания доступного фосфора, МАФ является источником минерального азота в аммонийной форме – фактора, который также мог оказать влияние на почвенную микрофлору. Поэтому после окончания второго этапа инкубирования в почвенных образцах определяли содержание минерального азота. Было установлено, что на ДП и СЛ почвах внесение МАФ привело к увеличению содержания аммонийного азота, в то время как на ЧВ изменения были статистически незначимы. По-видимому, это указывает на низкую нитрифицирующую способность в выбранных условиях ДП и СЛ почв и высокую – ЧВ. Высказанное предположение подтверждается тем, что для вариантов МАФ и глифосат + МАФ на ЧВ наблюдали рост количества нитратного азота (табл. 5).
Корреляционный анализ показал наличие прямой взаимосвязи (r = 0.83) между количеством копий 16S рРНК и содержанием минерального азота в аммонийной форме, что может указывать на вклад нитрификаторов в общее обилие бактерий в выбранных условиях и объясняться внесением доступного азота в аммонийной форме.
Оценка содержания минерального азота показала, что на ДП почве внесение глифосата привело к уменьшению количества доступного азота в аммонийной форме. Ранее аналогичный эффект при обработке почвы гербицидом отмечен рядом исследователей [20, 49, 53]. Глифосат в дозе внесения выше 4 кг/га приводил к значимому снижению азотфиксирующей способности Azotobacter chroococcum и A. vinelandii, а дозы 20–28 кг/га – практически к полному ингибированию этого процесса [49]. Кроме того, наблюдаемое уменьшение содержания аммонийного азота может быть связано с усилением процесса нитрификации, ранее отмеченное в ряде работ [11, 53]. Установлено, что внесение глифосата может инициировать увеличение доли аммонийокисляющих бактерий при однократном внесении гербицида [11].
Несмотря на значимое возрастание содержания глифосата в почвах после внесения МАФ, гербицид не оказал негативного влияния на длину и биомассу растений (рис. 2), что хорошо согласуется с общеизвестным фактом, что глифосат не является гербицидом почвенного действия.
Рис. 2.
Влияние МАФ и глифосата на длину (А) и сухую биомассу (Б) растений. Планками показано стандартное отклонение (n = 3). Для каждой почвы одинаковые буквы указывают на принадлежность к одной группе по данным дисперсионного анализа.
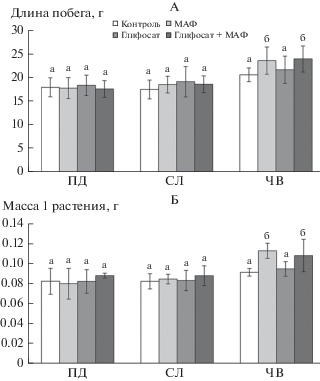
Полученные результаты свидетельствуют о высокой скорости инактивации глифосата в выбранных условиях. Для ЧВ, кроме того, отмечено положительное влияние МАФ, наблюдавшееся как при отсутствии гербицида, так и в его присутствии: внесение удобрения способствовало увеличению длины (на 10–15%) и массы (16–28%) побегов пшеницы. Отмеченное положительное влияние МАФ на рост растений на исследованном черноземе объясняется, по-видимому, низким содержанием минерального азота в этой почве. При значении этого показателя менее 15 мг/кг (для ЧВ 5.3 ± 0.2 мг/кг) почвы относятся к группе с очень низкой обеспеченностью растений азотом и очень высокой потребностью в удобрениях [1].
ЗАКЛЮЧЕНИЕ
В условиях лабораторного эксперимента при внесении в рекомендуемых дозах глифосат инактивируется в дерново-подзолистой, серой лесной почвах и черноземе на 95–99% в течение недели. Максимальная инактивация наблюдается на черноземе. При содержании подвижного фосфора в почве больше 6 мг/кг и актуальной кислотности больше 5 наблюдается временное уменьшение обилия бактерий, оцениваемого на основании содержания количества копий генов 16S рРНК. Показано наличие значимой обратной корреляционной взаимосвязи (r = –0.97) между остаточной концентрацией глифосата и содержанием 16S рРНК.
Внесение МАФ приводит к мобилизации глифосата во всех исследованных почвах. Наиболее ярко этот эффект проявляется на серой лесной почве, где концентрация глифосата в присутствии МАФ была в 3.6 раза выше, чем при его отсутствии. Для дерново-подзолистой почвы и чернозема выщелоченного это отношение составило 1.5 и 2.8 соответственно. Несмотря на увеличение количества доступного фосфора при внесении МАФ в 2.4–4.2 раза, статистически значимого изменения количества копий генов phnJ, кодирующих C–P-лиазу α- и γ-протеобактерий, обнаружено не было. Для дерново-подзолистой почвы в присутствии глифосата было показано снижение количества азота в аммонийной и увеличение – в нитратной форме, что может свидетельствовать об усилении процесса нитрификации. Высвобождение глифосата не сопровождалось негативным влиянием на длину и биомассу растений пшеницы. Полученные результаты свидетельствуют о том, что внесение фосфорных удобрений в почвы, загрязненные глифосатом, может сопровождаться увеличением риска миграции гербицида в сопредельные среды.
Список литературы
Гамзиков Г.П. Прогноз обеспеченности почв азотом и потребности полевых культур в азотных удобрениях // Инновации и продовольственная безопасность. 2015. № 3. С. 11–20.
ГОСТ 26204 Почвы. Определение подвижных соединений фосфора и калия по методу Чирикова в модификации ЦИНАО.
ГОСТ 26207 Почвы. Определение подвижных соединений фосфора и калия по методу Кирсанова в модификации ЦИНАО.
Железова А.Д., Тхакахова А.К., Ярославцева Н.В., Гарбуз С.А., Лазарев В.И., Когут Б.М., Кутовая А.В., Холодов В.А. Микробиологические показатели агрегатов типичных черноземов в многолетних полевых опытах // Почвоведение. 2017. № 6. С. 711–717. https://doi.org/10.7868/S0032180X17060120
Железова А.Д., Манучарова Н.А., Горленко М.В. Структурные и функциональные характеристики прокариотного комплекса дерново-подзолистой почвы под воздействием гербицида глифосата // Вестник Моск. ун-та. Сер. 17, почвоведение. 2018. № 2. С. 48–54.
Классификация и диагностика почв СССР. М.: Колос, 1977. 223 с.
Куликова Н.А., Лебедева Г.Ф. Гербициды и экологические аспекты их применения. Книжный дом “ЛИБРОКОМ”. М., 2015. 152 с.
Практикум по агрохимии / Под ред. Минеева В.Г. М.: Изд-во Моск. ун-та, 2001. 689 с.
Свиридов А.В., Шушкова Т.В., Ермакова И.Т., Иванова Е.В., Эпиктетов Д.О., Леонтьевский А.А. Микробная деградация гербицида глифосата (обзор) // Прикладная биохимия и микробиология. 2015. № 2. С. 183–190.
Теория и практика химического анализа почв / Под ред. Воробьевой Л.А. М.: ГЕОС, 2006. 400 с.
Allegrini M., Gomez E. del V., Zabaloy M.C. Repeated glyphosate exposure induces shifts in nitrifying communities and metabolism of phenylpropanoids // Soil Biol. Biochem. 2017. V. 105. P. 206–215. https://doi.org/10.1016/j.soilbio.2016.11.024
Aparicio V.C., Geronimo E.De, Marino D., Primost J., Carriquiriborde P., Costa J.L. Environmental fate of glyphosate and aminomethylphosphonic acid in surface waters and soil of agricultural basins // Chemosphere. 2013. V. 93. P. 1866–1873. https://doi.org/10.1016/j.chemosphere.2013.06.041
Araujo A.S.F., Monteiro R.T.R., Abarkeli R.B. Effect of glyphosate on the microbial activity of two Brazilian soils // Chemosphere. 2003. V. 52. P. 799–804. https://doi.org/10.1016/S0045-6535(03)00266-2
Banks M.L., Kennedy A.C., Kremer R.J., Eivazi F. Soil microbial community response to surfactants and herbicides in two soils // Appl. Soil Ecology. 2014. V. 74. P. 12–20. https://doi.org/10.1016/j.apsoil.2013.08.018
Benbrook Ch.M. Trends in glyphosate herbicide use in the United States and globally // Environ. Sci. Europe. 2016. 28:3. https://doi.org/10.1186/s12302-016-0070-0
Borggaard O.K., Gimsing L. Fate of glyphosate in soil and the possibility of leaching to ground and surface waters: a review // Pest Management Science. 2008. V. 64. P. 441–456. https://doi.org/10.1002/ps.1512
Bott S., Tesfamariam T., Kania A., Eman B., Aslan N., Römheld V., Neumann G. Phytotoxicity of glyphosate soil residues re-mobilised by phosphate fertilization // Plant and Soil. 2011. V. 342. P. 249–263. https://doi.org/10.1007/s11104-010-0689-3
Chen X., Jiang N., Chen Z., Tian J., Sun N., Xu M., Chen L. Response of soil phoD phosphatase gene to long-term combined applications of chemical fertilizers and organic materials // Appl. Soil Ecology. 2017. V. 119. P. 197–204. https://doi.org/10.1016/j.apsoil.2017.06.019
Cherni A.E., Trabelsi D., Chebil S., Barhoumi F., Rodríguez-Llorente I.D., Zribi K. Effect of glyphosate on enzymatic activities, Rhizobiaceae and total bacterial communities in an agricultural Tunisian soil // Water, Air and Soil Pollution. 2015. V. 226. P. 145. https://doi.org/10.1007/s11270-014-2263-8
Damin V., Franco H.C.J., Moraes M.F., Franco A., Trivelin P.C.O. Nitrogen loss in Brachiaria decumbens after application of glyphosate or glufosinate-ammonium // Scientia Agricola. 2008. V. 65. P. 402–407.
de Jonge H., de Jonge L.W., Jacobsen O.H., Yamaguchi T., Moldrup P. Glyphosate sorption in soils of different pH and phosphorus content // Soil Sci. 2001. V. 166. P. 230–238.
Dick R.E., Quinn J.P. Glyphosate-degrading isolates from environmental samples: occurrence and pathways of degradation // Appl. Microbiol. Biotechnol. 1995. V. 43. P. 545–550. https://doi.org/10.1007/BF00218464
Druart C., Delhomme O., de Vaufleury A., Ntcho E., Millet M. Optimization of extraction procedure and chromatographic separation of glyphosate, glufosinate and aminomethylphosphonic acid in soil // Analytical and Bioanalytical Chemistry. 2011. V. 399. P. 1725–1732. https://doi.org/10.1007/s00216-010-4468-z
Erban T., Stehlik V., Sopko B., Markovic M., Seifrtova M., Halesova T., Kovaricek P. The different behaviors of glyphosate and AMPA in compost-amended soil // Chemosphere. 2018. V. 207. P. 78–83. https://doi.org/10.1016/j.chemosphere.2018.05.004
Ermakova I.T., Shushkova T., Leontievsky A.A., Kise-leva N.I., Zharikov M., Zharikov G.A. Bioremediation of glyphosate-contaminated soils // Appl. Microbiol. Biotechnol. 2010. V. 88. № 2. P. 585–594. https://doi.org/10.1007/s00253-010-2775-0
Ermakova I.T., Shushkova T.V., Sviridov A.V., Zelenkova N.F., Vinokurova N.G., Baskunov B.P., Leontievsky A.A. Organophosphonates utilization by soil strains of Ochrobactrum anthropi and Achromobacter sp. // Archives of Microbiology. 2017. V. 199. P. 665–675. https://doi.org/10.1007/s00203-017-1343-8
Fan J., Yang G., Zhao H., Shi G., Geng Y., Hou T., Yao K. Isolation, identification and characterization of a glyphosate-degrading bacterium, Bacillus cereus CB4, from soil // J. Gener. Appl. Microbiol. 2012. V. 58. P. 263–271. https://doi.org/10.2323/jgam.58.263
Fierer N., Jackson J.A., Vilgalys R., Jacksson R.B. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays // Appl. Environ. Microbiol. 2005. V. 71. P. 4117–4120. https://doi.org/10.1128/AEM.71.7.4117
Fraser T.D., Lynch D.H., Gaiero J., Khosla K., Dunfield K.E. Quantification of bacterial non-specific acid (phoC) and alkaline (phoD) phosphatase genes in bulk and rhizosphere soil from organically managed soybean fields // Appl. Soil Ecology. 2017. V. 111. P. 48–56. https://doi.org/10.1016/j.apsoil.2016.11.013
Gimsing A.L., Borggaard O.K. Effect of phosphate on the adsorption of glyphosate on soils, clay minerals and oxides // Int. J. Environ. Anal. Chem. 2002. V. 82. P. 545–552
Gimsing A.L., Borggaard O.K., Bang M. Influence of soil composition on adsorption of glyphosate and phosphate by contrasting Danish surface soils // Eur. J. Soil Sci. 2004. V. 55. P. 183–191. https://doi.org/10.1046/j.1365-2389.2003.00585.x
Gimsing A.L., Szilas C., Borggaard O.K. Sorption of glyphosate and phosphate by variable-charge tropical soils from Tanzania // Geoderma. 2007. V. 138. P. 127–132.https://doi.org/10.1016/j.geoderma.2006.11.001
Glyphosate Issue Paper: Evaluation of Carcinogenic Potential. USA: EPA, 2016. 227 P.
Gomes M.P., Maccario S., Lucotte M., Labrecque M., Juneau Ph. Consequences of phosphate application on glyphosate uptake by roots: impacts for environmental management practices // Sci. Total Environ. 2015. V. 537. P. 115–119. https://doi.org/10.1016/j.scitotenv.2015.07.054
ISO 10694:1995 Soilquality – Determination of organic and total carbon after dry combustion (elementary analysis).
IUSS Working GroupWRB. World Reference Base for Soil Resources 2014, International soil classification system for naming soils and creating legends for soil maps // FAO. World Soil Resources Reports. 2014. V. 106. 203 p.
Kanissery R.G., Welsh A., Sims G.K. Effect of soil aeration and phosphate addition on the microbial bioavailability of carbon-14-glyphosate // J. Environ. Quality. 2015. V. 44. P. 137–144. https://doi.org/10.2134/jeq2014.08.0331
Kryuchkova Y.V., Burygin G.L., Gogoleva N.E., Gogolev Y.V., Chernyshova M.P., Makarov O.E., Fedorov E.E., Turkovskaya O.V. Isolation and characterization of a glyphosate-degrading rhizosphere strain, Enterobacter cloacae K7 // Microbiol. Res. 2014. V. 169. P. 99–105. https://doi.org/10.1016/j.micres.2013.03.002
la Cecilia D., Maggi F. Analysis of glyphosate degradation in a soil microcosm // Environmental Pollution. 2018. V. 233. P. 201–207. https://doi.org/10.1016/j.envpol.2017.10.017
Lancaster S.H., Hollister E.B., Senseman S.A., Gentry T.J. Effects of repeated glyphosate applications on soil microbial community composition and the mineralization of glyphosate // Pest Manag. Sci. 2010. V. 66. P. 59–64. https://doi.org/10.1002/ps.1831
Munira S., Farenhorst A., Flaten D., Grant C. Phosphate fertilizer impacts on glyphosate sorption by soil // Chemosphere. 2016. V. 153. P. 471–477. https://doi.org/10.1016/j.chemosphere.2016.03.028
Nguyen D.B., Rose M.T., Rose T.J., Morris S.G., van Zwieten L. Impact of glyphosate on soil microbial biomass and respiration: a meta-analysis // Soil Biol. Biochem. 2016. V. 92. P. 50–57. https://doi.org/10.1016/j.soilbio.2015.09.014
Newman M.M., Hoilett N., Lorenz N., Dick R.P., Liles M.R., Ramsier C., Kloepper J.W. Glyphosate effects on soil rhizosphere-associated bacterial communities // Sci. Total Environ. 2016. V. 543. P. 155–160. https://doi.org/10.1016/j.scitotenv.2015.11.008
Okada E., Costa J.L., Bedmar F. Glyphosate dissipation in different soils under no-till and conventional tillage // Pedosphere. 2017. https://doi.org/10.1016/S1002-0160(17)60430-2
Ololade I.A., Oladoja N.A., Oloye F.F., Alomaja F., Akerele D.D., Iwaye J., Aikpokpodion P. Sorption of glyphosate on soil components: the roles of metal oxides and organic materials // Soil and Sediment Contamination. 2014. V. 23. P. 571–585. https://doi.org/10.1080/15320383.2014846900
Pipke R., Amrhein N. Carbon-phosphorus lyase activity in permeabilized cells of Arthrobacter sp. GLP-1 // FEBS Lett. 1988. V. 236. P. 135–138. https://doi.org/10.1016/0014-5793(88)80301-6
Powell J.R., Levy-Booth D.J., Gulden R.H., Asbil W.L., Campbell R.G., Dunfield K.E., Hamill A.S., Hart M.M., Lerat S., Nurse R.E., Pauls K.P., Sikkema P.H., Swanton C.J., Trevors J.T., Klironomos J.N. Effects of genetically modified, herbicide-tolerant crops and their management on soil food web properties and crop litter decomposition // J. Appl. Ecology. 2009. V. 46. P. 388–396. https://doi.org/10.1111/j.1365-2664.2009.01617.x
Ragot S.A., Kertesz M.A., Bünemann E.K. phoD alkaline phosphatase gene diversity in soil // Appl. and Environmental Microbiology. 2015. V. 81. P. 7281–7289. https://doi.org/10.1128/aem.01823-15
Santos A., Flores M. Effects of glyphosate on nitrogenfixation of free-living heterotrophic bacteria // Lett. Appl. Microbiol. 1995. V. 20. P. 349–352. https://doi.org/10.1111/j.1472-765X.1995.tb01318.x
Shehata A., Kühnert M., Haufe S., Krüger M. Neutralization of the antimicrobial effect of glyphosate by humic acid in vitro // Chemosphere. 2014. V. 104. P. 258–261. https://doi.org/10.1016/j.chemosphere.2013.10.064
Sidoli P., Baran N., Angulo-Jaramillo R. Glyphosate and AMPA adsorption in soils: laboratory experiments and pedotransfer rules // Environ. Sci. Poll. Res. 2016. V. 23. P. 5733–5742. https://doi.org/10.1007/s11356-015-5796-5
Silva V., Montanarella L., Jones A., Fernández-Ugalde O., Mol H.G.J., Ritsema C.J., Geissen V. Distribution of glyphosate and aminomethylphosphonic acid (AMPA) in agricultural topsoils of the European Union // Sci. Total Environ. 2018. V. 621. P. 1352–1359. https://doi.org/10.1016/j.scitotenv.2017.10.09
Stratton G.W., Stewart K.E. Effects of the herbicide glyphosate on nitrogen cycling in an acid forest soil // Water, Air, and Soil Pollution. 1991. V. 60. P. 231–247. https://doi.org/10.1007/BF00282625
Székács A., Darvas B. Forty years with glyphosate. In: Herbicides – properties, synthesis and control of weeds. Croatia: InTech, 2012. P. 247–284. https://doi.org/10.5772/32491
Tejada M. Evolution of soil biological properties after addition of glyphosate, diflufenican and glyphosate + + diflufenican herbicides // Chemosphere. 2009. V. 76. P. 365–373. https://doi.org/10.1016/j.chemosphere.2009.03.040
Wang C., Lin X., Li L., Lin L., Lin S. Glyphosate shapes a dinoflagellate-associated bacterial community while supporting algal growth as sole phosphorus source // Frontiers Microbiol. 2017. V. 8. https://doi.org/10.3389/fmicb.2017.02530
Chen M.X., Cao Z.Y., Jiang Y., Zhu Z.W. Direct determination of glyphosate and its major metabolite, aminomethylphosphonic acid, in fruits and vegetables by mixed-mode hydrophilic interaction/weak anion-exchange liquid chromatography coupled with electrospray tandem mass spectrometry // J. Chromatography A. 2013. V. 1272. P. 90–99. https://doi.org/10.1016/j.chroma.2012.11.069
Yao M., Henny C., Maresca J.A. Freshwater bacteria release methane as a by-product of phosphorus acquisition // Appl. and Environmental Microbiology. 2016. V. 82. P. 6994–7003. https://doi.org/10.1128/AEM.02399-16
Zabaloy M.C., Garland J.L., Gomez M.A. An integrated approach to evaluate the impacts of the herbicides glyphosate, 2,4-D and metsulfuron-methyl on soil microbial communities in the Pampas region, Argentina // Appl. Soil Ecology. 2012. V. 40. P. 1–12. https://doi.org/10.1016/j.apsoil.2008.02.004
Zabaloy M.C., Zanini G.P., Bianchinotti V., Gomez M.A., Garland J.L. Herbicides in the soil environment: linkage between bioavailability and microbial ecology // Herbicides, Theory and Applications. Croatia: InTech, 2011. P. 161–192. https://doi.org/10.5772/12880
Zhan H., Feng Y., Fan X., Chen S. Recent advances in glyphosate biodegradation // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 5033–5043. https://doi.org/10.1007/s00253-018-9035-0
Дополнительные материалы отсутствуют.


