Почвоведение, 2020, № 6, стр. 716-725
Микробные сообщества межледниковых и интерстадиальных палеопочв позднего плейстоцена
М. В. Семенов a, *, Т. И. Чернов a, А. Д. Железова a, Д. А. Никитин a, А. К. Тхакахова a, Е. А. Иванова a, Н. А. Ксенофонтова a, b, С. А. Сычева c, Т. В. Колганова d, О. В. Кутовая a
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
b МГУ им. М.В. Ломоносова
111991 Москва, Ленинские горы, 1, Россия
c Институт географии РАН
119017 Москва, Старомонетный пер., 29, Россия
d Институт биоинженерии, ФИЦ “Фундаментальные основы биотехнологии” РАН
119071 Москва, Ленинский пр-т, 33, стр. 2, Россия
* E-mail: mikhail.v.semenov@gmail.com
Поступила в редакцию 28.08.2019
После доработки 15.09.2019
Принята к публикации 27.12.2019
Аннотация
Проанализирована таксономическая структура микробных сообществ разновозрастных позднеплейстоценовых палеопочв на среднерусской возвышенности, сформированных при контрастных климатических условиях. Рассматривались гумусовые горизонты палеопочв интерстадиалов ранневалдайского (105–95 тыс. лет) и средневалдайского (33–24 тыс. лет) возраста, микулинского межледниковья (130–117 тыс. лет), а также современный чернозем. Анализ микробной ДНК проводили при помощи количественной полимеразной цепной реакции и секвенирования ампликонов гена 16S рРНК (ДНК-метабаркодинга). Численность копий генов архей, бактерий и грибов последовательно уменьшалась с увеличением возраста почвы. Все рассматриваемые палеопочвы значительно отличались друг от друга по структуре микробных сообществ. Соотношение филумов Verrucomicrobia и Nitrospirae выступало в качестве диагностического показателя, указывающего на обеспеченность органическим веществом, а также на произошедшие изменения в циклах углерода и азота. По сравнению с современным черноземом типичным и палеопочвами микулинского межледниковья, соотношение Verrucomicrobia/Nitrospirae в интерстадиальных почвах было меньше в 140–200 раз. С возрастом почвы увеличивалась доля грамотрицательных протеобактерий и ацидобактерий и снижалась доля грамположительных актинобактерий и фирмикут. Современный чернозем и палеопочвы межледниковья характеризовались схожими значениями микробного разнообразия, тогда как в палеопочвах валдайских интерстадиалов разнообразие и видовое богатство микроорганизмов были значительно ниже. Согласно анализу β-разнообразия, палеопочвы разного типа и возраста в соответствии с условиями своего формирования поддерживают разную структуру и разнообразие микробных сообществ. Микробные сообщества могут выступать в качестве стратиграфических маркеров и индикаторов различных климатических условий, в которых формировались палеопочвы.
ВВЕДЕНИЕ
Палеопочвы сформировались под воздействием природных условий, существовавших в геологическом прошлом [5, 18]. Если палеопочвы захоронены на значительной глубине (глубже 2–3 м), они изолированы от активного воздействия современных факторов почвообразования и представляют собой относительно стабильные системы, способные сохранять информацию о природных особенностях предыдущих эпох [6, 24, 39, 42]. Изучение палеопочв позволяет реконструировать палеоэкологические условия (климат, ландшафт и биоту), существовавшие во время почвообразования, предшествующего погребению [11, 13, 24, 38]. Структура и разнообразие микробных сообществ палеопочв считаются одним из перспективных диагностических показателей при реконструкции климата и природных условий [9, 21, 39, 42], поскольку микроорганизмы являются чувствительными индикаторами состояния почвы и биогеоценоза в целом [3, 23]. Несмотря на изолированное состояние, микроорганизмы в палеопочвах сохраняют свою активность. Это связано с тем, что в данных объектах часто поддерживается относительно высокая влажность из-за капиллярной влаги, образующейся на границе слоев разного гранулометрического состава и/или близкого расположения грунтовых вод [1]. В палеопочвах сохраняется достаточное количество органического вещества (больше 1%) [7, 10], при этом невелика сезонная амплитуда колебания температур [1], что способствует сохранению микробных сообществ.
С помощью методов микроскопии, газовой хроматографии и культивирования микроорганизмов произведено множество исследований по составу и активности микробиома голоценовых палеопочв [8, 12, 20]. Показано, что погребенные гумусовые горизонты превышают по численности, биомассе и видовому разнообразию минеральные [7, 12] и могут быть сопоставимы с гумусовыми горизонтами современных почв [4]. По уровню биомассы и эмиссии CO2 погребенные почвы зачастую близки к современным [16], однако соотношения экологических групп микроорганизмов в погребенных и современных почвах существенно отличаются [8]. Палеопочвы сохраняют значительное количество ДНК даже по прошествии 5000 лет погребения [2, 3]. Применение молекулярно-генетических методов выявило снижение численности и разнообразия микроорганизмов в палеопочвах, а также значительное отличие таксономической структуры прокариот по сравнению с современными почвами [22, 39]. Оказалось, что в погребенных почвах крайне мала доля бактериального филума Verrucomicrobia [22], представители которого не выявляются в этих объектах с помощью методов классической микробиологии.
Несмотря на длительное изучение состояния погребенных почв, продолжает оставаться актуальным вопрос о применимости численности и таксономического состава микробиома этих объектов в качестве маркеров для диагностики палеопочв разного типа и возраста [22]. Для почв, погребенных под археологическими земляными сооружениями относительно небольшого возраста (1500–1700 лет до н. э. и 400–500 лет н. э.), не удалось выявить каких-либо маркерных черт микробиома для индикации разных типов погребенных почв [22].
Наше исследование проведено для значительно более древних почв, чем голоценовые – позднеплейстоценовых палепочв межледниковья и двух интерстадиалов, т.е. кратковременных периодов потепления во время оледенения (130–117, 105–95 и 33–24 тыс. л. н. соответственно). Предполагали, что данные микробиологические показатели могут приобрести диагностическую роль при рассмотрении таких палеопочв, контрастно различающихся по климатическим и флористическим условиям во время их формирования. Проанализировали таксономическую структуру микробных сообществ ряда палеопочв на территории Курской области, вскрытых в Александровском карьере и отличавшихся погребением при разных климатических условиях – микулинском межледниковье и интерстадиалах валдайского оледенения.
ОБЪЕКТЫ И МЕТОДЫ
Почвы. Александровский карьер расположен в 10 км к югу от г. Курска, на междуречье рек Сеймы и Млодати, между двумя верховьями балки Кукуев лог. Мощность позднеплейстоценовой лёссово-почвенной толщи превышает 12 м. В карьере вскрыта палеобалка, в днище и на склонах которой развита межледниковая Рышковская палеопочва [17, 18]. В заполнении палеобалки залегают четыре интерстадиальные палеопочвы (сформированные во время интерстадиалов – кратковременных периодов потепления во время оледенения), чередующиеся с валдайскими лёссами и делювиально-солифлюкционными отложениями [15, 45]. Для анализа взяты образцы гумусовых горизонтов почв разного возраста: ледниковых интерстадиалов ранневалдайского (Кукуевская почва – 105–95 тыс. лет) и средневалдайского (Брянская почва – 33–24 тыс. лет) возраста; почва микулинского межледниковья (Рышковская – 130–117 тыс. лет) на склоне и на дне палеобалки; современная почва (чернозем типичный) (табл. 1) [14]. Образцы почв отобрали в трехкратной физической повторности. Содержание органического углерода (Сорг) и общего азота (Nобщ) в почве определяли на автоматическом HCNS-анализаторе Leco 932 (США). Величину ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ измеряли потенциометрическим способом при соотношении почва : вода, равном 1 : 2.5.
Таблица 1.
Возраст исследуемых почв [14]
| Индекс | Почва | Период | Возраст почвы, тыс. л. н |
|---|---|---|---|
| C | Чернозем типичный, Haplic Chernozem (Loamic, Pachic) | Голоцен | 10.3–0 |
| B | Брянская палеопочва | Средневалдайский интерстадиал | 33–24 |
| K | Кукуевская палеопочва | Ранневалдайский интертадиал | 105–95 |
| R1 | Рышковская палеопочва на склоне палеобалки | Микулинское межледниковье | 130–117 |
| R2 | Рышковская палеопочва в днище палеобалки | Микулинское межледниковье | 130–117 |
Экстракция тотальной ДНК из почв. Почвенную ДНК экстрагировали из образцов массой 0.2 г с помощью набора PowerSoil DNA Isolation Kit (MO BIO Laboratories, США) согласно протоколу производителя. До выделения ДНК образцы хранили при −70°C. Первичную обработку почвенных образцов проводили с использованием гомогенизатора Precellys 24 (BertinTechnologies, Франция).
Количественную оценку содержания рибосомальных генов бактерий, архей и грибов осуществляли методом полимеразной цепной реакции (ПЦР) в реальном времени. Для учета архей и бактерий использовали праймеры на ген 16S рРНК, для учета грибов – на регион ITS. Реакцию проводили в амплификаторе Real-Time CFX96 Touch (“Bio-Rad”). Реакционную смесь готовили из препарата SuperMix Eva Green (“Bio-Rad”). В качестве количественных стандартов концентрации генов 16S рРНК для бактерий использовали растворы клонированных фрагментов рибосомального оперона штамма К12 Esherichia coli, для архей – штамма FG-07 Halobacterium salinarum, для грибов – штамма дрожжей Saccharomyces cerevisae Meyen 1B-D1606. Для каждого образца реакцию проводили в трех повторностях. Концентрацию генов рассчитывали с помощью программного обеспечения CFX Manager. Концентрацию генов в препаратах ДНК пересчитывали в количество генов на 1 г почвы с учетом разведений и массы навески.
ДНК-метабаркодинг. Для проведения анализа проводили амплификацию региона V4 гена 16S рРНК с использованием универсальных прямого и обратного праймеров 515F и 806R [27]. После получения ампликонов библиотеки очищали и смешивали эквимолярно с помощью набора SequalPrep™ Normalization Plate Kit (Thermo Fisher Scientific, Waltham, США). Результирующий пул библиотек проверяли на капиллярном электрофорезе и затем секвенировали на приборе Illumina MiSeq.
Биоинформатический анализ результатов секвенирования. Обработку данных секвенирования осуществляли с помощью программ QIIME 1.9 [26]. Прямые и обратные чтения, имеющие перекрытие не менее 180 нуклеотидов, объединяли при помощи алгоритма fastq-join, далее работали с объединенными ридами. С помощью QIIME проводили проверку качества секвенирования. Сиквенсы объединяли в операционные таксономические единицы (ОТЕ) на основе критерия 97% сходства нуклеотидного состава. Удаляли синглтоны (ОТЕ, содержащих только один сиквенс) и последовательности генов 16S рРНК хлоропластов и митохондрий.
Определение таксономической принадлежности ОТЕ проводили с использованием базы данных SILVA v.128. Статистические анализы проводили с использованием программ QIIME, Microsoft Excel и Statistica. Для оценки общего разнообразия (α‑разнообразия) микробных сообществ рассчитывали следующие показатели: количество обнаруженных ОТЕ, индекс Chao1 (оценка реального числа ОТЕ в микробиоме) и индекс Шеннона. Для оценки сходства микробиомов друг с другом (β-разнообразия) использовали метрику weighted UniFrac [35]. Визуализацию результатов анализа β-разнообразия проводили при помощи метода главных компонент в двумерном пространстве.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химические свойства почв. Содержание органического углерода в палеопочвах варьировало в диапазоне от 0.45 до 0.72%. Наименьшие запасы органического углерода (0.45%) выявлены в самой молодой из исследуемых палеопочв – средневалдайского интерстадиала (33–24 тыс. лет), в то время как в наиболее древней палеопочве микулинского межледниковья значения этого показателя в полтора раза больше – 0.63%. Разное количество органического углерода в палеопочвах, прежде всего, связано с его изначальным запасом, т.е. с генезисом почв и, соответственно, с растительностью и климатом [13]. Значительное влияние на сохранение органического вещества также оказывают локальные условия захоронения почвы [37–39]. Межледниковая почва сформирована в гораздо более продолжительный и теплый период по сравнению с интерстадиальными почвами [18], поэтому для нее были характерны более высокие значения содержания углерода и численности микроорганизмов. По сравнению с палеопочвами, содержание органического углерода в современном черноземе оказалось на порядок больше – 7.46% (табл. 2). Таким образом, вне зависимости от возраста, исследованные захороненные почвы теряют более 90% запасов органического углерода, при этом сохраняя его на относительно стабильном уровне в течение длительного срока, что согласуется с результатами предыдущих работ [7, 10].
Таблица 2.
Химический состав почв
| Почва | Сорг, % | рН | ${\text{Ca}}_{{{\text{обм}}}}^{{2 + }}$ | ${\text{Mg}}_{{{\text{обм}}}}^{{2 + }}$ | |
|---|---|---|---|---|---|
| H2O | KCl | смоль(экв)/кг | |||
| Рышковская | 0.63 | 7.6 | 7.5 | 17.5 | 2.8 |
| Кукуевская | 0.72 | 8.1 | 7.6 | 16.0 | 6.8 |
| Брянская | 0.45 | 7.6 | 7.5 | 25.5 | 2.4 |
| Современная | 7.46 | 7.1 | 6.9 | 18.0 | 7.5 |
Основная часть рассматриваемых почв характеризовалась слабощелочной реакцией среды, исключением стала палеопочва ранневалдайского интерстадиала (pH 8.1) (табл. 2). Исследованные палеопочвы характеризовались высоким содержанием обменных ионов кальция (17.5–25.5 смоль(экв)/кг) и магния (2.4–6.8 смоль(экв)/кг для Mg2+), что может быть связано с обилием карбонатных солей, типичных для палеочерноземов [34].
Наиболее представленными фракциями в гранулометрическом составе палеопочв являлись крупная пыль (0.05–0.01 мм) и ил (<0.001 мм), на долю которых приходилось 35–60 и 28–44% (табл. 3). Таким образом, микроорганизмы рассматриваемых палеопочв должны существовать в условиях недостатка кислорода из-за преобладания мелкодисперсных частиц.
Таблица 3.
Гранулометрический состав почв
| Почва | Содержание фракций (мм), % | ||||||
|---|---|---|---|---|---|---|---|
| 1–0.25 | 0.25–0.05 | 0.05–0.01 | 0.01–0.005 | 0.005–0.001 | <0.001 | <0.01 | |
| Рышковская | 0.5 | 1.2 | 49.0 | 10.6 | 11.0 | 27.7 | 49.3 |
| Кукуевская | 0.1 | 0.2 | 46.1 | 9.5 | 10.7 | 33.4 | 53.6 |
| Брянская | 0.2 | 0.0 | 34.6 | 9.3 | 12.1 | 43.8 | 65.2 |
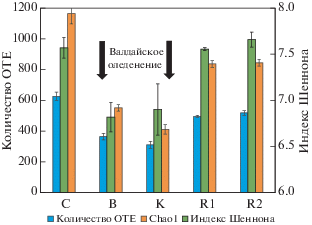
Численность копий рибосомальных генов прокариот и грибов. Наибольшая численность копий рибосомальных генов на грамм сухой почвы выявлена в современном черноземе, составляя 3.1 × 1011 ‒ для бактерий, 5.4 × 1010 ‒ для архей и 2.6 × 1010 ‒ для грибов соответственно. Данные показатели численности микробных генов достаточно велики даже в сравнении со значениями для других типичных черноземов [43]. В исследованных палеопочвах численность рибосомальных генов была на три порядка меньше по сравнению с современной почвой, снижаясь с увеличением возраста почвы (рис. 1). Наименьшая численность микроорганизмов выявлена в палеопочве микулинского межледниковья на склоне палеобалки: 1.6 × 108 генов бактерий, 9.7 × 107 генов архей и 2.5 × 107 генов грибов (рис. 2). Таким образом, несмотря на длительную изоляцию в течение около 117 тыс. лет, недостаток органического вещества, влаги и аэрации, содержание микроорганизмов в палеопочвах лишь сокращается, но не исчезает полностью. Численность микроорганизмов в исследуемых палеопочвах была на 1–2 порядка ниже, чем для относительно недавно захороненных палеопочв бронзового века (1500‒1700 лет до н. э.) и раннего Средневековья (400‒500 лет н. э.) [22]. Палеопочва последнего средневалдайского интерстадиала характеризовалась схожей численностью копий генов архей и бактерий с минеральными горизонтами B и С современных черноземов, а остальные рассматриваемые палеопочвы лишь незначительно уступали им [43]. Основное различие по численности генов между палеопочвами и минеральными горизонтами современных почв проявлялось для грибных сообществ, количество копий которых в палеопочвах снижалось на порядок [43].
Рис. 1.
Численность копий генов архей, бактерий и грибов в погребенных почвах Александровского карьера и в фоновой современной почве. Здесь и далее: С – современный чернозем; B – палеопочва средневалдайского интерстадиала; K – палеопочва ранневалдайского интерстадиала; R1 – палеопочва микулинского межледниковья склона палеобалки; R2 – палеопочва микулинского межледниковья днища палеобалки.

Рис. 2.
Таксономическая структура микробиомов погребенных почв Александровского карьера на уровне филумов.
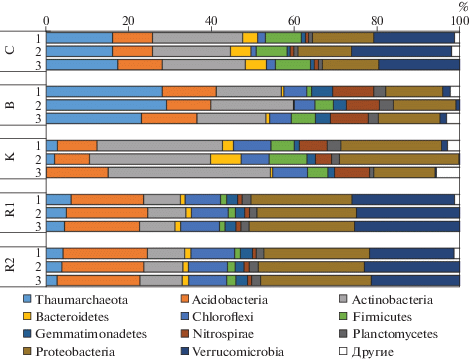
Таксономическая структура микробных сообществ современного чернозема и палеопочв. После обработки данных и формирования ОТЕ получено 78 065 сиквенсов (от 2329 до 10 890 сиквенсов на образец). Медианная длина сиквенсов – 300 нуклеотидов. Современный чернозем характеризовался доминированием 7 основных филумов прокариот: Thaumarchaeota (16.4%), Acidobacteria (10.0%), Actinobacteria (20.0%), Proteobacteria (13.7%), Verrucomicrobia (20.9%), Firmicutes (8.1%). Подобное распределение представленности филумов, в котором доминируют археи, актинобактерии и веррукомикробии, является характерным для черноземных почв [43].
Рассматриваемые палеопочвы значительно отличались по структуре микробных сообществ как от современного чернозема, так и друг от друга. В целом, с возрастом почвы увеличивалась доля грамотрицательных Proteobacteria и Acidobacteria и снижалась доля грамположительных бактерий – Actinobacteria и Firmicutes (рис. 2). Палеопочва средневалдайского интерстадиала характеризовалась наибольшей долей Thaumarchaeota (26.5%), Nitrospirae (9%) и Gemmatimonadets (4.0%), а также низкой представленностью Bacteroidetes (0.6%) и Verrucomicrobia (1.5%). Палеопочва ранневалдайского интерстадиала отличалась низкой численностью Thaumarchaeota (1.7%) и Verrucomicrobia (0.7%), и высокой представленностью Actinoba-cteria (32.7%). Палеопочва микулинского межледниковья характеризовалась высокой долей Verrucomicrobia (21%), Acidobacteria (20%) и Chloroflexi (9.6%), но малой представленностью Actinobacteria (9.4%).
Главным отличием обеих палеопочв валдайских интерстадиалов были крайне низкие доли (0.7 и 1.5%) представителей филума Verrucomicrobia, которые доминировали в современном черноземе (21%) и палеопочве межледниковья (25%), а также значительным развитием бактерий филума Nitrospirae. Вопрос о факторах, ответственных за распределение Verrucomicrobia в почвах до сих пор остается открытым. В исследуемых палеопочвах в группе Verrucomicrobia преобладал порядок Chthoniobacteriales, представители которого являются сахаролитиками [31]. Долгое время веррукомикробии считались олиготрофной группой, способной расти в средах с низкой доступностью углерода [28, 29, 44] и приуроченной луговым экосистемам [25]. Тем не менее, последние исследования демонстрируют, что Verrucomicrobia широко представлены в лесных экосистемах, а их распределение определяется направлением потоков углерода и растительным покровом [30, 43]. Численность веррукомикробий также уменьшается при распашке и остро реагирует на сокращение содержания органического вещества почвы [40, 43]. Таким образом, значительное снижение представленности Verrucomicrobia в интерстадиальных палеопочвах валдайского оледенения может свидетельствовать о неблагоприятных биоклиматических условиях, низкой активности цикла углерода и запасов органического вещества в почвах интерстадиалов валдайского оледенения.
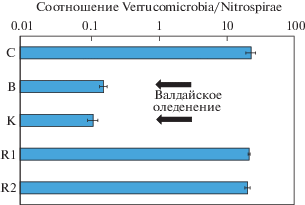
Палеопочвы интерстадиалов валдайского оледенения также характеризовались широким распространением бактерий рода Nitrospira (филума Nitrospirae), доля которого выросла в этих почвах в 9 и 7 раз соответственно. Филум Nitrospirae играет ключевую роль в цикле азота [36], проводя вторую стадию нитрификации – окисление нитрита в нитрат [32]. Nitrospira характеризуются гибким метаболизмом, способностью к миксотрофии [32] и высокой адаптированностью к низким концентрациям азота [41]. В отличие от бактерий рода Nitrospira бактерии рода Nitrobacter способны осуществлять вторую стадию нитрификации лишь при высоких концентрациях азота [41]. Поскольку в палеопочвах обоих интерстадиалов не детектировались Nitrobacter, но активно развивались Nitrospira, можно сделать вывод, что во время интерстадиалов почвы характеризовались не только низкими запасами углерода, но и азота. По сравнению с современной почвой и палеопочвами микулинского межледниковья, соотношение Verrucomicrobia/Nitrospirae в интерстадиальных почвах снижалось в 140–200 раз (от 20.9–23.4 до 0.02–0.09) (рис. 3). Низкая представленность Verrucomicrobia и активное распространение Nitrospirae также выявлялись в палеопочвах более молодого (голоценового) возраста [39, 42], поэтому соотношение данных таксонов может выступать в качестве диагностического показателя, указывающего на обеспеченность органическим веществом, а также на произошедшие изменения в циклах углерода и азота.
Рис. 3.
Соотношение Verrucomicrobia/Nitrospirae в составе микробиомов погребенных почв Александровского карьера на уровне филумов.
α-Разнообразие микробных сообществ палеопочв. Наибольшими значениями индексов разнообразия, учитывающих только количество таксонов, характеризовался современный чернозем, в котором было выявлено 627 ОТЕ (рис. 4). В палеопочве микулинского межледниковья детектировалось 496 и 519 ОТЕ, в интерстадиальных Брянской и Кукуевской палеопочвах – 365 и 311 соответственно. Микробные сообщества современного чернозема и палеопочв микулинского межледниковья статистически не различались по индексу Шеннона (7.6), описывающему не только видовое богатство, но и выравненность сообщества. Обе интерстадиальные палеопочвы валдайского оледенения характеризовались резким снижением индекса Шеннона (6.8 и 6.9 соответственно). Таким образом, индексы микробного разнообразия также могут служить маркером, по которому можно разделять палеопочвы, развивавшиеся в условиях интерстадиалов и межледниковий.
Рис. 4.
Индексы α-разнообразия (количество OTE, Chao1 и индекс Шеннона) микробиомов погребенных почв Александровского карьера на уровне филумов.
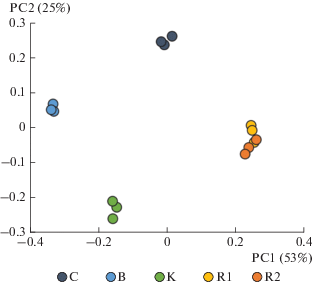
Кластеризация и диагностический потенциал микробных сообществ палеопочв. Согласно сравнительному анализу β-разнообразия прокариотных сообществ, микробиомы всех почв значительно отличаются друг от друга, формируя индивидуальные кластеры (рис. 5). При этом микробиомы образцов палеопочвы микулинского межледниковья, взятых в гумусовых горизонтах с разной глубины на склоне и в днище палеобалки, образуют единый кластер. Полученные результаты свидетельствуют о специфичности микробных сообществ погребенных почв, относящихся к одному и тому же периоду.
Рис. 5.
Двумерные диаграммы сходства микробиомов погребенных почв Александровского карьера по методу главных компонент на основе метрики сходства weighted UniFrac.
На основе полученных кластеров были определены основные группы микроорганизмов, разделяющие почвы по двум главным компонентам при анализе β-разнообразия (табл. 4). В современной почве выявлена повышенная численность бактерий семейства Propionibacteriacea, родов Bacillus и Xiphinematobacter. Род Xiphinematobacter относится к филуму Verrucomicrobia и является эндосимбионтом нематод Xiphinema, ответственным за проведение их партеногенеза (формы полового размножения). В палеопочве средневалдайского интерстадиала ассоциированными таксонами являлись Desulfurellaceae, Gaiella, Paenibacillus и таумархеоты Nitrosopshaera, а ранневалдайского интерстадиала – роды Cohnella и Variovorax. Палеопочва микулинского междледниковья выделялась высокой представленностью ацидобактерий – семейства Acidobacteriaceae (подгруппы 1 и 4), родов Bryobacter и Solibacter. Ассоциированными с данной палеопочвой были также протеобактерии родов Beijerinckiaceae, Methylocystis, Haliangium и Methylobacteriaceae. Также определены таксоны микроорганизмов, наличие которых свойственно палеопочвам обоих интерстадиалов (Брянская и Кукуевская) или обоих периодов межледниковья (Рышковская и современный чернозем). Ассоциированными с обоими периодами межледниковья оказались микроорганизмы Variibacter и Chitinophagaceae, а общими для палеопочв двух интерстадиалов являлись Nitrospira, Comamonadaceae, Methylotenera, Streptomyces и Terrimonas.
Таблица 4.
Микроорганизмы, ассоциированные с рассматриваемыми почвами, а также с группами почв, объединенными по принадлежности к интерстадиалам (Брянская и Кукуевская) и периодам межледниковья (Рышковская и современный чернозем)
| Группа почв | |||||
|---|---|---|---|---|---|
| современная | Брянская | Кукуевская | Рышковская | межледниковые | интерстадиальные |
| Bacillus Xiphinematobacter Propionibacteriaceae |
Desulfurellaceae Gaiella Nitrososphaera Paenibacillus |
Cohnella Variovorax |
Acidobacteriaceae
(Subgroup 1) Blastocatellaceae (RB41) Beijerinckiaceae Bryobacter Methylocystis Solibacter Haliangium Methylobacteriaceae |
Chitinophagaceae Variibacter | Nitrospira Comamonadaceae Methylotenera Streptomyces Terrimonas |
ЗАКЛЮЧЕНИЕ
Численность микробных генов постепенно уменьшается с течением времени после погребения почвы. Соотношение филумов Verrucomicrobia и Nitrospirae может выступать в качестве диагностического показателя, указывающего на обеспеченность органическим веществом, а также на произошедшие изменения в циклах углерода и азота. По сравнению с современной почвой и палеопочвами микулинского межледниковья, соотношение Verrucomicrobia/Nitrospirae в почвах интерстадиалов Валдайского оледенения оказалось ниже в 140–200 раз. С возрастом почвы увеличивается доля грамотрицательных протеобактерий и ацидобактерий, при этом снижается доля грамположительных актинобактерий и фирмикут.
Современный чернозем и почвы микулинского межледниковья характеризуются схожими значениями микробного разнообразия, тогда как в интерстадиальных палеопочвах наблюдается существенное снижение общего разнообразия и количества видов. Согласно анализу β-разнообразия, микробиомы рассматриваемых палеопочв значительно отличаются друг от друга, формируя индивидуальные непересекающиеся кластеры. Структура и разнообразие микробиома могут использоваться в качестве маркеров “биологической памяти” палеопочв четвертичного периода, несущих определенную информацию о биоклиматических условиях до погребения данных почв.
Список литературы
Архангельская Т.А., Прохоров М.В., Мазиров М.А. Годовая динамика температуры пахотных почв палеокриогенных комплексов Владимирского ополья // Криосфера Земли. 2008. № 3. С. 80–86.
Благодатская Е.В., Хохлова О.С., Андерсон Т.Х., Благодатский С.А. Пул экстрагируемой микробной ДНК и микробиологическая активность палеопочв Южного Приуралья // Микробиология. 2003. Т. 72. № 6. С. 847–853.
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество научных изданий КМК, 2016. 243 с.
Борисов А.В., Демкина Т.С., Демкин В.А. Палеопочвы и климат Ергеней в эпоху бронзы IV–II тысячелетия до н. э. М.: Наука, 2006. 210 с.
Величко А.А., Морозова Т.Д. Климаты и ландшафты Северной Евразии в условиях глобального потепления. Ретроспективный анализ и сценарии. М.: ГЕОС, 2010. С. 120–127.
Демкин В.А., Каширская Н.Н., Демкина Т.С., Хомутова Т.Э., Ельцов М.В. Палеопочвенные исследования курганов в долине р. Иловля (Приволжская возвышенность) // Почвоведение. 2008. № 2. С. 133–145.
Демкин В.А., Борисов А.В., Демкина Т.С., Хомутова Т.Э., Золотарева Б.Н., Каширская Н.Н., Демкина Е.В. Степные пирамиды Евразии: уникальный архив голоценовых палеопочв // Палеопочвы и индикаторы континентального выветривания в истории биосферы. Сер. “Геобиологические системы в прошлом”. М.: ПИН РАН, 2010. С. 132–163.
Демкина Т.С., Хомутова Т.Э., Каширская Н.Н., Стретович И.В., Демкин В.А. Микробиологические исследования палеопочв археологических памятников степной зоны // Почвоведение. 2010. № 2. С. 213–220.
Демкина Т.С., Хомутова Т.Э., Каширская Н.Н., Стретович И.В., Демкин В.А. Характеристика микробных сообществ степных подкурганных палеопочв сарматского времени (I‒IV вв. НЭ) // Почвоведение. 2009. № 7. С. 836‒846.
Иванов И.В., Песочина Л.С., Семенов В.М. Биоминерализация органического вещества в современных целинных, пахотных, погребенных и ископаемых черноземах // Почвоведение. 2009. № 10. С. 1192‒1202.
Макеев А.О. Экологическая роль палеопочв в геологической истории Земли. Почвы в биосфере и жизни человека. М.: Изд-во Моск. ун-та. 2012. 183–283 с.
Марфенина О.Е., Сахаров Д.С., Иванова А.Е., Русаков А.В. Микологические свойства голоценовых и позднеплейстоценовых палеогоризонтов и фрагментов палеопочв // Почвоведение. 2009. № 4. С. 469–478.
Морозова Т.Д. Развитие почвенного покрова Европы в позднем плейстоцене. М.: Наука, 1981. 282 с.
Путеводитель научных полевых экскурсий VII съезда Общества почвоведов им. В.В. Докучаева и Всероссийской с зарубежным участием научной конференции Почвоведение – продовольственной и экологической безопасности страны (Белгород, 15–22 августа 2016 г.). М. 2016., 122 с.
Пушкина П.Р., Сычева С.А. Палеопочвы ложбин Среднерусской возвышенности в ранневалдайское время // Почвоведение. 2013. № 4. С. 1037–1046. https://doi.org/10.7868/S0032180X13090098
Русаков А.В., Новиков В.В. Биологическая активность современных и погребенных почв исторического центра Санкт-Петербурга // Микробиология. 2003. № 72(1). С. 117–125.
Сычева С.А. Эволюционный анализ плейстоценовых погребенных малых эрозионных форм // Геоморфология. 1996. № 3. С. 31–38.
Сычева С.А., Гунова В.С. Результаты изучения позднеплейстоценового лёссово-почвенного комплекса в погребенной балочной системе Средне-Русской возвышенности // Бюллетень комиссии по изучению четвертичного периода. № 65. М.: ГЕОС, 2004. С. 86–101.
Сычева С.А. Позднеплейстоценовые мерзлотные феномены в перигляциальной области Русской равнины и их связь с палеопочвами // Проблемы палеогеографии и стратиграфии плейстоцена. М.: Изд-во Моск. ун-та, 2011. Вып. 3. С. 228–237.
Хомутова Т.Э., Демкина Т.С., Демкин В.А. Оценка суммарной и активной микробной биомассы разновозрастных подкурганных палеопочв // Микробиология. 2004. № 2. С. 241–247.
Хомутова Т.Э., Демкина Т.С., Борисов А.В., Шишлина Н.И. Состояние микробных сообществ подкурганных палеопочв пустынно-степной зоны эпохи средней бронзы (XXVII–XXVI вв. до н. э.) в связи с динамикой увлажненности климата // Почвоведение. 2017. № 2. С. 239–248. https://doi.org/10.7868/S0032180X1702006X
Чернов Т.И., Железова А.Д., Кутовая О.В., Макеев А.О., Тхакахова А.К., Бгажбa Н.А., Курбанова Ф.Г., Русаков А.В., Пузанова Т.А., Хохлова О.С. Сравнительная оценка структуры микробиомов погребенных и современных почв при помощи анализа микробной ДНК // Микробиология. 2018. № 6. С. 737–746.
Anderson T.H. Microbial eco-physiological indicators to asses soil quality // Agriculture, Ecosystems Environment. 2003. № 98(1–3). Р. 285–293.
Aseyeva E., Makeev A., Kurbanova F., Kust P., Rusakov A., Khokhlova O., Mihailov E., Puzanova T., Golyeva A. Paleolandscape Reconstruction Based on the Study of A Buried Soil of the Bronze Age in the Broadleaf Forest Area of the Russian Plain // Geosciences. 2019. V. 9(3). P. 111.
Bergmann G.T., Bates S.T., Eilers K.G., Lauber C.L., Caporaso J.G., Walters W.A., Knight R., Fierer N. The under-recognized dominance of Verrucomicrobia in soil bacterial communities // Soil Biol. Biochem. 2011. V. 43(7). P. 1450–1455.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Gonzalez Peña A. et al. QIIME allows analysis of high-throughput community sequencing data // Nature methods. 2010. V. 7(5). P. 335.
Caporaso J.G., Lauber C.L., Walters W.A., Berg-Lyons D., Huntley J., Fierer N., Owens S.M. et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms // ISME J. 2012. V. 6. P. 1621−1624.
da Rocha U.N., Andreote F.D., de Azevedo J.L., van El-sas J.D., van Overbeek L.S. Cultivation of hitherto-uncultured bacteria belonging to the Verrucomicrobia subdivision 1 from the potato (Solanum tuberosum L.) rhizosphere // J. Soil Sediment. 2010. V. 10. P. 326–339.
Eilers K.G., Debenport S., Anderson S., Fierer N. Digging deeper to find unique microbial communities: the strong effect of depth on the structure of bacterial and archaeal communities in soil // Soil Biol. Biochem. 2012. V. 50. P. 58–65.
Fierer N., Ladau J., Clemente J.C., Leff J.W., Owens S.M., Pollard K.S., Knight R., Gilbert J.A., McCulley R.L. Reconstructing the microbial diversity and function of pre-agricultural tallgrass prairie soils in the United States // Science. 2013. V. 342. P. 621–624.
Janssen P.H. Pathway of glucose catabolism by strain VeGlc2, an anaerobe belonging to the Verrucomicrobiales lineage of bacterial descent // Appl. Environ. Microbiol. 1998. V. 64. P. 4830–4833.
Koch O., Tscherko D., Kandeler E. Temperature sensitivity of microbial respiration, nitrogen mineralization, and potential soil enzyme activities in organic alpine soils // Global Biogeochem. Cycles. 2007. V. 21. P. GB4017.
Koch H., Lücker S., Albertsen M., Kitzinger K., Herbold C., Spieck E., Nielsen P.H., Wagner M., Daims H. Expanded metabolic versatility of ubiquitous nitrite-oxidizing bacteria from the genus Nitrospira // Proceedings of the National Academy of Sciences. 2015. V. 112(36). P. 11371–11376.
Kovda I., Sycheva S., Lebedeva M., Inozemtzev S. Variability of carbonate pedofeatures in a loess-paleosol sequence and their use for paleoreconstructions // J. Mountain Sci. 2009. V. 6(2). P. 155–161.
Lozupone C., Lladser M.E., Knights D., Stombaugh J., Knight R. UniFrac: an effective distance metric for microbial community comparison // ISME J. 2011. V. 5(2). P. 169.
Lücker S., Wagner M., Maixner F., Pelletier E., Koch H., Vacherie B., Rattei T., Sinninghe Damsté J.S., Spieck E., Le Paslier D., Daims H. A Nitrospira metagenome illuminates the physiology and evolution of globally important nitrite-oxidizing bacteria // Proceedings of the National Academy of Sciences. 2010. V. 107(30). P. 13479–13484.
Lukens W.E., Nordt L.C., Stinchcomb G.E., Driese S.G., Tubbs J.D. Reconstructing pH of paleosols using geochemical proxies // J. Geology. 2018. V. 126(4). P. 427–449.
Makeev A., Kust P., Lebedeva M., Rusakov A., Terhorst B., Yakusheva T. Soils in the bipartite sediments within the Moscow glacial limits of the Russian Plain: Sedimentary environment, pedogenesis, paleolandscape implication // Quarter. Int. 2017. V. 501. P. 147–173.
Makeev A., Aseeva E., Rusakov A., Sorokina K., Puzanova T., Khokhlova O., Kust P., Kurbanova F., Chernov T., Kutovaya O., Lebedeva M., Mihailov E. The environment of the Early Iron Age at the southern fringe of the forest zone of the Russian Plain // Quarter. Int. 2019. V. 502. P. 218–237.
Navarrete A.A., Soares T., Rossetto R., van Veen J.A., Tsai S.M., Kuramae E.E. Verrucomicrobial community structure and abundance as indicators for changes in chemical factors linked to soil fertility // Antonie van Leeuwenhoek. 2015. V. 108(3). P. 741–752.
Nowka B., Daims H., Spieck E. Comparison of oxidation kinetics of nitrite-oxidizing bacteria: Nitrite availability as a key factor in niche differentiation // Appl. Environ. Microbiol. 2015. V. 81(2). P. 745–753.
Rusakov A., Makeev A., Khokhlova O., Kust P., Lebedeva M., Chernov T., Golyevae A., Popova A., Kurbanova F., Puzanova T. Paleoenvironmental reconstruction based on soils buried under Scythian fortification in the southern forest-steppe area of the East European Plain // Quarter. Int. 2019. V. 502. P. 197–217.
Semenov M.V., Chernov T.I., Tkhakakhova A.K., Zhele-zova A.D., Ivanova E.A., Kolganova T.V., Kutovaya O.V. Distribution of prokaryotic communities throughout the Chernozem profiles under different land uses for over a century // Appl. Soil Ecol. 2018. V. 127. P. 8–18.
Senechkin I.V., Speksnijder A.G.C.L., Semenov A.M., van Bruggen A.H.C., van Overbeek L.S. Isolation and partial characterization of bacterial strains on low organic carbon medium from soils fertilized with different organic amendments // Microbial Ecol. 2010. V. 60. P. 829–839.
Sycheva S., Khokhlova O. Genesis, 14C-age and duration of development of the Bryansk paleosol on the Central Russian upland on dating of different materials // Quarter. Int. 2016. V. 399. P. 111–121.
Дополнительные материалы отсутствуют.


