Почвоведение, 2020, № 7, стр. 803-815
Соединения азота в почвах континентальных окраин Европейского сектора Российской Арктики
Е. В. Шамрикова a, *, С. В. Денева a, О. С. Кубик a, А. Н. Панюков a
a Институт биологии Коми научного центра Уральского отделения РАН
167982 Сыктывкар, Коммунистическая, 28, Россия
* E-mail: shamrik@ib.komisc.ru
Поступила в редакцию 20.07.2019
После доработки 19.11.2019
Принята к публикации 26.12.2019
Аннотация
Проанализированы особенности распределения органических и минеральных форм азота в маршевых и тундровых почвах европейского сектора Российской Арктики (побережья Баренцева и Белого морей). Методом газовой хроматографии на CHNS-O-элементном анализаторе измерено содержание общего азота, фотометрическим методом – содержание азота неорганических соединений. Методом жидкостной хроматографии на ионообменных смолах определен состав гидролизуемых аминокислот. Минеральные соединения составляют незначительную долю общего азота почв, основная часть азотного фонда (до 97% от общего содержания) представлена органической формой (Nорг). Масса Nорг варьирует в широких пределах как в маршевых (0.3–15.8 г/кг), так и тундровых почвах (5–20 г/кг в торфяных горизонтах и 0.3–2 г/кг в минеральных). Содержание N–${\text{NH}}_{4}^{ + }$ в первых колеблется в диапазоне 5–20, а вторых – 30–200 мг/кг. Нитратный азот обнаружен в поверхностных горизонтах почв маршей в количестве 0.2–4.6 мг/кг. Для маршевых почв характерно накопление Nорг на поверхности, либо в срединной части профиля при наличии гумусово-аккумулятивных горизонтов, погребенных современными морскими отложениями. В торфяно-глееземе имеет место аккумуляция Nорг и N–${\text{NH}}_{4}^{ + }$ над мерзлотой, в торфяной олиготрофной почве – в многолетнемерзлой толще. Содержание азота гидролизуемых аминокислот в почвах разного генезиса соответствует 0.6–8 г/кг, что составляет 30–60% почвенного органического азота и 2–12% органического углерода. Распределение N аминокислот и органического азота в профилях идентично. Отмечено однообразие качественного состава аминосоединений и близость соотношения большинства из них. Доля аргинина, гистидина, фенилаланина, тирозина, изолейцина составляет <4% каждой, лизина, валина, пролина, серина и треонина – по 5–7%, аланина и лейцина – по 10–12%. Вглубь профиля маршевых почв выражено повышение доли глицина при его колебании от 12 до 20% и снижение роли аспарагиновой, глутаминовой аминокислот с 11 до 6%. В маршевых почвах выявлена корреляционная связь содержания илистой фракции, несиликатных форм железа с Nорг, N–${\text{NH}}_{4}^{ + }$ и с азотом большинства идентифицированных аминокислот (r = 0.6–0.9). Максимальные значения r характерны для пар дитионитрастворимых форм Fe с азотом треонина и гистидина.
ВВЕДЕНИЕ
Побережья арктических морей России – уникальная малоисследованная территория. Здесь на ограниченной площади встречаются почвы тундровых и болотных экосистем, засоленных маршей [21–23]. Актуальность изучения почвенного покрова прибрежно-морских ландшафтов возрастает в связи с глобальными изменениями природной среды. Наблюдаемые повышения температуры воздуха вызывают интенсификацию геохимических процессов, в том числе определяющих параметры цикла азота [2, 9, 43].
Обобщение сведений о почвах тундровой зоны, развивающихся вне влияния моря, свидетельствует о достаточно высоком содержании в них азота, основная часть которого сосредоточена в составе слабогумифицированного органического вещества [9, 51]. Преобладающим процессом биологического цикла азота в экосистемах тундры является аммонификация. Процессы нитрификации и денитрификации не рассматриваются в качестве важного звена круговорота элемента [2, 9, 11, 42, 44]. Согласно [9, 49], в тундровых почвах минерализуется около 1% азота, что меньше, чем в почвах бореального пояса (3–7%) [9, 11]. Медленные темпы гумификации и минерализации органических остатков определяются низкой среднегодовой температурой, краткостью вегетационного периода, бедностью бактериальной флоры, сильнокислой реакцией почвенной среды и анаэробными условиями [19, 43]. Важная роль в круговороте азота в почвах принадлежит аминокислотам (АМК), обогащение которыми происходит в результате разложения растительных и животных остатков. На азот гидролизуемых аминокислот в почвах тайги и лесотундры приходится от 30 до 50% общего азота [4, 11].
В отличие от зональной тундровой растительности, ткани солеустойчивых видов, растущих в прибрежной зоне, обогащены азотом [21]. Кроме того, заметное влияние на азотный цикл прибрежных почв оказывает орнитогенный прессинг. Экскреторная деятельность птиц может обогащать почву азотом, повышая его содержание от двух до десяти раз и достигая в местах гнездования 9% [6].
Фиксация азотсодержащих органических соединений минеральной матрицей почв – один из механизмов стабилизации органического вещества. Вопреки традиционному мнению о лабильности пептидных связей [34, 55] и меньшей устойчивости белков к химическому и биологическому воздействию по сравнению с ароматическими кольцевыми структурами, продолжительность пребывания азотсодержащих органических соединений в почвах, как правило, значительна и может исчисляться сотнями и тысячами лет [29, 41]. Среди механизмов закрепления азотистых соединений – адсорбция глинистыми минералами и гидроксидами железа за счет электростатических сил между функциональными группами АМК и минеральными поверхностями [16, 17, 26, 27, 35, 36, 41, 48], а также включение органических веществ в межслоевое пространство глинистых минералов [18, 37]. Природа адсорбента определяет количество удерживаемых азотистых соединений. Почвенные фракции, обогащенные аллофаном, отличаются самым высоким содержанием азотсодержащих органических соединений. Фракциям с высокой долей смектита свойственен широкий диапазон, а наименьшее содержание обнаруживается в почвах с преобладанием каолинита [46].
Цель исследования – выявить особенности распределения форм азота в прибрежных маршевых и водораздельных тундровых почвах континентальных окраин европейского сектора Российской Арктики. Работа продолжает тему изучения почв арктических побережий России [21–23].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования выбраны участки распространения маршевых и водораздельных тундровых почв в прибрежной зоне Баренцева моря и маршевых почв побережья Белого моря (рис. 1). Названия тундровых почв водораздельных территорий (табл. 1) даны в соответствии с классификацией и диагностикой почв России [7, 14]. Использованы принципы опубликованных схем разделения маршевых почв по разным таксономическим единицам [20–22, 24, 53]. Их наименование также дано в соответствии с системой мировой базы почвенных ресурсов [10]. Подробное описание почв и ландшафтов приведено ранее [21–23]. Здесь отметим особенности формирования почв, влияющие на процессы азотного цикла.
Таблица 1.
Объекты исследований (из работы [22])
| Номер участка | Краткая характеристика участков исследования | |
|---|---|---|
| Побережье Белого моря | ||
| I | 66°38′47.5″ N, 44°28′59.1″ Е (дата отбора – 09.07.14): п-ов Канин, восточный берег Мезенского залива, устье р. Несь; марши среднего уровня, почва – маршевая слоистая дерново-глеевая тяжелосуглинистая (Gleyic Tidalic Fluvisol (Clayic, Ochric)); фитоценоз – приморский осоково-злаковый луг (доминанты: Elymus fibrosus, Bromopsis inermis, Festuca rubra, Carex sp.) | |
| Побережье Баренцева моря | ||
| II | 68°36′24.9″ N, 056°33′17.8″ E (дата отбора – 10.07.13): Печорская губа, устье р. Черная; марши среднего уровня, почва – маршевая дерново-глеевая легкосуглинистая (Gleyic Tidalic Fluvisol (Loamic, Ochric)); фитоценоз – приморский разнотравно-осоковый луг (доминанты: Carex subspathacea, Triglochin maritimum) | |
| III | III-1 | 68°19′49.0″ N, 59°31′05″ E (дата отбора – 12.07.13): Хайпудырская губа, устье р. Ханавэйяха, марши низкого уровня; почва – маршевая примитивная гиттиевая иловато-легкосуглинистая (Tidalic Fluvisol (Loamic)); фитоценоз – приморский осоковый луг (доминанты: Carex subspathacea) |
| III-2 | 68°19′49.4″ N, 59°31′07.8″ E (дата отбора – 12.07.13): Хайпудырская губа, устье р. Ханавэйяха, марши среднего уровня; почва – маршевая дерново-глеевая супесчаная (Gleyic Tidalic Fluvisol (Arenic, Ochric)); фитоценоз – приморский осоково-злаковый луг (доминанты: Carex glareosa, Calamagrostis deschampsioides, Arctanthemum hultenii, Plantago schrenkii, Potentilla egedii) | |
| III-3 | 68°19′53.3″ N, 59°31′57.2″ E (дата отбора – 06.07.13): низкий, с отмелями берег Хайпудырской губы, марши среднего уровня рядом с галечной косой; почва – маршевая слоистая примитивная слабодерновая глеевая песчаная (Gleyic Tidalic Fluvisol (Arenic, Ochric)); фитоценоз – кустарничково-злаковый луг с ивой (доминанты: Festuca richardsonii, Leymus arenarius, Salix phylicifolia) | |
| III-4 | 68°19′57.9″ N, 059°32′23.3″ E (дата отбора – 05.07.13): Хайпудырская губа, верхняя часть пологого (2°–3°) склона приморской террасы водораздела рек Ханавэйяха и Ярэйяха; почва – торфяно-глеезем мерзлотный (Histic Reductaquic Cryosol); фитоценоз – пушицево-моховая тундра (доминанты: Eriophorum Scheuchzeri, Sphagnum girgensohnii, S. russowii, S. fimbriatum, Polytrichum commune) | |
| III-5 | 68°20′05.7″ N, 59°33′21.9″ E (дата отбора – 03.07.13): Хайпудырская губа, верхняя часть приморской террасы водораздела рек Ханавэйяха и Ярэйяха; почва – торфяная олиготрофная мерзлотная (Cryic Folic Histosol); фитоценоз – полигональный болотный комплекс (доминанты: Ledum decumbens, Rubus chamaemorus, Sphagnum squarrosum, S. girgensohnii, Polytrichum commune) | |
| III-6 | 68°18′26.5″ N, 59°44′12.8″ E (дата отбора – 22.07.13): Хайпудырская губа, устье р. Море-Ю, марши среднего уровня; почва – маршевая примитивная дерново-глеевая тяжелосуглинистая (Gleyic Tidalic Fluvisol (Loamic, Ochric, Epiprotosalic)); фитоценоз – приморский разнотравно-злаковый луг (доминанты: Agrostis straminea, Triglochin maritimum, Potentilla egedii, Carex glareosa) | |
| III-7 | 68°16′58.9″ N, 59°54′49.5″ Е (дата отбора – 26.07.13): 68°16′58.9″ N, 59°54′49.5″ Е (дата отбора – 26.07.13): слабо выположенная вершина водораздела, расположенного по левому берегу р. Море-Ю; почва – торфяно-глеезем криогенно-ожелезненный мерзлотный (Histic Reductaquic Cryosol); фитоценоз – пушицево-кустарничковая моховая тундра (доминанты: Eriophorum vaginatum, E. Scheuchzeri, Rubus chamaemorus, Empetrum hermaphroditum, Sphagnum girgensohnii, S. russowii, Polytrichum commune) | |
| III-8 | 68°17′06.2″ N, 59°55′05.9″ E (дата отбора – 26.07.13): средняя часть пологого водораздельного (2°–3°) склона по левому берегу р. Море-Ю; почва – торфяная олиготрофная мерзлотная (Cryic Folic Histosol); фитоценоз – полигональный болотный комплекс (доминанты: Betula nana, Eriophorum vaginatum, Cladonia arbuscula, C. rangiferina, Sphagnum girgensohnii, Polytrichum commune) | |
В полосе маршей побережья Хайпудырской губы (участки III-1, III-2, III-3) наблюдаются многочисленные признаки жизнедеятельности птиц – помет, перья, поеди. На поверхности почвы маршей низкого уровня, возле устья р. Ханавэйяха (участок III-1) отмечено обилие биоматериала, приносимого морем. Незначительное воздействие орнитофауны испытывают и почвы тундровых участков III-4 и III-5, расположенных рядом с маршами.
Структура азотного пула торфяно-глеезема с признаками стратификации (участок III-4) во многом определяется спецификой пространственного расположения. Почва формируется в 150 м от моря, в верхней части склона к морской террасе, представляющего собой переходную зону от тундровой полосы к маршам. Торфяно-глеезем, в меньшей степени, чем маршевые почвы, подвержен влиянию процесса импульверизации. Вместе с тем, более низкая ландшафтная позиция, в сравнении с торфяной олиготрофной почвой (уч. III-5), формирующейся на высоком берегу, делает участок III-4 более открытым для морской воды во время высоких приливов и нагонов.
Химический состав исследуемых почв приведен в табл. 2. Данные получены в экоаналитической лаборатории, а также в отделе почвоведения Института биологии Коми НЦ УрО РАН. Массовая доля общего углерода (Собщ) и общего азота (Nобщ) в почвах измерена на CHNS-O-элементном анализаторе ЕА 1110 (Carlo Erba, Италия). Значения рН определены на ионометре универсальном Анион-4100 (Россия). В образцах почв с ${\text{р}}{{{\text{Н}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ > 6.5 объемно-метрическим методом с п-омощью кальциметра 08.53 Eijkelkamp (SA07, США-Нидерланды) выполнено определение неорганического углерода (Снеорг). Содержание минеральных форм азота (N-${\text{NH}}_{{\text{4}}}^{{\text{ + }}}{\text{,}}$ N-${\text{NО}}_{3}^{ - }$) измерено методом на фотометре фотоэлектрическом КФК-3 (Россия). Углерод и азот органических соединений (Сорг, Nорг) найдены по разности содержаний общих и неорганических форм элементов. В почвах с содержанием общего азота более 1.8 г/кг методом жидкостной хроматографии на ионообменных смолах (анализатор аминокислот ААА 339) согласно аттестованной методике КХА МВИ № 88-17641-97-201011 установлен состав гидролизуемых аминокислот. Экстракция кислот выполнена хлороводородной кислотой с(HCl) = 6 моль/дм3 в запаянных стеклянных ампулах при температуре t = (110.0 + 1.0)°С в течение 24 ч. Определение гранулометрического состава почв проведено методом Качинского, оксалаторастворимых форм железа – по методу Тамма, дитионитрастворимых форм Fe – по методу Мера и Джексона [1]. Содержание Fe в пробах измерено методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой Spectro Ciros SPECTROARCOS.
Таблица 2.
Химический состав исследуемых почв
| Горизонт | Глубина, см | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | Содержание | C/N | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Собщ (Снеорг) | Nобщ | N–${\text{NH}}_{4}^{ + }$ | N–${\text{NO}}_{3}^{ - }$ | ИФ/П | Fe-Т | Fe-МД | ||||
| г/кг | мг/кг | % | ||||||||
| Участок I. Маршевая слоистая дерново-глеевая тяжелосуглинистая почва | ||||||||||
| AYao | 0–2 | 6.31 | 272.0 | 15.80 | 208.8 | 0.5 | – | – | – | 20 |
| AYh | 2–13 | 7.20 | 37.0(0.1) | 3.70 | 15.8 | 0.2 | 27/3 | – | – | 12 |
| ACao,h,g | 13–43 | 7.38 | 25.0(0.1) | 2.70 | 8.2 | 0 | 30/3 | – | – | 11 |
| СG | 43–61 | 7.01 | 23.0(0) | 2.20 | 6.8 | 0 | 29/2 | – | – | 12 |
| СG~~ | 61–98 | 7.84 | 12.4(0.2) | 0.87 | 3.3 | 0 | 17/3 | – | – | 17 |
| Участок II. Маршевая дерново-глеевая легкосуглинистая почва | ||||||||||
| AYao | 0–6 | 6.16 | 47.0(0) | 3.30 | 38.5 | 0 | – | – | – | 17 |
| AYh | 6–20 | 5.82 | 24.0(0) | 1.80 | – | 0 | 16/2 | – | – | 16 |
| ACao,h,g | 20–53 | 6.99 | 7.1(0) | 0.58 | – | 0 | 16/2 | – | – | 14 |
| Участок III-1. Маршевая примитивная гиттиевая иловато-легкосуглинистая почва | ||||||||||
| W | 0–3 | 7.17 | 9.1(1.8) | 0.89 | 11.2 | 4.59 | 11/4 | 0.71 | 0.60 | 10 |
| ACao,h | 3–24 | 5.98 | 41.0(0) | 3.30 | 4.3 | 0.75 | 13/2 | 0.17 | 0.14 | 15 |
| ACao,g | 24–67 | 6.82 | 10.7(0.4) | 0.79 | 4.3 | 0 | 14/2 | 0.18 | 0.13 | 15 |
| СG | 67–89 | 7.19 | 14.4(0.8) | 0.98 | 5.3 | 0 | 17/2 | 0.53 | 0.36 | 16 |
| Участок III-2. Маршевая дерново-глеевая легкосуглинистая почва | ||||||||||
| AYao | 0–10 | 4.77 | 75.0 | 5.00 | 18.0 | 0.42 | – | 0.27 | 0.25 | 18 |
| AYh | 10–19 | 5.52 | 13.4 | 0.95 | 4.5 | 0 | 11/1 | 0.05 | 0.03 | 17 |
| ACao,g | 19–30 | 3.58 | 4.8 | 0.43 | 8.3 | 0 | 8/1 | 0.17 | 0.17 | 13 |
| СG | 30–63 | 4.10 | 7.1 | 0.57 | – | 0 | 11/1 | 0.13 | 0.14 | 15 |
| СG | 63–78 | 5.45 | 11.4 | 0.88 | – | 0 | 14/2 | 0.12 | 0.11 | 15 |
| Участок III-3. Маршевая слоистая примитивная слабодерновая глеевая песчаная почва | ||||||||||
| W | 0–1.5 | 6.28 | 87.0 | 5.20 | 21.1 | 0 | 33/28 | 0.10 | 0.08 | 20 |
| ACao,h | 1.5–6 | 6.20 | 66.0 | 5.50 | 21.1 | 0 | 6/2 | 0.09 | 0.08 | 14 |
| Сh,f~~ | 6–49 | 7.58 | 9.6(0.4) | 0.36 | 1.3 | 0 | – | 0.08 | 0.12 | 31 |
| CG~~ | 49–75(79) | 6.04 | 9.4(0) | 0.93 | 5.1 | 0 | 7/1 | 0.05 | 0.04 | 12 |
| СG,h~~ | 75(79)–97 | 7.89 | 15.2(0.3) | 0.65 | 1.4 | 0 | – | 0.09 | 0.14 | 27 |
| СG┴ | 97–105 | 8.09 | 9.4(0.2) | 0.68 | 1.6 | 0 | 4/2 | 0.06 | 0.09 | 16 |
| Участок III-4. Торфяно-глеезем мерзлотный | ||||||||||
| Оmr | 0–3 | 4.85 | 105.0 | 3.50 | 36.0 | 0 | – | 0.20 | 0.18 | 35 |
| Т1 | 3–20 | 4.87 | 346.0 | 10.30 | 37.5 | 0 | – | 0.36 | 0.36 | 39 |
| Т2 | 20–27 | 4.57 | 262.0 | 14.30 | 72.4 | 0 | – | 0.23 | 0.19 | 21 |
| G | 27–37 | 5.20 | 35.0 | 2.00 | 14.8 | 0 | 17/0 | 0.06 | 0.05 | 21 |
| Участок III-5. Торфяная олиготрофная мерзлотная почва | ||||||||||
| O | 0–1 | 3.87 | 434.0 | 7.90 | 48.0 | 0 | – | 0.10 | 0.12 | 64 |
| T1 | 1–16 | 3.96 | 447.0 | 14.00 | 77.0 | 0 | – | 0.12 | 0.12 | 37 |
| Т2 | 16–23 | 3.98 | 444.0 | 18.00 | 79.0 | 0 | – | 2.30 | 1.76 | 29 |
| Т⊥ | 23–30 | 4.04 | 468.0 | 20.00 | 186.0 | 0 | – | 0.74 | 0.62 | 28 |
| Участок III-6. Маршевая примитивная дерново-глеевая тяжелосуглинистая почва | ||||||||||
| AYao | 0–4 | 6.21 | 6.1 | 0.49 | 16.6 | 0 | 18/4 | 0.75 | 0.75 | 15 |
| AYh | 4–11 | 6.46 | 38.0(0) | 3.00 | 12.1 | 0 | 19/1 | 0.64 | 0.17 | 15 |
| ACao,h,g | 11–30 | 6.69 | 26.0(0) | 1.80 | 7.5 | 0 | 23/1 | 0.36 | 0.25 | 17 |
| СG | 30–57 | 7.20 | 5.3(0.6) | 0.32 | 3.1 | 0 | 7/1 | 0.27 | 0.19 | 17 |
| Участок III-7. Торфяно-глеезем криогенно-ожелезненный мерзлотный | ||||||||||
| О | 0–3 | 4.16 | 403.0 | 5.00 | 51.0 | 0 | – | 0.08 | 0.10 | 95 |
| Т1 | 3–11 | 3.93 | 409.0 | 6.50 | 48.0 | 0 | – | 0.14 | 0.13 | 74 |
| Т2 | 11–13 | 4.43 | 310.0 | 12.50 | 64.0 | 0 | – | 0.39 | 0.45 | 29 |
| Gсfтикc | 13–27 | 5.51 | 3.7 | 0.34 | 5.3 | 0 | 15/0 | 1.69 | 1.99 | 13 |
| G1 | 27–38 | 5.48 | 3.9 | 0.35 | 2.8 | 0 | 16/0 | 0.61 | 0.66 | 13 |
| G2 | 38–55(69) | 5.53 | 7.5 | 0.50 | 4.5 | 0 | 18/1 | 0.59 | 0.73 | 18 |
| G⊥ | 55(69)–76 | 5.92 | 4.6 | 0.33 | 4.0 | 0 | 15/1 | 0.37 | 0.60 | 16 |
| Участок III-8. Торфяная олиготрофная мерзлотная почва | ||||||||||
| О | 0–2 | 3.82 | 328.0 | 8.60 | 53.4 | 0 | – | – | – | 45 |
| Т1 | 2–22 | 3.89 | 327.0 | 14.00 | 34.4 | 0 | – | – | – | 27 |
| Т2 | 22–33 | 4.05 | 472.0 | 13.20 | 70.3 | 0 | – | – | – | 42 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Азот органических и неорганических соединений почв. Основная часть азотного фонда маршевых и водораздельных почв представлена его органической формой (до 97% от общего его содержания). В маршевых почвах содержание азота не превышает 16 г/кг (табл. 2). В отдельных разрезах (уч. III-1, III-3, III-6) максимальное содержание отмечено в средней части профиля в гумусово-аккумулятивных горизонтах, погребенных современными морскими отложениями. Захоронение горизонтов в пределах 2–13 см могло быть вызвано перемещением значительного количества минеральной массы во время серии крупных штормов лета 2010 г. [8]. В остальных случаях наблюдается преимущественное накопление азота в поверхностных горизонтах почв. Отношение органических форм углерода и азота С/N в большинстве случаев составляет менее 20, достигая в отдельных вариантах 30. Для образцов, в которых отсутствуют сведения о минеральном азоте, для расчета C/N использовали данные по общему содержанию N. Большая обогащенность гумуса азотом поверхностного горизонта W(0-3) почвы, расположенной на маршах низкого уровня (участок III-1), связана, по-видимому, с поступлением значительного количества птичьего помета (С/N < 8 [6, 52, 54]) и морского биоматериала (С/N < 10 [28, 32, 33]).
В почвах водораздельных территорий содержание органического азота колеблется в широком диапазоне значений. В пределах органогенных горизонтов составляет 5–20 г/кг, и с глубиной отмечено увеличение этого показателя. В торфяной олиготрофной почве максимальное содержание Nорг приходится на многолетнемерзлую толщу, что согласуется с ранее полученными результатами [4] и, вероятно, объясняется особенностями ее формирования. В минеральной части торфяно-глеезема содержание азота в 20 раз меньше по сравнению с торфяными слоями, кроме того, выражено его накопление в надмерзлотных горизонтах. Отношение C/N в поверхностных горизонтах тундровых почв участков III-5, III-7, III-8 составляет 50–100. Вниз по профилю данный показатель снижается, что, вероятно, вызвано постепенным обогащением слаборазложившихся растительных остатков азотом в связи с неэквивалентным выделением углерод- и азотсодержащих газов, а также вымыванием растворимых органических соединений [15]. В профиле торфяно-глеезема, формирующегося в переходной полосе между маршами и тундрой (участок III-4), C/N несколько меньше. Максимальное значение в подповерхностном горизонте Т1 (3–20 см) объясняется, по-видимому, привносом минерального наилка на поверхность почвы во время продолжительных и обильных весенних половодий. Это также подтверждается меньшим содержанием углерода и азота в его поверхностном горизонте О (0–3 см) при сравнении с другими тундровыми почвами. Полному погребению почвы, как это происходит на соседних маршах (участки III-1 и III-6), вероятно, препятствует более высокое положение участка в рельефе. К факторам, определяющим низкие значения C/N у этой почвы, может относиться и жизнедеятельность птиц. Аналогичная ситуация для почв водораздельных территорий, формирующихся на высоких морских берегах, отмечена ранее [50].
Содержание N–${\text{NH}}_{4}^{ + }$ в засоленных почвах колеблется от единиц до двух сотен мг/кг; в большинстве случаев диапазон значений составляет 5–20 мг/кг, уменьшаясь с глубиной. В органогенных горизонтах водораздельных почв этот показатель равен 40–200, в минеральных – менее 20 мг/кг. Накопление N–${\text{NH}}_{4}^{ + }$ связано с процессами аммонификации и действием орнитогенного фактора. Для соотнесения роли этих двух источников на участках III-1–III-6 необходимы дополнительные исследования. На остальных участках доминирующий процесс образования иона аммония – распад азотсодержащих органических соединений. Двукратное превышение содержания N–${\text{NH}}_{4}^{ + }$ в мерзлом грунте торфяной олиготрофной почвы участка III-5, по сравнению с сезонноталой толщей, очевидно связано с особенностями N-минерализации в условиях многолетней мерзлоты [4]. В торфяно-глееземе (участок III-7) выражена надмерзлотная аккумуляции азота как в органической, так и в аммиачной форме. Нитратный азот обнаружен лишь в поверхностных горизонтах маршевых почв в количествах 0.2–4.6 мг/кг. Таким образом, минерализация органического вещества в почвах арктических побережий в основном ограничивается стадией аммонификации, нитрификация выражена слабо. К причинам, сдерживающим процессы нитрификации, относятся низкие температуры, избыточное увлажнение, а в торфяных почвах дополнительно – высокая кислотность почвенного раствора.
Азот гидролизуемых аминокислот почв. В исследуемых почвах обнаружено 19 аминокислот: нейтральные – глицин Gly, аланин Ala, валин Val, изолейцин Ile, лейцин Leu, пролин Pro; отрицательные – аспарагиновая Asp, глутаминовая Glu; гидроксимоно – аспарагиновая Asp, глутаминовая Glu; гидроксимоно-аминокарбоновые – серин Ser, треонин Thr; положительные – лизин Lys, гистидин His, аргинин Arg; ароматические – тирозин Tyr, фенилаланин Phe и серосодержащие – цистеин Cys, метионин Met (табл. 3). Аналогичный перечень характерен для гидролизатов почв разного генезиса, гумусовых кислот, а также растений и почвенных микроорганизмов [3, 11, 25]. Это указывает на довольно однообразный качественный состав АМК подобных объектов. Из-за потерь S-содержащих аминокислот в ходе кислотной экстракции, ограничимся обсуждением результатов исследований для 17-ти соединений, аналогично работе [4].
Таблица 3.
Аминокислотный состав почв
| № участка |
Глубина, см | Содержание аминокислот в сухом веществе | ɷ(САМК) | ɷ(NАМК) | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Asp | Thr | Ser | Glu | Pro | Gly | Ala | Cys | Val | Met | Ile | Leu | Tyr | Phe | His | Lys | Arg | ∑АМК | ||||
| % | |||||||||||||||||||||
| I | (0–2) | 0.72 | 0.38 | 0.34 | 0.83 | 0.44 | 0.46 | 0.48 | 0.02 | 0.33 | 0.00 | 0.23 | 0.62 | 0.18 | 0.23 | 0.07 | 0.41 | 0.26 | 6.0 | 9.9 | 51.4 |
| (2–13) | 0.09 | 0.06 | 0.06 | 0.09 | 0.08 | 0.11 | 0.07 | 0.02 | 0.05 | 0.00 | 0.04 | 0.10 | 0.05 | 0.02 | 0.01 | 0.06 | 0.04 | 1.0 | 11.9 | 34.6 | |
| (13–43) | 0.06 | 0.05 | 0.03 | 0.05 | 0.04 | 0.06 | 0.05 | 0.01 | 0.04 | 0.00 | 0.02 | 0.07 | 0.01 | 0.02 | 0.01 | 0.04 | 0.02 | 0.6 | 10.7 | 29.3 | |
| (43–61) | 0.05 | 0.05 | 0.02 | 0.05 | 0.04 | 0.07 | 0.05 | 0.00 | 0.04 | 0.00 | 0.02 | 0.06 | 0.01 | 0.02 | 0.01 | 0.04 | 0.02 | 0.6 | 10.6 | 34.3 | |
| II | (0–6) | 0.11 | 0.07 | 0.06 | 0.11 | 0.06 | 0.09 | 0.08 | 0.01 | 0.06 | 0.00 | 0.04 | 0.12 | 0.04 | 0.04 | 0.01 | 0.07 | 0.04 | 1.0 | 10.6 | 41.1 |
| III-1 | (3–24) | 0.11 | 0.05 | 0.08 | 0.12 | 0.07 | 0.09 | 0.08 | 0.01 | 0.06 | 0.00 | 0.04 | 0.13 | 0.03 | 0.04 | 0.01 | 0.07 | 0.05 | 1.0 | 11.3 | 42.1 |
| III-2 | (0–10) | 0.22 | 0.12 | 0.11 | 0.20 | 0.12 | 0.14 | 0.13 | 0.01 | 0.10 | 0.00 | 0.07 | 0.22 | 0.06 | 0.07 | 0.02 | 0.11 | 0.07 | 1.8 | 10.6 | 47.6 |
| III-3 | (0–1.5) | 0.22 | 0.13 | 0.12 | 0.23 | 0.13 | 0.15 | 0.15 | 0.01 | 0.11 | 0.00 | 0.08 | 0.22 | 0.05 | 0.07 | 0.03 | 0.11 | 0.07 | 1.9 | 9.9 | 48.8 |
| (1.5–6) | 0.22 | 0.13 | 0.12 | 0.20 | 0.12 | 0.16 | 0.14 | 0.01 | 0.11 | 0.00 | 0.07 | 0.22 | 0.05 | 0.07 | 0.02 | 0.10 | 0.06 | 1.8 | 12.5 | 44.3 | |
| III-4 | (0–3) | 0.12 | 0.07 | 0.07 | 0.12 | 0.06 | 0.08 | 0.08 | 0.01 | 0.06 | 0.00 | 0.04 | 0.10 | 0.03 | 0.04 | 0.02 | 0.07 | 0.05 | 1.0 | 4.5 | 39.9 |
| (3–20) | 0.31 | 0.16 | 0.14 | 0.29 | 0.09 | 0.19 | 0.20 | 0.01 | 0.14 | 0.00 | 0.10 | 0.24 | 0.07 | 0.08 | 0.04 | 0.15 | 0.09 | 2.3 | 3.0 | 30.6 | |
| (20–27) | 0.66 | 0.34 | 0.33 | 0.65 | 0.32 | 0.42 | 0.42 | 0.03 | 0.30 | 0.00 | 0.23 | 0.53 | 0.19 | 0.21 | 0.10 | 0.35 | 0.21 | 5.3 | 67.0 | 50.3 | |
| (27–37) | 0.06 | 0.03 | 0.04 | 0.06 | 0.03 | 0.05 | 0.05 | 0.00 | 0.03 | 0.00 | 0.03 | 0.06 | 0.02 | 0.02 | 0.01 | 0.04 | 0.02 | 0.6 | 7.0 | 37.4 | |
| III-5 | (0–1) | 0.32 | 0.17 | 0.16 | 0.34 | 0.15 | 0.19 | 0.22 | 0.01 | 0.16 | 0.00 | 0.12 | 0.29 | 0.08 | 0.09 | 0.05 | 0.16 | 0.11 | 2.6 | 2.7 | 45.0 |
| (1–16) | 0.54 | 0.30 | 0.28 | 0.54 | 0.32 | 0.36 | 0.36 | 0.02 | 0.27 | 0.01 | 0.20 | 0.53 | 0.17 | 0.20 | 0.11 | 0.27 | 0.16 | 4.6 | 4.7 | 44.9 | |
| (16–23) | 0.63 | 0.31 | 0.31 | 0.62 | 0.24 | 0.42 | 0.41 | 0.03 | 0.33 | 0.01 | 0.23 | 0.56 | 0.18 | 0.21 | 0.12 | 0.33 | 0.17 | 5.1 | 5.2 | 38.6 | |
| (23–30) | 0.79 | 0.41 | 0.38 | 0.77 | 0.32 | 0.48 | 0.50 | 0.04 | 0.39 | 0.00 | 0.29 | 0.68 | 0.25 | 0.27 | 0.16 | 0.44 | 0.23 | 6.4 | 6.2 | 43.5 | |
| III-6 | (4–11) | 0.09 | 0.05 | 0.06 | 0.09 | 0.05 | 0.08 | 0.07 | 0.01 | 0.05 | 0.00 | 0.04 | 0.11 | 0.02 | 0.03 | 0.01 | 0.06 | 0.04 | 0.9 | 10.1 | 38.7 |
| (11–30) | 0.03 | 0.04 | 0.02 | 0.04 | 0.03 | 0.04 | 0.04 | 0.01 | 0.03 | 0.00 | 0.02 | 0.06 | 0.01 | 0.02 | 0.01 | 0.03 | 0.02 | 0.5 | 7.8 | 33.2 | |
| III-7 | (0–3) | 0.21 | 0.10 | 0.09 | 0.20 | 0.09 | 0.11 | 0.13 | 0.01 | 0.10 | 0.00 | 0.07 | 0.16 | 0.07 | 0.07 | 0.03 | 0.10 | 0.07 | 1.6 | 1.8 | 43.8 |
| (3–11) | 0.26 | 0.14 | 0.13 | 0.25 | 0.11 | 0.15 | 0.16 | 0.01 | 0.13 | 0.00 | 0.10 | 0.22 | 0.08 | 0.09 | 0.04 | 0.12 | 0.09 | 2.1 | 2.3 | 43.4 | |
| (11–13) | 0.59 | 0.31 | 0.27 | 0.55 | 0.23 | 0.34 | 0.35 | 0.02 | 0.24 | 0.00 | 0.17 | 0.47 | 0.12 | 0.16 | 0.09 | 0.30 | 0.18 | 4.4 | 6.3 | 48.2 | |
| III-8 | (0–2) | 0.34 | 0.20 | 0.19 | 0.37 | 0.16 | 0.23 | 0.22 | 0.01 | 0.15 | 0.00 | 0.11 | 0.29 | 0.06 | 0.08 | 0.05 | 0.16 | 0.10 | 2.7 | 3.7 | 43.4 |
| (2–22) | 0.62 | 0.39 | 0.33 | 0.72 | 0.35 | 0.42 | 0.47 | 0.04 | 0.34 | 0.00 | 0.26 | 0.69 | 0.26 | 0.29 | 0.13 | 0.40 | 0.24 | 6.0 | 8.5 | 56.3 | |
| (22–23) | 0.32 | 0.20 | 0.19 | 0.40 | 0.23 | 0.22 | 0.26 | 0.02 | 0.21 | 0.00 | 0.16 | 0.39 | 0.11 | 0.15 | 0.08 | 0.22 | 0.13 | 3.3 | 3.6 | 33.1 | |
Содержание аминокислот в маршевых почвах составляет 40–500 мкмоль/кг. В органогенных горизонтах тундровых почв количество аминокислот сопоставимо с маршевыми почвами. Несмотря на то, что массовая доля азота индивидуальных аминокислот различается существенно (от 6–8% для Cys, Tyr, Phe до 27% для His) для всех изучаемых почв изменение содержания и аминокислот, и азота аминокислот идентично распределению почвенного органического азота (рис. 2). Доля азота аминокислот в верхних горизонтах составляет половину от органического азота, с глубиной этот показатель уменьшается до 30%. В торфяных горизонтах тундровых почв вклад аминокислот в азотный статус составляет 40–60%, что близко к ранее полученным данным [11]. Все это свидетельствует о существенном вкладе азота аминокислот в азотный фонд почв окраинных арктических территорий.
Рис. 2.
Взаимосвязь содержания органического азота Nорг (%) в маршевых и тундровых почвах и общей массы аминокислот (1) (%), азотом аминокислот (2) (%).
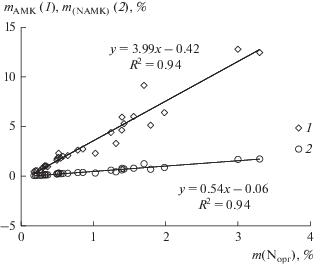
В составе гидролизатов всех объектов доминируют нейтральные аминокислоты (60–75%), такие как Ala, Gly, Thr, являющиеся наиболее устойчивыми [4]. Доля ароматических АМК составляет 4–7, гидроксиаминокислот – 10–15%. Вклад положительных АМК в общее содержание составляет десятую часть их общей массы, отрицательных – соответствует диапазону 13–34%. Абсолютное содержание Asp и Glu от поверхностного горизонта к нижележащей толще уменьшается до 9 раз (участок I), что может быть связано с их большей растворимостью и вымыванием из почв [12, 40, 47], а также участием, как прекурсоров, в биосинтезе других аминокислот, избирательной адсорбцией, минерализацией, поглощением растениями и микроорганизмами и др. [11, 40, 43]. Помимо отрицательных аминокислот, существенно снижается количество Phe и Pro (в 12 и 6 раз, соответственно).
Ранее [43] было показано, что информативным показателем почвообразовательных процессов может быть отношение масс положительных и отрицательных аминокислот (k). На примере исследуемых тундровых почв выявлено уменьшение значений k с глубиной в пределах торфяной толщи. В то же время, использование расчетного показателя k для маршевых почв, возможно, не целесообразно в связи с регулярным обновлением почвенного профиля, а также наличием погребенных горизонтов. Несколько меньшая относительная доля отрицательных АМК в гидролизатах маршевых почв (18.4%) по сравнению с тундровыми (21.3%) согласуется с меньшей кислотностью первых.
Выявлено, что изучаемые почвы характеризуются не только схожим качественным составом аминокислот, но и близким относительным содержанием большинства из них. Для всех почвенных горизонтов, вне зависимости от их генезиса, доля Arg, His, Phe, Tyr, Ile не превышает 4% для каждой, вклад Lys, Val, Pro, Ser и Thr составляет по 5–7, Ala и Leu – по 10–12%. Основные различия относительного содержания аминокислот в объектах сводятся к изменениям трех соединений – нейтральной аминокислоты Gly и отрицательных Asp и Glu. Диапазон колебаний массовой доли первой 12–20%, отмечается тенденция к накоплению глицина с глубиной. В свою очередь содержание Glu напротив уменьшается, варьируя от 6 до 11%. Эта тенденция прослеживается в большинстве почв, но в наибольшей степени выражена в почвах маршей.
Аминокислотный спектр торфяной олиготрофной почвы уч. III-5, формирующейся на водоразделе в приморской полосе, типичен для торфяных мерзлотных почв (табл. 3). Состав АМК в подстилочно-торфяном О (0–1 см) горизонте и характерном представителе напочвенного покрова исследуемого участка Polytrichum commune [4], различаются в пределах погрешности измерений. С глубиной, включая мерзлотную толщу, отмечено последовательное увеличение содержания всех АМК. Наиболее существенное обогащение торфа аминокислотами наблюдается на первых этапах разложения органических остатков; при переходе от горизонта О к Т1 их содержание увеличивается в 1.5–2.2 раза. В большей степени выражена аккумуляция гетероциклической His и ароматических Tyr и Phe, относящихся к “тяжелым” АМК (М = 155–181 г/моль). Их количество от поверхности почвы к мерзлотной толще повышается в 3–3.2 раза, тогда как остальных АМК в 2.1–2.5. Накопление названных аминокислот в пределах торфяной толщи отмечено и в почвах уч. III-7 и III-8, формирующихся в 10 км от побережья Хайпудырской губы.
В профиле торфяной олиготрофной почвы участка III-8 максимальное содержание аминокислот, как и органического азота, соответствует горизонту Т1 (2–22 см). Уменьшение азотного пула глубже 22 см при одновременном существенном увеличении содержания органического углерода может быть связано с хронологической инверсией торфонакопления. Подобные процессы в торфяных почвах на южной границе Восточно-Европейской криолитозоны были отмечены ранее [13]. На определенной стадии могло произойти размывание торфа и обрушение в термокарстовое озерцо или мочажину бортов подтаявшего торфяного бугра. Похожие случаи обнажения древнего торфа на поверхности наблюдаются в настоящее время и при активации процессов термоэрозии в результате постепенной деградации многолетнемерзлой породы [45].
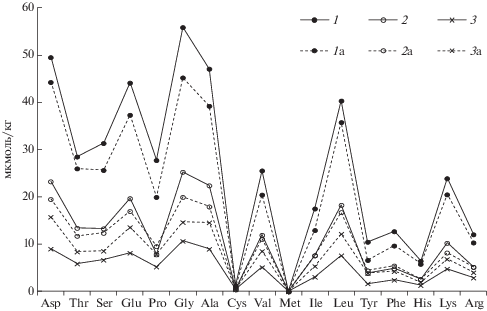
Сумма аминокислот в органогенных горизонтах торфяно-глеезема участка III-7 в 1.5–2 раза меньше по сравнению с сезонноталой толщей олиготрофных почв. Возможно, это объясняется меньшей дренированностью данного участка, что определяет различия в составе растительных сообществ. Напочвенный покров участков III-5 и III-8 представлен сообществом, характерным для торфяных бугров, участка III-4 – аналогичен растительности мочажин (табл. 1). Специфика распределения аминокислот в профиле торфяно-глеезема с признаками стратификации (участок III-4) связана, как показано выше, с поступлением на поверхность почвы минерального наилка. Если содержание всех АМК в одноименных горизонтах Т1 и Т2 торфяно-глеезема, представленного на побережье (участок III-4), в среднем в 1.2 раза выше по сравнению с торфяно-глееземом, развитым в 10 км от береговой зоны Хайпудырской губы (участок III-8), то отношение содержания аминокислот в поверхностных горизонтах О этих почв имеет обратный характер и равно 0.6 (рис. 3). При кислотном гидролизе из минерального G горизонта торфяно-глеезема извлекается в 10 раз меньшее количество аминокислот по сравнению с вышележащим органогенным Т2 слоем.
Рис. 3.
Содержание гидролизуемых аминокислот в горизонтах торфяно-глееземов: участок III-4 О (0–3 см) (1), Т1 (3–20 см), (2), Т2 (20–27 см) (3) и участок III-7 О (0–3 см) (1а), Т1 (3–11 см) (2а), Т2 (11–13 см) (3а).
Связь соединений азота с минеральными компонентами почв. В ходе исследований для маршевых почв выявлена связь (r ~ 0.7) содержания илистой фракции с содержанием органического азота и азота аминокислот (табл. 5 ). При оценке корреляции использованы данные для бескарбонатных минеральных горизонтов почв, что исключает погрешность измерения массовой доли илистой фракции почв в присутствии карбонатов.
Селективность адсорбции идентифицированных аминокислот несиликатными соединениями железа подтверждается наличием тесной связи между содержанием Fe и азотом аминокислот (r ~ 0.6–0.8) и отсутствие таковой для органического азота (табл. 4). Более высокой степенью корреляции в каждом отдельном случае характеризуется связь с дитионитрастворимым Fe, среди индивидуальных соединений наиболее тесные корреляции получены с азотом гидроксиаминокислоты Thr и гетероциклической аминокислоты His (в обоих вариантах r = 0.84). Обе кислоты образуют с ионами железа устойчивые хелатные комплексные соединения. В отношении последней установлено, что адсорбция заметно падает с уменьшением радиуса пор адсорбентов [12]. Данное явление связано с проявлением фактора ассоциации молекул в водных и особенно в водно-солевых растворах. Отдельными исследованиями показано, что в водных растворах His образует ассоциаты, включающие до пяти молекул [12].
Таблица 4.
Уравнения взаимных связей (коэффициенты парной корреляции) параметров минеральных горизонтов почв
| Почва участка | Формы азота | ИФ | Fe-Т | Fe-МД | |
|---|---|---|---|---|---|
| % | |||||
| I, II, III-1–III-4, III-6 | Nорг | г/кг | у = 0.12х – 0.40 (0.69) | – | – |
| II, III-1–III-4, III-6 | NАМК | у = 0.06х + 0.05 (0.59) | у = 2.19х + 0.25 (0.63) | у = 2.85х + 0.34 (0.78) | |
| II, III-1–III-4, III-6 | N–${\text{NH}}_{4}^{ + }$ | мг/кг | у = 0.36х + 3.90 (0.45) | у = 26.24х – 0.60 (0.71) | у = 27.35х + 3.05 (0.82) |
| III-7 | – | у = 1.20х + 3.17 (0.68) | у = 1.18х + 3.00 (0.75) | ||
Можно назвать несколько факторов, уменьшающих тесноту связи минеральных компонентов почв и азотсодержащих органических соединений, включая аминокислоты. Во-первых, ставится под сомнение полнота гидролиза пептидных связей хлороводородной кислотой [39]. В частности, могут быть не полностью гидролизованы N-органические соединения, окклюдированные минеральными частицами фракции пыли и глины [38]. Во-вторых, регулярное отложение свежих слоев аллювия разного минералогического состава может определять формирование горизонтов с разной удельной адсорбцией в отношении соединений азота. Так, сорбционная емкость в отношение аминокислот составляет 1–2.4 г аминокислот/г минерала (верхняя граница относится к монтмориллониту) [30, 31]. Согласно трехслойной модели [36] и модели “луковичных слоев” [48] некоторая часть соединений азота (аминокислоты, амиды, нитрилы, ароматические амины и др.) может удерживаться за счет электростатических сил и водородных связей не самими минералами, а функциональными группами органических соединений, уже сорбированных минеральными поверхностями, то есть располагаться за пределами контактной зоны. Подобные соединения способны экстрагироваться хлороводородной кислотой, но не имеют прямой связи с минеральной матрицей. Сведения о соотношении N-содержащих органических соединений, находящихся в контактной и кинетической (внешней) зоне трехслойных супрамолекулярных ансамблей органических веществ на поверхности минералов, отсутствуют. Дополнительно, как было указано выше, при кислотном гидролизе в той иной степени разрушаются отдельные аминокислоты [12].
Мольное отношение обеих несиликатных форм железа к азоту суммы гидролизуемых аминокислот (n(1/3Fe3+)/n(NАМК)), где n(1/3Fe3+) – количество вещества эквивалента железа, у маршевой почвы первого участка равно 0.1, почв участков III-3 и III-6 – 0.5–0.7. Следует отметить, что в отдельных случаях критерий Швертмана (отношение оксалаторастворимого железа к дитиониторастворимому при параллельной схеме экстракции, КШ) превышает единицу КШ = 1–1.4 и свидетельствует об неаддитивности вытяжек Тамма и Мера–Джексона [5].
Помимо азот-органических соединений минеральными поверхностями адсорбируется и аммонийный азот [18, 27, 36], что косвенно подтверждают наши данные (табл. 5 ). На фоне накопления органического азота отмечена надмерзлотная аккумуляция N–${\text{NH}}_{4}^{ + }$ в торфяно-глееземе (участок III-7), вероятно, связанная с накоплением над мерзлотой потенциальных адсорбентов – илистых частиц и дитионитрастворимых форм железа (табл. 2).
ЗАКЛЮЧЕНИЕ
Полярное усиление глобального потепления на протяжении XXI в. вызывает всплеск интереса к циклам азота и углерода в Арктике. Изучение распределения форм N в почвах континентальных окраин европейской части России остается актуальной задачей современности.
В ходе исследований установлено, что в составе суммарного пула почвенного азота маршевых и тундровых почв побережья Баренцева и Белого морей при существенном колебании содержания Nорг доминируют органические соединения – до 97%. В маршевых почвах выявлена аккумуляция Nорг в поверхностных горизонтах. В тундровых почвах отмечено обогащение торфа органическим азотом с глубиной, включая мерзлотную толщу. Выявлены случаи отклонения названных закономерностей распределения Nорг в профилях вследствие протекания современных седиментационных процессов, как в почвах маршей, так и в тундровых почвах, расположенных в переходной полосе от маршей к тундрам, на более высоких по сравнению с маршами ландшафтных позициях. В торфяных водораздельных почвах изменение общей тенденции распределения азота в профиле дополнительно может быть вызвано хронологической инверсией торфонакопления.
Органический азот почв на 30–60% представлен азотом аминокислот, изменение содержания которых идентично распределению почвенного органического азота. Почвы характеризуются однообразным качественным составом аминокислот, а также сходным относительным содержанием большинства их них. Доля Arg, His, Phe, Tyr, Ile не превышает 4% каждой, вклад Lys, Val, Pro, Ser и Thr составляет по 5–7%, Ala и Leu – по 10–12%. В маршевых почвах выражено накопление глицина с глубиной при колебании от 12 до 20% на фоне снижения доли Asp, Glu с 11 до 6%.
Неорганический азот в исследованных почвах в основном представлен аммонийной формой. Содержание N–${\text{NH}}_{4}^{ + }$ в маршевых почвах, при варьировании в диапазоне 5–20 мг/кг, уменьшается с глубиной. В пределах органогенной толщи водораздельных торфяных почв содержание аммонийного азота составляет 30–90, достигая 200 мг/кг в мерзлотном грунте. В поверхностных горизонтах маршевых почв присутствует нитратный азот, но в минимальных количествах – менее 5 мг/кг.
Для исследуемых почв выявлена количественная взаимозависимость минеральных компонентов (несиликатные формы железа, илистая фракция) маршевых почв с органическим азотом, азотом аминокислот и аммонийным азотом. Бóльшей теснотой отличаются связи дитионитрастворимых форм Fe с азотом аминокислот, среди них гидроксиаминокислоты Thr и гетероциклические аминокислоты His, образующих с ионами железа(III) хелатные комплексы.
Следствием криогенных процессов, типичных для исследуемых почв, является надмерзлотная аккумуляция органического и аммонийного азота в торфяно-глееземах, а также накопление этих форм азота в многолетнемерзлом грунте торфяных олиготрофных почв.
Список литературы
Агрохимические методы исследования почв. М.: Наука, 1975. 656 с.
Бузин И.С., Макаров М.И., Малышева Т.И., Кадулин М.С., Королева Н.Е., Маслов М.Н. Трансформация соединений азота в почвах горно-тундровых экосистем Хибин // Почвоведение. 2019. № 5. С. 570–577.https://doi.org/10.1134/S0032180X1903002X
Василевич Р.С., Безносиков В.А. Аминокислотный состав гумусовых веществ тундровых почв // Почвоведение. 2015. № 6. С. 685–692.https://doi.org/10.7868/S0032180X1506012X
Василевич Р.С., Габов Д.Н., Безносиков В.А., Груздев И.В., Лодыгин Е.Д. Высоко и низкомолекулярные органические соединения в тундровых торфяниках // Теоретическая и прикладная экология. 2015. № 1. С. 53–61.
Водяницкий Ю.Н. Соединения железа и их роль в охране почв. М.: Почв. ин-т им. В.В. Докучаева Россельхозакадемии, 2010. 282 с.
Иванов А.Н., Авессаломова И.А. Орнитогенные экосистемы – геохимические феномены биосферы // Биосфера. 2012. Т. 4. № 4. С. 385–396.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Лавриненко И.А., Лавриненко О.В., Добрынин Д.В. Многолетняя динамика и гибель растительности маршей Колоколковой губы Баренцева моря // Растительность России. СПб. 2012. № 21. С. 66–77.
Маслов М.Н., Макаров М.И. Трансформация соединений азота в тундровых почвах Северной Фенноскандии // Почвоведение. 2016. № 7. С. 813–821.https://doi.org/10.7868/S0032180X16070078
Мировая реферативная база почвенных ресурсов 2014. Международная система почвенной классификации для диагностики почв и создания легенд почвенных карт. Исправленная и дополненная версия 2015 / Научные редакторы перевода: М.И. Герасимова, П.В. Красильников. ФАО и МГУ им. М.В. Ломоносова, 2017.
Мошкина Е.В. Азотные соединения в почвах Северо-Запада России и динамика их под влиянием антропогенного воздействия (на примере Карелии). Автореф. … канд. с./х. н. СПб., 2009. 19 с.
Никольский Б.П., Рабинович В.А. Справочник химика. Т. 2. Основные свойства неорганических и органических соединений. М.–Л.: Химия, 1964. 1162 с.
Пастухов А.В., Марченко-Вагапова, Каверин Д.А., Кулижский С.П., Кузнецов О.Л., Панов В.С. Динамика развития бугристых торфяников на южной границе Восточно-Европейской // Почвоведение. 2017. № 5. С. 544–557. https://doi.org/10.7868/S0032180X17030091
Полевой определитель почв России. М.: Почв. ин-т им. В.В. Докучаева. 2008. 182 с.
Родин Л.Е., Базилевич Н.И. Динамика органического вещества и биологический круговорот зольных элементов и азота в основных типах растительности Земного шара. М.: Наука, 1965. 264 с.
Семенов В.М., Когут Б.М. Почвенное органическое вещество. М.: ГЕОС, 2015. 233 с.
Соколов В.Н. Глинистые породы и их свойства // Соросовский образовательный журн. 2000. Т. 6. № 9. С. 59–66.
Трофимов С.Я., Соколова Т.А., Дронова Т.Я., Толпешта И.И. Минеральные компоненты почв: учебное пособие по некоторым главам курса химии почв. Тула: Гриф и К, 2007. 104 с.
Федорец Н.Г., Бахмет О.Н. Экологические особенности трансформации соединений углерода и азота в лесных почвах. Петрозаводск: Карельский научный центр РАН, 2003. 240 с.
Черноусенко Г.И., Орешникова Н.В., Украинцева Н.Г. Засоление почв побережья северных и восточных морей России // Почвоведение. 2001. № 10. С. 1192–1206.
Шамрикова Е.В., Денева С.В., Кубик О.С. Распределение углерода и азота в почвенном покрове прибрежной территории Баренцева моря (Хайпудырская губа) // Почвоведение. 2019. № 5. С. 558–569.https://doi.org/10.1134/S0032180X19030092
Шамрикова Е.В., Денева С.В., Панюков А.Н., Кубик О.С. Свойства почв и характер растительности побережья Хайпудырской губы Баренцова моря // Почвоведение. 2018. № 4. С. 402–412. https://doi.org/10.7868/S0032180X18040020
Шамрикова Е.В., Кубик О.С., Денева С.В., Пунегов В.В. Состав водорастворимой фракции почв побережья Баренцева моря: органический углерод и азот, низкомолекулярные компоненты // Почвоведение. 2019. № 11. С. 1322–1338. https://doi.org/10.1134/S0032180X19110108
Шляхов С.А. Классификация почв морских побережий. Владивосток, 1996. 35 с.
Amelung W., Zhang X., Flach K.W. Amino acids in grassland soils: Climatic effects on concentrations and chirality // Geoderma. 2006. V. 130. P. 207–217.https://doi.org/10.1016/j.geoderma.2005.01.017
Audfenkampe A., Hedges J., Richey J., Krusche A., Llerena C. Sorptive fractionation of dissolved organic nitrogen and amino acids onto fine sediments within the Amazon // pLimnology and Oceanograhy. 2001. V. 46. P. 1921–1935.
Bai J., Ouyang H., Deng W., Zhu Y., Zhang X., Wang Q. Spatial distribution characteristics of organic matter and total nitrogen of marsh soils in river marginal wetlands // Geoderma. 2005. V. 124. P. 181–192. https://doi.org/10.1016/j.geoderma.2004.04.012
Cesário M. Teresa, Fonseca M. Manuela R., Marques Mafalda M., de Almeida M., Catarina M.D. Marine algal carbohydrates as carbon sources for the production of biochemicals and biomaterials // Biotechnology Advances. 2018. V. 36. Is. 3. P. 798–817. https://doi.org/10.1016/j.biotechadv.2018.02.006
Cotrufo M.F., Wallenstein M.D., Boot C.M., Denef K., Paul E. The Microbial Efficiency-Matrix Stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: do labile plant inputs form stable soil organic matter? // Glob. Change Biol. 2013. V. 19. P. 988–995. https://doi.org/10.1111/gcb.12113
Craig O.E., Collins M.J. The removal of protein from mineral surfaces: Implications for residue analysis of archaeological materials // J. of Arch. Sci. 2002. V. 29. P. 1077–1082. https://doi.org/10.1006/jasc.2001.0757
De Cristofaro A., Violante A. Effect of hydroxyl-aluminium species on the sorption and interlayering of albumin onto montmorillonite // Appl. Clay Sci. 2001. V. 19. P. 59–67.https://doi.org/10.1S0169-1317(01)00047-3
Frigstad H., Andersen T., Bellerby R.G.J., Silyakova A., Hessen D. Variation in the seston C : N ratio of the Arctic Ocean and pan-Arctic shelves // J. Marine System. 2014. V. 129. P. 214–223. https://doi.org/10.1016/j.jmarsys.2013.06.004
Harris C.M., McTigue N.D., McClelland J.W., Dunton K.H. Do high Arctic coastal food webs rely on a terrestrial carbon subsidy? // Food Webs. 2018. V. 15. P. 1–14. https://doi.org/10.1016/j.fooweb.2018.e00081
Huguet C., de Lange G.J., Gustafsson O., Middelburg J.J., Sinninghe Damste J.S., Schouten S. Selective preservation of soil organic matter in oxidized marine sediments (Madeira Abyssal Plain) // Geochimica et Cosmochimica Acta. 2008. V. 72. P. 6061–6068. https://doi.org/10.5194/bg-7-483-2010
Kaiser K., Guggenberger G. The role of DOM sorption to mineral surfaces in the preservation of organic matter in soils // Org. Geochem. 2000. V. 31. P. 711–725.
Kleber P., Sollins R., Sutton M. A conceptual model of organo-mineral interactions in soils: self-assembly of organic molecular fragments into zonal structures on mineral surfaces // Biogeochemistry. 2007. V. 85. P. 9–24. https://doi.org/10.1007/s10533-007-9103-5
Krull E., Baldock J.A., Skjemstad J.O. Importance and mechanism and processes of the stabilisation of soil organic matter for modelling carbon turnover // Functional Plant Biology. 2003. V. 30. P. 207–222.https://doi.org/10.1071/FP02085
Leinweber P., Schulten H.-R. Nonhydrolyzable forms of soil organic nitrogen: extractability and composition // J. Plant Nutr. Soil Sci. 2000. V. 163. P. 433–439.https://doi.org/10.1002/1522-2624(200008)163:4<433:: AID-JPLN433>3.0.CO;2-F
Martens D.A., Loeffelmann K.L. Soil amino acid composition quantified by acid hydrolysis and anionchromatography-pulsed amperometry // J. Agric. Food Chem. 2003. V. 51. P. 6521–6529.https://doi.org/10.1021/jf034422e
McBride M.B. Environmental Chemistry of Soils. Oxford University Press. New York, 1994. 406 p.https://doi.org/10.1016/j.gca.2010.01.006
Mikutta R., Kaiser K., Dӧorr N., Vollmer A., Chadwick O.A., Chorover J., Kramer M.G., Guggenberger G. Mineralogical impact on organic nitrogen across a long-term soil chronosequence (0.3–4100 kyr) // Geochimica Cosmochimica Acta. 2010. V. 74. P. 2142–2164.https://doi.org/10.1016/j.gca.2010.01.006
Miltner A., Kindler R., Knicker H., Richnow H.-H., Kӧastner M. Fate of microbial biomass-derived amino acids in soil and their contribution to soil organic matter // Org. Geochem. 2009. V. 40. P. 978–985. https://doi.org/10.1016/j.orggeochem.2009.06.008
Moon J., Ma Li, Xia K., Plant W.M.A. Microbial and mineral contributions to amino acid and protein organic matter accumulation during 4000 years of pedogenesis // Soil Biology and Biochemistry. 2016. V. 100. P. 42–50. https://doi.org/10.1016/j.soilbio.2016.05.011
Nannipieri P., Eldor P. The chemical and functional characterization of soil N and its biotic components // Soil Biol. Biochem. 2009. V. 41. P. 2357–2369.https://doi.org/10.1016/j.soilbio.2009.07.013
Ronkainen T., Väliranta M., McClymont E., Biasi C., Salonen S., Fontana S., Tuittila E.-S. A combined biogeochemical and palaeobotanical approach to study permafrost environments and past dynamics // J. of Quaternary Sci. 2015. V. 30. P. 189–200. https://doi.org/10.1002/jqs.2763
Schulten H.R., Leinweber P. New insights into organic-mineral particles: composition, properties and models structure // Biology Fertility Soils. 2000. V. 30. P. 399–432.https://doi.org/10.1007/s003740050020
Shamrikova E.V., Kubick O.S., Kaverin D.A., Pastuhov A.V., Zavarzina A.G., Punegov V.V. Soluble organic compounds as a regulator of biochemical processes in the North (Electronic resource) // Dissolved Organic Matter (DOM): Properties, Applications and Behavior. N.Y.: Nova science publishers, 2017. P. 55–80.
Sollins P., Homann P., Caldwell B.A. Stabilization and destabilization of soil organic matter: mechanisms and controls // Geoderma. 1996. V. 74. P. 65-105.https://doi.org/10.1016/S0016-7061(96)00036-5
Stark S. Nutrient cycling in the tundra / Nutrient cycling in terrestrial ecosystems. Soil Biology. V. 10. Springer-Verlag Berlin, Heidelberg. 2007. P. 309–331.https://doi.org/10.1007/978-3-540-68027-7_11
Stempniewicz L., Błachowiak-Samołyk K., Węsławski J.M. Impact of climate change on zooplankton communities, seabird populations and arctic terrestrial ecosystem – a scenario // Deep-Sea Res. Pt. II. 2007. V. 54. P. 2934–2945. https://doi.org/10.1016/j.dsr2.2007.08.012
Stottlemyer R., Rhoades C., Steltzer H. Soil temperature, moisture, and carbon and nitrogen mineralization at a taiga-tundra ecotone, Noatak National Preserve, Northwestern Alaska / Ed: Galloway J.P.. USGS Prof. Pap. 2001. P. 127–137.
Szymanski W., Wojtun B., Stolarczyk M., Siwek J., Wascinska J. Organic carbon and nutrients (N, P) in surface soil horizons in a non–glaciated catchment, SW Spitsbergen // Polish Polar Research. 2016. V. 37. N 1. P. 49–66. https://doi.org/10.1515/popore?2016?0006
Tseits M.A., Dobrynin D.V. Classification of Marsh Soils in Russia // Eurasian Soil Science. 2005. V. 38. Suppl. 1. P. 544–548.
Zmudczyńska-Skarbek K., Balazy P. Following the flow of ornithogenic nutrients through the Arctic marine coastal food webs // J. Marine Systems. 2017. V. 168. P. 31–37. https://doi.org/10.1016/j.jmarsys.2016.12.006
Zonneveld K.A.F., Versteegh G.J.M., Kasten S., Eglinton T.I., Emeis K.C., Huguet C., Koch B.P., de Lange G.J., de Leeuw J.W., Middelburg J.J., Mollenhauer G., Prahl F.G., Rethemeyer J., Wakeham S.G. Selective preservation of organic matter in marine environments; processes and impact on the sedimentary record // Biogeosciences. 2010. V. 7. P. 483–511. https://doi.org/10.5194/bg-7-483-2010
Дополнительные материалы отсутствуют.



