Почвоведение, 2021, № 1, стр. 45-59
Влияние температуры и минеральных добавок азота и фосфора на процессы разложения и состав почвенно-коровых субстратов
В. О. Лопес де Гереню a, *, И. Н. Курганова a, Н. А. Галибина b, Е. А. Капица c, Е. В. Шорохова b, c
a Институт физико-химических и биологических проблем почвоведения РАН
142290 Московская обл., Пущино, ул. Институтская, 2, Россия
b Институт леса Карельского научного центра РАН
185910 Республика Карелия, Петрозаводск, ул. Пушкинская, 11, Россия
c Санкт-Петербургский государственный лесотехнический университет имени С.М. Кирова
5194021 Санкт-Петербург, Институтский пер., Россия
* E-mail: ikurg@mail.ru
Поступила в редакцию 27.04.2020
После доработки 25.05.2020
Принята к публикации 27.05.2020
Аннотация
В таежных лесах неотъемлемым компонентом подстилки является кора хвойных пород (КХП). На примере почвенно-коровых субстратов (ПКС), приготовленных на основе КХП, в рамках 12-месячного лабораторного эксперимента при трех контрастных температурах (2, 12 и 22°С) и достаточном увлажнении была выполнена количественная оценка влияния температурного фактора и минеральных добавок азота (N) и фосфора (Р) на скорость (DecR), константу (k) разложения КХП, общие потери С-СО2 и проанализированы изменения ее химического состава. Температурный коэффициент Q10 для средней величины DecR за время всего эксперимента варьировал от 1.1 до 2.5 в зависимости от температурного интервала и состава ПКС. Наиболее значительно влияние температуры на динамику разложения проявлялось в течение первого и второго месяцев эксперимента, объясняя 47% вариабельности величины DecR. На более поздних стадиях эксперимента ключевым фактором, влияющим на процесс разложения КХП и объясняющим 18–63% дисперсии DecR, являлся состав ПКС, определяемый внесением минеральных форм N и P. Максимальные потери С-СО2 за время всего эксперимента (158–187 г С/(кг коры) или 34–41% от исходного содержания С) наблюдались при 22°С. Наиболее существенное уменьшение спирторастворимых соединений (56–64%) при всех температурах имело место в варианте с внесением минерального N, в то время как убыль целлюлозы была наиболее значительной (64–69%) в варианте с совместным внесением N и Р, и практически не зависела от температуры проведения эксперимента. Потери лигнина были незначительными и составили лишь 3–12% их исходного количества. Внесение минеральных добавок N и Р являлось ключевым фактором стимуляции процесса разложения КХП, существенно сокращая время ее разложения и улучшая качество получаемых субстратов.
ВВЕДЕНИЕ
Неотъемлемым компонентом лесной подстилки в таежных экосистемах является древесная кора (ДК). Так, в среднетаежных ельниках доля коры может достигать 6.7% от общей массы подстилки [6]. Крупные древесные остатки состоят на 10 и более процентов из коры, а ее объем в составе порубочных остатков на свежих вырубках может достигать 21 м3/га, что по массе составляет 36 кг/га [5]. Скорость разложения ДК, как и большинства природных органических субстратов, зависит как от абиотических, так и от биотических факторов [21, 42, 60]. В определенном диапазоне температур (T), при отсутствии ограничения по содержанию влаги, скорость разложения растительных материалов, включая ДК, с повышением Т увеличивается [31, 41, 59, 63]. Зависимость скорости разложения древесных остатков от содержания влаги более сложная, поскольку и высокая, и низкая влажность могут ограничивать активность организмов-деструкторов, обитающих в коре и древесине [66].
Качество субстрата, и, прежде всего, его биохимический состав, оказывает влияние не только на биостойкость растительного материала, но и на состав микробного сообщества [25, 34, 38]. Хотя, концентрация основных биофильных элементов в коре и древесине изменяется в значительных пределах, широкие соотношения концентраций углерода к азоту (C/N) и углерода к фосфору (C/P) характерны для древесины и коры всех видов деревьев [56]. На примере разложения подстилки в бореальных и умеренных лесах было показано, что добавление минеральных форм N и P оказывает стимулирующее действие на процесс ее разложения [32, 39]. В рамках лабораторного эксперимента по оценке сопряженного влияния температуры и добавок N и P на динамику разложения коры осины было выявлено, что увеличение температуры инкубирования оказывало более слабое влияние на скорость деструкции коры осины по сравнению с внесением минеральных форм N и P [41].
С середины XIX в. произошло резкое увеличение атмосферных выпадений N и P, что сказалось не только на процессе депонирования углерода в лесных экосистемах [61], но и повлияло на скорость разложения растительных материалов, определяя тем самым актуальность количественных оценок эмиссионных потерь С из древесных остатков в целом и из ДК в частности. Из-за сложностей разделения влияния биотических и абиотических факторов в полевых условиях, наиболее предпочтительными для изучения взаимного влияния нескольких факторов на процесс распада растительных материалов являются лабораторные инкубационные эксперименты, которые проводятся в хорошо контролируемых условиях [9, 41, 52]. В рамках настоящей работы изучали сопряженное влияние температуры и минеральных добавок N и P на интенсивность биогенного разложения почвенно-коровых субстратов на основе коры хвойных пород. Задачи исследования включали: 1) описание динамики скорости разложения КХП в широком диапазоне температур (T = 2, 12 и 22°C) в течение 12-месячного инкубационного эксперимента; 2) оценку влияния минеральных добавок N и P на динамику выделения и общие потери C-CO2 во время инкубирования КХП при разных температурах; 3) количественное определение констант разложения КХП и температурной чувствительности средней скорости разложения, используя коэффициент Q10; 4) оценку изменения химического состава КХП за 12 мес. инкубирования при разных температурах.
ОБЪЕКТЫ И МЕТОДЫ
Подготовка субстратов и схема эксперимента. Смесь КПХ (ель ~70% и сосна ~30%) представляла собой свежие порубочные остатки деревьев, спиленных в текущем году и полученных при окорке стволов на лесообрабатывающем предприятии в Ленинградской области. Кору в состоянии естественной влажности (47–53%) измельчали с помощью секатора на небольшие кусочки (менее 2 × 2 см). Чтобы имитировать естественное положение коры на поверхности почвы, готовили почвенно-коровые субстраты. С этой целью в каждый флакон емкостью 500 мл помещали измельченную кору (20 г) и тщательно смешивали ее с материалом гумусового горизонта серой лесной почвой (Haplic Luvisols, Cорг = = 13.4 ± 0.9 г C/кг почвы, Nобщ = 1.01 ± 0.10 г N/кг почвы, pHKCl = 5.90 ± 0.01) в соотношении ~2 : 1 по сухой массе (или 10 : 1 по объему). Затем во флаконы с 30 г ПКС добавляли 5 мл дистиллированной воды (вариант контроль) или раствора азотных и фосфорных удобрений. Минеральные добавки в виде мочевины (NH2)2CO и двойного суперфосфата (Ca(H2PO4)2 H2O) вносили из расчета 1% от массы сухой коры для каждого элемента (азота и фосфора). Влажность субстратов соответствовала ~80% их водоудерживающей способности. Были приготовлены следующие варианты почвенно-коровых субстратов: 1 – кора + почва, ПКС (контроль); 2 – кора + почва + N, ПКС-N; 3 – кора + почва + N + P, ПКС-NP. Подготовленные флаконы с субстратами устанавливали в термостаты и инкубировали в течение 12 месяцев при трех контрастных температурах: 2, 12 и 22°С. В течение эксперимента влажность субстратов поддерживали на начальном уровне, увлажняя не реже 2–3 раз в месяц. Повторность опыта – трехкратная.
Определение скорости разложения КХП. Скорость разложения коры (decomposition rate, DecR) в составе ПКС оценивали по интенсивности выделения CO2. Измерения производили 2–5 раз в неделю в течение первых двух месяцев инкубирования и 1–2 раза в неделю в течение следующих десяти месяцев. В процессе инкубирования флаконы закрывали полиэтиленовыми пленками, проницаемыми для воздуха, но предотвращающими испарение влаги. Приблизительно за 3–5 ч до каждого измерения DecR флаконы проветривали 20–25 мин под вытяжкой в токе воздуха, затем герметично закрывали плотными резиновыми пробками и возвращали в термостат. Концентрацию CO2 во флаконах измеряли с помощью инфракрасного газоанализатора LiCor 820 (США). Величина DecR чистой почвы была очень низкой и при всех температурах не превышала 0.7–1.4% от значений DecR почвенно-коровых субстратов. Принимая во внимание этот незначительный вклад почвы в общий поток CO2 из ПКС, мы оценивали величину DecR в пересчете на сухой вес коры. Расчет DecR (мг С/кг коры/ч) проводили по формуле [40, 41]:
(1)
$DecR = dС \times 12V{\text{флак}} \times {{1000} \mathord{\left/ {\vphantom {{1000} m}} \right. \kern-0em} m} \times 22.4t \times 100,$Общую величину потерь углерода в форме CO2 за 12 мес. эксперимента (total loss, TotL-С, мг С/г коры) рассчитывали, используя кумулятивные кривые DecR.
Химические и биохимические анализы. В конце эксперимента образцы коры тщательно промывали дистиллированной водой и сушили при комнатной температуре. Концентрацию углерода (C), азота (N) и водорода (Н) в образцах измельченной коры (5 повторностей) определяли с помощью автоматического анализатора CNHS (Leco Corp., США). Содержание фосфора определяли спектрофотометрически (ОКБ Спектр СФ-2000, Россия) с молибдатом аммония после сухого озоления в муфеле [33, 58]. Величину рН измеряли в водной вытяжке (соотношение кора : вода = 1 : 25) потенциометрическим рН-датчиком (Hanna, Германия). Содержание спирторастворимых веществ (Eth-Ext), включающих алифатические и ароматические углеводы, терпены, карболовые кислоты, смолу, жирные кислоты, эфирные масла, жиры и фитостерины, а также целлюлозы (Cel) и лигнина (Lig) определяли в образцах коры до и после 12-месячного инкубирования. Содержание Lig и Cel оценивали гравиметрическим методом Классона и Кюршнера [23, 27], который был адаптирован в Аналитической лаборатории Института леса Карельского научного центра РАН [10]. Лигнин определяли в остатках экстракта после удаления битуминозных веществ и обработки 72%-ной серной кислотой; целлюлозу экстрагировали смесью концентрированной азотной кислоты и этанола (объемное соотношение = 1 : 4). Биохимические анализы и измерения рН проводили без аналитических повторностей.
Основываясь на сравнении биохимического состава образцов коры хвойных пород до и после 12-месячного инкубирования, мы оценили доли остаточных количеств основных групп органических соединений (Eth-Ext, Cel и Lig) от их начального содержания в коре хвойных пород. Изменение концентраций Eth-Ext, Lig и Cel в образцах коры в течение 12-месячного эксперимента оценивали с учетом убыли C в образцах коры за тот же период.
Обработка данных и статистический анализ. Константу разложения коры (k, 1/год) оценивали по однокомпонентной экспоненциальной модели [37, 46]:
где TotL-C – кумулятивные потери C-СО2 в результате микробного разложения коры (г С/кг коры), Со – исходное содержание С в КХП (г С/кг коры), k – константа разложения, 1/год; t – время инкубации (лет). Период полуразложения, необходимый для потери 50% углерода в исходной коре, оценивали по величине Т0.5 = 0.693/k, а время, соответствующее разложению 95% органического вещества, оценивали как Т0.95 = 3/k [3, 13, 34].Температурную чувствительность скорости разложения коры (DecR) определяли по коэффициенту Q10 [24]:
(3)
${{Q}_{{10}}} = {{\left( {{{DecR2} \mathord{\left/ {\vphantom {{DecR2} {DecR1}}} \right. \kern-0em} {DecR1}}} \right)}^{{[{{10} \mathord{\left/ {\vphantom {{10} {(T2{\text{ }}--T1)}}} \right. \kern-0em} {(T2{\text{ }}--T1)}}]}}},$Оценку влияния температуры на значения DecR, TotL-C и k проводили при помощи однофакторного дисперсионного анализа (ANOVA). Двухфакторный дисперсионный анализ использовали для сравнения различий средней величины DecR для трех вариантов, различающихся по составу ПКС, и трех различных температур. Коэффициенты корреляции Спирмена использовали для определения связи между значениями DecR в разные фазы эксперимента и TotL-C, k и химическими свойствами КХП в конце эксперимента. Статистический анализ данных проводили с использованием STATISTICA 6, при уровне значимости α = 0.05.
РЕЗУЛЬТАТЫ
Химический состав коры хвойных пород и его изменение за время проведения эксперимента. Исходные образцы КХП характеризовались кислой реакцией среды (рН = 4.7), широкими соотношениями С/N и С/Р, равными 114 и 556, соответственно, при величине С/Н = 7.8 (табл. 1). В составе КХП преобладали Lig и Cel, содержание которых в 7.6 раза превышало содержание спирторастворимых веществ.
Таблица 1.
Исходные химические характеристики коры хвойных пород
| Характеристика | Среднее ± SE |
|---|---|
| С, г/кг коры | 450 ± 11 |
| N, г/кг коры | 4.0 ± 0.1 |
| H, г/кг коры | 58 ± 0.3 |
| P, г/кг коры | 0.81 |
| C/N | 114 ± 2 |
| C/H | 7.8 ± 0.2 |
| C/P | 556 ± 14 |
| P/N | 0.20 |
| pH (H2O) | 4.7 ± 0.1 |
| Зольность, % | 4.6 |
| Спирторастворимые соединения (Eth-Ext), % | 7.8 |
| Целлюлоза (Cel), % | 32.3 |
| Лигнин (Lig), % | 27.4 |
| Eth-Ext/(Cel + Lig) | 1 : 7.6 |
| Lig/N | 69 |
Смешивание КХП с почвой для приготовления ПКС привело к нейтрализации водной суспензии, и после 12-месячной инкубации на варианте ПКС без добавок значение рН при 22°С составило 6.9 ед. (рис. 1, А). При внесении минерального N нейтрализация водной суспензии из ПКС при всех температурах была выражена более отчетливо, чем при совместном внесении N и Р: увеличение рН по сравнению с исходной корой составило 2.1–2.7 и 0.5–1.8 ед. рН соответственно. Столь существенное подщелачивание мы связываем с интенсификацией процессов разложения КХП при внесении минерального N и преимущественной потерей легкогидролизуемых органических соединений, обеспечивавших низкие значения рН (рис. 2, А), что подтверждает отрицательная корреляция между значениями рН и содержанием Eth-Ext в КХП в конце эксперимента (r = –0.77, P = 0.02; табл. S1 ).
Рис. 1.
Влияние температуры и минеральных добавок на величину рН (А), зольность (Б), содержание С (В), отношения С/N (Г), С/P (Д) и P/N (Е) в коре хвойных пород после 12 мес. инкубирования почвенно-коровых субстратов. Условные обозначения здесь и далее на рисунках (кроме рис. 3): 1 – исходная кора (контроль), 2 – ПКС, 3 – ПКС-N, 4 – ПКС-NP; ПКС – кора + почва; ПКС-N – кора + почва + N; ПКС-NP – кора + почва + N + P.

Рис. 2.
Влияние температуры и добавок минеральных форм N и P на остаток спирторастворимых веществ (А), целлюлозы (Б), лигнина (В), соотношений Lig/N (Г), Lig/Cel (Д) и доли спирторастворимых соединений (Е) в коре хвойных пород после 12 мес. инкубирования почвенно-коровых субстратов.
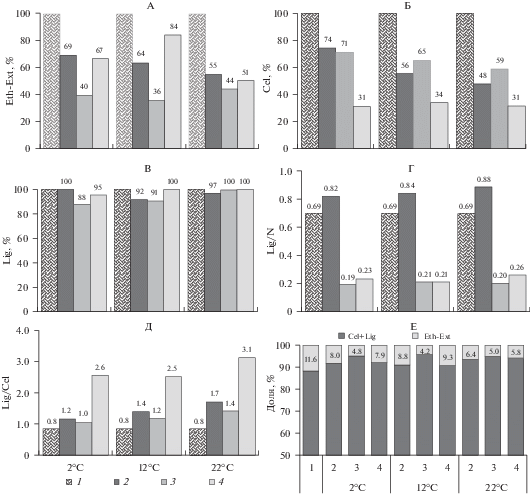
Закономерным результатом минерализации органических соединений за время 12-месячного инкубирования являлось значительное увеличение зольности (рис. 2, Б) и уменьшение содержания С по сравнению с исходной КХП (рис. 2, В). Внесение минеральных добавок ожидаемо привело к существенному росту содержания N в вариантах ПКС-N и ПКС-NP (рис. S1 ) и уменьшению в этих вариантах отношения С/N, которое в зависимости от температуры в конце проведения эксперимента изменялось от 18 до 27 (рис. 2, Г). Содержание Р увеличилось, а отношение С/Р ожидаемо уменьшилось только на варианте с внесением фосфора (рис. 1, S1 ). Отношение P/N было самым низким (0.03–0.04) на варианте ПКС-N, увеличиваясь в 6–8 раз на варианте с внесением фосфора (рис. 1, Е). Содержание Н в КХП всех вариантов опыта за 12 мес. инкубирования практически не изменилось по сравнению с содержанием Н в исходной коре (рис. S1 ). Отношение С/Н варьировало в пределах 7.3–8.0 и также слабо зависело от варианта опыта и температуры инкубирования (рис. S1 ).
Расчет парных коэффициентов корреляции показал наличие отрицательных взаимосвязей между содержанием С и Р (r = –0.84, Р < 0.01), а также между содержанием Н, Р и отношением Р/N (r = –0.82…–0.92, Р ≤ 0.01) в КХП в конце эксперимента (табл. S1 ).
За время 12-месячной инкубации произошло снижение содержания Eth-Ext и Cel на 16–64 и 26–69% от их исходного количества, соответственно (рис. 2, А, Б). Наиболее существенные потери Eth-Ext (56–64%) при всех температурах имели место в варианте с внесением минерального N, в то время как убыль Cel была наиболее значительной (64–69%) в варианте с совместным внесением N и Р и практически не зависела от температуры проведения эксперимента. Потери Lig были незначительными и составили лишь 3–12% их исходного количества (рис. 2, В).
В то же время отношение Lig/N в КХП (рис. 2, Г) в конце эксперимента в варианте без минеральных добавок незначительно возросло (в 1.2–1.3 раза) по сравнению с исходной корой, а в вариантах с внесением N закономерно уменьшились (в 2.7–3.6 раза). Добавление фосфора на фоне азота существенно ускоряло деструкцию целлюлозы, и отношение Lig/Cel в варианте ПКС-NP было в 1.8–2.6 больше по сравнению с другими вариантами опыта (рис. 2, Г). Доля более устойчивых к минерализации органических соединений (Сel + Lig) по отношению к содержанию спирторастворимых веществ (Eth-Ext) за время эксперимента увеличилась при совместном внесении N и P (рис. 3, Е).
Рис. 3.
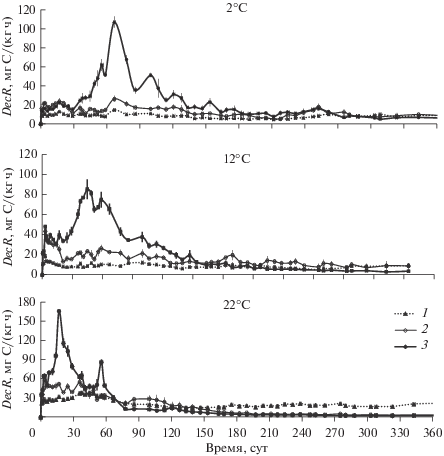
Динамика скорости выделения С-СО2 из почвенно-коровых субстратов различного состава в течение 12 мес. инкубирования при температурах 2, 12 и 22°С: 1 ‒ ПКС, 2 ‒ ПКС-N, 3 ‒ ПКС-NP.
Выявлены достоверные (P < 0.01) корреляционные связи между содержанием в КХП в конце эксперимента Cel и P (r = –0.81), Н (r = 0.88) и отношениями C/P (r = 0.81) и Р/N (r = –0.91). Поскольку содержание Cel в КХП негативно коррелировало с содержанием Lig (r = –0.78, Р = 0.01), то аналогичные описанным выше взаимосвязи для Cel только с обратными знаками были обнаружены между содержанием Lig, Р, Н и отношением С/P (табл. S1 ). Таким образом, изменения химического состава КХП и соотношения различных групп биохимических соединений в результате 12-месячного инкубирования были взаимосвязаны и в существенно большей степени определялись внесением минеральных добавок, чем температурой проведения эксперимента.
Динамика DecR в течение 12 мес. инкубирования. При поддержании постоянной и достаточной влажности динамика скорости выделения С-СО2 из ПКС (DecR) в течение 12 мес. эксперимента зависела как от варианта опыта (внесение минеральных добавок), так и от температуры инкубации (рис. 3). При 22°С обогащение ПКС минеральным N привело к наиболее заметному увеличению значений DecR в течение первых 5–6 нед. инкубирования по сравнению с ПКС без добавок. При 12 и 2°С усиление выделения С-СО2 на варианте ПКС-N было более растянуто во времени и продолжалось около пяти и семи месяцев, соответственно.
Одновременное внесение минеральных форм N и P инициировало ощутимый всплеск выделения С-СО2, продолжительность и интенсивность которого зависели от температуры проведения эксперимента. Наиболее выраженный и самый короткий (около двух месяцев) отклик DecR на добавление N и P наблюдали при 22°С. При 12 и 2°C усиленное выделение С-СО2 продолжалось около 5–6 мес., но было менее интенсивным, чем при 22°С. Наиболее заметное увеличение DecR (до 116–167 мг С/(кг коры ч)) было зарегистрировано при 22°C в течение третьей недели опыта. При 12°С самые высокие значения DecR (78–85 мг С/(кг коры ч)) наблюдали в течение седьмой недели эксперимента, а при 2°С максимальная скорость выделения С-СО2 (68–107 мг С/(кг коры ч)) была зарегистрирована в течение 11-ой недели опыта.
Через 5–7 мес. инкубирования различия в значениях DecR, вызванные добавками минеральных форм N и P, становились незначительными при всех температурах. Более того, при 22°С начиная с шестого месяца проведения эксперимента значения DecR в варианте ПКС превышали таковые в вариантах с добавлением минеральных форм N и P.
Таким образом, внесение добавок минеральных удобрений ускоряло деструкцию КХП в составе ПКС. Одновременное внесение минеральных форм N и Р индуцировало значительный всплеск DecR при всех температурах в первые месяцы проведения эксперимента. Однако при 2 и 12°С период усиленного выделения С-СО2 начинался позднее и был менее интенсивным по скорости, но более продолжительным по времени, чем при 22°С. Добавление только минерального N также вызывало усиление разложения КХП, но оно было менее выражено по сравнению с вариантом ПКС-NP при сохранении отмеченных выше закономерностей.
Влияние минеральных добавок и температуры на DecR на разных этапах эксперимента. Основываясь на временной динамике интенсивности выделения С-СО2, 12-месячный период эксперимента разделили на четыре временных интервала (1–2, 3–4, 5–6 и 7–12 мес.) и рассчитали средние значения величины DecR для каждого из них и для всего 12-месячного периода инкубирования (рис. 4). При поддержании постоянной и достаточной влажности минеральные добавки значительно увеличивали DecR на всех этапах эксперимента при всех изученных температурах, за исключением варианта ПКС-NP при 22°С в течение 5–12 мес. инкубирования. Как правило, увеличение DecR за счет минеральных добавок было наиболее выраженным в варианте ПКС-NP (в 2.6–7.4 раза) в течение первых четырех месяцев (при 2 и 22°С) или шести месяцев (при 12°С) инкубирования. Наименее заметным это увеличение было на заключительном этапе эксперимента (7–12 мес.) при 2 и 12°С. При внесении только минерального N величина DecR в первые месяцы эксперимента увеличилась не более, чем в 2.2 раза по сравнению с вариантом без добавок.
Рис. 4.
Средняя скорость выделения С-СО2 из почвенно-коровых субстратов различного состава при температурах 2, 12 и 22°С в течение различных стадий проведения инкубационного эксперимента: 1–2 мес. (1), 3–4 мес. (2), 5–6 мес. (3), 7–12 мес. (4), 1–12 мес. (5).
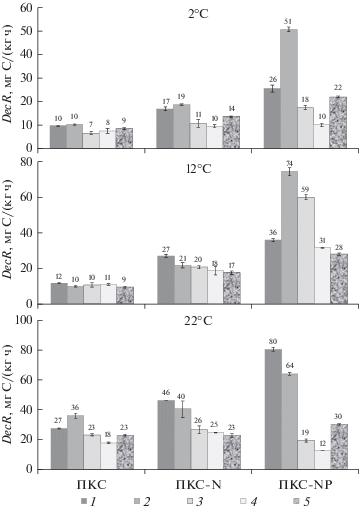
Средняя величина DecR в течение 1–2 мес. инкубирования коррелировала с содержанием лигнина и фосфора (r = 0.67–0.68, P < 0.05; табл. S2 ). Для величины DecR в течение 3–4 и 1–12 мес. эксперимента значимая (при P < 0.05) положительная связь выявлена с содержанием Lig, N и Р (r = 0.68–0.91), а отрицательная – с остаточным содержанием Cel, С, Н (r = –0.68…–0.92) и соотношениями C/P и Cel/Lig (r = –0.76…–0.90; табл. S2 ).
При поддержании постоянной и достаточной влажности влияние температуры на DecR зависело как от стадии эксперимента, так и от состава ПКС (табл. 2). В варианте ПКС без добавок значения температурного коэффициента Q10 в интервале более высоких температур (12–22°C) на всех этапах эксперимента были выше аналогичных значений в интервале более низких температур (2–12°С): 1.6–3.7 против 0.9–1.6. В вариантах с внесением минеральных форм N и Р отмеченная выше закономерность соблюдалась только для средней величины DecR в течение 1–2 мес. эксперимента. Эта закономерность была обратной для всех остальных временных интервалов. При повышении температуры инкубирования с 2 до 12°С величины Q10 были самыми высокими в течение 5–6 и 7–12 мес. в вариантах ПКС-N и ПКС-NP и составляли 1.9 и 3.1–3.4 соответственно. При повышении температуры с 12 до 22°С значения Q10 на всех стадиях эксперимента были больше в варианте ПКС без добавок, чем на вариантах ПКС-N и ПКС-NP.
Таблица 2.
Температурные коэффициенты Q10 для DecR ПКС различного состава на разных стадиях проведения эксперимента и в различных температурных интервалах
| Температурный интервал | Вариант опыта | Температурные коэффициенты Q10 | ||||
|---|---|---|---|---|---|---|
| 1-2 мес. | 3-4 мес. | 5-6 мес. | 7-12 мес. | 1-12 мес. | ||
| 2–12°C | ПКС | 1.2 | 0.9 | 1.6 | 1.4 | 1.1 |
| ПКС-N | 1.6 | 1.1 | 1.9 | 1.9 | 1.3 | |
| ПКС-NP | 1.4 | 1.5 | 3.4 | 3.1 | 1.3 | |
| 12–22°C | ПКС | 2.4 | 3.7 | 2.2 | 1.6 | 2.5 |
| ПКС-N | 1.7 | 1.9 | 1.3 | 1.3 | 1.3 | |
| ПКС-NP | 2.3 | 0.9 | 0.3 | 0.4 | 1.1 | |
Проведение двухфакторного дисперсионного анализа показало, что в течение первых двух месяцев эксперимента общая дисперсия величины DecR в равной степени объяснялась влиянием “минеральных добавок” и “температуры”, вклад которых составлял 50 и 47% соответственно (табл. 3). В течение 3–4 и 7–12 мес. инкубирования фактор “минеральные добавки” отвечал за 63 и 37% общей дисперсии DecR соответственно, a в течение 5–6 мес. эксперимента его влияние было незначимым. Влияние фактора “температура” на величину DecR было слабым в течение 3–4 мес. инкубирования и становилось незначимым, начиная с пятого месяца эксперимента. Взаимодействие факторов, напротив, было наиболее существенным в течение 5–12 мес. эксперимента, объясняя 60–77% дисперсии DecR. За время всего эксперимента дисперсия средней величины DecR на 59% объяснялась влиянием минеральных добавок и на 37% – влиянием температуры.
Таблица 3.
Влияние минеральных добавок и температуры на величину DecR на различных стадиях эксперимента (результаты двухфакторного дисперсионного анализа)
| Фактор | 1–2 месяцы | 3–4 месяцы | 5–6 месяцы | 7–12 месяцы | 1–12 месяцы | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| F | p | η2, % | F | p | ƞ2, % | F | p | ƞ2, % | F | p | ƞ2, % | F | p | ƞ2, % | |
| Температура (T) | 1021 | <0.0001 | 46.7 | 7 | 0.01 | 5.6 | 0.03 | 0.97 | 0.2 | 0.7 | 0.52 | 1.2 | 207 | <0.0001 | 37.4 |
| Минеральные добавки (МД) | 1093 | <0.0001 | 49.9 | 74 | <0.0001 | 63.1 | 3.2 | 0.07 | 17.5 | 22 | <0.0001 | 37.3 | 325 | <0.0001 | 58.8 |
| T × МД | 73 | <0.0001 | 3.4 | 35 | <0.0001 | 30.4 | 13.9 | <0.0001 | 76.8 | 35 | <0.0001 | 59.8 | 20 | <0.0001 | 3.7 |
| Ошибка | 0.0 | 0.9 | 5.5 | 1.7 | 0.2 | ||||||||||
Общие потери C-CO2 из ПКС за 12 месяцев эксперимента. При поддержании постоянной и достаточной влажности суммарные потери С в форме СО2 (TotL-C) из ПКС в течение 12 мес. эксперимента варьировали от 74–77 до 185–187 г С/(кг коры) в зависимости от температуры и состава смеси (табл. 4). Эти значения соответствовали минерализации 16–17 и 40–41% от исходного (до инкубации) содержания C в коре, составляющем 450 г C/кг коры.
Таблица 4.
Общие потери С-СО2 (TotL-C) из почвенно-коровых субстратов разного состава при различных температурах за 12 мес. инкубационного эксперимента и их доля от исходного содержания С до начала эксперимента (среднее (стандартная ошибка, SE))
| Вариант | TotL-C, г С/кг коры | TotL-C, % от начального содержания C в коре | ||||
|---|---|---|---|---|---|---|
| 2°С | 12°С | 22°С | 2°С | 12°С | 22°С | |
| ПКС | 74 (5) | 77 (4) | 152 (31) | 16 (1) | 17 (1) | 33 (7) |
| ПКС-N | 110 (4) | 128 (11) | 139 (16) | 24 (1) | 28 (2) | 30 (4) |
| ПКС-NP | 187 (4) | 185 (6) | 158 (2) | 41 (1) | 40 (1) | 34 (0) |
Максимальные потери С-СО2 наблюдали на варианте ПКС-NP при 2 и 12°С, а минимальные значения TotL-C регистрировали на варианте ПКС при тех же температурах. В зависимости от состава ПКС, величина TotL-C наиболее существенно варьировала при 2 и 12°С (от 74–77 до 185–187 г С/кг коры), и слабо изменялась при 22°С (139–158 г С/кг коры). Внесение минеральных добавок N и P увеличивало долю потерь С от их исходного содержания в 1.5–2.6 раза при 2 и 12°С и не оказывало значимого влияния при 22°С. Двухфакторный дисперсионный анализ показал, что фактор “минеральные добавки” отвечал за 57% дисперсии общих потерь C-СО2 из ПКС, тогда как фактор “температура” объяснял только 18% дисперсии величины TotL-C (табл. 5).
Таблица 5.
Влияние минеральных добавок и температуры на величину TotL-C и константы разложения (результаты двухфакторного дисперсионного анализа)
| Фактор | TotL-C | k | ||||
|---|---|---|---|---|---|---|
| F | p | η2, % | F | p | η2, % | |
| Температура (T) | 25.4 | <0.0001 | 17.8 | 51.5 | <0.0001 | 15.2 |
| Минеральные добавки (МД) | 80.7 | <0.0001 | 56.5 | 265.2 | <0.0001 | 78.2 |
| T × МД | 35.6 | <0.0001 | 25.0 | 21.6 | <0.0001 | 6.4 |
| Ошибка | 0.7 | 0.3 | ||||
Оценка констант и периодов разложения коры хвойных пород. Константы разложения КХП при поддержании постоянной и достаточной влажности субстратов при инкубировании постепенно возрастали с увеличением температуры только на вариантах ПКС и ПКС-N и незначительно варьировали в варианте ПКС-NP (табл. 6). Факторы “минеральные добавки” и “температура” объясняли соответственно 78 и 15% дисперсии констант разложения исследуемых смесей (табл. 5).
Таблица 6.
Константы разложения (k), период полуразложения T0.5 и полное время разложения T0.95 КХП в составе почвенно-коровых субстратов различного состава при различных температурах за 12 мес. инкубационного эксперимента (среднее (SE))
| Вариант | k, 1/год | T0.5, лет | T0.95, лет | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 2°С | 12°С | 22°С | 2°С | 12°С | 22°С | 2°С | 12°С | 22°С | |
| ПКС | 0.17 (0.01) | 0.19 (0.01) | 0.50 (0.02) | 3.98 (0.13) | 3.73 (0.23) | 1.40 (0.04) | 17.2 (0.5) | 16.2 (1.0) | 6.0 (0.2) |
| ПКС-N | 0.30 (0.01) | 0.37 (0.01) | 0.52 (0.05) | 2.33 (0.05) | 1.88 (0.07) | 1.36 (0.14) | 10.1 (0.2) | 8.1 (0.3) | 5.9 (0.6) |
| ПКС-NP | 0.68 (0.02) | 0.75 (0.03) | 0.67 (0.01) | 1.04 (0.02) | 0.93 (0.03) | 1.03 (0.02) | 4.5 (0.1) | 4.0 (0.1) | 4.5 (0.1) |
Период полуразложения ПКС (T0.5) также зависел от состава смеси и температуры проведения эксперимента, демонстрируя закономерности, идентичные тем, которые установлены для константы разложения. Самое короткое время полуразложения (∼1 год) было характерно для варианта ПКС-NP, и оно не зависело от температуры (табл. 6). Наиболее длительное время полуразложения (~4 года) демонстрировали ПКС без добавок при температурах 2 и 12°С. Согласно нашим оценкам, для полного разложения КХП в составе почвенно-коровых субстратов требуется от 4 до 17 лет в зависимости от их состава и температуры инкубирования.
Таким образом, при поддержании постоянной и достаточной влажности внесение минеральных добавок оказало существенный эффект на общие потери С-СО2, константы и время разложения ПКС только при температурах 2 и 12°С. При 22°С перечисленные показатели не зависели от состава ПКС. В целом температурный фактор объяснял 15–18% дисперсии величины k и TotL-C, в то время как фактор “минеральные добавки” объяснял 57–78% вариабельности этих величин.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние минеральных добавок на процессы разложения КХП. Подобно большинству растительных материалов [2, 56], в составе исследуемой смеси коры хвойных пород, преобладающим элементом является С при существенно более низком содержании других биофильных элементов, что значительно ограничивает интенсивность биогенного разложения растительных остатков в условиях несбалансированных (для деструкторов) пропорций питательных веществ [1, 8, 11]. Концентрации N и P в древесине и коре являются недостаточными для создания и поддержания активности микробной биомассы организмов-деструкторов [15, 16, 49]. В процессе биогенного разложения КХП в составе почвенно-коровых субстратов, куда добавляли минеральный N, происходило существенное обогащение смесей азотом и уменьшалось отношение С/N (рис. 1, S1 ). В 12-месячных лабораторных экспериментах по компостированию коры осины, сосны, ели и лиственницы было показано, что доступность N является ключевым фактором для стимуляции процесса распада коры [13]. В наших более ранних экспериментах с ПКС на основе коры осины было выявлено, что внесение добавок N и Р в виде минеральных удобрений сдвигало соотношения C/N и C/P в сторону более благоприятных условий для сообщества микроорганизмов и существенно увеличивало скорость разложения коры осины [41].
В настоящем исследовании добавление минеральных форм N и P значительно увеличивало значения DecR при всех изученных температурах, но преимущественно в первые 4–6 мес. эксперимента (рис. 5 ). Аналогично для ПКС на основе коры осины, одновременное внесение азотно-фосфорных удобрений в почвенно-коровые смеси на основе КХП приводило к большему эффекту, чем внесение только минерального азота. Сходные результаты – очевидное увеличение DecR за счет добавления минеральных азотно-фосфорных удобрений к композициям на основе древесной коры – были продемонстрированы в однолетних лабораторных экспериментах для коры осины, сосны, ели и лиственницы [12, 13]. Было показано, что после пяти месяцев компостирования сосновой коры с добавками минеральных азотно-фосфорных удобрений количество биомассы грибов увеличилось в пять раз по сравнению с чистой сосновой корой [13]. Предполагается, что распад коры и древесных тканей непосредственно связан с активностью ферментов, разрушающих целлюлозу и лигнин, путем распределения ресурсов и, как правило, ограничен доступностью N и/или P [54, 55]. При низкой доступности свободных N и P микроорганизмы затрачивают больше энергии на синтез эктоэнзимов, чтобы получить необходимое количество N и P из органических материалов [54, 55]. Было обнаружено, что скорость разложения древесных материалов покрытосеменных пород положительно коррелирует с такими характеристиками древесины, как концентрации P и N [62]. В нашем эксперименте средняя скорость разложения ПКС за 12 мес. инкубирования и общие потери С за это время также положительно коррелировали с концентрацией N и Р и были отрицательно связаны с отношениями C/N, C/P и концентрацией Н в КХП по окончании опыта.
Из-за различий между влиянием минеральных добавок N и P на микробное сообщество, процессы минерализации и иммобилизации питательных веществ идут при внесении этих элементов разными путями, причем усвоение Р инициирует более ощутимые потоки веществ, чем усвоение N [48, 57]. Взаимодействия между N и P для биохимических и микробных процессов сложны, особенно для N, который содержится в нуклеиновых кислотах, полисахаридах, белках и гуминовых веществах [54]. Кроме того, некоторые зарубежные исследователи [28, 54] отмечают, что повышенная доступность P при внесении фосфорных удобрений также может уменьшать ингибирующее влияние минерального N во время разложения древесной коры. Ранее, на примере коры осины мы показали, что влияние совместного применения N и P привело к более глубоким биохимическим изменениям состава ПКС после 12-месячного инкубирования, чем добавление одного азота [41]. В настоящем эксперименте при всех температурах наблюдали более выраженное уменьшение содержания С, Н, Cel и отношения Cel/Lig в КХП при одновременном внесении N и P по сравнению с внесением одного азота (рис. 1, 2, S1 ). Остаточные количества Eth-Ext и Lig подчинялись обратной закономерности при всех температурах: их содержание в КХП в конце эксперимента при совместном добавлении N и Р было больше, чем при внесении только N, то есть совместное внесение N и Р ингибировало разложение лигнина и спирторастворимых веществ. Таким образом, добавляя к исходным ПКС минеральные формы N и Р, мы получили разные типы условий, которые характеризуются разными соотношением основных биофильных элементов – C/N, C/P, P/N (рис. 1). В одних субстратах (ПКС-N) были созданы более благоприятные условия для разрушения лигнина и особенно экстрактивных веществ (среди которых, вероятно, есть те, которые придают древесине устойчивость к биодеградации, то есть в принципе плохо разлагаются), а в других (ПКС-NР) – деградация лигнина практически не происходила, а экстрактивных веществ – замедлялась, но при этом активно утилизировалась целлюлоза. При температуре 22°С утилизация лигнина происходила менее активно, чем при 2 и 12°С, о чем свидетельствуют более высокие отношения Lig/N и Lig/Cel (рис. 2). По-видимому, по этой причине общие потери С в варианте ПКС-NP были самыми низкими при 22°С.
На примере растений было показано, что для нормального развития микоризы, обеспечивающей растения аммонийным азотом, необходимо определенное соотношение P/N в почве [20]. Если и азот, и фосфор лимитированы, то микориза гриба первоначально преобразует недоступные формы фосфора, извлекая энергию, которая в дальнейшем будет использована бактериями для фиксации азота [19]. Напротив, избыток фосфора не способствует улучшению потребления азота за счет азотфиксирующих бактерий. Так, например, при увеличении содержания фосфора в почве больше, чем ~140 мг/кг микориза становится неэффективна, что ухудшает потребление азота [14, 18].
В нашем эксперименте было выявлено также, что добавки минеральных форм N и Р значительно (в 1.5–2.6 раза) увеличивали общие потери С-СО2 и константы разложения только при температурах 2 и 12°C (табл. 4). Добавление минеральных форм N и P при 22°C на эти показатели не влияло. Но, несмотря на это, периоды полуразложения (T0.5) и полного разложения (T0.95) КХП в составе ПКС были самыми короткими при совместном применении N и P, составляя около 1 года и 4–4.5 лет соответственно и не зависели от температуры. Время, необходимое для полного разложения КХП в зоне бореальных лесов в естественных условиях, будет наиболее близким к величине T0.95 для варианта ПКС при температуре 2°С и, согласно нашим оценкам, может составлять 17 лет. Обнаружены тесные положительные корреляционные связи между величиной T0.95 и отношением C/N (r = 0.75; P = 0.04), подтверждая высказанное выше утверждение, что доступность N является ключевым фактором для стимуляции процесса разложения КХП. Аналогичные взаимосвязи были обнаружены в 12-месячных лабораторных экспериментах по компостированию композиций с корой осины, сосны, ели и лиственницы [13]. В естественных условиях, когда кора прикреплена к стволу, в процессе разложения происходит накопление азота [47, 50, 53], а в коре в составе порубочных остатков такого накопления не происходит [5].
Дисперсионный анализ показал, что качество субстрата было ключевым фактором, регулирующим процесс разложения КХП на всех этапах проведения эксперимента. Минеральные добавки N и P влияли на соотношения C/N и Lig/Cel во время длительной инкубации КХП и вызывали значительное увеличение величин DecR, k и общих потерь углерода, тем самым уменьшая время ее разложения. Из-за сдвига в соотношениях C/N и C/P в сторону более благоприятных условий для сообщества микроорганизмов, влияние совместного внесения N и P в ПКС на основе КХП было заметнее, чем эффект от добавления только N.
Влияние температуры на процессы разложения ПКС. В условиях достаточного увлажнения температура является ключевым абиотическим фактором, контролирующим процесс разложения органических веществ почвы [37, 40], растительного опада [42, 43] и древесных остатков, включая древесную кору [37, 41, 45]. Повышение температуры окружающей среды приводило к значительному увеличению скорости разложения древесных остатков, если не было ограничения по содержанию влаги [29, 35, 44, 64, 65]. В нашем лабораторном эксперименте увеличение температуры в интервале 2–22°C значимо влияло на увеличение значений DecR только за первые два месяца инкубирования, объясняя менее половины (47%) дисперсии величины DecR (табл. 3). На более поздних стадиях эксперимента (5–12-й месяцы) влияние температуры было незначимым, а основным фактором, определяющим скорость разложения КХП, был состав ПКС. Возможное объяснение полученных результатов состоит в том, что в течение первого периода инкубации в КХП присутствовали легкоразлагаемые субстраты, разложение которых происходило с достаточно высокой скоростью и без внесения N и P. Позднее, когда в составе КХП преобладающими компонентами являются целлюлоза и лигнин, ключевым фактором, определяющим скорость разложения КХП, становится качество субстрата, то есть доступность N и P для организмов-деструкторов. Было выявлено, что увеличение температуры инкубирования с 12 до 22°C вызывало заметный рост скорости разложения ПКС без применения добавок, а температурная чувствительность DecR на всех этапах проведения эксперимента была существенно выше, чем соответствующие значения Q10 для скорости разложения КХП в смесях с минеральными добавками (табл. 2).
В последнее время было выявлено, что температура влияет на биогенное разложение растительных остатков за счет сочетания прямых и косвенных эффектов [51]. Прямой эффект приводит к изменениям скоростей ферментативно-катализируемых микробных процессов, тогда как косвенный эффект проявляется в изменении структуры микробных сообществ [17, 22]. Кроме того, активность разложения значительно варьирует среди грибов, означая, что состав грибного сообщества играет важную роль в регулировании скоростей разложения древесных остатков [26, 30, 51]. Поэтому процесс биохимической трансформации КХП в составе почвенно-коровых смесей очень сложный и отражает взаимосвязанный эффект биотических и абиотических факторов, а также прямые и косвенные температурные эффекты.
Проведенные исследования имеют не только теоретический, но и практический аспект. Так, переработка древесины связана с получением большого количества отходов. В первую очередь, это отходы окорки древесины, образующиеся при ее подготовке к производству целлюлозы, древесной массы и других полуфабрикатов, скапливающиеся в отвалах [4]. Проблема утилизации таких отвалов весьма актуальна и может происходить либо путем их сжигания, либо путем их использования в качестве основного компонента для производства органических компостов, в которые добавляют минеральные удобрения, чтобы получить сбалансированный по основным элементам питания субстрат [13].
ЗАКЛЮЧЕНИЕ
Состав почвенно-коровых субстратов и температура проведения эксперимента оказали существенное влияние на динамику разложения, суммарные потери C-СО2 за 12 мес. эксперимента и константу разложения коры хвойных пород. Температура существенно влияла на скорость разложения КХП только в течение первых двух месяцев инкубирования, когда общее количество питательных веществ в ней было достаточно высоким и ограничивало процесс разложения КХП в незначительной степени. На более поздних стадиях разложения ведущим фактором становится состав ПКС, поскольку концентрация биогенных элементов N и P уже в более значительной степени может лимитировать разложение более устойчивых компонентов коры – целлюлозы и лигнина. Мы показали, что совместное влияние температуры и минеральных добавок на процессы разложения КХП зависело от стадии проведения эксперимента и было максимальным в первые 5–6 мес. инкубирования. Применение минеральных добавок для ускорения процессов компостирования почвенно-коровых субстратов на основе КХП и получения композиций, более сбалансированных по основным питательным элементам, представляется перспективным в целях утилизации отходов лесозаготовительной и деревообрабатывающей промышленности.
Список литературы
Ведрова Э.Ф. Разложение органического вещества лесных подстилок // Почвоведение. 1997. № 2. С. 216–223.
Гелес И.С. Древесная биомасса и основы экологически приемлемых технологий ее химико-механической переработки. Петрозаводск: КарНЦ РАН, 2001. 382 с.
Гришина Л.А., Копцик Г.Н., Макаров М.И. Трансформация органического вещества почв. М.: Изд-во Моск. ун-та, 1990. 88 с.
Девятловская А.Н., Журавлева Л.Н., Девятловский Н.В. Утилизация древесной коры девевоперерабатывающих предприятий // Актуальные проблемы лесного комплекса. 2010. № 27. С. 51–54.
Капица Е.А., Шорохова Е.В., Ромашкин И.В., Галибина Н.А., Никерова К.М., Казарцев И.А. Разложение коры в составе порубочных остатков после сплошных рубок в среднетаежных лесах // Лесоведение. 2019. № 1. С. 38–48. https://doi.org/10.1134/S0024114819010066
Кузнецов М.А. Влияние условий разложения и состава опада на характеристики и запас подстилки в средне-таежном чернично-сфагновом ельнике // Лесоведение. 2010. № 6. С. 54–60.
Курганова И.Н., Лопес де Гереню В.О., Аблеева В.А., Быховец С.С. Климат южного Подмосковья: современные тренды и оценка экстремальности // Фундаментальная и прикладная климатология. 2017. № 4. С. 62–78. https://doi.org/10.21513/2410-8758-2017-4-66-82
Ларионова А.А., Квиткина А.К., Быховец С.С., Лопес де Гереню В.О., Колягин Ю.Г., Каганов В.В. Влияние азота на минерализацию и гумификацию лесных опадов в модельном эксперименте // Лесоведение. 2017. № 2. С. 128–139.
Никонова Л.Г., Курганова И.Н., Лопес де Гереню В.О., Жмурин В.А., Головацкая Е.А. Влияние абиотических факторов на разложение опада растений-торфообразователей в инкубационном эксперименте // Вестн. Том. гос. ун-та. Биология. 2019. № 46. С. 148–170. https://doi.org/10.17223/19988591/46/8
Оболенская А.В., Ельницкая 3.П., Леонович А.А. Лабораторные работы по химии древесины и целлюлозы. М.: Экология, 1991. 320 с.
Семенов В.М., Ходжаева А.К. Агроэкологические функции растительных остатков в почве // Агрохимия. 2006. № 7. С. 63–81.
Ульянова O.A., Нечаева (Бабур) A.C., Хижняк C.B. Трансформация сосновой коры и композиций на ее основе // Вестник КрасГАУ. 2009. № 11. С. 126–130.
Ульянова О.А., Чупрова В.В. Минерализация коры различных видов деревьев и удобрительных композиций на ее основе // Агрохимия. 2015. № 2. С. 33–45.https://doi.org/10.14258/jcprm.2018043847
Abbott L.K., Robson A.D. Growth of subterranean clover in relation to the formation of endomycorrhizas by introduced and indigenous fungi in a field soil // New Phytologist. 1978. V. 81. P. 575–585. https://doi.org/10.1111/j.1469-8137.1978.tb01631.x|
Alexander M.L. Introduction to soil microbiology. N.Y.: John Wiley that and Sons, 1977. 472 p.
Allison F.E. Decomposition wood and bark sawdusts in soil, nitrogen requirements, and effect on plants // Technical Bulletin № 1332. Agricultural Research Service. United States Department of Agriculture. 1965. 58 p.
Allison S.D., Wallenstein M.D., Bradford M.A. Soil-carbon response to warming dependent on microbial physiology // Nature Geoscience. 2010. V. 3. P. 336–340. https://doi.org/10.1038/NGEO846
Amijee F., Tinker P.B., Stribley D.P. The development of endomycorrhizal root systems. VII. A detailed study of effects of soil phosphorus on colonization // New Phytologist. 1989. V. 111. P. 435–446.
Artursson V., Finlay R.D., Jansson J.K. Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth // Environmental Microbiology. 2006. V. 8. P. 1–10. https://doi.org/10.1111/j.1462-2920.2005.00942.x|
Baum C., Makeschin F. Effects of nitrogen and phosphorus fertilization on mycorrhizal formation of two poplar clones (Populus trichocarpa and P. tremula × × tremuloides) // J. Plant Nutrition and Soil Science. 2000. V. 163. P. 491–497. https://doi.org/10.1002/1522-2624(200010)163:5<491: AID-JPLN491>3.0.CO;2-3|
Benbi D.K., Khosa M.K. Effects of Temperature, Moisture, and Chemical Composition of Organic Substrates on C Mineralization in Soils // Communications in Soil Science and Plant Analysis. 2014. V. 45(21). P. 2734–2753.https://doi.org/10.1080/00103624.2014.950423
Bradford M.A. Thermal adaptation of decomposer communities in warming soils // Front. Microbiol. 2013. V. 4. Article 333. https://doi.org/10.3389/fmicb.2013.00333
Browning B.L. Methods of Wood Chemistry. New York, London: Intersci. Publ. 1967. V. 2. 498 p. https://doi.org/10.1002/pol.1968.160061112|
Chen H., Harmon M.E., Griffiths R.P., Hicks W. Effects of temperature and moisture on carbon respired from decomposing woody roots // For. Ecol. Manag. 2000. V. 138. P. 51–64.
Cornwell W.K., Cornelissen J.H.C., Allison S.D., Bauhus J., Eggleton P., Preston C.M., Scarff F., Weedon J.T., Wirth C., Zanne A.E. Plant traits and wood fates across the globe: rotted, burned, or consumed? // Global Change Biol. 2009.V. 15. P. 2431–2449. https://doi.org/10.1111/j.1365-2486.2009.01916.x
Crowther T.W., Boddy L., Jones T.H. Outcomes of fungal interactions are determined by soil invertebrate grazers // Ecol. Lett. 2011. V. 14. P. 1134–1142. https://doi.org/10.1111/j.1461-0248.2011.01682.x
Dence C.W. The determination of lignin // Methods of Lignin Chemistry. Berlin: Springer-Verlag, 1992. P. 33–61. https://doi.org/10.1007/978-3-642-74065-7_3
Fog K. The effect of added nitrogen on the rate of decomposition of organic matter // Biol. Rev. 1988. V. 63. P. 433–462.
Forrester J.A., Mladenoff D.J., Gower S.T., Stoffel J.L. Interactions of temperature and moisture with respiration from coarse woody debris in experimental forest canopy gaps // Forest Ecol. Manag. 2012. V. 265. P. 124–132. https://doi.org/10.1016/j.foreco.2011.10.038
Gessner M.O., Swan C.M., Dang C.K., McKie B.G., Bardgett R.D., Wall D.H., Hattenschwiler S. Diversity meets decomposition // Trends Ecol. Evol. 2010. V. 25. P 372–380. https://doi.org/10.1016/j.tree.2010.01.010
Harmon M.E., Franklin J.F., Swanson F.J., Sollins P., Gregory S.V., Lattin N.G., Sedell J.R., Lienkaemper G.W., Cromack K., Jr., Cummins K.W. Ecology of coarse woody debris in temperate ecosystems // Advan. Ecol. Res.1986. V. 15. P. 133–302.
Hobbie S.E., Vitousek P.M. Nutrient limitation of decomposition in Hawaiian forests // Ecology. 2000. V. 81. P. 1867–1877. https://doi.org/10.1890/0012-9658(2000)081[1867:NLODIH] 2.0.CO;2
Houba V.J.G., Lexmond Th.M., Novozamsky I., van der Lee J.J. State of the art and future developments in soil analysis for bioavailability assessment // Science of the Total Environment. 1996. V. 178. P. 21–28.https://doi.org/10.1016/0048-9697(95)04793-X
Hu Z., Xu C., McDowell N.G., Johnson D.J., Wang M., Luo Y., Zhou X., Huang Z. Linking microbial community composition to C loss rates during wood decomposition // Soil Biol. Bioch. 2017. V. 104. P. 108–116.https://doi.org/10.1016/j.soilbio.2016.10.017
Jomura M., Kominami Y., Tamai K., Miyama T., Goto Y., Dannoura M., Kanazawa Y. The carbon budget of coarse woody debris in a temperate broad-leaved secondary forest in Japan // Tellus B. 2007. V. 59. P. 211–222.https://doi.org/10.1111/j.1600-0889.2006.00234.x
Kahl T., Arnstadt T., Baber K., Bässler C., Bauhus J., Borken W., Buscot F., Floren A., Heibl C., Hessenmöller D., Hofrichter M., Hoppe B., Kellner H., Krüger D., Linsenmair K.E., Matzner E., Otto P., Purahong W., Seilwinder C., Schulze E.-D., Wende B., Weisser W.W., Gossner M.M. Wood decay rates of 13 temperate tree species in relation to wood properties, enzyme activities and organismic diversities // Forest Ecol. Manag. 2017. V. 391. P. 86–95. https://doi.org/10.1016/j.foreco.2017.02.012
Kätterer T., Reichstein M., Andren O., Lomander A. Temperature dependence of organic matter decomposition: a critical review using literature data analyzed with different model // Biol. Fertil. Soils. 1998. V. 27. P. 258–262.
Kazartsev I., Shorohova E., Kapitsa E., Kushnevskaya E. Decaying Picea abies log bark hosts diverse fungal communities // Fungal Ecology. 2018. V. 33. P. 1–12. https://doi.org/10.1016/j.funeco.2017.12.005
Knorr M., Frey S.D., Curtis P.S. Nitrogen additions and litter decomposition: A meta-analysis // Ecology. 2005. V. 86. P. 3252–3257. https://doi.org/10.1890/05-0150
Kurganova I.N., Lopes de Gerenyu V.O., Gallardo Lancho J.F., Oehm C.T. Evaluation of the Rates of Soil Organic Matter Mineralization in Forest Ecosystems of Temperate Continental, Mediterranean, and Tropical Monsoon Climates // Euras. Soil Sci. 2012. V. 45(1). P. 68–79. https://doi.org/10.1134/S1064229312010085
Kurganova I., Lopes de Gerenyu V., Natalia Galibina N., Kapitsa E., Shorohova E. Coupled effect of temperature and mineral additions facilitates decay of aspen bark // Geoderma. 2018. V. 316 P. 27–37. https://doi.org/10.1016/j.geoderma.2017.12.014
Larionova A.A., Maltseva A.N., Lopes de Gerenyu V.O., Kvitkina A.K., Bykhovets S.S., Zolotareva B.N., Kudeyarov V.N. Effect of temperature and moisture on the mineralization and humification of leaf litter in a model incubation experiment // Eurasian Soil Science. 2017. № 4. P. 422–431. https://doi.org/10.1134/S1064229317020089
Nikonova L.G., Golovatskaya E.A., Kur’ina I.V., Kurganova I.N. Decomposition Rate of Peat-Forming Plants in Oligotrophic Bogs of the Southern Taiga Subzone of Western Siberia: Assessment of the Effect of Water Table Level and Peat Deposit Temperature // Eurasian Soil Science. 2019. V. 52. № 9. P. 1101–1111. https://doi.org/10.1134/S1064229319090060
Ohtsuka T., Shizu Y., Hirota M., Yashiro Y., Shugang J., Iimura Y., Koizumi H. Role of coarse woody debris in the carbon cycle of Takayama forest, central Japan // Ecol Res. 2014. V. 29. P. 91–101. https://doi.org/10.1007/s11284-013-1102-5
Olajuyigbe S., Tobin B., Nieuwenhuis M. Temperature and moisture effects on respiration rate of decomposing logs in a Sitka spruce plantation in Ireland // Forestry. 2012. V. 85(4). P. 485–496. https://doi.org/10.1093/forestry/cps045
Olson J. Energy storage and the balance of producers and decomposers in ecological systems // Ecology. 1963. V. 44(2). P. 322–331. https://doi.org/10.2307/1932179
Palviainen M., Laiho R., Mäkinen H., Finér L. Do decomposing Scots pine, Norway spruce, and silver birch stems retain nitrogen? // Can. J. For. Res. 2008. V. 38(12). P. 3047–3055. https://doi.org/10.1139/X08-147
Plante A.F. Soil biogeochemical cycling of inorganic nutrients and metals // Soil microbiology, ecology and biochemistry. Elsevier, New York, New York, USA. 2005. P. 389–432.
Qualls R.G., Richardson C.J. Phosphorus Enrichment Affects Litter Decomposition, Immobilization, and Soil Microbial Phosphorus in Wetland Mesocosms // Soil Sci. Soc. Am. J. 2000. V. 64. P. 799–808. https://doi.org/10.2136/sssaj2000.642799x
Romashkin I., Shorohova E., Kapitsa E., Galibina N., Nikerova K. Carbon and nitrogen dynamics along the log bark decomposition continuum in a mesic old-growth boreal forest // European J. Forest Research. 2018. V. 137(5). P. 643–657. https://doi.org/10.1007/s10342-018-1131-2
Rubenstein M.A., Crowther T.W., Maynard D.S., Schilling J.S., Bradford M.A. Decoupling direct and indirect effects of temperature on decomposition // Soil Biol. Bioch. 2017. V. 112. P. 110–116.https://doi.org/10.1016/j.soilbio.2017.05.005
Semenov V.M., Pautova N.B., Lebedeva T.N., Khromychkina D.P., Semenova N.A., Lopes de Gerenyu V.O. Plant Residues Decomposition and Formation of Active Organic Matter in the Soil of the Incubation Experiments // Eurasian Soil Science. 2019. V. 52(10). P. 1183–1194. https://doi.org/10.1134/S1064229319100119
Shorohova E., Kapitsa E., Kazartsev I., Romashkin I., Polevoi A., Kushnevskaya A. Tree species traits are the predominant control on the decomposition rate of tree log bark in a mesic old-growth boreal forest // For. Ecol. Manag. 2016. V. 377. P. 36–45. https://doi.org/10.1016/j.foreco.2016.06.036
Sinsabaugh R.L., Antibus R.K., Linkins A.E., McClaugherty C.A., Rayburn L., Repert D., Weiland T. Wood decomposition: nitrogen and phosphorus dynamics in relation to extracellular enzyme activity // Ecology 1993. V. 74. P. 1586–1593. https://doi.org/10.2307/1940086
Sinsabaugh R.L., Antibus R.K., Linkins A.E., Rayburn L., Repert D., Weiland T. Wood decomposition over a first-order watershed: mass loss as a function of exoenzyme activity // Soil Biol. Bioch. 1992. V. 24. P. 743–749. https://doi.org/10.1016/0038-0717(92)90248-V
Skonieczna J., Małek S., Polowy K., Węgiel A. Elements Content of Scots pine (Pinus sylvestris L.) stands of different densities // Drewno Prace Naukowe Doniesienia Komunikaty. 2014. V. 57(192). P. 77–87.
Stefano M., Trofymow J.A., Jackson R.B., Porporato A. Stoichiometric controls on carbon, nitrogen, and phosphorus dynamics in decomposing litter // Ecol. Monogr. 2010. V. 80(1). P. 89–106. https://www.jstor.org/stable/27806875
Tan K.H. Soil Sampling, preparation and analysis (2ndedition). Florida, USA. 2005. 623 p. https://trove.nla.gov.au/work/9640029
Taylor B.R., Parkinson D. Aspen and pine leaf litter decomposition in laboratory microcosms. II. Interactions of temperature and moisture level // Can. J. Bot. 1988. V. 66. P. 1966–1973. https://doi.org/10.1139/b88-269
Thongjoo C., Miyagawa S., Kawakubo N. Effects of Soil Moisture and Temperature on Decomposition Rates of Some Waste Materials from Agriculture and Agro-industry // Plant Production Science. 2005. V. 8(4). P. 475–481. https://doi.org/10.1626/pps.8.475
Wang R., Goll D., Balkanski Y., Hauglustaine D., Boucher O., Ciais P., Janssens I., Penuelas J., Guenet B., Sardans J., Bopp L., Vuichard N., Zhou F., Li B., Piao S., Peng S., Huang Y., Tao S. Global forest carbon uptake due to nitrogen and phosphorus deposition from 1850 to 2100 // Glob Chang Biol. 2017. V. 23(11). P. 4854–4872. https://doi.org/10.1111/gcb.13766
Weedon J.T., Cornwell W.K., Cornelissen J.H.C., Zanne A.E., Wirth C., Coomes D.A. Global meta-analysis of wood decomposition rates: a role for trait variation among tree species? // Ecol. Lett. 2009. V. 12. P. 45–56. https://doi.org/10.1111/j.1461-0248.2008.01259.x
Winckler J.P., Cherry R.S., Schlesinger W.H. The Q10 relationship of microbial respiration in a temperate forest soil // Soil Biol. Biochem. 1996. V. 28(8). P. 1067–1072. https://doi.org/10.1016/0038-0717(96)00076-4
Wu J., Zhang X., Wang H., Sun J., Guan D. Respiration of downed logs in an old-growth temperate forest in north-eastern China // Scand. J. Forest Res. 2010. V. 25. P. 500–506. https://doi.org/10.1080/02827581.2010.524166
Yoon T.K, Han S., Lee D., Han S.H., Noh N.J., Son Y. Effects of sample size and temperature on coarse woody debris respiration from Quercus variabilis logs // J. For. Res. 2014. V. 19(2). P. 249–259. https://doi.org/10.1007/s10310-013-0412-3
Zhou L., Dai L., Gu H., Zhong L. Review on the decomposition and influence factors of coarse woody debris in forest ecosystem // J. For. Res. 2007. V. 18(1). P. 48–54. https://doi.org/10.1007/s11676-007-0009-9
Дополнительные материалы
- скачать ESM.docx
- Рис. S1. Влияние температуры и минеральных добавок на содержание N (А), Н (Б), Р (В) и отношение С/Н (Г) в коре хвойных пород после 12 месяцев инкубирования почвенно-коровых субстратов: исходная кора (контроль, 1), ПКС (2), ПКС-N (3), ПКС-NP (4). ПКС ‒ кора+почва; ПКС-N ‒ кора+почва+N; ПКС-NP ‒ кора+почва+N+P.
Таблица S1. Коэффициенты корреляции Спирмена между концентрациями С, Р, N, Н, P, Cel, Lig, Eth-Ext, их отношениями, значениями рН(Н2О) и зольностью коры в конце проведения эксперимента
Таблица S2. Коэффициенты корреляции Спирмена между общими потерями C-CО2 за время всего эксперимента (TotL-С, г/кг коры), средними величинами DecR на разных стадиях эксперимента и концентрациями С, Р, N, Н, P, Cel, Lig, Eth-Ext, их отношениями, значениями рН(Н2О) и зольностью коры в конце проведения эксперимента.


