Почвоведение, 2021, № 11, стр. 1346-1362
Эколого-трофическая структура и таксономическая характеристика сообществ микроорганизмов почв северной части архипелага Новая Земля
Д. А. Никитин a, *, Л. В. Лысак b, О. В. Кутовая a, Т. А. Грачева b
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: dimnik90@mail.ru
Поступила в редакцию 17.02.2021
После доработки 15.04.2021
Принята к публикации 27.04.2021
Аннотация
С помощью метода посева на элективные среды оценены численность и таксономическое разнообразие микроорганизмов в почвах северной части архипелага Новая Земля. Содержание аэробных и анаэробных азотфиксаторов, а также денитрификаторов низкое (десятки и сотни КОЕ/г почвы). Численность сапротрофных бактерий варьировала от 3.3 × 104 до 1.2 × 106 КОЕ/г почвы; актиномицетов – от 1.3 × 103 до 4.0 × 105 КОЕ/г почвы; микромицетов – от 2.5 × 102 до 1.5 × 104 КОЕ/г почвы. Численность всех изученных групп микроорганизмов (кроме аэробных азотфиксаторов) исследованных почв резко уменьшается вниз по профилю, что положительно коррелирует с содержанием органического углерода и общего азота. В сообществе почвенных микроорганизмов доминируют бактерии родов Arthrobacter и Bacillus, актиномицеты родов Streptomyces и Micromonospora, а также микроскопические грибы родов Goffeauzyma, Phoma, Pseudogymnoascus и Thelebolus. В целом численность и таксономическое разнообразие микроорганизмов исследованных почв меньше по сравнению с почвами Земли Франца-Иосифа. Этот феномен связан с иссушающим и охлаждающим влиянием самого крупного ледника в России на Новой Земле.
ВВЕДЕНИЕ
Информация о природе Новой Земли (НЗ) скудна, поскольку с 1954 г. до 90-х гг. XX в. здесь находился испытательный полигон ядерного оружия [31]. Только с 2009 г., после появления национального парка “Русская Арктика”, появилась возможность продолжить изучение природы архипелага [32]. С 2012 г. получению новых знаний о НЗ во многом способствует научно-образовательный проект “Арктический Плавучий Университет”.
Несмотря на то, что НЗ является крупнейшим архипелагом Европейской Арктики, о его физико-географических характеристиках имеется лишь общая информация [30]. Климат НЗ арктический с продолжительной холодной (до –40°C) зимой, сильными ветрами (до 40–50 м/с) и существенными осадками (300–400 мм/год). Средняя температура августа не превышает +2.5°C на севере и +6.5°C на юге. Характерная особенность НЗ – высокая влажность воздуха (90–100%) и частые туманы [32]. Спецификой о. Северный является расположение на нем самого большого (около 20 тыс. км2) покровного ледника России.
Территория НЗ относится к Урало-Пайхойской складчатости с палеозойскими и мезозойскими глинистыми сланцами, известняками, доломитами и алевролитами, перекрытыми четвертичными ледниковыми и морскими отложениями [18], а также элювием, коллювием, пролювием и делювием [1, 32].
Рельеф НЗ представлен горными массивами до 1500 м и морскими террасами до 1000 м разделенными денудационно-абразионными равнинами до 300 м [1]. На побережье НЗ образуются такие аккумуляционные формы, как пляжи и косы, а также полигоны, пятна, полосы.
С геоботанической точки зрения север архипелага относится к высокоарктическим пустошам [58]. В фитоценозах доминируют мохообразные и лишайники. Характерными цветковыми растениями являются ивки Salix polaris и камнеломки Saxifraga oppositifolia. По числу видов лидируют семейства мятликовых (Poaceae) и камнеломковых (Saxifragaceae) [24, 32].
Почвы НЗ изучены лишь на западном побережье архипелага [6, 7, 18, 30], где они преимущественно представлены полосчатыми комплексами каменистых россыпей и почво-пленками [7, 18]. Профиль большинства почв редуцирован и от окружающих пород отличается повышенным содержанием иллита, каолинита и смектита [18]. В северной части архипелага, где проведены данные исследования, почвенный покров состоит из чередования пелоземов сильноскелетных остаточно-карбонатных (Skeletic Leptosols (Loamic)), карбопетроземов (Calcaric Leptosols (Protic)), петроземов (Skeletic Leptosols (Protic)) и криоземов (Oxyaquic Cryosols (Loamic)) [27].
Информация о микроорганизмах НЗ отрывочна, касается лишь культивируемых простейших и бактерий озер, а также поверхности растений [48]. Ранее получены сведения о биологической активности почв отдельных районов северной части о. Северный НЗ [27]. Однако таксономическое разнообразие бактерий, актиномицетов и микромицетов почв – крупнейшего депозитария микроорганизмов в природе [34, 46] – архипелага до сих пор не известно.
Цель работы – оценка численности и разнообразия основных эколого-трофических групп микробного сообщества в почвах северной части НЗ.
ОБЪЕКТЫ И МЕТОДЫ
Почва. Объекты исследования расположены на о. Северный НЗ в районе заливов Русская Гавань, Ледяная Гавань и Бухта Благополучия, а также мыса Желания. Условия отбора и хранения образцов, а также детальное описание растительности, почвенных разрезов и их фото приведено в нашей статье [27]. Координаты ключевых точек, классификационный статус почв и некоторые физико-химические свойства исследованных образцов представлены в табл. 1.
Таблица 1.
Свойства почв севера Новой Земли [27]
| Название почвы | Индекс образца | Горизонт | Глубина, см | Влажность почвы, % массы | рНводн | Cорг | CaCO3 | Nобщ | Cорг/Nобщ |
|---|---|---|---|---|---|---|---|---|---|
| % | |||||||||
| Мыс Желания, 76.95° с.ш., 68.52° в.д. | |||||||||
| Криозем остаточно-карбонатный сильноскелетный | CJ-22 | О | 0–3 | 80.3 | 7.3 | – | – | – | – |
| CJ-23 | CRсa | 3–28 | 13.1 | 8.1 | 0.76 | 3.42 | 0.11 | 6.9 | |
| Петрозем криотурбированный остаточно-карбонатный сильноскелетный | CJ-24 | W + С | 0–23 | 9.0 | 8.0 | 0.33 | – | 0.02 | 16.5 |
| CJ-25 | Ссa,sk | 23–33 | 8.2 | 8.1 | 0.23 | 4.41 | 0.03 | 7.7 | |
| Ледяная Гавань, 76.29° с.ш., 68.15° в.д. | |||||||||
| Карбопетрозем очень сильно-скелетный | LG-11 | W + Cca,sk | 0–17 | 8.2 | 8.1 | 2.06 | 40.15 | 0.13 | 15.8 |
| Пелозем гумусовый криотурбированный остаточно-карбонатный сильноскелетный | LG-12 | Wca | 0–4 | 6.2 | 7.6 | 0.82 | 9.91 | 0.14 | 2.6 |
| LG-13 | Сca | 4–19 | 9.1 | 7.9 | 1.16 | 12.50 | 0.14 | 8.9 | |
| LG-14 | Сca | 19–32 | 38.6 | 8.0 | 1.52 | – | 0.17 | 10.1 | |
| Пелозем гумусовый перегнойный остаточно-карбонатный сильноскелетный | LG-15 | O + W | 0–5 | 52.8 | 7.4 | 18.69 | – | 1.23 | 15.2 |
| LG-16 | Сca | 4–17 | 14.8 | 8.0 | 1.37 | 33.15 | 0.14 | 9.8 | |
| LG-17 | Сca | 17–30 | 13.7 | 8.2 | 0.21 | 2.67 | 0.03 | 7.0 | |
| Русская Гавань, 76.19° с.ш., 62.72° в.д. Русская Гавань |
|||||||||
| Криозем глееватый скелетный | RG-1 | О | 0–4 | 65.2 | 7.1 | 9.80 | – | 0.63 | 15.6 |
| RG-2 | CR | 4–11 | 47.8 | 7.5 | 3.85 | – | 0.32 | 12.0 | |
| RG-3 | СRg | 11–22 | 38.0 | 7.9 | 2.76 | – | 0.19 | 14.5 | |
| Петрозем | RG-4 | О + С | 0–21 | 15.4 | 8.0 | 0.83 | – | 0.1 | 8.3 |
| Карбопетрозем гумусовый мерзлотный сильноскелетный | RG-5 | Wсa | 0–9 | 11.3 | 8.2 | 2.59 | 28.90 | 0.1 | 25.9 |
| RG-6 | Cсa,sk | 9–16 | 9.3 | 8.2 | 2.13 | 30.57 | 0.1 | 21.3 | |
| Пелозем остаточно-карбонатный сильноскелетный | RG-7 | О + Ссa | 0–14 | 14.8 | 8.0 | 6.32 | 18.83 | 0.1 | 158.0 |
| Бухта Благополучия, 75.62° с.ш.; 63.80° в.д. | |||||||||
| Пелозем гумусовый остаточно-карбонатный среднескелетный | ВВ-8 | W + Сca | 0–31 | 11.4 (19.5) | 8.0 | 0.94 | 8.16 | 0.11 | 8.5 |
| Криозем грубогумусовый остаточно-карбонатный | ВВ-9 | АОca | 0–10 | 49.9 | 7.8 | 1.38 | 5.91 | 0.11 | 12.5 |
| ВВ-10 | CR | 10–19 | 11.4 | 7.5 | 3.84 | – | 0.29 | 13.2 | |
Микробиологический посев. Аэробных азотфиксаторов (род Azotobacter) выявляли на среде Эшби с маннитом методом почвенных комочков, анаэробных азотфиксаторов (род Clostridium) – на среде Виноградского методом предельных разведений [10]. О развитии бактерий рода Clostridium судили по образованию газа, характерной микроморфологии и таблицам Мак-Креди [49]. Денитрификаторов изучали на жидкой среде для микроорганизмов группы нитратного дыхания [14] методом предельных разведений [9].
Определение численности и таксономической структуры сапротрофных бактерий проводили на агаризованной глюкозо-пептонно-дрожжевой среде с нистатином [21]. Численность и таксономический состав актиномицетов выявляли на агаризованном казеин-глицериновом агаре с нистатином [12]. Посев для учета численности бактерии и актиномицеты проводили из разведений 1 : 100, 1 : 1000 в трехкратной повторности после обработки почвенной суспензии на приборе УЗДН1 (22 кГц, 0.44А, 2 мин) для десорбции клеток с поверхности почвенных частиц [10]. Посевы для учета численности бактерии и актиномицетов инкубировали при комнатной температуре. Учет бактерий осуществляли на 10–14 сутки, а для актиномицетов – на 14–21 сутки. Представителей основных морфотипов изолировали на скошенный агар и идентифицировали по общепринятым определителям [4, 21, 33]. Выделяли следующие группы по относительному обилию родов: доминанты (>30%), субдоминанты (20–30%), группа среднего обилия (10–20%) и минорные компоненты (<10%).
Анализ видового состава микромицетов осуществляли глубинным посевом [43]. Почвенную суспензию перед посевом обрабатывали с помощью встряхивателя Vortex 5 мин при 3500 об./мин. Аликвоту 100 мкл суспензии почвы с разведением 1 : 100 помещали на дно стерильных чашек Петри, в которые заливали расплавленную и охлажденную до +50°С среду Чапека с добавлением стрептомицина (100 мг/л). Инкубацию посевов проводили при +25°С в течение 2–3 нед. и при +5°С в течение 4–6 нед. После чего производили учет общего числа колоний мицелиальных грибов и их первичную идентификацию по определителям [37, 38]. Таксономическую принадлежность отдельных штаммов дополнительно проверяли по анализу участков ITS рДНК [5]. Секвенирование участков ITS рДНК проводили с помощью набора реактивов BigDye Terminator V3.1 Cycle Sequencing Kit (Applied Biosystems, USA) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130xl Genetic Analyzer в Научно-производственной компании “Синтол” (Москва).
РЕЗУЛЬТАТЫ
Аэробные азотфиксаторы рода Azotobacter выявлены только в минеральном BCR и надмерзлотном СRg горизонтах криозема глееватого скелетного Русской Гавани (профиль RG-1-3), а также по всему профилю RG-5-6 карбопетрозема гумусового мерзлотного сильноскелетного того же района архипелага, органогенном горизонте АОca криозема грубогумусового остаточно-карбонатного Бухты Благополучия (профиль ВВ-9-10), а также поверхностного горизонта O + W пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного Ледяной Гавани (LG-15). Значительное содержание (76% обрастания почвенных комочков) Azotobacter отмечено в минеральном горизонте СRg криозема глееватого скелетного Русской Гавани (образец RG-3); меньше аэробных азотфиксаторов (30% обрастания) выявлено в горизонте BCR (образец RG-2) того же профиля. В остальных изученных образцах количество аэробных азотфиксаторов низкое (менее 14% обрастания) или они не были обнаружены.
Анаэробные азотфиксаторы рода Clostridium обнаружены во всех образцах, кроме горизонта O + W и надмерзлотного горизонта Сca пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-15-17). Численность Clostridium варьировала от 0.3 × 101 до 2.4 × 103 КОЕ/г почвы (рис. 1), однако большая часть образцов характеризовалась 101–102 КОЕ/г почвы. Минимальные показатели (десятки КОЕ/г почвы) выявлены для горизонта Ссa,sk петрозема криотурбированного остаточно-карбонатного сильноскелетного района мыса Желания (профиль CJ-24-25) и по всему профилю RG-5-6 карбопетрозема гумусового мерзлотного сильноскелетного района Русской Гавани. В поверхностном органогенном горизонте O + W и минеральном надмерзлотном слое Сca пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-15-17) анаэробных азотфиксаторов не обнаружено. Максимальная численность Clostridium отмечена в горизонте СR криозема грубогумусового остаточно-карбонатного Бухты Благополучия (профиль BB-9-10). Выявлена тенденция к увеличению количества анаэробных азотфиксаторов вниз по профилю почв. Для криозема глееватого скелетного Русской Гавани (профиль RG-1-3), пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-15-17) и криозема грубогумусового остаточно-карбонатного Бухты Благополучия (профиль BB-9-10) максимум анаэробных азотфиксаторов обнаружен в подповерхностном горизонте.
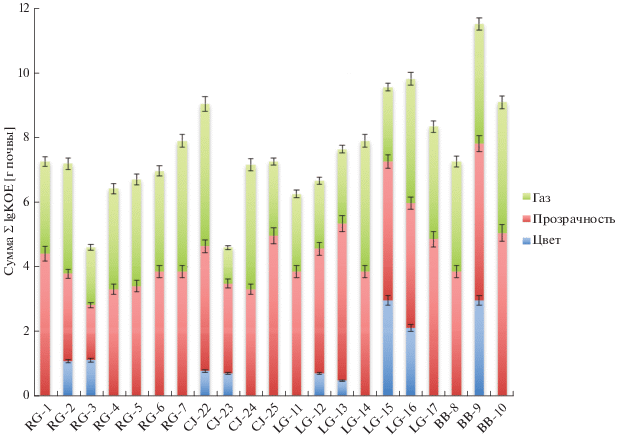
Численность денитрификаторов минимальна (менее 5.0 Σlg КОЕ/г почвы) для надмерзлотных горизонтов криозема глееватого скелетного Русской Гавани (RG-1-3) и криозема остаточно-карбонатного сильноскелетного мыса Желания (СJ-22-23) (рис. 2). Количество представителей данной эколого-трофической группы максимально (более 9.0 Σlg КОЕ/г почвы) в поверхностных слоях пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного Ледяной Гавани (LG-15-17) и криозема грубогумусового остаточно-карбонатного Бухты Благополучия (BB-9-10). Для одних профилей (СJ-22-23, RG-1-3, LG-15-17, BB-9-10) выявлено снижение, а для других (RG-5-6, LG-12-14) – повышение количества денитрификаторов от поверхностных слоев к глубинным. В целом почвы мыса Желания показали наименьшие значения КОЕ по сравнению с другими исследованными районами архипелага.
Численность комплекса культивируемых сапротрофных бактерий (СБК) в почвах НЗ варьировала от 3.3 × 104 до 1.2 × 106 КОЕ/г почвы (табл. 2). Минимальные показатели численности зафиксированы в минеральных горизонтах криозема остаточно-карбонатного сильноскелетного (4.0 × × 103 КОЕ/г почвы) и петрозема криотурбированного остаточно-карбонатного сильноскелетного (3.3 × 104 КОЕ/г почвы) мыса Желания. Максимальное содержание бактерий (около 1.0 × 106 КОЕ/г почвы) выявлено в моховом очесе АОca криозема грубогумусового остаточно-карбонатного Бухты Благополучия (профиль ВВ-9-10), единственном горизонте W + Cca,sk карбопетрозема очень сильно скелетного Ледяной Гавани (профиль LG-11), подповерхностном Ссa пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-15-17) и криозема глееватого скелетного Русской Гавани (профиль RG-1-3). В большинстве почв происходило уменьшение численности бактерий вниз по профилю. Только в RG-5-6, LG-12-14 и LG-15-17 обнаружено увеличение численности бактерий в надмерзлотном горизонте. В большинстве почвенных горизонтов численность бактерий составляла от 3.0 × 105 до 8.0 × × 105 КОЕ/г почвы.
Таблица 2.
Структура сообществ культивируемых почвенных гетеротрофных бактерий и актиномицетов
| Почва | Индекс образца | Горизонт | Глубина, см | Численность бактерий, 104 × КОЕ/г | Численность актиноми-цетов, 103 × КОЕ/г | Доля актино-мицетов, % | Доминан-тные роды | Субдоми-нантные роды | Группа родов среднего обилия и минорные компоненты |
|---|---|---|---|---|---|---|---|---|---|
| Мыс Желания, 76.95° с.ш., 68.52° в.д. | |||||||||
| Криозем остаточно-карбонатный сильноскелетный | CJ-22 | О | 0–3 | 9.6 ± 1.0 | 14 ± 0.8 | 2 | Arthrobacter | Bacillus, Myxococcus, | Pseudomonas, Xanthomonas, Alcaligenes, Aquaspirillum, Clostridium, Sporocytophaga |
| CJ-23 | CRсa | 3–28 | 4.0 ± 0.4 | 14 ± 0.8 | 1 | Arthrobacter | Bacillus | Comamonas, Aquaspirillum, Caulobacter, Clostridium | |
| Петрозем криотурбированный остаточно-карбонатный сильноскелетный | CJ-24 | W + С | 0–23 | 8.4 ± 0.8 | 12 ± 1.8 | 1 | Arthrobacter | Bacillus, Myxococcus, | Pseudomonas, Xanthomonas, Alcaligenes, Aquaspirillum, Rhizobium, Clostridium |
| CJ-25 | Ссa,sk | 23–33 | 3.3 ± 0.3 | 6 ± 0.4 | 1 | Arthrobacter | Bacillus | Comamonas, Aquaspirillum, Caulobacter, Clostridium | |
| Ледяная Гавань, 76.29° с.ш., 68.15° в.д. | |||||||||
| Карбопетрозем очень сильно скелетный | LG-11 | W + Cca,sk | 0–17 | 114.0 ± 11.4 | 300 ± 33 | 12 | Arthrobacter, Myxococcus | Cytophaga | Polyangium, Pseudomonas, Comamonas, Aquaspirillum, Sporocytophaga |
| Пелозем гумусовый криотурбированный остаточно-карбонатный сильноскелетный | LG-12 | Wca | 0–4 | 17.8 ± 1.8 | 240 ± 14 | 57 | Bacillus | Arthrobacter | Streptomyces, Rhodococcus, Promicromonospora, Pseudomonas, Aquaspirillum |
| LG-13 | Wca | 4–19 | 82.1 ± 8.2 | 293 ± 33 | 7 | Arthrobacter | Bacillus | Azotobacter, Clostridium, Rhodococcus, Aquaspirillum, Alcaligenes, Clostridium |
|
| LG-14 | Сca | 19–32 | 23.3 ± 2.4 | 4.7 ± 0.81 | 3 | Arthrobacter | Bacillus | Aquaspirillum, Alcaligenes, Caulobacter, Clostridium | |
| Пелозем гумусовый перегнойный остаточно-карбонатный сильноскелетный | LG-15 | Сca | 0–5 | 53.8 ± 5.4 | 227 ± 21 | 46 | Streptomyces | Polyangium, Myxococcus | Polyangium, Pseudomonas, Aquaspirillum, Cytophaga, Azotobacter |
| LG-16 | O + W | 4–17 | 108.5 ± 10.9 | 12 ± 2 | 9 | Arthrobacter | Streptomyces | Aquaspirillum, Alcaligenes, Clostridium | |
| LG-17 | Сca | 17–30 | 29.6 ± 3.0 | 2.7 ± 0.17 | 3 | Arthrobacter | Streptomyces | Aquaspirillum, Alcaligenes, Caulobacter | |
| Русская Гавань, 76.19° с.ш., 62.72° в.д. | |||||||||
| Криозем глееватый скелетный | RG-1 | О | 0–4 | 104.5 ± 10.5 | 45 ± 9 | 12 | Bacillus, Myxococcus | Cytophaga | Polyangium, Pseudomonas, Aquaspirillum, Xanthobacter, Clostridium, Sporocytophaga |
| RG-2 | CR | 4–11 | 72.1 ± 7.2 | 12 ± 4.5 | 4 | Bacillus | – | Aquaspirillum, Alcaligenes, Azotobacter, Clostridium | |
| RG-3 | СRg | 11–22 | 10.6 ± 1.3 | – | – | Bacillus | – | Aquaspirillum, Alcaligenes, Caulobacter, Azotobacter | |
| Петрозем | RG-4 | О + С | 0–21 | 94.5 ± 10.5 | 94.5 ± 10.5 | 11 | Arthrobacter | Bacillus | Polyangium, Pseudomonas, Aquaspirillum, Xanthomonas, Clostridium, Sporocytophaga |
| Карбопетрозем гумусовый мерзлотный сильноскелетный | RG-5 | Wсa | 0–9 | 48.0 ± 4.8 | 48.0 ± 4.8 | 6 | Arthrobacter | Streptomyces, Cytophaga | Myxococcus, Polyangium, Pseudomonas, Aquaspirillum, Xanthomonas, Azotobacter, Clostridium |
| RG-6 | Cсa,sk | 9–16 | 56.3 ± 5.6 | 11.3 ± 1.1 | 2 | Arthrobacter | Streptomyces | Pseudomonas, Aquaspirillum, Xanthomonas, Azotobacter, Clostridium | |
| Пелозем остаточно-карбонатный сильноскелетный | RG-7 | О + Ссa | 0–14 | 65.0 ± 6.6 | 1.3 ± 0.2 | 1 | Arthrobacter | Myxococcus, Cytophaga | Pseudomonas, Aquaspirillum, Xanthomonas, Clostridium, Sporocytophaga |
| Бухта Благополучия, 75.62° с.ш.; 63.80° в.д. | |||||||||
| Пелозем гумусовый остаточно-карбонатный среднескелетный | ВВ-8 | W + Сca | 0–31 | 87.2 ± 8.6 | 12 ± 2 | 6 | Arthrobacter | Bacillus | Pseudomonas, Alcaligenes, Aquaspirillum, Clostridium |
| Криозем грубогумусовый остаточно-карбонатный | ВВ-9 | АОca | 0–10 | 118.0 ± 12.0 | 440 ± 40 | 37 | Arthrobacter, Myxococcus | Bacillus | Cytophaga, Polyangium, Comamonas, Aquaspirillum, Azotobacter, Clostridium |
| ВВ-10 | CR | 10–19 | 62.1 ± 7.0 | 45 ± 3 | 11 | Arthrobacter | Bacillus | Comamonas, Aquaspirillum, Caulobacter, Clostridium | |
Из почв НЗ выделено 105 штаммов сапротрофных прокариот, отнесенных с 19 родам бактерий (табл. 2). Грамположительные бактерии представлены шестью родами: Arthrobacter, Bacillus, Clostridium, Promicromonospora, Rhodococcus, Streptomyces. Грамотрицательные бактерии представлены 13-ю родами: Alcaligenes, Aquaspirillum, Azotobacter, Caulobacter, Comamonas, Cytophaga, Myxococcus, Polyangium, Pseudomonas, Rhizobium, Sporocytophaga, Xanthomonas, Xanthobacter.
В большинстве образцов доминировали бактерии рода Arthrobacter. Только в пелоземе гумусовом криотурбированном остаточно-карбонатном сильноскелетном Ледяной Гавани (профиль LG-12-14) наблюдалось преобладание рода Bacillus, а в пелоземе перегнойно-гумусовом криотурбированном остаточно-карбонатном сильноскелетном Ледяной Гавани (профиль LG-15-17) – рода Streptomyces. В качестве субдоминантов выступали бактерии родов Bacillus, Cytophaga, Myxococcus и Polyangium. Группа среднего обилия и минорные компоненты представлены в основном грамотрицательными бактериями родов Alcaligenes, Aquaspirillum, Azotobacter, Caulobacter, Comamonas, Pseudomonas, Rhizobium, Sporocytophaga, Xanthobacter и Xanthomonas.
В горизонтах, богатых органическим веществом (моховой очес, альго-бактериальные пленки), зафиксировано высокое родовое богатство бактерий и присутствие активных гидролитиков Cytophaga, Myxococcus, Polyangium и Sporocytophaga, а также копиотрофов родов Alcaligenes, Azotobacter, Comamonas, Pseudomonas, Rhizobium, Xanthobacter и Xanthomonas. В надмерзлотных горизонтах обнаружены олиготрофы рода Caulobacter.
Актиномицеты имели численность – от 103 до 105 КОЕ/г почвы. Данная группа микроорганизмов выявлена во всех образцах, кроме оглеенного горизонта СRg криозема глееватого скелетного Русской Гавани (профиль RG-1-3). Минимум актиномицетов (1.3 × 103 КОЕ/г почвы) выявлен в пелоземе остаточно-карбонатном сильноскелетном Русской Гавани (профиль RG-7). Максимум мицелиальных прокариот (4.0 × 105 КОЕ/г почвы) отмечен в органогенном горизонте АОca криозема грубогумусового остаточно-карбонатного Бухты Благополучия (профиль ВВ-9-10). Также большое количество актиномицетов (3.0 × × 105 КОЕ/г почвы) выявлено в горизонте W + + Cca,sk карбопетрозема очень сильно скелетного Ледяной Гавани (профиль LG-11). Несколько меньше актиномицетов (около 2.8 × 105 КОЕ/г почвы) в поверхностных горизонтах пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-12-14). Вниз по профилям всех изученных почв численность мицелиальных прокариот уменьшалась. В пелоземе гумусовом криотурбированном остаточно-карбонатном сильноскелетном (профиль LG-12-14) и пелоземе гумусовом перегнойном остаточно-карбонатном сильноскелетном Ледяной Гавани (профиль LG-15-17) в прокариотном комплексе высока доля актиномицетов (46 и 57% соответственно).
Из почв НЗ выделено 40 штаммов актиномицетов, представителей родов Streptomyces и Micromonospora. 35 изолятов рода Streptomyces относились к 15 видам из 6 серий и 5 секций. В минеральных горизонтах доминировали представители секций и серий Cinereus Achromogenes, Cinereus Chromogenes, Albus Albus. В органогенных горизонтах разнообразие было шире, встречались секции и серии Roseus, Imperfectus, Helvolo-Flavus Helvolus.
Преобладали (80–100% обилия) представители рода Streptomyces. Однако в моховом очесе АОca криозема грубогумусового остаточно-карбонатного Бухты Благополучия (профиль BB-9-10) доминировали виды рода Micromonospora. В минеральных горизонтах видовое разнообразие актиномицетов невелико и представлено видами: Streptomyces albus, S. albolongus, S. odorifer, S. albogriseolus, S. pseudogriseolus. Более разнообразны органогенные горизонты, где дополнительно обнаружены виды: S. cattleya, S. higroscopicus, S. werraensis, S. parvullus, S. canarius, S. violascens, S. candidus, S. spororaveus, S. gelaticus. Из органогенных горизонтов выделены пигментированные актиномицеты секции и серии Roseus, Helvolo-Flavus Helvolus, Cinereus Chromogenes, Cinereus Violaceus. Максимальное разнообразие актиномицетов отмечено для поверхностного горизонта пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-15-17).
Микроскопические грибы имели суммарную численность от 2.5 × 102 до 1.5 × 104 КОЕ/г почвы (рис. 3). Наименьшие значения (порядка 102 КОЕ/г почвы) выявлены в криоземе остаточно-карбонатном сильноскелетном мыса Желания (CJ-24-25), пелоземе гумусовом криотурбированном остаточно-карбонатном сильноскелетном (профиль LG-12-14) и пелоземе гумусовом перегнойном остаточно-карбонатном сильноскелетном района Ледяной Гавани (профиль LG-15-17). Максимум микромицетов (порядка 104 КОЕ/г почвы) в моховом очесе О криозема остаточно-карбонатного сильноскелетного мыса Желания (профиль CJ-22-23), горизонте АОсa криозема грубогумусового остаточно-карбонатного района Бухты Благополучия (профиль ВВ-9-10), горизонте W + + Cca,sk карбопетрозема очень сильно скелетного Ледяной Гавани (профиль LG-11) и моховом очесе О криозема глееватого Русской Гавани (профиль RG-1-3). Для большей части образцов количество микромицетов не превышало 103 КОЕ/г почвы. В целом численность микромицетов уменьшается вниз по профилю исследованных почвенных профилей.
Выделено 49 видов микромицетов, относящихся к 24 родам из 3 отделов (табл. 3). Отдел Mucoromycota представлен родами Mortierella, Mucor, Rhizopus и Umbelopsis. Отдел Ascomycota – 2 телеоморфными (Antarctomyces, Thelebolus) и 18 анаморфными родами. Отдел Basidiomycota представлен дрожжами Goffeauzyma, Mrakia и Rhodotorula. Выделенные микромицеты относятся к 13-ти порядкам: Hypocreales (роды Acremonium, Cosmospora, Epicoccum, Pochonia, Sarocladium); Pleosporales (роды Alternaria, Coniothyrium); Thelebolales (роды Antarctomyces, Thelebolus); Eurotiales (роды Aspergillus, Penicillium, Paecilomyces); Helotiales (роды Cadophora, Pseudogymnoascus); Capnodiales (род Cladosporium); Chaetothyriales (род Cladophialophora); Saccharomycetales (род Geotrichum); Tremellales (род Goffeauzyma); Mucorales (роды Mortierella, Mucor, Rhizopus, Umbelopsis); Chaetothyriales (род Phialophora); Pleosporales (род Phoma); Sporidiobolales (род Rhodotorula). Наибольшее число родов (5) принадлежит к порядку Hypocreales, 4 рода насчитывает порядок Mucorales, 3 рода – порядками Eurotiales.
Таблица 3.
Структура сообществ культивируемых почвенных микромицетов
| Род/вид | Вариант | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CJ-22 | CJ-23 | CJ-24 | CJ-25 | LG-11 | LG-12 | LG-13 | LG-14 | LG-15 | LG-16 | LG-17 | RG-1 | RG-2 | RG-3 | RG-4 | RG-5 | RG-6 | RG-7 | ВВ-8 | ВВ-9 | ВВ-10 | |
| Acremonium strictuma W. Gams |
˅+ | ˅ | + | ˅ | ˅+ | ˅ | ˅ | ˅ | |||||||||||||
| Acremonium charticolaa (Lindau) W. Gams | ˅+ | + | + | + | ˅ | + | + | + | |||||||||||||
| Alternaria alternataa, c, d (Fr.) Keissl. |
+ | + | |||||||||||||||||||
| Antarctomyces psychrotrophicus*,f Stchigel & Guarro |
˅ | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ | |||||||||||||
| Aspergillus sydowiia, e (Bainier & Sartory) Thom & Church |
+ | + | + | ||||||||||||||||||
| Aspergillus versicolora, e (Vuill.) Tirab. |
˅ | + | ˅+ | ||||||||||||||||||
| Aureobasidium pullulansa, b, e (de Bary & Löwenthal) G. Arnaud |
+ | ˅ | ˅ | + | ˅+ | ||||||||||||||||
| Cadophora luteo-olivacea*, с, f (J.F.H. Beyma) T.C. Harr. et McNew |
˅+ | ˅+ | |||||||||||||||||||
| Cadophora malorum*, с, d, f (Kidd & Beaumont) W. Gams |
˅ | ˅ | ˅ | ||||||||||||||||||
| Cladosporium cladosporioidesa, c, d, e (Fresen) G.A. de Vries |
˅ | + | + | ˅+ | + | + | |||||||||||||||
| Cladosporium herbarumc, d, e (Pers.) Link | ˅ | ˅ | ˅+ | ||||||||||||||||||
| Cladosporium sp.a, c, d | + | ||||||||||||||||||||
| Cladophialophora sp.a | ˅ | ˅ | ˅ | ||||||||||||||||||
| Coniothyrium glomeratuma, d Corda | + | + | + | ||||||||||||||||||
| Cosmospora butyri*, a (J.F.H. Beyma) Gräfenhan, Seifert et Schroers |
+ | ||||||||||||||||||||
| Epicoccum nigrumb, c Link | + | + | + | ˅ | |||||||||||||||||
| Geotrichum candiduma, b, c, e Link |
+ | ˅+ | + | ˅ | + | + | |||||||||||||||
| Goffeauzyma gilvescens*,f (Chernov & Babeva) Xin Zhan Liu, F.Y. Bai, M. Groenew. & Boekhout |
˅ | ˅ | ˅ | ˅ | ˅ | ˅+ | ˅ | ˅ | ˅ | ˅+ | ˅+ | ||||||||||
| Mortierella alpinaa Peyrone | ˅ | + | ˅+ | + | ˅+ | ˅+ | |||||||||||||||
| Mortierella elongataa Linnem. |
˅ | ˅ | + | + | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ | |||||||||||
| Mortierella minutissimaa Tiegh. |
˅ | ˅ | ˅+ | ˅ | ˅ | ˅ | + | ˅ | ˅ | + | |||||||||||
| Mrakia frigida*,f (Fell, Statzell, I.L. Hunter & Phaff) Y. Yamada & Komag. |
˅ | ˅ | ˅ | ˅ | ˅+ | ˅+ | ˅ | ||||||||||||||
| Mucor hiemalisa,e Wehmer | + | + | + | ˅+ | |||||||||||||||||
| Mucor plumbeusa Bonord. | + | + | |||||||||||||||||||
| Paecilomyces lilacinusa,e (Thom) Samson |
+ | ˅ | ˅ | ||||||||||||||||||
| Penicillium aurantiogriseuma,e Dierckx |
˅+ | + | + | + | ˅+ | ˅ | ˅ | ˅+ | ˅ | + | ˅+ | ˅+ | ˅+ | ||||||||
| P. canescensa Sopp | ˅ | ˅ | ˅ | ˅ | |||||||||||||||||
| Penicillium chrysogenuma,e Thom |
˅+ | + | + | + | + | ˅ | ˅ | ˅ | ˅+ | + | + | ˅+ | ˅+ | ˅ | ˅+ | ||||||
| Penicillium communea Thom |
˅+ | + | ˅+ | ˅ | ˅ | + | + | ˅+ | ˅ | ˅ | ˅+ | ||||||||||
| Penicillium janczewskiia K.M. Zaleski |
+ | + | + | ˅ | ˅ | ˅ | ˅ | + | ˅+ | + | ˅ | ||||||||||
| Penicillium janthinelluma Biourge |
˅+ | + | + | + | + | ˅ | |||||||||||||||
| Penicillium simplicissimuma (Oude.) Thom |
+ | + | + | ˅+ | + | ˅ | |||||||||||||||
| Penicillium verrucosuma Dierckx |
˅ | ˅ | ˅ | ˅ | ˅ | ˅+ | ˅+ | ˅+ | ˅+ | ˅ | ˅ | ||||||||||
| Penicillium waksmaniia K.M. Zaleski |
+ | ˅ | + | ||||||||||||||||||
| Phialophora alba*, a, d, f J.F.H. Beyma |
˅ | + | + | ˅ | |||||||||||||||||
| Phialophora lagerbergii*, a, d, e, f (Melin et Nannf.) Conant |
˅ | + | |||||||||||||||||||
| Phoma exiguaa, c, d Desm. | ˅ | ˅ | ˅ | ˅ | + | ||||||||||||||||
| Phoma glomerataa, c, d (Corda) Wollenw. et Hochapfel |
+ | ||||||||||||||||||||
| Phoma herbarum*, a, c, d Westend. |
˅ | ˅ | ˅ | ˅ | + | ˅+ | ˅+ | ˅ | ˅+ | ||||||||||||
| Pochonia bulbillosa*, a (W. Gams et Malla) Zare et W. Gamsa |
+ | + | |||||||||||||||||||
| Pseudogymnoascus pannorum*, a, e, f (Link) Minnis & D.L. Lindner |
˅ | ˅ | ˅ | ˅ | ˅ | ˅+ | ˅+ | ˅ | ˅+ | ˅ | ˅+ | ˅ | ˅ | ˅+ | ˅ | ||||||
| Pseudogymnoascus vinaceusa, f Dal Vesco | ˅ | ˅ | ˅ | ˅+ | ˅+ | ˅ | ˅ | ˅ | ˅+ | ˅+ | |||||||||||
| Rhizopus stolonifera, d, e (Ehrenb.) Vuill. |
˅+ | ˅+ | |||||||||||||||||||
| Rhodotorula mucilaginosa*, a, b, f (A. Jörg.) F.C. Harrison | + | ˅ | ˅+ | ˅ | ˅ | ||||||||||||||||
| Sarocladium kiliensea, c, d, e (Grütz) Summerb. |
+ | + | |||||||||||||||||||
| Thelebolus microsporusa, f (Berk. et Broome) Kimbr. | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ | |||||||||||
| Thelebolus ellipsoideus*, a, f Brumm. & de Hoog | ˅ | ˅ | ˅ | + | |||||||||||||||||
| Thelebolus stercoreus*, a, f Tode | ˅ | ˅ | ˅ | + | ˅ | ˅+ | |||||||||||||||
| Umbelopsis ramannianaa (Möller) W. Gams |
˅ | ˅+ | ˅ | ||||||||||||||||||
| Mycelia sterilia (dark color) | + | + | + | + | |||||||||||||||||
| Mycelia sterilia (light color) | + | ˅ + | ˅ | ˅ | ˅ | ˅ | ˅ | ˅ + | ˅ | ˅ | + | ||||||||||
Примечание. * – виды, определенные по анализу участков ITS рДНК; а – cапротрофы; b – эпифиты/эндофиты/эккрисотрофы; c – потенциальные патогены растений; d – целлюлолитики; e – условные патогены животных и человека; f – виды характерные холодных экосистем. ∨ – рост отмечен при +5°С; + – рост отмечен при +25°С.
Исследованные районы НЗ характеризовались отличными друг от друга сообществами микромицетов. Так, Acremonium и Alternaria выявлены лишь для мыса Желания и Русской Гавани; Antarctomyces и Umbelopsis приурочены к органогенным горизонтам всех изученных почв, кроме Ледяной Гавани; Aspergillus и Aureobasidium, Cladosporium отмечены в районе Бухты Благополучия и Русской Гавани; Cadophora, Mucor, Pochonia – к образцам районов Ледяной Гавани и Русской Гавани; Cladophialophora – Бухты Благополучия и Ледяной Гавани; Coniothyrium – только Бухты Благополучия; Rhizopus – к образцам мыса Желания и району Ледяной Гавани; Cosmospora и Sarocladium отмечены в одном образе Ледяной Гавани; Epicoccum, Geotrichum, Paecilomyces – характерны для Бухты Благополучия, Русской Гавани, Ледяной Гавани; Goffeauzyma, Mortierella, Mrakia, Penicillium, Phialophora, Phoma, Pseudogymnoascus, Rhodotorula, Thelebolus – обнаружены во всех изученных локациях НЗ.
Одни штаммы микромицетов выделялись только при +5°С – Antarctomyces psychrotrophicus, Cadophora malorum, Cladophialophora sp., Thelebolus microsporus, другие – лишь при +25°С – Alternaria alternata, Aspergillus sydowii, Coniothyrium glomeratum, Mucor plumbeus, Phoma glomerata, Sarocladium kiliense, а большинство учтенных штаммов выявлялись при обеих температурах инкубирования.
Сапротрофные микромицеты обнаружены во всех образцах и представлены типичными почвенными родами [37, 55] – Acremonium, Alternaria, Aspergillus, Aureobasidium, Cladosporium, Coniothyrium, Cosmospora, Geotrichum, Mortierella, Mucor, Paecilomyces, Penicillium, Phialophora, Phoma, Pochonia, Pseudogymnoascus, Rhizopus, Rhodotorula, Sarocladium, Thelebolus, Umbelopsis, часть которых (Antarctomyces, Cadophora, Goffeauzyma, Mrakia, Pseudogymnoascus, Rhodotorula, Thelebolus) характерна для холодных экосистем. Значительная часть сапротрофных видов (Aspergillus sydowii, A. versicolor, Aureobasidium pullulans, Cladosporium cladosporioides, C. herbarum, Mucor hiemalis, Paecilomyces lilacinus, Penicillium aurantiogriseum, P. chrysogenum, Pseudogymnoascus pannorum, Rhizopus stolonifera, Sarocladium kiliense) входит в базу данных BSL патогенных для человека и животных видов [36].
Среди выделенных микромицетов практически не было видов, экологически связанных с растениями – эпифитов, эндофитов или эккрисотрофов – Aureobasidium pullulans, Epicoccum nigrum, Geotrichum candidum, Rhodotorula mucilaginosa. Однако выявлено довольно много целлюлолитиков, практически все из которых являются фитопатогенами – Alternaria alternata, Cadophora malorum, Cladosporium cladosporioides, C. herbarum, Cladosporium sp., Coniothyrium glomeratum, Epicoccum nigrum, Geotrichum candidum, Phialophora alba, Phialophora lagerbergii, Phoma exhigua, P. glomerate, P. herbarum, Rhizopus stolonifer, Sarocladium kiliense.
Наибольшим видовым разнообразием характеризовались роды: Penicillium (9 видов), а также Acremonium, Cladosporium, Mortierella, Phoma, Thelebolus – по 3 вида. По численности (от 8.5 × 102 до 3.5 × 103 КОЕ/г почвы) и обилию (от 18 до 31%) доминировали представители сапротрофных и характерные для холодных экосистем родов: Antarctomyces, Cadophora, Goffeauzyma, Penicillium, Phoma, Pseudogymnoascus, Thelebolus (рис. 3). Почти все доминанты имели большое обилие лишь в поверхностных органогенных горизонтах.
ОБСУЖДЕНИЕ
Азотфиксация. Низкая численность аэробных азотфиксаторов может быть связана с суровыми климатическими условиями, обуславливающими низкую общую биологическую активность почв о. Северный архипелага [27]. Другими авторами отмечено малое содержание азотфиксаторов в почвах полярных регионов [51]. Скудность растительного покрова севера НЗ также может являться причиной малого количества азотфиксаторов в Арктике [53] по сравнению с почвами умеренного пояса [19, 26].
Большая численность анаэробных азотфиксаторов, по-видимому, связана с микроаэрофильными условиями почвы, обусловленным значительной влажностью в период отбора образцов и небольшим содержанием общего азота (табл. 1). Представителей данной эколого-трофической группы значительно меньше, чем в почвах умеренного пояса [19, 26]. Численность анаэробных азотфиксаторов существенно уменьшалась в почвах с повышенной щелочностью. Так, в почвах с максимальным рН 8.2 карбопетроземе гумусовом мерзлотном сильноскелетном Русской Гавани (профиль RG-5-6) отмечена низкая численность представителей данной эколого-трофической группы, а в надмерзлотном горизонте Ссa пелозема перегнойно-гумусового остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-15-17) анаэробные азотфиксаторы не выявлены.
Численность денитрификаторов в образцах НЗ на порядок меньше, чем в почвах умеренного климата [20], что может быть связано с ингибированием биологической активности почвы покровным ледником НЗ [27].
В посевах большинства органогенных и некоторых минеральных горизонтов не выявлено изменения цвета среды при инкубации (рис. 2), что свидетельствует о постоянном уровне рН и отсутствии денитрификаторов [20].
Нами отмечена положительная корреляция между влажностью почвы и численностью денитрификаторов. Это можно объяснить тем, что денитрификация протекает в условиях недостатка атмосферного кислорода, при котором микроорганизмы восстанавливают окисные формы неорганических веществ [50, 59]. Обнаружена связь численности денитрификаторов с содержанием органического углерода и общего азота. Данный процесс в почве протекает при разложении органического вещества, в том числе и микробиологического происхождения [59]. Активная эмиссия газов в среде для выявления денитрификаторов во всех образцах свидетельствует о функционально значимом процессе нитратного дыхания не только в органогенных, но и в минеральных горизонтах [20].
Численность и таксономическая структура комплекса культивируемых сапротрофных бактерий (СБК) в исследованных почвах НЗ сравнима с таковыми для Шпицбергена [57]. В то же время количество КОЕ и число таксонов СБК почв севера НЗ значительно меньше по сравнению с грунтами Восточной Антарктиды [21, 44]. Такие различия могут быть связаны с климатическим фактором [42]. В большинстве профилей численность СБК резко уменьшалась с глубиной, но в некоторых почвах наблюдалось увеличение количества КОЕ в надмерзлотном горизонте ретинизации, как и для антарктических оазисов [21, 44].
Во всех исследованных почвах НЗ доминировали грамположительные бактерии, что типично для высоких широт [45, 47]. В большинстве образцов НЗ с высоким содержанием карбонатов доминировали представители рода Arthrobacter, предпочитающие нейтральные и щелочные значения рН [35, 39, 57]. Субдоминантами в органогенных горизонтах являлись представители родов Bacillus, Cytophaga, Myxococcus, Polyangium и Streptomyces – активные деструкторы растительных полимеров [17, 40]. В минеральных горизонтах субдоминанты представлены родами Bacillus и Streptomyces. Группа среднего обилия и минорные компоненты включали грамотрицательные бактерии, доля которых в полярных почвах обычно невелика [47]. Определенного интереса заслуживает выделение из минеральных горизонтов родов Caulobacter и Aquaspirillum – обитателей олиготрофных водных местообитаний [54].
Численность актиномицетов в почвах НЗ сравнима с таковой в пелоземах гумусовых глеевых Пинежского заповедника Архангельской области [29] и криоземах грубогумусных глееватых воркутинской тундры Республики Коми [13], но несколько меньше, чем в торфяно-криоземе типичном Ямала [11]. Отмечено уменьшение численности актиномицетов с глубиной по профилям как изученных почв НЗ, как и других полярных территорий [41, 56].
Микроскопические грибы имели на порядок меньшую численность и таксономическое разнообразие, чем в более северных архипелагах Земли Франца-Иосифа (ЗФИ) [15, 26] и Шпицбергена [16], но сравнимы с таковыми Восточной Антарктиды [3, 21, 23, 25, 43]. Вероятно, нарушение закона широтной зональности, предполагающего увеличение количества таксонов и числа организмов от полюсов к экватору [2], вызвано суровостью локальных климатических условий севера НЗ из-за покровного ледника [27, 30]. В то время как ЗФИ и Шпицберген подвержены менее выраженному оледенению, чем НЗ [52].
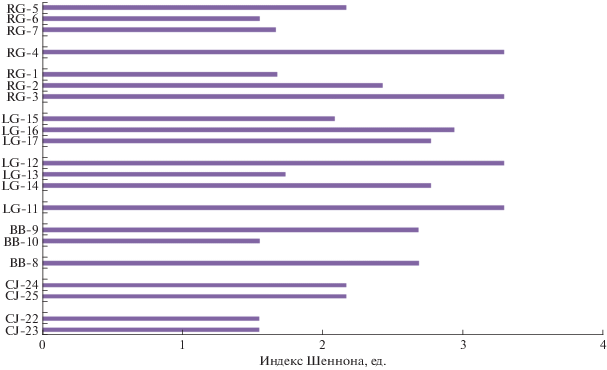
Значения индекса Шеннона микромицетов НЗ варьировали от 1.54 до 3.29 (рис. 4). Минимальное α-разнообразие отмечено в криоземе остаточно-карбонатном сильноскелетном мыса Желания (CJ-22-23), надмерзлотном горизонте CR криозема грубогумусового остаточно-карбонатного Бухты Благополучия (профиль ВВ-9-10) и в горизонте Rсa карбопетрозема гумусового мерзлотного сильноскелетного Русской Гавани (профиль RG-5-6). Максимальные значения индекса Шеннона для микромицетов выявлены в горизонте W + Cca,sk карбопетрозема очень сильно скелетного Ледяной Гавани (профиль LG-11), органогенном горизонте Wca пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-12-14) и надмерзлотном горизонте СRg криозема глееватого скелетного Русской Гавани (RG-1-3). Низкое α-разнообразие (до 2 по индексу Шеннона) также обнаруживалось в горизонте Wca пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-12-14), моховом очесе О криозема глееватого склетного Русской Гавани (профиль RG-1-3) и О + Ссa пелозема остаточно-карбонатного сильноскелетного Русской Гавани (профиль RG-7).
ЗАКЛЮЧЕНИЕ
В сообществе почвенных микроорганизмов севера НЗ доминируют представители сапротрофного блока – грамположительные бактерии рода Arthrobacter, актиномицеты родов Streptomyces и Micromonospora, а также микромицеты родов Goffeauzyma, Phoma, Pseudogymnoascus и Thelebolus. Численность всех культивируемых микроорганизмов (кроме аэробных азотфиксаторов) в изученных почвах резко уменьшается вниз по профилю, что положительно коррелирует с содержанием органического углерода и общего азота.
Численность и таксономическое разнообразие микроорганизмов изученных объектов НЗ меньше, чем в более северных архипелагах ЗФИ и Шпицбергена. Данный парадокс может быть связан с иссушающим и охлаждающим влиянием самого большого в России ледника на острове Северный НЗ.
Низкое обилие азотфиксаторов и относительно большое количество денитрификаторов позволяет сделать вывод о некотором вкладе почв севера НЗ в эмиссию оксидов азота в атмосферу. В перспективе необходима оценка продуцирования парниковых газов из почв обследованных территорий.
Список литературы
Большиянов Д.Ю., Анохин В.М., Гусева Е.А. Новые данные о строении рельефа и четвертичных отложений архипелага Новая Земля. Геолого-геофизическая характеристики литосферы Арктического региона // Тр. ВНИИ Океангеологии. 2006. № 210(6). С. 149–161.
Букварева Е., Алещенко Г. Принцип оптимального разнообразия биосистем. Товарищество научных изданий КМК. 2013. 522 с.
Власов Д.Ю., Кирцидели И.Ю., Абакумов Е.В., Новожилов Ю.К., Зеленская М.С., Баранцевич Е.П. Антропогенная инвазия микромицетов в ненарушенные экосистемы оазиса Холмы Ларсеманн (Восточная Антарктида) // Российский журнал биологических инвазий. 2020. № 13(2). С. 23–34.
Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А., Терехова Л.П., Максимова Т.С. Определитель актиномицетов. М.: Наука, 1983. 248 с.
Глушакова А.М., Качалкин А.В., Чернов И.Ю. Особенности динамики эпифитных и почвенных дрожжевых сообществ в зарослях недотроги железконосной на перегнойно-глеевой почве // Почвоведение. 2011. № 8. С. 966–972.
Горячкин С.В. Почвенный покров Севера (структура, генезис, экология, эволюция). М.: ГЕОС, 2010. 414 с.
Горячкин С.В., Караваева Н.А., Таргульян В.О. География почв Арктики: современные проблемы // Почвоведение. 1998. № 5. С. 520–530.
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А, Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1096. https://doi.org/10.7868/S0032180X15090038
Егоров Н.С. Практикум по микробиологии. М.: Изд-во Моск. ун-та, 1976.
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. С. 60.
Звягинцев Д.Г., Зенова Г.М., Грачева Т.А., Курапова А.И., Дуброва М.С. Разнообразие почвенных актиномицетных комплексов, обусловленное температурными адаптациями мицелиальных актинобактерий // Теоретическая и прикладная экология. 2011. № 1. С. 4–23.
Зенова Г.М. Почвенные актиномицеты редких родов: Методическое руководство. М.: Изд-во Моск. ун-та, 2000. 81 с.
Зенова Г.М., Дуброва М.C., Звягинцев Д.Г. Структурно-функциональные особенности комплексов почвенных психротолерантных актиномицетов // Почвоведение. 2010. № 4. С. 482–487.
Ильина Т.К., Фомина О.М. Авторское свидетельство № 113328а от 30.06.83. Питательная среда для культивирования почвенных микроорганизмов.
Кирцидели И.Ю. Микроскопические грибы в почвах острова Хейса (Земля Франца-Иосифа) // Новости систематики низших растений. 2015. № 49. С. 151–160.
Кирцидели И.Ю., Власов Д.Ю., Зеленская М.С., Ильюшин В.А., Новожилов Ю.К., Чуркина И.В., Баранцевич Е.П. Оценка антропогенной инвазии микроскопических грибов в арктические экосистемы (архипелаг шпицберген) // Гигиена и санитария. 2020. № 99(2). С. 145–151. https://doi.org/10.33029/0016-9900-2020-99-2-145-151
Корнейкова М.В., Редькина В.В., Мязин В.А., Фокина Н.В., Шалыгина Р.Р. Микроорганизмы почв полуострова Рыбачий // Тр. Кольского научного центра РАН. 2019. № 10(4(7)). С. 108–122.
Крупская В.В., Мирошников А.Ю., Доржиева О.В., Закусин С.В., Семенков И.Н., Усачева А.А. Минеральный состав почв и донных осадков заливов архипелага Новая Земля // Океанология. 2017. № 57(1). С. 238–245.
Кутовая О.В. Трансформация структуры микробного сообщества дерново-подзолистой почвы под воздействием дождевых червей // Агрохимический вестник. 2008. № 2. С. 13–14.
Кутовая О.В., Гребенников А.М., Тхакахова А.К., Исаев В.А., Гармашов В.М., Беспалов В.А., Чевердин Ю.И., Белобров В.П. Изменение почвенно-биологических процессов и структуры микробного сообщества агрочерноземов при Разных способах обработки почвы // Бюл. Почв. ин-та им. В.В. Докучаева. 2018. № 92. С. 35–61. https://doi.org/10.19047/0136-1694-2018-92-35-61
Лысак Л.В., Максимова И.А., Никитин Д.А., Иванова А.Е., Кудинова А.Г., Соина В.С., Марфенина О.Е. Микробные сообщества почв Восточной Антарктиды // Вестник Моск. ун-та. Сер. 16. Биология. 2018. № 73(3). С. 132–140.
Лысак Л.В., Скворцова И.Н., Добровольская Т.Г. Методы оценки бактериального разнообразия почв и идентификации почвенных бактерий. М.: Макс-пресс, 2003. 120 с.
Марфенина О.Е., Никитин Д.А., Иванова А.Е. Структура грибной биомассы и разнообразие культивируемых микромицетов в почвах Антарктиды (станции Прогресс и Русская) // Почвоведение. 2016. № 8. С. 991–999. https://doi.org/10.7868/S0032180X16080074
Мосеев Д.С., Сергиенко Л.А. К флоре островов архипелага Земля Франца-Иосифа и северной части архипелага Новая Земля (аннотированный список видов) // Уч. зап. Петрозаводского государственного университета. 2017. № 4. С. 165.
Никитин Д.А., Марфенина О.Е., Максимова И.А. Использование сукцессионного подхода при изучении видового состава микроскопических грибов и содержания грибной биомассы в антарктических почвах // Микология и фитопатология. 2017. № 51(4). С. 211–219.
Никитин Д.А., Иванова Е.А., Железова А.Д., Семенов М.В., Гаджиумаров Р.Г., Тхакахова А.К., Чернов Т.И., Ксенофонтова Н.А., Кутовая О.В. Оценка влияния технологии no-till и вспашки на микробиом южных агрочерноземов // Почвоведение. 2020. № 12. С. 1508–1520. https://doi.org/10.31857/S0032180X20120084
Никитин Д.А., Лысак Л.В., Бадмадашиев Д.В., Холод С.С., Мергелов Н.С., Долгих А.В., Горячкин С.В. Биологическая активность почв северных территорий архипелага Новая Земля // Почвоведение. 2021. № 10. С. 1207–1230. https://doi.org/10.31857/S0032180X21100087
Никитин Д.А., Семенов М.В., Семиколенных А.А., Максимова И.А., Качалкин А.В., Иванова А.Е. Биомасса грибов и видовое разнообразие культивируемой микобиоты почв и субстратов о. Нортбрук (Земля Франца-Иосифа) // Микология и фитопатология. 2019. № 53(4). С. 210–222. https://doi.org/10.1134/S002636481904010X
Прокопенко В.В., Зенова Г.М., Манучарова Н.А. Экофизиологическая характеристика психротолерантных актиномицетов тундровых и лесных ландшафтов // Почвоведение. 2019. № 6. С. 734–742. https://doi.org/10.1134/S0032180X19040105
Семенков И.Н. Физико-географическая характеристика архипелага Новая Земля (литературный обзор). 2020. С. 1–40. https://doi.org/10.13140/RG.2.2.15583.20642
Усачева А.А., Семенков И.Н., Мирошников А.Ю., Крупская В.В., Закусин С.В. Геохимические особенности арктотундровых ландшафтов восточного побережья Новой Земли // Вестник Моск. ун-та. Сер. 5. География. 2016. № 6. С. 87–95.
Холод С.С. Растительность в окрестностях мыса Желания (остров Северный архипелага Новая Земля) // Растительность России. 2020. № 38. С. 85–138. https://doi.org/10.31111/vegrus/2020.38.85
Хоулт Дж., Крига Н., Снита П., Стейли Дж., Уилльямса С. Определитель бактерий Берджи / Пер. с анг. под ред. Г.А. Заварзина. М.: Мир, 1997. 800 с.
Bach E.M., Williams R.J., Hargreaves S.K., Yang F., Hofmockel K.S. Greatest soil microbial diversity found in micro-habitats // Soil Biology and Biochemistry. 2018. V. 118. P. 217–226. https://doi.org/10.1016/j.soilbio.2017.12.018
Belov A.A., Cheptsov V.S., Vorobyova E.A, Manucharova N.A., Ezhelev Z.S. Culturable Bacterial Communities Isolated from Cryo-Arid Soils: Phylogenetic and Physiological Characteristics // Pleontological J. 2020. V. 54(8). P. 903–912. https://doi.org/10.1134/S0031030120080043
de Hoog G.S., Guarro J., Gené J., Figueras M.J. Atlas of clinical fungi (No. Ed. 2). Centraalbureau voor Schimmelcultures (CBS). 2000. 1126 p.
Domsch K.H., Gams W., Anderson T.H. Compendium of soil fungi, 2nd taxonomically revised. Eching: IHW-Verlag. 2007. 627 p.
Ellis M.B. Dematiaceous hyphomycetes. 1971. 608 p.
Fanin N., Kardol P., Farrell M., Nilsson M.C., Gundale M.J., Wardle D.A. The ratio of Gram-positive to Gram-negative bacterial PLFA markers as an indicator of carbon availability in organic soils // Soil Biology and Biochemistry. 2019. V. 128. P. 111–114. https://doi.org/10.1016/j.soilbio.2018.10.010
Flimban S., Oh S.E., Joo J.H., Hussein K.A. Characterization and identification of cellulose-degrading bacteria isolated from a microbial fuel cell reactor // Biotechnology and Bioprocess Engineering. 2019. V. 24(4). P. 622–631. https://doi.org/10.1007/s12257-019-0089-3
Gesheva V., Negoita T. Psychrotrophic microorganism communities in soils of Haswell Island, Antarctica, and their biosynthetic potential // Polar Biology. 2012. V. 35(2). P. 291–297. https://doi.org/10.1007/s00300-011-1052-8
Hutchins D.A., Jansson J.K., Remais J.V., Rich V.I., Singh B.K., Trivedi P. Climate change microbiology–problems and perspectives // Nature Reviews Microbiology. 2019. V. 17(6). P. 391–396. https://doi.org/10.1038/s41579-019-0178-5
Kochkina G.A., Ivanushkina N.E., Lupachev A.V., Starodumova I.P., Vasilenko O.V., Ozerskaya S.M. Diversity of mycelial fungi in natural and human-affected Antarctic soils // Polar Biology. 2019. V. 42(1). P. 47–64. https://doi.org/10.1007/s00300-018-2398-y
Kudinova A.G., Petrova M.A., Dolgikh A.V., Soina V.S., Lysak L.V., Maslova O.A. Taxonomic Diversity of Bacteria and Their Filterable Forms in the Soils of Eastern Antarctica (Larsemann Hills and Bunger Hills) // Microbiology. 2020. V. 89(5). P. 574–584. https://doi.org/10.1134/S0026261720050136
Kumar S., Suyal D.C., Yadav A., Shouche Y., Goel R. Microbial diversity and soil physiochemical characteristic of higher altitude // PloS one. 2019. V. 14(3). P. e0213844. https://doi.org/10.1371/journal.pone.0213844
Malard L.A., Pearce D.A. Microbial diversity and biogeography in Arctic soils // Environmental microbiology reports. 2018. V. 10(6). P. 611–625. https://doi.org/10.1111/1758-2229.12680
Malcheva B., Nustorova M., Zhiyanski M., Sokolovska M., Yaneva R., Abakumov E. Diversity and activity of microorganisms in Antarctic polar soils // One Ecosystem. 2020. V. 5. P. e51816. https://doi.org/10.3897/oneeco.5.e51816
Mazei Y.A., Tsyganov A.N., Chernyshov V.A., Ivanovsky A.A., Payne R.J. First records of testate amoebae from the Novaya Zemlya archipelago (Russian Arctic) // Polar Biology. 2018. V. 41(6). P. 1133–1142. https://doi.org/10.1007/s00300-018-2273-x
McCready R.G.L., Gould W.D., Barendregt R.W. Nitrogen isotope fractionation during the reduction of NO3− to NH4+ by Desulfovibrio sp. // Canadian J. Microbiology. 1983. V. 29(2). P. 231–234.
Möller K. Effects of anaerobic digestion on soil carbon and nitrogen turnover, N emissions, and soil biological activity // Agronomy for sustainable development. 2015. V. 35(3). P. 1021–1041. https://doi.org/10.1007/s13593-015-0284-3
Nash M.V., Anesio A.M., Barker G., Tranter M., Varliero G., Eloe-Fadrosh E.A., Nielsen T., Turpin-Jelfs T., Benning L.G., Sánchez-Baracaldo P. Metagenomic insights into diazotrophic communities across Arctic glacier forefields // FEMS microbiology ecology. 2018. V. 94(9). fiy114. https://doi.org/10.1093/femsec/fiy114
Norum R., Proctor J. Svalbard: Spitsbergen, Jan Mayen and Franz Josef Land. Bradt Travel Guides. 2018.
Rousk K., Sorensen P.L., Michelsen A. Nitrogen fixation in the High Arctic: a source of ‘new’nitrogen? // Biogeochemistry. 2017. V. 136(2). P. 213–222. https://doi.org/10.1007/s10533-017-0393-y
Salcher M.M. Isolation and cultivation of planktonic freshwater microbes is essential for a comprehensive understanding of their ecology // Aquatic Microbial Ecology. 2016. V. 77(3). P. 183–196. https://doi.org/10.3354/ame01796
Seifert K.A., Gams W. The genera of Hyphomycetes–2011 update // Persoonia. 2011. V. 27. P. 119. https://doi.org/10.3767/003158511X617435
Selbmann L., Zucconi L., Ruisi S., Grube M., Cardinale M., Onofri S. Culturable bacteria associated with Antarctic lichens: affiliation and psychrotolerance // Polar Biology. 2010. V. 33(1). P. 71–83. https://doi.org/10.1007/s00300-009-0686-2
Singh P., Singh S.M., Singh R.N., Naik S., Roy U., Srivastava A., Bölter M. Bacterial communities in ancient permafrost profiles of Svalbard, Arctic // J. Basic Microbiology. 2017. V. 57(12). P. 1018–1036. https://doi.org/10.1002/jobm.201700061
Walker D.A., Raynolds M.K., Danils F.J.A., Einarsson E., Elvebakk A., Gould W., Katenin A.E., Kholod S.S., Markon C.J., Melnikov E.S., Moskalenko N.G., Talbot S.S., Yurtsev B.A. and other members of the CAVM Team. The Circumpolar Arctic vegetation map // J. Vegetation Sciences. 2005. V. 16. P. 267–282. https://doi.org/10.1111/j.1654-1103.2005.tb02365.x
Wang J., Chadwick D.R., Cheng Y., Yan X. Global analysis of agricultural soil denitrification in response to fertilizer nitrogen // Science of the Total Environment. 2018. V. 616. P. 908–917. https://doi.org/10.1016/j.scitotenv.2017.10.229
Дополнительные материалы отсутствуют.