Почвоведение, 2021, № 3, стр. 347-354
Прокариотное сообщество древней мерзлоты Антарктиды после облучения гамма-излучением в модельных условиях Марса
В. С. Чепцов a, b, *, Е. А. Воробьева a, Н. А. Манучарова a, М. В. Горленко a, А. К. Павлов c, М. С. Розанова a, В. Н. Ломасов d, А. А. Белов a, А. Е. Чумиков b
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт космических исследований РАН
117997 Москва, Профсоюзная ул., 84/32, Россия
c Физико-технический институт им. А.Ф. Иоффе РАН
194021 Санкт-Петербург, Политехничекая ул., 26, Россия
d Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Политехническая ул., 29, Россия
* E-mail: cheptcov.vladimir@gmail.com
Поступила в редакцию 08.05.2020
После доработки 19.05.2020
Принята к публикации 26.06.2020
Аннотация
Исследовано влияние облучения гамма-излучением дозой 100 кГр в условиях низкого давления (1 торр) и низкой температуры (–50°С) на микробное сообщество древней мерзлой осадочной породы Антарктиды. Установлено, что общая численность клеток прокариот, определяемая методом эпифлуоресцентной микроскопии, как и численность метаболически активных клеток бактерий и архей, обнаруженных с помощью метода флуоресценции in situ гибридизации, после облучения сохраняется на контрольном уровне, в то время как число культивируемых гетеротрофных бактерий снижалось на порядок. Методом мультисубстратного тестирования показано, что микробный комплекс сохранил высокую потенциальную метаболическую активность и функциональное разнообразие после воздействия совокупности экстремальных физических факторов. Устойчивость, продемонстрированная микробным сообществом, существенно превышает общепринятые оценки радиорезистентности прокариот и свидетельствует о недооценке радиорезистентности микроорганизмов в естественных местообитаниях, важной роли минеральной гетерофазной среды и условий облучения (давления, температуры). Исследование подтверждает потенциальную возможность длительной криоконсервации жизнеспособных микроорганизмов земного типа в реголите Марса, а также возможность переноса анабиотических форм жизни в составе малых тел в космической среде.
ВВЕДЕНИЕ
Ионизирующее излучение является важнейшим фактором, оказывающим непрерывное воздействие на динамику биосферных процессов в прошлом и настоящем [6, 14]. С развитием цивилизации необходимость оценки влияния радиации на естественную среду возрастает в связи с производством ядерной энергии, накоплением радиоактивных отходов и усилением радиационной нагрузки на биосферу. Выход человека за пределы Земли, перспективы освоения других планет Солнечной системы также требуют совершенствования знаний о радиационно активной среде и устойчивости в ней известных нам форм жизни.
Влияние радиации на микроорганизмы изучается на протяжении десятилетий, однако остается много нерешенных вопросов. Прежде всего, неясны пределы устойчивости микроорганизмов в естественной среде обитания к воздействию ионизирующего излучения. Показано, что наиболее радиорезистентные виды прокариот в чистой культуре способны выдерживать воздействие доз около 20–25 кГр [25]. Но в условиях природных гетерофазных органо-минеральных экотопов (почв, пород) радиорезистентность микроорганизмов может существенно меняться. Большое биоразнообразие природных микробных сообществ, разнообразие экологических ниш (микрозон), характеризуемых различными физико-химическими параметрами, дублирование экологических функций микроорганизмами, внутри- и межпопуляционные взаимодействия, присутствие пула метаболитов и протекторные свойства гетерофазной среды способствуют поддержанию гомеостаза экосистем и их функционированию и выживанию при экстремальных нагрузках [11, 35]. Микроорганизмы природных местообитаний имеют развитые взаимосвязанные механизмы ответа на различные стрессовые воздействия [18] и повышенный адаптационный потенциал [20], что также может существенно корректировать их устойчивость к радиационным воздействиям.
Радиорезистентность микроорганизмов в природной среде относительно мало изучена. По данным различных авторов, стерилизующие дозы для почв и грунтов варьируют от ~6 до 65 кГр [22, 25, 30, 31]. В подавляющем большинстве работ по изучению радиорезистентности микробных сообществ in situ обнаружение жизнеспособных клеток проводилось только культуральными методами. В то же время известно, что в стрессовых условиях микроорганизмы могут образовывать некультивируемые и покоящиеся формы [12, 30], и эти физиологические перестройки имеют существенное значение в стратегии выживания микроорганизмов и микробных сообществ в почвах и породах, особенно в экстремальных местообитаниях [34]. Переход микроорганизмов в покоящееся или некультивируемое состояние может быть ошибочно воспринят как их гибель, а величина стерилизующей дозы радиации может быть недооценена. Очевидно, что подобные исследования требуют одновременного применения как культуральных, так и in situ методов. Стерилизующие дозы радиации для естественных микробных сообществ на сегодняшний день не определены, как и факторы, влияющие на устойчивость микроорганизмов in situ.
Ионизирующая радиация рассматривается как основной фактор, лимитирующий существование и распространения жизни за пределами нашей планеты [3, 27]. Результаты исследований радиорезистентности микроорганизмов используются при планировании космических миссий для оценки возможности обнаружения живых организмов и биомолекул в составе различных космических объектов, а также при построении моделей зарождения и эволюции жизни. При воздействии радиации на клетку во внеземных условиях возможна существенная модификация радиационных эффектов. В частности, температура, давление, состав атмосферы, присутствие воды и другие факторы влияют на количество радиационных повреждений в клетке [3, 10]. В связи с этим важно исследовать синергичное действие комплекса внеземных условий на сложные гетерогенные биокосные системы (почвы, породы, грунты), являющиеся земными аналогами гипотетических инопланетных экосистем.
Недавно было показано, что микробные сообщества древних (возрастом около 2 млн лет) мерзлых пород Арктики in situ способны выдерживать воздействие гамма-излучения в дозах до 100 кГр в условиях низкого давления и низкой температуры [7]. Столь высокая радиорезистентность существенно превосходит существующие представления об устойчивости микроорганизмов. Для выявления механизмов, обусловливающих стабильность природных экосистем при воздействии гамма-излучения, необходимы: 1 – сравнительное изучение радиорезистентности микробных сообществ в так называемых “экстремальных местообитаниях” и биотопах, не подверженных постоянной высокой стрессовой нагрузке с оценкой влияния на стрессоустойчивость их физико-химических характеристик и генезиса; 2 – сравнительный анализ данных, полученных ранее для других экстремальных природных объектов с целью выяснить, насколько высокая радиорезистентность микробных сообществ in situ является общим феноменом, специфической характеристикой экстремальных экотопов.
В настоящей работе исследовали комплексное воздействие физических факторов, имитирующих основные условия поверхности Марса (гамма-излучение (100 кГр), низкое давление (1 торр) и низкую температуру (–50°С)) на жизнеспособность природного микробного сообщества длительно мерзлой осадочной антарктической породы. Вечная мерзлота и аридные полярные пустыни Антарктиды рассматриваются в числе природных местообитаний Земли, наиболее приближенных по совокупности физико-химических условий к известной характеристике реголита Марса. Это является основанием для проведения микробиологических исследований астробиологической направленности в наиболее экстремальных районах Антарктиды, в частности, в районе Сухих Долин [13, 16, 32]. Использованная в экспериментах доза радиации подразумевала длительное воздействие космических лучей на марсианский реголит и накопление радиационных повреждений клетками, предположительно сохраненных в анабиотическом состоянии микроорганизмов в грунте Марса. Такой подход при выявлении предельной дозы позволяет оценить геологическое время сохранения жизнеспособности микроорганизмами и микробными сообществами земного типа в реголите после утраты Марсом значительной части атмосферы и формирования условий, характеризующих планету в современном состоянии.
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения исследования использован образец антарктической мерзлой осадочной породы (образец А-6/99-6). Образец отобран с глубины 1.3–1.5 м в скважине 6/99, пробуренной в равнинном районе долины Бикона (77°50′ S, 160°36′ E, 1270 м над ур. моря) [16]. Регион Сухих долин в Антарктиде, где расположена станция Мак Мёрдо, интенсивно исследуется и подробно описан [5]. Возраст мерзлоты, исследованной в данной работе, оценивается в 50–300 тыс. лет [16]. Осадочная порода представляет собой крупнозернистый песок с включениями гальки, сцементированный льдом в массивную криогенную структуру глубиной не менее 20 м (далее не бурили). Максимальная отрицательная температура, зарегистрированная в исследованных мерзлых породах, –18.5°C. Содержание ионов ${\text{NO}}_{{\text{3}}}^{ - },$ Cl–, ${\text{CO}}_{{\text{3}}}^{{{\text{2}} - }},$ ${\text{NH}}_{{\text{4}}}^{ + },$ Na+, Mn2+, Mg2+, K+ и суммарное содержание ионов Fe2+ + Fe3+ в образце составляло 0.78, 62.3, 172.39, 2.56, 915.15, 331.35, 10.47, 106.98 и 34.22 мг/кг соответственно. Содержание Сорг составляло 0.01%. рН водной вытяжки 8.21 [16]. Методика отбора образцов и их транспортировки в лабораторию была подробно описана ранее [16]. После доставки в лабораторию до проведения эксперимента образцы хранили при –18°С.
Перед облучением образец мерзлой породы инкубировали без внесения каких-либо веществ при температуре +28°С в течение 10 сут с целью реактивации микробного сообщества, затем высушивали до воздушно-сухого состояния в течение суток при той же температуре. Далее образец был разделен на 4 навески, одна из которых не была облучена и служила контролем, 3 навески были облучены. Для облучения образцы помещали в ранее описанную климатическую камеру [28], позволяющую поддерживать стабильно низкое давление 1 торр и температуру –50°С в течение всего времени облучения. Облучение проводили на гамма-установке К-120000 с источниками 60Со при интенсивности излучения 5 кГр/ч. После облучения до проведения анализов образцы хранили при –18°С.
Определение численности культивируемых гетеротрофных аэробных бактерий проводили методом посева каждого образца из серии разведений на плотные питательные среды: глюкозо-пептоно-дрожжевую (ГПД) (пептон – 2 г/л; глюкоза – 1 г/л; дрожжевой экстракт – 1 г/л; гидролизат казеина – 1 г/л; СаСО3 – 1 г/л, агар-агар – 20 г/л) и 1/2 R2A (R2A агар (“Difco”, США) – 9.1 г/л, агар-агар – 15 г/л) [1]. Культивирование проводили при температуре +28°С. Общую численность прокариот в образцах определяли методом эпифлуоресцентной микроскопии (ЭФМ) с акридином оранжевым [1]. Оценку численности бактерий и архей проводили с помощью метода флуоресценции in situ гибридизации (FISH) с рРНК-специфичными флуоресцентно мечеными олигонуклеотидными зондами ARCH915 и EUB338 + EUB338I (“Синтол”, Россия), специфичными для представителей доменов Archaea и Bacteria соответственно. Анализ проводили по методике, описанной ранее [21]. Потенциальную метаболическую активность микробных сообществ исследовали методом мультисубстратного тестирования согласно ранее описанной методике [2] с изменениями [7]. Статистическую обработку данных проводили с использованием программных пакетов STATISTICA 8.0, Microsoft Office Excel 2007 и оригинального программного обеспечения “Эко-Лог” [2].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Число КОЕ аэробных гетеротрофных бактерий после облучения снизилось на порядок (табл. 1). Тем не менее, численность культивируемых клеток бактерий сохранялась на высоком уровне – десятки миллионов КОЕ/г. Общее содержание клеток прокариот, определенное методом ЭФМ с акридином оранжевым, после облучения уменьшилось в 1.5–1.8 раз. Общая численность прокариот и число КОЕ бактерий во всех исследованных образцах несколько превышали соответствующие показатели других образцов мерзлых пород Сухих долин и долины Бикона [16]. Вероятно, это связано с увеличением численности микроорганизмов в ходе инкубации образцов. В составе микробных сообществ in situ при исследованнии методом FISH были обнаружены как бактерии, так и археи. После облучения содержание метаболически активных клеток бактерий и архей изменилось несущественно (изменения не превышали погрешности измерений), при этом и варьирование показателей численности клеток в облученных образцах было незначительным, что свидетельствует о высокой воспроизводимости результатов эксперимента.
Таблица 1.
Влияние гамма-излучения (100 кГр), низкой температуры (–50°С) и низкого давления (1 торр) на численность культивируемых бактерий (КОЕ/г), общую численность прокариот (кл/г) и численность метаболически активных бактерий и архей (кл/г) в образце А-6/99-6
| Образец | Среда ГПД | Среда 1/2 R2A | Общая численность (ЭФМ) | Archaea (FISH) | Bacteria (FISH) |
|---|---|---|---|---|---|
| Контроль | 1.1 ± 0.4 × 108 | 3.5 ± 2.9 × 107 | 1.5 ± 0.2 × 109 | 5.6 ± 2.6 × 107 | 1.1 ± 0.3 × 108 |
| Облученный № 1 | 1 ± 0.3 × 107 | 2.5 ± 1.9 × 106 | 8.5 ± 1.3 × 108 | 4 ± 1.8 × 107 | 6.9 ± 2.5 × 107 |
| Облученный № 2 | 1.6 ± 1.1 × 107 | 2.9 ± 1.6 × 106 | 9.9 ± 0.9 × 108 | Не опр. | |
| Облученный № 3 | 9.2 ± 3.2 × 106 | 9.8 ± 8.1 × 105 | 8.3 ± 1.2 × 108 | ||
Исследованное микробное сообщество древней антарктической мерзлоты продемонстрировало in situ повышенную радиорезистентность в сравнении с известными данными. В частности, ранее было показано, что при облучении поверхностных образцов мерзлой породы из того же региона (Мак-Мёрдо, Сухие долины) дозой 6 кГр в нормальных условиях число КОЕ бактерий снижалось более чем на 2 порядка [25]. Сведения о выживании прокариот при облучении дозами свыше 80 кГр отсутствуют [22, 25, 31], за исключением вышеупомянутых результатов наших исследований [7].
В контрольном образце число КОЕ в зависимости от среды культивирования составляло 2.3–7.3% от общей численности прокариот (ЭФМ) и 32–100% от числа метаболически активных клеток бактерий (FISH). В облученных образцах эти показатели составляли 0.1–1.6 и 3.6–14.5% соответственно. Можно предполагать, что уменьшение доли культивируемых клеток связано с изменением физиологического статуса микроорганизмов in situ и торможением процессов репликации. Возможен переход части популяций в некультивируемое состояние, что является известной реакцией прокариот на стрессовое воздействие [12]. Подобный результат (уменьшение числа КОЕ при небольшом изменении общей численности прокариот) мог быть обусловлен и переходом микроорганизмов в дормантное состояние, однако дормантные клетки, как правило, не обнаруживаются методом FISH без применения специальных методик [8]. Отношение же численности метаболически активных бактерий и общей численности прокариот практически не изменялось после облучения. Эффект перехода почвенных бактерий в некультивируемое состояние в результате облучения наблюдали ранее Питонцо с соавт. [30]. Этими авторами было показано, что при благоприятных условиях возможен выход бактерий из некультивируемого состояния и восстановление способности к культивированию.
При анализе основных параметров функционального разнообразия и метаболической активности микробных сообществ после облучения образцов, поведенном с использованием метода мультисубстратного тестирования, отмечено возрастание коэффициентов рангового распределения спектров потребления субстратов (d), что указывает на некоторую дестабилизацию сообщества. Сократилось разнообразие потребляемых субстратов (N), увеличилась удельная метаболическая работа (W) (табл. 2). Значения индексов Шеннона (H) и индексов выравненности (E) оставались близки к контрольным значениям. Среднее потребление пентоз, спиртов, олигосахаров и солей органических кислот было близко к утилизации этих групп субстратов в контроле, в то время как потребление гексоз, полимеров и аминокислот возросло в 1.5, 2.1 и 2.7 раз соответственно. Таким образом, после облучения в заданных моделируемых условиях при небольшом уменьшении функционального разнообразия наблюдался рост потенциальной метаболической активности. Микробное сообщество антарктической мерзлой породы после облучения более активно в сравнении с контролем потребляло аминокислоты и полимеры (рис. 1). Однако в целом метаболический “образ” сообщества после воздействия дозой 100 кГр в заданных условиях существенно не нарушился.
Таблица 2.
Параметры функционального разнообразия и потенциальной метаболической активности микробных сообществ вечномерзлой породы до и после воздействия моделируемых условий
| Параметр функционального состояния микробного сообщества | Образец | |||
|---|---|---|---|---|
| контроль | облученный № 1 | облученный № 2 | облученный № 3 | |
| Коэффициент рангового распределения спектров потребления субстратов, d | 1.22 | 1.31 | 1.4 | 1.34 |
| Количество потребляемых субстратов, N | 23 | 18 | 20 | 21 |
| Удельная метаболическая работа, W | 1523 | 1652 | 1732 | 1715 |
| Выравненность, E | 0.98 | 0.97 | 0.97 | 0.96 |
| Индекс Шеннона, H | 4.4 | 4 | 4.1 | 4.2 |
Рис. 1.
Потребление (оптическая плотность в лунках МСТ-планшета) номинальных групп субстратов микробным сообществом до и после облучения. П – пентозы, Г – гексозы, О – олигосахариды, С – спирты, А – аминокислоты, ОК – соли органических кислот, Пм – полимеры, ААН – амины, амиды, нуклеозиды. Образцы: 1 – контроль; 2 – облученный образец № 1, 3 – облученный образец № 2, 4 – облученный образец № 3.
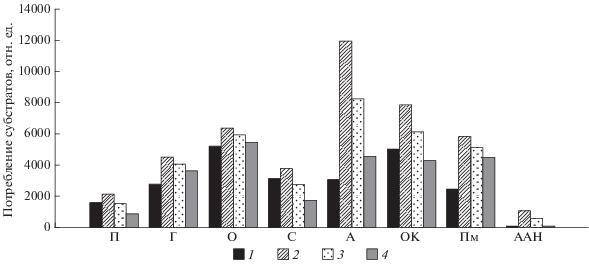
В ранее опубликованных исследованиях [23, 29] при облучении почв гамма-излучением дозами около 10 кГр в нормальных условиях угнетение микробных сообществ in situ было более существенным, чем в нашем эксперименте: потенциальная метаболическая активность сокращалась в 6 и более раз, разнообразие потребляемых субстратов – в 4 и более раз, вплоть до полного ингибирования активности. При этом была продемонстрирована возможность восстановления метаболической активности и функционального разнообразия при увлажнении и последующей инкубации облученных образцов [23].
Таким образом, совокупное воздействие высокой дозы гамма-излучения, низкой температуры и низкого давления не приводит к гибели прокариотных комплексов, сформировавшихся в экстремальных условиях мерзлоты Антарктиды. Однако такое воздействие может вызывать изменение репродуктивной и метаболической активности функционирующих популяций. Основным механизмом быстрого реагирования прокариотных сообществ на такое воздействие, по-видимому, является переход в некультивируемое и/или дормантное состояние.
Результаты настоящего исследования согласуются с полученными нами ранее данными об устойчивости прокариот древней мерзлой породы Арктики к аналогичному воздействию [7], несмотря на существенно иной генезис пород, существенные различия в температурных условиях и длительности пребывания пород в мерзлом состоянии. Продемонстрирована идентичная реакция микробных сообществ на комплексное воздействие основных физических факторов реголита Марса: существенное уменьшение числа КОЕ при сохранении общего содержания клеток прокариот и числа метаболически активных клеток на уровне, близком к исходному, сохранение метаболического “образа” микробного комплекса при небольшом сокращении разнообразия потребляемых субстратов и увеличении потенциальной метаболической активности с активным потреблением аминокислот. В то же время по показателям общей численности, определяемой методом ЭФМ, сообщество мерзлоты Антарктиды оказалось несколько менее устойчивым, чем ранее исследованный микробный комплекс мерзлой породы Арктики, обнаружив сокращение общего обилия клеток после облучения. В арктической мерзлоте общая численность прокариот сохранялась на контрольном уровне [7]. Возможно, сказалось различие в возрасте исследованных мерзлых пород, то есть времени их пребывания при отрицательных температурах. В течение длительной криоконсервации микроорганизмы полярных регионов Земли могут аккумулировать радиационные повреждения вследствие воздействия весьма высоких доз ионизирующего излучения, полученных в течение геологического времени [15]. Для ранее исследованной нами мерзлоты Арктики суммарная аккумулированная доза вероятно не превышала 4–6 кГр, для более молодых антарктических – на порядок меньше. Экспериментально показано, что бактерии способны приобретать повышенную радиорезистентность после облучения [17]. Другим фактором для обсуждения некоторых различий в устойчивости может быть температура осадочной толщи, которая в Антарктиде на 10–15°С ниже. Если в мерзлоте Восточной Сибири она составляет –7–12°С, что позволяет клеткам сохранять физиологическую активность и восстанавливать повреждения, то в мерзлоте Антарктиды в месте отбора образцов она достигает –18–27°С [15, 16], то есть тормозит метаболическую активность клеток и, следовательно, процессы репарации, до минимального уровня. Однако в целом полученные данные свидетельствуют о том, что высокая радиорезистентность in situ характерна для микроорганизмов, выживающих в экстремально холодных местообитаниях.
Устойчивость, продемонстрированная микробными сообществами мерзлоты in situ, существенно превышает общепринятые оценки радиорезистентности микроорганизмов. Как уже отмечено, радиорезистентность обусловлена условиями, в которых проводилось облучение: низкая температура, низкое давление, и, следовательно, низкая концентрация кислорода и воды. Известно, что понижение температуры и снижение концентрации источников свободных радикалов (кислорода и воды) существенно уменьшает количество радиационных повреждений клетки [3, 10]. Однако полученные данные дают основания полагать, что радиорезистентность микроорганизмов в естественной среде обитания недооценивается. Это отчасти подтверждается данными о выживании грибов Cryomyces antarcticus после облучения гамма-излучением дозой 117 кГр при нормальных условиях [26]. Заметим, что эукариоты принято считать более радиочувствительными в сравнении с прокариотами [22].
В настоящее время представления об экстремофилии и устойчивости микроорганизмов заметно меняются. Обнаруживаются все более устойчивые микроорганизмы, таксономический спектр устойчивых форм расширяется. В частности, дополняются знания о температурных границах роста микроорганизмов [33], об устойчивости к высокому и низкому давлению [28, 33], сильным окислителям [4], обнаруживаются новые радиорезистентные виды микроорганизмов [24, 31]. Диапазон жизнеспособности клеток оказывается гораздо шире, чем считалось ранее.
Результаты исследования позволяют более адекватно оценивать перспективу обнаружения жизнеспособных микроорганизмов в грунте Марса. Предполагается, что на начальных этапах эволюции планеты Марс имел климат благоприятный для развития биосферы [13]. В дальнейшем, при изменении климата, гипотетическая биосфера могла быть криоконсервирована подобно микробным сообществам древней мерзлоты [16]. При этом длительность ее сохранения в жизнеспособном состоянии неизбежно лимитируется накоплением радиационных повреждений в клетках, так как в условиях низких температур скорость репарации повреждений клетками очень мала [3, 27, 33]. Учитывая интенсивность излучения в реголите Марса [9, 19], доза 100 кГр аккумулируется в течение 1.3 млн лет в поверхностном слое реголита и в течение 20 млн лет на глубине 5 м. Полученные данные позволяют предполагать возможность сохранения жизнеспособных микроорганизмов и реликтовых экосистем в реголите Марса, по крайней мере, в течение указанных периодов времени после утраты Марсом значительной части атмосферы и приближения к современным условиям. Следует еще раз подчеркнуть, что после облучения микробное сообщество мерзлоты сохраняло метаболическую активность in situ, что подтверждается данными FISH. Следовательно, микроорганизмы были способны осуществлять репарацию повреждений после воздействия столь высокой дозы радиации. Этот факт говорит о том, что расчетная длительность сохранения гипотетических экосистем в реголите Марса может быть существенно увеличена. Кроме того, из результатов исследования следует, что в условиях низкого давления и низкой температуры испытанная нами доза облучения ниже стерилизующей.
Список литературы
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. 304 с.
Горленко М.В., Кожевин П.А. Мультисубстратное тестирование природных микробных сообществ. М.: МАКС Пресс, 2005. 88 с.
Baumstark-Khan C., Facius R. Life under conditions of ionizing radiation // Astrobiology: The Quest for the Conditions of Life. Berlin: Springer, 2002. P. 261–284. https://doi.org/10.1007/978-3-642-59381-9_18
Beblo-Vranesevic K., Huber H., Rettberg P. High tolerance of Hydrogenothermus marinus to sodium perchlorate. // Frontiers in Microbiology. 2017. V. 8. P. 1369. https://doi.org/10.3389/fmicb.2017.01369
Bockheim J.G., Campbell I.B., McLeod M. Permafrost distribution and active-layer depths in the McMurdo Dry valleys, Antarctica // Permafrost and Periglacial Processes. 2007. V. 18. № 3. P. 217–227. https://doi.org/10.1002/ppp.588
Brown A.R., Boothman C., Pimblott S.M., Lloyd J.R. The impact of gamma radiation on sediment microbial processes // Applied and Environmental Microbiology. 2015. V. 81. № 12. P. 4014–4025. https://doi.org/10.1128/AEM.00590-15
Cheptsov V.S., Vorobyova E.A., Manucharova N.A., Gorlenko M.V., Pavlov A.K., Vdovina M.A., Lomasov V.N., Bulat S.A. 100 kGy gamma-affected microbial communities within the ancient Arctic permafrost under simulated Martian conditions // Extremophiles. 2017. V. 21. № 6. P. 1057–1067. https://doi.org/10.1007/s00792-017-0966-7
Daims H., Stoecker K., Wagner M. Fluorescence in situ hybridization for the detection of prokaryotes // Molecular microbial ecology. Abingdon: Taylor and Francis, 2005. P. 192–212.
Dartnell L.R., Desorgher L., Ward J.M., Coates A.J. Martian sub-surface ionising radiation: biosignatures and geology // Biogeosciences Discussions. 2007. V. 4. № 1. P. 455–492.
Dartnell L.R., Hunter S.J., Lovell K.V., Coates A.J., Ward J.M. Low-temperature ionizing radiation resistance of Deinococcus radiodurans and Antarctic Dry Valley bacteria // Astrobiology. 2010. V. 10. № 7. P. 717–732. https://doi.org/10.1089/ast.2009.0439
El-Registan G.I., Mulyukin A.L., Nikolaev Y.A., Stepanenko I.Y., Kozlova A.N., Martirosova E.I., Shanenko E.F., Strakhovskaya M.G., Revina A.A. The role of microbial low-molecular-weight autoregulatory factors (alkylhydroxybenzenes) in resistance of microorganisms to radiation and heat shock // Advances in Space Research. 2005. V. 36. № 9. P. 1718–1728. https://doi.org/10.1016/j.asr.2005.02.070
El-Registan G.I., Mulyukin A.L., Nikolaev Y.A., Suzina N.E., Gal’chenko V.F., Duda V.I. Adaptogenic functions of extracellular autoregulators of microorganisms // Microbiology. 2006. V. 75. № 4. P. 380–389. https://doi.org/10.1134/S0026261706040035
Fairén A.G., Davila A.F., Lim D., Bramall N., Bonaccorsi R., Zavaleta J., Uceda E.R., Stoker C., Wierzchos J., Dohm J.M., Amils R., Andersen D., McKay C.P. Astrobiology through the ages of Mars: the study of terrestrial analogues to understand the habitability of Mars // Astrobiology. 2010. V. 10. № 8. P. 821–843. https://doi.org/10.1089/ast.2009.0440
Giardino G., Pillitteri I., Favata F., Micela G. The X-ray luminosity of solar-mass stars in the intermediate age open cluster NGC 752 // Astronomy and Astrophysics. 2008. V. 490. № 1. P. 113–123. https://doi.org/10.1051/0004-6361:200810042
Gilichinsky D. Permafrost as a microbial habitat // Encyclopedia of environmental microbiology. N.Y.: Wiley, 2002. P. 932–956.
Gilichinsky D.A., Wilson G.S., Friedmann E.I., McKay C.P., Sletten R.S., Rivkina E.M., Vishnivetskaya T.A., Erokhina L.G., Ivanushkina N.E., Kochkina G.A., Shcherbakova V.A., Soina V.S., Spirina E.V., Vorobyova E.A., Fyodorov-Davydov D.G., Hallet B., Ozerskaya S.M., Sorokovikov V.A., Laurinavichyus K.S., Shatilovich A.V., Chanton I.P., Ostroumov V.E., Tiedje J.M. Microbial populations in Antarctic permafrost: biodiversity, state, age and implication for astrobiology // Astrobiology. 2007. V. 7. № 2. P. 275–311. https://doi.org/10.1089/ast.2006.0012
Harris D.R., Pollock S.V., Wood E.A., Goiffon R.J., Klingele A.J., Cabot E.L., Schackwitz W., Martin J., Eggington J., Durfee T.J., Middle C.M., Norton J.E., Popelars M.C., Li H., Klugman S.A., Hamilton L.L., Bane L.B., Pennacchio L.A., Albert T.J., Perna N.T., Cox M.M., Battista J.R. Directed evolution of ionizing radiation resistance in Escherichia coli // J. Bacteriology. 2009. V. 191. № 16. P. 5240–5252. https://doi.org/10.1128/JB.00502-09
Harrison J.P., Gheeraert N., Tsigelnitskiy D., Cockell C.S. The limits for life under multiple extremes // Trends in Microbiology. 2013. V. 21. № 4. P. 204–212. https://doi.org/10.1016/j.tim.2013.01.006
Hassler D.M., Zeitlin C., Wimmer-Schweingruber R.F., Ehresmann B., Rafkin S., Eigenbrode J.L., Brinza D.E., Weigle G., Böttcher S., Böhm E., Burmeister S., Guo J., Köhler J., Martin C., Reitz G., Cucinotta F.A., Kim M., Grinspoon D., Bullock M.A., Posner A., Gómez-Elvira J., Vasavada A., Grotzinger J.P., MSL Science Team. Mars’ surface radiation environment measured with the Mars Science Laboratory’s Curiosity rover // Science. 2014. V. 343. P. 1244797. https://doi.org/10.1126/science.1244797
Kryazhevskikh N., Demkina E., Loiko N., Baslerov R., Kolganova T., Soina V., Manucharova N.A., Gal’chenko V.F., El’-Registan G. Comparison of the adaptive potential of the Arthrobacter oxydans and Acinetobacter lwoffii isolates from permafrost sedimentary rock and the analogous collection strains // Microbiology. 2013. V. 82. № 1. 29–42. https://doi.org/10.1134/S0026261713010050
Manucharova N.A., Vlasenko A.N., Men’ko E.V., Zvyagintsev D.G. Specificity of the chitinolytic microbial complex of soils incubated at different temperatures // Microbiology. 2011. V. 80. № 2. P. 205–215. https://doi.org/10.1134/S002626171102010X
McNamara N.P., Black H.I.J., Beresford N.A., Parekh N.R. Effects of acute gamma irradiation on chemical, physical and biological properties of soils // Applied Soil Ecology. 2003. V. 24. № 2. P. 117–132. https://doi.org/10.1016/S0929-1393(03)00073-8
McNamara N.P., Griffiths R.I., Tabouret A., Beresford N.A., Bailey M.J., Whiteley A.S. The sensitivity of a forest soil microbial community to acute gamma-irradiation // Applied Soil Ecology. 2007. V. 37. № 1–2. P. 1–9. https://doi.org/10.1016/j.apsoil.2007.03.011
Mirzaie A., Mehrabadi J.F., Amirmozafari N., Nejadsattari T. Isolation and characterization of a new gamma and UV radiation resistant bacterium from soil samples of an Iranian radioactive site and analysis of its pigment // Microbiology. 2015. V. 84. № 3. P. 449–452. https://doi.org/10.1134/S0026261715030133
Musilova M., Wright G., Ward J.M., Dartnell L.R. Isolation of radiation-resistant bacteria from Mars analog Antarctic Dry Valleys by preselection, and the correlation between radiation and desiccation resistance // Astrobiology. 2015. V. 15. № 12. P. 1076–1090. https://doi.org/10.1089/ast.2014.1278
Pacelli C., Selbmann L., Zucconi L., Raguse M., Moeller R., Shuryak I., Onofri S. Survival, DNA integrity, and ultrastructural damage in Antarctic cryptoendolithic eukaryotic microorganisms exposed to ionizing radiation // Astrobiology. 2017. V. 17. № 2. P. 126–135. https://doi.org/10.1111/1758-2229.12632
Pavlov A.K., Blinov A.V., Konstantinov A.N. Sterilization of Martian surface by cosmic radiation // Planetary and Space Science. 2002. V. 50. № 7–8. P. 669–673. https://doi.org/10.1016/S0032-0633(01)00113-1
Pavlov A.K., Shelegedin V.N., Vdovina M.A., Pavlov A.A. Growth of microorganisms in Martian-like shallow subsurface conditions: laboratory modelling // International Journal of Astrobiology. 2010. V. 9. № 1. P. 51–58. https://doi.org/10.1017/S1473550409990371
Pitonzo B.J., Amy P.S., Rudin M. Effect of gamma radiation on native endolithic microorganisms from a radioactive waste deposit site // Radiation Research. 1999a. V. 152. № 1. P. 64–70. https://doi.org/10.2307/3580050
Pitonzo B.J., Amy P.S., Rudin M. Resuscitation of microorganisms after gamma irradiation // Radiation Research. 1999b. V. 152. № 1. P. 71–75. https://doi.org/10.2307/3580051
Rainey F.A., Ray K., Ferreira M., Gatz B.Z., Nobre M.F., Bagaley D., Rash B.A., Park M.J., Earl A.M., Shank N.C., Small A.M., Henk M.C., Battista J.R., Kämpfer P., da Costa M.S. Extensive diversity of ionizing-radiation-resistant bacteria recovered from Sonoran Desert soil and description of nine new species of the genus Deinococcus obtained from a single soil sample // Applied and Environmental Microbiology. 2005. V. 71. № 9. P. 5225–5235. https://doi.org/10.1128/AEM.71.9.5225-5235.2005
Rivkina E., Abramov A., Spirina E., Petrovskaya L., Shatilovich A., Shmakova L., Scherbakova V. Vishnivetskaya T. Earth’s perennially frozen environments as a model of cryogenic planet ecosystems // Permafrost and Periglacial Processes. 2018. V. 29. № 4. P. 246–256. https://doi.org/10.1002/ppp.1987
Rummel J.D., Beaty D.W., Jones M.A., Bakermans C., Barlow N.G., Boston P.J., Chevrier V.F., Clark B.C., de Vera J.-P.P., Gough R.V., Hallsworth J.E., Head J.W., Hipkin V.J., Kieft T.L., McEwen A.S., Mellon M.T., Mikucki J.A., Nicholson W.L., Omelon C.R., Peterson R., Roden E.E., Lollar B.S., Tanaka K.L., Viola D., Wray J.J. A new analysis of Mars “special regions”: findings of the second MEPAG Special Regions Science Analysis Group (SR-SAG2) // Astrobiology. 2014. V. 14. № 11. P. 887–968. https://doi.org/10.1089/ast.2014.1227
Soina V.S., Mulyukin A.L., Demkina E.V., Vorobyova E.A., El-Registan G.I. The structure of resting bacterial populations in soil and subsoil permafrost // Astrobiology. 2004. V. 4. № 3. P. 345–358. https://doi.org/10.1089/ast.2004.4.345
Soina V.S., Vorobyova E.A. Adaptation of bacteria to the terrestrial permafrost environment // Origins. Cellular origin, life in extreme habitats and astrobiology. Dordrecht: Springer, 2004. P. 427–444. https://doi.org/10.1007/1-4020-2522-X_26
Дополнительные материалы отсутствуют.


