Почвоведение, 2021, № 3, стр. 338-346
Динамика биоэлектрического потенциала в прикорневой зоне растений при поливах
Т. Э. Кулешова a, *, Н. Р. Галль a
a Физико-технический институт им. А.Ф. Иоффе
194021 Санкт-Петербург, ул. Политехническая, 26, Россия
* E-mail: www.piter.ru@bk.ru
Поступила в редакцию 24.04.2020
После доработки 15.06.2020
Принята к публикации 10.08.2020
Аннотация
Проведено сравнение двух способов измерения биоэлектрических потенциалов (БЭП) растений: основанного на инвазивной установке электродов и на неинвазивном способе обеспечения контакта. Показано, что введение игольчатых электродов в ткань растений приводит к снижению разности потенциалов с 70 мВ до уровня шума в течение ~30–45 мин и означает измерение потенциалов, генерируемых растительным организмом на основе стресса, вызванного травмой. Для долговременных измерений БЭП в прикорневой зоне, отражающих функциональное состояние растений и электрофизиологический сигнал растительного организма непосредственно в условиях нормальной жизнедеятельности, разработана эквивалентная схема измерений БЭП с учетом электрических свойств растений в ризосферной зоне и установка для автоматизированного получения электрофитограмм на основе предложенного метода обеспечения неинвазивного контакта корней растений с электродной системой за счет их прорастания. Измерены БЭП в условиях варьируемой влажности корнеобитаемой среды и организации распространения воды вдоль и против направления роста корней. При влажности почвенного субстрата на уровне 60–70% от полной влагоемкости биопотенциал в среднем постоянен и флуктуирует стохастически в интервале от 245 до 275 мВ. При высыхании грунта значения БЭП уменьшаются почти в два раза, он восстанавливается после полива, причем время задержки его восстановления увеличивается с ростом вододефицитного периода. Предложена модель, описывающая эффекты, протекающие в системе при вододефицитном режиме и при поливе.
ВВЕДЕНИЕ
Энергетической характеристикой взаимодействия и движения заряженных частиц в тканях исследуемой живой системы выступает биоэлектрический потенциал (БЭП). Измеряемый как разность потенциалов между двумя точками, биопотенциал отражает электрическую активность органа или организма в целом, вызванную характером протекания метаболических процессов.
История исследований БЭП живых организмов насчитывает более 200 лет, однако механизм электрогенеза до сих пор остается предметом дискуссий. Обычно считается, что причиной возникновения БЭП является ионный транспорт минеральных элементов за счет циркуляции воды по проводящим сосудам растения. Однако возможен и вклад трансмембранных потенциалов клеток и другие механизмы. Клетки растительной ткани избирательно проницаемы для таких ионов, как K+, Ca2+, Cl–, ${\text{NO}}_{{\text{3}}}^{--},$ ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{--},$ ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}$ и др., различия в их концентрации внутри и снаружи клеток являются причиной возникновения трансмембранного потенциала [7, 8, 13]. В данном случае разность потенциалов обусловлена эффектом Гиббса–Доннана – дополнительным увеличением осмотического давления за счет диффузии ионов неорганических солей через проницаемые для них мембраны, концентрационными эффектами и работой ионных насосов [20, 21]. Перемещение ионов в разбавленных водных растворах внеклеточных и внутриклеточных жидкостей растений приводит к возникновению электрического тока. При этом подвижность иона определяется в первую очередь его молекулярным размером в гидратированной форме, а электрическое сопротивление связано с плотностью ионного потока [21].
В жизнедеятельности растений одну из главных ролей играет корнеобитаемая среда: почва или почвозаменитель, обеспечивающие растения источниками питания и энергии, в том числе макро- и микроэлементами. Минеральное питание растительных организмов происходит за счет поглощения, связывания и транспорта ионов с помощью корневой системы из окружающей среды – ризосферы. Внешние условия: освещенность, минеральное питание, влажность, температура и др. – могут оказывать существенное влияние на величину БЭП в растениях и корнеобитаемой среде [3, 16]. Кроме того, известно, что в самой почве проявляются электрические поля, которые связываются с диффузионной электродвижущей силой (ЭДС), ЭДС суспензионного эффекта, граничными потенциалами Доннана, мембранными ЭДС и диффузионно-адсорбционными потенциалами в водонасыщенных средах [12].
Питательные вещества в основном адсорбированы на почвенных частицах. В связи с этим большое значение имеет процесс обменной адсорбции в системе почва–растение. Ионы минеральных солей могут поступать в клетки корневой системы растений из почвенного раствора, обладающего свойствами катионообменника, в результате контактного обмена с почвенными частицами ионов H+ на катионы и анионов ${\text{HCO}}_{{\text{3}}}^{--},$ OH– и органических кислот – на минеральные анионы [7]. Как следствие может возникать разность потенциалов вдоль корневой системы. Создаваемые в ризосферной зоне корневой системой градиенты БЭП, возникающие из-за различий в функционировании тканей и органов растений, в свою очередь, оказывают влияние на перемещение веществ, регуляции процессов жизнедеятельности клеток и растения в целом, электротоническую передачу раздражений, морфогенетические процессы и др. [6, 14]. Как правило, ткани с высоким уровнем обмена веществ имеют отрицательный потенциал по отношению к более инертным органам [3]. В большинстве случаев электрический потенциал почвы относительно растения отрицателен [11].
Возможны два различных способа измерения БЭП: 1 – внутриклеточный потенциал фиксируется путем помещения рабочего электрода внутрь клетки, а референтного электрода за ее пределами в раствор; 2 – БЭП (часто называемый “активным потенциалом”) большой группы клеток, то есть растительной ткани, определяется с помощью контакта электродов с разными точками растения, между которыми и проводится измерение [15, 17, 19, 21]. В настоящее время для измерения БЭП растений в основном используется инвазивная установка электродов, сопряженная с повреждением тканей, – обычно один игольчатый электрод устанавливается в основание растения, а другой в ткань листа [3, 18]. Такое электрофизиологическое измерение может приводить к существенному изменению БЭП, которые в этой ситуации отражают не физиологические, но стрессовые процессы в поврежденной ткани или организме в целом.
Наоборот, неинвазивная установка, основанная на мягком проводящем поверхностном контакте электрода и ткани пригодна для изучения именно физиологических процессов. При этом параметры сигнала отведения определяются [9] характеристиками электрогенных проявлений: параметрами потенциала покоя, возбуждения, метаболического потенциала, потенциала асимметрии и электрохимическими процессами, протекающими в живом организме. Размещение электродов в ризосферной зоне позволит получать информацию о деятельности электрогенных структур: адсорбционных, диффузионных и окислительно-восстановительных потенциалах в системе растение–корнеобитаемая среда.
Наиболее широкое использование в электрофизиологических неинвазивных исследованиях растений получил метод экстраклеточного отведения с использованием неполяризующихся электродов [1], контакт которых с растительной тканью осуществляется с помощью электропроводящего геля [2]. При измерениях такими электродами обычно используют метод отведения потенциала через солевые мостики. Однако при этом возможно влияние катионов и их концентрации на величину БЭП, возникновение в точке контакта между электродом и объектом электрохимического потенциала, подсыхание и засоление места контакта [10]. На величину измеряемого БЭП существенное влияние оказывает место расположения измеряемого электрода на объекте. Одним из наиболее значимых недостатков описанных методов является их неприменимость для проведения измерений в корнеобитаемой среде в реальном времени.
Цель работы – изучение влияния распространения воды на БЭП в системе корнеобитаемая среда–растение с помощью атравматичного безвредного метода регистрации.
ОБЪЕКТЫ И МЕТОДЫ
В качестве объекта исследования выбрали растения хлорофитума хохлатого (Chlorophytum comosum (Thunb.) Jacques). Преимуществом данного вида является быстрый рост и размножение вегетативным способом, то есть получение большого количества образцов с идентичным генетическим кодом и отсутствием различий в наследственных признаках. С морфологической точки зрения растения хлорофитума удобны тем, что имеют развитую корневую систему, потенциально способную обеспечить большую площадь контакта с электродами.
Растения выращивали при температуре 22–23°С в условиях естественного освещения с досветкой лампой накаливания, так что длительности облучения составляла ~12 ч. В качестве корнеобитаемой среды использовали универсальный готовый питательный грунт (почвенный субстрат) Terra Vita (Россия), содержащий не менее 150 мг/мл азота (NH4 + NO3), 270 мг/мл фосфора (P2O5), 300 мг/мл калия (K2O).
Для измерения электрических явлений, в частности величин БЭП тканей растений, необходимо обеспечить омический контакт измерительных электродов с тканями. Представлялось важным с методической точки зрения обеспечить режим измерения, который сам не влиял бы существенно на рост и функционирование растений. Кроме неинвазивности (отсутствия механических повреждений тканей) значимо было, чтобы отбираемый для измерений ток был минимален и не вызывал поляризации ткани. Это накладывало ограничения на входное сопротивление измерительных приборов, которое в наших экспериментах были не ниже 105 Ом.
Для исключения возможности искажения проводимых измерений наводками, возникающими в результате электромагнитного фона лаборатории, использовали два подхода. В первом тестовые измерения проводили внутри металлического экрана (“клетки Фарадея”) что должно было снизить роль электрической части наводки. Во втором – в нескольких местоположениях, различающихся по удаленности от возможных источников электромагнитных (ЭМ) помех, поскольку уровень ЭМ фона сильно меняется от точки к точке. Во всех случаях получили практически одинаковые результаты измерений, то есть роль наводок лежала на пределе чувствительности используемых измерительных приборов.
Исследование состояло из двух этапов. На первом провели серию измерений БЭП в листе хлорофитума относительно его корневой системы с использованием инвазивных контактов. Первоначально его измеряли пятиразрядным вольтметром В7-34А с входным сопротивлением 10 МОм. Однако из-за неудобства размещения габаритного оборудования в зоне роста растения вольтметр заменили на мультиметр, специально предназначенный для использования в лабораторных и полевых условиях, обладающий чувствительностью 100 мкВ. Получаемые значения БЭП образца совпадали на обоих приборах. Вольтметр Multimeter Digital DT 838 с внутренним сопротивлением 1 МOм был оснащен модифицированными игольчатыми электродами в виде тонкой трубки из твердой нержавеющей стали с диаметром 0.25 мм. Расстояние между электродами составляло 200 мм. Один электрод помещали в корневую шейку, второй – в лист растения.
На втором этапе, как альтернатива описанному выше традиционному решению, была разработана схема проведения эксперимента методом, не повреждающим растение. Это позволило изучать электрофизиологический сигнал растительного организма непосредственно в условиях нормальной жизнедеятельности. Использовали метод поверхностных неинвазивных измерений БЭП [4]. Токособирающими контактами служили две проводящих сетки из нержавеющей стали с размером ячейки 7 × 7 мм2, которые помещали на расстоянии 50 мм друг от друга в емкость для выращивания хлорофитума (рис. 1, А) объемом 500 мл, заполненную универсальным грунтом. Выращенное ранее растение перемещали в тестируемую емкость так, чтобы корни прошли через ячейки сетки. Сетки выводили наружу через боковую поверхность емкости для выращивания и подключали к измерительному прибору.
Рис. 1.
А – схема неинвазивного измерения биопотенциалов в системе корнеобитаемая среда–растение, Б – эквивалентная схема измерений биоэлектрических потенциалов. Обозначения: R1 – сопротивление почвенного субстрата, R2, R3 – сопротивление утечек между корнями и ризосферой, R4 – сопротивление корней, R5 – измерительное сопротивление регистрирующего прибора, Е1 – ЭДС в почвенном субстрате, Е2 – эквивалентная ЭДС участка корня, V – вольтметр (1 – растительный организм, 2 – электроды в виде сеток из коррозионностойкого материала, 3 – емкость для выращивания наполненная почвенным субстратом, 4 – измерительный прибор).
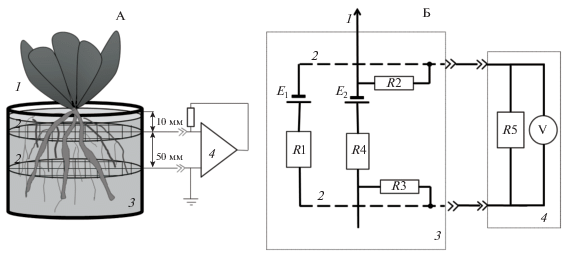
Для автоматизации эксперимента и on-line мониторинга БЭП растений использовали платформу для разработки электронных устройств Arduino Mega 2560, базирующуюся на микроконтроллере ATmega2560 и связанную с компьютером через USB-кабель. Входное сопротивление устройства составляло 100 кОм. Программный код (скетч), написанный на языке Arduino, позволял регистрировать и записывать разность потенциалов на электродных сетках нескольких тестируемых объектов раз в секунду или реже, в зависимости от задачи.
Использовали следующую эквивалентную схему измерений (рис. 1, Б): R1 – это сопротивление почвенного субстрата, шунтирующее измерительную цепь, сопротивления R2 и R3 определяются процессами, протекающими на границе между тканями растения и соприкасающейся с ними сеткой, R4 – это эквивалентное внутреннее сопротивление корней, обусловленное физиологическими особенностями растения, E1 – ЭДС, создаваемая в первую очередь за счет окислительно-восстановительных реакций в почвенном субстрате, Е2 – ЭДС в качестве которой выступает корневая система, сумма этих ЭДС дает измеряемый БЭП. Все величины не могут произвольно меняться в ходе эксперимента, так как являются характеристиками растения и его текущего физиологического состояния. Отчасти мы можем влиять только на величину R1, которая зависит от степени увлажненности почвенного субстрата. R5 – сопротивление прибора, который используется для измерения БЭП. Мы стремились к тому, чтобы сопротивление R5 было значительно большим, чем величины R2–R4. В экспериментах снижение величины R5 от 10 до 1 МOм никак не сказывалось на величине измеряемых потенциалов.
РЕЗУЛЬТАТЫ
В результате инвазивного измерения получено, что БЭП “материнского” растения хлорофитума, росшего в условиях естественного освещения, составил 70 мВ в момент введения электродов в ткани растения. Надземная часть растения была заряжена положительно относительно корня. После этого был зарегистрирован экспоненциальный спад сигнала до величин меньше чувствительности прибора в 100 мкВ в течение 30 мин.
Инвазивные измерения БЭП также проводили для группы “дочерних” растений хлорофитума: тестируемые образцы на 14 сут помещали в условия искусственного освещения с одинаковым спектральным составом, но различной длительностью светового периода: от нескольких светодефицитных режимов (3, 1 и 0.25 ч) до достаточного времени облучения (9 ч), при котором содержание фотосинтетических пигментов равно таковому для естественных условий выращивания [5]. Методика измерения БЭП была та же. Для всех исследуемых образцов аналогично результатам, полученным для “материнского” растения, наблюдали уменьшение значений биопотенциалов в течение ~30–45 мин. Начальная величина БЭП для “дочерних” хлорофитумов варьировала в пределах 15–25 мВ. Скорость и характеристики спада биопотенциалов растений, росших в условиях различной длительности освещения, сильно разнились. Была обнаружена некоторая зависимость увеличения времени спада БЭП от степени светодефицитности: для растений, развивающихся в условиях максимального дефицита света, скорость спада уменьшена в 2–3 раза по сравнению с растениями, которые находились в условиях достаточного освещения. Однако полученные кривые были существенно немонотонны, не совпадали для образцов, росших в одинаковых условиях, и были сложны для интерпретации.
Из полученных с помощью инвазивных измерений результатов можно сделать вывод, что спад БЭП с течением времени связан с нарушением структуры тканей хлорофитума во время введения электродов. Это приводит к изменению разности потенциалов между этим участком и другими частями растительного организма. В ответ на вносимое электродами механическое повреждение растение, для ограничения действия стрессора, включает работу защитных механизмов от возникновения некроза в области контакта ткани с электродом до синтеза регуляторных молекул и образования экранирующего слоя, отделяющий некротические участки от здоровых. Измеряемый потенциал характеризует реакцию на рану [22], получающиеся кривые сложны и не поддаются корректной интерпретации, так как сильно различаются для тестируемых объектов и являются следствием очень многофакторных процессов. Они слабо пригодны для оценки текущего физиологического состояния растения.
В связи с непригодностью метода, основанного на введении электродов в ткань живых растений, из-за сложности его применения для ризосферной зоны и регистрации параметров не функционального состояния растений, а скорее реакции на внешнее травматическое воздействие, предложили использовать неинвазивную установку электродов, основанную на поверхностном контакте с корневой системой.
Для изучения влияния водного режима на изменение БЭП растения был проведен эксперимент по длительному непрерывному измерению БЭП с течением времени в условиях варьируемой влажности почвенного субстрата. Имелась также возможность организации градиентного распространения воды по направлению роста корней и против (полив сверху и снизу). В емкость с электродными сетками сажали хлорофитум, корни которого были контролируемо пророщены сквозь сетки. Главным достоинством данной системы, являлось то, что корни растения физиологически касались поверхности электродных сеток, образуя с ними электрический контакт, не вызванный каким-либо нарушением анатомического или физиологического состояния корней.
При отсутствии растения стационарной разности потенциалов между сетками зафиксировано не было, иногда наблюдался сигнал, не превышающий 50 мВ и проявляющийся одиночными выбросами (пару раз в сутки). Это позволило исключить предположение о возникновение контактных потенциалов.
Сопротивление между электродами в рассматриваемой системе корнеобитаемая среда–растение при нормальных условиях роста и умеренной влажности на уровне ~60% от полной влагоемкости (ПВ) составило ~0.5 МОм. Отмечено, что после посадки растения, в ходе его адаптации к новым условиям и запуске механизма поглощения и транспорта ионов из корнеобитаемой среды наблюдается рост сопротивлении почвенного субстрата с 0.5 до 1.4 МОм в течение 3 сут, что, видимо, связано со снижением влажности до 40–50% от ПВ. При внесении в емкость 50 мл воды сопротивление уменьшалось до 0.3 МОм, а при насыщении субстрата добавлением 150 мл воды до ~80% от ПВ, его величина снижалась до 0.12 МОм.
После размещения растения в емкости для выращивания и обеспечения контакта его корневой системы с электродами наблюдался плавный рост БЭП. В условиях достаточной влажности прикорневой зоны БЭП через ~3 сут выходил на средний уровень порядка 260 мВ и менялся стохастически в интервале от 245 до 275 мВ; при высыхании грунта значения начинали уменьшаться. Первый полив в направлении от надземной части хлорофитума к корневой системе провели через 3 сут после начала эксперимента, последующие – через 12 и 15 сут от последнего внесения воды соответственно. Во всех случаях вариации условий засухоустойчивости наблюдалась качественно схожая динамика изменения БЭП: слабый спад потенциала в период выдержки растения без полива, затем его увеличение скачком после полива и затем выравнивание до нового стационарного состояния. На рис. 2 приведена зависимость разности потенциалов между сетками в корнеобитаемой среде–растении от времени, начиная с момента внесения в субстрат жидкости через 3 (кривая 1), 12 (кривая 2) и 15 сут (кривая 3) от предыдущего полива.
Рис. 2.
Изменение биоэлектрического потенциала с течением времени в момент увлажнения корнеобитаемой среды от корневой шейки к кончикам корней хлорофитума через 1 – 3 сут, 2 – 12 сут, 3 – 15 сут с предыдущего полива.

Важными характеристиками динамики БЭП являются: а) время задержки скачка после полива, б) время нарастания БЭП до максимума, в) величина скачка БЭП и г) время выхода на стационарное состояние. На наш взгляд, все они характеризуют значимые процессы, протекающие в прикорневой зоне.
Время задержки изменения потенциала после полива, увеличивается с ростом периода без увлажнения почвенного субстрата. Причем при длительности выдержки растения без воды в 3 сут и незначительном снижение влажности почвенного субстрата до ~45% от ПВ эта задержка составила меньше 3 мин, а при 15-суточной выдержке без полива и высыхании корнеобитаемой среды до уровня 10–12% от ПВ – порядка часа. Таким образом, диапазон изменения параметра составил более 20 раз. На наш взгляд, это время характеризует сумму двух эффектов: диффузионное распространение воды в прикорневой зоне, и адаптивные свойства корней, переходящих из режима вододефицита в избыточное водопоглощение.
Наоборот, время нарастания БЭП до максимума для всех экспериментальных условий оказывается близким. Видимо, оно связано с совокупностью процессов, включающих как физиологический ответ растения на увлажненность, так и чисто физический процесс шунтирования БЭП увлажненным почвенным субстратом с повышенной проводимостью.
Сама величина скачка БЭП тоже сильно зависит от времени выдержки растения в условиях вододефицита. Короткий период выдержки приводит к малой величине скачка не более 10% от начального уровня, тогда как долгие выдержки создают скачок, составляющий 25–30% от величины новой физиологической нормы, достигаемой после полива.
Время выхода БЭП на новый стабильный уровень, то есть компенсационный эффект и адаптация растения тоже зависит от того, сколько времени растение выдерживалось без полива. Если растение поливалось часто, то это время мало и составляет порядка 2.5 мин, при длительных интервалах между поливами оно может достигать 40–50 мин. В сводной табл. 1 охарактеризовано время изменений БЭП и величины изменения самих БЭП, зависящие от распространения воды в системе корнеобитаемая среда–растения и связанных с этим физиологических реакциях при организации полива через разные промежутки.
Таблица 1.
Время изменения биоэлектрического потенциала в зависимости от периода, проведенного без полива, при распространении воды от поверхности почвенного субстрата к корневой системе
| Параметр | Вариант 1 | Вариант 2 | Вариант 3 |
|---|---|---|---|
| Время без полива, дни | 3 | 12 | 15 |
| Время задержки изменения БЭП после полива, с | 200 | 1170 | 3800 |
| Время нарастания БЭП от стабильного до максимального значения, с | 250 | 300 | 200 |
| Время достижения нового стабильного уровня БЭП после максимума, с | 150 | 2830 | 2400 |
| Разность величин БЭП до и после полива, мВ | 1–2 | 20 | 120 |
| Величина скачка БЭП, наблюдаемая после полива над новым физиологическим уровнем, мВ | 5 | 15 | 30 |
Видно, что величина и особенно динамика изменений БЭП прикорневой зоны зависит от меры засушливости корнеобитаемой среды, то есть от степени вододефицитного стресса. При нормальных благоприятных условиях, когда растению хватает воды, биопотенциал – стабилен. При нехватке воды потенциал начинает медленно уменьшаться, после полива происходит скачок потенциала, дальнейшее его увеличение и стабилизация.
Аналогично были проведены измерения при подаче и поступлении воды снизу – от конца корневой системы к основанию растения. Сделаны три серии измерений с разным интервалом дней после подачи воды снизу: через 3, 12 и 15 сут от предыдущего увлажнения. При организации такого водообеспечения растений не наблюдается скачок потенциала, а происходит его плавное перераспределение и стабилизация за времена порядка десятков мин. Абсолютные величины изменения БЭП практически те же, что и в предыдущих опытах.
ОБСУЖДЕНИЕ
Полученные результаты могут интерпретироваться с учетом как физиологических процессов в организме растения и окружающей корнеобитаемой среде, так и чисто физических эффектов, сопутствующих электрическим измерениям. Можно предложить следующую модель, последовательно описывающую протекающие в системе эффекты при поливе: сначала происходит увлажнение почвенного субстрата, но в растение еще не начала поступать вода, и его физиологическое состояние соответствует тому, что имело место до начала полива. Длительность этого процесса определяется свойствами почвы и зависит от степени ее высыхания. Затем растение начинает активно всасывать воду из корнеобитаемой среды. С электрической точки зрения это можно трактовать как увеличение величины эквивалентной ЭДС за счет увеличения транспорта ионов в корнях после полива. При этом увлажненная почва с более низким сопротивлением начинает шунтировать имеющиеся БЭП. Однако рост ЭДС компенсирует эти утечки, более того, резко включающийся механизм всасывания ионов ведет к перекомпенсации, проявляющийся как максимум на временных зависимостях БЭП. Тот факт, что время выхода на максимум не зависит от длительности выдержки растения без полива, показывает, что, скорей всего, изменение БЭП в этом временном диапазоне (200–300 с) соответствует физиологическому, и притом локальному процессу, относящемуся в большей степени к корневой системе, на который степень вододефицитного стресса, видимо, не влияет. Наконец, на третьей стадии растение находится в фазе адаптации к новым условиям увлажненности. При этом время выхода на стабильный уровень БЭП зависит от того, насколько организм растения был обезвожен в результате длительного перерыва в поливе.
Можно рассмотреть и еще один возможный механизм возникновения скачка БЭП. Полив приводит к уменьшению внутреннего сопротивления корней растения из-за протекания воды в корнях и стебле. Корни растения состоят из проводящих каналов, через которые идет всасывание воды. Логично предположить, что сопротивление внешнего покрова корня выше в его верхней части, примыкающей к стеблю по сравнению с нижней частью.
Когда происходит полив сверху, то поступление воды в корень идет в первую очередь через поры вблизи корневой шейки и дальше поступательно вниз по всей длине корневой системы по мере увлажнения субстрата вглубь (рис. 3, А). Если рассматривать корень как проводник с постоянным удельным сопротивлением ρ и одинаковой площадью сечения S по всей длине L, то разность между значениями потенциала в начале и в конце участка цепи пропорциональна длине корня:
(1)
${{\varphi }_{1}}--{{\varphi }_{2}} = IR = {{I\rho L} \mathord{\left/ {\vphantom {{I\rho L} S}} \right. \kern-0em} S}\sim L,$(2)
$\Delta {{\varphi }_{1}}\sim {{L}_{1}} < \Delta {{\varphi }_{2}}\sim {{L}_{2}} \ldots < \Delta {{\varphi }_{n}}_{{}}\sim {{L}_{n}}.$Рис. 3.
Поступление воды в корень длиной L через поры и связанное с этим изменение биопотенциалов Δφ (А): при поливе сверху Δφ1 < Δφ2 … < Δφn, при поливе снизу Δφ ~ const (Б), строение окаймленной поры [6] и градиент давления во время массового потока воды (В), и его блокирования (Г: 1 – окаймление, 2 – полость поры, 3 – торус, 4 – замыкающая пленка поры).
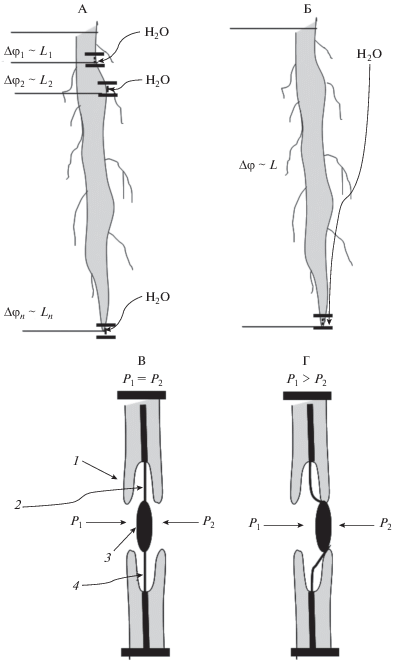
В случае подачи воды снизу, она по почвенным капиллярам поступает к корневой системе растений сперва через самые нижние поры в районе корневого чехлика и далее распространяется вверх к надземной части растения (рис. 3, Б). При этом разность потенциалов пропорциональна сразу всей длине проводника от основания до конца корней и постоянна:
Финальный уровень БЭП и, видимо, физиологическое состояние растения одинаковы при обоих видах полива.
Время задержки изменения БЭП, описанное в табл. 1 связано со строением поры и градиентом давления – основной движущей силой водного потока от почвы через растение. Так как поровая мембрана эластична, окаймленные поры функционируют как клапаны – при определенном давлении торус смещается к одной или другой стороне окаймления, закрывая поровое отверстие. В случае, когда давление воды со стороны клетки P1 равно давлению P2 со стороны почвы пора открыта, осуществляется транспорт воды за счет корневого давления и транспирации (рис. 3, В). При малом водном потоке со стороны почвы (засухе) на торус действует большее давление P1 со стороны клетки и пора закрывается (рис. 3, Г). Таким образом, чем суше почва, тем менее интенсивен поток влаги к корню, который определяется перепадом давлений влаги в прикорневой зоне и, что важно, влагопроводностью корнеобитаемой среды, на порядки снижающейся при уменьшении влажности, и тем больше времени нужно на открытие пор.
ЗАКЛЮЧЕНИЕ
Разработанный метод неинвазивного мониторинга биопотенциалов корней растений в отличие от инвазивных методов позволил воспроизводимо наблюдать вариации БЭП в ответ на циклы увлажнения. Новый способ обеспечения контакта растение–электрод с помощью прорастания корней через электродные сетки является простым и относительно легко реализуемым. Он не вызывает физиологического ответа на рану по сравнению с инвазивным методом, и не вносит значительных изменений в жизнедеятельность растения, за счет того, что корни самопроизвольно прорастают сквозь металлические контактные сетки.
Измерение БЭП в прикорневой зоне позволяет изучать взаимодействия растения с корнеобитаемой средой. БЭП ризосферы отражает характер протекания в реальном времени метаболических процессов, связанных с водным режимом, транспортом ионов и минеральных веществ в корнеобитаемой среде. Представленные результаты показали, что изменение биопотенциалов растений с течением времени, представленное в виде графиков-электрофитограмм, является объективным показателем состояний растительных организмов, и могут использоваться как система фитомониторинга, то есть отслеживания состояний растительных организмов, и как параметр для выбора путей стимуляции их развития.
Список литературы
Бурлакова Е.В., Вепринцев Б.Н., Кольс О.Р., Кригер Ю.А. Практикум по общей биофизике. Вып. ІІІ–ІV: Исследования биоэлектрических явлений в тканях и клетках. М.: Высшая школа, 1961. 262 с.
Воденеев В.А., Шерстнева О.Н., Сурова Л.М., Сёмина М.М., Катичева Л.А., Сухов В.С. Изменение параметров индуцированных электрическими сигналами ответов фотосинтеза при увеличении возраста проростков пшеницы // Физиология растений. 2016. Т. 63. № 6. С. 873–880.
Коловский Р.А. Биоэлектрические потенциалы древесных растений. Новосибирск: Наука, 1980. 176 с.
Кулешова Т.Э., Бушлякова А.В., Галль Н.Р. Неинвазивное измерение биоэлектрических потенциалов растений // Письма в ЖТФ. 2019. Т. 45. Вып. 5. С. 6–8.
Кулешова Т.Э., Лихачев А.И., Павлова Е.С., Кулешов Д.О., Нащекин А.В., Галль Н.Р. Взаимосвязь спектров поглощения пигментов растений и светодиодного освещения с различным спектральным составом // Журн. технической физики. 2018. Т. 88. № 9. С. 1285–1289.
Кутимская М.А., Бузунова М.Ю., Убрятова Л.В. Биоэлектрогенез и информационный обмен у высших растений, включая зерновые культуры // Вестник ИрГСХА. 2014. № 60. С. 105–110.
Медведев С.С. Физиология растений: учебник. СПб.: БХВ-Петербург, 2012. 512 с.
Опритов В.А. Электричество в жизни животных и растений // Соросовский образовательный журн. 1996. № 9. С. 40–46.
Орлов Ю.Н., Суглобова О.Н. Исследование характеристик биоэлектрических электродов. М.: МГТУ им. Н.Э. Баумана, 2008. 44 с.
Пасичный А.П., Карманов В.Г. Измерение биоэлектрического потенциала листьев высших растений бесконтактным способом // Вопросы экспериментальной биофизики и кибернетики растений. Тр. АФИ. 1969. № 24. С. 161–168.
Поздняков А.И. Биоэлектрические потенциалы в системе почва–растение // Почвоведение. 2013. № 7. С. 813–821.
Поздняков А.И., Позднякова Л.А., Позднякова А.Д. Стационарные электрические поля в почвах. М.: КМК Scientific Press Ltd., 1996. 358 с.
Пятыгин С.С. Распространяющиеся электрические сигналы в растениях // Цитология. 2008. Т. 50. № 2. С. 154–159.
Brenner E.D., Stahlberg R., Mancuso S., Vivanco J., Baluška F., Van Volkenburgh E. Plant neurobiology: an integrated view of plant signaling // Trends in plant science. 2006. V. 11. № 8. P. 413–419. https://doi.org/10.1016/j.tplants.2006.06.009
Fromm J., Lautner S. Electrical signals and their physiological significance in plants // Plant, Cell Environ. 2007. V. 30. № 3. P. 249–257. https://doi.org/10.1111/j.1365-3040.2006.01614.x
Hasegawa Y., Hoshino R., Uchida H. Development of cultivation environment control system using plant bioelectric potential // Proceedings of NOLTA. 2015. P. 860–863.
Karlsson L. Instrumentation for measuring bioelectrical signals in plants // Rev. Sci. Instrum. 1972. V. 43. № 3. P. 458–464. https://doi.org/10.1063/1.1685661
Murohashi F., Uchida H., Hasegawa Y. Evaluation of photosynthetic activity by bioelectric potential for optimizing wavelength ratio of plant cultivation light // Int. J. Biosensors Bioelectronics. 2018. V. 4. № 6. P. 281–287. https://doi.org/10.15406/ijbsbe.2018.04.00141
Ochiai T., Tago S., Hayashi M., Fujishima A. Highly sensitive measurement of bioelectric potentials by boron–doped diamond electrodes for plant monitoring // ECS Transactions. 2016. V. 75. № 16. P. 233–242. https://doi.org/10.1149/07516.0233ecst
Parkinson K.J. Bioelectric potentials in plants: dissertation. Durham University, 1963. 371 p.
Tattar T.A., Blanchard R.O. Electrophysiological research in plant pathology // Ann. Rev. Phytopathol. 1976. V. 14. № 1. P. 309–325.
Tyler S.E.B. Nature’s electric potential: A systematic review of the role of bioelectricity in wound healing and regenerative processes in animals, humans, and plants // Frontiers in Physiology. 2017. V. 8. P. 627. https://doi.org/10.3389/fphys.2017.00627
Дополнительные материалы отсутствуют.


