Почвоведение, 2021, № 3, стр. 304-319
Наночастицы серебра в почве: поступление, трансформация, токсичность (обзор)
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт биохимии РАН им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Ленинский пр., 33, Россия
* E-mail: knat@darvodgeo.ru
Поступила в редакцию 05.05.2020
После доработки 15.06.2020
Принята к публикации 12.07.2020
Аннотация
Обзор посвящен представлению и анализу количественных данных по поступлению и содержанию наночастиц серебра (AgНЧ) в почве, их возможной трансформации и токсичности. Показано, что опубликованные значения содержания AgНЧ в почве основаны исключительно на результатах моделирования и варьируют в широком диапазоне от 5.33×10–6 до 7.4 мкг/кг при скорости поступления AgНЧ от 1.2 × 10–3 до 9.68 мкг/кг в год. Описаны основные превращения AgНЧ в почве (взаимодействие с твердой фазой, почвенными коллоидами, растворенным органическим веществом и окислительно-восстановительные процессы), приводящие к преимущественному закреплению AgНЧ в верхнем слое почвы. Сопоставление данных о содержании AgНЧ в почве и условий проведения токсикологических экспериментов показало, что в большинстве случаев токсичность исследована при содержании AgНЧ 102–105 мкг/кг почвы, что превышает оценочные значения этого показателя в реальных условиях в 10 и более раз. На основании анализа существующих представлений о транслокации AgНЧ из почвы в растения сделан вывод об отсутствии риска загрязнения сельскохозяйственной продукции AgНЧ в настоящее время. Приведены данные о возрастании регистрируемых негативных эффектов AgНЧ на микроорганизмы при увеличении времени экспонирования. Сделан вывод о необходимости исследований, направленных на оценку последствий поступления AgНЧ в почву в условиях долгосрочных экспериментов продолжительностью более 90 сут при содержании AgНЧ, не превышающем 10 мкг/кг.
ВВЕДЕНИЕ
Серебро в коллоидном состоянии, или наночастицы серебра (AgНЧ), широко применяются в повседневной жизни, относясь, наряду с наночастицами (НЧ) оксида титана TiO2, к наиболее широко используемым в промышленности [30]. По различным источникам, количество коммерчески доступных продуктов на основе AgНЧ на сегодняшний день составляет от 244 [115] до 937 [79]. Более 15 производимых продуктов предназначены для применения в сельском хозяйстве [79], около 10 – в растениеводстве (табл. 1). Большая их часть позиционируется в качестве дезинфектантов растений широкого спектра действия, обладающих бактерицидной, фунгицидной и вирицидной активностью; единственный зарегистрированный в РФ препарат Зеребра Агро относится к регуляторам роста растений. Его продажи на 2018 г. составили 261 тыс. л., прогноз на 2019 г. – 370 тыс. л. [8], что эквивалентно 131–185 кг AgНЧ (здесь и далее содержание AgНЧ указано по серебру). В 2017 г. препаратом было обработано 3 млн га [2] в 50 регионах РФ [7]. Всего в нашей стране по системе добровольной сертификации продукции наноиндустрии “Наносертифика” зарегистрировано около 10 продуктов, содержащих AgНЧ [1].
Таблица 1.
Агрохимикаты, содержащие AgНЧ
| НЧ | Препарат | Регистрант | Форма*, д. в., % |
|---|---|---|---|
| Ag | SomGuard silcop | AgriLife | П, 99 |
| Ag | Nanosept® Aqua | Nanosept | Нет данных |
| Ag | Nanosept® | Nanosept | П, 99 |
| Ag | Nano-Silver | Kanak Biotech | П, 99 |
| Ag | Agro 2400 | SilverTech | ККР, 0.24 |
| Ag | Nanoxy | SilverTech | ККР, 3 |
| Ag | Silperox | SilverTech | ККР |
| Ag | Nano Silver | LandGreen | ККР, 0.8 |
| Ag | Зеребра Агро | “Резерв”, “Нанобиотех” | ККР, 0.05 |
| Ag + Cu | Agro 2475 | SilverTech | ККР, 0.24 + 0.75 |
| Ag + Cu + хитозан | Agro 2490 | SilverTech | ККР, 0.24 + 0.75 + 0.15 |
По оценкам, только в европейских странах при существующем производстве AgНЧ 5.5 т/год [103] ожидается рост их содержания в почвах со скоростью от 1.2 нг/кг до 4 мкг/кг (табл. 2). В США производство AgНЧ оценивается как 2.8–20 т/год [40], что будет сопровождаться увеличением их содержания в почве каждый год на от 6.6 нг/кг до 2.3 мкг/кг.
Таблица 2.
Расчетное содержание AgНЧ в почвах различных регионов
| Регион | Содержание | Ежегодное поступление | Источник |
|---|---|---|---|
| Европа (Дания) | 6–530 нг/кг | Нет данных | [39] |
| Европа (Швейцария) | 0.02–0.1 мкг/кг | Нет данных | [76] |
| Европа (Швейцария) | Нет данных | 8.7–41.2 нг/кг | [40] |
| Европа | 1.5 мкг/кг | Нет данных | [92] |
| Европа | Нет данных | 174–4091 нг/кг | [40] |
| Европа | Нет данных | 1.2–110 нг/кг | [103] |
| США | 7.4 мкг/кг | 6.6–2380 нг/кг | [40] |
| США | 0.1–0.7 мкг/кг | Нет данных | [41] |
| Африка (ЮАР) | 5.33 × 10–6–1.93 × 10–3 мкг/кг | 2.24–120.79 кг | [77] |
| Австралия | 9.8 × 10–5–2.3 × 10–2 мкг/кг* | 24.2–48 кг* | [102] |
| Весь мир | Нет данных | 2.14–9.68 мкг/кг | [73] |
* Рассчитано автором на основе данных, представленных в дополнительных материалах к [103].
Согласно недавно проведенным исследованиям, самая высокая прогнозируемая концентрация, ниже которой не ожидается никаких негативных эффектов, для AgНЧ составляет 0.05 мг/кг почвы [92]. При самых неблагоприятных прогнозах эта концентрация в почвах европейских стран может быть достигнута в течение ближайших 50 лет. Общее поступление AgНЧ в почвы в мировом масштабе варьирует в диапазоне 15–77 т/год (рассчитано автором на основании данных, представленных в дополнительных материалах к [54]), а производство AgНЧ к 2025 г. может составить 400–800 т [85].
Наряду с поступлением инженерных AgНЧ, они могут образовываться в окружающей среде из ионов серебра Ag+. До недавнего времени полагали, что этот процесс происходит преимущественно в природных водах путем восстановления Ag+ под действием солнечного света в присутствии растворенного органического вещества [68]. Однако последние исследования показали протекание аналогичных процессов в полной темноте [33, 112], что позволяет предположить образование AgНЧ в почвах.
Данные о скорости поступления и аккумуляции AgНЧ в почве привели к интенсификации изучения их поведения в природных средах, токсичности и оценке рисков применения. Этим вопросам в нашей и иностранной научной литературе посвящено большое количество работ [3, 12, 19, 21, 47, 57, 60, 62, 73, 81, 85, 94, 101]. Основные процессы, происходящие с серебром и содержащими его НЧ в почве, хорошо описаны [21, 58, 67, 83, 89]; природа токсичности AgНЧ также широко обсуждается [26, 29, 70, 87, 105, 108]. В большинстве случаев, однако, проводимые исследования AgНЧ не учитывают их возможные реальные концентрации в почве, что делает невозможным использование полученных результатов при прогнозировании рисков, связанных с широким применением AgНЧ.
Цель обзора – представить современную информацию о существующих количественных данных по поступлению и содержанию AgНЧ в почве, их возможной трансформации и токсичности, а также выделить современные наиболее актуальные направления исследований в этой области.
AgНЧ В ПОЧВЕ: ИСТОЧНИКИ ПОСТУПЛЕНИЯ, КОЛИЧЕСТВЕННАЯ ОЦЕНКА, ТРАНСФОРМАЦИЯ И ТОКСИЧНОСТЬ
Поступление AgНЧ в почвы. AgНЧ применяют во многих технологиях, а сами наночастицы входят в широкий спектр потребительских товаров, использующих оптические, проводящие и антибактериальны свойства серебра:
– в качестве биоцидов AgНЧ содержатся в одежде, обуви, красках, перевязочных материалах, бытовых приборах, косметике, пластмассах и т. д. [81];
– как соединения с исключительными проводящими свойствами AgНЧ входят в состав проводящих чернил и композитов для повышения тепловой или электрической проводимости этих материалов [110];
– диагностические применения: AgНЧ используют в биосенсорах и биоимиджинге [100];
– оптические свойства AgНЧ востребованы в областях, требующих эффективного сбора света, включая металл-усиленную флуоресценцию [67] и поверхностно-усиленное рамановское рассеяние [111].
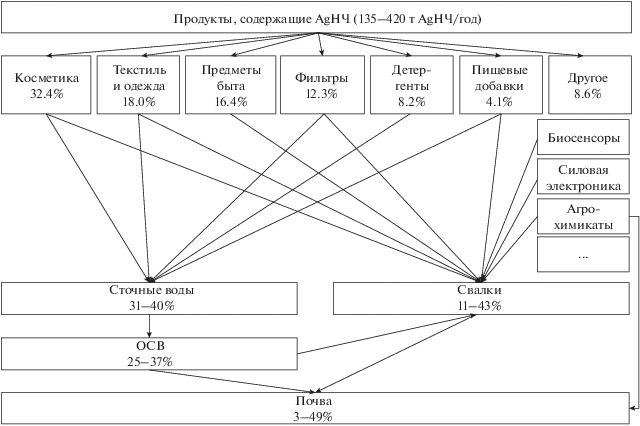
Уникальность свойств AgНЧ привела к их интенсивному использованию в повседневных товарах, а также во многих коммерческих и промышленных секторах (рис. 1) при общем производстве 135–420 т/год [85]. Распределение синтезируемых AgНЧ по производимым продуктам [12] свидетельствует, что наиболее интенсивно в настоящее время они применяются в косметических товарах, в то время как их потребление в сельском хозяйстве, непосредственно приводящем к поступлению к AgНЧ в почву, не превышает 8.6%. Тем не менее, согласно существующим оценкам, именно почва является основой средой, куда в конечном итоге поступают AgНЧ [40]. 15% биоцидов на основе AgНЧ, входящих в состав медицинских принадлежностей, моющих средств, полотенец и увлажнителей воздуха, аккумулируется в почве [15]. Суммарное количество AgНЧ, накапливающихся в почве, изменяется от 3 [102] до 35–49% от общего количества произведенных [39, 40]. Это связано с тем, что значительное количество AgНЧ из товаров поступает либо в сточные воды, либо на свалки. Согласно неофициальным оценкам, 70% произведенной косметики оказывается на свалках в неиспользованном виде [10], а около 90% НЧ из косметики попадает в сточные воды [54]. AgНЧ из одежды и обуви, содержащей от 0.003 до 1400 мг/кг [20], за первые 3 стирки вымываются на 69–86% [16]. 90–95% НЧ, используемых в научных исследованиях, системах фильтрации, медицинских препаратах, также оказываются в сточных водах [54]. В среднем в сточные воды попадает от 31 [103] до 40% [102] использованных AgНЧ (расчеты проведены автором на основании представленных в публикациях данных), а общая концентрация серебра в сточных водах может достигать 0.05−0.2 мкг/л [54]. На свалки попадает от 11 [103] до 43% [102] использованных AgНЧ (расчеты проведены автором на основании представленных в публикациях данных). Суммарно в почвы и на свалки попадает 60–76% синтезируемых AgНЧ [54].
Среди тяжелых металлов серебро занимает второе место (после меди) по содержанию в бытовом мусоре и хозяйственно-бытовых сточных водах [5], а осадки сточных вод (ОСВ) являются основным аккумулятором AgНЧ (до 95%) из сточных вод [92, 102]. Так как бытовые и промышленные отходы могут попадать в почву в результате внесения в почву ОСВ в качестве удобрений [23], то последние в настоящее время обычно признают основным источником AgНЧ в почве [92]: в мире в качестве удобрений используется от 5 в РФ [9] до 100% в Африке к югу от Сахары производимых ОСВ [54].
По существующим оценкам, содержание AgНЧ в ОСВ в Европе варьируется в диапазоне 1.31–4.44 мг/кг, а в США 1.29–5.86 мг/кг [40], достигая в исключительных случаях величин 850 мг/кг [52]. В РФ отсутствуют нормативы на содержание AgНЧ или общего серебра в почвах [6] или ОСВ, используемых как удобрение [4], поэтому данные по нашей стране немногочисленны. По некоторым источникам, общее содержание серебра в ОСВ г. Москвы и близлежащих районов лежит в диапазоне 4–86 мг/кг. [9]. Так как обычно в форме AgНЧ содержится не более 2% общего количества серебра вследствие перехода НЧ в форму Ag2S [102], то можно говорить о расчетном содержании AgНЧ не выше 0.08–1.72 мг/кг ОСВ, что сопоставимо с содержанием AgНЧ в ОСВ Европы и США.
При концентрации AgНЧ в препаратах, предназначенных для применения в растениеводстве, 0.5 г/л и рекомендуемых дозах внесения 100–150 мл/га (для озимой пшеницы) и двукратной обработке это означает, что максимально в почву может попадать около 100–150 мг AgНЧ/га в год. При мощности пахотного горизонта 20 см и плотности почвы 1.2 г/см3 максимальное возрастание содержания AgНЧ в пахотном слое составит 0.004–0.006 мкг/кг в год. Прибавив сюда возрастание содержания AgНЧ в почве вследствие предпосевной обработки семян (200 мл/т, норма высева 160–250 кг/га), суммарный диапазон составит 0.005–0.007 мкг AgНЧ/кг в год. Для пропашных культур (на примере картофеля) диапазон, рассчитанный аналогичным образом на основании рекомендуемых способов обработки, составит не более 0.008–0.019 мкг AgНЧ/кг в год. В случае использования ОСВ в рекомендуемых дозах внесения 5–15 т/га [9] ожидаемое увеличение содержания AgНЧ (без учета возможных превращений AgНЧ) в пахотном слое составит 0.36–1.075 мкг/кг в год, то есть будет на 1–2 порядка больше, чем в случае использования AgНЧ как средства защиты растений. Приведенные оценки показывают, что в РФ, как и других странах, рост содержания AgНЧ в почвах можно ожидать преимущественно вследствие использования ОСВ в качестве удобрений. Это свидетельствует о необходимости разработки новых требований к свойствам ОСВ при использовании их в качестве удобрений, учитывающим, по крайней мере, общее содержание серебра. Важность разработки требований обусловлена тем, что расчетный среднегодовой объем выхода ОСВ оценивается в 2.5 млн т/год и около 5–7% от этого количества (125–175 тыс. т) используется как удобрение [9].
Реальные концентрации AgНЧ в почве оцениваются в широком диапазоне и составляют до 1.5 мкг/кг в Европе и до 7.4 мкг/кг в США (табл. 2). Минимальное содержание, не превышающее 1.93 × 10–3 мкг/кг, указывают для ЮАР. В качестве концентраций, соответствующих реальному содержанию AgНЧ в почве, в настоящее время рекомендовано использовать от 0.02–0.10 мкг/кг [76] до 0.01–1 мг/кг [42, 113].
В заключение обсуждения существующих количественных оценок поступления AgНЧ в окружающую среду необходимо отметить, что несмотря на близкие значения прогнозируемых диапазонов количества AgНЧ, поступающих в сточные воды и на свалки, оценки доли AgНЧ, оказывающихся в почве, могут различаться на порядок (рис. 1). Прежде всего, это связано с отсутствием аналитических методов определения наноматериалов в почве и необходимостью использовать для этих целей исключительно данные моделирования [88, 102]. Одним из наиболее перспективных аналитических методов является масс-спектрометрия с индуктивно-связанной плазмой одиночных частиц (single particle inductively coupled plasma mass spectrometry, spICP-MS), позволяющая обнаруживать и количественно определять НЧ [71]. Однако этот метод еще не получил широкого распространения. Оценка смоделированных концентраций в почве, в свою очередь, также является достаточно проблематичной, так как различные модели не обязательно учитывают одни и те же источники AgНЧ, пути их поступления в окружающую среду или время, за которое происходит этот процесс [41]. Кроме того, важной проблемой является учет возможной трансформации AgНЧ в процессе получения ОСВ, таких как разрушение AgНЧ с высвобождением ионов серебра, их сульфидирование и т. п. Немногочисленные модели, в которых была проведена попытка учесть этот процесс, показывают, что доля AgНЧ в почве от общего количества использованных НЧ может уменьшиться с 24 до 3%, а доля AgНЧ, переходящих из ОСВ в почвы, с 30 до 0.8% [102] (расчеты проведены автором на основании представленных в публикации данных). Наконец, в настоящее время нами не обнаружено моделей, учитывающих обратный процесс – образование AgНЧ из ионного серебра. Это указывает на необходимость проведения исследований, направленных на количественную оценку процессов образования и трансформации AgНЧ в окружающей среде.
Процессы, происходящие с AgНЧ в почве. При поступлении в почву AgНЧ могут претерпевать различные процессы трансформации (рис. 2), приводящие как к закреплению серебра в почве, так и к уменьшению его содержания в почве вследствие транслокации в растения или вымывания из почвы. Преобладающее направление трансформации зависит от свойств AgНЧ (размера, заряда стабилизирующего агента) и особенностей почвы (гранулометрического состава, рН, содержания и свойств органического вещества и др.), но, согласно существующим представлениям, в почве не обнаруживаются нетрансформированные AgНЧ [24]. Основные возможные превращения AgНЧ в окружающей среде подробно описаны в ряде обзоров [21, 61, 70, 83, 86, 88, 95, 112]; их краткое описание приведено далее.
Взаимодействие с растворенным органическим веществом. Растворенное органическое вещество (РОВ) представляет собой сложную смесь органических соединений, обладающих разнообразными функциональными группами. Поэтому процесс взаимодействия РОВ с AgНЧ – комбинация электростатического, ван-дер-Ваальсова и гидрофобного взаимодействий между поверхностями РОВ и AgНЧ [21]. При адсорбции РОВ на поверхности AgНЧ может происходить увеличение их стабильности вследствие роста сил электростатического отталкивания между частицами или возрастания гидрофобности поверхности [28]. В ряде работ была продемонстрирована способность гуминовых веществ повышать стабильность AgНЧ [49, 66], однако взаимодействию AgНЧ с почвенным РОВ посвящены единичные работы [58]. Установлено, что AgНЧ преимущественно взаимодействуют с короткоцепочечными алифатическими соединениями РОВ. В результате взаимодействия происходит уменьшение абсолютной величины электрокинетического потенциала AgНЧ и, как следствие, снижение их стабильности. Повышение стабильности AgНЧ в присутствии РОВ было отмечено только при их высокой концентрации (10 мг/л, что при использовании авторами вытяжки 1 : 2.5 для получения почвенного раствора приблизительно соответствует содержанию AgНЧ 250 мг/кг). Следует отметить, однако, что в работе [58] были исследованы только цитрат-стабилизированные AgНЧ и AgНЧ без стабилизирующего агента, а в качестве РОВ – водная вытяжка из пойменной почвы с высоким содержанием кальция, но без железа и алюминия. Это свидетельствует об актуальности исследований, связанных с оценкой взаимодействия РОВ почв различных почвенно-географических зон с AgНЧ, стабилизированными наиболее часто используемыми для этой цели соединениями (поливинилпирролидоном, полиэтиленгликолем, сульфированным нафталиновым конденсатом, додецилбензолсульфоновой кислотой, олеатом натрия [19]).
Взаимодействие с почвенными неорганическими коллоидами. Процессы гомоагрегации AgНЧ в почвах считаются маловероятными [24, 25, 61]; ведущим процессом их коагуляции считается гетероагреция, являющаяся следствием взаимодействия с неорганическими коллоидами (глинистыми минералами, оксидами и гидроксидами). Наиболее интенсивно гетероагреция протекает при высокой ионной силе почвенного раствора, частично компенсирующей отрицательный заряд AgНЧ, хотя этот процесс возможен и при низкой ионной силе [24, 25]. Важным фактором, контролирующим гетероагрегацию AgНЧ, является рН: чем ближе его значение к точке нулевого заряда AgНЧ, тем более интенсивное их взаимодействие с неорганическими коллоидами следует ожидать.
В случае коллоидных частиц, несущих положительный заряд, наблюдается их быстрое взаимодействие с AgНЧ, приводящее к увеличению размера частиц и уменьшению критической концентрации коагуляции (ККК) [25, 116]. По оценкам [25] при концентрации AgНЧ 4.2 мг/л в присутствии магемита начальная скорость увеличения гидродинамического диаметра НЧ была 2.95 нм/с, а ККК снизилась с 22 мМ (ККК гомоагрегации AgНЧ) до <1 мМ. В случае коллоидов, несущих постоянный отрицательный заряд (каолинит, монтмориллонит), отрицательно заряженные AgНЧ могут взаимодействовать только с положительно заряженными участками, присутствующими на сколах минералов [106]. В этом случае быстрая гетероагрегация AgНЧ, приводящая к их осаждению, происходит только при низкой ионной силе (менее 0.01), в то время как при высокой ионной силе образующиеся гетероагрегаты менее подвержены флокуляции и характеризуются более высокими значениями ККК [25]. Так как в большинстве случаев ионная сила почвенного раствора лежит в диапазоне 0.0004–0.005 [18, 25], то в реальных условиях следует ожидать выпадения AgНЧ вследствие гетероагрегации с глинистыми коллоидами. Тем не менее, при некоторых условиях ионная сила почвенного раствора может возрастать, а гетероагрегация приводить к увеличению стабильности AgНЧ. Показано, что известкование приводит к увеличению содержания в почвенном растворе Ca2+, Mg2+ и ${\text{HCO}}_{{\text{3}}}^{--},$ но уменьшению Al3+, результатом чего является двукратное увеличение ионной силы. При высокой скорости минерализации органического азота в весенний период, сопровождающейся выходом в почвенный раствор дополнительного количества ${\text{NO}}_{{\text{3}}}^{--}$ и катионов, также может наблюдаться увеличение ионной силы [34]. В солонцах ионная сила может достигать 0.05–1.2 [13].
Согласно существующим представлениям, гетероагрегацию следует рассматривать как весьма вероятный процесс для AgНЧ практически во всех почвах [25]. Неизученное направление в этой области – оценка гетероагрегации в реалистичных условиях, когда концентрация коллоидов во много раз превосходит концентрацию AgНЧ, а также присутствует почвенный РОВ. Важность количественной оценки процесса гетероагрегации AgНЧ в почвах связана с тем, что она во многом определяет возможность миграции наночастиц по почвенному профилю.
Взаимодействие с твердой частью почвы. В целом существующие количественные оценки связывающей способности почвы по отношению к AgНЧ указывают на возможность их интенсивного закрепления в почвенном профиле. Медианное значение константы распределения, определенное в колоночных экспериментах для 16-ти пахотных почв Австралии (рН 4.55–7.73, Сорг 0.1–7.0%, содержание глины 1–59%) составило 589 л/кг при варьировании от 50 до 2511 л/кг при начальной концентрации AgНЧ 1.24 мг/кг [24]. В аналогичном исследовании, проведенном на 25 пахотных почвах Германии (pH 4.3–7.3, Сорг 0.04–2.5%, содержание глины 0.01–39.2%) величины динамической константы распределения лежали в диапазоне 0.6–2391 л/кг, среднее значение 260 л/кг, при начальной концентрации AgНЧ 7.5–750 мг/кг [46]. Величины максимальной сорбционной емкости для AgНЧ на 6 почвах (рН 7.70–8.14, Сорг 0.11–1.06%, содержание глины 18–42%) лежали в диапазоне 2.35–4.53 мг/кг [86], что значительно превышает существующие оценки возможного содержания AgНЧ в почвах (табл. 2). Во всех случаях параметры, характеризующие величину связывания AgНЧ почвами, возрастали с увеличением содержания глинистых частиц. Несмотря на высокие средние значения констант связывания, указывающие что содержание AgНЧ в почве (мг/кг) в 260–589 раз превосходят концентрацию AgНЧ в почвенном растворе (мг/л), следует отметить, что при повышении начальной концентрации AgНЧ с 1.24 до 1842 мг/кг авторы [24] наблюдали рост константы с 589 л/кг до 9420 мг/кг, что позволяет высказать предположение об уменьшении константы распределения при низком содержании AgНЧ, соответствующем реальным. Кроме того, в исследовании [46] в 17-ти почвах из 25 величина константы распределения не превышала 10 л/кг. Это свидетельствует о том, что значительная часть AgНЧ, не связанная с твердой фазой почвы, может мигрировать по почвенному профилю. В работе [25] показано, что в 8 из 11 исследованных почв AgНЧ могут проникать на глубину до 12 см (высота почвенной колонки в этом исследовании); всего через колонку проходило от 0.2 до 9% от общего количества AgНЧ. Авторы установили, что одним из определяющих факторов в подвижности AgНЧ в почвах является их взаимодействие с почвенными неорганическими коллоидами, прежде всего, алюминия. Образующиеся в результате этого взаимодействия гетероагрегаты задерживаются почвенными частицами и не мигрируют по почвенному профилю. В случае наличия макропор, размер которых превышает размеры гетероагрегатов, возможна быстрая инфильтрация AgНЧ в составе почвенных коллоидов. В колоночных экспериментах [71] при искусственном загрязнении почвы AgНЧ в дозе 50 мкг/кг на трех различных почвах (рН 6.8–7.9, Сорг 0.2–3.4%, содержание глины 0–11%) было показано, что 75–90% AgНЧ остаются в верхнем слое, 3–14% были обнаружены в элюате. Кроме того, ряд авторов высказал предположение, что AgНЧ, первоначально связывающиеся с твердой фазой почвы, в дальнейшем могут десорбироваться и вымываться в нижележащие горизонты под действием ливневых дождей: после 50 сут экспонирования почвы в естественных условиях при общем количестве осадков 166 мм распределение AgНЧ было бимодальным с максимумами в слоях 0–4 и 7.6–20 см [95]. Таким образом, несмотря на то, что максимальное содержание AgНЧ следует ожидать в верхнем горизонте почвы, риск их миграции в нижележащие горизонты существует, и определять его следует в условиях конкретной почвы.
Растворение. Растворение AgНЧ, то есть высвобождение ионов Ag+, было показано для различных природных сред, включая почвенные растворы [24, 58]. Наиболее эффективно этот процесс протекает при низких рН (около 4.0) и при отсутствии РОВ [69]. Количественные оценки этого процесса, проведенные в модельном почвенном растворе, показывают, что доля ионов серебра, высвобождающихся из AgНЧ в течение 1 суток после внесения, в диапазоне рН 4–9 варьировала (в зависимости от способа расчета) от 8 до 26%; внесение РОВ может уменьшить этот показатель до 1% и менее [24]. Высвобождающиеся ионы серебра могут сорбироваться на почвенных частицах, образовывать малорастворимые Ag2S или AgCl или поглощаться растениями и микроорганизмами. Считается, что количество биодоступных Ag+ в почве не превышает 5% [50].
Высказано предположение, что ионы серебра, сорбированные на поверхности AgНЧ, в дальнейшем могут вытесняться ионами Ca2+ почвенного раствора с последующим окислением серебра [66]. Однако ряд исследователей полагает, что даже при значительном ингибировании высвобождения Ag+ в почвенном растворе могут присутствовать ионы серебра, десорбирующиеся с поверхности AgНЧ при старении [58]. Количественных оценок этого процесса пока не существует [58], однако известно, что интенсивная сорбция ионов серебра почвенными компонентами, наблюдаемая в течение первых часов взаимодействия, сменяется их десорбцией, приводящей к возрастанию количества несвязанных ионов серебра в почве в 10 раз [17].
Важным процессом, который может происходить с высвобождающимися ионами Ag+, является их дальнейший переход в AgНЧ под действием природного органического вещества или почвенных микроорганизмов [48, 53, 114]. Несмотря на то, что проникновение солнечного света в почву не превышает 0.2–0.4 мм [45], недавно было показано образование AgНЧ диаметром 12.8 нм в песчаном субстрате как под действием солнечной радиации в течение 10 ч, так и в темноте. Предполагают, что образование AgНЧ в присутствии природного органического вещества начинается с восстановления ионов Ag+ до нуль валентного серебра Ag0, которое становится ядром будущей наночастицы. Затем на поверхности Ag0 начинается автокаталитическое восстановление ионов серебра, приводящее к росту наночастицы [48]. При освещении процесс первичного восстановления Ag+ происходит под действием супероксиданион радикала ${\text{O}}_{2}^{{ \bullet - }},$ а в темноте – путем прямого переноса электрона от фенольных групп органического вещества к Ag+. Наиболее эффективно этот процесс протекает в щелочных условиях, когда окисление Ag+ незначительно: при рН 8.6 за 90 ч инкубирования (Ag+ 100 мг/л, природное органическое вещество 143 мг С/л, освещение) ионное серебро полностью переходило в форму AgНЧ [48].
Принципиальная возможность восстановления Ag+ до AgНЧ микроорганизмами показана как для внутриклеточных, так и для экстрацеллюлярных условий [11]. Способность эффективно переводить ионы серебра в наночастицы установлена для многих почвенных микроорганизмов. При культивировании Bacillus megaterium [90] в присутствии 1 мМ нитрата серебра AgНЧ диаметром 80–99 нм образовывались в течение первых минут после начала эксперимента. Способность образовывать AgНЧ диаметром 6–13 нм в аналогичных условиях была установлена для B. indicus, B. cecembensis, Pseudomonas antarctica, P. proteolytica, P. meridiana, Arthrobacter kerguelensis и A. gangotriensis [97]. Однако возможность протекания таких процессов непосредственно в условиях почвы пока не установлена. Согласно оценочным расчетам, из образующихся AgНЧ в почве 11–31% могут иметь абиотическое происхождение, в то время как 69–89% являются результатом биологического восстановления [48].
Окисление–восстановление. Под действием солнечного света многие наночастицы на основе металлов могут претерпевать различные окислительно-восстановительные превращения, приводящие к изменению их свойств [21]. Для AgНЧ была показана возможность их агрегации вследствие сильного осциллирующего диполь-дипольного взаимодействия, вызванного солнечным светом [22].
Другим процессом, характерным для AgНЧ, является сульфидирование. Многими исследователями было показано, что элементарное серебро Ag0 на поверхности наночастиц может окисляться до ионов Ag+, которые затем вступают в реакцию с неорганическими сульфидами с образованием Ag2S. В результате могут образовываться наночастицы сульфидов серебра, новые AgНЧ, поверхность которых полностью представлена сульфидами серебра, или их смешанный тип [64]. Так как Ag2S является плохо растворимым соединением, то сульфидированные AgНЧ перестают быть источником Ag+, что приводит к уменьшению токсичности AgНЧ. В случае присутствия в среде значительного количества ионов хлора, аналогичные процессы могут идти с образованием AgCl. Долгое время полагали, что сульфидирование – процесс детоксификации AgНЧ в природе [64]. Однако недавние исследования с использованием продолжительной экспозиции 140 сут показали, что даже после сульфидирования AgНЧ в концентрации 5–8 мг/кг эффективно ингибируют процесс нитрификации в почве [59]. Наиболее интенсивно процесс сульфидирования AgНЧ протекает в сточных водах и на очистных сооружениях, где существуют анаэробные условия и присутствие сероводорода способствует образованию Ag2S [55]. Возможность сульфидирования AgНЧ в почве в нейтральных (рН 6.9) и щелочных (рН 7.9) условиях после 3 мес. инкубирования была продемонстрирована в работе [93].
Таким образом, данные по взаимодействию AgНЧ показывают, что AgНЧ претерпевают в почве комплекс превращений, связанных с процессами взаимодействия с почвенными коллоидами, сорбции на твердой фазе почвы, растворения и окисления-восстановления. Количественная оценка процессов затруднена вследствие отсутствия широкого распространения аналитических методов определения AgНЧ в почве (критический обзор методов приведен в [88]). Тем не менее, очевидно, что эти процессы определяют количество доступного для организмов серебра и, как следствие, токсичность попадающих в почву AgНЧ.
Токсичность AgНЧ в почве. Использование AgНЧ как универсального антисептика началось с 1897 г., когда в продажу поступил препарат коллоидного серебра Колларгол; в 1954 г. в США был разрешен биоцид на основе коллоидного серебра Algaedyn, используемый в настоящее время как альгицид в частных бассейнах [81]. Природе токсичности AgНЧ посвящено значительное количество обзоров [26, 29, 56, 70, 87, 105, 108]. Несмотря на продолжительную историю использования AgНЧ, в том числе в сельском хозяйстве, работы по токсичности AgНЧ в почвенной среде относительно немногочисленны (табл. 3). При этом исследованные концентрации AgНЧ обычно составляют 102–105 мкг/кг почвы, что превышает максимальные оценочные значения этого показателя (табл. 2) в 10 и более раз. Таким образом, очевидно, что в настоящее время остро стоит необходимость оценки токсичности к AgНЧ в условиях, отражающих реальные.
Таблица 3.
Токсичность AgНЧ в почвах
| Объект | AgНЧ, мкг/кг* | Свойства почвы | Экспозиция, сут | Источник | ||
|---|---|---|---|---|---|---|
| грануломет-рический состав | рН | Сорг, % | ||||
| Растения | ||||||
| Chlamydomonas reinhardtii | 4 × 104 | Супесь | 5.6 | 3.39 | 6 | [78] |
| Lolium perenne | >1 × 105 | Глина | 5.1 | 3.3 | 53 | [89] |
| >1 × 105 | Суглинок | 6 | 2.1 | 53 | ||
| Phaseolus radiatus | >2 × 106 | Суглинок | 6 | Нет данных | 5 | [63] |
| Pinus muricata | 3.5 × 105 | Суглинок | 4.94 | 3.88 | 120 | [104] |
| Pinus sylvestris | 8 × 104 | Глина | 5 | 0.5 | 2 | [14] |
| 1 × 105 | Суглинок | 8.3 | 0.1 | 2 | ||
| 8 × 104 | Суглинок | 5 | 0.1 | 15 | ||
| 8 × 104 | Суглинок | 8.3 | 0.1 | 15 | ||
| Sorghum bicolor | <1 × 105 | Суглинок | 6 | 5 | [63] | |
| Triticum aestivum | 5 × 102 | Песок | 7.92 | 0 | 14 | [31] |
| Олигохеты | ||||||
| Eisenia andrei | 1.5 × 104 | Суглинок | 5.67 | 0.93 | 28 | [91] |
| Eisenia fetida | 7.3 × 105–7.7 × 105 | Суглинок | 6.23 | 7.65 | 28 | [98] |
| 7.7 × 105–8 × 105 | Суглинок | 6.23 | 7.65 | 28 | [99] | |
| <4.45 × 105 | Песок | 5.5 | 2.1 | 56 | [80] | |
| Lumbricus rubellus | 1.56 × 104 | Нет данных | 5.0 | 3.8 | 28 | [72] |
| Enchytraeus crypticus | <2.7 × 103 | Песок | 5.8 | 0.67 | 28 | [107] |
| Микроорганизмы | ||||||
| Общий пул микроорганизмов | 3.2 | Суглинок | 6.2 | 1.6 | 120 | [44] |
| 3 × 102 | Суглинок | 5.67 | 0.93 | 32 | [92] | |
| 10 | Суглинок | 7.2 | 2.88 | 365 | [42] | |
| 10 | Суглинок | 7.2 | 2.88 | 90, 180 | [43] | |
| 1 × 102 | Суглинок | 7.2 | 2.88 | 180 | [43] | |
| Betaproteobacteria | 10 | Суглинок | 7.2 | 2.88 | 365 | [42] |
| Аммонийокисляющие бактерии | 10 | Суглинок | 7.2 | 2.88 | 365 | [42, 43] |
| Аммонийокисляющие бактерии и археи | >1 × 104 | Суглинок | 7.13 | 1.25 | 37 | [113] |
| Азотфиксирующие | 10 | Суглинок | 7.2 | 2.88 | 7 | [43] |
| Actinobacteria, Chloroflexi, Planctomycetes, Verrucomicrobia. | 1 × 105 | Суглинок | 7.13 | 1.25 | 37 | [113] |
| Thaumarchaeota, Euryarchaeota, Parvarchaeota | 1 × 105 | Суглинок | 7.13 | 1.25 | 37 | [113] |
| Эктомикоризные грибы | 3.5 × 105 | Суглинок | 4.94 | 3.88 | 240 | [104] |
| Процессы и ферменты | ||||||
| Денитрификация | 1 × 104 | Суглинок | 5.2 | 1.5 | 3.33 | [109] |
| Нитрификация | 3.4 × 103 | Суглинок | 5.67 | 0.93 | 100 | [92] |
| Арилсульфатаза | 1.25 | Песок | 5.7 | 1.5 | 42 | [84] |
| Дегидрогеназа | 1 × 103 | Суглинок | 7.13 | 1.25 | 4 | [113] |
| 1 × 104 | Песок | 7.0 | 3.54 | <1 | [96] | |
| Лейцинаминопептидаза | 10 | Суглинок | 7.2 | 2.88 | 1, 90, 365 | [43] |
| 12.5 | Песок | 5.7 | 1.5 | 42 | [84] | |
| 1.25 × 102 | Песок | 5.7 | 1.8 | 42 | [84] | |
| Уреаза | 1 × 104 | Суглинок | 7.13 | 1.25 | 1 | [113] |
| 1 × 103 | Песок | 7.0 | 3.54 | 1 | [96] | |
Для растений выраженная токсичность AgНЧ в песчаном субстрате показана при их содержании 0.5 мг/кг и больше [31]; в почвах – при 40 мг/кг и больше [78]. При низких концентрациях AgНЧ в ряде случаев отмечают их стимулирующий эффект по отношению к растениям [56]. Токсичность AgНЧ для растений при низком содержании в твердом субстрате (10 мкг/кг) была показана только в случае клевера Trifolium repens при выращивании на смеси песка с перлитом и объяснялась угнетением арбускулярных микоризных грибов Glomus caledonium [36]. Отмечаемые симптомы токсичности у растений под действием AgНЧ включают в себя уменьшение длины корней и побегов, биомассы и изменение морфологии корней [63, 78, 89, 104]. Создание стрессовых условий для растений в присутствии AgНЧ подтверждается данными об образовании активных форм кислорода (АФК) [31]. Механизмы действия AgНЧ на растения обсуждены в обзорах [26, 29, 56, 70, 87, 105, 108].
Исследователи отмечают, что токсичность AgНЧ в почве меньше, чем в водных средах, что объясняется низкой биодоступностью AgНЧ вследствие их агрегирования в поровой воде и сорбции на почвенных частицах [63]. Низкая биодоступность AgНЧ в почве подтверждается невысокими значениями факторов их биоаккумуляции в надземных частях растений (отношение содержания серебра в растениях к его содержанию в почве): от 0.001 для маша Phaseolus radiatus и сорго Sorghum bicolor [63] до 0.07–0.1 для свеклы Beta vulgaris и шпината Spinacia oleracea [89]. В последнем случае указывается, что содержание серебра 5–10 мг/кг биомассы, представляющее опасность для человека, может быть достигнуто только при содержании AgНЧ 70 мг/кг [89]. Поэтому полагают, что в настоящее время AgНЧ не представляют угрозы с точки зрения их накопления в сельскохозяйственной продукции [60].
Для дождевых червей минимальная концентрация, при которой наблюдали токсичность AgНЧ, составляет 15 мг/кг (табл. 3), что также превышает оценочное содержание AgНЧ в почве на 3–4 порядка. Регистрируемые токсичные эффекты: уменьшение биомассы и подавление размножения. Установлено, что токсичность AgНЧ по отношению к олигохетам обусловлена влиянием на экспрессию генов, участвующих в метаболизме сахаров и аминокислот, а также регулирующих активность аденилаткиназы (EC 2.7.4.3) и рибосомальную активность [80].
Наибольшее количество токсикологических экспериментов было проведено с микроорганизмами (табл. 3). В этом случае диапазон исследованных концентраций включает в себя низкие концентрации от 3.2 [44] до 10 мкг/кг [42, 43], соответствующие оценочным (табл. 2). Токсичность AgНЧ показана как по отношению к конкретным почвенным бактериям, таким как Pseudomonas putida [37, 82] и P. chlororaphis [31], так и группам бактерий [51, 74] и бактериальному сообществу в целом [42–44, 92]. Современные представления и данные о токсичности AgНЧ по отношению к микроорганизмам суммированы в обзорах [26, 29, 62, 92, 105, 108, 113].
В целом можно сказать, что из исследованных групп почвенных микроорганизмов наиболее чувствительными к AgНЧ являются микроорганизмы, принимающие участие в превращениях азота и углерода [42]. Резкое сокращение видового разнообразия почвенного бактериального сообщества при длительной инкубации в присутствии AgНЧ может нарушить процессы автотрофной нитрификации и гумусообразования [42]. В работе [44] было продемонстрировано значимое уменьшение общего количества N в почве и, как следствие, роста отношения C : N при инкубировании почвы в присутствии AgНЧ 32 мкг/кг в течение 120 сут. Причиной этого, по-видимому, является уменьшение количества бактерий Acidobacteria [42], играющих важную роль в процессах трансформации целлюлозы и хитина [35] и ингибирование нитрифицирующих микроорганизмов [42, 43, 92, 113].
Другой важный вывод, следующий из анализа существующей литературы – это невозможность получения адекватной оценки токсичности AgНЧ по отношению к почвенным микроорганизмам на основе краткосрочных экспериментов. Рядом исследований показано, что выраженная токсичность AgНЧ при низких концентрациях может быть зафиксирована только при проведении долгосрочных экспериментов продолжительностью более 90 сут [43]. Причиной долгосрочного действия AgНЧ может являться длительное постепенное высвобождение из них серебра в биодоступной форме [26, 43, 95].
Таким образом, анализ литературы показывает, что в настоящее время отсутствуют данные, указывающие на токсичность AgНЧ по отношению к растениям и олигохетам при содержании, соответствующем оценочным концентрациям AgНЧ в почве. Тем не менее, неоднократно продемонстрированное на микроорганизмах возрастание регистрируемых негативных эффектов AgНЧ при увеличении времени экспозиции свидетельствует о необходимости проведения долгосрочных токсикологических исследований для растений и олигохет. Косвенным подтверждением в пользу зависимости токсичности AgНЧ для этих организмов от продолжительности воздействия является продемонстрированное увеличение ингибирования роста сосны шиповатой P. muricata при увеличении времени воздействия AgНЧ с 1 до 4 мес. [104], а также установленный рост активности антиоксидантных ферментов у дождевого червя Aporrectodea caliginosa при увеличении времени экспозиции с 1 до 4 нед. [38]. Рост токсичности AgНЧ в почве при их старении был также показан на примере коллембол Folsomia candida [75].
ЗАКЛЮЧЕНИЕ
В настоящее время во всем мире наблюдается рост использования наночастиц серебра (AgНЧ); их прогнозируемое поступление в почву, преимущественно в составе осадков сточных вод, составляет 15–77 т/год. Количественная оценка содержания AgНЧ в почве затруднена вследствие отсутствия инструментальных методов их определения. Существующие оценки этого показателя, проведенные на основе моделирования, варьируют в широком диапазоне от 5.33 × 10–6 до 7.4 мкг/кг при скорости поступления AgНЧ от 1.2 × 10–3 до 9.68 мкг/кг в год.
При поступлении в почву AgНЧ претерпевают различные превращения, связанные с их взаимодействием с твердой фазой почвы, почвенными коллоидами, РОВ и окислительно-восстановительными процессами и приводящие к преимущественному закреплению AgНЧ в верхнем слое почвы. В определенных условиях до 15% внесенных AgНЧ могут мигрировать по почвенному профилю; риск миграции AgНЧ в нижележащие горизонты следует определять в условиях конкретной почвы. В области поведения AgНЧ в почве наименее исследованным является вопрос количественной оценки абиотической и биотической трансформации ионов серебра в AgНЧ.
Существующие данные по токсичности AgНЧ в почве относительно немногочисленны и в большинстве случаев получены для содержания AgНЧ 102–105 мкг/кг почвы, что превышает оценочные значения этого показателя в реальных условиях в 10 и более раз. Данные о транслокации AgНЧ из почвы в растения позволяют в настоящее время исключить риск загрязнения ими сельскохозяйственной продукции. Токсичность по отношению к растениям и олигохетам в почве для AgНЧ не отмечается вплоть до их содержания 5 × 102 и 2.7 × 103 мкг/кг соответственно. Наиболее чувствительными к AgНЧ являются микроорганизмы, для которых ингибирование роста может наблюдаться при содержании 3.2 мкг/кг почвы. Важным фактором, определяющим регистрируемую токсичность AgНЧ, является продолжительность экспонирования: на микроорганизмах было неоднократно продемонстрировано возрастание регистрируемых негативных эффектов AgНЧ при увеличении этого параметра до 90 сут и более. Поэтому основным направлением изучения последствий поступления AgНЧ в почву является оценка их эффектов в условиях долгосрочных экспериментов при содержании AgНЧ, не превышающем 10 мкг/кг.
Список литературы
Автономная некоммерческая организация “Центр сертификации продукции и систем менеджмента в сфере наноиндустрии” (АНО “Наносертифика”). http://nanocertifica.ru/
Белоусова Е. Приумножать, не разрушая // Агроэксперт. 2018. № 1. С. 13–17.
Гладкова М.М., Терехова В.А. Инженерные наноматериалы в почве: источники поступления и пути миграции // Вестн. Моск. ун-та. Сер. 17. Почвоведение. 2013. № 3. С. 34–39.
ГОСТ Р 17.4.3.07-2001 Охрана природы (ССОП). Почвы. Требования к свойствам осадков сточных вод при использовании их в качестве удобрений.
Долина Л.Ф. Современная техника и технологии для очистки сточных вод от солей тяжелых металлов. Днепропетровск: Континент, 2008. 254 с.
Загрязнение почв Российской Федерации токсикантами промышленного происхождения в 2018 г. Обнинск: ФГБУ “НПО “Тайфун”, 2019. 118 с.
Зеребра агро. Стимулятор роста с фунгицидным эффектом на основе коллоидного серебра / https://scs.technology/products/zerebra-agro/
Колерова В. Серебряный век аграрной культуры // Российский экспортер. 2019. № 2(12). С. 72–75.
Ладонин В.Ф., Мерзлая Г.Е., Афанасьев Р.Ф. Стратегия использования осадков сточных вод и компостов на их основе в агрикультуре / Под ред. Милащенко Н.3. М.: Агроконсалт, 2002. 140 с.
Adorn Cosmetics. Real cost of cosmetics: environmental impact / https://www.adorncosmetics.com.au/ blog/post/environmental-impact/
Ahmad S., Munir S., Zeb N., Ullah A., Khan B., Ali J., Bilal M., Omer M., Alamzeb M., Salman S.M., Ali S. Green nanotechnology: a review on green synthesis of silver nanoparticles – an ecofriendly approach // Int. J. Nanomedicine. 2019. V. 14. P. 5087–5107. https://doi.org/10.2147/IJN.S200254
Anjum N.A., Gill S.S., Duarte A.C., Pereira E., Ahmad I. Silver nanoparticles in soil–plant systems // J. Nanopart. Res. 2013. V. 15. 1896. https://doi.org/10.1007/s11051-013-1896-7
Batukaev A.-M.A., Endovitsky A.P., Andreev A.G., Kalinichenko V.P., Minkina T.M., Dikaev Z.S., Mandzhieva S.S., Sushkova S.N. Ion association in water solution of soil and vadose zone of chestnut saline solonetz as a driver of terrestrial carbon sink // Solid Earth. 2016. V. 7(2). P. 415–423. https://doi.org/10.5194/se-7-415-2016
Bayramzadeh V., Ghadiri M., Davoodi M.H. Effects of silver nanoparticle exposure on germination and early growth of Pinus sylvestris and Alnus subcordata // Sains Malaysiana. 2019. V. 48(5). P. 937–944. https://doi.org/10.17576/jsm-2019-4805-02
Benn T., Cavanagh B., Hristovski K., Posner J.D., Westerhoff P. The release of nanosilver from consumer products used in the home // J. Environ. Qual. 2010. V. 39. P. 1875–1882. https://doi.org/10.2134/jeq2009.0363
Benn T.M., Westerhoff P. Nanoparticle silver released into water from commercially available sock fabrics // Environ. Sci. Technol. 2008. V. 42. P. 4133–4139. https://doi.org/10.1021/es7032718
Benoit R., Wilkinson K.J., Sauvé S. Partitioning of silver and chemical speciation of free Ag in soils amended with nanoparticles // Chem. Centr. J. 2013. V. 7. P. 75. https://doi.org/10.1186/1752-153X-7-75
Black A.S., Campbell A.S. Ionic strength of soil solution and its effect on charge properties of some New Zealand soils // J. Soil Sci. 1982. V. 33. P. 249–262.
Calderón-Jiménez B., Johnson M.E., Montoro Bustos A.M., Murphy K.E., Winchester M.R., Vega Baudrit J.R. Silver nanoparticles: technological advances, societal impacts, and metrological challenges. // Front. Chem. 2017. V. 5. Article 6.
Chalmers University of Technology. Nanosilver from clothing can pose major environmental problems // ScienceDaily. 2012. November 1. / [Электронный источник] – URL:www.sciencedaily.com/releases/2012/11/121101073002.htm
Chen H. Metal based nanoparticles in agricultural system: behavior, transport, and interaction with plants // Chem. Spec. Bioavailab. 2018. V. 30. P. 123–134. https://doi.org/10.1080/09542299.2018.1520050
Cheng Y., Yin L., Lin S., Weisner S., Bernhardt E., Liu J. Toxicity reduction of polymer-stabilized silver nanoparticles by sunlight // J. Phys. Chem. C. 2011. V. 115. P. 4425–4432. https://doi.org/10.1021/jp109789j
Colman B.P., Arnaout C.L., Anciaux S., Gunsch C.K., Hochella M.F., Kim B., Lowry G.V., McGill B.M., Reinsch B.C., Richardson C.J. Low concentrations of silver nanoparticles in biosolids cause adverse ecosystem responses under realistic field scenario // PLoS One. 2013. V. 8. P. e57189. https://doi.org/10.1371/journal.pone.0057189
Cornelis G., Doolette C., Thomas M., McLaughlin M.J., Kirby J.K., Beak D.G., Chittleborough D. Retention and dissolution of engineered silver nanoparticles in natural soils // Soil Sci. Soc. Am. J. 2012. V. 76(3). P. 891–902. https://doi.org/10.2136/sssaj2011.0360
Cornelis G., Pang L., Doolette C., Kirby J.K., McLaughlin M.J. Transport of silver nanoparticles in saturated columns of natural soils // Sci. Total Environ. 2013. V. 463. P. 120–30. https://doi.org/10.1016/j.scitotenv.2013.05.089
Courtois P., Rorat A., Lemiere S., Guyoneaud R., Attard E., Levard C., Vandenbulcke F. Ecotoxicology of silver nanoparticles and their derivatives introduced in soil with or without sewage sludge: a review of effects on microorganisms, plants and animals // Environ. Pollut. 2019. V. 253. 578e598. https://doi.org/10.13140/RG.2.2.10331.11042
Coutris C., Joner E.J., Oughton D.H. Aging and soil organic matter content affect the fate of silver nanoparticles in soil // Sci. Total Environ. 2012. V. 420. P. 327–333. https://doi.org/10.1016/j.scitotenv.2012.01.027
Cumberland S.A., Lead J.R. Particle size distributions of silver nanoparticles at environmentally relevant conditions // J. Chromatography. 2009. V. 1216(52). P. 9099–9105.
de la Rosa G., García-Castaneda C., Vazquez-Núnez E., Alonso-Castro A.J., asurto-Islas G., Mendoza A., Cruz-Jimenez G., Molina C. Physiological and biochemical response of plants to engineered NMs: implications on future design // Plant Physiol. Biochem. 2017. V. 110. P. 226e235. https://doi.org/10.1016/j.plaphy.2016.06.014
Degenkolb L., Kaupenjohann M., Klitzke S. The variable fate of Ag and TiO2 nanoparticles in natural soil solutions—sorption of organic matter and nanoparticle stability // Water Air Soil Pollut. 2019. V. 230. P. 62. https://doi.org/10.1007/s11270-019-4123-z
Dimkpa C.O., Calder A., Gajjar P., Merugu S., Huang W., Britt D.W., McLean J.E., Johnson W.P., Anderson A.J. Interaction of silver nanoparticles with an environmentally beneficial bacterium, Pseudomonas chlororaphis // J. Hazard. Mater. 2011. V. 188. P. 428–435. https://doi.org/10.1016/j.jhazmat.2011.01.118
Dimkpa C.O., McLean J.E., Martineau N., Britt D.W., Haverkamp R., Anderson A.J. Silver nanoparticles disrupt wheat (Triticum aestivum L.) growth in a sand matrix // Environ. Sci. Technol. 2013. V. 47. P. 1082–1090. https://doi.org/0.1021/es302973y
Dong B., Liu G., Zhou J., Wang J., Jin R. Transformation of silver ions to silver nanoparticles mediated by humic acid under dark conditions at ambient temperature // J. Hazard. Mater. 2020. V. 383. P. 121190. https://doi.org/10.1016/j.jhazmat.2019.121190
Edmeades D.C., Wheeler D.M., Clinton O.E. The chemical composition and ionic strength of soil solutions from New Zealand topsoils // Austral. J. Soil Res. 1985. V. 23(2). P. 151–165. https://doi.org/10.1071/sr9850151
Eichorst S.A., Trojan D., Roux S., Herbold C., Rattei T., Woebken D. Genomic insights into the Acidobacteria reveal strategies for their success in terrestrial environments // Environ. Microbiol. 2018. V. 20(3). P. 1041–1063. https://doi.org/10.1111/1462-2920.14043
Feng Y., Cui X., He Sh., Dong G., Chen M., Wang J., Lin X. The role of metal nanoparticles in influencing arbuscular mycorrhizal fungi effects on plant growth // Environ. Sci. Technol. 2013. V. 47. P. 9496–9504. https://doi.org/10.1021/es402109n
Gajjar P., Pettee B., Britt D.W., Huang W., Johnson W.P., Anderson A.J. Antimicrobial activities of commercial nanoparticles against an environmental soil microbe, Pseudomonas putida KT2440 // J. Biol. Eng. 2009. V. 3. P. 9. https://doi.org/10.1186/1754-1611-3-9
Gooneratne R., Saaleb N., Robinson B., Cavanagh J., Ross J., Lashing A., Wellby M. Biochemical- and neuro-toxicity of silver nanoparticle and silver nitrate in soil to Aporrectodea calginosa earthworms // Toxicol. Lett. 2017. V. 280. Suppl. 1. P. S203. https://doi.org/10.1016/j.toxlet.2017.07.554
Gottschalk F., Lassen C., Kjoelholt J., Christensen F., Nowack B. Modeling flows and concentrations of nine engineered nanomaterials in the Danish environment // Int. J. Environ. Res. Publ. Health. 2015. V. 12(5). P. 5581–5602. https://doi.org/10.3390/ijerph120505581
Gottschalk F., Sonderer T., Scholz R.W., Nowack B. Modeled environmental concentrations of engineered nanomaterials (TiO2, ZnO, Ag, CNT, Fullerenes) for different regions // Environ. Sci. Technol. 2009. V. 43. P. 9216–9222.
Gottschalk F., Sun T.Y., Nowack B. Environmental concentrations of engineered nanomaterials: Review of modeling and analytical studies // Environ. Pollut. 2013. V. 181. P. 287–300. https://doi.org/10.1016/j.envpol.2013.06.003
Grün A.-L., Emmerling Ch. Long-term effects of environmentally relevant concentrations of silver nanoparticles on major soil bacterial phyla of a loamy soil // Environ. Sci. Eur. 2018. V. 30. 31. https://doi.org/10.1186/s12302-018-0160-2
Grün A.-L., Straskraba S., Schulz S., Schloter M., Emmerling Ch. Long-term effects of environmentally relevant concentrations of silver nanoparticles on microbial biomass, enzyme activity, and functional genes involved in the nitrogen cycle of loamy soil // J. Environ. Sci. 2018. V. 69. P. 12–22. https://doi.org/10.1016/j.jes.2018.04.013
Hänsch M., Emmerling Ch. Effects of silver nanoparticles on the microbiota and enzyme activity in soil // J. Plant Nutr. Soil Sci. 2010. V. 173. P. 554–558. https://doi.org/10.1002/jpln.200900358
Hebert V.R., Miller G.C. Depth dependence of direct and indirect photolysis on soil surfaces // J. Agr. Food Chem. 1990. V. 38. P. 913–918.
Hoppe M., Mikutta R., Utermann J., Duijnisveld W., Guggenberger G. Retention of sterically and electrosterically stabilized silver nanoparticles in soils // Environ. Sci. Technol. 2014. V. 48(21). P. 12628–12635. https://doi.org/10.1021/es5026189
Huang S., Wang L., Liu L., Hou Y., Li L. Nanotechnology in agriculture, livestock, and aquaculture in China. A review // Agron. Sustain. Dev. 2015. V. 35. P. 369–400. https://doi.org/10.1007/s13593-014-0274-x
Huang Y.-N., Qian T.-T., Dang F., Yin Y.-G., Li M., Zhou D.-M. Significant contribution of metastable particulate organic matter to natural formation of silver nanoparticles in soils // Nature Comm. 2019. V. 10. P. 3775. https://doi.org/10.1038/s41467-019-11643-6
Huynh K.A., Chen K.L. Aggregation kinetics of citrate and polyvinylpyrrolidone coated silver nanoparticles in monovalent and divalent electrolyte solutions // Environ. Sci. Technol. 2011. V. 45. P. 5564–5571.
Jacobson A.R., McBride M.B., Baveye P., Steenhuis T.S. Environmental factors determining the trace-level sorption of silver and thallium to soils // Sci. Total Environ. 2005. V. 345(1–3). P. 191–205.
Juan W., Kunhui S., Zhang L., Youbin S. Effects of silver nanoparticles on soil microbial communities and bacterial nitrification in suburban vegetable soils // Pedosphere. 2017. V. 27. P. 482–490. https://doi.org/10.1016/S1002-0160(17)60344-8
Kampe S., Kaegi R., Schlich K., Wasmuth C., Hollert H., Schlechtriem Ch. Silver nanoparticles in sewage sludge: bioavailability of sulfidized silver to the terrestrial isopod Porcellio scaber // Environ. Toxicol. Chem. 2018. V. 37(6). P. 1606–1613. https://doi.org/10.1002/etc.4102
Kang F.X., Alvarez P.J., Zhu D.Q. Microbial extracellular polymeric substances reduce Ag+ to silver nanoparticles and antagonize bactericidal activity // Environ. Sci. Technol. 2014. V. 48. P. 316–322. https://doi.org/10.1021/es403796x
Keller A.A., Lazareva A. Predicted releases of engineered nanomaterials: from global to regional to local // Environ. Sci. Technol. Lett. 2014. V. 1. P. 65–70. https://doi.org/10.1021/ez400106t
Kent R.D., Oser J.G., Vikesland P.J. Controlled evaluation of silver nanoparticle sulfidation in a full-scale wastewater treatment plant // Environ. Sci. Technol. 2014. V. 48. P. 8564–8572. https://doi.org/10.1021/es203475a
Khan M.R., Adam V., Rizvi T.F., Zhang B., Ahamad F., Josko I., Zhu Y., Yang M., Mao Ch. Nanoparticle-plant interactions: two-way traffic // Small. 2019. V. 15. P. 1901794. https://doi.org/10.1002/smll.201901794
Khot L.R., Sankaran S., Maja J.M., Ehsani R., Schuster E.W. Applications of nanomaterials in agricultural production and crop protection: a review // Crop Prot. 2012. V. 35. P. 64–70. https://doi.org/10.1016/j.cropro.2012.01.007
Klitzke S., Metreveli G., Peters A., Schaumann G.E., Lang F. The fate of silver nanoparticles in soil solution – sorption of solutes and aggregation // Sci. Total Environ. 2015. V. 535. P. 54–60. https://doi.org/10.1016/j.scitotenv.2014.10.108
Kraas M., Schlich K., Knopf B., Wege F., Kagi R., Terytze K., Hund-Rinke K. Long-term effects of sulfidized silver nanoparticles in sewage sludge on soil microflora // Environ. Toxicol. Chem. 2017. V. 36(12). P. 3305–3313. https://doi.org/10.1002/etc.3904
Kranjc E., Drobne D. Nanomaterials in plants: a review of hazard and applications in the agri-food sector // Nanomater. 2019. V. 9. 1094. https://doi.org/10.3390/nano9081094
Kumahor S.K., Hron P., Metreveli G., Schaumann G.E., Vogel H.-J. Transport of citrate-coated silver nanoparticles in unsaturated sand // Sci. Total Environ. 2015. V. 535. P. 113–121. https://doi.org/10.1016/j.scitotenv.2015.03.023
Kwak J.I., An Y.-J. The current state of the art in research on engineered nanomaterials and terrestrial environments: different-scale approaches // Environ. Res. 2016. V. 151. P. 368–382. https://doi.org/10.1016/j.envres.2016.08.005
Lee W.-M., Kwak J.I., An Y.-J. Effect of silver nanoparticles in crop plants Phaseolus radiatus and Sorghum bicolor: media effect on phytotoxicity // Chemosphere. 2012. V. 86. P. 491–499. https://doi.org/10.1016/j.chemosphere.2011.10.013
Levard C., Hotze E.M., Colman B.P., Dale A.L., Truong L., Yang X.Y., Lowry G.V. Sulfidation of silver nanoparticles: natural antidote to their toxicity // Environ. Sci. Technol. 2013. V. 47(23). P. 13440–13448. https://doi.org/10.1021/es403527n
Li M., Wang P., Dang F., Zhou D.-M. The transformation and fate of silver nanoparticles in a paddy soil: effects of soil organic matter and redox conditions // Environ. Sci.: Nano. 2017. V. 4. P. 919–928. https://doi.org/10.1039/C6EN00682E
Li X., Lenhart J.J., Walker H.W. Dissolution-accompanied aggregation kinetics of silver nanoparticles // Langmuir. 2010. V. 26. P. 16690–16698. https://doi.org/10.1021/la101768n
Liaw J.-W., Wu H.-Y., Huang C.-C., Kuo M.-K. Metal-enhanced fluorescence of silver island associated with silver nanoparticle // Nanoscale Res. Lett. 2016. V. 11. P. 26. https://doi.org/10.1186/s11671-016-1247-6
Liu H., Gu X., Wei C., Fu H., Alvarez P.J.J., Li Q., Zheng S., Qu X., Zhu D. Threshold concentrations of silver ions exist for the sunlight-induced formation of silver nanoparticles in the presence of natural organic matter // Environ. Sci. Technol. 2018. V. 52. P. 4040–4050. https://doi.org/10.1021/acs.est.7b05645
Liu J., Hurt R.H. Ion release kinetics and particle persistence in aqueous nano-silver colloids // Environ. Sci. Technol. 2010. V. 44. P. 2169–2175. https://doi.org/10.1021/es9035557
López-Moreno M.L., Cedeno-Mattei Y., Bailón-Ruiz S.J., Vazquez-Nunez E., Hernandez-Viezcas J.A., Perales-Pérezh O.J., De la Rosa G., Peralta-Videa J.R., Gardea-Torresdey J.L. Environmental behavior of coated NMs: physicochemical aspects and plant interactions // J. Hazard. Mater. 2018. V. 347. P. 196–217. https://doi.org/10.1016/j.jhazmat.2017.12.058
Mahdi K.N.M., Peters R., van der Ploeg M., Ritsema C., Geissen V. Tracking the transport of silver nanoparticles in soil: a saturated column experiment // Water Air Soil Pollut. 2018. V. 229. P. 334. https://doi.org/10.1007/s11270-018-3985-9
Makama S., Piella J., Undas A., Dimmers W.J., Peters R., Puntes V.F., van den Brink N.W. Properties of silver nanoparticles influencing their uptake in and toxicity to the earthworm Lumbricus rubellus following exposure in soil // Environ. Pollut. 2016. V. 218. P. 870–878. https://doi.org/10.1016/j.envpol.2016.08.016
Massarsky A., Trudeau V.L., Moon T.W. Predicting the environmental impact of nanosilver // Environ. Toxicol. Pharmacol. 2014. V. 38. P. 861–873.
McGee C.F., Storey S., Clipson N., Doyle E. Concentration-dependent responses of soil bacterial, fungal and nitrifying communities to silver nano and micron particles // Environ. Sci. Pollut. Res. 2018. V. 25. P. 18693–18704.https://doi.org/10.1007/ s1135 6-018-2087-y
McKee M.S., Engelke M., Zhang X., Lesnikov E., Köser J., Eickhorst T., Filser J. Collembola reproduction decreases with aging of silver nanoparticles in a sewage sludge-treated soil // Front. Environ. Sci. 2017. V. 5. Article 19. https://doi.org/10.3389/fenvs.2017.00019
Mueller N.C., Nowack B. Exposure modeling of engineered nanoparticles in the environment // Environ. Sci. Technol. 2008. V. 42. P. 4447–4453.
Musee N. Simulated environmental risk estimation of engineered nanomaterials: a case of cosmetics in Johannesburg City // Hum. Exp. Toxicol. 2010. V. 30(9). P. 1181–1195. https://doi.org/10.1177/0960327110391387
Nam S.-W., Kwak J.I., An Y.-J. Quantification of silver nanoparticle toxicity to algae in soil via photosynthetic and flow-cytometric analyses // Sci. Rep. 2018. V. 8. 292.https://doi.org/10.1038/s41598-017-18680-5
Nanotechnology Products Database (NPD) / [Электронный источник] – URL: https://product. statnano.com
Novo M., Lahive E., Díez-Ortiz M., Matzke M., Morgan A.J., Spurgeon D.J., Svendsen C., Kille P. Different routes, same pathways: molecular mechanisms under silver ion and nanoparticle exposures in the soil sentinel Eisenia fetida // Environ. Pollut. 2015. V. 205. P. 385–393. https://doi.org/10.1016/j.envpol.2015.07.010
Nowack B., Krug H.F., Height M. 120 years of nanosilver history: implications for policymakers // Environ. Sci. Technol. 2011. V. 45. P. 1177–1183. https://doi.org/10.1021/es103316q
Ortega-Calvo J.J., Molina R., Jimenez-Sanchez C., Dobson P.J., Thompson I.P. Bacterial tactic response to silver nanoparticles // Environ. Microbiol. Rep. 2011. V. 3. P. 526–534.
Pachapur V.L., Larios A.D., Cledón M., Brar S.K., Verma M., Surampalli R.Y. Behavior and characterization of titanium dioxide and silver nanoparticles in soils // Sci. Total Environ. 2016. V. 563–564. P. 933–943. https://doi.org/10.1016/j.scitotenv.2015.11.090
Peyrot C., Wilkinson K.J., Desrosiers M., Sauvé S. Effects of silver nanoparticles on soil enzyme activities with and without added organic matter // Environ. Toxicol. Chem. 2014. V. 33(1). P. 115–125. https://doi.org/10.1002/etc.2398
Pulit-Prociak J., Banach M. Silver nanoparticles – a material of the future…? // Open Chem. 2016. V. 14. P. 76–91. https://doi.org/10.1515/chem-2016-0005
Rahmatpour S., Shirvani M., Mosaddeghi M.R., Bazarganipour M. Retention of silver nano-particles and silver ions in calcareous soils: influence of soil properties // J. Environ. Manag. 2017. V. 193. P. 136–145. https://doi.org/10.1016/j.jenvman.2017.01.062
Rastogi A., Zivcak M., Sytar O., Kalaji H.M., He X., Mbarki S., Brestic M. Impact of metal and metal oxide nanoparticles on plant: a critical review // Front. Chem. 2017. V. 5. Article 78. https://doi.org/10.3389/fchem.2017.00078
Rodrigues S.M., Trindade T., Duarte A.C., Pereira E., Koopmans G.F., Römkens P.F.A.M. A framework to measure the availability of engineered nanoparticles in soils: trends in soil tests and analytical tools // Trend. Anal. Chem. 2016. V. 75. P. 129–140. https://doi.org/10.1016/j.trac.2015.07.003
Saleeb N., Gooneratne R., Cavanagh J., Bunt C., Hossain A.K.M.M., Gaw S., Robinson B. The mobility of silver nanoparticles and silver ions in the soil-plant system // J. Environ. Qual. 2019. V. 48. P. 1835–1841. https://doi.org/10.2134/jeq2019.03.0098
Saravanan M., Vemu A.K., Barik S.K. Rapid biosynthesis of silver nanoparticles from Bacillus megaterium (NCIM 2326) and their antibacterial activity on multi drug resistant clinical pathogens // Coll. Surf. B. 2011. V. 88. P. 325–331. https://doi.org/10.1016/j.colsurfb.2011.07.009
Schlich K., Klawonn T., Terytze K., Hund-Rinke K. Effects of silver nanoparticles and silver nitrate in the earthworm reproduction test // Environ. Toxicol. Chem. 2013. V. 32(1). P. 181–188. https://doi.org/10.1002/etc.2030
Schlich K., Klawonn T., Terytze K., Hund-Rinke K. Hazard assessment of a silver nanoparticle in soil applied via sewage sludge // Environ. Sci. Eur. 2013. V. 25. Article 17. https://doi.org/10.1186/2190-4715-25-17
Sekine R., Brunetti G., Donner E., Khaksar M., Vasilev K., Jämting A.K., Scheckel K.G., Kappen P., Zhang H., Lombi E. Speciation and lability of Ag-, AgCl- and Ag2S-nanoparticles in soil determined by X-ray absorption spectroscopy and diffusive gradients in thin films // Environ. Sci. Technol. 2015. V. 49(2). P. 897–905. https://doi.org/10.1021/es504229h
Servin A.D., White J.C. Nanotechnology in agriculture: next steps for understanding engineered nanoparticle exposure and risk // NanoImpact. 2016. V. 1. P. 9–12. https://doi.org/10.1016/j.impact.2015.12.002
Shah V., Collins D., Walker V.K., Shah S. The impact of engineered cobalt, iron, nickel and silver nanoparticles on soil bacterial diversity under field conditions // Environ. Res. Lett. 2014. V. 9(2). P. 024001. https://doi.org/10.1088/1748-9326/9/2/024001
Shin Y.-J., Kwak J.I., An Y.-J. Evidence for the inhibitory effects of silver nanoparticles on the activities of soil exoenzymes // Chemosphere. 2012. V. 88. P. 524–529. https://doi.org/10.1016/j.chemosphere.2012.03.010
Shivaji S., Madhu S., Singh S. Extracellular synthesis of antibacterial silver nanoparticles using psychrophilic bacteria // Process Biochem. 2011. V. 49. P. 830–837. https://doi.org/10.1016/j.procbio.2011.06.008
Shoults-Wilson W.A., Reinsch B.C., Tsyusko O.V., Bertsch P.M., Lowry G.V., Unrine J.M. Effect of silver nanoparticle surface coating on bioaccumulation and reproductive toxicity in earthworms (Eisenia fetida) // Nanotoxicol. 2011. V. 5(3). P. 432–444. https://doi.org/10.3109/17435390.2010.537382
Shoults-Wilson W.A., Reinsch B.C., Tsyusko O.V., Bertsch P.M., Lowry G.V., Unrine J.M. Role of particle size and soil type in toxicity of silver nanoparticles to earthworms // Soil Sci. Soc. Am. J. 2011. V. 75. P. 365–375. https://doi.org/10.2136/sssaj2010.0127nps
Sotiriou G.A., Pratsinis S.E. Engineering nanosilver as an antibacterial, biosensor and bioimaging material // Curr. Opin. Chem/ Eng. 2011. V. 1(1). P. 3–10. https://doi.org/10.1016/j.coche.2011.07.001
Su Y., Ashworth V., Kim C., Adeleye A.S., Rolshausen Ph., Roper C., White J., Jassby D. Delivery, uptake, fate, and transport of engineered nanoparticles in plants: a critical review and data analysis // Environ. Sci.: Nano. 2019. V. 6. P. 2311–2331. https://doi.org/10.1039/c9en00461k
Sun T.Y., Conroy G., Donner E., Hungerbühler K., Lombic E., Nowack B. Probabilistic modelling of engineered nanomaterial emissions to the environment: a spatio-temporal approach // Environ. Sci.: Nano. 2015. V. 2. P. 340–351. https://doi.org/10.1039/c5en00004a
Sun T.Y., Gottschalk F., Hungerbühler K., Nowack B. Comprehensive probabilistic modelling of environmental emissions of engineered nanomaterials // Environ. Pollut. 2014. V. 185. P. 69–76. https://doi.org/10.1016/j.envpol.2013.10.004
Sweet M.J., Singleton I. Soil contamination with silver nanoparticles reduces Bishop pine growth and ectomycorrhizal diversity on pine roots // J. Nanopart. Res. 2015. V. 17. Р. 448. https://doi.org/10.1007/s11051-015-3246-4
Tian H., Kah M., Kariman K. Are nanoparticles a threat to mycorrhizal and rhizobial symbioses? A critical review // Front. Microbiol. 2019. V. 10. Article 1660. https://doi.org/10.3389/fmicb.2019.01660
Tombacz E., Szekeres M. Colloidal behavior of aqueous montmorillonite suspensions: the specific role of pH in the presence of indifferent electrolytes // Appl. Clay Sci. 2004. V. 27. P. 75–94.
Topuz E., van Gestel C.A.M. The effect of soil properties on the toxicity and bioaccumulation of Ag nanoparticles and Ag ions in Enchytraeus crypticus // Ecotoxicol. Environ. Saf. 2017. V. 144. P. 330–337. https://doi.org/10.1016/j.ecoenv.2017.06.037
Tripathi D.K., Tripathi A., Shweta, Singh S., Singh Y., Vishwakarma K., Yadav G., Sharma S., Singh V.K., Mishra R.K., Upadhyay R.G., Dubey N.K., Lee Y., Chauhan D.K. Uptake, accumulation and toxicity of silver nanoparticle in autotrophic plants, and heterotrophic microbes: a concentric review // Front. Microbiol. 2017. V. 26. Article 8. https://doi.org/10.3389/fmicb.2017.00007
VandeVoort A.R., Skipper H., Arai Y. Macroscopic assessment of nanosilver toxicity to soil denitrification kinetics // J. Environ. Qual. 2014. V. 43. P. 1424–1430. https://doi.org/10.2134/jeq2013.12.0524
Wang F., Zeng X., Yao Y., Sun R., Xu J., Wong C.-P. Silver nanoparticle-deposited boron nitride nanosheets as fillers for polymeric composites with high thermal conductivity // Sci. Rep. 2016. V. 6. P. 19394. https://doi.org/10.1038/srep19394
Wei C., Li M., Zhao X. Surface-enhanced Raman scattering (SERS) with silver nano substrates synthesized by microwave for rapid detection of foodborne pathogens // Front Microbiol. 2018. V. 9. 2857. https://doi.org/10.3389/fmicb.2018.02857
Wimmer A., Kalinnik A., Schuster M. New insights into the formation of silver based nanoparticles under natural and semi-natural conditions // Water Res. 2018. V. 141. P. 227–234. https://doi.org/10.1016/j.watres.2018.05.015
Yan Ch., Huang J., Cao Ch., Li R., Ma Y., Wang Y. Effects of PVP-coated silver nanoparticles on enzyme activity, bacterial and archaeal community structure and function in a yellow-brown loam soil // Environ. Sci. Pollut. Res. 2020. https://doi.org/10.1007/s11356-019-07347-5
Yin G., Yang X., Hu L., Tan Zh., Zhao L., Zhang Zh., Liu J., Jiang G. Superoxide-mediated extracellular biosynthesis of silver nanoparticles by the fungus Fusarium oxysporum // Environ. Sci. Technol. Lett. 2016. V. 3. P. 160–165. https://doi.org/10.1021/acs.estlett.6b00066
Zhang W., Ke S., Sun C., Xu X., Chen J., Yao L. Fate and toxicity of silver nanoparticles in freshwater from laboratory to realistic environments: a review // Environ. Sci. Pollut. Res. 2019. https://doi.org/10.1007/s11356-019-04150-0
Zhou D., Abdel-Fattah A.I., Keller A.A. Clay particles destabilize engineered nanoparticles in aqueous environments // Environ. Sci. Technol. 2012. V. 46. P. 7520–7256. https://doi.org/10.1021/es3004427
Дополнительные материалы отсутствуют.