Почвоведение, 2021, № 4, стр. 407-419
Исследование стабильности почвенного органического вещества методами дериватографии и длительной инкубации
Д. А. Соколов a, И. И. Дмитревская b, Н. Б. Паутова a, Т. Н. Лебедева a, В. А. Черников b, В. М. Семенов a, *
a Институт физико-химических и биологических проблем почвоведения РАН – обособленное подразделение
ФИЦ ПНЦБИ РАН
142290 Пущино, Московской области, ул. Институтская, 2, Россия
b Российский государственный аграрный университет – МСХА имени К.А. Тимирязева
127550 Москва, Тимирязевская ул., 49, Россия
* E-mail: v.m.semenov@mail.ru
Поступила в редакцию 30.06.2020
После доработки 24.08.2020
Принята к публикации 27.10.2020
Аннотация
Почвенное органическое вещество (ПОВ) включает в себя многие классы лабильных и прочных соединений, которые доступны для разложения микроорганизмами или, наоборот, защищены от биодеградации вследствие биологической, химической и физической стабилизации. Считается, что чем больше тепловой энергии расходуется на деструкцию ПОВ, тем оно стабильнее и более устойчиво к биоразложению. Сравнивали термостойкость и биологическую стабильность органического вещества в десяти почвах, залегающих в лиственно-лесной, лесостепной, степной и сухостепной биоклиматических областях европейской части России. По величине энергии активации (Еа) самая высокая термостабильность органического вещества характерна для чернозема обыкновенного и луговой слитизированной почвы, самая низкая термостабильность свойственна серой лесной почве, а остальные типы почв занимали промежуточное положение по устойчивости к термическому окислению. Термически лабильный пул (<390–400°C) органического вещества в почвах составлял в среднем 41% (32–60%) от всего ПОВ, а термически стабильный пул (>390–400°C) был равен 59% (40–68%). Биологическая стабильность ПОВ, оцениваемая по отношению потенциально-минерализуемого органического вещества к устойчивому для минерализации (индекс биологической стабильности), уменьшалась в следующем ряду почв: чернозем обыкновенный > луговая слитизированная > серая лесная = луговая каштановая > луговой солонец > пойменная луговая. Размеры потенциально-минерализуемого пула ПОВ в исследуемых почвах были в 6–27 раз меньше, чем термолабильного пула, а параметры, характеризующие термостабильность ПОВ не коррелировали с индексом биологической стабильности. Таким образом, термолабильность ПОВ не идентична его способности к биоразложению.
ВВЕДЕНИЕ
Почва представляет собой сложную, саморегулирующуюся, многокомпонентную систему, представленную твердой, жидкой, газовой и живой фазами. Межфазные взаимодействия лежат в основе многих явлений и эффектов, придающих почве сходство и разнообразие свойств и режимов. Дискретные частицы остатков биоты, негуминовые биомолекулы и ансамбли гуминовых веществ, стохастически адсорбированные в конгломерате минеральных частиц, образуют твердую часть почвенного органического вещества (ПОВ) [5]. Слагающие ПОВ остатки биоты и продукты микробного метаболизма имеют разную исходную и приобретенную химическую прочность [9, 20, 24]. Исходная прочность органического вещества обусловлена внутренними свойствами входящих в их состав индивидуальных соединений, отличающихся по соотношению элементов, форме молекул, составу функциональных групп. К числу наиболее химически прочных соединений, устойчивых к разложению, относятся лигнин, танин, кутин, суберин, воски и др. Вторичная прочность органического вещества возникает в результате его биологического и химического видоизменения в почве в результате увеличения доли лигнина и полифенолов в разлагаемых остатках, синтеза микробных метаболитов, типа меланина и гломалина, образования гуминовых веществ, обугливания [9]. Традиционно считается, что чем выше доля прочных органических соединений в составе ПОВ, тем больше его стабильность [3, 9, 14, 29, 30, 46].
По современным представлениям химическая прочность соединений ответственна за краткосрочную и среднесрочную защищенность органического вещества от нескольких лет до десятилетий, тогда как долговременное сохранение компонентов ПОВ в течение сотен и тысяч лет обеспечивается стабилизацией органических соединений минеральной частью почвы [3, 25, 45, 46]. Минеральная часть твердой фазы почвы катализирует реакции конденсации и полимеризации, сорбирует биомолекулы органических мономеров, вовлечена в образование металлоорганических и координационных связей, создает физические барьеры между микроорганизмами (ферментами) и субстратами, придавая последним пространственную недосягаемость. Остатки микробной биомассы быстрее и прочнее стабилизируются поверхностью минеральных частиц, чем твердые дискретные частицы растительных остатков, а мономеры – чем крупные молекулы биополимеров [18, 19]. Поэтому даже простые по химическому составу органические соединения, но связанные минеральной матрицей почвы, демонстрируют высокую прочность и выраженную стабильность.
К числу методов, позволяющих оценить соотношение разнофазных компонентов почвы, как и прочность внутренних и внешних химических связей ПОВ, относится дериватографический метод. Этот метод основан на регистрации химических и физико-химических процессов, происходящих в образце при изменении температуры (фазовые превращения, термическое разложение и окисление, внутримолекулярные перегруппировки и др.) с получением 4 типов кривых: температурной (Т), дифференциально-термической (ДТА), термогравиметрической (ТГ) и дифференциально-термогравиметрической (ДТГ) [4]. Кривая ДТА на дериватограмме характеризует фазовые превращения в образце, кривая ТГ показывает изменение массы образца в неизотермических или изотермических условиях, давая представление о термической (термоокислительной) стабильности компонентов почвы, а локальные пики на кривой ДТГ объясняются изменением механизмов разложения и составом разлагаемого материала. По ТГ и ДТГ оценивается качественный состав ПОВ, определяется соотношение между термически лабильными и стабильными его пулами, исследуется структура супрамолекулярных комплексов и идентифицируется пирогенный, органический и неорганический углерод в почве [2, 12, 15–17, 21, 27, 31, 38, 39, 43, 44].
Выделяется несколько температурных интервалов с одинаковыми закономерностями по убыли массы почвы, соответствующие испарению адсорбционно связанной воды, разложению органического вещества, физико-химическим превращениям почвенных минералов [1, 2, 15–17, 21, 26, 27, 31, 32, 35, 39, 44]. По степени устойчивости к термической деструкции ПОВ подразделяется на лабильный пул со слабосвязанным, биологически разлагаемым органическим веществом и стабильный пул с прочносвязанными, преимущественно гуминовыми компонентами [2, 26, 33, 39]. Методами аналитического пиролиза и термогравиметрии в сочетании с дифференциальной сканирующей калориметрией (ДСК), масс-спектрометрией или хромато-масс-спектрометрией выделяются три группы органических веществ, различающиеся по степени устойчивости к термической деструкции: лабильные, прочные (recalcitrant) и особо прочные (refractory) [13, 16, 21, 22, 26, 27, 31, 36]. Диапазоны температур, характеризующие термоустойчивость этих трех групп веществ, могут варьировать в зависимости от условий исследований и свойств почвы [42].
По бытовавшим ранее представлениям термолабильное органическое вещество обладает большей способностью к биологическому разложению, чем термостабильное, поэтому термические свойства отдельных групп ПОВ могут быть индикатором их биологического разложения почвенными микроорганизмами [28, 34, 38, 39]. Однако в некоторых исследованиях получены иные результаты. Обнаружены разные взаимосвязи между термической и биологической стабильностью ПОВ для образцов с низким и высоким содержанием Сорг в почве [33]. Выделяемые по термостабильности пулы ПОВ оказались не идентичными биологически активному пулу ПОВ, а термическое окисление в целом не позволяло идентифицировать пулы ПОВ с разной биологической стабильностью [21, 37]. При повышении температуры от 200 до 500°С не происходило выделения биологически стабильных фракций органического вещества, связанных с почвенными минералами [23].
Цель работы – сравнить размеры термолабильного, термостабильного и биологически активного пулов ПОВ, выделенных дериватографическим и биокинетическим способами для почв, отличающихся по гранулометрическому составу и условиям гумусообразования и установить, в какой мере термоустойчивость ПОВ характеризует его биологическую стабильность.
ОБЪЕКТЫ И МЕТОДЫ
Характеристика исследуемых почв. В исследованиях использовали образцы разных типов почв, отобранных под естественной растительностью и сельскохозяйственными культурами в лиственно-лесной, лесостепной, степной и сухостепной биоклиматических областях европейской части России. Почвенные образцы отбирали из верхнего гумусового горизонта из трех стенок почвенных разрезов, заложенных в учебных целях. Участки естественных угодий и пашни располагались в пределах одного района исследований. Свежеотобранные образцы сразу высушивали на открытом воздухе до воздушно-сухого состояния. Названия почв, сведения о месте отбора образцов, угодьях, содержании органического углерода (Cорг) и азота (Nобщ) в почвах и показатели гранулометрического состава представлены в табл. 1.
Таблица 1.
Места отбора образцов почв и их физико-химические свойства
| № образца | Слой, см | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | Cорг | Nобщ | CO2карбонатов | ЕКО, ммоль(экв) /100 г | Масса частиц, % | |
|---|---|---|---|---|---|---|---|---|
| % | >0.01 мм | <0.001 мм | ||||||
| Серая лесная почва (Luvic Greyzemic Phaeozems (Loamic)), мелколиственный лес (Тульская обл., Щекинский район) 53°9740′ N, 37°1801′ E | ||||||||
| 1 | 0–15 | 5.12 | 2.29 | 0.20 | 0 | 11.3 | 69.9 | 6.6 |
| Серая лесная почва (Luvic Greyzemic Phaeozems (Loamic, Aric)), пшеница (Тульская обл., Щекинский район) 53°9720′ N, 37°1782′ N | ||||||||
| 2 | 0–30 | 5.32 | 1.81 | 0.17 | 0 | 5.0 | 67.0 | 9.4 |
| Чернозем обыкновенный (Haplic Chernozems (Loamic, Pachic)), луговая степь (Воронежская обл., Таловский район) 51°0491′ N, 40°7234′ E | ||||||||
| 3 | 0–16 | 7.15 | 4.72 | 0.39 | 0.36 | 47.5 | 31.7 | 37.5 |
| Чернозем обыкновенный (Haplic Chernozems (Loamic, Aric, Pachic)), пшеница (Воронежская обл., Таловский район) 51°0476′ N, 40°7223′ E | ||||||||
| 4 | 0–23 | 6.95 | 3.56 | 0.35 | 0.27 | 50.0 | 29.7 | 40.9 |
| Луговая слитизированная почва (Pellic Vertisols (Gleyic, Humic)), пойменный луг (Волгоградская обл., Новоаннинский район) 50°5048′ N, 42°5614′ E | ||||||||
| 5 | 0–3 | 6.46 | 4.16 | 0.33 | 0.89 | 37.5 | 38.4 | 37.6 |
| 6 | 3–30 | 6.47 | 2.95 | 0.28 | 0.98 | 40.0 | 31.4 | 41.6 |
| Луговой солонец солончаковый мелкий (Endosalic Gleyic Solonetz (Loamic, Cutanic)), пойменный луг (Волгоградская обл., Новоаннинский район) 50°4972′ N, 42°5699′ E | ||||||||
| 7 | 0–8 | 7.69 | 1.95 | 0.16 | 1.43 | 32.5 | 42.9 | 33.4 |
| 8 | 8–17 | 7.68 | 1.77 | 0.16 | 1.78 | 32.5 | 39.2 | 39.4 |
| Лугово-каштановая почва (Gleyic Kastanozems (Loamic, Chromic)), пойменный луг (Волгоградская обл., Новоаннинский район) 50°5029′ N, 42°5820′ E | ||||||||
| 9 | 0–5 | 7.76 | 2.68 | 0.21 | 1.25 | 35.0 | 49.6 | 24.4 |
| Солонец степной мелкий на микроплакоре (Haplic Solonetz (Loamic, Albic)), степь (Волгоградская обл., Иловлинский район) 49°0994′ N, 44°0397′ E | ||||||||
| 10 | 0–4 | 7.14 | 2.82 | 0.23 | 1.43 | 12.5 | 62.1 | 15.9 |
| 11 | 4–26 | 7.62 | 1.04 | 0.10 | 1.07 | 12.5 | 57.9 | 30.9 |
| Каштановая солонцеватая почва (Luvic Kastanozems (Loamic, Endosalic, Protosodic)), степь (Волгоградская обл., Иловлинский район) 49°0978′ N, 44°0413′ E | ||||||||
| 12 | 0–8 | 7.70 | 2.34 | 0.20 | 1.25 | 30.0 | 55.12 | 26.7 |
| Лугово-болотная глеевая почва (Dystric Gleysols (Loamic, Humic)), пойменный луг (Волгоградская обл., Староахтубинский район) 48°6892′ N, 44°9124′ E | ||||||||
| 13 | 0–5 | 6.79 | 2.85 | 0.23 | 0.89 | 30.0 | 33.2 | 42.3 |
| 14 | 5–30 | 6.98 | 1.03 | 0.11 | 1.25 | 35.0 | 24.8 | 43.3 |
| Пойменная луговая почва (Eutric Fluvisols (Loamic, Humic, Oxyaquic)), пойменная дубрава (Волгоградская обл., Староахтубинский район) 48°6910′ N, 44°9068′ E | ||||||||
| 15 | 0–3 | 6.97 | 2.82 | 0.23 | 0.98 | 27.5 | 46.9 | 30.8 |
| 16 | 3–20 | 7.08 | 2.34 | 0.19 | 1.07 | 20.0 | 52.6 | 26.8 |
Дериватографический анализ почв. Дериватограф Q-1500D системы Паулик-Паулик-Эрдей (Венгрия) включает ячейку для дифференциального термического анализа) и термовесы для термогравиметрии. Ячейка для ДТА имеет регистратор разности температур (ΔT) исследуемого образца и эталона (Al2O3), а также регистратор температуры нагревания (T). Нагрев ячейки осуществляется с помощью программного регулятора нагрева, обеспечивающего заданную скорость нагрева и равномерность повышения температуры. Платиновые тигли с карманами для термопар заполняются почвой и эталоном. Термопары подключены к гальванометрам зеркального типа. Нагрев осуществляется с помощью печи. Регистрация сигналов происходит через соответствующие блоки и передается на компьютер [1].
В воздушно-сухих образцах почв удаляли видимые невооруженным глазом растительные остатки, после чего почву массой 5–10 г растирали в агатовой ступке до частиц <0.05 мм. Навески каждого образца почвы массой по 0.5 г помещали в платиновые тигли. Тигли закрывали крышками, потом устанавливали в ячейку прибора на торцы держателя образцов, накрывали кварцевым стаканом и помещали в печь. Скорость нагрева образца составляла 10 град/мин, конечная температура сжигания 1000°C. По полученным термограммам (рис. 1, рис. S1 ) производили разметку для вычисления относительной потери массы, соответствующей максимальной скорости термического разложения. На размеченной термограмме по кривой ДТГ отмечали начало процесса потери массы и его окончание (одностадийный процесс). На кривую ТГ переносили значения соответствующих температур начала (Тн) и завершения (Тк) стадии, после чего находили температурный интервал реакции (Тк – Тн). Термическое разложение органического вещества рассматривали как последовательность одностадийных процессов, отображаемых одиночными пиками. По кривой ДТА устанавливали характер пиков (экзотермический или эндотермический), рассчитывали ширину, высоту, площадь и экстраполированную точку начала процесса. Экзотермы или эндотермы с плохим разрешением объясняли наложением процессов термического разложения. Окисление продуктов термического распада дает ярко выраженный экзотермический пик [1]. По кривой ТГ определяли скорость термического разложения при заданной температуре или максимальную скорость разложения, соответствующую минимуму на кривой ДТГ, а также рассчитывали энергию активации термической деструкции (Еa) методом Райха–Фуосса, используя программное обеспечение Simulink пакета MathLab.
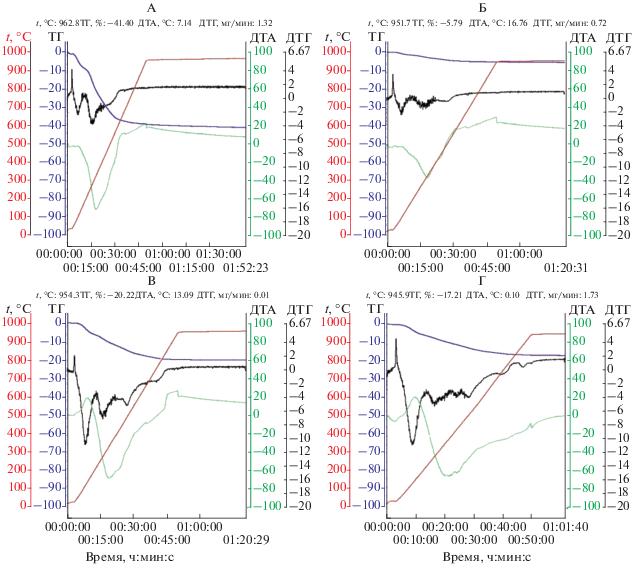
Рис. 1.
Термограммы образцов серой лесной почвы (А – почва под лесом, Б – пахотная почва) и обыкновенного чернозема (В – луговая степь, Г – пашня).
Определение минерализационной способности и биологической стабильности ПОВ. Потенциально-минерализуемое органическое вещество определяли путем инкубации образцов цельных почв при постоянных условиях температуры (22°C) и влажности (25 вес. %) с количественным учетом С–СО2 в течение 160–170 сут, как это описано в работе [6]. Масса инкубируемой почвы составляла 10 г. Инкубацию образцов проводили в стеклянных флаконах емкостью 100 мл. Повторность – трехкратная. Первое измерение концентрации С–СО2 в газовой фазе инкубируемых образцов проводили через 3–4 ч, а последующие – ежедневно в течение первой недели, затем три раза в неделю, в течение второго месяца инкубации – два раза в неделю, начиная с третьего месяца инкубации – один раз в неделю. После каждого измерения флаконы проветривали. Концентрацию C–СО2 определяли на газовом хроматографе (Кристалл Люкс 4000 М). Получали скорость потока (мг/100 г в сут), кумулятивную величину (мг/100 г) продуцирования С–СО2, содержание углерода активного (потенциально-минерализуемого) органического вещества в почве на момент начала инкубации, рассчитываемое по однокомпонентному уравнению кинетики первого порядка:
где Ct – кумулятивное количество С–СО2 (мг/100 г почвы) за время t, сут; С0 – содержание активного (потенциально минерализуемого) углерода, мг/100 г; k – константа скорости минерализации, сут–1.Кумулятивные кривые продуцирования С–СО2 представлены на рис. S2 . Биокинетические параметры C0 и k вычисляли методом нелинейной оценки программы Statistica. Биологическую стабильность ПОВ оценивали соответствующим индексом биологической стабильности (ИБС), значения которого устанавливаются по соотношению:
(2)
${\text{ИБС}} = {{\left( {{{C}_{{{\text{орг}}}}}--{{С}_{0}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{C}_{{{\text{орг}}}}}--{{С}_{0}}} \right)} {{{C}_{0}}}}} \right. \kern-0em} {{{C}_{0}}}}{\kern 1pt} .$Допускается, что чем шире отношение содержания углерода в устойчивом пуле к таковому в активном пуле, тем стабильнее органическое вещество в почве.
Определение физико-химических свойств почв. Содержание общего углерода и общего азота в образцах почв определяли с помощью СNHS-анализатора (Leco 932, USA). Вычитая содержание карбонатов из общего углерода, устанавливали содержание органического углерода (Cорг). Карбонаты в почве определяли ацидиметрическим методом, ЕКО – методом Бобко–Аскинази в модификации ЦИНАО, ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ – с помощью рН-метра (Sartorius Basic Meter PB-11, USA), гранулометрический состав – методом пипетки с обработкой пирофосфатом натрия [10, 11]. В табл. 1 приведено содержание частиц >0.01 и <0.001 мм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дериватографическое определение содержания и стабильности органического вещества в почвах. По полученным термограммам (рис. 1, рис. S1 ) определен компонентный состав исследуемого ряда почв. Твердая фаза гумусовых горизонтов почв на 82–96% представлена минеральной частью, а 3.3–13.3% массы приходится на органическую часть (табл. 2). Доля адсорбционно-связанной воды в почвах варьировала от 1.0 до 3.4% от массы воздушно-сухих образцов. Самое узкое соотношение минеральной массы к органическому веществу обнаруживалось в черноземе обыкновенном и в луговой слитизированной почве (от 5 до 8), а самое широкое – в пахотной серой лесной почве и в нижних слоях гумусового горизонта солонца степного и пойменной луговой почве (от 20 до 29). Разные соотношения между минеральной и органической частью в твердой фазе почв обусловлены, главным образом, варьированием содержания органического вещества. Если коэффициент вариации для минеральной части исследуемого ряда почв составлял 4%, то для органической части – 38%. Изменчивость минеральной части почвы была обусловлена, главным образом, содержанием физического песка (r = 0.750, P = 0.001), тогда как органической части – физической глины (r = 0.653, P = 0.006). Среди гранулометрических фракций, относящихся к физической глине, количество органического вещества достоверно коррелировало с процентом частиц <0.001 мм.
Таблица 2.
Компонентный состав зональных и интразональных почв
| № образца | Доля компонентов, % от массы | Отношение минеральной массы к органической | ||
|---|---|---|---|---|
| вода | минеральная часть | органическое вещество | ||
| 1 | 1.4 | 92.0 | 6.6 | 13.9 |
| 2 | 1.0 | 95.7 | 3.3 | 29.0 |
| 3 | 2.9 | 82.1 | 15.0 | 5.5 |
| 4 | 3.4 | 83.3 | 13.3 | 6.3 |
| 5 | 3.2 | 84.1 | 12.7 | 6.6 |
| 6 | 2.7 | 86.8 | 10.4 | 8.3 |
| 7 | 2.4 | 89.0 | 8.6 | 10.3 |
| 8 | 2.9 | 88.6 | 8.5 | 10.4 |
| 9 | 2.2 | 88.8 | 9.0 | 9.9 |
| 10 | 1.3 | 91.1 | 7.6 | 12.0 |
| 11 | 1.9 | 93.8 | 4.3 | 21.8 |
| 12 | 1.2 | 92.2 | 6.6 | 13.9 |
| 13 | 3.1 | 89.1 | 7.8 | 11.4 |
| 14 | 3.2 | 90.0 | 6.8 | 13.2 |
| 15 | 2.6 | 88.7 | 8.7 | 10.2 |
| 16 | 2.9 | 92.4 | 4.7 | 19.6 |
Примечание. Номера образцов почв см. табл. 1.
Регистрируемые дериватографом термические и термогравиметрические эффекты позволяют обнаружить характер и эффективность химических и физико-химических превращений в почвенном образце и вызываемые этими превращениями изменения массы образца. Суммарные потери массы почвы, возникающие при постепенном нагревании почвенного образца до 1000°C, складываются из испарения воды, сгорания органического вещества почвы и неидентифицированных потерь (табл. 3). Доля воды в термодеструкционных потерях составляла 14–30%, органического вещества – 49–83%, а неидентифицированного материала, представленного, по-видимому, карбонатами и слабосвязанными и непрочными фрагментами почвенных минералов – от 2 до 26%.
Таблица 3.
Состав термодеструкционных потерь при дериватографическом анализе разных почв
| № образца | Еа, кДж/г почвы | Органическое вещество | Вода | Неидентифицированные потери | |||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | 2 | ||
| 1 | 88.7 | 179–495 | 63.4 | 111 | 13.7 | >495 | 22.9 |
| 2 | 61.1 | 301–495 | 57.7 | 100 | 16.7 | >495 | 25.6 |
| 3 | 236.7 | 274–767 | 78.1 | 120 | 15.4 | >767 | 6.5 |
| 4 | 260.8 | 283–890 | 77.8 | 137 | 20.1 | >890 | 2.1 |
| 5 | 221.6 | 280–781 | 75.9 | 135 | 18.9 | >781 | 5.2 |
| 6 | 187.2 | 282–723 | 76.5 | 127 | 20 | >723 | 3.5 |
| 7 | 143.8 | 298–788 | 72.1 | 130 | 20.3 | >788 | 7.6 |
| 8 | 128.2 | 281–713 | 69.7 | 130 | 24 | >713 | 6.3 |
| 9 | 143.1 | 288–745 | 75.7 | 124 | 18.6 | >745 | 5.7 |
| 10 | 136.0 | 286–735 | 81.4 | 113 | 13.8 | >735 | 4.8 |
| 11 | 46.7 | 292–526 | 54.2 | 127 | 24.8 | >526 | 21 |
| 12 | 117.0 | 297–781 | 83.3 | 115 | 15.3 | >781 | 1.4 |
| 13 | 104.5 | 284–529 | 60.8 | 130 | 24.4 | >529 | 14.8 |
| 14 | 82.3 | 292–539 | 58.1 | 135 | 27.2 | >539 | 14.7 |
| 15 | 142.3 | 284–681 | 72.7 | 134 | 21.7 | >681 | 5.6 |
| 16 | 80.7 | 261–484 | 49 | 105 | 29.6 | >484 | 21.4 |
Примечание. Номера образцов см. табл. 1. 1 – температура деструкции, °C; 2 – % от термодеструкционных потерь.
Температура десорбции и испарения воды составляла в среднем 122°C, варьируя для разных почв от 98 до 137°C. Термическая деструкция органического вещества в почвах происходила в интервале температур от 177–301 до 484–890°C. Неидентифицрованные потери возникали при температуре выше 484–890°C. Чем выше была верхняя граница термодеструкции органического вещества, тем меньше вещества приходилось на неидентифицированные потери (r = –0.924, P < 0.001). В других исследованиях удаление воды из почвы наблюдалось при температуре от 25–40 до 150–220°C, термодеструкция органического вещества – от 180–200 до 550–700°C, а термическое разрушение отдельных минералов – преимущественно от 600–700 до 900–1000°C [4, 15, 16, 21, 26, 27, 31, 32, 35, 39, 44].
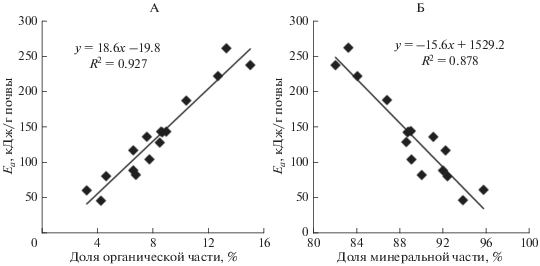
Минимальное количество тепловой энергии, необходимое для протекания химических и физико-химических реакций, определяется как энергия активации (Еа). Чем меньше значение Еа, тем выше скорость реакции, инициируемой повышением температуры, тем менее стабильным является вещество. Разложение сложного и гетерогенного по составу ПОВ осуществляется в несколько стадий, отличающихся по скорости, и, следовательно, энергией активации. Считается, что энергия, необходимая для всего процесса термодеструкции, контролируется самой медленной его стадией, требующей самой высокой энергии активации. Поэтому, величина энергии активации напрямую зависит как от количества компонентов, так и от прочности внутренних и внешних связей. Чем больше в почвенном образце органического вещества и меньше приходится на минеральную часть, тем выше величина энергии активации (рис. 2). С другой стороны, наличие обратной корреляции Еа с неидентифицированным веществом (r = –0.751, P = 0.001) и отсутствие достоверной связи с количеством органического вещества и воды в составе термодеструкционных потерь свидетельствует о том, что неидентифицированные потери вызваны преимущественно деструкцией некоторых почвенных минералов, и на эти процессы идут основные затраты тепловой энергии.
Рис. 2.
Зависимость величины энергии активации (Eа) от соотношения органической (А) и минеральной (Б) частей в образцах исследуемых почв.
Судя по величинам Еа, самая высокая термоустойчивость свойственна органическому веществу чернозема обыкновенного и луговой слитизированной почвы, а самая низкая, в 3.3 раза меньше, чем в черноземе – органическому веществу серой лесной почвы (табл. 3). Остальные типы почв образовывали промежуточную по термостойкости группу. В образцах из поверхностного слоя гумусового горизонта независимо от типа почв затраты энергии на окисление органического вещества были в 1.1–2.9 раз больше, чем в образцах из нижней части. Различия по величине Еа между слоями в пределах гумусового горизонта могли быть связаны с обогащенностью органического вещества поверхностного слоя термостойкими соединениями в составе фракции твердых дискретных частиц (POM), образованных при разложении растительных остатков. Как было показано ранее [8], в поверхностном слое гумусового горизонта этих почв масса POM вместе с гранулометрической фракцией песка была в 1.2–1.4 раза больше, чем в нижнем слое. Таким образом, величина энергии активации дает общее представление о термической стабильности ПОВ.
При анализе кривых ДТГ, полученных для исследуемого ряда почв, обнаруживается несколько пиков, указывающих на разную термочувствительность органических соединений, слагающих ПОВ. Известные классы органических соединений в зависимости от химического состава, присутствия алифатических и ароматических структур и других свойств, имеют разную чувствительность к термическим воздействиям, подразделяясь на две или три группы по термостойкости. Группу легкосгораемого углерода (300°C) образуют преимущественно алифатические соединения с карбоксильными группами, а трудносгораемого углерода (450°C) – ароматические соединения [39]. По данным термогравиметрии в сочетании с дифференциальной сканирующей калориметрией выделены три группы: лабильные органические вещества (200–380°C), главным образом, углеводы и другие алифатические соединения; устойчивые вещества (380–475°С), представленные лигнином и полифенолами; особо прочные вещества (475–650°С) в виде поликонденсированных ароматических форм, включая черный углерод [31]. Углеводы, пептиды, фенолы, мономеры лигнина и другие соединения легкой фракции (<2.0 г/см3), представленной частично разложившимися остатками растений, более термолабильны, чем те же соединения тяжелой фракции (>2.2 г/см3), а наибольшую стойкость демонстрируют органические соединения, связанные почвенными минералами [38]. Выбор температурных диапазонов, в которых предполагается, что ПОВ является термически стабильным или нестабильным, весьма условен, зависит от условий эксперимента и в каждом конкретном случае должен основываться на особенностях кривых ТГ или ДТГ [44].
Следовательно, природная термостойкость органических соединений может меняться в зависимости от вида стабилизации, которой они подвергаются в почве. Можно предположить, что простое по химическому составу и структуре соединение, но стабилизированное в почве, будет более термостабильным, чем более сложное с ароматической структурой, но химически или физически незащищенное. Поэтому дериватографический анализ ПОВ дает совокупное представление и о природе, и о защищенности органического вещества. Наибольшее число пиков на ДТГ-кривой, регистрируемое в образцах пахотного чернозема, обусловлено не столько широким спектром органических веществ в составе ПОВ, сколько разнообразием механизмов стабилизации органических соединений в почве (табл. 4). В низкотемпературной области с термолабильным органическим веществом в 15 из 16 образцов появлялся только один пик, тогда как в высокотемпературной области со стабильным органическим веществом в 7 образцах было по два пика, в 7 образцах по три пика, а в одном даже четыре пика. От 32 до 60% органического вещества в исследованном ряду почв может быть отнесено к термолабильному пулу, а от 40 до 68% – к термостабильному соответственно. Только в образце нижнего слоя гумусового горизонта лугово-болотной почвы термолабильный пул ПОВ был больше термостабильного, в двух образцах размеры пулов были примерно одинаковыми, а в остальных, особенно в черноземе, луговой слитизированной и каштановой солонцеватой почвах, в ПОВ доминировали термостабильные компоненты. В среднем для разных типов почв в термолабильном и термостабильном пулах содержалось 41 и 59% ПОВ. Можно заметить, что величины термолабильного пула органического вещества в серой лесной почве Тульской области (40–52%) оказались немногим выше размеров лабильного пула в серой лесной почве Московской области (32–42%), полученных с помощью изотопа 13С [3]. Можно допустить, что термической деструкции подвергается больше органического вещества, чем реально способного к обороту.
Таблица 4.
Соотношение термолабильного и термостабильного пулов в составе органического вещества разных почв
| № образца | Соотношение массы органического вещества к Сорг | Доля пулов, % от ПОВ | |
|---|---|---|---|
| термолабильный <390–400°C |
термостабильный >390–400°C |
||
| 1 | 2.88 | 40 (2) | 60 (2) |
| 2 | 1.83 | 52 (1) | 48 (2) |
| 3 | 3.18 | 34 (1) | 66 (3) |
| 4 | 3.73 | 33 (1) | 67 (4) |
| 5 | 3.06 | 36 (1) | 64 (3) |
| 6 | 3.53 | 42 (1) | 58 (3) |
| 7 | 4.42 | 35 (1) | 65 (3) |
| 8 | 4.81 | 40 (1) | 60 (3) |
| 9 | 3.36 | 37 (1) | 63 (3) |
| 10 | 2.70 | 32 (1) | 68 (2) |
| 11 | 4.13 | 51 (1) | 49 (1) |
| 12 | 2.78 | 34 (1) | 66 (2) |
| 13 | 2.73 | 48 (1) | 52 (2) |
| 14 | 6.58 | 60 (1) | 40 (2) |
| 15 | 3.08 | 38 (1) | 62 (3) |
| 16 | 2.01 | 45 (1) | 55 (2) |
| Минимум | 1.83 | 32 (1) | 40 (1) |
| Максимум | 6.58 | 60 (2) | 68 (4) |
| Среднее ± стандартное отклонение | 3.42 ± 1.16 | 41 ± 8 | 59 ± 8 |
Примечание. Номера образцов почв см. табл. 1. В скобках – количество пиков на термогравиметрической кривой.
Еще одной примечательной особенностью является широкая вариабельность отношений от 1.83 до 6.58 между массой органического вещества, полученной дериватографическим методом и содержанием Сорг, измеренным сухим сжиганием, хотя между этими показателями существовала достоверная корреляция (r = 0.836, P < 0.001). Поэтому использование общих для всех случаев коэффициентов пересчета Сорг в органическое вещество или в гумус не правомочно.
Биологическая стабильность органического вещества в разных почвах. Биологическая стабильность ПОВ определяется как устойчивость к разложению и минерализации микроорганизмами вследствие химической, физической и биологической стабилизации, поступающих в почву органических соединений. Органическое вещество в почве приобретает защищенность и стабильность в результате формирования гуминовых веществ и органо-минеральных комплексов, образования физических барьеров и пространственной недосягаемости при агрегации, исходной (приобретенной) прочности органических соединений, дезактивации ферментов, наличия дискомфортной экологической среды для микроорганизмов [9, 25, 41, 45, 46]. Доступное и потенциально-минерализуемое микроорганизмами органическое вещество считается биологически активным, а устойчивое и слаборазлагаемое – биологически стабильным [7]. Биологическая стабильность ПОВ количественно иллюстрируется тремя показателями: процентом активного органического вещества в общем его содержании, константой скорости минерализации и индексом биологической стабильности [6].
В гумусовом горизонте необрабатываемых зональных почв (серая лесная, чернозем обыкновенный, лугово-каштановая, каштановая солонцеватая) содержалось 92–131 мг/100 г углерода активного органического вещества (табл. 5). Для пахотных аналогов серой лесной почвы и обыкновенного чернозема характерно существенное обеднение гумусового горизонта активным органическим веществом. В интразональных почвах в поверхностном слое (от 0–2 до 0–8 см) гумусового горизонта содержалось в 1.4–4.9 раза больше активного органического вещества (108–212 мг/100 г), чем в смежных слоях на глубине до 15–30 см от дневной поверхности (23–119 мг/100 г). Как следует из этих данных, только от 1.9 до 7.5% от Сорг было биологически активным (табл. 5). Органическое вещество нижних слоев гумусовых горизонтов интразональных почв обладало меньшей минерализационной способностью, чем поверхностных слоев (2.2–5.1 и 4.0–7.5% от Сорг соответственно), а пахотных серой лесной почвы и чернозема, чем необрабатываемых аналогов (1.9–3.2 и 2.7–4.2% от Сорг соответственно).
Таблица 5.
Оценка стабильности органического вещества разных почв по биокинетическим параметрам
| № образца | Биологически активное органическое вещество | ИБС | ||
|---|---|---|---|---|
| мг/100 г | % от Сорг | k, сут–1 | ||
| 1 | 96 ± 0 | 4.2 | 0.031 ± 0.000 | 23 |
| 2 | 59 ± 2 | 3.2 | 0.034 ± 0.000 | 29 |
| 3 | 129 ± 1 | 2.7 | 0.031 ± 0.001 | 35 |
| 4 | 67 ± 0 | 1.9 | 0.043 ± 0.002 | 52 |
| 5 | 179 ± 4 | 4.3 | 0.020 ± 0.002 | 22 |
| 6 | 75 ± 1 | 2.5 | 0.039 ± 0.001 | 38 |
| 7 | 108 ± 2 | 5.5 | 0.020 ± 0.000 | 17 |
| 8 | 61 ± 3 | 3.4 | 0.017 ± 0.001 | 27 |
| 9 | 92 ± 1 | 3.4 | 0.023 ± 0.001 | 28 |
| 10 | 212 ± 4 | 7.5 | 0.022 ± 0.001 | 12 |
| 11 | 44 ± 1 | 4.2 | 0,020 ± 0.001 | 23 |
| 12 | 131 ± 3 | 5.5 | 0.013 ± 0.001 | 17 |
| 13 | 114 ± 2 | 4.0 | 0.027 ± 0.001 | 24 |
| 14 | 23 ± 1 | 2.2 | 0.039 ± 0.000 | 45 |
| 15 | 168 ± 1 | 6.0 | 0.023 ± 0.000 | 16 |
| 16 | 119 ± 1 | 5.1 | 0.023 ± 0.001 | 19 |
Константы скорости минерализации органического вещества в верхнем горизонте зональных и интразональных почв были одного и того же порядка (0.013–0.043 сут-1) и практически не зависели ни от свойств почв, ни от изменения землепользования. Это свидетельствует о том, что потенциально-минерализуемый пул органического вещества в зональных и интразональных почвах представлен примерно одним и тем же набором органических веществ, а некоторые различия между почвами по минерализуемости органического вещества обусловлены внешними и внутренними факторами, контролирующими доступность органических компонентов почвенным микроорганизмам и прочность стабилизации трансформируемых остатков биоты.
Определены индексы биологической стабильности (ИБС) почвенного органического вещества, которые показывают, во сколько раз количество устойчивого к минерализации углерода больше потенциально-минерализуемого. Значения ИБС уменьшались в следующем ряду почв: чернозем обыкновенный > луговая слитизированная = лугово-болотная > серая лесная = лугово-каштановая > луговой солонец > каштановая солонцеватая = солонец степной = пойменная луговая. Можно предположить, что повышенная биологическая стабильность органического вещества, например, в лугово-болотной почве обусловлена слабым нарастанием микробной биомассы в силу неблагоприятных для микроорганизмов условий питания и жизнедеятельности, а в черноземах – быстрой и полной стабилизацией микробной биомассы и продуктов разложения. Таким образом, определение потенциально-минерализуемого органического вещества путем длительного инкубирования почвенных образцов с количественным измерением выделяющегося С–СО2 является наиболее достоверным способом оценки биологической стабильности ПОВ. Несмотря на большие запасы органического вещества в почвах только небольшая его часть доступна для микроорганизмов и может быть минерализована за теплое время года.
Сравнение термической и биологической стабильности ПОВ. Допускается, что компоненты ПОВ, разрушаемые при относительно низких температурах сгорания, являются более доступными для микроорганизмов и пригодными для использования в качестве источника энергии и питания по сравнению с органическими веществами, которые разлагаются при более высоких температурах [2, 12, 34, 40]. Наибольшее соответствие термической стабильности органического вещества его биоразлагаемости проявляется в низкотемпературной зоне <350°С [34]. Термогравиметрически измеренные потери массы почв при температуре до 260°C положительно коррелировали с выделением CO2 при инкубации почвенных образцов [40]. Однако по уточненным данным существуют разные взаимосвязи между термической и биологической стабильностью ПОВ для образцов с низким и высоким содержанием Сорг в почве, что обусловлено развитием разных механизмов стабилизации органического вещества [33]. В других исследованиях показано, что количество сгоревшего органического вещества мало зависело от повышения температуры в интервале 200–400°C и не было сопоставимо ни с лабильными (POM), ни со стабильными фракциями (Mineral Associated Organic Matter) ПОВ [37]. В трех фракциях ПОВ с температурой деструкции в интервалах 190–310, 310–390 и 390–480°C среднее время существования (MRT) углерода было почти одинаковым (11.6, 12.2 и 15.4 года соответственно) и лишь в пуле ПОВ, разлагаемом при температуре 480–1000°C, составляло 163 года [21]. Следовательно, ПОВ может быть подразделяться на термолабильный и термостабильный пулы, но термическая лабильность и биоразлагаемость ПОВ мало связаны друг с другом. Показано также, что фракция ПОВ, устойчивая к термическому окислению при 300°C, содержала значительное количество “молодого” углерода, поступившего в почву из кукурузы, а термическое окисление при повышении температуры от 200 до 500°C было не пригодным для выделения фракций ПОВ, связанных с минералами [23].
В нашем исследовании не найдено достоверной корреляции энергии активации (Еа) соответственно с содержанием потенциально-минерализуемого органического вещества (С0), процентом С0 от Сорг, константой скорости минерализации, индексом биологической стабильности. Парадоксальным образом доля термостабильного пула положительно коррелировала с содержанием потенциально-минерализуемого органического вещества, тогда как связь с другими параметрами биологически активного пула, в том числе с ИБС, была недостоверной. Следовательно, тепловая энергия не идентична энергии ферментативных реакций в почве, а термическое окисление органического вещества – биологическому окислению, катализируемому ферментами. Термический и биокинетический способы анализа дают разные и не связанные между собой характеристики качества ПОВ и доминирующих механизмов его стабильности. Термолабильное органическое вещество включает в себя, по-видимому, компоненты активного и медленного пулов ПОВ, а термоустойчивое органическое вещество – медленного и пассивного пулов.
ЗАКЛЮЧЕНИЕ
Стабильность ПОВ является функцией физико-химических свойств почвы, биологической активности почвенных сообществ, факторов внешней среды и является одним из главных свойств ПОВ, обеспечивающих его длительную сохранность. Разные пути и механизмы стабилизации–дестабилизации органического вещества в почве придают ПОВ физическую, химическую и биологическую стабильность, оцениваемую соответствующими способами фракционирования.
Термические и термогравиметрические эффекты, происходящие при постепенном нагревании почвенного образца до 1000°C, дают представление о термической (термоокислительной) стабильности ПОВ и качественном составе слагающих его компонентов. По величине энергии активации, показывающей минимальное количество тепловой энергии, необходимой для протекания химических и физико-химических реакций, самая высокая термостойкость свойственна органическому веществу чернозема обыкновенного и луговой слитизированной почвы, а самая низкая – органическому веществу серой лесной почвы. Остальные типы почв образовывали промежуточную по термостойкости группу.
ПОВ, подверженное термодеструкции в низкотемпературной области (<390–400°C) относится к термолабильному, а окисляемое в высокотемпературной области (>390–400°C) – к термостабильному. В среднем для разных типов почв в термолабильном и в термостабильном пулах содержалось 41 и 59% органического вещества. На дифференциально-термогравиметрических кривых исследуемых почв обнаруживалось от двух до пяти пиков, что свидетельствует о гетерогенности ПОВ и разнообразии механизмов формирования термопрочности.
Интенсивность продуцирования С–СО2 является количественной и качественной характеристикой минерализационной способности ПОВ, а отношение устойчивого к минерализации органического вещества к потенциально-минерализуемому – мерой его биологической стабильности. Биологическая стабильность органического вещества уменьшалась в следующем ряду почв: чернозем обыкновенный > луговая слитизированная > > серая лесная > луговой солонец > пойменная луговая. Обеднение пахотных почв активным органическим веществом сопровождается увеличением доли стабильного, биологически консервативного органического вещества.
Термолабильность ПОВ не идентична его способности к биоразложению, а термический и биокинетический способы анализа дают разные и не связанные между собой характеристики качества ПОВ и доминирующих механизмов его стабильности.
Список литературы
Белопухов С.Л., Шнее Т.В., Дмитревская И.И., Маслова М.Д., Гришина Е.А., Калабашкина Е.В. Методические указания по проведению испытаний биологических образцов методом термического анализа. М.: Изд-во РГАУ-МСХА им. К.А. Тимирязева, 2014. 87 с.
Болатов А.А., Черников В.А., Лукин С.М. Дериватографический метод изучения гумусового состояния дерново-подзолистых супесчаных почв // Агрохимический вестник. 2010. № 3. С. 38–40.
Ларионова А.А., Золотарева Б.Н., Евдокимов И.В., Быховец С.С., Кузяков Я.В., Бюггер Ф. Идентификация лабильного и устойчивого пулов органического вещества в агросерой почве // Почвоведение. 2011. № 6. С. 685–698.
Макарова И.А., Лохова Н.А. Физико-химические методы исследования строительных материалов. Братск: Изд-во БрГУ, 2011. 139 с.
Семенов В.М., Когут Б.М. Почвенное органическое вещество. М.: ГЕОС, 2015. 233 с.
Семенов В.М., Когут Б.М., Зинякова Н.Б., Масютенко Н.П., Малюкова Л.С., Лебедева Т.Н., Тулина А.С. Биологически активное органическое вещество в почвах европейской части России // Почвоведение. 2018. № 4. С. 457–472. https://doi.org/10.7868/S0032180X1804007X
Семенов В.М., Кравченко И.К., Иванникова Л.А., Кузнецова Т.В., Семенова Н.А., Гисперт М., Пардини Дж. Экспериментальное определение активного органического вещества в некоторых почвах природных и сельскохозяйственных экосистем // Почвоведение. 2006. № 3. С. 282–292.
Семенов В.М., Лебедева Т.Н., Паутова Н.Б. Дисперсное органическое вещество в необрабатываемых и пахотных почвах // Почвоведение. 2019. № 4. С. 440–450. https://doi.org/10.1134/S0032180X19040130
Семенов В.М., Тулина А.С., Семенова Н.А., Иванникова Л.А. Гумификационные и негумификационные пути стабилизации органического вещества в почве (обзор) // Почвоведение. 2013. № 4. С. 393–407.
Теории и методы физики почв. Коллективная монография / Под ред. Е.В. Шеина и Л.О. Карпачевского. М.: Гриф и К, 2007. 616 с.
Теория и практика химического анализа почв / Под ред. Л.А. Воробьевой. М.: ГЕОС, 2006. 400 с.
Ускова Н.В., Черников В.А., Белопухов С.Л. Агроэкологическая оценка влияния длительного применения удобрений на гумусовое состояние дерново-подзолистой почвы // Известия ТСХА. 2018. Вып. 2. С. 18–33. https://doi.org/10.26897/0021-342X-2018-2-18-33
Холодов В.А., Фарходов Ю.Р., Жеребкер А.Я., Ярославцева Н.В. Оценка возможности применения аналитического двухстадийного пиролиза с хроматомасс-спектрометрией для изучения гуминовых веществ in situ // Бюл. Почв. ин-та им. В.В. Докучаева. 2018. Вып. 94. С. 3–18. https://doi.org/10.19047/0136-1694-2018-94-3-18
Чуков С.Н., Лодыгин Е.Д., Абакумов Е.В. Использование 13С ЯМР-спектроскопии в исследовании органического вещества почв (обзор) // Почвоведение. 2018. № 8. С. 952–964. https://doi.org/10.1134/S0032180X18080026
Шапченкова О.А., Анискина А.А., Лоскутов С.Р. Термический анализ органического вещества мерзлотных почв (Среднесибирское плоскогорье) // Почвоведение. 2011. № 4. С. 439–446.
Шапченкова О.А., Краснощеков Ю.Н., Лоскутов С.Р. Использование методов термического анализа для оценки органического вещества почв, пройденных пожарами // Почвоведение. 2011. № 6. С. 738–747.
Boguta P., Sokołowska Z., Skic K. Use of thermal analysis coupled with differential scanning calorimetry, quadrupole mass spectrometry and infrared spectroscopy (TG-DSC-QMS-FTIR) to monitor chemical properties and thermal stability of fulvic and humic acids // PLoS One. 2017. V. 12. P. e0189653. https://doi.org/10.1371/journal.pone.0189653
Cotrufo M.F., Soong J.L., Horton A.J., Campbell E.E., Haddix M.L., Wall D.H., Parton W.J. Formation of soil organic matter via biochemical and physical pathways of litter mass loss // Nature Geosci. 2015. V. 8. P. 776–779. https://doi.org/10.1038/NGEO2520
Cotrufo M.F., Wallenstein M.D., Boot C.M., Denef K., Paul E. The Microbial Efficiency-Matrix Stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: do labile plant in-puts form stable soil organic matter? // Global Change Biol. 2013. V. 19(4). P. 988–995. https://doi.org/10.1111/gcb.12113
Derenne S., Largeau C. A review of some important families of refractory macromolecules: composition, origin, and fate in soil and sediments // Soil Sci. 2001. V. 166(11). P. 833–847. https://doi.org/10.1097/00010694-200111000-00008
Dorodnikov M., Fangmeier A., Kuzyakov Y. Thermal stability of soil organic matter pools and their δ13C values after C3–C4 vegetation change // Soil Biol. Biochem. 2007. V. 39(5). P. 1173–1180. https://doi.org/10.1016/j.soilbio.2006.12.025
Guo F., Wu F., Mu Y., Hu Y., Zhao X., Meng W., Giesy J.P., Lin Y. Characterization of organic matter of plants from lakes by thermal analysis in a N2 atmosphere // Scientific Rep. 2016. V. 6(22877). https://doi.org/10.1038/srep22877
Helfrich M., Flessa H., Dreves A., Ludwig B. Is thermal oxidation at different temperatures suitable to isolate soil organic carbon fractions with different turnover? // J. Plant Nutr. Soil Sci. 2010. V. 173(1). P. 61–66. https://doi.org/10.1002/jpln.200700280
Kögel-Knabner I. The macromolecular organic composition of plant and microbial residues as inputs to soil organic matter // Soil Biol. Biochem. 2002. V. 34(2). P. 139–162. https://doi.org/10.1016/S0038-0717(01)00158-4
Kögel-Knabner I., Ekschmitt K., Flessa H., Guggenberger G., Matzner E., Marschner B., von Lützow M. An integrative approach of organic matter stabilization in temperate soils: Linking chemistry, physics, and biology // J. Plant Nutr. Soil Sci. 2008. V. 171(1). P. 5–13. https://doi.org/10.1002/jpln.200700215
Kucerik J., Demyan M.S., Siewert C. Practical application of thermogra-vimetry in soil science. Part 4. Relationship between clay, organic carbon and organic matter contents // J. Thermal Analysis and Calorimetry. 2016. V. 123. P. 2441–2450. https://doi.org/10.1007/s10973-015-5141-8
Kučerík J., Tokarski D., Demyan M.S., Merbach I., Siewert C. Linking soil organic matter thermal stability with contents of clay, bound water, organic carbon and nitrogen // Geoderma. 2018. V. 316. P. 38–46. https://doi.org/10.1016/j.geoderma.2017.12.001
Leinweber P., Jandl G., Baum C., Eckhardt K-U., Kandeler E. Stability and composition of soil organic matter control respiration and soil enzyme activities // Soil Biol. Biochem. 2008. V. 40(6). P. 1496–1505. https://doi.org/10.1016/j.soilbio.2008.01.003
Lichtfouse E., Chenu C., Baudin F., Leblond C., da Silva M., Béhar F., Derenne S., Largeau C., Wehrung P., Albrecht P. A novel pathway of soil organic matter formation by selective preservation of resistant straight-chain biopolymers: chemical and isotope evidence // Org. Geochem. 1998. V. 28(6). P. 411–415. https://doi.org/10.1016/S0146-6380(98)00005-9
Marschner B., Brodowski S., Dreves A., Gleixner G., Gude A., Grootes P.M., Hamer U., Heim A., Jandl G., Ji R., Kaiser K., Kalbitz K., Kramer C., Leinweber P., Rethemeyer J., Schäffer A., Schmidt M.W.I., Schwark L., Wiesenberg G.L.B. How relevant is recalcitrance for the stabilization of organic matter in soils? // J. Plant Nutr. Soil Sci. 2008. V. 171. P. 91–110. https://doi.org/10.1002/jpln.200700049
Merino A., Ferreiro A., Salgado J., Fontúrbel M.T., Barros N., Fernández C., Vega J.A. Use of thermal analysis and solid-state 13C CP-MAS NMR spectroscopy to diagnose organic matter quality in relation to burn severity in Atlantic soils // Geoderma. 2014. V. 226–227. P. 376–386. https://doi.org/10.1016/j.geoderma.2014.03.009
Oudghiri F., Allali N., Quiroga J.M., Rodriguez-Barroso M.R. TG–FTIR analysis on pyrolysis and combustion of marine sediment // Infrared Phys. Technol. 2016. V. 78. P. 268–274. https://doi.org/10.1016/j.infrared.2016.08.015
Peltre C., Fernández J.M., Craine J.M., Plante A.F. Relationships between Biological and Thermal Indices of Soil Organic Matter Stability Differ with Soil Organic Carbon Level // Soil Sci. Soc. Am. J. 2013. V. 77(6). P. 2020–2028. https://doi.org/10.2136/sssaj2013.02.0081
Plante A.F., Fernández J.M., Leifeld J. Application of thermal analysis techniques in soil science // Geoderma. 2009. V. 153(1–2). P. 1–10. https://doi.org/10.1016/j.geoderma.2009.08.016
Plante A.F., Fernández J.M., Haddix M.L., Steinweg J.M., Conant R.C. Biological, chemical and thermal indices of soil organic matter stability in four grassland soils // Soil Biol. Biochem. 2011. V. 43(5). P. 1051–1058. https://doi.org/10.1016/j.soilbio.2011.01.024
Sanderman J., Grandy A.S. Ramped thermal analysis for isolating biologically meaningful soil organic matter fractions with distinct residence times // Soil. 2020. V. 6. P. 131–144. https://doi.org/https://doi.org/10.5194/soil-6-131-2020
Schiedung M., Don A., Wordell-Dietrich P., Alcántara V., Kuner P., Guggenberger G. Thermal oxidation does not fractionate soil organic carbon with differing biological stabilities // J. Plant Nutr. Soil Sci. 2017. V. 180(1). P. 18–26.
Schulten H.R., Leinweber P. Thermal stability and composition of mineral-bound organic matter in density fractions of soil // Eur. J. Soil Sci. 1999. V. 50(2). P. 237–248. https://doi.org/10.1046/j.1365-2389.1999.00241.x
Siewert C. Investigation of the thermal and biological stability of soil organic matter. Berlin: Institute of ecology soil science department, 2001. 127 p.
Siewert C., Demyan M.S., Kučerík J. Interrelations between soil respiration and its thermal stability // J. Thermal Analysis Calorimetry. 2012. V. 110(1). P. 413–419. https://doi.org/10.1007/s10973-011-2099-z
Sollins P., Homann P., Caldwell B.A. Stabilization and destabilization of soil organic matter: mechanisms and controls // Geoderma. 1996. V. 74. P. 65–105. https://doi.org/10.1016/S0016-7061(96)00036-5
Tokarski D., Kučerík J., Kalbitz K., Demyan M.S., Merbach I., Barkusky D., Ruehlmann J., Siewert C. Contribution of organic amendments to soil organic matter detected by thermogravimetry // J. Plant Nutr. Soil Sci. 2018. V. 181(5). P. 664–674. https://doi.org/10.1002/jpln.201700537
Tokarski D., Wiesmeier M., Weissmannová H.D., Kal-bitz K., Demyan M.S., Kučerík J., Siewert C. Linking thermogravimetric data with soil organic carbon fractions // Geoderma. 2020. V. 362. P. 114–124. https://doi.org/10.1016/j.geoderma.2019.114124
Volkov D.S., Rogova O.B., Proskurnin M.A., Farkhodov Y.R., Mar-keeva L.B. Thermal stability of organic matter of typical chernozems under dif-ferent land uses // Soil Till. Res. 2020. V. 197(104500). https://doi.org/10.36291/HIT.2019.volkov.050
von Lützow M., Kögel-Knabner I., Ekschmitt K., Flessa H., Guggenberger G., Matzner E., Marschner B. SOM fractionation methods: Relevance to functional pools and to stabilization mechanisms // Soil Biol. Biochem. 2007. V. 39. P. 2183–2207. https://doi.org/10.1016/j.soilbio.2007.03.007
von Lützow M., Kögel-Knabner I., Ekschmitt K., Matzner E., Guggenberger G., Marschner B., Flessa H. Stabilization of organic matter in temperate soils: Mechanisms and their relevance under different soil conditions – a review // Eur. J. Soil Sci. 2006. V. 57. P. 426–445. https://doi.org/10.1111/j.1365-2389.2006.00809.x
Дополнительные материалы
- скачать ESM_1.docx
- Рис. S1. Термограммы образцов луговой слитизированной почвы (5 – 0-3 см, 6 – 3-30 см), лугового солонца (7 – 0-8 см, 8 – 8-17 см), лугово-каштановой почвы (9), солонца степного (10 – 0-4 см, 11 – 4-26 см), каштановой солонцеватой почвы (12), лугово-болотной почвы (13 – 0-5 см, 14 – 5-30 см), пойменной луговой почвы (15 – 0-3 см, 16 – 3-20 см).
- скачать ESM_2.docx
- Рис. 2S. Динамика кумулятивного выделения С-СО2 из образцов луговой слитизированной почвы (5 – 0-3 см, 6 – 3-30 см), лугового солонца (7 – 0-8 см, 8 – 8-17 см), лугово-каштановой почвы (9), солонца степного (10 – 0-4 см, 11 – 4-26 см), каштановой солонцеватой почвы (12), лугово-болотной почвы (13 – 0-5 см, 14 – 5-30 см), пойменной луговой почвы (15 – 0-3 см, 16 – 3-20 см) в течение длительной инкубации.


