Почвоведение, 2021, № 6, стр. 725-734
Качественные и количественные характеристики почвенного микробиома в зоне воздействия выбросов Кандалакшского алюминиевого завода
М. В. Корнейкова a, b, *, Д. А. Никитин c
a Российский университет дружбы народов
117198 Москва, ул. Миклухо-Маклая, 6, Россия
b Институт проблем промышленной экологии Севера – обособленное подразделение ФИЦ КНЦ РАН
184209 Апатиты, мкр. Академгородок, 14A, Россия
c Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, Россия
* E-mail: korneykova.maria@mail.ru
Поступила в редакцию 30.08.2020
После доработки 01.10.2020
Принята к публикации 27.10.2020
Аннотация
Проведена оценка величины биомассы прокариот и грибов методом люминесцентной микроскопии, определено содержание копий рибосомальных генов микроорганизмов методом реал-тайм ПЦР, изучено таксономическое разнообразие культивируемых микромицетов в Al–Fe-гумусовых подзолах на песчаной морене (Albic Podzols) на разном расстоянии от Кандалакшского алюминиевого завода, расположенного на Кольском полуострове. В почве всех участков наибольшее количество копий рибосомальных генов выявлено для бактерий (4.3 × 1010…10.3 × 1010 копий/г почвы). Для грибов и архей их количество изменялось в пределах 0.4 × 1010…3.1 × 1010 копий генов/г почвы. Отмечено существенное увеличение биомассы актиномицетов вблизи завода, тогда как биомасса бактерий и грибов практически не изменилась на разном расстоянии от источника выбросов. Мицелий и споры грибов преимущественно представлены мелкими формами диаметром 2–3 мкм. На сильнозагрязненном участке (8 км от завода) доля спор составила более половины суммарной биомассы грибов и количество крупных спор было максимальным (33.6%). Длина грибного мицелия изменялась от 92.3 до 206.3 м/г, при этом закономерностей в его распределении по градиенту загрязнения не выявлено. Отмечено сокращение разнообразия почвенных микромицетов на уровне родов и вышестоящих таксонов по градиенту загрязнения выбросами завода. Выявлена смена структуры сообществ с полидоминантной (фоновый участок) на монодоминантную (вблизи завода). Penicillium spinulosum доминировал на всех загрязненных участках в 15 км зоне. На фоновом участке, кроме вышеуказанного вида, к доминирующим относились Trichoderma koningii, P. implicatum и группа грибов со стерильным мицелием.
ВВЕДЕНИЕ
Благодаря уникальным конструкционным и эксплуатационным качествам цветных металлов во всем мире растет их добыча [14]. Однако значительная часть процесса производства данной продукции связана с повышенными экологическими рисками для окружающей среды [29]. Например, отмечается увеличение объемов промышленных выбросов в атмосферу от заводов, занимающихся добычей алюминия [36]. Наиболее токсичными для биоты соединениями данных газов признаны фторсодержащие вещества, в первую очередь фториды (HF, SiF4, NaF, Na3AlF6 и др.) [30]. Их генезис на предприятиях обусловлен применением электролитического способа производства алюминия из глинозема, в котором в качестве электролита используют расплав криолита и фторида алюминия [22].
Несмотря на то, что большая часть фторидов осаждается в радиусе 15 км от алюминиевых заводов, их мелкодисперсные и газообразные соединения могут переноситься на расстояние более 50 км, оказывая серьезный ущерб лесным биогеоценозам [39]. Кроме того, из-за промышленных выбросов заводов цветных металлов происходит существенное загрязнение почвы, являющейся основой существования и стабильности наземных экосистем [15]. Это приводит к отчуждению окрестных земель всех типов землепользования, нанося существенный экономический ущерб [36]. Для ограничения вредных выбросов алюминиевых заводов необходимо своевременно выявлять предельно допустимые концентрации загрязняющих веществ в окружающей среде, что, в свою очередь, возможно лишь при наличии дорогостоящего оборудования или грамотного применения методов биоиндикации [29].
Микроорганизмы – неотъемлемый компонент окружающей среды и типичные обитатели почвы [1]. В то же время микроорганизмы являются частью почвенной биоты, наиболее быстро реагирующей на разнообразные внешние воздействия, в том числе и наличие загрязнителей [18]. Изменения в численном и таксономическом составе прокариот и микобиоты могут служить индикатором состояния экосистем. Особое внимание в данном контексте стоит уделить микобиоте, поскольку микромицеты в значительной степени определяют здоровье почвы [34], а деятельность сапротрофных микроскопических грибов может приводить к улучшению почвенных свойств, связанных с ее плодородием [24].
Первые работы по изучению свойств почв, почвенной биоты и процессов трансформации органического вещества, находящихся в зоне воздействия Кандалакшского алюминиевого завода, проведены в период 2001–2005 гг. [2, 4]. В связи с тем, что в это время на заводе ввели в эксплуатацию новые газоочистные сооружения электролизного производства в 2011 г. были проведены повторные исследования с целью сравнения некоторых свойств почв и характеристик почвенной микробиоты [3]. Однако в проведенных работах изучали только культивируемую часть сообщества.
Цель работы – изучение биомассы и содержания рибосомальных генов прокариот и грибов, а также определение таксономического разнообразия культивируемых почвенных микромицетов в зоне воздействия выбросов Кандалакшского алюминиевого завода.
ОБЪЕКТЫ И МЕТОДЫ
Характеристика участков. Ранее проведено зонирование территории исследования по степени загрязнения почвы соединениями фтора и состоянию растительного покрова [3]. Выделены следующие зоны по градиенту (трансекте) загрязнения воздушными выбросами Кандалакшского алюминиевого завода: максимального загрязнения, распространяющаяся до 1.5 км от источника выбросов; сильного – до 8 км; умеренного – до 15 км и условно фоновый участок на расстоянии 50 км от завода (рис. 1).
Почвы на изучаемой территории представлены Al–Fe-гумусовыми подзолами (Albic Podzols) на моренных сильнозавалуненных песчаных отложениях. Мощность органогенного горизонта составляла 3–5 см. Загрязнение почв отразилось на морфологических признаках подстилок. Подстилка на максимально загрязненном участке имеет почти черную окраску. На площадках, расположенных в 8 и 15 км от завода, морфологические признаки загрязнения выражены в меньшей степени, а в образцах, взятых в 50 км, они отсутствуют [4]. Характеристика участков приведена в табл. 1.
Таблица 1.
Характеристика участков в зоне воздействия Кандалакшского алюминиевого завода
| Расстояние от завода, км | Степень загрязнения | Координаты | Растительность |
|---|---|---|---|
| 1.5 | Максимальная | 67°12′82″ N 32°25′58″ E |
Сосняк вороничный Древесный ярус: Pinussylvestris subsp. lapponica (Fries eh C. Hartm.) Holmb. Напочвенный покров: Empetrum hermaphroditum Hager. |
| 8 | Сильная | 67°15′16″ N 32°25′47″ E |
Сосняк брусничный сфагновый Древесный ярус: Pinussylvestris subsp. lapponica (Fries eh C. Hartm.) Holmb. Напочвенный покров: Empetrum hermaphroditum Hager., Vaccinium myrtillus L., Vaccinium vitis-idaea L., Ledum palustre L. |
| 15 | Умеренная | 67°18′43″ N 32°29′07″ E |
Сосняк брусничный сфагновый Древесный ярус: Pinussylvestris subsp. lapponica (Fries eh C. Hartm.) Holmb. Напочвенный покров: Empetrum hermaphroditum Hager., Vaccinium myrtillus L., Vaccinium vitis-idaea L., Ledum palustre L. Мхи: Pleurozium schreberi (Brid.) Mitt., Polytrichum commune Hedw., Sphagnum sp. |
| 50 | Отсутствует | 67°33′54″ N 32°10′91″ E |
Сосняк чернично-сфагновый Древесный ярус Pinussylvestris subsp. lapponica (Fries eh C. Hartm.) Holmb. Напочвенный покров Empetrum hermaphroditum Hager., Vaccinium myrtillus L., Vaccinium vitis-idaea L., Vaccinium uliginosum L. Лишайники: Cladonia rangiferina (L.) F.H. Wigg., Cladonia mitis Sandst., Cladonia cornuta (L.) Hoffm., Cetraria islandica (L.) Ach. Мхи: Pleurozium schreberi (Brid.) Mitt., Polytrichum commune Hedw., Sphagnum sp., Hylocomium splendens (Hedw.), Dicranum drummondii C. Muell. |
Отбор проб. Отбор почвенных образцов проводили на стационарных участках площадью 100 м2, расположенных в 1.5, 8, 15 и 50 км, из органогенного горизонта по стандартной методике отбора образцов для микробиологического анализа с возможными мерами по предотвращению контаминаций. Всего отобрано и проанализировано 80 почвенных образцов.
Численность клеток и биомассу прокариот определяли методом люминесцентной микроскопии (микроскоп Zeiss Axioskop 2 plus (Германия), объектив ×100, масляная иммерсия) с применением флуоресцеинового красителя акридиновый оранжевый. Десорбцию клеток с почвенных частиц проводили ультразвуком, используя прибор УДНЗ-1 (2 мин, 22 кГц, 0.44 А), приготовление препаратов осуществляли по стандартной методике [12, 13]. Из каждого образца готовили 6 препаратов, в каждом из которых подсчитывали клетки в 30 полях зрения.
Количество грибных пропагул и длину мицелия микобиоты определяли методом люминесцентной микроскопии (микроскоп Биомед 5ПР ЛЮМ (Россия), объектив ×40) с применением флуоресцентного красителя калькофлуор белый. Десорбцию клеток с почвенных частиц проводили вортексом MSV-3500 (Латвия) при скорости 3500 об./мин в течение 10 мин, а приготовление препаратов – по стандартной методике [13]. Из каждого образца готовили 3 препарата, на каждом из которых подсчитывали клетки в 90 полях зрения. Длину грибного и актиномицетного мицелия в грамме образца определяли по стандартной методике [13].
Количественную оценку содержания рибосомальных генов бактерий, архей и грибов осуществляли методом полимеразной цепной реакции (ПЦР) в реальном времени. Для учета архей и бактерий использовали праймеры на ген 16S рРНК, для учета грибов – на регион ITS. Реакцию проводили в амплификаторе Real-Time CFX96 Touch (“Bio-Rad”). Реакционную смесь готовили из препарата SuperMix Eva Green (“Bio-Rad”). В качестве количественных стандартов концентрации генов 16S рРНК для бактерий использовали растворы клонированных фрагментов рибосомального оперона штамма К12 Escherichia coli, для архей – штамма FG-07 Halobacterium salinarum, для грибов – штамма дрожжей Saccharomyces cerevisiae Meyen 1B-D1606. Для каждого образца реакцию проводили в трех повторностях. Концентрацию генов рассчитывали с помощью программного обеспечения CFX Manager. Количество генов в препаратах ДНК пересчитывали на грамм почвы с учетом разведений и массы навески.
Таксономическое разнообразие культивируемых микромицетов изучали на основе культурально-морфологических признаков (микроскоп Olympus CX41) с использованием современных определителей [17, 37]. Наименование видов и систематическое положение дано по базе данных: CABI Bioscience Databases (http://www.indexfungorum.org). Для ряда видов, выделенных в виде стерильного мицелия, идентификацию осуществляли на основании анализа участка рибосомальных генов ITS1–5.8S–ITS2 рДНК. Выделение ДНК проводили по методике, описанной ранее [20], но культуры подвергали трем циклам обработки, поскольку мицелиальные грибы более устойчивы к внешним воздействиям, чем дрожжи. Секвенирование участков ДНК проводили с помощью набора реактивов BigDye Terminator V. 3.1 Cycle Sequencing Kit (Applied Biosystems, USA) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130l Genetic Analyzer в научно-производственном центре “Синтол” (Москва).
Для характеристики разнообразия и структуры комплексов микромицетов использовали индексы Шеннона, Симпсона и Пиелу. Статистическую обработку данных осуществляли с применением пакетов прикладных программ Statistica 10.0 и Microsoft Excel 2007.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
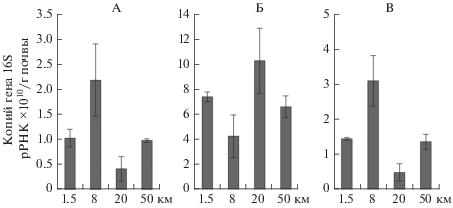
Численность копий рибосомальных генов 16S рРНК архей в зоне воздействия выбросов алюминиевого завода изменяется от 0.4 × 1010 в 15 км от завода до 2.2 × 1010 копий генов/г почвы в 8 км от предприятия по производству алюминия (рис. 2). Экологические особенности архей весьма плохо изучены [19]. В то же время уменьшение обилия архей в 15 км зоне предположительно можно связать с увеличением содержания железа и фосфора по сравнению с участком 8 км от завода, о чем свидетельствуют исследования, проведенные нами ранее [3]. Численность 16S рРНК бактерий в 2–5 раз больше, чем архей – 4.3 × × 1010…10.3 × 1010 копий генов/г почвы. Такое распределение характерно для большинства зональных, в том числе тундровых, типов почв [40]. В противоположность археям, на сильнозагрязненном участке число копий генов бактерий минимально, а на умеренно загрязненном – максимально. Численность рибосомальных генов ITS рРНК грибов соответствует по порядку для архей – от 0.5 × 1010 до 3.1 × 1010 копий генов/г почвы. Интересно отметить, что распределение численности копий генов архей и грибов для равноудаленных от источника загрязнения участках также сходны: средний уровень обилия на расстоянии 2 и 50 км; максимальный – на удалении в 8 км; минимальный – для дистанции 15 км от завода. Предполагаем, что на эти группы микроорганизмов в данной ситуации проявляется одинаковое воздействие экологических факторов. Поскольку распределение химических свойств изученных почв изменяется по градиенту в зависимости от степени удаления от предприятия [3, 4], определяющим фактором развития архей и грибов может являться растительность [16]. Так, наибольшее обилие архей и грибов в 8 км зоне может быть обусловлено, с одной стороны, присутствием брусники Vaccinium spp., с другой стороны отсутствием мхов и лишайников в зонах 15 и 50 км.
Рис. 2.
Количество копий генов архей (А), бактерий (Б) и микроскопических грибов (В) по градиенту загрязнения выбросами алюминиевого предприятия.
Микробная биомасса и ее структура. Методом прямого учета не выявлено существенной разницы в численности прокариот по градиенту загрязнения (табл. 2). На разных участках она изменялась от 10.8 × 107 до 15.7 × 107 кл./г почвы. Наибольшая численность отмечена на расстоянии 15 км от источника выбросов, наименьшая – в 8 км от завода. Диапазон колебаний значений биомассы прокариот в почве на разном расстоянии от завода также несущественен – от 2.3 до 3.6 × 10–3 мг/г почвы. Большие значения численности и биомассы прокариот на удаленных от завода участках можно объяснить увеличением разнообразия растительного покрова по градиенту загрязнения. С ростом количества таксонов растений экспоненциально увеличивается и число микроорганизмов в ризосферном блоке [24], что особенно ярко проявляется для относительно неплодородных северных регионов [5, 25].
Таблица 2.
Биомасса прокариот на различном расстоянии от источника загрязнения выбросами Кандалакшского алюминиевого завода
| Расстояние от завода, км | Общая численность прокариот, ×107 кл/г почвы | Биомасса прокариот, ×10–3 мг/г почвы | Длина актиномицетного мицелия, м/г | Биомасса актиномицетного мицелия, ×10–3 мг/г |
|---|---|---|---|---|
| 1.5 | 13.1 ± 2.9 | 2.6 ± 0.6 | 31.2 ± 6.9 | 1.2 ± 0.3 |
| 8 | 10.8 ± 2.4 | 2.3 ± 0.5 | 13.9 ± 3.1 | 0.5 ± 0.1 |
| 15 | 15.7 ± 3.5 | 3.6 ± 0.8 | 2.2 ± 0.5 | 0.08 ± 0.02 |
| 50 | 14.7 ± 3.2 | 3.1 ± 0.7 | 15.9 ± 3.6 | 0.08 ± 0.02 |
В то же время выявлено значительное увеличение длины и биомассы мицелия актиномицетов вблизи завода (зона 1.5 км) – 31.2 м/г почвы и 1.2 × × 10–3 мг/г соответственно, тогда как на фоновом участке (зона 50 км) они в 2 раза меньше – 16.0 и 0.6 × 10–3 мг/г. Данную закономерность можно объяснить значительной толерантностью группы актиномицетов к различным негативным факторам по сравнению с грибами или бактериями [6, 38]. Снижение активности конкурентных микроорганизмов позволило развиваться актиномицетам даже при наличии высокого количества загрязнителей. Наименьшую длину и биомассу актиномицетов отмечали на 15 км, она составила всего лишь 2.2 м/г почвы и 0.1 × 10–3 мг/г соответственно.
Не отмечено четкой тенденции изменения биомассы грибов на разном расстоянии от источника выбросов. Вблизи алюминиевого завода (до 2 км) биомасса грибов достигала наибольшего значения – 0.4 мг/г почвы (табл. 3), что можно связать с высокой устойчивостью отдельных таксонов микобиоты к токсичным металлам [23], а также с типом преобладающей растительности. На расстоянии 8 км от источника выбросов она оказалась наименьшей (0.3 мг/г почвы) даже по сравнению с более удаленными участками (0.2–0.31 мг/г почвы). Не исключено, что в 8 км зоне негативное воздействие фторидов на микобиоту снижается, и возрастает конкуренция различных групп грибов за ресурсы. Ранее нами выявлена тенденция к уменьшению биомассы почвенных микромицетов по градиенту загрязнения выбросами алюминиевого завода [3]. Однако в этих работах определение биомассы микроорганизмов проводили по методике [31] без разделения грибной биомассы на споры и мицелий, что отражает уровень физиологической активности микобиоты [12].
Таблица 3.
Биомасса грибов и ее структура на разном расстоянии от источника выбросов
| Расстоя-ние от завода, км | Мицелий (d = 3 мкм) | Споры (диаметр, мкм) | Общая биомасса спор, мг/г почвы | Суммарная биомасса грибов, мг/г почвы | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| биомасса, мг/г | длина, м | доля мицелия в общей биомассе, % | 2 | 3 | 5 | ||||||
| численность, ×105 шт./г | масса, ×10–2 мг/г | численность, ×104 шт./г | масса, мг/г | численность, ×103 шт./г |
масса, ×10–2 мг/г |
||||||
| 1.5 | 0.3 ± ± 0.1 | 206.3 ± ± 45.4 | 66.3 ± ± 13.9 | 1.31 ± ± 0.27 | 4.4 ± 0.7 | 5.3 ± 1.2 | 0.06 ± ± 0.01 | 3.5 ± 1.2 | 1.8 ± ± 0.5 | 0.13 ± ± 0.03 | 0.39 ± ± 0.08 |
| 8 | 0.12 ± ± 0.03 | 92.3 ± ± 20.3 | 48.7 ± ± 10.7 | 1.04 ± ± 0.23 | 3.5 ± 0.8 | 4.7 ± 1.0 | 0.05 ± ± 0.01 | 8.3 ± 2.8 | 4.5 ± ± 1.9 | 0.13 ± ± 0.03 | 0.25 ± ± 0.06 |
| 15 | 0.23 ± ± 0.05 | 180.6 ± ± 39.7 | 75.2 ± ± 16.5 | 1.01 ± ± 0.23 | 3.4 ± 0.7 | 2.4 ± 0.6 | 0.03 ± ± 0.01 | 3.12 ± 0.05 | 1.7 ± ± 0.3 | 0.08 ± ± 0.02 | 0.31 ± ± 0.07 |
| 50 | 0.17 ± ± 0.04 | 136.6 ± ± 30.1 | 59.8 ± ± 13.2 | 1.38 ± ± 0.30 | 4.6 ± 0.6 | 4.6 ± 1.0 | 0.05 ± ± 0.01 | 2.1 ± 0.5 | 1.1 ± ± 0.5 | 0.11 ± ± 0.02 | 0.28 ± ± 0.06 |
Длина грибного мицелия в исследованных почвах составила от 92.3 до 206.3 м/г почвы. Минимальное значение определено в почве участка, расположенного в 8 км от источника выбросов, а максимальное – вблизи завода. Более половины грибной биомассы (60–75%) приходилось на мицелий в почве всех участков, за исключением 8 км, где она составила 48%. В остальных почвенных образцах грибы, в основном, находились в виде спор, а доля грибного мицелия (где его обнаруживали) составляла от 22 до 31%. Развитие мицелия грибов обычно угнетено при снижении общей биомассы микобиоты [12], что отмечено и в данном исследовании.
Выявлено некоторое изменение морфологической структуры спор под воздействием выбросов завода, которое более ярко проявилось на расстоянии 8 км от источника загрязнения. Это может свидетельствовать об угнетающем воздействии комбината на комплексы почвенных грибов [23], так как в ненарушенных почвах северной тайги грибы находятся в основном в форме мицелия [26, 27].
Численность грибных спор изменялась от нескольких тысяч до нескольких сотен тысяч на грамм почвы, что на порядок меньше, чем для почв Большеземельской тундры [8]. Почти на всех участках более 97% спор представлено мелкими формами до 3 мкм, что в целом характерно для почв полярных регионов [10, 11], за исключением сильнозагрязненного участка, где доля мелких спор несколько меньше. Вклад крупных спор в общую биомассу составил 14.6, 33.6 и 21.5% для участков, расположенных в 1.5, 8 и 15 км соответственно. Наименьшая численность и биомасса крупных спор отмечена на фоновом участке.
Таксономическое разнообразие культивируемых микромицетов исследуемой территории представлено 31 видом, относящимся к 16 родам, 14 семействам, 13 порядкам, 9 классам и 2 отделам (табл. 4). Со всех участков выделено примерно одинаковое количество видов: 19, 22, 17 и 22 для 1.5, 8, 15 и 50 км соответственно. Однако на уровне таксонов более высокого уровня (род, семейство, порядок, класс) отмечена существенная разница. На участке 1.5 км от завода грибы принадлежали 8 родам, 9 семействам, 8 порядкам, 5 классам, тогда как на более удаленных участках количество таксонов увеличилось.
Таблица 4.
Таксономическое разнообразие комплексов микроскопических грибов по градиенту загрязнения выбросами алюминиевого завода
| Виды | Расстояние от завода, км | |||
|---|---|---|---|---|
| 1.5 | 8 | 15 | 50 | |
| Отдел Zygomycota Класс Incertae sedis Порядок Mucorales Семейство Mucoraceae | ||||
| Mucor hiemalis Wehmer | + | + | + | + |
| Mucor plumbeus Bonord. | + | |||
| Класс Mortierellomycetes Порядок Mortierellales Семейство Mortierellaceae | ||||
| Mortierella alpina Peyronel | + | + | ||
| Класс Incertae sedis Порядок Umbelopsidales Семейство Umbelopsidaceae | ||||
| Umbelopsis longicollis (Dixon-Stew.) Y.N. Wang, X.Y. Liu & R.Y. Zheng | + | + | ||
| Umbelopsis isabellina (Oudem.) W. Gams | + | + | + | |
| Отдел Ascomycota Класс Eurotiomycetes Порядок Eurotiales Семейство Aspergillaceae | ||||
| Penicillium aurantiogriseum Dierckx | + | + | ||
| P. corylophilum Dierckx | + | |||
| P. glabrum (Wehmer)Westling* | + | + | + | + |
| P. jensenii K.W. Zaleski | + | |||
| P. implicatum Biourge* | + | + | + | + |
| P. lividum Westling | + | + | ||
| P. miczynskii K.W. Zalesski* | + | + | + | |
| P. nalgiovense Laxa | + | |||
| P. restrictum J.C. Gilman & E.V. Abbott | + | + | ||
| P. raistrickii G. Sm. | + | + | + | + |
| P. simplicissimum (Oudem.) Thom | + | + | + | |
| P. spinulosum Thom* | + | + | + | + |
| P. thomii Maire* | + | + | + | |
| Talaromyces verruculosus (Peyronel) Samson, N. Yilmaz, Frisvad & Seifert* | + | + | + | + |
| Порядок Chaetothyriales Семейство Herpotrichiellaceae | ||||
| Exophiala jeanselmei (Langeron) McGinnis & A.A. Padhye | + | + | ||
| Класс Sordariomycetes Порядок Hypocreales Семейство Hypocreaceae | ||||
| Trichoderma koningii Oudem.* | + | + | + | + |
| T. polysporum (Link) Rifai | + | |||
| Порядок Microascales Семейство Microascaceae | ||||
| Wardomyces anomalus F.T. Brooks & Hansf. | + | + | ||
| Scopulariopsis brumptii Salv.-Duval | + | |||
| Порядок Hypocreales Семейство Incertae sedis | ||||
| Acremonium rutilum W.Gams | + | + | + | |
| Класс Dothideomycetes Порядок Pleosporales Семейство Torulaceae | ||||
| Torula allii (Harz) Sacc. | + | + | + | |
| Семейство Incertae sedis | ||||
| Acremonium felinum (Marchal) Kiyuna, K.D. An, R. Kigawa & Sugiy. | + | + | + | + |
| Класс Dothideomycetes Порядок Dothideales Семейство Saccotheciaceae | ||||
| Aureobasidium pullulans (de Bary & Löwenthal) G. Arnaud | + | + | + | + |
| Порядок Capnodiales Семейство Cladosporiaceae | ||||
| Amorphotheca resinae Parbery | + | + | + | |
| Cladosporium cladosporioides (Fresen.) G.A. de Vries | + | |||
| Класс Leotiomycetes Порядок Helotiales Семейство Sclerotiniaceae | ||||
| Botrytis cinerea Pers. | + | |||
| Класс Orbiliomycetes Порядок Orbiliales Семейство Orbiliaceae | ||||
| Arthrobotrys arthrobotryoides (Berl.) Lindau | + | |||
| Sterilia mycelia | + | + | + | |
На всех участках наибольшее количество видов принадлежало роду Penicillium. На максимально загрязненном участке 65% всех выделенных видов относилось к этому роду, тогда как на более удаленных участках лишь 30–40%. На удаленных участках отмечалось увеличение разнообразия микромицетов на уровне родов за счет появления грибов родов Mortierella, Umbelopsis, Acremonium, Wardomyces, Torula и др.
В видовом составе комплексов микроскопических грибов разных участков выявлены как сходства, так и отличия. Виды Penicillium corylophilum, P. jensenii, P. nalgiovense, Scopulariopsis brumptii выделены только в 1.5 км от источника выбросов; Mucor plumbeus, Trichoderma polysporum – исключительно на фоновом участке. Грибы, относящиеся к порядку Mucorales, являются типичными обитателями почв холодных и умеренно холодных регионов, многие из них известны как психротолеранты и олиготрофы [21]. Надо отметить их большое разнообразие и обилие в фоновых почвах. Виды рода Cladosporium, особенно C. cladosporioides и C. sphaerospermum – одни из наиболее широко распространенных в мире грибов [17]. Есть сведения, что они обычны в экстремально холодных местообитаниях, таких как почвы высокогорий, Арктики и Антарктики [11, 21, 35]. Кроме того, имеются данные о том, что C. cladosporioides может расти при –10°С [32].
Почва фоновой территории характеризуется большим видовым разнообразием микромицетов (Н = 3.7) по сравнению с почвой загрязненных участков (Н = 1.74) (табл. 5). Почти 50% видов, выделенных из контрольных почв, не были отмечены в почвах с высоким уровнем загрязнения. Видовое разнообразие микромицетов зоны максимального загрязнения уменьшается за счет сокращения всех групп грибов (доминирующих, часто встречающихся, редких и случайных), поскольку для этих почв свойственна нейтрализация кислотности и потеря структурности, обусловленная уменьшением содержания почвенного гумуса [4, 9].
Таблица 5.
Значения индексов разнообразия, выровненности и доминирования для комплексов почвенных микроскопических грибов по градиенту загрязнения выбросами алюминиевого завода
| Расстояние от завода, км | Индекс | ||
|---|---|---|---|
| Шеннона | Симпсона | Пиелу | |
| 1.5 | 1.74 | 0.53 | 0.49 |
| 8 | 2.26 | 0.4 | 0.64 |
| 15 | 2.14 | 0.38 | 0.52 |
| 50 | 3.7 | 0.11 | 0.86 |
Выявлено как сходство, так и различия в структуре комплексов микромицетов (рис. 3). Так, виды P. spinulosum доминировали на всех участках. Однако если на участках, расположенных в 1.5, 8 и 15 км от завода, грибы этого вида были абсолютными доминантами, то на фоновом участке к доминирующим также относились Trichoderma koningii, P. implicatum и группа грибов со стерильным мицелием. Необходимо отметить, что группу часто встречающихся видов грибов трех участков, расположенных ближе к заводу, составляли P. glabrum, P. miczynskii, Talaromyces verruculosus и группа грибов со стерильным мицелием с той лишь разницей, что P. miczynskii часто встречался только вблизи завода, а грибы со стерильным мицелием – на участках 8 и 15 км. Высокая степень обилия грибов со стерильным мицелием – распространенная ситуация для экстремальных местообитаний, в том числе для загрязненных территорий [7, 35].
Рис. 3.
Обилие микроскопических грибов по градиенту загрязнения выбросами алюминиевого завода: 1.5 (A), 8 (Б), 15 (В), 50 км от завода (Г). Представлены виды с наибольшим значением индекса обилия.

Отмечено изменение структуры доминирования в загрязненных почвах по сравнению с фоновыми. Как правило, структура ненарушенных природных сообществ полидоминантна. При антропогенном воздействии происходит “концентрация доминирования”, о чем свидетельствует индекс Симпсона (табл. 5). Значение показателя Симпсона, отражающего уменьшение числа видов-доминантов, в максимально загрязненной почве увеличивалось до 0.53, наименьшим оно было на участке 1.5 км – 0.11. Отмечается увеличение показателей индекса выравненности видов Пиелу по мере удаления от завода (0.49 – для загрязненного участка и 0.86 – для фонового участка).
Проанализировав изменения в видовом составе и структуре комплексов микроскопических грибов, можно выделить виды, чувствительные и устойчивые к выбросам алюминиевого предприятия. К первой группе можно отнести Mucor plumbeus, Mortierella alpina, Umbelopsis longicollis, Trichoderma polysporum; ко второй – Penicillium corylophilum, P. jensenii, P. nalgiovense, Exophiala jeanselmei, Scopulariopsis brumptii. Наибольшая чувствительность проявляется у видов, имеющих относительно узкий ареал обитания. Хотя для почв таких грибов установлено немного, именно такие виды целесообразно использовать как биоиндикаторы антропогенного воздействия. Виды с широким ареалом более устойчивы к загрязнению.
ЗАКЛЮЧЕНИЕ
Выбросы алюминиевого предприятия не оказали выраженного воздействия на сообщества бактерий: их численность вблизи завода, выявленная методом прямого счета, так и ПЦР реал-тайм, практически не отличалась от таковой на фоновом участке. В то время как численность, биомасса, длина мицелия актиномицетов существенно увеличились вблизи завода. Для микромицетов была выявлена тенденция к увеличению числа копий генов и биомассы по мере приближения к источнику выбросов.
Наиболее существенные изменения анализируемых параметров почвенных микробных сообществ по сравнению с фоновой территорией выявлены на сильнозагрязненном участке (8 км от завода). Здесь отмечено максимальное количество копий рибосомальных генов грибов и архей, минимальное – бактерий; самая низкая численность и биомасса прокариот и грибов. В структуре грибной биомассы прослеживается преобладание спор над мицелием, а также зафиксировано наибольшее количество крупных спор размером 5 мкм и более. Подобные результаты получены для культивируемых грибов аэробионтов в зоне воздействия выбросов алюминиевого завода [28].
Вероятно, выбросы завода оказывают наибольшее воздействие на культивируемую часть сообщества, что выражается в изменении видового состава и структуры сообществ микромицетов. Отмечена перестройка видовой структуры сообществ микромицетов вблизи завода, а также выявлены чувствительные и устойчивые виды микромицетов, которые можно считать биоиндикаторами на загрязнение почв выбросами алюминиевого предприятия.
Список литературы
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1087. https://doi.org/10.7868/S0032180X15090038
Евдокимова Г.А., Зенкова И.В. Почвенная биота сосновых лесов Кольского полуострова под воздействием выбросов предприятия алюминиевой промышленности // Почвоведение. 2003. № 8. С. 973–979.
Евдокимова Г.А., Корнейкова М.В., Мозгова Н.П. Изменения свойств почв и почвенной биоты в зоне воздействия аэротехногенных выбросов Кандалакшского алюминиевого завода // Почвоведение. 2013. № 10. С. 1274–1280. https://doi.org/10.7868/S0032180X13100031
Евдокимова Г.А., Переверзев В.Н. Влияние выбросов предприятия алюминиевой промышленности на загрязнение подстилок и водяники (Empetrum hermaphroditum Hager.) в сосновых лесах Кольского полуострова // Почвоведение. 2003. № 9. С. 1141–1146.
Евдокимова Г.А., Мозгова Н.П., Корнейкова М.В., Ахтулова Е.М., Михайлова И.В. Воздействие загрязнения почв дизельным топливом на растения и ризосферную микробиоту на Кольском Севере // Агрохимия. 2007. № 12. С. 49–55.
Зенова Г.М., Дуброва М.C., Звягинцев Д.Г. Структурно-функциональные особенности комплексов почвенных психротолерантных актиномицетов // Почвоведение. 2010. № 4. С. 482–487.
Власов Д.Ю., Зеленская М.С., Кирцидели И.Ю., Абакумов Е.В., Крыленков В.А., Лукин В.В. Грибы на природных и антропогенных субстратах в Западной антарктике // Микология и фитопатология. 2012. Т. 46. № 1. С. 20–26.
Ковалева В.А., Денева С.В., Панюков А.Н. Микробиологические показатели почвы постагрогенного биогеоценоза в тундровой зоне // Вестник Института биологии Коми НЦ УрО РАН. 2016. № 4(198). С. 2–9. https://doi.org/10.31140/j.vestnikib.2016.4(198).1
Лебедева Е.В. Микромицеты почв в окрестностях комбината цветной металлургии на Кольском полуострове // Микология и фитопатология. 1993. Т. 27. Вып. 1. С. 12–17.
Никитин Д.А., Марфенина О.Е., Кудинова А.Г., Лысак Л.В., Мергелов Н.С., Долгих А.В., Лупачев А.В. Микробная биомасса и биологическая активность почв и почвоподобных тел береговых оазисов Антарктиды // Почвоведение. 2017. № 9. С. 1122–1133.
Никитин Д.А., Семёнов М.В., Семиколенных А.А., Максимова И.А., Качалкин А.В., Иванова А.Е. Биомасса грибов и видовое разнообразие культивируемой микобиоты почв и субстратов о. Нортбрук (Земля Франца-Иосифа) // Микология и фитопатология. 2019 Т. 53. № 4. С. 210–222.
Полянская Л.М., Пинчук И.П., Степанов А.Л. Сравнительный анализ методов люминесцентной микроскопии и каскадной фильтрации для оценки численности и биомассы бактерий в почве: роль разведения почвенной суспензии // Почвоведение. 2017. № 10. С. 1216–1219. https://doi.org/10.7868/S0032180X17100082
Полянская Л.М., Звягинцев Д.Г. Содержание и структура микробной биомассы как показатели экологического состояния почв // Почвоведение. 2005. № 6. С. 706–714.
Korneykova M.V., Evdokimova G.A. Microbiota of the ground air layers in natural and industrial zones of the Kola Arctic // J. Environ. Sci. Health. Part A. 2018. V. 53 № 3. P. 271–277. https://doi.org/10.1080/10934529.2017.1397444
Bulei C., Todor M., Kiss I. Sustainable resource of raw materials: non-ferrous metals turned back into the economy as secondary raw materials. // Acta Techn. Corvininesis-Bull. Engin. 2019. № 12(4). P. 91–94.
Coleman D.C., Callaham M.A. Crossley Fundamentals of soil ecology. Academic press, 2017. 376 p.
Dommergues Y.R. Interactions between non-pathogenic soil microorganisms and plants. Elsevier, 2012. V. 4. 480 p.
Domsch K.H., Gams W., Anderson T.H. Compendium of Soil Fungi. IHW–Verlag, Eching, 2007.
Dutka B.J., Bitton G. Toxicity testing using microorganisms. CRC Press, 2019. V. 2.
Garrett R.A., Klenk H.P. (Eds.) Archaea: evolution, physiology, and molecular biology. John Wiley & Sons, 2008. 400 p.
Glushakova A.M., Kachalkin A.V., Chernov I.Y. Specific features of the dynamics of epiphytic and soil yeast communities in the thickets of Indian balsam on mucky gley soil // Eurasian Soil Sci. 2011. V. 44(8). P. 886–892. https://doi.org/10.1134/S1064229311080059
Hassan N., Rafiq M., Hayat M., Shah A.A., Hasan F. Psychrophilic and psychrotrophic fungi: a comprehensive review // Rev. Environ. Sci. Bio/Technol. 2016. V. 15. P. 147–72. https://doi.org/10.1007/s11157-016-9395-9
Haupin W.E. Principles of aluminum electrolysis // Essential Readings in Light Metals. Springer, Cham. 2016. P. 3–11. https://doi.org/10.1007/978-3-319-48156-2_1
Henderson L., Lilje E., Robinson K., Gleason F., Lilje O. Effects of toxic metals on chytrids, fungal-like organisms, and higher fungi // The Fungal Community: Its Organization and Role in the Ecosystem. 2017. № 16. 433 p.
Irawan B., Afandi A., Hadi S. Effects of saprophytic microfungi application on soil fertility based on their decomposition properties // J. Appl. Biol. Sci. 2017. № 2. P. 15–19.
Keuper F., Wild B., Kummu M., Beer C., Blume-Werry G., Fontaine S., Gavazov K., Gentsch N., Guggenberger G., Hugelius G., Jalava M. Rhizosphere priming doubles soil carbon loss from northern circumpolar permafrost area // Geophys. Res. Abs. V. 21. 2019.
Khabibullina F.M., Kuznetsova E.G., Vaseneva I.Z. Micromycetes in podzolic and bog-podzolic soils in the middle taiga subzone of northeastern European Russia // Eurasian Soil Sci. 2014. V. 47(10). P. 1027–1032. https://doi.org/10.1134/S1064229314100044
Korneikova M.V. Comparative analysis of the number and structure of the complexes of microscopic fungi in tundra and taiga soils in the north of the Kola Peninsula // Eurasian Soil Sci. 2018. V. 51(1). P. 89–95. https://doi.org/10.1134/S1064229318010106
Lyu Y., Zhang K., Chai F., Cheng T., Yang Q., Zheng Z., Li X. Atmospheric size-resolved trace elements in a city affected by non-ferrous metal smelting: Indications of respiratory deposition and health risk // Environ. Poll. 2017. P. 559–571. https://doi.org/10.1016/j.envpol.2017.02.039
Mahdi A., Jain A., Bhatnagar M., Bhatnagar R. Fluoride Toxicity // Food Toxicology. 2016. 355 p.
Olsen R.A., Hovland J. Fungal flora and activity in Norway spruce needle litter // Report. Department of Microbiology, Agricultural University of Norway, 1985. 41 p.
Onofri S., Selbmann L., Zucconi L., Pagano S. Antarctic microfungi as models for exobiology // Planetary and Space Sci. 2004. № 52. P. 229–237. https://doi.org/10.1016/j.pss.2003.08.019
Pathan S., Ceccherini M., Sunseri F., Lupini A. Rhizosphere as hotspot for plant-soil-microbe interaction // Carbon and Nitrogen Cycling in Soil. Springer. Singapore, 2020. P. 17–43. https://doi.org/10.1007/978-981-13-7264-3_2
Rao D.L.N., Aparna K., Mohanty S.R. Microbiology and biochemistry of soil organic matter, Carbon Sequestration and Soil Health // Ind. J. Fertil. 2019. V. 15. P. 124–138.
Robinson T., Singh D., Nigam P. Solid-state fermentation: a promising microbial technology for secondary metabolite production // Appl. Microbiol. Biotechnol. 2001. V. 55. № 3. C. 284–289. https://doi.org/10.1007/s002530000565
Saevarsdottir G., Kvande H., Welch B.J. Aluminum production in the times of climate change: the global challenge to reduce the carbon footprint and prevent carbon leakage // JOM. 2020. № 72. P. 296–308. https://doi.org/10.1007/s11837-019-03918-6
Seifert K., Morgan-Jones G., Gams W., Kendrick B. The genera of Hyphomycetes. Utrecht: CBS, Reus, 2011.
Singh S., Pandey S., Chaudhary H. Actinomycetes: tolerance against heavy metals and antibiotics // Int. J. BioAssays. 2014. V. 3. P. 3376–3383.
Vasil’chuk J.Y., Ivanova E.A., Krechetov P.P., Terskaya E.V. Heavy metals and fluorine in soils and plants of the Minusinsk Basin // International Congress on Soils of Urban, Industrial, Traffic, Mining and Military Areas. Springer, Cham. 2017. P. 232–239. https://doi.org/10.1007/978-3-319-89602-1_28
Zhelezova A., Chernov T., Tkhakakhova A., Xenofontova N., Semenov M., Kutovaya O. Prokaryotic community shifts during soil formation on sands in the tundra zone // PloS one. 2019. V. 14. https://doi.org/10.1371/journal.pone.0206777
Дополнительные материалы отсутствуют.