Почвоведение, 2021, № 6, стр. 735-746
Изотопный состав азота микробной биомассы почв альпийских и тундровых экосистем
М. И. Макаров a, *, М. С. Кадулин a, Т. И. Малышева a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: mmakarov@soil.msu.ru
Поступила в редакцию 23.10.2020
После доработки 26.10.2020
Принята к публикации 30.10.2020
Аннотация
Формирование изотопного состава азота микробной биомассы почв (δ15Nмикр) связано с процессами трансформации соединений азота, определяющими изотопный состав элемента в разных азотсодержащих соединениях, и с балансом доступности углерода и азота для микроорганизмов. Изучена зависимость δ15Nмикр от изотопного состава азота в субстрате (δ15N общего и экстрагируемого азота), а также зависимость δ15Nмикр и 15N-обогащения микробной биомассы (Δ15Nмикр = δ15Nмикр – δ15Nсубстр) от показателей доступности азота (соотношение C/N в почве, активность N-минерализации, концентрация экстрагируемого азота и эффективность использования азота) в почвах четырех экосистем альпийского пояса Северного Кавказа и четырех экосистем тундрового пояса Хибин. Показано, что величина δ15Nмикр варьирует от –0.2 до +8.4‰ и может характеризоваться как 15N-обогащением, так и обеднением (отрицательные значения Δ15Nмикр) относительно общего и экстрагируемого азота почвы. Как правило, Δ15Nмикр составляет 1.5–3.1‰ относительно Nобщ и 0.6–4.8‰ относительно Nэкстр. Однако в наиболее N-дефицитных условиях в почвах горно-тундровых лишайниковых и кустарничковых пустошей Nмикр не накапливает повышенное количество изотопа 15N. Величины δ15Nмикр и Δ15Nмикр не показали тесной связи с соотношением C/N. Гораздо лучше аккумуляция тяжелого изотопа азота в микробной биомассе связана с N-минерализацией (положительно) и эффективностью использования азота (отрицательно). Это свидетельствует о роли микробной диссимиляции азота в контролировании изотопного состава азота микробной биомассы почв.
ВВЕДЕНИЕ
Фракционирование изотопов азота (N) в биосфере происходит в результате дискриминации тяжелого изотопа 15N в большинстве процессов трансформации азотсодержащих соединений. Это позволяет использовать изотопный состав N почв и растений для интегральной характеристики азотного цикла [11, 27] и характеристики его отдельных процессов в экосистемах [2, 5, 9, 17]. Ключевым компонентом экосистем, ответственным за трансформацию органического вещества, контролирование соотношения минеральных и органических форм азота и доступности N для растений являются почвенные микроорганизмы. Однако данные по изотопному составу азота в них редки, поэтому использование этого показателя для характеристики азотного цикла и процессов трансформации азотсодержащих соединений в экосистемах не получило широкого распространения.
Наибольшего успеха в изучении закономерностей формирования изотопного состава азота микробной биомассы почв (δ15Nмикр) добились ученые из Университета Северной Аризоны [10, 13–15]. До этих исследований имелись сведения об обогащении изотопом 15N культур бактерий относительно аминокислоты, как единственного источника азота [21], а также плодовых тел и гифов эктомикоризных и сапротрофных грибов относительно органического вещества почв [18, 19, 29]. Однако именно в работах ученых из Аризоны было впервые показано, что общая микробная биомасса, как правило, является наиболее обогащенным изотопом 15N пулом азота в почве [13, 15]. Кроме того, они предложили модель, объясняющую варьирование 15N-обогащения микроорганизмов в зависимости от относительной доступности углерода и азота, что позволило характеризовать особенности процессов трансформации органического вещества в почвах на основе данных по изотопному составу углерода и азота почвенных микроорганизмов [10, 14].
В основе модели лежит давно сформировавшееся представление о том, что гетеротрофные организмы, выделяющие азот во внешнюю среду в ходе диссимиляции, обогащены тяжелым изотопом 15N относительно потребляемой пищи, так как его дискриминация при диссимиляции выше, чем при ассимиляции [12, 23, 25]. Соответственно, соотношение количеств элемента, вовлеченных в эти процессы обмена веществ, будет определять степень 15N-обогащения организма. При высокой доступности углерода и низкой азота (большое соотношение C/N в субстрате) микроорганизмы преимущественно ассимилируют азот и характеризуются относительно небольшими значениями δ15N, связанными с изотопным составом азота в основных его субстратах. В случае повышения доступности азота (уменьшение соотношения C/N в субстрате) его избыток удаляется из клеток преимущественно в виде 14N, и δ15N микроорганизмов возрастает. Эта модель была подтверждена при изучении большого разнообразия почв Аризоны, в частности, в почвах высотных и возрастных градиентов [10, 13, 14] и полупустынных почв с разным уровнем поступления навоза крупного рогатого скота [15]. В почвах возрастного градиента на Гавайях модель также нашла подтверждение [14].
После этих ярких работ появился ряд новых свидетельств, подтверждающих обогащенность изотопом 15N микробной биомассы почв [20, 22, 26, 30, 32], а также отдельных видов микроорганизмов при их культивировании на разных азотсодержащих средах [28, 33]. В единичных исследованиях предложенная модель была подтверждена в лабораторном инкубационном эксперименте с почвой [20] и при анализе почв разных систем землепользования [32].
Однако изученных в этом аспекте почв все еще немного, поэтому до конца неизвестно, насколько универсальна предложенная модель для контроля величины δ15Nмикр в разнообразных почвенных условиях. В связи с этим мы проверили гипотезу ассимиляции–диссимиляции, как важного механизма контроля δ15Nмикр, на примере двух градиентов доступности азота: в альпийском поясе Кавказа и тундровом поясе Хибин. В соответствии с этой гипотезой мы ожидали, что (1) азот микробной биомассы обогащен изотопом 15N по сравнению с другими пулами азота почв, и (2) величина 15N-обогащения зависит от относительной доступности углерода и азота для микроорганизмов (соотношения C/N в почве, активности N-минерализации и эффективности использования азота).
ОБЪЕКТЫ И МЕТОДЫ
Исследовали почвы вдоль двух градиентов, демонстрирующих выраженные различия процессов трансформации соединений азота и его доступности для организмов в зависимости от положения на геохимически сопряженных элементах мезорельефа.
Первый объект – это хорошо изученная катена в альпийском поясе Северного Кавказа на северо-восточных отрогах хребта Малая Хатипара в Тебердинском государственном природном биосферном заповеднике (Карачаево-Черкесская республика). Изучали почвы четырех биогеоценозов (альпийская лишайниковая пустошь (АЛП), гераниево-копеечниковый луг (ГКЛ), пестроовсяницевый луг (ПЛ) и альпийский ковер (АК)). АЛП занимает малоснежные участки на гребнях и выпуклых верхних частях склонов, ПЛ – среднюю часть склона с бóльшим снегонакоплением, ГКЛ расположен в нижней части склона и в западинах на склоне со значительным снегонакоплением, АК развит на многоснежных участках у подножия склона.
Горно-луговые почвы (Umbric Leptosols) этих экосистем были подробно охарактеризованы ранее, включая процессы трансформации соединений азота и его изотопный состав [3–6]. Они характеризуются высоким содержанием органического вещества и N. Преобладающей формой неорганических соединений азота является аммонийная (N–${\text{NH}}_{4}^{ + }$). Меньшие концентрации N–${\text{NH}}_{4}^{ + }$ и меньшие активности минерализации органических соединений азота характерны для почв АЛП и АК, занимающих крайние положения в геоморфологическом профиле. Соотношение C/N различается несильно, будучи несколько меньшим в почвах АЛП и ГКЛ, для которых характерно присутствие бобовых растений в составе фитоценозов [3, 6].
Второй объект – это катена в тундровом поясе Хибин на склоне горы Вудъяврчор (Ботанический цирк на территории Полярно-альпийского ботанического сада-института им. Н.А. Аврорина (Мурманская область)). Здесь также изучали почвы четырех биогеоценозов (кустарничково-лишайниковая пустошь (КЛП), кустарниковая пустошь (КП), злаковый луг (ЗЛ) и осоковый луг (ОЛ)). Почвы представлены сухоторфяно-подбуром иллювиально-гумусовым (Folic Leptosol) в КЛП, сухоторфяно-литоземом перегнойно-грубогумусовым (Folic Leptosol) в КП и литоземами перегнойно-темногумусовыми (Haplic Leptosols) в луговых экосистемах. Процессы трансформации соединений азота и его изотопный состав подробно охарактеризованы в наших недавних работах [1, 2]. Эти почвы резко различаются по содержанию экстрагируемых неорганических и органических соединений N. В почвах КЛП и КП экстрагируемый N представлен в основном органическими соединениями, концентрации N–${\text{NH}}_{4}^{ + }$ невелики, а азот нитратов (N–${\text{NO}}_{3}^{ - }$) содержится в следовых количествах. При переходе от почв пустошей к почвам лугов концентрации неорганических и органических соединений N возрастают в 36–62 раза и в 3–8 раз соответственно, и начинает преобладать N неорганических соединений, что полностью соответствует увеличению в десятки раз активностей N-минерализации и нитрификации. Соотношение C/N в поверхностных органогенных горизонтах составляет 21–30 и не демонстрирует четкой закономерности изменения в катене. В верхних минеральных горизонтах оно отличается в почвах пустошей (20.8–21.2) и лугов (14.0–15.9) [1].
Изучали поверхностный гумусово-аккумулятивный горизонт в почвах альпийских экосистем и два горизонта (поверхностный органогенный (TJ или O) и верхний минеральный (BFH или AH)) в почвах тундровых экосистем. Образцы почв отбирали в полиэтиленовые пакеты в пределах каждого фитоценоза в 8 повторностях в почвах альпийских экосистем и в 5 повторностях в почвах тундровых экосистем, замораживали не позднее 5 часов после отбора и хранили до выполнения анализов в замороженном состоянии.
Изотопный состав азота микробной биомассы почв характеризовали на основе определения величины δ15N хлороформ-лабильного азота, который используется для расчета азота микробной биомассы методом фумигации-экстракции [8]. Хотя фракция азота, экстрагируемая из фумигированных хлороформом почв, представляет лишь примерно половину от общего азота микробной биомассы, соответствие ее изотопного состава изотопному составу азота микробной биомассы убедительно обосновано в опубликованных работах [13, 14]. Экстракцию азота из исходных и фумигированных хлороформом образцов осуществляли с использованием 0.05 М K2SO4 вместо стандартного 0.5 М K2SO4. Ранее показано, что такое уменьшение концентрации соли не влияет существенно на экстрагируемость хлороформ-лабильного азота, но позволяет получать более воспроизводимые результаты изотопного анализа за счет большей концентрации азота в анализируемом образце – осадке после выпаривания экстракта K2SO4 [22].
Азот, экстрагируемый из нефумигированных (Nэкстр) и фумигированных (Nэкстр фум) образцов, концентрировали, выпаривая 10 мл экстракта в фарфоровой чашке на водяной бане при 60°С. Выпаренные соли гомогенизировали металлическим шпателем и растирали фарфоровым пестиком. Для изотопного анализа Nэкстр использовали 30–40 мг соли, а для анализа Nэкстр фум – 15–20 мг, в которых содержалось 20–60 мкг N.
Расчет δ15Nмикр проводили на основе изотопного масс-баланса с использованием данных о концентрациях и изотопном составе Nэкстр и Nэкстр фум:
После этого рассчитывали 15N-обогащение Nмикр относительно субстрата (Nобщ и Nэкстр):
Величины δ15Nэкстр и δ15Nэкстр фум определяли в Центре исследований и анализа стабильных изотопов Геттингенского университета на элементном анализаторе с масс-спектрометром Deltaplus. Результаты по концентрациям разных форм углерода и азота и N-минерализации взяты из опубликованных работ [1, 3, 4, 6] (табл. 1). Для характеристики абсолютной и относительной доступности азота, кроме обычно используемых соотношений Cобщ/Nобщ и Cэкстр/Nэкстр, N-минерализации, дополнительно использовали концентрации Nэкстр, Cэкстр и рассчитали доли Nэкстр от Nмикр, Cэкстр от Cмикр, а также эффективность использования азота (NUE – Nitrogen Use Efficiency), характеризующую распределение поглощаемого микроорганизмами азота между микробной биомассой и диссимиляцией в виде неорганических соединений [24]:
Таблица 1.
Содержание фракций C и N и N-минерализация в почвах горно-тундровых и альпийских экосистем, среднее ± стандартное отклонение (по [1, 3, 4, 6])
| Биогео-ценоз | Cобщ, % |
Cэкстр | Cмикр | Nобщ, % |
Nэкстр | Nмикр | N–${\text{NH}}_{4}^{ + }$ | N–NO3– | N-минера-лизация, мг N/кг в сутки |
|---|---|---|---|---|---|---|---|---|---|
| мг/кг | мг/кг | ||||||||
| Альпийские экосистемы, горизонт А | |||||||||
| АЛП | 11.0 ± 1.3 | 91 ± 20 | 1074 ± 185 | 0.97 ± 0.12 | 28.0 ± 7.3 | 120 ± 25 | 16.3 ± 4.8 | 2.2 ± 0.5 | 0.13 ± 0.02 |
| ПЛ | 10.3 ± 0.9 | 227 ± 43 | 1110 ± 126 | 0.79 ± 0.06 | 53.2 ± 10.3 | 94 ± 11 | 28.3 ± 9.5 | 1.0 ± 0.3 | 0.63 ± 0.16 |
| ГКЛ | 10.6 ± 2.1 | 189 ± 39 | 1016 ± 269 | 0.89 ± 0.17 | 77.4 ± 16.5 | 105 ± 38 | 49.7 ± 9.9 | 0.9 ± 0.3 | 1.07 ± 0.04 |
| АК | 11.8 ± 1.5 | 248 ± 59 | 1011 ± 377 | 0.88 ± 0.08 | 49.2 ± 17.3 | 86 ± 30 | 23.2 ± 10.1 | 1.0 ± 0.4 | 0.33 ± 0.05 |
| Горно-тундровые экосистемы, органогенный горизонт (ТJ или О) | |||||||||
| КЛП | 23.6 ± 5.2 | 166 ± 41 | 1015 ± 202 | 1.12 ± 0.20 | 11.7 ± 1.3 | 78 ± 25 | 1.8 ± 1.0 | 0.12 ± 0.00 | 0.35 ± 0.04 |
| КП | 32.2 ± 2.2 | 466 ± 106 | 3205 ± 316 | 1.23 ± 0.04 | 28.1 ± 8.6 | 285 ± 50 | 2.4 ± 3.3 | 0.22 ± 0.00 | 0.79 ± 0.12 |
| ЗЛ | 40.7 ± 2.6 | 1402 ± 333 | 3991 ± 869 | 1.38 ± 0.19 | 160 ± 26 | 357 ± 58 | 86 ± 16 | 0.96 ± 0.77 | 15.9 ± 1.1 |
| ОЛ | 36.0 ± 1.5 | 1290 ± 303 | 1765 ± 284 | 1.72 ± 0.21 | 197 ± 57 | 195 ± 51 | 113 ± 40 | 4.64 ± 2.94 | 14.9 ± 3.1 |
| Горно-тундровые экосистемы, верхний минеральный (органо-минеральный) горизонт (BH или AH) | |||||||||
| КЛП | 10.8 ± 4.3 | 101 ± 21 | 247 ± 113 | 0.50 ± 0.16 | 9.7 ± 0.9 | 23 ± 7 | 1.6 ± 1.0 | 0.11 ± 0.00 | 0.31 ± 0.03 |
| КП | 9.3 ± 2.2 | 124 ± 19 | 119 ± 20 | 0.43 ± 0.08 | 10.4 ± 2.7 | 14 ± 4 | 1.9 ± 0.7 | 0.11 ± 0.00 | 0.50 ± 0.05 |
| ЗЛ | 14.6 ± 4.6 | 248 ± 40 | 410 ± 86 | 0.91 ± 0.26 | 32.9 ± 7.1 | 35 ± 6 | 13.7 ± 3.8 | 2.72 ± 1.01 | 4.7 ± 0.7 |
| ОЛ | 11.0 ± 0.7 | 461 ± 41 | 131 ± 18 | 0.79 ± 0.04 | 39.7 ± 3.5 | 15 ± 3 | 7.7 ± 1.0 | 1.93 ± 0.43 | 3.8 ± 0.5 |
Высокий показатель NUE свидетельствует о закреплении большей части поглощаемого микроорганизмами азота в составе биомассы и выделении в среду малого количества N в составе ${\text{NH}}_{4}^{ + }.$ Небольшое значение NUE, напротив, показывает, что значительная часть поглощаемого азота не закрепляется в биомассе микроорганизмов, а выделяется ими в виде N–${\text{NH}}_{4}^{ + }.$
Для проверки значимости влияния фактора “биогеоценоз” на изучаемые показатели использовали непараметрический тест Краскела–Уоллиса. Для оценки связи между величинами δ15Nмикр и δ15Nобщ, δ15Nэкстр, а также между δ15Nмикр, Δ15Nмикр-о и Δ15Nмикр-э, с одной стороны, и показателями доступности азота (Cобщ/Nобщ, Cэкстр/Nэкстр, доля Nэкстр от Nмикр, N-минерализация, NUE), с другой, использовали коэффициенты корреляции Спирмана.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Величина δ15Nмикр в изученных почвах варьирует от –0.2 до +8.4‰ (табл. 2). В гумусовых горизонтах почв альпийских экосистем она составляет 4.5–7.4‰. Близкие значения характерны для верхних минеральных горизонтов почв тундровых экосистем (4.9–8.4‰), но в органогенных горизонтах этих почв значения δ15Nмикр значительно меньше (от –0.2 до 2.5‰).
Таблица 2.
Показатели относительной доступности C и N для микроорганизмов, δ15N фракций азота и 15N-обогащение микробной биомассы (‰) в почвах горно-тундровых и альпийских экосистем, среднее ± стандартное отклонение
| Биогео-ценоз | Cобщ/Nобщ | Cэкстр/Nэкстр | Cмикр/Nмикр | Cэкстр, % от Смикр |
Nэкстр, % от Nмикр |
NUE | δ15Nобщ | δ15Nэкстр | δ15Nмикр | Δ15Nмикр-о | Δ15Nмикр-э |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Альпийские экосистемы, горизонт А | |||||||||||
| АЛП | 11.3 ± 0.8 | 3.3 ± 0.6 | 9.0 ± 1.0 | 9 ± 2 | 23 ± 4 | 0.87 ± 0.02 | 3.0 ± 0.4 | 3.9 ± 1.0 | 4.5 ± 1.2 | 1.5 ± 0.7 | 0.6 ± 1.0 |
| ПЛ | 13.0 ± 0.4 | 4.3 ± 0.7 | 11.8 ± 0.5 | 21 ± 3 | 59 ± 8 | 0.76 ± 0.04 | 4.4 ± 0.6 | 3.1 ± 0.9 | 6.8 ± 0.9 | 2.4 ± 0.9 | 3.7 ± 0.5 |
| ГКЛ | 12.0 ± 0.5 | 2.4 ± 0.3 | 9.7 ± 1.6 | 19 ± 7 | 74 ± 12 | 0.67 ± 0.06 | 4.6 ± 0.8 | 2.6 ± 0.4 | 7.4 ± 1.3 | 2.8 ± 1.1 | 4.8 ± 1.1 |
| АК | 13.4 ± 0.5 | 5.0 ± 1.2 | 11.8 ± 0.8 | 24 ± 8 | 57 ± 11 | 0.78 ± 0.09 | 4.2 ± 0.7 | 3.0 ± 2.2 | 6.6 ± 1.3 | 2.4 ± 1.0 | 4.3 ± 1.1 |
| Горно-тундровые экосистемы, органогенный горизонт (ТJ или О) | |||||||||||
| КЛП | 21.0 ± 1.1 | 14.2 ± 2.8 | 12.8 ± 1.2 | 16 ± 2 | 15 ± 2 | 0.97 ± 0.04 | 2.4 ± 1.4 | 2.8 ± 0.8 | 2.2 ± 1.3 | –0.2 ± 0.7 | –0.6 ± 0.6 |
| КП | 26.3 ± 2.0 | 16.6 ± 3.2 | 11.4 ± 1.5 | 15 ± 1 | 10 ± 2 | 0.99 ± 0.02 | –0.3 ± 0.8 | 1.3 ± 0.4 | 2.5 ± 1.1 | 2.8 ± 0.4 | 1.2 ± 0.9 |
| ЗЛ | 29.8 ± 3.8 | 8.8 ± 1.6 | 11.1 ± 1.4 | 35 ± 6 | 45 ± 8 | 0.80 ± 0.05 | –2.1 ± 0.9 | –1.5 ± 0.9 | –0.2 ± 0.8 | 1.9 ± 0.7 | 1.3 ± 1.0 |
| ОЛ | 21.1 ± 1.9 | 6.5 ± 1.3 | 9.3 ± 1.2 | 73 ± 5 | 101 ± 16 | 0.62 ± 0.08 | –1.7 ± 0.7 | –1.1 ± 0.7 | 1.0 ± 1.2 | 2.7 ± 0.9 | 2.1 ± 1.2 |
| Горно-тундровые экосистемы, верхний минеральный (органо-минеральный) горизонт (BH или AH) | |||||||||||
| КЛП | 20.8 ± 3.4 | 10.4 ± 1.8 | 10.8 ± 0.9 | 41 ± 8 | 42 ± 8 | 0.93 ± 0.03 | 4.6 ± 0.8 | 6.5 ± 0.4 | 4.9 ± 2.0 | 0.3 ± 1.3 | –1.6 ± 1.4 |
| КП | 21.2 ± 1.2 | 11.9 ± 1.9 | 9.1 ± 1.0 | 104 ± 25 | 74 ± 17 | 0.87 ± 0.08 | 5.4 ± 0.3 | 5.9 ± 0.7 | 5.2 ± 1.3 | –0.2 ± 1.1 | –0.7 ± 0.6 |
| ЗЛ | 15.9 ± 0.7 | 7.5 ± 0.4 | 11.7 ± 1.4 | 60 ± 8 | 94 ± 22 | 0.68 ± 0.05 | 5.3 ± 0.5 | 5.1 ± 1.1 | 8.4 ± 1.7 | 3.1 ± 1.0 | 3.3 ± 0.5 |
| ОЛ | 14.0 ± 0.2 | 11.6 ± 0.6 | 8.6 ± 1.1 | 352 ± 58 | 264 ± 45 | 0.61 ± 0.03 | 5.2 ± 0.1 | 6.2 ± 0.2 | 8.0 ± 1.1 | 2.8 ± 1.1 | 1.8 ± 1.1 |
Значения δ15Nмикр в гумусовых горизонтах хорошо согласуются с полученными ранее. Так, для горно-луговых альпийских почв опубликованы значения в диапазоне 6.3–7.2‰ [22]. В почвах хвойных и смешанных лесов в Австрии [26], хвойных посадок в Центральном Китае [32], а также травяных экосистем прерий в Канзасе [31] величина δ15Nмикр составила 4.7–5.9‰. Несколько большие значения (7–11‰) получены для пахотной лювисоли Франции [20] и для почв высотного градиента в Северной Аризоне [14].
Одновременно опубликованы и гораздо большие значения δ15Nмикр. В полупустынных почвах Аризоны с разным уровнем поступления навоза крупного рогатого скота величина составила 13–18‰ [13, 15], в пахотных почвах Центрального Китая – 12.4–15.9‰ [32], в серых лесных почвах, черноземах и каштановых почвах Русской равнины – 10.4–16.5‰ [22].
Небольшие значения δ15Nмикр (1.8–2.3‰), подобные полученным нами для органогенных горизонтов, также фиксировались, например, в почвах под травяными сообществами в Канзасе [30].
Азот микробной биомассы почв альпийских и тундровых экосистем в большинстве случаев характеризуется 15N-обогащением относительно Nобщ и Nэкстр (величина Δ15Nмикр-о составила 1.5–3.1‰, а Δ15Nмикр-э – 0.6–4.8‰). Вместе с тем, в гумусовых горизонтах почв КЛП и КП и в органогенном горизонте почвы КЛП горной тундры Хибин 15N-обогащение микробной биомассы относительно Nобщ практически отсутствует (Δ15Nмикр-о = = ‒0.2…+0.3‰), а относительно Nэкстр и вовсе характерно 15N-обеднение микробной биомассы (Δ15Nмикр-э = –0.6…–1.6‰).
В опубликованных работах Nмикр также, как правило, характеризуется 15N-обогащением. Так, в почвах Аризоны, формирующихся в разных биоклиматических условиях, 15N-обогащение составило в среднем 3.2‰ относительно Nобщ и 3.7‰ относительно Nэкстр [13]. Значения Δ15Nмикр, близкие к полученным нами в этой работе, наблюдались в горно-луговых почвах Тебердинского заповедника и ранее (2.3–2.4‰ относительно Nобщ и 1.2–3.7‰ относительно Nэкстр) [22].
Несколько большие величины 15N-обогащения микробной биомассы относительно Nобщ показаны для почв хвойных и смешанных лесов в Австрии (4–5‰) [26] и для почв Центрального Китая (1.8–6.8‰) [32]. Опубликованы и гораздо большие показатели 15N-обогащения микробной биомассы, которые были получены для очень контрастных почв. Например, очень большое обогащение (17‰) относительно Nобщ отмечено в тундровых почвах на севере Норвегии [7], но одновременно этот показатель составил до 10‰ в серых лесных почвах, черноземах и каштановых почвах Русской равнины. Относительно Nэкстр15N-обогащение микробной биомассы в этих почвах достигало 11.9–14.5‰ [22].
Вместе с тем микробная биомасса почвы не всегда характеризуется обогащением изотопом 15N относительно других пулов азота. Так, в пахотной лювисоли во Франции Nмикр не оказался 15N-обогащенным ни относительно Nобщ, ни относительно Nэкстр, и только в результате лабораторной инкубации почвы этот показатель достиг 2 и 3.5‰ относительно Nобщ, и Nэкстр соответственно [20].
В почвах под травяными сообществами в Канзасе разные исследователи обнаружили либо очень маленькое 15N-обогащение микробной биомассы относительно Nобщ (0.1–0.6‰) [31], либо установили как ее обеднение (–0.8…–1.4‰), так и обогащение (1.3–1.8‰) [30]. Относительно Nэкстр обогащение в обоих случаях было более выражено: 2.2–3.0‰ [31] и 0–3.5‰ [30].
Обогащение микроорганизмов изотопом 15N относительно субстрата было показано и при культивировании гриба (Saccharomyces cerevisiae), бактерии (Escherichia coli) и архей (Sulfolobus tokodaii и Halobacterium salinarum) на средах с казаминовыми кислотами в качестве источника азота. 15N-обогащение культур составило 3.6 ± 0.2, 0.6 ± 0.2 и 3.5 ± 0.7‰ для гриба, бактерии и архей соответственно. При этом индивидуальные аминокислоты микроорганизмов демонстрировали широкий диапазон 15N-обогащения (от –3.0 до 9.0‰) [33].
Большую величину δ15Nмикр и 15N-обогащение микробной биомассы почв связывают с большей дискриминацией изотопа 15N при диссимиляции азота, чем при его ассимиляции, и, следовательно, эти показатели должны быть связаны с вовлеченностью азота в процессы обмена веществ микроорганизмами [10, 13–15]. Вместе с тем на формирование величины δ15Nмикр оказывает влияние изотопный состав используемых микроорганизмами азотных субстратов, который может интегрально характеризоваться величинами δ15Nобщ и δ15Nэкстр, а более точно – величинами δ15N индивидуальных соединений, преимущественно поглощаемых микроорганизмами.
В частности, наличие положительной корреляции между δ15Nмикр и δ15Nобщ позволило авторам указать на прямое влияние источника азотного питания микроорганизмов на величину δ15Nмикр в почвах Центрального Китая [32]. Вместе с тем высказывалось мнение, что фракционирование изотопов в процессе поглощения и метаболизма азота микроорганизмами может существенно влиять на величину δ15Nмикр, и поэтому этот показатель вряд ли может надежно идентифицировать используемый микроорганизмами азотный субстрат в природных условиях [16].
В нашем случае показана прямая корреляция между δ15Nмикр и δ15Nобщ как для всей совокупности исследованных образцов альпийских и тундровых почв, так и для отдельных групп почвенных горизонтов (рис. 1). Таким образом, небольшие значения δ15Nмикр в органогенных горизонтах могут быть связаны с более легким изотопным составом азота субстрата, используемого микроорганизмами. Вместе с тем величина δ15Nмикр в органогенных горизонтах тундровых почв КЛП и КП, характеризующихся низкой доступностью азота, оказалась больше, чем в соответствующих горизонтах почв ЗЛ и ОЛ, активность N-минерализации в которых гораздо выше. Такой неожиданный результат может быть предположительно объяснен высокой долей мицелия грибов, образующих эрикоидную микоризу, в составе микробной биомассы органогенных горизонтов почв КЛП и КП. Известно, что в условиях низкой доступности азота микоризные грибы активно фракционируют изотопы азота, аккумулируя 15N в своем составе [16].
Рис. 1.
Соотношение между изотопным составом азота микробной биомассы и показателями изотопного состава других пулов азота почвы и доступности азота. Здесь и на рис. 2 и 3: сплошная линия тренда – для всей совокупности образцов; серые квадраты и штрихпунктирная линия тренда – для горизонта А альпийских почв; белый кружок и штриховая линия тренда – для органогенных горизонтов горно-тундровых почв; черный кружок и пунктирная линия тренда – для верхних минеральных горизонтов горно-тундровых почв. Показаны только статистически значимые коэффициенты аппроксимации (p < 0.05).
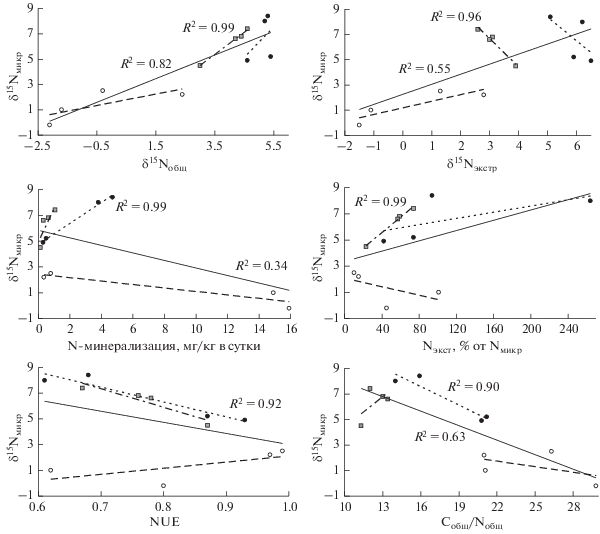
Нехарактерная закономерность формирования величины δ15Nмикр в органогенных горизонтах тундровых почв обусловливает снижение уровня ее взаимосвязи для всей совокупности изученных образцов почв с такими показателями доступности азота, как доля Nэкстр от Nмикр и NUE, а взаимосвязь с N-минерализацией не прямая, а обратная. При этом в минеральных горизонтах почв как альпийских, так и тундровых экосистем эти взаимосвязи гораздо более тесные (рис. 1). Это соответствует меньшим значениям δ15Nмикр в почвах АЛП, КЛП и КП, характеризующихся низкими показателями доступности азота. Величина δ15Nмикр отрицательно связана с соотношением Cобщ/Nобщ, что соответствует снижению накопления изотопа 15N в микроорганизмах на бедных азотом субстратах.
Положительная связь между δ15Nмикр и δ15Nэкстр заметно слабее, а в пределах групп верхних минеральных горизонтов она и вовсе отрицательная. Этот результат подтверждает мнение о том, что интегральная характеристика азотного цикла, как правило, хорошо отражается в изотопных данных через величину δ15Nобщ, тогда как характеристика отдельных процессов по изотопным показателям более лабильных пулов почвенного азота в природных условиях является не таким простым вопросом [11, 27]. Например, разница в величине δ15N разных фракций лабильного азота в изученных почвах может превышать 10–20‰ [2, 5], при этом неизвестно, какие из них преимущественно поглощаются микроорганизмами в конкретных почвенных условиях.
Связь между δ15Nмикр, изотопным составом азота субстрата и активностью диссимиляции азота может быть не всегда очевидной и в связи с тем, что эффект от физиологического фракционирования изотопов и от изотопного состава субстрата может быть как однонаправленным, так и частично компенсирующим. Так, при низкой доступности азота характерно небольшое фракционирование изотопов в процессах ассимиляции-диссимиляции, и одновременно небольшое фракционирование при поглощении ограниченного ресурса. В результате величина δ15Nмикр оказывается приближенной к δ15N основных источников азота. В случае же высокой доступности азота, с одной стороны, происходит сильное фракционирование изотопов в процессах ассимиляции–диссимиляции, приводящее к росту величины δ15Nмикр, но с другой, повышается и фракционирование при поглощении азота, когда преимущественно поглощается изотоп 14N, компенсируя увеличение δ15Nмикр. Такой эффект, возможно, проявляется в органических горизонтах почв горно-тундровых лугов (ЗЛ и ОЛ), для которых характерны высокие показатели N-минерализации и содержания неорганических соединений азота, но величина δ15Nмикр при этом меньше, чем в органических горизонтах почв КЛП и КП (табл. 2).
15N-обогащение микробной биомассы в почвах альпийских и тундровых экосистем относительно Nобщ и Nэкстр демонстрирует, как хорошее, так и гораздо меньшее соответствие известным закономерностям, к которым относятся, прежде всего, обратная связь с соотношениями Cобщ/Nобщ и Cэкстр/Nэкстр [10, 14, 30, 32] и прямая – с активностью N-минерализации [14]. Первая взаимосвязь в исследованных нами почвах оказалась неубедительной, продемонстрировав для всей совокупности изученных образцов лишь слабую тенденцию (статистически значимая связь только между Δ15Nмикр-э и Cэкстр/Nэкстр) (рис. 2 и 3). Наиболее выраженной она оказалась для минеральных горизонтов почв горно-тундровых экосистем. Таким образом, в отличие от хорошо выраженной отрицательной связи между соотношением Cобщ/Nобщ и δ15Nмикр, подобная взаимосвязь с Δ15Nмикр-о и Δ15Nмикр-э не прослеживается ввиду относительной обогащенности азотом органического вещества в почве АЛП, характеризующейся низкой доступностью азота, и отсутствия взаимосвязи в органических горизонтах тундровых почв.
Рис. 2.
Соотношение между 15N-обогащением микробной биомассы относительно общего азота почвы и показателями доступности азота и углерода.
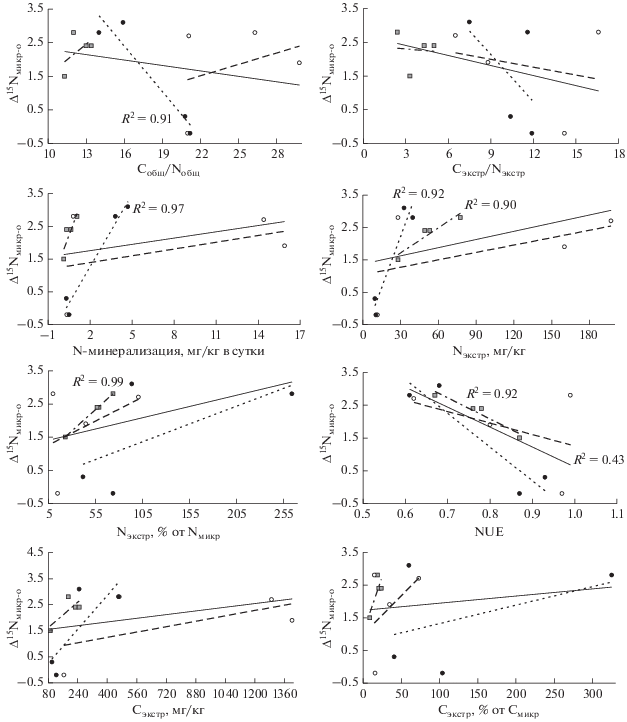
Рис. 3.
Соотношение между 15N-обогащением микробной биомассы относительно экстрагируемого азота почвы и показателями доступности азота и углерода.
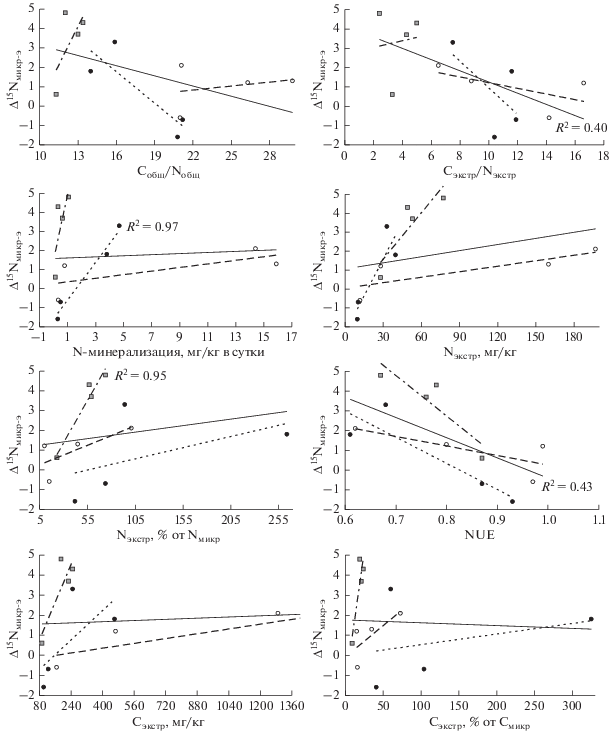
Прямая взаимосвязь Δ15Nмикр-о и Δ15Nмикр-э с N‑минерализацией выражена лучше, особенно в минеральных горизонтах. Прямая связь наблюдается также между 15N-обогащением микробной биомассы и абсолютной и относительной концентрациями Nэкстр, а обратная связывает 15N-обогащение с NUE. Таким образом, все показатели, отражающие активность диссимиляции азота микроорганизмами, взаимосвязаны с 15N-обогащением микробной биомассы. Полученный результат подтверждает действенность ранее предложенного механизма контроля изотопного состава микробной биомассы в почве, связанного с варьированием относительной доступности углерода и азота для микробного питания, определяющей уровень диссимиляции азота микроорганизмами [10, 14]. Этой гипотезе соответствуют и результаты полевого эксперимента с удобрением травяных экосистем в Канзасе, где 15N-обогащение микробной биомассы почв при внесении азотных удобрений значимо превышало этот показатель в почвах без удобрений, а также было связано положительно с количеством неорганического азота и отрицательно – с соотношением C/N [30].
Диссимиляционная гипотеза 15N-обогащения микробной биомассы была недавно подтверждена и при культивировании Aspergillus oryzae на пяти средах с разным соотношением C/N (от 5 до 100) с использованием глицина в качестве единственного источника азота. Интенсивное выделение ${\text{NH}}_{4}^{ + },$ обедненного изотопом 15N, при выращивании A. oryzae на средах с соотношением C/N < 30 сопровождалось увеличением δ15Nмикр. На средах с C/N >30 азот закреплялся в биомассе A. oryzae, а величина δ15Nмикр при этом не менялась более чем на 1‰. Между 15N-обогащением Nмикр относительно глицина и NUE, как и соотношением C/N в субстрате, наблюдалась отрицательная корреляция [28].
В отличие от показателей доступности азота, которые являются хорошими предикторами δ15Nмикр и 15N-обогащения микробной биомассы, и от соотношений C/N в почве и экстрагируемых компонентах, которые косвенно характеризуют относительную доступность углерода и азота и в меньшей степени определяют значения 15N-обогащения, показатели доступности углерода (Cэкстр и доля Cэкстр от Cмикр) не демонстрируют ожидаемой связи с показателями изотопного состава микробной биомассы (рис. 2 и 3). Высокая доступность углерода должна способствовать большей ассимиляции и меньшей диссимиляции азота и приводить к небольшим значениям δ15Nмикр и 15N-обогащения. Однако в исследованных почвах концентрации экстрагируемых углерода и азота положительно взаимосвязаны (R2 = 0.84, p < 0.001). В результате показатели доступности углерода оказываются положительно связанными с показателями изотопного состава микробной биомассы. Положительная связь между 15N-обогащением микробной биомассы и концентрацией Cэкстр характерна также для почв травяных экосистем в Канзасе [30]. Нам известна только одна работа [15], в которой показана отрицательная связь между 15N-обогащением микробной биомассы относительно экстрагируемого азота и концентрацией экстрагируемого углерода.
ЗАКЛЮЧЕНИЕ
Микробная биомасса почв альпийских и горно-тундровых экосистем в большинстве случаев обогащена изотопом 15N относительно общего и экстрагируемого азота. Степень обогащения связана с активностью диссимиляции азота микроорганизмами, зависящей от доступности ресурса. Показателями такой доступности являются абсолютная и относительная концентрации экстрагируемого азота, активность N-минерализации и эффективность использования азота микроорганизмами. В то же время соотношения C/N в почве и экстрагируемых соединениях не всегда являются надежными показателями, определяющими 15N-обогащение микробной биомассы почв, а абсолютная и относительная концентрации экстрагируемого углерода не являются показателями высокой доступности углерода и низкой – азота.
Список литературы
Бузин И.С., Макаров М.И., Малышева Т.И., Кадулин М.С., Королева Н.Е., Маслов М.Н. Трансформация соединений азота в почвах горно-тундровых экосистем Хибин // Почвоведение. 2019. № 5. С. 570–577.
Макаров М.И., Бузин И.С., Тиунов А.В., Малышева Т.И., Кадулин М.С., Королева Н.Е. Изотопный состав азота в почвах и растениях горно-тундровых экосистем Хибин // Почвоведение. 2019. № 10. С. 1185–1197.
Макаров М.И., Лавренов Н.Г., Онипченко В.Г., Тиунов А.В., Малышева Т.И., Сабирова Р.В. Азотное питание растений альпийской лишайниковой пустоши в условиях обогащения почвы элементами минерального питания // Экология. 2020. № 2. С. 83–89.
Макаров М.И., Леошкина Н.А., Ермак А.А., Малышева Т.И. Сезонная динамика минеральных форм азота в горно-луговых альпийских почвах // Почвоведение. 2010. № 8. С. 969–978.
Макаров М.И., Малышева Т.И., Меняйло О.В. Изотопный состав азота и трансформация азотсодержащих соединений в горно-луговых альпийских почвах // Почвоведение. 2019. № 9. С. 1039–1048.
Макаров М.И., Онипченко В.Г., Тиунов А.В., Малышева Т.И., Кадулин М.С. Почвы и азотное питание растений альпийских экосистем Северо-Западного Кавказа при многолетнем повышении доступности биофильных элементов // Почвоведение. 2020. № 8. С. 1016–1024.
Barthelemy H., Stark S., Kytöviita M.M., Olofsson J. Grazing decreases N partitioning among coexisting plant species // Funct. Ecol. 2017. V. 31. P. 2051–2060.
Brooks P.C., Landman A., Pruden G., Jenkinson D.S. Chloroform fumigation and release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen // Soil Biol. Biochem. 1985. V. 17. P. 837–842.
Choi W.J., Ro H.M., Lee S.M. Natural 15N abundances of inorganic nitrogen in soil treated with fertilizer and compost under changing moisture regimes // Soil Biol. Biochem. 2003. V. 35. P. 1289–1298.
Coyle J.S., Dijkstra P., Doucett R.R., Schwartz E., Hart S.C., Hungate B.A. Relationships between C and N availability, substrate age, and natural abundance 13C and 15N signatures of soil microbial biomass in a semiarid climate // Soil Biol. Biochem. 2009. V. 41. P. 1605–1611.
Dawson T.E., Mambelli S., Plamboeck A.H., Templer P.H., Tu K.P. Stable isotopes in plant ecology // Annual Rev. Ecol. System. 2002. V. 33. P. 507–559.
De Niro M.J., Epstein S. Influence of diet on the distribution of nitrogen isotopes in animals // Geochim. Cosmochim. Acta. 1981. V. 45. P. 341–351.
Dijkstra P., Ishizu A., Doucett R., Hart S.C., Schwartz E., Menyailo O.V., Hungate B.A. 13C and 15N natural abundances of the soil microbial biomass // Soil Biol. Biochem. 2006. V. 38. P. 3257–3266.
Dijkstra P., LaViolette C.M., Coyle J.S., Doucett R.R., Schwartz E., Hart S.C., Hungate B.A. 15N enrichment as an integrator of the effects of C and N on microbial metabolism and ecosystem function // Ecology Lett. 2008. V. 11. P. 389–397.
Dijkstra P., Menyailo O.V., Doucett R.R., Hart S.C., Schwartz E., Hungate B.A. C and N availability affects the 15N natural abundance of the soil microbial biomass across a cattle manure gradient // European J. Soil Sci. 2006. V. 57. P. 468–475.
Emmerton K.S., Callaghan T.V., Jones H.E., Leake J.R., Michelsen A., Read D.J. Assimilation and isotopic fractionation of nitrogen by mycorrhizal fungi // New Phytol. 2001. V. 151. P. 503–511.
Farrell R.E., Sandercock P.J., Van Kessel C. Landscape-scale variations in leached nitrate: Relationship to denitrification and natural nitrogen-15 abundance // Soil Sci. Soc. Am. J. 1996. V. 60. P. 1410–1415.
Gebauer G., Taylor A.F.S. 15N natural abundance in fruit bodies of different functional groups of fungi in relation to substrate utilization // New Phytol. 1999. V. 142. P. 93–101.
Kohzu A., Yoshioka T., Ando T., Takahashi M., Koba K., Wada E. Natural 13C and 15N abundance of field-collected fungi and their ecological implicatios // New Phytol. 1999. V. 144. P. 323–334.
Lerch T.Z., Nunan N., Dignac M.-F., Chenu C., Mariotti A. Variations in microbial isotopic fractionation during soil organic matter decomposition // Biogeochemistry. 2011. V. 106. P. 5–21.
Macko S.A., Fogel M.L., Hare P.E., Hoering T.C. Isotopic fractionation of nitrogen and carbon in the synthesis of amino acids by microorganisms // Chem. Geol. 1987. V. 65. P. 79–92.
Makarov M.I., Malysheva T.I., Menyailo O.V., Soudzilovskaia N.A., van Logtestijn R.S.P., Cornelissen J.H.C. Effect of K2SO4 concentration on extractability and isotope signature (δ13C and δ15N) of soil C and N fractions // Eur. J. Soil Sci. 2015. V. 66. P. 417–426.
Minagawa M., Wada E. Stepwise enrichment of N-15 along food-chains – further evidence and the relation between delta-N-15 and animal age // Geochim. Cosmochim. Acta. 1984. V. 48. P. 1135–1140.
Mooshammer M., Wanek W., Hämmerle I., Fuchslueger L., Hofhansl F., Knoltsch A., Schnecker J., Takriti M., Watzka M., Wild B., Keiblinger K.M., Zechmeister-Boltenstern S., Richter A. Adjustment of microbial nitrogen use effciency to carbon:nitrogen imbalances regulates soil nitrogen cycling // Nat. Commun. 2014. V. 5. 3694.
Post D.M. Using stable isotopes to estimate trophic position: models, methods and assumptions // Ecology. 2002. V. 83. P. 703–718.
Pörtl K., Zechmeister-Boltenstern S., Wanek W., Ambus P., Berger T.W. Natural 15N abundance of soil N pools and N2O reflect the nitrogen dynamics of forest soils // Plant Soil. 2007. V. 295. P. 79–94.
Robinson D. δ15N as an integrator of the nitrogen cycle // Trends Ecol. Evol. 2001. V. 16. P. 153–162.
Shinoda K., Yano M., Yoh M., Yoshida M., Makabe A. Control of the nitrogen isotope composition of the fungal biomass: evidence of microbial nitrogen use efficiency // Microbes Environ. 2019. V. 34. P. 5–12.
Taylor A.F.S., Högbom L., Högberg M., Lyon A.J.E., Näsholm T., Högberg P. Natural 15N abundance in fruit bodies of ectomycorrhizal fungi from boreal forests // New Phytol. 1997. V. 136. P. 713–720.
Tiemann L.K., Billings S. Indirect effects of nitrogen amendments on organic substrate quality increase enzymatic activity driving decomposition in a mesic grassland // Ecosystems. 2011. V. 14. P. 234–247.
Williams M.A., Rice C.W., Owensby C.E. Natural 15N abundances in a tallgrass prairie ecosystem exposed to 8-y of elevated atmospheric CO2 // Soil Biol. Biochem. 2006. V. 38. P. 409–412.
Wu J., Zhang Q., Yang F., Yao Lei, Zhang Q., Cheng X. Afforestation impacts microbial biomass and its natural 13C and 15N abundance in soil aggregates in central China // Sci. Total Environ. 2016. V. 568. P. 52–56.
Yamaguchi Y.T., Chikaraishi Y., Takano Y., Ogawa N.O., Imachi H., Yokoyama Y., Ohkouchi N. Fractionation of nitrogen isotopes during amino acid metabolism in heterotrophic and chemolithoautotrophic microbes across Eukarya, Bacteria, and Archaea: Effects of nitrogen sources and metabolic pathways // Org. Geochem. 2017. V. 111. P. 101–112.
Дополнительные материалы отсутствуют.


