Почвоведение, 2021, № 7, стр. 838-848
Микробная биомасса в низинных торфяниках: запасы, структура, активность
А. В. Головченко a, *, Ю. Д. Дмитриенко a, А. А. Морозов a, Л. А. Поздняков a, b, Т. В. Глухова c, Л. И. Инишева d
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7-2, Россия
c Институт лесоведения РАН
143030 Московская область, с. Успенское, ул. Советская, 21, Россия
d Томский государственный педагогический университет
634061 Томск, ул. Киевская, 60, Россия
* E-mail: golovchenko.alla@gmail.com
Поступила в редакцию 30.07.2020
После доработки 12.09.2020
Принята к публикации 24.10.2020
Аннотация
Пристальное внимание микробиологов уделяется верховым торфяникам. Низинные торфяники исследуются по остаточному принципу и, как правило, только их деятельный слой. Цель настоящего исследования – оценка запасов, структуры и активности микробной биомассы полных профилей низинных торфяников различного генезиса. Объекты исследования – низинные торфяники лесного, озерного и пойменного типов заболачивания (Тверская, Томская области). Биомассу микроорганизмов определяли люминесцентно-микроскопическим методом, активность микробного дыхания – методом газовой хроматографии. Запасы микробной биомассы в исследуемых торфяниках, рассчитанные на трехметровый профиль, составляют 7–13 т/га. Запасы эукариотной биомассы варьируют от 3 до 9 т/га, прокариотной – от 3 до 4 т/га. Соотношение эукариотной и прокариотной биомассы менялось по профилю: в деятельном слое преобладала эукариотная биомасса, в инертном слое – преимущественно прокариотная. В структуре прокариотной биомассы по всему профилю доминировали бактерии. Доля актиномицетного мицелия не превышала 15%. Обнаружена достоверная зависимость содержания прокариотной биомассы от ботанического состава торфов, слагающих профили исследуемых торфяников. Ее значения нарастали от группы древесных к группе травяных торфов. Выявлены особенности низинных торфяников различного генезиса. Торфяник лесного заболачивания имел наибольшие запасы микробной биомассы. Торфяник озерного происхождения отличался высокой биогенностью деятельного слоя. Торфяник пойменного происхождения был максимально обогащен бактериальной биомассой. Уровень потенциального дыхания во многих слоях торфяников в 2–5 раз превышал актуальный. Интенсивность дыхания была больше в пойменном торфянике.
ВВЕДЕНИЕ
Оценка биосферной роли болот как сложных и многокомпонентных систем невозможна без учета микробиологической составляющей. От микробного пула и его активности зависит скорость утилизации растительных остатков и накопление органического вещества в торфяной залежи.
Долгое время основным способом определения численности микроорганизмов в торфяных почвах был метод посева [3, 11, 12, 17–19, 23, 26]. Однако культивировать на средах удается не более 0.01% от общего количества бактериальных клеток, обнаруживаемых в торфе микроскопическими методами [15]. Эти методы позволяют оценить бактериальную биомассу в полном объеме, так как дают возможность учитывать как культивируемые, так и некультивируемые бактерии. Метод посева не дает представление о мицелиальной части грибного комплекса, так как учитывает преимущественно споры грибов [40]. Микроскопические методы дают возможность определить грибную биомассу и ее популяционную структуру, так как позволяют дифференцировать и проводить одновременный учет мицелия и спор грибов.
Следует отметить, что значительное количество работ, связанных с оценкой микробной биомассы почв, в том числе и торфяных, выполнено в России люминесцентно-микроскопическим методом. Пристальное внимание микробиологов уделяется олиготрофным торфяным почвам [8, 10, 13, 14, 20]. Показано, что в структуре микробной биомассы этих почв преобладает эукариотная составляющая, представленная мицелием в олиготрофно-торфяном горизонте (ТО) и преимущественно спорами – в органогенной породе (ТТ). Доля прокариотных микроорганизмов в общей микробной биомассе не превышает 15%. В эутрофных торфяных почвах выявлена иная структура микробной биомассы – доминирование в большей части профиля прокариотной составляющей, представленной преимущественно жизнеспособными бактериями. Эта особенность была установлена для узкого круга эутрофных торфяных почв [7, 10, 14]. Проверить выявленную тенденцию предполагается в настоящей работе, где объектами исследования являются эутрофные торфяные почвы различного генезиса.
В настоящее время остается нерешенным вопрос о состоянии, в котором находятся микроорганизмы в глубоких слоях торфяников. Информативным показателем, характеризующим микробную активность, является дыхание микроорганизмов. Исследования этого процесса по всему профилю торфяных почв малочисленны [11, 12].
Цель настоящего исследования – оценка запасов, структуры и активности микробной биомассы полных профилей эутрофных торфяных почв различного генезиса.
ОБЪЕКТЫ И МЕТОДЫ
Объекты исследования – низинные торфяники, классифицированные как эутрофные перегнойно-торфяные мощные почвы [27] – Sapric Histosols.
Низинный торфяник 1 (здесь и далее “торфяник 1”) под сосняком болотно-травяным – часть болотного массива “Петушиха” (Тверская область), образовавшаяся вследствие заболачивания озера [5]. Залежь сложена низинными сильно- и среднеразложившимися торфами древесной, древесно-травяной и травяно-моховой группы, подстилается смешанно-водорослевым сапропелем. Значение рНсол варьирует по профилю в узком диапазоне 5.6–5.8. Отношение C/N в большей части профиля составляет 21–24 (табл. 1).
Таблица 1.
Ботанический состав и некоторые свойства низинных торфов, слагающих профиль исследуемых торфяников
| Глубина образца, см | Торфяник 1 | Торфяник 2 | Торфяник 3 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ботанический состав (СРТ) | рНсол | C/N | ботанический состав (СРТ) | рНсол | C/N | ботанический состав (СРТ) | рНсол | C/N | |
| 0–20 | Осоково-гипновый (29) | 5.8 | 22 | Травяной (25) | 4.4 | 40 | Осоковый (25–27) | 6.1 | 17 |
| 20–50 | Древесный (46–48) | 5.6 | 23 | Осоковый (34) | 4.7 | 23 | 6.0 | 15 | |
| 50–75 | 5.6 | 24 | Травяной (31) | 4.9 | 21 | 5.7 | 26 | ||
| 50–100 | 5.7 | 24 | Вахтовый (26) | 5.4 | 21 | 5.7 | 20 | ||
| 100–150 | 5.7 | 21 | Травяной (21) | 5.6 | 23 | 7.2 | 22 | ||
| 150–200 | 5.6 | 21 | Травяно-гипновый (20–25) | 6.5 | 18 | Осоково-гипновый (35–37) | 7.2 | 17 | |
| 200–250 | 5.7 | 21 | 7.3 | 17 | 7.3 | 23 | |||
| 250–300 | Древесно-осоковый (50) | 5.8 | 39 | 7.4 | 20 | 7.2 | 22 | ||
Низинный торфяник 2 (“торфяник 2”) под березняком сосново-зеленомошным – часть болотного массива “Клюквенное” (Томская область), образовавшаяся вследствие заболачивания леса. Залежь представлена низинными среднеразложившимися торфами травяной и травяно-моховой групп, подстилается легкими и тяжелыми суглинками. Значение рНсол постепенно увеличивается вниз по профилю от 4.4 до 7.4. Отношение C/N уменьшается вниз по профилю – от 40 до 17.
Низинный торфяник 3 (“торфяник 3”) под смешанным лесом – часть болотного массива “Карбышевское” пойменного происхождения (Томская область). Залежь сложена низинными торфами травяной и травяно-моховой групп, степень разложенности которых увеличивается вниз по профилю от 25 до 37%, подстилается легкими и тяжелыми суглинками. Толща торфяной залежи характеризуются слабокислой реакцией почвенного раствора (5.7–6.1) в верхнем метровом слое и слабощелочной (7.2–7.3) – в остальной части профиля. Отношение C/N в исследуемом торфянике варьирует в широком диапазоне от 15 до 26.
На исследуемых болотных массивах осенью 2019 г. пробурены стратиграфические колонки для отбора образцов и последующего анализа. Отбор проведен методом смешанного образца из трех скважин. Исследовали слои: 0–20, 20–50, 50–100, 100–150, 150–200, 200–250, 250–300 см. Образцы торфа, отобранные с разных глубин, были помещены в стерильные пластиковые пакеты и в охлажденном виде доставлены в лабораторию.
Биомассу микроорганизмов определяли люминесцентно-микроскопическим методом [21]. Для десорбции микробных клеток торфяную суспензию (1 г торфа /100 мл стерильной воды) обрабатывали на ультразвуковом диспергаторе Bandelin Sonopuls HD 2070 (Germany) в течение 2 мин при мощности 50%. Затем наносили 0.01 мл суспензии на препарат для бактерий и 0.02 мл – на препарат для грибов. Использовали обезжиренные предметные стекла. Для одного образца готовили 6 бактериальных и 6 грибных препаратов. Препараты высушивали на воздухе, а затем фиксировали над пламенем горелки. Окраску препаратов производили водными растворами акридина оранжевого (для учета бактерий и актиномицетного мицелия) и калькофлуора белого (для учета мицелия и спор грибов). Осуществляли просмотр окрашенных препаратов на микроскопе “ЛЮМАМ-ИЗ” (Россия). На препарате просматривали 20 полей зрения – для учета бактерий и 50 – для учета спор грибов, актиномицетного и грибного мицелия.
Расчет биомассы микроорганизмов осуществляли по формулам, приведенным в статье [7]. Проводили пересчет показателей обилия микроорганизмов на 1 г сухого торфа. Для этого определяли влажность образцов, высушивая их при 105°С в течение 6 ч.
Актуальное и потенциальное дыхание определяли методом газовой хроматографии [21].
Для измерения актуального дыхания отбирали навески торфа (1.5 г) в трехкратной повторности, которые помещали во флаконы объемом 15 мл. Флаконы закрывали резиновой пробкой и инкубировали при комнатной температуре в течение суток. Затем их открывали и проветривали несколько минут, после чего опять закрывали и отправляли на повторную инкубацию в термостат при температуре 28°C на 19–20 ч. После инкубации из флакона отбирали инсулиновым шприцом пробу (0.5 мл), в которой измеряли содержание СО2 на хроматографе “Кристалл 5000.2” (Россия). Для измерения потенциального дыхания готовили флаконы и проводили измерение по той же схеме, что и для актуального дыхания. Только перед второй инкубацией добавляли во флакон 1 мл раствора глюкозы из расчета 2.5 мг/г торфа. Активность дыхания выражали в нг СО2/(мл сут).
Виды низинного торфа и степень их разложенности были определены в НИИББ при ТГУ. Содержание углерода и азота в различных слоях исследуемых торфяников выявляли с помощью CHNS-анализатора Vario EL III (Elementar, Germany) в токе кислорода при 1150°С, обменную кислотность – по ГОСТу 11623-89.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основная часть микробной биомассы почвы, представленная грибами (эукариотная составляющая) и бактериями (прокариотная составляющая), составляет около 95% от общей живой биомассы. На долю архей приходится 1%, на долю простейших – 2% [29, 31]. В большинстве экосистем деструкция природных полимеров осуществляется комплексом эукариотных и прокариотных микроорганизмов [16]. В наземных экосистемах ведущая роль в этом процессе отводится грибам [28, 35].
Рассмотрим показатели обилия и популяционную структуру грибной биомассы в исследуемых торфяниках.
Грибная биомасса, рассчитанная на грамм сухого торфа, варьировала от 0.1 до 10.9 мг/г в зависимости от глубины залегания торфа и объекта исследования (табл. 2). В исследуемых торфяниках выявлено убывание грибной биомассы вниз по профилю. Оно носит более выраженный характер в торфянике 1. Иное распределение грибной биомассы обнаружено в органогенной породе торфяника 2 – на глубине 1.5–2.5 м выявлен второй максимум, сравнимый с таковым в подповерхностном слое (0–20 см). Грибная биомасса характеризовалась минимальными значениями и не превышала 0.3 мг/г в торфянике 1 с глубины 1 м, в торфянике 3 – с 1.5 м, в торфянике 3 – с 2.5 м.
Таблица 2.
Биомасса грибов (мг/г) и относительная доля (%) мицелия грибов (МГ) и спор грибов (СГ) в профиле исследуемых торфяников
| Глубина образца, см | Торфяник 1 | Торфяник 2 | Торфяник 3 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| биомасса | доля в биомассе | биомасса | доля в биомассе | биомасса | доля в биомассе | ||||
| МГ | СГ | МГ | СГ | МГ | СГ | ||||
| 0–20 | 10.9 ± 0.2 | 80 | 20 | 4.6 ± 0.3 | 90 | 10 | 3.0 ± 0.2 | 80 | 20 |
| 20–50 | 3.8 ± 0.4 | 65 | 35 | 3.3 ± 0.1 | 82 | 18 | 1.5 ± 0.2 | 53 | 47 |
| 50–75 | 0.6 ± 0.04 | 0 | 100 | 0.9 ± 0.05 | 0 | 100 | 1.0 ± 0.1 | 0 | 100 |
| 50–100 | 0.4 ± 0.03 | 0 | 100 | 0.4 ± 0.04 | 0 | 100 | 1.0 ± 0.1 | 0 | 100 |
| 100–150 | 0.1 ± 0.03 | 0 | 100 | 0.4 ± 0.03 | 0 | 100 | 0.4 ± 0.1 | 0 | 100 |
| 150–200 | 0.2 ± 0.04 | 0 | 100 | 4.4 ± 0.1 | 76 | 24 | 0.3 ± 0.04 | 0 | 100 |
| 200–250 | 0.1 ± 0.02 | 0 | 100 | 4.5 ± 0.3 | 86 | 14 | 0.3 ± 0.04 | 0 | 100 |
| 250–300 | 0.2 ± 0.03 | 0 | 100 | 0.2 ± 0.04 | 0 | 100 | 0.2 ± 0.03 | 0 | 100 |
При рассмотрении популяционной структуры грибного комплекса низинных торфяников, следует вспомнить о существующем разделении торфяной залежи на 2 слоя. Верхний слой считали почвой, а нижний слой – торф-органогенной породой [6, 25]. Другие названия этих слоев – деятельный (acrotelm) и инертный (catotelm). В национальном атласе почв России деятельный слой соответствует торфяному горизонту, а инертный – органогенной породе [22]. Граница между деятельным и инертным слоями соответствует максимальному опусканию грунтовых вод во время летней подсушки торфа. Для исследуемых почв мощность деятельного слоя не превышает 50 см.
В структуре грибной биомассы деятельного слоя исследуемых торфяников доминирует мицелий. Его доля составляет 53–80%. В инертном слое грибная биомасса представлена спорами, кроме слоя 1.5–2.5 м торфяника 2, где обнаружение грибного мицелия внесло коррективы в структуру грибной биомассы.
Доминирование активного компонента грибной биомассы – мицелия – в деятельном слое исследуемых торфяников логично, так как грибы эффективнее бактерий используют органический субстрат почвы [32, 38] и играют ведущую роль на первых этапах его деструкции [39]. Деструкция природных полимеров мицелиальными грибами эффективна при относительно низких величинах влажности и в условиях достаточного обеспечения кислородом и биогенными элементами. Все эти условия имеют место в деятельном слое торфяников.
Запасы грибной биомассы, рассчитанные на трехметровый профиль исследуемых торфяников, составляют 304–892 г/м2 торфа. Торфяник 1 озерного происхождения максимально обогащен грибной биомассой. Ее запасы в 1.5–3 раза больше, чем в торфяниках пойменного и лесного заболачивания (табл. 3).
Таблица 3.
Запасы микробной биомассы (г/м2) в различных слоях и в профиле исследуемых торфяников (1–3)
| Слой, см | Эукариотная | Прокариотная | Общая | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | |
| 0–50 | 495 (85) | 278 (31) | 157 (52) | 91 (29) | 68 (18) | 92 (26) | 586 (66) | 346 (27) | 249 (38) |
| 50–300 | 85 (15) | 615 (69) | 147 (48) | 218 (71) | 302 (82) | 260 (74) | 303 (34) | 917 (73) | 407 (62) |
| 0–300 | 580 | 893 | 304 | 309 | 370 | 352 | 889 | 1263 | 656 |
Запасы грибной биомассы в деятельном слое (0–50 см) торфяников варьируют в диапазоне – от 157 до 495 г/м2 торфа, в инертном (0.5–3 м) – от 85 до 615 г/м2 торфа. Максимальный вклад деятельного слоя (85%) в общую грибную биомассу выявлен в торфянике 1, минимальный (31%) – в торфянике 2. Для инертных слоев этих торфяников выявлена обратная закономерность – доля грибной биомассы наименьшая (15%) в торфянике 1 и наибольшая (69%) в торфянике 2. Высокая доля грибной биомассы в инертном слое торфяника 2 связана с обнаружением грибного мицелия на глубине 1.5–2.5 м в количестве, сопоставимом с подповерхностным слоем. Торфяник 3 характеризуется равным вкладом деятельного и инертного слоев в общую грибной биомассу.
Закономерности относительно запасов, популяционной структуры и профильного распределения грибной биомассы в исследуемых торфяниках подтверждаются данными, полученными для низинных торфяников других регионов [7, 10, 14]. Нехарактерным является обнаружение грибного мицелия в глубоких слоях низинных торфяников, что сразу ставит перед исследователем вопрос о его жизнеспособности и активности. Болотная вода может быть источником поступления кислорода из верхних слоев в нижнюю толщу торфяников. В низинных торфяниках влияние напорных вод способствует относительно равномерному перемещению водных масс. Период условного водообмена, рассчитанный по результатам изотопного изучения стратиграфии болотных вод, в верхней 1.5 м толще составляет менее года, в более глубоких слоях – менее 10–20 лет [24]. Доступными на этих глубинах могут быть и питательные вещества, так как в низинных торфяниках элементный химический состав постоянно или периодически корректируется поступлением минеральных веществ с паводковыми и почвенно-грунтовыми водами [1]. Таким образом, существование грибов в глубоких слоях низинных торфяников возможно. Об их функционировании может свидетельствовать обнаружение активности дыхания на этих глубинах.
Бактерии отличаются устойчивостью к внешним воздействиям и экстремальным условиям среды, большинство из них способны выживать в переувлажненных условиях [36].
Пределы колебаний прокариотной биомассы в исследуемых торфяниках – от 0.3 до 1.7 мг/г торфа. Различным оказался характер ее профильного распределения. В торфянике 1 и 3 биомасса была максимальной в верхнем слое, затем уменьшалась вниз по профилю. Однако в некоторых слоях выявляли ее дополнительные пики. В торфянике 2 прокариотная биомасса была больше в средней части профиля, а в верхнем и самом нижнем слоях – характеризовалась минимальными значениями. Характер профильного распределения прокариотной биомассы был аналогичен распределению бактерий по профилю, что закономерно, так как в ее структуре доминируют бактерии (85–96%). На долю актиномицетного мицелия приходится от 4 до 15%. Макcимальная доля актиномицетного мицелия (8–15%) в прокариотной биомассе была выявлена в торфянике 2 (табл. 4).
Таблица 4.
Биомасса прокариотных микроорганизмов (мг/г) и относительная доля (%) бактерий (Б) и актиномицетного мицелия (АМ) в профиле исследуемых торфяников
| Глубина образца, см | Торфяник 1 | Торфяник 2 | Торфяник 3 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| биомасса | доля в биомассе | биомасса | доля в биомассе | биомасса | доля в биомассе | ||||
| Б | АМ | Б | АМ | Б | АМ | ||||
| 0–20 | 1.7 ± 0.06 | 95 | 5 | 0.7 ± 0.03 | 90 | 10 | 1.7 ± 0.03 | 94 | 6 |
| 20–50 | 1.0 ± 0.01 | 94 | 6 | 1.3 ± 0.1 | 92 | 8 | 1.0 ± 0.1 | 95 | 5 |
| 50–75 | 1.1 ± 0.01 | 94 | 6 | 1.0 ± 0.04 | 92 | 8 | 0.9 ± 0.01 | 94 | 6 |
| 50–100 | 1.2 ± 0.03 | 93 | 7 | 1.2 ± 0.03 | 90 | 10 | 0.8 ± 0.03 | 96 | 4 |
| 100–150 | 0.5 ± 0.02 | 94 | 6 | 1.3 ± 0.04 | 85 | 15 | 0.6 ± 0.02 | 95 | 5 |
| 150–200 | 0.4 ± 0.02 | 94 | 6 | 1.0 ± 0.04 | 86 | 14 | 1.0 ± 0.02 | 94 | 6 |
| 200–250 | 0.3 ± 0.01 | 90 | 10 | 0.8 ± 0.02 | 92 | 8 | 1.0 ± 0.01 | 95 | 5 |
| 250–300 | 0.4 ± 0.02 | 90 | 10 | 0.6 ± 0.03 | 92 | 8 | 0.6 ± 0.02 | 93 | 7 |
Анализ литературных данных относительно структуры прокариотной биомассы в низинных торфяниках различных регионов России показал, что доминирующим компонентом являются бактерии. Их доля варьирует от 75 до 99% [7, 10, 14]. Авторы этих статей отмечают, что бактерии доминируют в прокариотной биомассе по всему профилю. Доля актиномицетного мицелия в прокариотной биомассе оказалась максимальной в низинных высокозольных торфяниках под черноольшанниками (от 7 до 25%) [10] и минимальной (от 4 до 7% – в верхних слоях и от 0 до 3% – в нижней толще) – в низинных торфяниках торфяного массива “Таган“ (Томская область) [14].
Торфяные почвы формируются почти исключительно за счет поступления отмерших частей растений в почву, поэтому ботанический состав торфа представляет собой одну из важнейших характеристик [22].
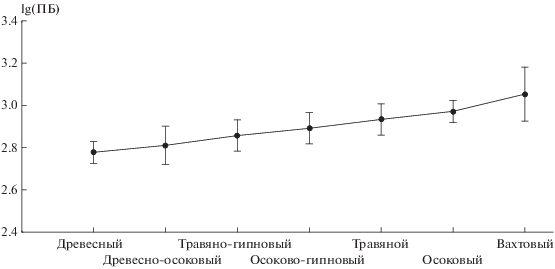
Однофакторный дисперсионный анализ выявил достоверную (Критерий Фишера = 6.96, при уровне значимости <0.0002) зависимость прокариотной биомассы от ботанического состава торфов, слагающих профиль исследуемых торфяников. Следует отметить, что прокариотная биомасса нарастала в ряду групп низинных торфов: древесных < древесно-травяных < травяно-моховых < травяных. Максимальные показатели прокариотной биомассы были приурочены к слоям вахтового торфа (рис. 1). Вахта трехлистная характеризуется максимальной скоростью разложения. Она занимает лидирующую позицию среди трав по потерям при разложении фракции ее листьев, корней, корневищ – до 80% массы за 2 года опыта [4]. Так как актиномицеты доминируют на поздних стадиях сукцессии, закономерно увеличение содержания их биомассы в слоях торфа, где растительные остатки находятся в более переработанном состоянии. Бактериальный приоритет может быть связан с повышенным содержанием азота в этом виде торфа.
Рис. 1.
Зависимость прокариотной биомассы (ПБ, мкг/г торфа) от ботанического состава торфов, слагающих профиль исследуемых торфяников.
Запасы прокариотной биомассы в деятельном слое торфяников варьировали от 68 до 92 г/м2, в трехметровом профиле – от 309 до 370 г/м2 (табл. 3). В прокариотной биомассе всего профиля на деятельный слой приходится от 18% (в торфянике 2) до 26–29% (в торфяниках 3 и 1 соответственно). Большая часть прокариотной биомассы (71–82%) сосредоточена в инертном слое.
О жизнеспособности бактерий в инертном слое торфяников могут свидетельствовать: рост на питательных средах; сезонная динамика показателей обилия; высокая доля живых клеток среди всех клеток, выявляемых с помощью красителя L7012 (LIVE/DEAD – BacLight bacterial viability kit); нитрогеназная активность [2, 9, 10] и т. д.
Соотношение эукариотной и прокариотной биомассы – один из экологических показателей состояния почвы. Основную долю в микробной биомассе почв разных типов составляют грибы. Их вклад в общую микробную биомассу, выявленный микроскопическими методами, варьирует от 58 до 90% (в среднем – 76%) [34].
В исследуемых торфяниках это соотношение менялось по профилю. В деятельном слое преобладала эукариотная биомасса, которая была в 2–5 раз больше прокариотной. В инертном слое соотношение было иным. В этом слое в торфяниках 1 и 3 доминировала прокариотная биомасса. Она была в 2–3 раза больше эукариотной биомассы. В торфянике 2 эукариотная биомасса доминировала по всему профилю. Такая структура микробной биомассы стала возможной из-за обнаружения грибного мицелия не только в деятельном слое, но и в глубоких слоях торфяника.
Запасы общей микробной биомассы, рассчитанные на трехметровый профиль, варьируют в исследуемых торфяниках от 7 до 13 т/га (табл. 3). Величины, характеризующие микробный пул в исследуемых торфяниках, сопоставимы с таковыми в низинных торфяниках карстовых ландшафтов [7] и в 2–4 раза больше, чем в низинных высокозольных торфяниках [10].
Дробный анализ структуры микробной биомассы, основанный на выделении биомассы грибного мицелия, спор грибов, бактерий, актиномицетного мицелия, также выявил различия между деятельным и инертным слоями торфяников. В деятельном слое во всех торфяниках преобладала биомасса грибного мицелия. Она в 2–6 раз превосходила биомассу грибных спор и в 4 раза – бактериальную биомассу. Исключением является торфяник 3 пойменного происхождения, в котором биомасса грибного мицелия и бактерий характеризовалась величинами одного порядка. В инертном слое торфяников наблюдали иную картину. В этом слое доминировала биомасса бактерий. Она в 1.5–2 раза превышала биомассу грибных спор. Торфяник 2 лесного заболачивания отличался от других соотношением компонентов микробной биомассы. В инертном слое этого торфяника, также как и в деятельном, доминировала биомасса грибного мицелия (рис. 2).
Рис. 2.
Значения биомассы (г/м2) грибного мицелия (МГ), спор грибов (СГ), бактерий (Б) и актиномицетного мицелия (АМ) в деятельном (I), инертном слоях (II) и в полном профиле (III) исследуемых торфяников (1, 2, 3).
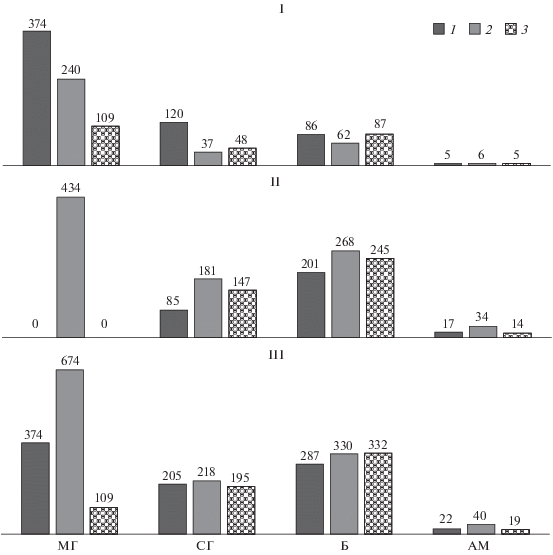
При рассмотрении всего профиля оказалось, что исследуемые торфяники существенно различаются только по биомассе грибного мицелия, тогда как биомасса бактерий, спор грибов и актиномицетного мицелия имеет близкие значения.
Сравнение торфяников различного генезиса выявило их особенности. Торфяник 1 озерного происхождения отличала насыщенность микробной биомассой деятельного слоя. Торфяник 2 лесного заболачивания характеризовался максимальными значениями всех компонентов биомассы и имел высокий микробный пул. В профиле торфяника 3 пойменного происхождения доминировала бактериальная биомасса. Она превосходила биомассу грибных спор в 2 раза, а биомассу мицелия – в 3 раза.
Высокая степень насыщенности почвы микробными группировками еще не свидетельствует об активности микробного комплекса в ней. Более представительными в разрешении вопроса о состоянии микроорганизмов в торфяниках являются показатели активности процессов, протекающих на разных глубинах [10]. Одним из таких показателей является микробное дыхание почвы.
Уровень актуального дыхания в исследуемых торфяниках варьирует от 179 до 1879 нг CO2/(мл сут). Уровень потенциального дыхания во многих слоях торфяника в 2–5 раз превышает актуальный (рис. 3). Выявленный отклик на внесение глюкозы свидетельствует о том, что микробная биомасса по всему профилю низинных торфяников потенциально активна и способна к росту. В большей степени на внесение глюкозы отреагировало микробное сообщество торфяника 3 пойменного происхождения.
В исследуемых торфяниках максимальные значения и колебания эмиссии CO2 выявлены в подповерхностном слое, что логично, так как именно здесь напряженность процессов разложения растительных остатков особенно высока. Следует отметить, что в деятельном слое торфяников в микробной биомассе преобладает эукариотная составляющая, представленная мицелием грибов. Соответственно, активность дыхания в этом слое определяется совместным вкладом грибов и бактерий. В инертном слое грибной компонент представлен спорами, поэтому дыхание определяется преимущественно бактериями. Бактерии, используя энергетические “резервы” и уменьшая свою метаболическую активность, адаптируются к неблагоприятным условиям и способны существовать в таком состоянии длительное время [37].
С глубиной происходит уменьшение как прокариотной биомассы (табл. 4), так и активности дыхания (рис. 3). Толща от 1 до 3 м торфяников 1 и 2 характеризуется стабильно низкими показателями. В пойменном торфянике 3 с нейтральной реакцией среды в большей части профиля, активность как актуального, так и потенциального дыхания находится на высоком уровне.
Выявлена положительная корреляционная связь между активностью дыхания и прокариотной биомассой в торфяниках озерного (коэффициент корреляции r = 0.84) и пойменного (r = 0.83) происхождения. В торфянике лесного заболачивания связь между этими параметрами была отрицательной (r = –0.67), что логично, так как в этом торфянике по всему профилю высока биомасса грибов. Их вклад в активность дыхания более весом, чем вклад бактерий. В этом же торфянике найдена корреляция между активностью дыхания и соотношением C/N (r = 0.83).
Для выявления экофизиологического состояния микробного сообщества исследователи рассчитывают метаболический коэффициент – qCO2 (cоотношение скоростей выделения CO2 из необогащенной почвы и почвы, в которую вносили избыток доступного субстрата – глюкозы). Оптимальным значением для почв считается показатель, равный примерно 0.2.
Для исследуемых торфяников qCO2 варьирует от 0.35 до 1 (табл. 5). Средние значения этого коэффициента составляют 0.5–0.6. Ближе к оптимальным, находятся значения qCO2, выявленные в профиле торфяника 3 пойменного происхождения.
Таблица 5.
Значения метаболического коэффициента (qCO2) в исследуемых торфяниках
| Глубина образца, см | Торфяник 1 | Торфяник 2 | Торфяник 3 |
|---|---|---|---|
| 0–20 | 0.50 | ~1 | 0.35 |
| 20–50 | 0.61 | 0.64 | 0.77 |
| 50–75 | 0.39 | 0.64 | ~1 |
| 75–100 | 0.55 | 0.44 | 0.41 |
| 100–200 | 0.66 | 0.56 | 0.43 |
| 200–300 | 0.44 | 0.83 | 0.34 |
Установлено, что максимальные значения qCO2 могут свидетельствовать: о значительных затратах микроорганизмов для того, чтобы оставаться в жизнеспособном состоянии [33]; о высокой скорости отмирания микробной биомассы [28]; о преобладании микроорганизмов r-стратегов [30]. В торфяниках все указанные причины повышения qCO2 могут иметь место. Пониженная концентрация кислорода в условиях постоянной насыщенности водой, низкие температуры в большей части профиля, органическое вещество (пища) в виде труднодоступных полимеров не способствуют активному функционированию микроорганизмов.
ЗАКЛЮЧЕНИЕ
Проведено комплексное исследование микробной биомассы полных профилей низинных торфяников различного генезиса. Ее запасы в расчете на трехметровый профиль, оказались высоки и составили 7–13 т/га. Микробная биомасса была представлена как эукариотной, так и прокариотной составляющими. Их соотношение менялось по профилю. В деятельном слое торфяников преобладала эукариотная биомасса, в инертном слое – преимущественно прокариотная.
Структура прокариотной биомассы была однотипной по всему профилю. В ней доминировали бактерии, на долю актиномицетного мицелия приходилось не более 15%. Впервые была выявлена достоверная зависимость содержания прокариотной биомассы от ботанического состава торфов, слагающих профили исследуемых торфяников. Ее значения увеличивались от группы древесных к группе травяных торфов. Максимальные показатели были приурочены к слоям вахтового торфа.
Структура эукариотной биомассы, в отличие от прокариотной, изменялась по профилю. В деятельном слое доминировал мицелий, составляя 53–80%. В инертном слое грибная биомасса была представлена спорами, кроме торфяника лесного заболачивания, в котором на глубине 1.5–2.5 м был обнаружен грибной мицелий.
Дробный анализ структуры микробной биомассы, основанный на выделении биомассы грибного мицелия, спор грибов, бактерий и актиномицетного мицелия, позволил выявить общие признаки низинных торфяников. При рассмотрении всего профиля (без деления на деятельный и инертный слои) оказалось, что исследуемые торфяники существенно различались только по биомассе грибного мицелия, тогда как биомасса бактерий, спор грибов и актиномицетного мицелия характеризовалась близкими значениями.
Торфяники различного генезиса имели свои особенности. Так, торфяник лесного заболачивания имел наибольшие запасы микробной биомассы. Торфяник озерного происхождения отличала насыщенность микробной биомассой деятельного слоя. Торфяник пойменного происхождения был максимально обогащен бактериальной биомассой.
Весомым оказался отклик микробной биомассы на внесение глюкозы, выявляемый по всему профилю, что свидетельствует о жизнеспособности и потенциальной активности микроорганизмов, не только в деятельном, но и в инертном слоях торфяников.
Полученные данные по запасам, структуре и активности микробной биомассы в низинных торфяниках могут быть дополнительным аргументом для включения в объем понятия “торфяная почва” всего профиля, а не только деятельного слоя.
Список литературы
Бахнов В.К. Биогеохимия болотного почвообразования // Сборник материалов пятой научной школы “Болота и биосфера”. Томск: ЦНТИ, 2006. С. 8–18.
Богданова О.Ю., Головченко А.В., Лысак Л.В., Глухова Т.В., Звягинцев Д.Г. Жизнеспособность бактерий в торфяниках // Почвоведение. 2014. № 4. С. 466–472.
Бубина А.Б. Характеристика микрофлоры торфов эвтрофного болота // Вестн. Томского гос. пед. ун-та (TSPU Bulletin). 2010. Вып. 3(93). С. 142–148.
Вишнякова Е.К., Миронычева-Токарева Н.П., Косых Н.П. Динамика разложения растений на болотах Васюганья // Вестник ТГПУ (TSPU Bulletin). 2012. № 7(122) С. 87–93.
Вомперский С.Э., Сирин А.А., Глухов А.И. Формирование и режим стока при гидролесомелиорации. М.: Наука, 1988. 168 с.
Герасимов Д.А. О принципах классификации, разведки и картирования торфяных месторождений // Почвоведение. 1937. № 10. С. 643–646.
Головченко А.В., Волкова Е.М. Запасы и структура микробной биомассы в торфяниках карстовых ландшафтов Тульской области // Почвоведение. 2019. № 3. С. 370–376.
Головченко А.В., Добровольская Н.Г., Инишева Л.И. Структура и запасы микробной биомассы в олиготрофных торфяниках южно-таежной подзоны Западной Сибири // Почвоведение. 2002. № 12. С. 1468–1473.
Головченко А.В., Добровольская Т.Г., Звягинцев Д.Г. Микробиологические основы оценки торфяника как профильного почвенного тела // Вестн. Томского гос. пед. ун-та (TSPU Bulletin). 2008. Вып. 4(78). С. 46–53.
Головченко А.В., Тихонова Е.Ю., Звягинцев Д.Г. Численность, биомасса, структура и активность микробных комплексов низинных и верховых торфяников // Микробиология. 2007. Т. 76. № 5. С. 711–719.
Гродницкая И.Д., Карпенко Л.В., Кнорре А.А., Сырцов С.Н. Микробная активность торфяных почв заболоченных лиственничников и болота в криолитозоне Центральной Эвенкии // Почвоведение. 2013. № 1. С. 67–79.
Гродницкая И.Д., Трусова М.Ю. Микробные сообщества и трансформация соединений углерода в болотных почвах таежной зоны (Томская область) // Почвоведение. 2009. № 9. С. 1099–1107.
Добровольская Т.Г., Головченко А.В., Звягинцев Д.Г., Инишева Л.И., Кураков А.В., Смагин А.В., Зенова Г.М., Лысак Л.В., Семенова Т.А., Степанов А.Л., Глушакова А.М., Початкова Т.Н., Кухаренко О.С., Качалкин А.В., Якушев А.В., Поздняков Л.А., Богданова О.Ю. Функционирование микробных комплексов верховых торфяников – анализ причин медленной деструкции торфа. М.: Товарищество научных изданий КМК, 2013. 128 с.
Добровольская Т.Г., Головченко А.В., Кухаренко О.С., Якушев А.В., Семенова Т.А., Инишева Л.И. Структура микробных сообществ верховых и низинных торфяников Томской области // Почвоведение. 2012. № 3. С. 317–326.
Добровольская Т.Г., Полянская Л.М., Головченко А.В., Смагина М.В., Звягинцев Д.Г. Микробный пул в торфяных почвах // Почвоведение. 1991. № 7. С. 69–77.
Заварзин Г.А. Лекции по природоведческой микробиологии. М.: Наука, 2004. 348 с.
Звягинцев Д.Г., Добровольская Т.Г., Головченко А.В., Зенова Г.М., Смагина М.В. Структура сапротрофного комплекса микроорганизмов в торфяниках // Микробиология. 1991. Т. 60. Вып. 6. С. 155–164.
Зенова Г.М., Грядунова А.А., Поздняков А.И., Звягинцев Д.Г. Аэробные и микроаэрофильные актиномицеты агроторфяной и торфяной типичных почв // Почвоведение. 2008. № 2. С. 235–240.
Иванова А.О., Головченко А.В., Добровольская Т.Г. Бактериальное разнообразие торфяников карстового происхождения // Вестн. Моск. ун-та. Сер. 17. Почвоведение. 2008. № 4. С. 52–56.
Инишева Л.И., Головченко А.В. Характеристика микробоценоза в торфяных залежах ландшафтного профиля олиготрофного торфогенеза // Сибирский экологический журн. 2007. № 3. С. 363–373.
Методы почвенной биохимии и микробиологии. М.: Изд-во Моск. ун-та, 1991. 304 с.
Национальный атлас почв Российской Федерации / Ред. С.А. Шоба. М.: Астрель: АСТ, 2011. 632 с.
Полякова А.В., Чернов И.Ю., Паников Н.С. Биоразнообразие дрожжей в гидроморфных почвах на примере травяно-сфагнового болота (Западная Сибирь) и кочкарной тундры (Барроу, Аляска) // Микробиология. 2001. Т. 70. № 5. С. 714–720.
Сирин А.А. Водообмен и сруктурно-функциональные особенности лесных болот. Автореф. дис. … докт. биол. н. М., 1999. 44 с.
Скрынникова И.Н. К вопросу об истории исследования, принципы классификации и систематики болотных почв СССР // Почвоведение. 1954. № 4. С. 37–50.
Хабибуллина Ф.М., Кузнецова Е.Г., Васенева И.З. Микромицеты подзолистых и болотно-подзолистых почв в подзоне Средней тайги и на северо-востоке Европейской части России // Почвоведение. 2014. № 10. С. 1228–1234.
Шишов Л.Л., Тонконогов В.Д., Лебедева И.И., Герасимова М.И. Классификация и диагностика почв России. Смоленск: “Ойкумена”, 2004. 342 с.
Anderson T.H., Domsch K.H. Application of eco-physiological quotients (qCO2 and qD) on microbial biomasses from soils of different cropping histories // Soil Biology & Biochemistry. 1990. V. 22. P. 251–255. https://doi.org/10.1016/0038-0717(90)90094-G
Beare M.H. Fungal and bacterial pathways of organic matter decomposition and nitrogen mineralization in arable soils // Soil Ecology in Sustainable Agricultural Systems. Boca Raton, FL.: CRC/Lewis Publishers, 1997. P. 37–70.
Dilly O. Microbial energetics in soils / In: Microorganisms in soils: roles in genesisand functions / Eds.: F. Buscot, A. Varma Berlin: Springer, 2005. P. 123–138. https://doi.org/10.1007/3-540-26609-7_6
Gattinger A., Ruser R., Schloter M., Munch J.C. Microbial community structure varies in different soil zones of a potato field // J.plant nutrition and soil science. 2002. V. 165. P. 421–428. https://doi.org/10.1007/s10457-016-0009-x
Holland E.A., Coleman D.C. Litter placement effects on microbial and organic matter dynamics in an agroecosystem // Ecology. 1987. V. 68. P. 425–433. https://doi.org/10.1007/BF00004497
Insam H., Haselwandter K. Metabolic quotient of the soil microflora in relation to plant succession // Oecologia. 1989. V. 79. № 1. P. 174–178. https://doi.org/10.1007/BF00388474
Joergensen R.G., Wichern F. Quantitative assessment of the fungal contribution to microbial tissue in soil // Soil Biol Biochem. 2008. V. 40. P. 2977–2991. https://doi.org/10.1007/s00374-009-0433-4
Lynd L.R., Weimer P.J., van Zyl W.H., Pretorius I.S. Microbial cellulose utilization: fundamentals and biotechnology // Microbiology and Molecular Biology Reviews. 2002. V. 66. № 3. P. 506–577. https://doi.org/10.1128/MMBR.66.3.506-577.2002
Nakamura A., Tun C.C., Asakawa S., Kimura M. Microbial community responsible for the decomposition of rice straw in a paddy field: estimation by phospholipid fatty acid analysis // Biol. Fertil. Soils. 2003. V. 38. P. 288–295. https://doi.org/10.1007/s00374-003-0658-6
Raubuch M., Dyckmans J., Joergensen R.G., Kreutzfeldt M. Relation between respiration, ATP content, and Adenylate Energy Charge (AEC) after incubation at different temperatures and after drying and rewetting // J. Plant Nutr. Soil Sci. 2002. V. 165. P. 435–440. https://doi.org/10.1002/1522-2624(200208)165:4<435:: AID-JPLN435>3.0.CO;2-3
Sakamoto K., Oba Y. Effect of fungal to bacterial biomass ratio on the relationship between CO2 evolution and total soil microbial biomass // Biol. Fertil. Soils. 1994. V. 17. № 1. P. 39–44. https://doi.org/10.1007/BF00418670
Swift M.J., Heal O.W., Anderson J.M. Decomposition in terrestrial ecosystems. Berkeley and Los Angeles: University California press, 1979. 363 p. https://doi.org/10.1007/0-387-21663-4_7
Wainwright M., Ali T.A., Killham K. Anaerobic growth of fungal mycelium from soil particles onto nutrient-free silica gel // Mycol. Res. 1994. V. 98(7). P. 761–762.
Дополнительные материалы отсутствуют.



