Почвоведение, 2021, № 7, стр. 862-870
Влияние низких концентраций стабильных электрофоретических фракций почвенных гуминовых кислот на стимуляцию/ингибирование длины корней проростков семян редиса
О. Е. Трубецкая a, О. А. Трубецкой b, *
a Филиал Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
142290 Пущино, Московской области, ул. Институтская, 6, Россия
b Институт фундаментальных проблем биологии РАН
142290 Пущино, Московской области, ул. Институтская, 2, Россия
* E-mail: olegi03@yahoo.com
Поступила в редакцию 26.08.2020
После доработки 12.10.2020
Принята к публикации 27.10.2020
Аннотация
С помощью сочетания эксклюзионной хроматографии низкого давления с аналитическим электрофорезом в полиакриламидном геле из гуминовых кислот (ГК) чернозема и почвенного стандарта Международного гуминового общества ГК-1S102H получены по три стабильные электрофоретические фракции А, В и C + D, различающиеся по электрофоретической подвижности и молекулярному размеру (МР), причем МРА > МРB > МРC + D. Исходные ГК и их фракции были проанализированы на наличие биологической активности (способности стимулировать или ингибировать рост первичных корней трехдневных проростков редиса) в концентрациях 1, 10–3 и 10–4 мг/л. Статистически значимый стимулирующий эффект (p < 0.05) для обоих ГК и их фракций А и В наибольшего МР был получен при ультранизкой концентрации 10–3 мг/л. Фракция C + D наименьшего МР из обоих препаратов ГК при этой концентрации статистически значимо ингибировала прорастание семян редиса. На основании анализа структурных характеристик можно предположить, что определяющим фактором стимуляции роста является наличие алифатических компонентов в составе ГК и фракций, а не их МР. В то же время ароматические компоненты обусловливают ингибирование роста растений.
ВВЕДЕНИЕ
В 1914 г. профессор ботаники Королевского колледжа Лондонского университета Вильям Ботомли впервые на основании лабораторных экспериментов пришел к выводу о том, что гуминовые вещества (ГВ) в небольших количествах стимулируют рост ряски (Lemna minor) и опубликовал серию статей, назвав экстрагированные им торфяные вытяжки “ауксиномами” [19]. В течение прошлого столетия учеными разных стран было показано, что малые дозы ГВ, экстрагированные из почв, торфов, углей, компостов и др., оказывают прямое и косвенное влияние не только на рост высших растений, но и на микроорганизмы, водоросли и грибы, влияя как на многие физиологические, так и биохимические свойства живых организмов [4, 11, 12, 35, 51, 52]. Убедительно продемонстрировано, что опосредованное влияние малых доз растворимых ГВ на рост заключается в облегчении ассимиляции растениями и микрооганизмами минеральных питательных макро- и микроэлементов [10, 13, 24], что создало фундаментальную основу для разработки гуминовых удобрений [14, 17, 25, 36, 42]. Прямое влияние ГВ на рост, возможное лишь в случае их проникновения внутрь клеток, было впервые продемонстрировано на высших растениях с помощью оригинальных агрохимических приемов в серии работ 1949–1954 гг. Л.А. Христевой с соавт. [10, 12]. Проникновение ГВ в клетки высших растений, а также грибов, водорослей и микроорганизмов было подтверждено другими исследователями с использованием ГВ и их аналогов, меченных радиоактивными изотопами углерода 14С [3, 40, 51] или тритием [31]. В 50-х годах прошлого века Христевой [10], Гуминским [2], Фляйгом [28] для объяснения прямого физиологического влияния на рост растений выдвинута гипотеза о том, что ГВ и их аналоги, содержащие хиноны и полифенолы, могут принимать участие в окислительно-восстановительных реакциях, влияя на процессы дыхания и фотосинтеза и стимулируя общий метаболизм растительного организма. Далее было обнаружено стимулирующее и/или ингибирующее влияние препаратов ГВ на активность нескольких протеаз, пероксидазы, протонной АТФазы, инвертазы, холинэстеразы и других ферментов [12, 18, 35]. В отдельных работах продемонстрировано влияние препаратов ГВ на синтез белков и нуклеиновых кислот [45, 52].
Несмотря на более чем вековую историю изучения, представления о взаимосвязи между содержанием структурных компонентов ГВ (жирных кислот, протеиноподобных и ароматических соединений, углеводов) и их влиянием на рост, физиологические и биохимические функции растений и микроорганизмов до конца не выяснены. Из-за чрезвычайно сложной и до конца не установленной структурной организации коллоидных наночастиц ГВ крайне трудно идентифицировать характеристические компоненты, осуществляющие регуляцию тех или иных процессов и их взаимосвязь. В частности непонятно, стимулируют ли усиление дыхания и увеличение сухой массы растения одни и те же или разные структурные компоненты ГВ [30, 37]. Не доказана прямая связь между увеличением количества хлорофилла в присутствии ГВ и фотосинтезом [15, 52], усилением дыхательной активности и ростом высших растений [1, 10, 44].
Выявление корреляции между структурой и функцией отдельных соединений в составе ГВ может быть перспективным для создания нового поколения природоподобных стимуляторов роста растений и расширит применение ГВ из различных источников (торфов, сапропелей, углей и др.) или их синтетических аналогов, полученных с помощью методов “зеленой химии”, в сельскохозяйственном производстве.
Одним из подходов, позволяющих расширить имеющиеся сведения о механизмах биологической активности почвенных ГВ, является параллельный структурный и функциональный анализ большого набора различных по генезису препаратов ГВ с использованием современных статистических методов для установления типа химических структур, отвечающих за различные типы биологической активности [20, 21, 29, 32, 39].
Другим подходом является разделение ГВ на отдельные компоненты или фракции, обладающие неодинаковым влиянием на рост и/или физиологическую и биохимическую активности растений с последующим всесторонним анализом химической структуры каждой фракции. Рядом исследователей продемонстрировано более сильное стимулирующее влияние гуминовых кислот (ГК) по сравнению с фульвокислотами (ФК) на рост корней и стеблей многих культур высших растений [51]. Однако имеются данные о том, что активность ФК может быть сравнима или даже быть выше активности ГК [5, 43]. Очевидно, что для понимания механизмов стимуляции роста растений требуются более “тонкие” методы фракционирования ГВ, чем их традиционное разделение на ГК, ФК и гумин. Для получения субфракций ГВ, ГК или ФК различного происхождения были использованы методы диализа [15, 16, 33, 38], эксклюзионной хроматографии низкого давления на сефадексе [27, 50], высокоэффективной эксклюзионной хроматографии [16, 22], а также ультрафильтрации [18, 26, 49]. В большинстве проведенных исследований фракционированию подвергались исходные препараты ГВ из почв [15, 16, 33, 49], компостов различных сроков созревания [26] или вермикомпоста [38]. В работе [50] фракционированию подвергали препарат почвенной ГК, а в работе [18] – препараты почвенных ГК и ФК, однако в обоих исследованиях была изучена лишь их способность влиять на ферментативную активность инвертазы [50] или четырех протеолитических ферментов [18], но не на рост растений. Лишь в одной работе [22] было проведено препаративное фракционирование ГК из вермикомпоста на фракции различного молекулярного размера (МР), изучены как некоторые структурные характеристики фракций, так и их способность влиять на скорость роста двух видов высших растений.
Трубецким с соавт. [7, 41, 48] разработан эффективный метод фракционирования почвенных ГК различного происхождения, основанный на сочетании препаративной эксклюзионной хроматографии низкого давления на сефадексе G-75 (ЭХ) и аналитического электрофореза в полиакриламидном геле (ЭПАГ). Использование сочетания ЭХ-ЭПАГ впервые позволило получить из ГК различного генезиса препаративные количества стабильных фракций, различающихся по электрофоретической подвижности и МР. Аналитический электрофорез использовался в качестве надежного критерия, позволяющего оценить эффективность фракционирования ГВ с помощью хроматографии. Стабильные электрофоретические фракции каждого образца ГК изучали с использованием рутинных и новейших аналитических методов, доказавших их контрастную химическую структуру [6–9, 23, 41, 46, 47].
Цель работы – исследование биологической активности контрастных по химической структуре стабильных электрофоретических фракций, полученных из препаратов ГК чернозема и ГК-1S102H – почвенного стандарта Международного гуминового общества (International Humic Substances Society – IHSS). Данное исследование является частью комплексного изучения структуры и функции почвенных ГК различного генезиса и их электрофоретических фракций, проводимое нами в течение последних 30 лет.
ОБЪЕКТЫ И МЕТОДЫ
Гуминовые вещества экстрагировали раствором 0.1 М пирофосфата натрия + 0.1 М NaOH (рН 13) из почвенного образца, взятого из горизонта А чернозема типичного тяжелосуглинистого на лёссе (Haplic Chernozem (Loamic, Pachic) (Курская область)). ГК чернозема получали кислотным осаждением как в работах [7, 41, 47, 48]. Препарат ГК, выделенный из почвы Эллиот (штат Иллинойс, США), являющийся основным международным почвенным гуминовым стандартом (1S102H), получен из Международного гуминового общества (IHSS). Информацию о методе выделения и структурных характеристиках данного стандарта можно найти на сайте IHSS (http://humic-substances.org/). Элементные составы в массовых процентах в пересчете на сухое беззольное вещество ГК чернозема (С – 62.5, Н – 4.3, N – 4.2) и стандарта ГК – 1S102H (С – 58.1, Н – 3.7, N – 4.1) весьма сходны, несмотря на различное географическое положение почв. Согласно американской классификации, обе почвы относятся к одному типу – моллисоль.
Сочетание препаративной ЭХ на колонке с сефадексом G-75 в 7М мочевине с аналитическим электрофорезом в 10% полиакриламидном геле (ЭПАГ) использовали для получения стабильных электрофоретических фракций ГК чернозема и стандарта ГК-1S102H согласно ранее разработанной методике [48]. Из препаратов ГК готовили по три индивидуальные стабильные электрофоретические фракции, названные А, В и C + D и различающиеся по времени выхода с хроматографической колонки. Для получения 100–200 мг фракций в 2010 г. проведено препаративное фракционирование 1 г ГК чернозема, включающее около 50 стандартных ЭХ-ЭПАГ процедур. В 2011 г. выделено 15–25 мг фракций из 100 мг почвенного стандарта ГК-1S102H. После очистки диализом и высушивания лиофилизацией сухие препараты фракций А, В и C + D, а также исходные препараты ГК хранили в темных плотно закрытых стеклянных баночках в темноте при комнатной температуре, периодически контролируя электрофоретические и некоторые спектральные характеристики препаратов. Фракции названы стабильными, так как в течение 9–10 лет наблюдения имели неизменные электрофоретическую подвижность, коэффициенты специфической абсорбции в ультрафиолетовой и видимой областях, а также идентичные спектры флуоресценции при длине волны возбуждения 270 нм.
Биологическую активность препаратов ГК чернозема, почвенного стандарта ГК-1S102H, а также фракций А, В и C + D, полученных из каждого образца ГК, оценивали методом фитотестирования по изменению длины первичных корней трехдневных проростков редиса (Raphanus sativus) относительно контроля (воды). В чашку Петри помещали диск фильтровальной бумаги диаметром 90 мм, равным диаметру чашки, на него раскладывали 10 семян редиса, бумагу смачивали 5 мл дистиллированной воды (контроль) или раствором ГК или фракции заданной концентрации. Сверху помещали второй бумажный диск, накрывали чашку крышкой и оставляли в темноте при комнатной температуре на 3 дня. Через 72 ч у каждого проростка измеряли длину первичного корня, затем все проростки выкладывали на темную пластиковую подложку и фотографировали. С помощью программы Excel рассчитывали среднее значение, стандартное отклонение, а также достоверность различий между экспериментальными и контрольными данными с использованием t-теста (критерия Стьюдента). Базовые растворы готовили растворением препаратов ГК и фракций до концентрации 1 мг/мл в 0.05 М NaOH и использовали в течение 1 месяца. В экспериментах по подбору оптимальных концентраций для фитотеста брали препарат ГК чернозема с концентрацией от 100 до 10–4 мг/л. Нужные концентрации получали путем разбавления аликвот базового раствора в 10, 100 и 1000 раз до объема 10 мл дистиллированной водой. Более низкие концентрации (10–3–10–4 мг/л) получали последовательным разбавлением раствора с концентрацией 1 мг/л. При сравнительном изучении биологической активности ГК и соответствующих фракций использовали три различные концентрации растворов: 1, 10–3 и 10–4 мг/л, то есть каждый эксперимент включал анализ 13 чашек Петри: 1 – контроль, 2–4 – ГК, 5–7 – фракция А, 8–10 – фракция В, 11–13 – фракция C + D. В одном эксперименте было использовано 130 семян редиса. Для ГК чернозема и фракций эксперимент проводили в шести повторностях в апреле–мае 2013 (две), марте–апреле 2018 (две) и апреле–мае 2019 гг. (две). Для почвенного стандарта ГК-1S102H и фракций эксперимент проводили в четырех повторностях в марте–апреле 2018 (две) и апреле–мае 2019 гг. (две).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
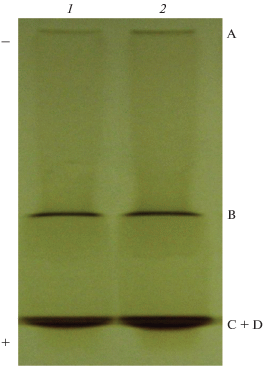
На рис. 1 представлены электрофореграммы ГК чернозема и международного почвенного стандарта ГК-1S102H в 10%-ном полиакриламидном геле (ПАГ). ГК, выделенные из почв различного генезиса и географического положения, разделились в электрическом поле на три дискретные естественно окрашенные коричневые зоны со сходными электрофоретическими подвижностями, обозначенные А (стартовая зона, не входящая в поры 10% ПАГ), В (узкая зона в середине геля) и С + D (зона в нижней части геля, состоящая из двух полос с близкими электрофоретическими подвижностями). С помощью сочетания ЭХ-ЭПАГ получены препаративные количества индивидуальных стабильных электрофоретических фракций А, В и C + D из обоих препаратов ГК.
Рис. 1.
Электрофореграмма ГК чернозема (1) и международного почвенного стандарта ГК-1S102H (2) в 10% ПАГ. Естественно окрашенные коричневые зоны на электрофореграмме представляют собой фракции А, В и C + D. Знаками + и – обозначено положение анода и катода.
Проведено исследование биологической активности исходных препаратов ГК чернозема, международного почвенного стандарта ГК-1S102H, а также их индивидуальных стабильных электрофоретических фракций А, В и C + D. Влияние препаратов ГК на рост высших растений оценивали с помощью метода проращивания семян редиса на фильтровальной бумаге, смоченной водой (контроль) или растворами ГК заданной концентрации. Первоначально проведена серия экспериментов по определению оптимальной концентрации ГК чернозема, вызывающей максимальное увеличение длины первичных корней трехдневных проростков редиса. Использовали концентрации ГК чернозема (СГКчернозема) в диапазоне от 100 до 10–4 мг/л. Оказалось, что в данном тесте при СГКчернозема = 10 мг/л и больше наблюдали ингибирование роста первичных корней редиса. Существенный стимулирующий эффект был обнаружен для СГКчернозема в диапазоне от 1 до 10–4 мг/л, причем по критерию Стьюдента при СГКчернозема = 10–3 мг/л различия между контрольными экспериментами в воде и растворе ГК были достоверны с p < 0.05, в то время как для СГКчернозема = 1 мг/л достоверность соблюдалась c p < 0.25, а при 10–4 мг/л – c p < 0.1. На основании вышеприведенного эксперимента для сравнительного анализа биологической активности ГК различного генезиса и их стабильных электрофоретических фракций (далее фракций) использовали концентрации препаратов 1, 10–3 и 10–4 мг/л.
На рис. 2 и в табл. 1 приведены результаты двух экспериментов, проведенных в апреле 2018 г. Международный почвенный стандарт ГК-1S102H показал результаты, сходные с ГК чернозема при концентрациях 10–3 и 10–4 мг/л. Оба препарата стимулировали рост первичных корней трехдневных проростков редиса (ГК чернозема – на 111 и 65%, ГК-1S102H – на 125 и 104% соответственно). Однако при концентрации 1 мг/л препарат ГК-1S102H на 44% снизил среднюю длину корней в противоположность ГК чернозема, где наблюдалось увеличение средней длины корней на 30%. Максимальный стимулирующий эффект обоих препаратов ГК – увеличение длины первичных корней трехдневных проростков редиса более, чем в два раза, проявлялся при концентрации 10–3 мг/л.
Рис. 2.
Влияние концентрации ГК чернозема и международного почвенного стандарта ГК-1S102H и их фракций А, В и C + D различного МР, полученных с помощью сочетания ЭХ-ЭПАГ, на длину первичных корней трехдневных проростков редиса. Слева (А, В) – результаты оригинальных экспериментов, справа (Б, Г) – диаграммы средних значений длины первичных корней со стандартными отклонениями.
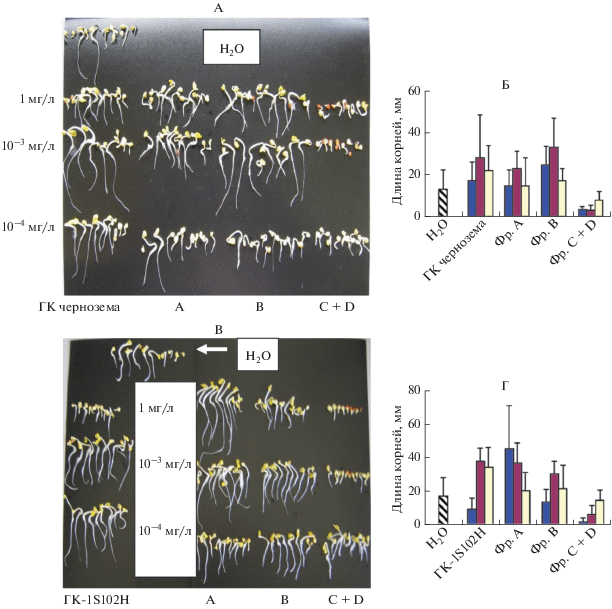
Таблица 1.
Биологическая активность ГК чернозема, международного почвенного стандарта ГК-1S102H и их стабильных электрофоретических фракций А, В, C + D, полученных с помощью сочетания ЭХ-ЭПАГ, в фитотесте по стимуляции или ингибированию длины первичных корней трехдневных проростков редиса (Raphanus sativus). Эксперименты проведены в апреле 2018 г.
| Образец | Номинальный молекулярный размер фракций, кДа | Биологическая активность | |||||
|---|---|---|---|---|---|---|---|
| СГК, 1 мг/л | СГК, 10–3 мг/л | СГК, 10–4 мг/л | |||||
| среднее значение длины корней, мм |
Т-тест* | среднее значение длины корней, мм | Т-тест | значение длины корней, мм | Т-тест | ||
| ГК чернозема | – | 17.0 ± 8.7 | 0.22 | 28.7 ± 20.5 | 0.03 | 21.7 ± 12.0 | 0.07 |
| фракция А | >100 | 14.7 ± 7.4 | 0.37 | 22.9 ± 8.0 | 0.03 | 14.8 ± 13.0 | 0.38 |
| фракция В | 100-30 | 24.4 ± 8.7 | 0.01 | 32.8 ± 13.6 | 0.002 | 17.1 ± 5.7 | 0.19 |
| фракция C + D | 30-5 | 3.5 ± 1.2 | 0.02 | 3.1 ± 2.6 | 0.01 | 8.0 ± 3.8 | 0.12 |
| ГК-1S102H | – | 9.1 ± 6.6 | 0.05 | 37.5 ± 7.9 | 0.0001 | 34.0 ± 11.8 | 0.002 |
| фракция A | >100 | 44.8 ± 26.0 | 0.003 | 36.8 ± 11.5 | 0.0006 | 19.8 ± 11.1 | 0.28 |
| фракция B | 100-30 | 13.6 ± 7.4 | 0.25 | 30.2 ± 7.5 | 0.004 | 21.2 ± 14.2 | 0.23 |
| фракция C + D | 30-5 | 1.7 ± 2.0 | 0.0006 | 5.8 ± 5.2 | 0.009 | 14.4 ± 5.8 | 0.30 |
* Т-тест (критерий Стьюдента) использовали для сравнения экспериментов по прорастанию семян в растворах гуминовых веществ и контрольных экспериментов в воде. В эксперименте с ГК чернозема и фракций среднее контрольное значение длины корней в воде составляло 13.1 ± 9.0 мм, в эксперименте с ГК-1S102H и фракций – 16.7 ± 11.0 мм.
Биологические активности фракций А, В и C + D в пределах каждого образца ГК значительно различались между собой. Фракции А и В из обоих образцов ГК стимулировали рост корней, а фракции C + D ингибировали прорастание семян редиса. По критерию Стьюдента ингибирование роста корней было достоверным (p < 0.05) при концентрациях фракции C + D, равных 1 и 10–3 мг/л. При снижении концентрации фракции C + D до 10–4 мг/л ее ингибирующая способность заметно уменьшилась. Максимальная стимулирующая активность была обнаружена во фракции В из ГК чернозема (увеличение длины корней по сравнению с контролем в 1.9 и 2.5 раза при концентрациях 1 и 10–3 мг/л соответственно), а также во фракции А из международного почвенного стандарта ГК-1S102H (увеличение длины корней по сравнению с контролем в 2.7 и 2.2 раза при концентрациях 1 и 10–3 мг/л соответственно).
Тестирование биологической активности фракций ГК чернозема проводили в шести повторностях – по две в 2013, 2018 и 2019 гг., а с почвенным стандартом ГК-1S102H в четырех – по две в 2018 и 2019 гг. Оказалось, что стимулирующая и ингибирующая активности фракций сохраняются на одном уровне в течение наблюдаемого периода, и максимальную активность фракции проявляют при ультранизкой концентрации 10–3 мг/л. Следует отметить, что все проведенные ранее другими исследователями эксперименты по влиянию препаратов ГВ различного происхождения на прорастание семян различных культур проводились при концентрациях не меньше 1 мг/л [1, 5, 10, 11, 35, 45, 51, 52].
Высокую эффективность ультранизких концентраций стабильных электрофоретических фракций почвенных ГК можно объяснить их контрастной химической структурой и физико-химическими свойствами, определенными ранее. На основании объема элюции индивидуальных фракций с сефадексной колонки, а также данных электрофореза в 10% ПАГ, ультрафильтрации на серии мембран с различным диаметром пор, сделан вывод о том, что в обоих препаратах ГК фракция А обладает наибольшим МР, сравнимым с размерами глобулярных белков молекулярной массы более 100 кДа, фракция В – 100–30 кДа, а фракция C + D – 30–5 кДа [6–8]. Электрофоретические слабозаряженные фракции А и В наибольшего МР состоят, главным образом, из гидрофобных алифатических длинноцепочечных углеводородных цепочек (насыщенных и ненасыщенных жирных кислот, алканов и алкенов), белковых и углеводных фрагментов. Напротив, наиболее гидрофильная легкорастворимая в воде фракция C + D наименьшего МР обогащена ароматическими структурными компонентами и карбоксильными группами. Совокупность этих свойств для каждой фракции получена с использованием методов обратно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) [7], Н1- и С13-ЯМР [47], пиролитической газовой хроматографии/масс-спектроскопии метилированных препаратов [9], горячего кислотного гидролиза [46], трехмерного флуоресцентного анализа [8], капиллярного электрофореза [23]. Можно предположить, что наличие алифатических амфифильных компонентов типа жирных кислот, которыми в особенности обогащены фракции А и В, облегчает проникновение активных компонентов ГВ из водных растворов в клеточные мембраны корней проростков редиса, способствуя прямой стимуляции роста корней, несмотря на значительный МР фракций. Для подтверждения данного предположения требуются дополнительные эксперименты с использованием радиоактивно-меченных стабильных электрофоретических фракций.
Следует принять во внимание высокую степень очистки фракций в процессе фракционирования ГК предложенным методом ЭХ-ЭПАГ. Раствор 7 М мочевины, использованный в качестве подвижной фазы в процессе препаративной ЭХ, разрывает водородные связи, предотвращая как взаимодействие между отдельными компонентами ГК, так и между ГК и частицами сефадекса. Одновременно мочевина является дезагрегирующим агентом, взаимодействующим с гидрофобной неполярной частью насыщенных жирных кислот [53], входящих в состав ГК. Кроме того, отбор фракций осуществляли на основании тестирования хроматографического профиля с помощью аналитического электрофореза. Это позволило выделить фракции, формирующие в ПАГ только одну электрофоретическую зону. Использование аналитического электрофореза совместно с УФ-детекцией было дополнительным критерием, позволяющим эффективно отобрать хроматографические фракции, контрастирующие не только по МР и электрофоретической подвижности, но и по химической структуре.
МР является одной из наиболее важных физико-химических характеристик ГВ, однако степень влияния этого параметра на способность стимулировать рост растений до конца не определена. Используя метод ультрафильтрации Дель’ Амико с соавт. [26], обнаружили, что независимо от времени компостирования городских отходов фракция ГВ наименьшего МР (<1 кДа) ингибировала прорастание семян ячменя, а фракция наибольшего МР (>10 кДа) оказывала стимулирующее действие. Причем как стимулирующий, так и ингибирующий эффекты не превышали 5–10%. Сходный эффект был продемонстрирован Альбузио с соавт. [15] на почвенном препарате ГВ, фракционированном с помощью диализа на две фракции с номинальными МР более и менее 8 кДа. Фракция с МР > 8кДа на 10–20% стимулировала рост 15-дневных проростков овса и перенос в корни растений макроэлементов, а фракция с МР < 8кДа стимулировала увеличение количества хлорофилла в листьях в два раза, но не влияла на рост растений. Авторы предположили, что поведение фракции с МР < 8кДа сходно с влиянием на растения растворимых фенолполикарбоновых кислот, проявляющих сходное действие на проростки высших растений. Однако авторами не было проведено структурного анализа полученных фракций ГВ, подтверждающих данное предположение. В работе Мусколо с соавт. [33] после фракционирования диализом подкисленных уксусной кислотой препаратов ГВ, выделенных из почв различного генезиса, фракции с МР менее и более 3.5 кДа одинаково влияли на рост каллуса черной сосны. В более поздних исследованиях этих авторов показано, что ГВ после удаления водорастворимых фенолов стимулировали рост растений в целом ряде тестов, в то время как фракция экстрагированных водорастворимых фенолов проявляла ингибирующее действие [34]. К сожалению, они не оценивали МР полученных фракций, а о наличии фенолов судили лишь на основании использования классической методики их экстракции. Канеллас и Пикколо [22] с помощью ЭХ-ВЭЖХ провели препаративное фракционирование препарата ГК из вермикомпоста на шесть фракций, различающихся по МР. Для каждой фракции и исходного препарата были определены С13-ЯМР спектры и биологическая активность. Несмотря на различные МР, фракции имели сходные С13-ЯМР-спектры, и их структура отличалась от исходного препарата ГК в сторону существенного увеличения содержания алифатических и уменьшения ароматических компонентов, что частично можно объяснить необратимой сорбцией части вещества на колонке, использованной для фракционирования, или его потери в процессе очистки фракций диализом. Фракции ГК вермикомпоста различного МР, слабо различающиеся по структуре, одинаково стимулировали увеличение длины первичных корней и количества боковых корней проростков арабидопсиса и кукурузы, причем стимулирующий эффект фракций был в 3–5 раз больше по сравнению с исходным препаратом ГВ. В использованных биологических тестах показана прямая взаимосвязь между содержанием алифатических компонентов и стимуляцией роста экспериментальных растений.
ЗАКЛЮЧЕНИЕ
Суммируя вышеприведенные литературные данные и результаты наших исследований с большой долей вероятности можно предположить, что определяющим фактором стимуляции роста является наличие алифатических компонентов в составе ГВ и фракций, а не их МР, в то время как наличие ароматических компонентов (например, полифенолов) вызывает ингибирование роста растений.
Идентификация в составе почвенных ГВ различного происхождения индивидуальных фракций различной химической структуры с контрастными биологическими свойствами и возможность их выделения в препаративных количествах открывает широкие перспективы для химического синтеза препаратов с функцией стимуляции или ингибирования роста растений, а также целевого поиска природного сырья (отработанных угледобывающих отвалов, сапропелей, торфов и др.), обладающего заданными свойствами.
Список литературы
Аброськин Д.П., Фуентес М., Гарсиа-Мина Х.М., Кляйн О.И., Сенник С.В., Волков Д.С., Перминова И.В., Куликова Н.А. Влияние гуминовых кислот и их комплексов с железом на функциональное состояние растений, выращенных в условиях дефицита железа // Почвоведение. 2016. № 10. С. 1167–1177. https://doi.org/10.7868/S0032180X16100026
Гуминский С. Механизм и условия физиологического действия гумусовых веществ на растительный организм // Почвоведение. 1957. № 12. С. 72–78.
Ибрагимов К.С., Фокин А.Д. Поглощение растениями водорастворимой фракции гумусовых веществ из подзолистой почвы // Известия Тимирязевской сельскохозяйственной академии. 1985. № 5. С. 74–80.
Кононова М.М. Органическое вещество почв. М.: Изд-во АН СССР, 1963. 314 с.
Кононова М.М., Панкова Н.А. Воздействие гумусовых веществ на рост и развитие растений // Доклады АН СССР. 1950. Т. XXIII. № 5. С. 1069–1071.
Трубецкой О.А., Пацаева С.В., Трубецкая О.Е. Фотохимическая деградация органических загрязняющих веществ в растворах почвенных гуминовых кислот // Почвоведение. 2019. № 9. С. 1063–1069. https://doi.org/10.1134/S0032180X19090107
Трубецкой О.А., Трубецкая О.Е. Обратно-фазовая высокоэффективная жидкостная хроматография стабильных электрофоретических фракций почвенных гуминовых кислот // Почвоведение. 2015. № 2. С. 166–174.https://doi.org/10.7868/S0032180X15020124
Трубецкой О.А., Трубецкая О.Е. Трехмерный флуоресцентный анализ почвенных гуминовых кислот чернозема и их электрофоретических фракций // Почвоведение. 2017. № 9. С. 1057–1064.https://doi.org/10.7868/S0032180X1709008
Трубецкой О.А., Трубецкая О.Е., Сайз-Хименес Ц. Исследование стабильных электрофоретических фракций гуминовых кислот методом пиролитической газовой хроматографии/масс-спектроскопии // Почвоведение. 2005. № 11. С. 1333–1340.
Христева Л.А. Об участии гуминовых кислот и других органических веществ в питании высших растений // Почвоведение. 1953. № 10. С. 46–59.
Христева Л.А. Стимулирующее влияние гуминовой кислоты на рост высших растений и природа этого явления // Гуминовые удобрения. Теория и практика их применения. Изд-во Харьковского ун-та, 1957. С. 75–93.
Христева Л.А. Физиологическая функция гуминовой кислоты в процессах обмена веществ высших растений // Гуминовые удобрения. Теория и практика их применения. Изд-во Харьковского ун-та, 1957. С. 95–108.
Христева Л.А., Пшеничный А.Е., Пивоваров Л.Р. Влияние гуминовой кислоты на жизнедеятельность высших растений при различных условиях минерального питания // Гуминовые удобрения. Теория и практика их применения. Изд-во Харьковского ун-та, 1957. С. 109–126.
Ярчук И.И., Пшеничный А.Е., Глобин П.Д., Кухаревский Г.В., Кузько Ф.С. и др. Эффективность гуминовых удобрений // Гуминовые удобрения. Теория и практика их применения. Изд-во Харьковского ун-та, 1957. С. 237–374.
Albuzio A., Nardi S., Dell’Anola G. Effect of humic fractions of different molecular size on the development of oat seedlings grown in varied nutritional conditions // Humic Substances in the Global Environment and Implication on Human Health. 1994. P. 199–204.
Albusio A., Nardi S., Gulli A. Plant growth regulation activity of small molecular size humic fractions // Sci. Total Environ. 1989. V. 81–82. P. 671–674.
Aranson N.Q., Edvards C.A., Lee S., Byrne R. Effects of humic acids from vermicomposts on plant growth // Eur. J. Soil Biol. 2006. V. 42. P. S65–S69.
Butler J.H.A., Ladd J.N. Importance of the molecular weight of humic and fulvic acids in determining their effects on protease activity // Soil Biol. Biochem. 1971. V. 3. P. 249–257.
Bottomley W.B. Some accessory factors in plant growth and nutrition // Proc. R. Soc. Lond. (Biol). 1914. V. 88. P. 237–247.
Canellas L.P., Zandonadi D.B., Busato J.G., Baldotto M.A., Simões M.L., Martin-Neto L., Façanha A.R., Spassini R., Piccolo A. Bioactivity and chemical characteristics of humic acids from tropical soils sequence // Soil Sci. 2008. V. 173. P. 624–637.
Canellas L.P., Dobbss L.B., Olivera A.L., Chagas J.G., Aguiar N.O., Rumjanek V.M., Novotny E.H., Olinares F.L., Spassini R., Piccolo A. Chemical properties of humic matter as related to induction of plant lateral roots // Eur. J. Soil Sci. 2012. V. 63. P. 315–324.
Canellas L.P., Piccolo A., Dobbss L.B., Spaccini R., Olivares F.L., Zandonadi D.B., Façanha A.R. Chemical composition and bioactivity properties of size-fractions separated from a vermicompost humic acid // Chemosphere. 2010. V. 78. P. 457–466.
Cavani L., Ciavatta C., Trubetskaya O.E., Reznikova O.I., Afanas’eva G.V., Trubetskoj O.A. Capillary zone electrophoresis of soil humic acid fractions obtained by coupling size-exclusion chromatography and polyacrylamide gel electrophoresis // J. Chromatography A. 2003. V. 983. P. 263–270.
Chen Y., Aviad T. Effect of humic substances on plant growth // Humic Substances in Soil and Crop Science: Selected Readings. Madison, 1990. P. 161–186.
Chen X.Z., Kou M., Tang Z.H., Zhang A.J., Li H.M., Wei M. Responses of root physiological characteristics and yield of sweet potato to humic acid urea fertilizer // PLOS ONE 2017. V. 12(12). https://doi.org/10.1371/journal.pone.0189715
Dell’Amico C., Masciandaro G., Ganni A., Ceccanti B., Garcia C., Hernandez T., Costa F. Effects of specific humic fractions on plant growth // Humic Substances in the Global Environment and Implication on Human Health. 1994. P. 563–566.
Fedoseeva E., Stepanov A., Yakimenko O., Patsaeva S., Freidkin M., Khundzhua D., Terekhova V. Biodegradation of humic substances by microscopic filamentous fungi: chromatographic and spectroscopic proxies // J. Soils Sediments. 2019. V. 19. P. 2676–2687.
Flaig W. Zur chemie der Huminsäuren und über die physiologische wirkung von modellsubastanzen von Huminsäuren // Arzneimittel-Forschung. 1954. V. 4. P. 402.
Garcia A.C., De Souza L.G.A., Pireira M.G., Castro R.N., Garcia-Mina J.M., Zonta E., Lisboa F.J.G., Berbara R.L.L. Structure-property-function relationship in humic substances to explain the biological activity in plants // Sci. Rep. 2016. V. 6. https://doi.org/10.1038/srep20798
Hartly R.D., Whitehead D.S. Phenolic acids in soils and their influence on plant growth and soil microbial processes // Soil organic matter and biological activityeds. 1985. Ch. 3. P. 109–149.
Klein O.I., Isakova E.P., Deryabina Yu I., Kulikova N.A., Badun G.A., Chernysheva M.G., Stepanova E.V., Koroleva O.V. Humic substances enhance growth and respiration in the basidiomycetes Trametes maxima under carbon limited conditions // J. Chem. Ecology. 2014. V. 40. P. 643–652.
Martinez-Balmon D., Spassini R., Aguiar N.O., Novotny E.H., Olivares F.L., Canellas L.P. Molecular characteristics of humic acids isolated from vermicomposts and their relationship to bioactivity // J. Agricultural Food Chem. 2014. V. 62(47). P. 11412–11419. https://doi.org/10.1021/jf504629c
Muscolo A., Sidari M., Attinà E., Francioso O., Tugnoli V., Nardi S. Biological activity of humic substances is related to the chemical structure // Soil Sci. Soc. Am. J. 2007. V. 71. P. 75–85.
Muscolo A., Sidari M., da Silva J.A.T. Biological effects of water-soluble soil phenol and humic extract on plant system // Acta Physiologiae Plantarum. 2013. V. 35(2). P. 309–320. https://doi.org/10.1007/s11738-012-1065-0
Nardi S., Concheri G., Dell’Agnola G. Biological activity of humus // Humic Substances in Terrestrial Ecosystems. 1996. Ch. 9. P. 361–406. Elsevier Science.
Nardi S., Pizzeghello D., Schiavon M., Ertani A. Plant biostimulants: physiological responses induced by protein hydrolyzed-bazed products and humic substances in plant metabolism // Scientia Agricola. 2016. V. 73(1). P. 18–23. https://doi.org/10.1590/0103-9016-2015-0006
Nardi S., Pizzeghello D., Muscolo A., Vianello A. Physiological effects of humic substances on higher plants // Soil Biol. Biochem. 2002. V. 34. P. 1527–1536.
Nardi S., Panuccino M.R., Abenavoli M.R., Muscolo A. Auxin-like effect of humic substances extracted from faeces of Allolobophora caliginosa and A.rosea // Soil Biol. Biochem. 1994. V. 26(10). P. 1341–1346.
Piccolo A., Nardi S., Concher G. Structural characteristivs of humic substances as related to nitrate uptake and growth regulation in plant systems // Soil Biol. Biochem. 1992. V. 24(4). P. 373–380.
Prat S., Pospišil F. Humic acids with C14 // Biol. Plantarum. 1959. V. 1. P. 71–81.
Richard C., Trubetskaya O.E., Trubetskoj O.A., Reznikova O.I., Afanas’eva G.V., Aguer J.P., Guyot G. The key_role of the low molecular size fraction of soil humic acids for fluorescence and photoinductive activity // Environ. Sci. Technol. 2004. V. 38. P. 2052–2057.
Savy D., Canellas L., Vinci G., Cozzolino V. Humic-like water-soluble lignins from Giant Reed (Arundo donax L.) display hormone-like activity on plant growth // J. Plant Growth Regulation. 2017. V. 36(4). P. 995–1001.
Sladky Z. The application of extracted humus substances to overground parts of plants // Biologia Plantarum 1959. V. 1. P. 199–204.
Thomas S.M., Thorne G.N., Pearman I. Effect of nitrogen on growth, yield and photorespiratory activity in spring wheat // Annals of Botany. 1978. V. 42. P. 827–837.
Trevisan S., Francioso O., Quaggiotti S., Nardi S. Humic substances biological activity at the plant-soil interface // Plant Signaling Behavior. 2010. V. 5–6. P. 635–643.
Trubetskaya O.E., Trubetskoj O.A., Afanas’eva G.V., Reznikova O.I., Markova L.F., Muranova T.A. Amino acids distribution in soil humic acids fractionated by tandem size exclusion chromatography polyacrylamide gel electrophoresis // Environ. Int. 1998. V. 24. P. 573–581.
Trubetskoj O.A., Hatcher P.G., Trubetskaya O.E. 1H-NMR and 13C-NMR spectroscopy of chernozem soil humic acid fractionated by combined size exclusion chromatography and electrophoresis // Chem. Ecology. 2010. V. 26. P. 315–325.
Trubetskoj O.A., Trubetskaya O.E., Afanas’eva G.V., Reznikova O.I., Saiz-Jimenez C. Polyacrylamide gel electrophoresis of soil humic acid fractionated by size-exclusion chromatography and ultrafiltration // J. Chromatography A. 1997. V. 767. P. 285–292.
Varanini Z., Pinton R., De Biasi M.G., Astolfi S., Maggioni A. Low molecular weight humic substances stimulate H+-ATPase activity of plasma membrane vesicles isolated from oat (Avena sativa L.) roots // Plant and Soil. 1993. V. 153. P. 61–69.
Vaughan D. The stimulation of invertase development in aseptic storage tissue slices by humic acid // Soil Biol. Biochem. 1967. V. 1. P. 15–28.
Vaughan D., Malcolm R.E. Influence of humic substances on growth and physiological processes // Soil organic matter and biological activity, chapter 1. Dordrecht, 1985. P. 37–75.
Vaughan D., Malcolm R.E., Ord B.G. Influence of humic substances on boichemical processes in plants // Soil organic matter and biological activity, chapter 2. Dordrecht, 1985. P. 77–108.
Wallqvist A., Covell D.G. Hydrophobic interactions in aqueous urea solutions with implications for the mechanism of protein denaturation // J. Am. Chem. Soc. 1998. V. 120. P. 427–428
Дополнительные материалы отсутствуют.


