Почвоведение, 2021, № 8, стр. 927-934
Методические аспекты определения жирных кислот в почве методом термохимолиза
Ю. Р. Фарходов a, b, *, Н. В. Ярославцева a, В. А. Холодов a
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: yulian.farhodov@yandex.ru
Поступила в редакцию 30.12.2020
После доработки 02.03.2021
Принята к публикации 03.03.2021
Аннотация
Жирные кислоты являются информативной частью неспецифического почвенного органического вещества. Их состав и содержание отражают особенности многих почвенных процессов и структуру микробиома почвы. Одним из наиболее простых и быстрых широко используемых методов анализа жирных кислот является термохимолиз. Однако до сих пор остаются не раскрытыми многие методические вопросы данного анализа. Цель работы – оценка влияния различных условий термохимолиза на содержание и состав жирных кислот типичного чернозема. Определен метиловых эфиров жирных кислот (МЭЖК) в зависимости от концентрации метилирующего агента гидроксида тетраметиламмония (ТМАГ), температуры пиролиза и времени инкубирования ТМАГ с почвой. Обнаружено, что при внесении избыточного количества дериватизирующего агента в условиях высокой температуры пиролиза уменьшаются выход МЭЖК и относительное содержание мононенасыщенных МЭЖК. Оптимальными условиями для анализа содержания жирных кислот являются температуры 300–500°С с применением 15–40 мкмоль/гС ТМАГ. Показано, что время экспозиции ТМАГ с почвой перед анализом не влияет на результаты термохимолиза.
ВВЕДЕНИЕ
Одним из важных компонентов почвы является органическое вещество [24]. Оно включает в себя как органические остатки (ткани растений и животных), так и отдельные вещества, которые подразделяются на специфические и неспецифические. Специфические вещества – это собственно гуминовые вещества, прошедшие специфический процесс гумификации, а неспецифические – все остальные [6].
Жирные кислоты (ЖК) формируются в живых организмах как конституционная составляющая клеточных мембран. При поступлении растительных остатков в почву ЖК становятся важным компонентом неспецифического почвенного органического вещества. По их совокупности можно судить о направлении трансформации органического вещества в почве, а с привлечением данных высокопроизводительного секвенирования возможно детальное изучение структуры и состояния микробного сообщества [7, 24, 27].
Традиционный метод определения ЖК в почвах основан на экстракции, дериватизации и хроматографировании [5, 30]. Он реализуется в несколько этапов, что обычно занимает несколько дней. Этот подход, даже с использованием экстракторов [22], требует значительного количества растворителей. Таким образом, основными недостатками метода являются длительность проведения анализа, его трудоемкость, а также стоимость анализа. Главными преимуществами – возможность изучения разных фракций ЖК, а также относительная его доступность, так как он не требует использования дополнительного оборудования, кроме газового хроматографа.
Другим подходом для анализа ЖК состава почв является термохимолиз, его также называют термогидролиз с метилированием или реакционным пиролизом. Метод заключается в пиролизе и дериватизации его продуктов с последующей газовой хроматографией [13]. По тому, когда происходит дериватизация продуктов пиролиза, темохимолиз делят на два типа: on-line и off-line. Для on-line термохимолиза характерна дериватизация в пиролитической ячейке во время пиролиза, при off-line термохимолизе продукты пиролиза собирают и дериватизируют отдельно [35]. В последнее время наиболее распространенным способом становится метод on-line термохимолиза, преимуществом которого является экспрессность. При этом основной недостаток заключается в необходимости использования дополнительного прибора в виде пиролитической приставки к газовому хроматографу.
Для дериватизации пиролизатов почвенного органического вещества обычно применяют алкилирующие (гидроксиды тетраметил,-этил,-бутиламмония, гидроксид триметилсульфония, ацетат тетраэтиламмония) и силилирующие (гексаметилдисилазан, триэтилсилилдиэтиламин, триметилсилилимидазол) реагенты [35]. В зависимости от исследуемых соединений подбирают необходимый дериватизирующий агент. Самым распространенным дериватизирующим агентом является гидроксид тетраметиламмония (ТМАГ, tetramethylammonium hydroxide, TMAH), который метилирует кислотные функциональные группы молекул, делая их менее полярными и более летучими. ТМАГ является сильным основанием (pKb 4.2) и может применяться при температурах термохимолиза до 600°С. Эти свойства делают его универсальным дериватизирующим агентом. Использование ТМАГ и ацетата тетраметиламмония (ТМАА), который обладает менее основными свойствами, для изучения ЖК в составе гумусовых кислот показало, что ТМАГ дериватизирует как свободные, так и связанные ЖК. В то время как ТМАА позволяет изучать только свободные ЖК. Таким образом, применение этих двух дериватизирующих агентов позволяет разделить ЖК по связи с гумусовыми кислотами [17, 38].
ТМАГ широко применяется для изучения почвенного органического вещества. Помимо определения состава ЖК, его используют для оценки содержания лигнина, сахаров, таннинов, аминокислот [19]. Однако в исследованиях часто опускают методические аспекты применимости: не обозначают объем, концентрацию дериватизирующего агента, не аргументируют выбор температуры пиролиза [10, 14, 16, 22, 36–39]. При изучении ЖК в составе бактерий Pseudomonas putida показано, что повышение температуры термохимолиза c ТМАГ до 500°С увеличивает выход МЭЖК, последующее повышение температуры уменьшает выход МЭЖК. Подобная закономерность – наличие оптимума – наблюдается при увеличении концентрации ТMAH [32]. При исследовании состава восков применяют температуру около 500°С [9], а для изучения лигнина и таннина оптимальная температура 500–600°С [23, 26, 27].
Другим фактором, который может повлиять на результаты анализа, является время инкубирования изучаемого образца вместе с ТМАГ. Время инкубирования ТМАГ с лигнином повышает выход некоторых его пиролизатов [23]. В другом исследовании инкубирование образцов криоконита с 25%-ным раствором ТМАГ приводило к существенному варьированию содержания МЭЖК в зависимости от продолжительности инкубирования [40]. Напротив, в аналогичном эксперименте, проводимом для ЖК молока, содержание МЭЖК не зависело от времени инкубирования пробы с ТМАГ [33].
Методические аспекты термохимолиза почвы для изучения ЖК состава практически не изучались, подобные исследования с черноземами Центральной России не проводили.
Цель работы – изучить влияние условий термохимолиза: температуры, концентрации ТМАГ и времени экспозиции ТМАГ с почвой – на содержание и состав ЖК.
ОБЪЕКТЫ И МЕТОДЫ
Отбор и подготовка образцов. В работе использовали образцы типичного чернозема (Haplic Chernozem) [3, 20], отобранные на участке многолетнего опыта “Ежегодно косимая степь” Центрально-Черноземного государственного биосферного заповедника им. В.В. Алехина (Курская область, 51°34.207 N, 36°05.444 E). Отбор образцов проводили из верхнего горизонта 0–15 см, методом конверта. Почву высушивали до воздушно-сухого состояния. В работе использовали смешанную пробу почвенных агрегатов 2–1 мм из трех индивидуальных образцов. Для исследования брали пробу смешанного образца около 100 г, которую перетирали в агатовой ступке и пропускали через сито 0.25 мм. Содержание общего углерода и азота (по данным сухого сжигания) составило 5.3 и 0.52% соответственно.
Термохимолиз. Навеску почвы от 2 до 3 мг помещали в чашечки для пиролиза объемом 80 мкл, добавляли 20 мкл раствора нонадекановой кислоты в ацетоне концентрацией 0.03 мг/мл (внутренний стандарт), чашечки высушивали в токе азота, после этого добавляли 20 мкл метилирующего агента, чашечки снова высушивали в токе азота, после чего проводили пиролиз в течение 1 мин при трех температурах: 300, 400 или 500°С, добиваясь увеличения интенсивности процессов температурной деструкции органических молекул. Для метилирования использовали 25%-ный по массе раствор ТМАГ (SigmaAldrich) в метаноле, из данного раствора готовили 4 рабочих раствора TMAГ с концентрациями 0.5, 1, 2.5, 5%. Объем рабочего раствора ТМАГ, который добавляли в чашечку с почвой был 20 мкл, что в пересчете на количество ТМАГ составляет 0.95, 1.9, 4.75, 9.5 мкмоль соответственно. Данный диапазон выбран таким образом, чтобы включал концентрации ТМАГ, которые чаще всего применяют в аналитическом пиролизе другие исследователи [19]. Нужно отметить, что раствор ТМАГ в метаноле обладает низким поверхностным натяжением, поэтому может формировать тонкую липкую пленку на поверхности чашечки для пиролиза и ее подставке. Следовательно, чтобы избежать потерь ТМАГ после его добавления, нужно избавиться от метанола путем высушивания.
Для проверки времени экспозиции ТМАГ с почвой в 21 чашечку вносили 4.75 мкмоль ТМАГ после чего в течение 40 ч каждые 2 ч анализировали по одному образцу при температуре 300°С.
В работе использовали пиролизер Frontier Lab Multi-Shot Pyrolizer EGA/PY 3030D, оснащенный автосемплером AS1020E и подключенный к газовому хроматографу с масс-детектором Shimadzu GCMS-QP2010 Ultra. Параметры хроматографирования: температура инжектора 300°С, капиллярная колонка GsBP-5MS длиной 30 м, газ-носитель гелий, скорость потока 1 мл/мин, температурный режим: начальная температура 100°С, без градиента 1.5 мин, затем температуру повышали со скоростью 5 град/мин до 300°С, далее температуру задерживали 7 мин при 300°С, возбуждение молекул проводили электронным ударом с энергией электронов 70 эВ, диапазон детектируемых m/z 47–600.
Идентификацию МЭЖК осуществляли с помощью библиотек масс-спектров NIST11, Library FAMEs, а также стандартного раствора МЭЖК C8-C24 (Supelco, CRM18918). Интегрирование хроматографических пиков проводили по ионам с m/z 55 и 74, которые являются основными для МЭЖК [4]. Для количественной оценки содержания МЭЖК применяли два способа: по нормированным значениям площадей хроматографических пиков относительно внутреннего стандарта, а также методом внутренней нормализации.
Для оценки влияния времени экспозиции метилирующего агента с почвой, его концентрации, а также температуры пиролиза изучали метиловые эфиры ненасыщенных ЖК: пальмитолеиновой (16 : 1ω7 по омега классификации) и олеиновой (18 : 1ω9), насыщенных ЖК: пальмитиновой (16 : 0), стеариновой (18 : 0), а также определяли сумму всех идентифицированных МЭЖК.
Статистическую обработку данных проводили с помощью дисперсионного анализа [2].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние температуры пиролиза и концентрации ТМАГ. На рис. 1 представлены данные содержания МЭЖК (отношение площади хроматографического пика анализируемого вещества к площади пика внутреннего стандарта) в зависимости от температуры термохимолиза и количества ТМАГ. Двухфакторный дисперсионный анализ показал, что на содержание МЭЖК достоверно влияет концентрация ТМАГ, а также взаимодействие факторов концентрации и температуры (табл. S1, S2 ). Видно, что увеличение концентрации добавляемого ТМАГ приводит к увеличению содержания МЭЖК, что закономерно. Влияние температуры на содержание МЭЖК тесно связано с концентрацией ТМАГ. При низких концентрациях ТМАГ высокая температура термохимолиза приводит к более эффективному метилированию ЖК. Для варианта c внесением 4.75 мкмоль ТМАГ эффективность метилирования не зависела от температуры. При бóльших концентрациях ТМАГ – температура, напротив, уменьшала выход МЭЖК. Вероятно, это связано с тем, что при низких концентрациях вещества высокая температура термохимолиза сдвигает химическое равновесие в сторону продуктов реакции, а при высокой температуре и высоких концентрациях ТМАГ, химическое равновесие сдвигается в сторону исходных веществ [18, 31].
Рис. 1.
Содержание МЭЖК (среднее, стандартное отклонение, n = 3) в зависимости от температуры и количества ТМАГ.

Для оценки состава ОВ почвы по данным пиролиза обычно используют метод внутренней нормализации, получая относительное содержание (relative abundance) каждого компонента относительно суммы всех компонентов пробы [42]. На рис. 2 представлены данные по относительному содержанию МЭЖК в почве, где видно, что температура и концентрация дериватизирующего агента оказывают влияние на долю обеих рассматриваемых ненасыщенных МЭЖК. В то же время относительное содержание насыщенных МЭЖК практически не зависит от этих факторов. На примере оценки относительного содержания метилпальмитолеата и метилолеата следует отметить, что способность мононенасыщенных ЖК к дериватизации неоднородна. Это хорошо заметно по выходу мононенасыщенных МЭЖК при температуре термохимолиза 500°С. Вероятно, этот факт связан с различиями в константах диссоциации ненасыщенных ЖК: пальмитолеиновая кислота обладает более выраженными кислотными свойствами по сравнению с олеиновой, поэтому при низких концентрациях ТМАГ эффективнее с ней взаимодействует [1]. При высоких концентрациях ТМАГ доля ненасыщенных МЭЖК одинаково уменьшается. Из литературных источников известно, что избыток ТМАГ приводит к изомеризации полиненасыщенных ЖК, уменьшая долю каждого изомера, а для мононенасыщенных ЖК подобной закономерности не наблюдается [12, 15, 41]. В нашем случае уменьшение доли мононенасыщенных МЭЖК, видимо, связано с гидрированием двойной связи. Об этом может свидетельствовать увеличение доли метилпальмитата, который образуется при гидрировании метилпальмитолеата. Однако остается непонятным, почему этот процесс выражен при высоких концентрациях дериватизирующего агента.
Рис. 2.
Относительное содержание МЭЖК (среднее, стандартное отклонение, n = 3) в зависимости от температуры и количества ТМАГ.
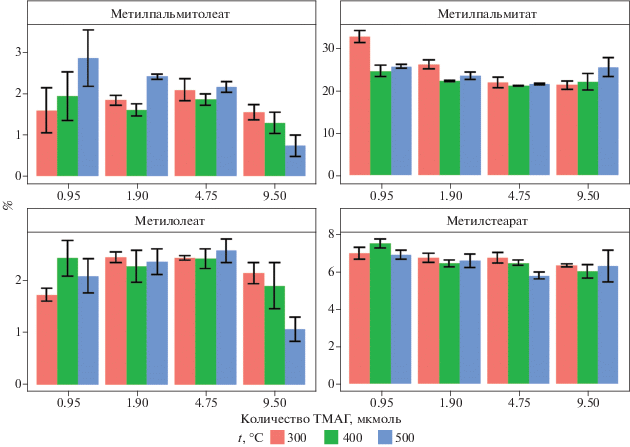
В эксперименте показано, что наибольшее влияние на результаты термохимолиза оказывает избыток ТМАГ. Поэтому для его проведения следует рекомендовать использование концентрации 1.9–4.75 мкмоль ТМАГ, что в пересчете на углерод почвы составляет 15–40 мкмоль/г. Точную оценку дать невозможно, так как доля липидов в почвенном органическом веществе сильно варьирует в зависимости от состава растительных остатков, типа почвы, горизонта и других факторов. Стоит отметить, что для предотвращения отрицательного влияния избытка ТМАГ в анализируемую пробу можно вносить метилацетат или уксусную кислоту [11, 12].
Влияние времени взаимодействия с ТМАГ. В исследовании для подачи проб в пиролизер использовали автосемплер. Поэтому после внесения дериватизирующего агента пробы попадали в пиролитическую ячейку по очереди примерно через каждые 2 ч. Таким образом, экспозиция почвы c ТМАГ до анализа увеличивалась по мере увеличения номера образца в автосемплере. Для оценки влияния времени экспозиции ТМАГ с почвой провели последовательный анализ по одному образцу при температуре 300°С 21 одинаковой пробы почвы с добавлением 4.75 мкмоль ТМАГ в течение 40 ч каждые 2 ч. Результаты этого эксперимента представлены на рис. 3. Видно, что тренд на уменьшение или увеличение содержания МЭЖК отсутствует. Однофакторный дисперсионный анализ показал, что содержание МЭЖК не зависит от времени нахождения почвы вместе с ТМАГ (табл. S3 ). Поэтому можно сделать вывод, что до проведения термохимолиза почвенное органическое вещество не реагирует с ТМАГ с образованием МЭЖК. Коэффициенты вариаций (CV) значений содержания МЭЖК в случае расчета относительно площадей пиков с нормированием на навеску и внутренний стандарт не превышали 20%, а при использовании метода внутренней нормализации 10% (табл. S4 ). Это говорит о приемлемой сходимости полученных данных [25]. В случае использовании метода внутренней нормализации коэффициенты вариации закономерно меньше, так как роль стандарта формально играет совокупность всех регистрируемых на хроматограмме компонентов [29].
ЗАКЛЮЧЕНИЕ
В ходе исследования показано влияние температуры и концентрации ТМАГ на результаты термохимолиза при изучении ЖК состава почвы. Выявлено, что оптимальными условиями термохимолиза для анализа содержания ЖК являются температуры 300–500°С и 15–40 мкмоль/гС ТМАГ. Показано, что время экспонирования почвы с ТМАГ не оказывает влияния на результаты термохимолиза. Хорошая сходимость (CV < 10%) результатов термохимолиза в совокупности с простой пробоподготовкой и коротким временем анализа, который может длиться около 10 мин в случае использования метода быстрой хроматографии, делает термохимолиз одним из перспективных методов для получения большого объема данных о ЖК почвы.
Список литературы
Грандберг И.И., Нам Н.Л. Органическая химия. М.: Юрайт, 2016. 608 с
Дмитриев Е.А. Математическая статистика в почвоведении. М., 1996. 326 с
Классификация и диагностика почв СССР. М.: Колос, 1977.
Лебедев А.Т. Масс-спектрометрия в органической химии. М.: Техносфера, 2015. 704 с.
Низовцев Н.А., Холодов В.А., Иванов В.А., Фарходов Ю.Р., Дымов А.А. Неспецифические органические соединения торфяных почв Приполярного Урала // Почвоведение. 2017. № 9. С. 1090–1097. https://doi.org/10.7868/S0032180X17070085
Орлов Д.С., Бирюкова О.Н., Суханова Н.И. Органическое вещество почв Российской федерации. М.: Наука, 1996.
Розенцвет О.А., Федосеева Е.В., Терехова В.А. Липидные биомаркеры в экологической оценке почвенной биоты: анализ жирных кислот // Успехи современной биологии. 2019. V. 139. № 2. P. 161–177. https://doi.org/10.1134/s0042132419020078
Холодов В.А., Фарходов Ю.Р., Ярославцева Н.В., Айдиев А.Ю., Лазарев В.И., Ильин Б.С. и др. Термолабильное и термостабильное органическое вещество черноземов разного землепользования // Почвоведение. 2020. V. 8. P. 970–982. https://doi.org/10.31857/S0032180X20080080
Asperger A., Engewald W., Fabian G. Thermally assisted hydrolysis and methylation – a simple and rapid online derivatization method for the gas chromatographic analysis of natural waxes // J. Anal. Appl. Pyrol. 2001. V. 61. № 1–2. P. 91–109. https://doi.org/10.1016/s0165-2370(01)00116-4
Barre P., Quenea K., Vidal A., Cecillon L., Christensen B.T., Katterer T. et al. Microbial and plant-derived compounds both contribute to persistent soil organic carbon in temperate soils // Biogeochemistry. 2018. V. 140. № 1. P. 81–92. https://doi.org/10.1007/s10533-018-0475-5
Ch M.I., Wen Y.F., Cheng Y. Gas chromatographic/mass spectrometric analysis of the essential oil of Houttuynia cordata Thunb by using on-column methylation with tetramethylammonium acetate // J. Aoac Int. 2007. V. 90. № 1. P. 60–67.
Challinor J.M. The scope of pyrolysis methylation reactions // J. Anal. Appl. Pyrol. 1991. V. 20. P. 15–24. https://doi.org/10.1016/0165-2370(91)80059-h
Challinor J.M. Review: the development and applications of thermally assisted hydrolysis and methylation reactions // J. Anal. Appl. Pyrol. 2001. V. 61. № 1–2. P. 3–34. https://doi.org/10.1016/s0165-2370(01)00146-2
Dodla S.K., Wang J.J., Cook R.L. Molecular Composition of Humic Acids from Coastal Wetland Soils along a Salinity Gradient // Soil Sci. Soc. Am. J. 2012. V. 76. № 5. P. 1592–1605. https://doi.org/10.2136/sssaj2011.0346
Downing D.T., Greene R.S. Methylation of fatty acids by pyrolysis of their tetramethylammonium salts in the gas chromatograph // Anal. Chem. 1968. V. 40. № 4. P. 827–828. https://doi.org/10.1021/ac60260a035
Ferro-Vazquez C., Kaal J., Santos Arevalo F.J., Criado Boado F. Molecular fingerprinting of c-14 dated soil organic matter fractions from archaeological settings in nw Spain // Radiocarbon. 2019. V. 61. № 1. P. 101–130. https://doi.org/10.1017/rdc.2018.62
Guignard C., Lemee L., Ambles A. Lipid constituents of peat humic acids and humin. Distinction from directly extractable bitumen components using TMAH and TEAAc thermochemolysis // Org. Geochem. 2005. V. 36. № 2. P. 287–297. https://doi.org/10.1016/j.orggeochem.2004.07.016
Han M., Yi W., Wu Q., Liu Y., Hong Y., Wang D. Preparation of biodiesel from waste oils catalyzed by a Bronsted acidic ionic liquid // Bioresource Technology. 2009. V. 100. № 7. P. 2308–2310. https://doi.org/10.1016/j.biortech.2008.10.046
He Y., Buch A., Szopa C., Williams A.J., Millan M., Guzman M. et al. The search for organic compounds with TMAH thermochemolysis: From Earth analyses to space exploration experiments // Trac-Trends Analyt. Chem. 2020. V. 127. https://doi.org/10.1016/j.trac.2020.115896
IUSS Working Group WRB. World Reference Base for Soil Resources 2014, International soil classification system for naming soils and creating legends for soil maps FAO: World Soil Resources Reports, 2014.
Jeanneau L., Jaffrezic A., Pierson-Wickmann A.C., Gruau G., Lambert T., Petitjean P. Constraints on the Sources and Production Mechanisms of Dissolved Organic Matter in Soils from Molecular Biomarkers // Vadose Zone J. 2014. V. 13. № 7. https://doi.org/10.2136/vzj2014.02.0015
Jeannotte R., Hamel C., Jabaji S., Whalen J.K. Comparison of solvent mixtures for pressurized solvent extraction of soil fatty acid biomarkers // Talanta. 2008. V. 77. № 1. P. 195–199. https://doi.org/10.1016/j.talanta.2008.06.006
Klingberg A., Odermatt J., Meier D. Influence of parameters on pyrolysis-GC/MS of lignin in the presence of tetramethylammonium hydroxide // J. Anal. Appl. Pyrol. 2005. V. 74. № 1–2. P. 104–109. https://doi.org/10.1016/j.jaap.2004.11.023
Lal R. Sequestration of atmospheric CO2 in global carbon pools // Energy Environ. Sci. 2008. V. 1. № 1. P. 86–100. https://doi.org/10.1039/b809492f
McFarren E.F., Lishka R.J., Parker J.H. Criterion for judging acceptability of analytical methods // Anal. Chem. 1970. V. 42. № 3. P. 358–365. https://doi.org/10.1021/ac60285a009
Nierop K.G.J., Preston C.M., Kaal J. Thermally assisted hydrolysis and methylation of purified tannins from plants // Anal. Chem. 2005. V. 77. № 17. P. 5604–5614. https://doi.org/10.1021/ac050564r
Nierop K.G.J., Filley T.R. Simultaneous analysis of tannin and lignin signatures in soils by thermally assisted hydrolysis and methylation using (13)C-labeled TMAH // J. Anal. Appl. Pyrol. 2008. V. 83. № 2. P. 227–231. https://doi.org/10.1016/j.jaap.2008.07.004
Nkongolo K.K., Narendrula-Kotha R. Advances in monitoring soil microbial community dynamic and function // J. Appl. Genetics. 2020. V. 61. № 2. P. 249–263. https://doi.org/10.1007/s13353-020-00549-5
Novak J. Quantitative analysis by gas chromatography. N.Y.: M. Dekker, 1975. 160 p.
Oates L.G., Read H.W., Gutknecht J.L.M., Duncan D.S., Balser T.B., Jackson R.D. A Lipid Extraction and Analysis Method for Characterizing Soil Microbes in Experiments with Many Samples // Jove-J. Visualized Experiments. 2017. № 125. https://doi.org/10.3791/55310
Pecha J., Sanek L., Fuerst T., Kolomaznik K. A kinetics study of the simultaneous methanolysis and hydrolysis of triglycerides // Chem. Eng. J. 2016. V. 288. P. 680–688. https://doi.org/10.1016/j.cej.2015.12.033
Poerschmann J., Parsi Z., Gorecki T., Augustin J. Characterization of non-discriminating tetramethylammonium hydroxide-induced thermochemolysis-capillary gas chromatography-mass spectrometry as a method for profiling fatty acids in bacterial biomasses // J. Chromatography A. 2005. V. 1071. № 1–2. P. 99–109. https://doi.org/10.1016/j.chroma.2004.10.010
Reis M.G., dos Reis M.M., Leath S., Stelwagen K. Direct analysis of fatty acid profile from milk by thermochemolysis-gas chromatography-mass spectrometry // J. Chromatography A. 2011. V. 1218. № 2. P. 316–323. https://doi.org/10.1016/j.chroma.2010.11.011
Ruess L., Chamberlain P.M. The fat that matters: Soil food web analysis using fatty acids and their carbon stable isotope signature // Soil Biol. Biochem. 2010. V. 42. № 11. P. 1898–1910. https://doi.org/10.1016/j.soilbio.2010.07.020
Shadkami F., Helleur R. Recent applications in analytical thermochemolysis // J. Anal. Appl. Pyrol. 2010. V. 89. № 1. P. 2–16. https://doi.org/10.1016/j.jaap.2010.05.007
Siles J.A., Cajthaml T., Filipova A., Minerbi S., Margesin R. Altitudinal, seasonal and interannual shifts in microbial communities and chemical composition of soil organic matter in Alpine forest soils // Soil Biol. Biochem. 2017. V. 112. P. 1–13. https://doi.org/10.1016/j.soilbio.2017.04.014
Valkova D., Grasset L., Ambles A. Molecular compounds generated by ruthenium tetroxide oxidation and preparative off line thermochemolysis of lignite humic acids from South Moravia: Implications for molecular structure // Fuel. 2009. V. 88. № 11. P. 2113–2121. https://doi.org/10.1016/j.fuel.2009.01.026
van Mourik J.M., Nierop K.G.J., Vandenberghe D.A.G. Radiocarbon and optically stimulated luminescence dating based chronology of a polycyclic driftsand sequence at Weerterbergen (SE Netherlands) // Catena. 2010. V. 80. № 3. P. 170–181. https://doi.org/10.1016/j.catena.2009.11.004
Vidal A., Quenea K., Alexis M., Derenne S. Molecular fate of root and shoot litter on incorporation and decomposition in earthworm casts // Org.Geochemis. 2016. V. 101. P. 1–10. https://doi.org/10.1016/j.orggeochem.2016.08.003
Williams A.J., Eigenbrode J., Floyd M., Wilhelm M.B., O’Reilly S., Johnson S.S. et al. Recovery of Fatty Acids from Mineralogic Mars Analogs by TMAH Thermochemolysis for the Sample Analysis at Mars Wet Chemistry Experiment on the Curiosity Rover // Astrobiology. 2019. V. 19. № 4. P. 522–546. https://doi.org/10.1089/ast.2018.1819
Williams M.G., Macgee J. Quantitative recovery of poly-unsaturated fatty-acids on pyrolytic methylation of their trimethylphenylammonium salts // J. Chromatography. 1982. V. 234. № 2. P. 468–471. https://doi.org/10.1016/s0021-9673(00)81888-9
Yoshida H., Sazawa K., Wada N., Hata N., Marumo K., Fukushima M. et al. Changes in the chemical composition of soil organic matter including water-soluble component during incubation: A case study of coniferous and broadleaf forest soils // Catena. 2018. V. 171. P. 22–28. https://doi.org/10.1016/j.catena.2018.06.032
Дополнительные материалы
- скачать ESM.doc
- Таблица S1. Результаты дисперсионного анализа по влиянию температуры и количества ТМАГ на содержание МЭЖК.
Таблица S2. Результаты дисперсионного анализа по влиянию температуры и количества ТМАГ на относительное содержание МЭЖК.
Таблица S3. Результаты дисперсионного анализа по влиянию времени инкубирования почвы с ТМАГ на относительное содержанию МЭЖК.
Таблица S4. Оценка повторяемости результатов содержания МЭЖК в типичном черноземе, полученных методом термохимолиза.



