Почвоведение, 2022, № 3, стр. 354-369
Влияние биоремедиации на биологическую активность чернозема выщелоченного, загрязненного нефтью и свинцом
Г. Ф. Рафикова a, Е. В. Кузина a, Т. Ю. Коршунова a, *
a Уфимский институт биологии УФИЦ РАН
450054 Уфа, пр. Октября, 69, Россия
* E-mail: korshunovaty@mail.ru
Поступила в редакцию 29.06.2021
После доработки 12.08.2021
Принята к публикации 27.10.2021
- EDN: ZFSSIB
- DOI: 10.31857/S0032180X22030121
Аннотация
В модельном эксперименте проведен комплексный анализ влияния загрязнения нефтью, свинцом и их комбинациями, а также биоремедиации с использованием микроорганизмов на биологическую активность выщелоченного чернозема (Luvic Chernozem). Объектом исследования явилась почва, отобранная на территории Уфимского района Республики Башкортостан и искусственно загрязненная перечисленными поллютантами. Для ее обработки применены углеводородокисляющие штаммы бактерий, устойчивые к повышенным концентрациям ионов свинца. Все виды поллютантов увеличивали фитотоксичность почвы, а применение микроорганизмов уменьшало ее, что проявилось в увеличении индекса всхожести семян на 1.2‒19.2% по сравнению с необработанными вариантами. Внесение свинца в нефтезагрязненную почву уменьшило степень разложения углеводородов на 4.4‒11.2%. Бактеризация загрязненных почв усилила деградацию углеводородов на 6.2‒33.8%. В почвах с нефтью, нефтью и свинцом увеличилась общая численность микроорганизмов. Выявлено, что актиномицеты наиболее чувствительны к присутствию ксенобиотиков. К концу эксперимента ферментативная активность нефтесодержащей почвы уменьшилась. Наличие свинца незначительно увеличило каталазную и инвертазную активности в первой половине опыта. Совместное загрязнение заметно подавляло активность каталазы и уреазы. Внесение микробных препаратов благоприятно сказалось на восстановлении ферментативной активности почвы. Использованные бактерии способствовали уменьшению фитотоксичности и увеличению ферментативной активности почвы, что делает их перспективными агентами для биорекультивации почв.
ВВЕДЕНИЕ
В последние десятилетия особое внимание уделяется антропогенному загрязнению почвы и проблемам, связанным с ее восстановлением. Среди большого числа поллютантов особо следует выделить тяжелые металлы (ТМ), загрязнение которыми является глобальной проблемой из-за их большого периода полураспада и стойкости в окружающей среде. Это, в свою очередь, приводит к накоплению ТМ в почве до такого уровня, когда они начинают оказывать токсический эффект на живые организмы и ее биологическую активность [9, 13, 79, 80]. Появление ТМ в почве может быть связано с естественным выветриванием материнской породы, однако в основном это происходит в результате воздушных выбросов металлургических предприятий и автотранспорта, гидрогенного загрязнения неочищенными сточными водами и осадками сточных вод, использования пестицидов и удобрений, неправильной утилизации промышленных отходов и т. д. [43, 56].
Другим приоритетным загрязняющим веществом является нефть. В процессе ее добычи, транспортировки, хранения и переработки могут происходить аварийные разливы. Углеводороды, попадая в почву, оказывают существенное негативное влияние на ее физико-химические и биологические свойства, а также на почвенную микро- и макробиоту [8, 9, 12, 15, 77]. Более того, нередки случаи, когда возникает совместное загрязнение, при котором ТМ и нефть присутствуют в почве одновременно, что делает ее восстановление еще более затруднительным [34, 50].
Биоремедиация с использованием метаболического потенциала биологических объектов представляет собою многообещающий метод восстановления экосистем, поскольку он эффективен и экономичен, а поллютант удаляется с минимальным ущербом для окружающей среды [57]. Ранее уже были проведены многочисленные эксперименты по определению воздействия этого способа очистки на биологическую активность разных типов почв, загрязненных нефтью и тяжелыми металлами [16, 18, 24, 49], в том числе в Республике Башкортостан [4, 14, 15]. Одним из вариантов биоремедиации является биоаугментация, которая подразумевает обработку нарушенных участков отдельными микроорганизмами или их консорциумами с желаемыми ферментативными свойствами и адаптационным потенциалом. Особый интерес для очистки почв, загрязненных одновременно нефтью и ТМ, представляют штаммы бактерий, обладающие как углеводородокисляющей активностью, так и устойчивостью к повышенным концентрациям ТМ в среде [26, 42, 50, 59]. Однако исследования биологической активности почвы в процессе ее очистки от нефти и тяжелых металлов с помощью микроорганизмов единичны [7].
Цель работы ‒ изучение влияния различных доз нефти и свинца на активность ферментов и микробиологические показатели выщелоченного чернозема, а также оценка эффективности применения бактерий-нефтедеструкторов для его восстановления.
ОБЪЕКТЫ И МЕТОДЫ
Объекты исследования. Исследования проводились с выщелоченным черноземом (Luvic Chernozem) в условиях модельного эксперимента. Использовали верхние горизонты (0–20 см) почвы, отобранной на территории Уфимского района Республики Башкортостан. Почва имела следующие показатели: pHKCl – 6.3, Nвал – 0.61%, содержание гумуса – 6.8%, подвижные P2O5 и K2O (0.2 н KCl) – 94.5 и 101.7 мг/кг почвы соответственно. Почву предварительно очищали от крупных корней и других растительных остатков, высушивали до воздушно-сухого состояния и просеивали через сито (размер ячеек 1 см), после чего ее помещали в вегетационные сосуды (по 3 кг). Для оптимизации водно-воздушного режима использовали дренаж, в течение опыта поддерживали влажность почвы на уровне 60% от полной влагоемкости и проводили регулярное рыхление. В опытные варианты вносили нефть (плотность – 852 кг/м3, вязкость – 28 мПа с, парафины (мас. %) – 3.3, смолы (мас. %) – 8.5, асфальтены (мас. %) – 5–9) в концентрации 50 г/кг почвы. Использованный вариант опыта соответствует диапазону концентраций нефти, считающемуся зоной стресса почвенной микробной системы, в которой отмечается увеличение катаболической активности и численности углеводородокисляющих микроорганизмов [11]. Биоремедиация с использованием активных углеводородокисляющих штаммов микроорганизмов при данном уровне загрязнения почвы, как правило, очень эффективна [3, 6]. Более высокие концентрации нефтяных углеводородов могут подавлять рост бактерий, что приводит к низкой эффективности биоразложения и даже к гибели углеводородокисляющих бактерий [54]. Также вносили свинец (Pb2+) – в виде растворенной в воде соли Pb(CH3COO)2 · 3Н2O квалификации “х. ч.” (Реахим, Россия) в количестве Pb2+ 450, 900 и 1800 мг/кг, что соответствует 15, 30 и 60 ПДК (на сегодняшний день в РФ предельно допустимая концентрация свинца в почве нормирована на уровне 30 мг/кг) и жидкую культуру бактерий в количестве 2 × 106 КОЕ/г (колониеобразующих единиц). В те варианты, в которые не было предусмотрено добавление растворов соли свинца и/или инокулята, добавляли соответствующее количество дистиллированной воды. Повторность опыта трехкратная. Контролем служил вариант почвы (фон) без добавок соли свинца, нефти и бактерий. Отбор проб почвы проводили на 3-и, 45-е и 95-е сутки эксперимента. Образцы сушили на воздухе, просеивали через сито (размер ячеек 2 мм) для создания гомогенной смеси и затем хранили в пластиковых пакетах при 4°C для последующих анализов.
Штаммы микроорганизмов. Для обработки почвы применяли штаммы бактерий из коллекции микроорганизмов Уфимского Института биологии УФИЦ РАН: Thalassospira xiamenensis UOM 2 (UOM 2), Enterobacter sp. UOM 3 (UOM 3), Pseudomonas songnenensis UOM 4 (UOM 4), а также микробную композицию (МК), в состав которой входили все вышеперечисленные штаммы.
Установлено, что штамм Enterobacter sp. UOM 3 обладает наибольшим сходством с типовыми штаммами видов E. asburiae и E. ludwigii [23]. Представители этих видов неоднократно описаны в научной литературе как типичные эндофитные и ризосферные бактерии, рекомендуемые для использования в сельском хозяйстве [68, 83]. Многочисленными исследованиями последних лет, в том числе и нашими, показана возможность использования штаммов рода Enterobacter для разложения нефти в почве, обусловленная их хорошей приживаемостью в почве и высокой углеводородокисляющей способностью [23, 27, 35, 38, 47, 73].
Указанные микроорганизмы не проявляли антагонизма по отношению друг к другу, обладали толерантностью к нефти и свинцу, а также способностью к синтезу фитогормона индолил-3-уксусной кислоты [23, 31]. Бактерии культивировали на термостатируемом шейкере при 180 об./мин и температуре 28°C в течение 72 ч на мясопептонном бульоне [19]. Для создания микробной композиции жидкие культуры каждого штамма смешивали в соотношении 1 : 1 : 1. Предварительно было установлено, что численность каждого штамма бактерий при культивировании на среде Раймонда [67] с нефтью (5%) и уксуснокислым свинцом (содержание Pb2+ 2.5 мг/мл) через 5 сут культивирования составляла не менее 1 × 106 КОЕ/мл. Это свидетельствует об устойчивости штаммов к повышенным концентрациям этого металла в среде и возможности использования ими углеводородов нефти в качестве источника углерода.
Выделение и количественный учет микроорганизмов осуществляли по общепринятой методике высева почвенной суспензии на питательные агаризованные среды: количество гетеротрофных микроорганизмов – на питательный агар (пептон – 10 г/л, дрожжевой экстракт – 5 г/л, NaCl – 5 г/л, глюкоза – 1 г/л, агар-агар – 15 г/л, вода дистиллированная – 1000 мл), олигонитрофилов и азотфиксаторов – на среду Эшби, целлюлозолитиков – на среду Гетчинсона, актиномицетов – на крахмало-аммиачный агар, углеводородокисляющих микроорганизмов (УВОМ) – на среду Цукамуры (в качестве источника углерода в каждую чашку Петри на поверхность среды наносили 100 мкл стерильного дизельного топлива), микромицетов – на подкисленную среду Чапека (pH 4.5) [19, 21].
Фитотоксичность образцов выщелоченного чернозема оценивали с помощью биотестов по прорастанию семян и росту растений редиса (Raphanus sativus L.) сорта Розово-красный с белым кончиком, простерилизованных в 1%-ном растворе перманганата калия. Водные экстракты почвенных образцов готовили путем встряхивания навесок почвы с дистиллированной водой в соотношении 1 : 10 вес/объем в течение 1 ч, а затем фильтровали [66]. В чашки Петри помещали фильтровальную бумагу, на которую наносили 5 мл водного экстракта почвы и раскладывали 20 семян редиса. В качестве контроля служили семена, обработанные дистиллированной водой. Всхожесть семян оценивалась по Tam и Tiquia [75]. Чашки Петри инкубировали 72 ч при температуре 22°С. При появлении корешка семена считали проросшими. Процент прорастания семян, удлинение корня и индекс всхожести рассчитывали по [66] следующим образом:
Процент прорастания семян (%) = (количество проросших семян в экстракте пробы/количество проросших семян в контрольном экстракте) ×100.
Удлинение корня (%) = (среднее удлинение корня в образце/среднее удлинение корня в контрольном экстракте) ×100.
Индекс всхожести (%) = (процент прорастания семян (%) × удлинение корня (%))/100.
Водоудерживающую способность почвы определяли согласно ГОСТ 26713-85.
Активность почвенных ферментов анализировали по следующим методикам: активность каталазы и инвертазы – по методу Галстяна, уреазы – по методу Щербакова и Райхинштейна [22].
Кислотность (pH) почвы оценивали потенциометрически по ГОСТ 27979-88.
Содержание нефтепродуктов в почве устанавливали гравиметрически как описано [58].
Статистическую обработку данных проводили по стандартным программам MS Excel. На рисунках и в таблицах данные представлены как среднее ± стандартная ошибка. Достоверность различий оценивали по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фитотоксичность. Индекс всхожести семян тест-растений для фоновой почвы на 95 сут эксперимента составлял 91.4%, тогда как для почвы с нефтью – 48.4% (табл. 1). Такой низкий уровень индекса всхожести обусловлен высокой концентрацией токсичных компонентов, содержащихся в поллютанте, которые оказывают ингибирующее действие на прорастание семян и рост корней [39]. Кроме того, нефтяное загрязнение сокращает доступность воды за счет образования маслянистой пленки на поверхности семян, что препятствует их прорастанию и ограничивает дальнейший рост растений [30, 61].
Таблица 1.
Влияние биоремедиации на фитотоксичность выщелоченного чернозема при загрязнении нефтью и свинцом (на 95-е сут эксперимента)
| Вариант | Показатели фитотоксичности, % | ||
|---|---|---|---|
| процент прорастания семян | удлинение корня | индекс всхожести | |
| ФП (контроль) | 93.3 | 98.0 | 91.4 |
| Загрязнение нефтью | |||
| НП | 73.3 | 66.0 | 48.4 |
| НП + UOM 2 | 93.3 | 72.5 | 67.6 |
| НП + UOM 3 | 76.7 | 72.0 | 55.2 |
| НП + UOM 4 | 83.3 | 68.0 | 56.6 |
| НП + МК | 80.0 | 62.0 | 49.6 |
| Загрязнение свинцом | |||
| ФП + Pb2+ 450 мг/кг почвы | 70.0 | 73.3 | 51.3 |
| ФП + Pb2+ 900 мг/кг почвы | 66.7 | 67.3 | 44.9 |
| ФП + Pb2+ 1800 мг/кг почвы | 46.7 | 26.5 | 12.4 |
| Загрязнение нефтью и свинцом | |||
| Pb2+ 450 мг/кг почвы | |||
| НП + Pb2+ | 80.0 | 68.0 | 54.4 |
| НП + Pb2+ + UOM 2 | 83.3 | 69.0 | 57.5 |
| НП + Pb2+ + UOM 3 | 83.3 | 74.0 | 61.6 |
| НП + Pb2+ + UOM 4 | 76.7 | 81.0 | 62.1 |
| НП + Pb2+ + МК | 80.0 | 73.0 | 58.4 |
| Pb2+ 900 мг/кг почвы | |||
| НП + Pb2+ | 76.7 | 58.0 | 44.4 |
| НП + Pb2+ + UOM 2 | 76.7 | 71.0 | 54.5 |
| НП + Pb2+ + UOM 3 | 80.0 | 62.5 | 50.0 |
| НП + Pb2+ + UOM 4 | 80.0 | 64.0 | 51.2 |
| НП + Pb2+ + МК | 73.3 | 73.0 | 53.5 |
| Pb2+ 1800 мг/кг почвы | |||
| НП + Pb2+ | 70.0 | 56.0 | 39.2 |
| НП + Pb2+ + UOM 2 | 76.7 | 70.0 | 53.7 |
| НП + Pb2+ + UOM 3 | 70.0 | 60.3 | 42.2 |
| НП + Pb2+ + UOM 4 | 73.3 | 70.0 | 51.3 |
| НП + Pb2+ + МК | 80.0 | 68.1 | 54.5 |
Применение УВОМ оказывало благоприятное воздействие на прорастание и всхожесть семян редиса в нефтезагрязненной почве. Это могло быть обусловлено ускоренным разложением углеводородов в почве, и, как результат, уменьшением количества токсических компонентов нефти. Индекс всхожести семян достигал максимума (67.6%) при использовании штамма Thalassospira xiamenensis UOM 2.
Загрязнение почвы свинцом приводило к уменьшению индекса всхожести семян редиса по сравнению с контролем. С увеличением концентрации ТМ в почве наблюдалось снижение индекса всхожести. Высокое содержание свинца (1800 мг/кг) заметно ингибировало прорастание семян. Это является одним из доказанных симптомов токсичности данного ТМ и объясняется его влиянием на ферментативную активность клеток растения, повреждением мембран и др. [52]. Наличие свинца приводило к активному развитию микроскопических грибов и поражению проростков редиса, что отрицательно сказывалось на росте и развитии растений.
При совместном загрязнении нефтью и свинцом всхожесть семян также была ниже, чем в контроле – индекс всхожести в опытных вариантах составлял 39.2–54.4%. Однако его значения при совместном воздействии поллютантов были выше, чем в присутствии только ТМ. Это согласуется с данными некоторых исследователей [53], сообщавших о снижении фитотоксичности при совместном загрязнении ТМ и органическими веществами, что, вероятно, объясняется связыванием ионов свинца с компонентами нефти и уменьшением его биодоступности для растений.
Внесение бактерий в почву, подвергшуюся комплексному загрязнению, приводило к улучшению показателей всхожести редиса. В присутствии минимальной концентрации свинца (450 мг/кг) индекс всхожести был максимальным при использовании штаммов UOM 3 и UOM 4 и составил 61.6 и 62.1% соответственно. С увеличением количества свинца до 900 и 1800 мг/кг наибольших значений индекс всхожести достигал при обработке штаммом UOM 2 и МК. Это могло быть связано как с биологическим разложением токсичных компонентов нефти, так и с возможной дезактивацией катионов свинца вследствие его связывания микроорганизмами. У представителей семейств Pseudomonadaceae и Enterobacteriaceae ранее была описана способность связывать ионы металлов внеклеточными биополимерами [46]. Кроме того, у псевдомонад обнаружено свойство сорбировать ТМ на клеточной стенке и поглощать их ионы внутриклеточно [74].
Считается, что значения индекса всхожести менее 50% указывают на фитотоксичность среды, 50–80% – на умеренную фитотоксичность, а более 80% – на отсутствие фитотоксичности [66]. В связи с этим можно отметить, что почвы, загрязненные нефтью в концентрации 5% и свинцом в концентрации больше 450 мг/кг, являются фитотоксичными. Применение бактерий на фоне нефтяного загрязнения и совместного присутствия нефти и ТМ уменьшает фитотоксичность почвы и переводит ее в категорию умеренно токсичных.
Деградация углеводородов нефти. Приживаемость интродуцированных бактерий является важным показателем, характеризующим эффективность биопрепарата.
Для оценки приживаемости исследуемых штаммов в почве проводили предварительные исследования с образцами стерильной почвы, чтобы исключить развитие аборигенной углеводородокисляющей микробиоты. Было отмечено, что на 14-е сутки после внесения исследуемых штаммов микроорганизмов численность УВОМ составляла 106‒107 КОЕ/г, тогда как в нефтезагрязненной стерильной почве они не обнаруживались.
В ходе данного эксперимента было показано, что количество УВОМ в образцах с обработкой через 45 суток было большим, чем в вариантах без обработки, что позволяет косвенно судить об адаптации и приживаемости привнесенных УВОМ.
Согласно полученным данным, численность УВОМ оставалась на уровне, достаточном для проявления их деструкционной активности (табл. 2). Биоразложение обычно считается основным механизмом удаления загрязнителей из почвы [36], хотя и другие механизмы (например, улетучивание) могли быть задействованы в этом процессе.
Таблица 2.
Динамика численности углеводородокисляющих микроорганизмов, степень биодеградации углеводородов и изменение pH в выщелоченном черноземе в процессе биоремедиации
| Вариант | Титр УВОМ, ×105 КОЕ/г | Биодеградация углеводородов, % | pHKCl | |||||
|---|---|---|---|---|---|---|---|---|
| 3 сут | 45 сут | 95 сут | 45 сут | 95 сут | 3 сут | 45 сут | 95 сут | |
| ФП (контроль) | 0.1 ± 0.004 | 0.1± 0.005 | 0.2 ± 0.008 | – | – | 6.40 | 6.36 | 6.42 |
| Загрязнение нефтью | ||||||||
| НП | 2.0 ± 0.09 | 330.0 ± 15.1 | 100.0 ± 4.7 | 33.2 | 53.0 | 6.35 | 5.97 | 6.19 |
| НП + UOM 2 | 9.0 ± 0.36 | 1040.0 ± 45.0 | 360.0 ± 17.6 | 53.2 | 83.8 | 6.39 | 6.03 | 6.21 |
| НП + UOM 3 | 3.0 ± 0.10 | 460.0 ± 22.6 | 54.0 ± 2.4 | 44.8 | 65.8 | 6.38 | 5.78 | 6.10 |
| НП + UOM 4 | 3.0 ± 0.11 | 510.0 ± 24.3 | 71.0 ± 3.2 | 46.8 | 79.8 | 6.37 | 5.95 | 6.16 |
| НП + МК | 3.0 ± 0.19 | 320.0 ± 15.6 | 40.0 ± 1.8 | 39.2 | 59.2 | 6.41 | 6.17 | 6.37 |
| Загрязнение свинцом | ||||||||
| ФП + Pb2+ 450 мг/кг | – | – | – | – | – | 6.20 | 5.94 | 6.00 |
| ФП + Pb2+ 900 мг/кг | – | – | – | – | – | 6.08 | 5.90 | 5.91 |
| ФП + Pb2+ 1800 мг/кг | – | – | – | – | – | 6.00 | 5.86 | 5.88 |
| Загрязнение нефтью и свинцом | ||||||||
| Pb2+ 450 мг/кг почвы | ||||||||
| НП + Pb2+ | 1.0 ± 0.06 | 52.0 ± 2.6 | 24.0 ± 1.1 | 28.4 | 48.6 | 5.80 | 5.65 | 6.15 |
| НП + Pb2+ + UOM 2 | 2.0 ± 0.08 | 130.0 ± 6.4 | 53.0 ± 2.2 | 31.4 | 59.6 | 5.82 | 6.07 | 6.24 |
| НП + Pb2+ + UOM 3 | 3.0 ± 0.08 | 620.0 ± 30.5 | 100.0 ± 4.7 | 37.6 | 70.4 | 5.79 | 6.12 | 6.25 |
| НП + Pb2+ + UOM 4 | 3.0 ± 0.13 | 535.0 ± 25.8 | 120.0 ± 5.6 | 35.4 | 70.0 | 5.78 | 6.10 | 6.28 |
| НП + Pb2+ + МК | 2.0 ± 0.09 | 210.0 ± 10.6 | 71.0 ± 3.2 | 33.2 | 68.8 | 5.81 | 6.18 | 6.34 |
| Pb2+ 900 мг/кг почвы | ||||||||
| НП + Pb2+ | 6.0 ± 0.32 | 250.0 ± 12.2 | 44.0 ± 2.3 | 26.6 | 44.6 | 6.28 | 6.00 | 6.10 |
| НП + Pb2+ + UOM 2 | 7.0 ± 0.34 | 540.0 ± 24.1 | 350.0 ± 16.2 | 36.6 | 78.4 | 5.72 | 6.12 | 6.28 |
| НП + Pb2+ + UOM 3 | 4.0 ± 0.20 | 320.0 ± 15.2 | 61.0 ± 3.0 | 36.8 | 60.8 | 5.81 | 6.19 | 6.30 |
| НП + Pb2+ + UOM 4 | 8.0 ± 0.42 | 450.0 ± 23.1 | 82.0 ± 3.8 | 40.2 | 62.8 | 5.75 | 6.17 | 6.31 |
| НП + Pb2+ + МК | 3.0 ± 0.07 | 480.0 ± 26.5 | 150.0 ± 7.2 | 41.2 | 72.6 | 5.79 | 6.21 | 6.39 |
| Pb2+ 1800 мг/кг почвы | ||||||||
| НП + Pb2+ | 2.0 ± 0.11 | 43.0 ± 2.0 | 10.0 ± 2.1 | 24.2 | 41.8 | 6.27 | 5.99 | 6.11 |
| НП + Pb2+ + UOM 2 | 7.0 ± 0.34 | 300.0 ± 14.3 | 150.0 ± 6.1 | 36.4 | 68.8 | 6.03 | 6.60 | 6.57 |
| НП + Pb2+ + UOM 3 | 10.0 ± 0.47 | 110.0 ± 5.2 | 65.0 ± 3.2 | 39.8 | 57.6 | 6.00 | 6.67 | 6.62 |
| НП + Pb2+ + UOM 4 | 11.0 ± 0.72 | 180.0 ± 8.6 | 50.0 ± 2.3 | 35.4 | 59.4 | 5.94 | 6.55 | 6.56 |
| НП + Pb2+ + МК | 5.0 ± 0.20 | 240.0 ± 11.1 | 100.0 ± 4.6 | 38.2 | 59.6 | 5.96 | 6.70 | 6.71 |
В почве, где присутствовала только нефть, деградация углеводородов шла более интенсивно, чем в почве с комплексным загрязнением. Бактеризация такой почвы усиливала разложение углеводородов на 6.2–30.8%, по сравнению с вариантом без обработки. Максимальных значений степень биодеструкции в нефтесодержащей почве к концу эксперимента достигала при внесении микроорганизмов UOM 2 и UOM 4 (83.8 и 79.8% соответственно).
Дополнительное внесение свинца в нефтезагрязненную почву во всех изучаемых концентрациях снижала степень разложения углеводородов на 4.4–11.2% по сравнению с данным показателем для почвы только с нефтью. Интродукция УВОМ благоприятно воздействовала на процессы деградации нефти в почве с комплексным загрязнением. Так, в почве с нефтью и содержанием ацетата свинца 450 мг/кг наиболее эффективными были культуры бактерий UOM 3 и UOM 4, в почве с 900 и 1800 мг/кг – UOM 2 и МК. Необходимо отметить отсутствие прямой зависимости степени биодеструкции углеводородов от количества свинца в почве при совместном загрязнении.
pH почвы. Присутствие нефти, свинца, а также их совместное воздействие приводило к подкислению среды к середине эксперимента (5.65–6.0), что, возможно, способствовало усилению неблагоприятного воздействия загрязнителей (табл. 2). Внесение в почву свинца в виде соли уксусной кислоты могло служить причиной кислой реакции среды. В вариантах, загрязненных нефтью, это могло быть связано c разложением углеводородов и образованием кислотных соединений и свободных катионов, что согласуется с данными других исследователей [28]. pH почвы – важный показатель, поскольку часто оказывает сильное влияния на растворимость металлов как в почве в целом, так и в почвенном растворе, а уменьшение pH на каждую единицу приводит к увеличению концентрации металлов примерно в 2 раза [63].
Однако к концу эксперимента было отмечено изменение pH в щелочную сторону и приближение водородного показателя к значениям, характерным для фоновой почвы. Вероятно, наблюдаемая тенденция к подщелачиванию объясняется высокой кислотно-щелочной буферной способностью черноземов [10]. В целом реакция среды была благоприятной для развития микроорганизмов и разложения органических веществ, в том числе и нефти, поскольку pH от 6 до 8 считается оптимальным для их роста [60].
Численность эколого-трофических групп микроорганизмов. Численность микроорганизмов является важным показателем биологической активности почвы и может служить индикатором ее состояния. Присутствие нефти в почве, а также совместное загрязнение вызывали увеличение численности гетеротрофных микроорганизмов, что, вероятно, связано с введением дополнительного источника углерода в виде нефти (табл. 3). Очевидно, что наибольший вклад в рост данного показателя численности вносили углеводородокисляющие микроорганизмы. Инокуляция нефтесодержащей почвы также приводила к росту количества гетеротрофных микроорганизмов, вероятно, за счет активного развития привнесенной углеводородокисляющей микробиоты, что согласуется с данными литературных источников [32]. Загрязнение различными дозами свинца не влияло на показатель численности гетеротрофных микроорганизмов в почве.
Таблица 3.
Динамика численности различных эколого-трофических групп микроорганизмов в выщелоченном черноземе в процессе биоремедиации
| Вариант | Гетеротрофные микроорганизмы, ×106 КОЕ/г |
Микромицеты, ×104 КОЕ/г |
Актиномицеты, ×105 КОЕ/г |
Олигонитрофилы
и азотфиксаторы, ×105 КОЕ/г |
Целлюлозолитики, ×103 КОЕ/г |
|||||
|---|---|---|---|---|---|---|---|---|---|---|
| 3 сут | 95 сут | 3 сут | 95 сут | 3 сут | 95 сут | 3 сут | 95 сут | 3 сут | 95 сут | |
| ФП (контроль) | 1.0 ± 0.1 | 5.0 ± 0.2 | 5.0 ± 0.31 | 1.5 ± 0.08 | 90.0 ± 4.60 | 80.0 ± 3.62 | 5.0 ± 0.31 | 3.2 ± 0.11 | 8.0 ± 0.32 | 10.0 ± 0.38 |
| Загрязнение нефтью | ||||||||||
| НП | 2.0 ± 0.1 | 100.0 ± 4.8 | 2.5 ± 0.12 | 0.3 ± 0.01 | 11.0 ± 0.58 | 1.0 ± 0.04 | 1.2 ± 0.09 | 0,8 ± 0.03 | 2.0 ± 0.08 | 0.2 ± 0.01 |
| НП + UOM 2 | 12.0 ± 0.5 | 310.0 ± 14.2 | 0.5 ± 0.02 | 0.1 ± 0.01 | 5.0 ± 0.24 | 1.0 ± 0.03 | 3.7 ± 0.12 | 3.1 ± 0.21 | 6.0 ± 0.22 | 10.0 ± 0.51 |
| НП + UOM 3 | 8.0 ± 0.3 | 120.0 ± 5.1 | 0.7 ± 0.02 | 0.2 ± 0.01 | 3.5 ± 0.14 | 0.5 ± 0.02 | 4.2 ± 0.32 | 1.9 ± 0.10 | 3.0 ± 0.14 | 1.0 ± 0.06 |
| НП + UOM 4 | 9.0 ± 0.4 | 145.0 ± 5.7 | 1.0 ± 0.04 | 0.3 ± 0.02 | 0.5 ± 0.03 | 0.1 ± 0.01 | 3.3 ± 0.21 | 0.3 ± 0.02 | 5.0 ± 0.35 | 4.0 ± 0.33 |
| НП + МК | 5.0 ± 0.2 | 150.0 ± 6.1 | 0.8 ± 0.02 | 0.1 ± 0.01 | 1.1 ± 0.03 | 0.5 ± 0.02 | 0.2 ± 0.01 | 0.1 ± 0.01 | 5.0 ± 0.22 | 1.0 ± 0.03 |
| Загрязнение свинцом | ||||||||||
| ФП + Pb2+ 450 мг/кг | 6.0 ± 0.2 | 2.0 ± 0.1 | 6.0 ± 0.05 | 0.2 ± 0.01 | 1.0 ± 0.03 | 0.1 ± 0.01 | 1.0 ± 0.06 | 0.1 ± 0.01 | 1.0 ± 0.05 | 1.0 ± 0.05 |
| ФП + Pb2+ 900 мг/кг | 8.0 ± 0.3 | 8.0 ± 0.3 | 10.0 ± 0.44 | 0.2 ± 0.01 | 6.5 ± 0.38 | 0.2 ± 0.01 | 1.0 ± 0.05 | 0.1 ± 0.01 | 0.5 ± 0.03 | 0.4 ± 0.01 |
| ФП + Pb2+ 1800 мг/кг | 2.0 ± 0.1 | 1.0 ± 0.1 | 8.0 ± 0.05 | 0.3 ± 0.02 | 1.0 ± 0.04 | 6.0 ± 0.30 | 1.0 ± 0.05 | 0.1 ± 0.01 | 0.2 ± 0.01 | 0.2 ± 0.01 |
| Загрязнение нефтью и свинцом | ||||||||||
| Pb2+ 450 мг/кг почвы | ||||||||||
| НП + Pb2+ | 22.0 ± 1.0 | 65.0 ± 1.2 | 8.0 ± 0.23 | 1.0 ± 0.07 | 13.0 ± 0.62 | 5.0 ± 0.25 | 20.0 ± 1.01 | 2.0 ± 0.10 | 1.1 ± 0.06 | 0.7 ± 0.03 |
| НП + Pb2+ + UOM 2 | 40.0 ± 2.5 | 75.0 ± 1.4 | 1.0 ± 0.08 | 0.6 ± 0.03 | 4.5 ± 0.23 | 1.0 ± 0.08 | 15.0 ± 0.76 | 0.5 ± 0.02 | 2.0 ± 0.12 | 3.0 ± 0.03 |
| НП + Pb2+ + UOM 3 | 44.0 ± 2.3 | 210.0 ± 15.6 | 2.5 ± 0.11 | 0.3 ± 0.02 | 0.5 ± 0.02 | 0.1 ± 0.01 | 12.5 ± 0.64 | 0.2 ± 0.01 | 3.0 ± 0.20 | 3.0 ± 0.20 |
| НП + Pb2+ + UOM 4 | 46.0 ± 2.2 | 230.0 ± 10.0 | 3.0 ± 0.20 | 0.5 ± 0.02 | 0.5 ± 0.02 | 0.1 ± 0.01 | 20.0 ± 1.27 | 0.4 ± 0.02 | 3.0 ± 0.14 | 1.0 ± 0.04 |
| НП + Pb2+ + МК | 43.0 ± 2.5 | 90.0 ± 3.5 | 2.0 ± 0.10 | 0.7 ± 0.03 | 1.3 ± 0.03 | 0.5 ± 0.02 | 10.0 ± 0.63 | 1.0 ± 0.04 | 2.0 ± 0.16 | 5.0 ± 0.12 |
| Pb2+ 900 мг/кг почвы | ||||||||||
| НП + Pb2+ | 13.0 ± 0.6 | 100.0 ± 4.5 | 10.0 ± 0.30 | 0.1 ± 0.01 | 1.1 ± 0.05 | 0.5 ± 0.03 | 11.0 ± 0.53 | 1.0 ± 0.05 | 0.5 ± 0.03 | 0.7 ± 0.03 |
| НП + Pb2+ + UOM 2 | 27.0 ± 1.2 | 165.0 ± 7.3 | 2.0 ± 0.11 | 0.3 ± 0.01 | 1.3 ± 0.05 | 0.3 ± 0.02 | 16.0 ± 0.72 | 3.1 ± 0.14 | 0.5 ± 0.02 | 5.2 ± 0.22 |
| НП + Pb2+ + UOM 3 | 24.0 ± 1.3 | 55.0 ± 2.6 | 3.0 ± 0.23 | 0.5 ± 0.02 | 1.2 ± 0.06 | 0.1 ± 0.01 | 13.0 ± 0.77 | 0.4 ± 0.01 | 0.2 ± 0.01 | 1.0 ± 0.05 |
| НП + Pb2+ + UOM 4 | 32.0 ± 1.5 | 50.0 ± 2.1 | 2.0 ± 0.09 | 0.2 ± 0.01 | 0.7 ± 0.03 | 0.1 ± 0.01 | 18.0 ± 0.94 | 7.2 ± 0.37 | 0.7 ± 0.02 | 11.0 ± 0.51 |
| НП + Pb2+ + МК | 26.0 ± 1.2 | 180.0 ± 5.4 | 4.0 ± 0.18 | 0.5 ± 0.03 | 1.0 ± 0.06 | 0.5 ± 0.02 | 20.0 ± 1.17 | 8.1 ± 0.35 | 0.5 ± 0.02 | 5.0 ± 0.37 |
| Pb2+ 1800 мг/кг почвы | ||||||||||
| НП + Pb2+ | 5.0 ± 0.2 | 20.0 ± 1.2 | 12.0 ± 0.16 | 0.3 ± 0.02 | 1.0 ± 0.04 | 0.5 ± 0.03 | 2.0 ± 0.10 | 0.7 ± 0.04 | 0.1 ± 0.01 | 0.1 ± 0.01 |
| НП + Pb2+ + UOM 2 | 14.0 ± 1.2 | 90.0 ± 4.3 | 3.0 ± 0.11 | 0.2 ± 0.01 | 1.3 ± 0.03 | 0.2 ± 0.01 | 3.0 ± 0.10 | 0.5 ± 0.03 | 0.1 ± 0.01 | 2.0 ± 0.18 |
| НП + Pb2+ + UOM 3 | 6.0 ± 0.2 | 45.0 ± 2.1 | 3.0 ± 0.10 | 0.1 ± 0.01 | 0.8 ± 0.04 | 0.1 ± 0.01 | 5.0 ± 0.25 | 1.1 ± 0.06 | 0.2 ± 0.01 | 1.0 ± 0.04 |
| НП + Pb2+ + UOM 4 | 8.0 ± 0.4 | 60.0 ± 2.9 | 2.0 ± 0.05 | 0.5 ± 0.03 | 1.1 ± 0.05 | 0.6 ± 0.03 | 2.0 ± 0.13 | 0.8 ± 0.04 | 0.1 ± 0.01 | 2.0 ± 0.01 |
| НП + Pb2+ + МК | 15.0 ± 0.7 | 80.0 ± 4.1 | 0.5 ± 0.03 | 0.4 ± 0.02 | 1.8 ± 0.08 | 0.3 ± 0.02 | 1.0 ± 0.06 | 0.3 ± 0.01 | 0.3 ± 0.02 | 1.0 ± 0.05 |
Наличие нефти и свинца как по-отдельности, так и вместе, угнетало развитие актиномицетов – их количество сокращалось на 1–2 порядка по сравнению с контролем. С одной стороны, уменьшение данного показателя со временем и в загрязненной, и в рекультивируемой почве может говорить о высокой чувствительности к поллютантам данной группы микроорганизмов. Ранее было отмечено [1], что повышенное содержание в почвах подвижных форм ТМ обусловливает структурно-функциональные изменения в актиномицетных сообществах, которые проявляются в уменьшении численности и сужении их видового разнообразия. С другой стороны, актиномицеты являются довольно чувствительными к изменению кислотности среды [2] и сокращение их численности могло быть связано с подкислением pH. Возможно, в составе актиномицетного комплекса изначально преобладали виды, которые имеют более узкий диапазон значений pH среды, пригодных для роста. Таким образом, загрязнение почвы негативно сказывалось на развитии актиномицетов: при этом могло иметь место как прямое токсическое действие поллютантов, так и опосредованное влияние через изменение условий среды при попадании нефти и ТМ в почву.
Количество микроскопических грибов в первые сутки после постановки эксперимента незначительно увеличивалось при внесении нефти и свинца, что возможно, было связано с подкислением почвы. Кроме того, микромицеты способны к использованию широкого диапазона органических соединений, в том числе нефти [20, 76] и ее низкие концентрации не оказывают на них выраженного токсического эффекта. Интродукция бактерий вызывала снижение численности грибов, что могло быть обусловлено их конкурентным взаимодействием с УВОМ за источники питания.
Изучение показателей численности олигонитрофильных, азотфиксирующих и целлюлозолитических микроорганизмов показало их негативный отклик на присутствие в почве поллютантов. Внесение УВОМ в отдельных случаях оказывало положительное влияние на развитие данных групп микроорганизмов. В частности, применение штамма UOM 2 в нефтезагрязненной почве, а также при совместном воздействии нефти и свинца в концентрации 900 мг/кг в конце опыта приводило к достижению численности, близкой к ее показателю в контроле. Таким образом, наиболее чувствительными к присутствию нефти и свинца в почве оказались актиномицеты, а рост численности гетеротрофных микроорганизмов в вариантах с нефтью, при совместном загрязнении и биоремедиации, очевидно, связан с активным развитием углеводородокисляющей микробиоты.
Ферментативная активность. Ферменты почвы являются катализаторами важных метаболических процессов, включая разложение органических загрязнителей [25, 70]. Считается, что они чувствительны к загрязнению, легко определяются без дорогостоящих и сложных инструментов, поэтому их часто используют в качестве индикаторов для оценки степени загрязнения почв различными поллютантами [29]. Недавние исследования показали, что привнесенные микроорганизмы могут улучшить ферментативную активность почвы [44, 62]. Также установлено, что резистентность бактерий к ТМ связана с повышенной активностью антиоксидантных ферментов и уреазы [33, 40, 69]. В частности, известно, что ТМ могут осаждаться бактериальной уреазой и способствовать удалению тяжелых металлов из почв [51].
Активность каталазы. Каталаза очень чувствительна к загрязнению ТМ и нефтью [37, 48]. Поэтому показатели ее активности можно использовать для анализа токсичности субстрата. Известно, что этот бактериальный фермент вызывает деградацию активных форм кислорода, образование которых индуцируется ТМ, нефтью и рядом других ксенобиотиков [82].
При загрязнении почвы нефтью первоначально наблюдалось увеличение каталазной активности (КА), однако со временем этот показатель уменьшался и становился ниже контрольных значений (рис. 1, А). В целом это согласуется с данными об ингибировании активности этого фермента углеводородами [64]. При интродукции штамма UOM 3 и МК в почве с нефтью, начиная со второй половины эксперимента, КА оставалась постоянной величиной (на уровне 3 мл O2/г мин), что может свидетельствовать о начале процесса стабилизации почвенных условий.
Рис. 1.
Каталазная активность почвы, загрязненной нефтью (a), свинцом в концентрации 450 мг/кг почвы (b), 900 мг/кг почвы (c), 1800 мг/кг почвы (d) и их сочетанием, в том числе при биоремедиации. Здесь и далее: ФП – фоновая почва, НП – нефтезагрязненная почва, Pb – ацетат свинца.
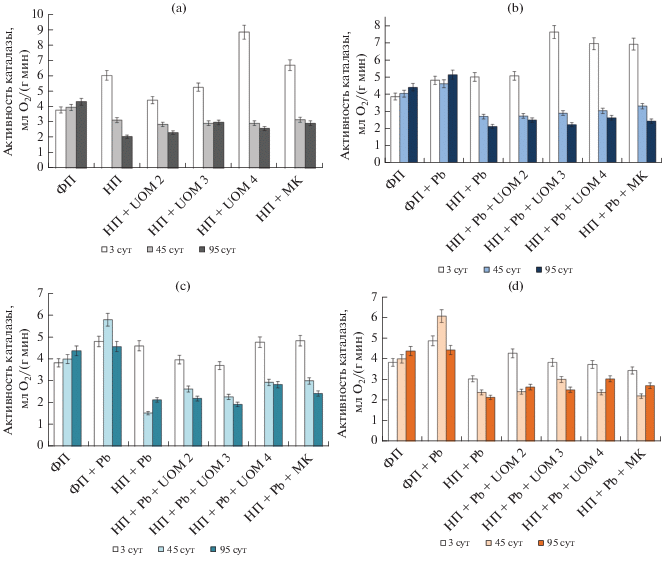
При внесении свинца показатель КА был выше значений контроля во всех вариантах. Максимальных значений он достигал на 45-е сут эксперимента в варианте со свинцом в количестве 1800 мг/кг почвы и составлял 6.1 мл O2/г мин (рис. 1d). Это подтверждает данные о том, что с возрастанием концентрации ТМ может наблюдаться тенденция по увеличению КА [81]. Вероятно, активация этого фермента в присутствии ацетата свинца была вызвана реакцией между ионом Pb2+ и функциональными группами каталазы.
Комплексное загрязнение почвы, как и отдельно нефтью, увеличивало КА на начальном этапе, в дальнейшем активность фермента уменьшалась (рис. 1b, 1c).
При биоаугментации почвы с нефтью и содержанием свинца 450 мг/кг показатель КА в середине и конце эксперимента был выше по сравнению с вариантом без обработки, а наиболее высокие значения достигнуты при использовании UOM 4 и МК. Применение бактерий в почве с нефтью и свинцом в количестве 1800 мг/кг, в целом, положительно сказывалось на активности фермента. В вариантах с интродукцией штамма UOM 4 и МК в нефтезагрязненную почву с высокой концентрацией свинца даже наблюдалось увеличение КА к концу эксперимента, что косвенно может свидетельствовать о нормализации окислительно-восстановительных процессов в среде.
Таким образом, в почве с нефтью, а также при совместном загрязнении была отмечена общая тенденция по снижению КА. Вопреки этому внесение в почву только свинца стимулировало активность фермента. Использование штаммов микроорганизмов благоприятно сказывалось на КА: данный показатель превышал таковой в варианте без бактеризации.
Активность инвертазы. Инвертаза является одним из ферментов, наиболее устойчивых к избыточному содержанию в почве ТМ и нефти [8, 17]. Несмотря на это, показатель его активности считается информативным при интегральной оценке состояния почв [5, 78].
Установлено, что в почве с нефтью, в том ч-исле после интродукции бактерий, происходило уменьшение инвертазной активности (ИА) (рис. 2a).
Рис. 2.
Инвертазная активность почвы, загрязненной нефтью (a), свинцом в концентрации 450 мг/кг почвы (b), 900 мг/кг почвы (c), 1800 мг/кг почвы (d) и их сочетанием, в том числе при биоремедиации.
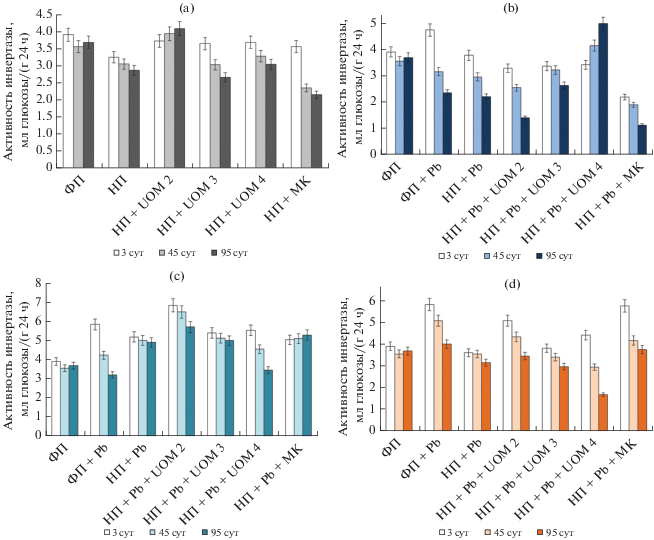
Это может быть связано с разрушением клеток, которое вызывается токсичными веществами в составе поллютанта [14]. Поскольку, инвертаза имеет внеклеточное происхождение, то гибель некоторых бактерий может вызвать уменьшение ее синтеза и снижение ферментативной активности почвы [65]. Исключение составлял вариант с внесением штамма UOM 2, у которого ИА на 95-е сут превышала таковую в контроле на 10%. Уменьшение активности фермента со временем наблюдалась и при совместном загрязнении (рис. 2b–2d). В подавляющем числе случаев в вариантах со свинцом изучаемый показатель был больше контрольных (главным образом в течение первой половины эксперимента). Внесение штамма бактерий UOM 4 в нефтесодержащую почву со свинцом в количестве 450 мг/кг, приводило к возрастанию ИА до 5 мг глюкозы/г почвы к концу опыта (рис. 2c, 2d). Восстановление ее уровня после начального ингибирования может быть связано с ростом привнесенной микробной популяции в результате адаптации [41] и способностью данного штамма к использованию более широкого спектра углеводородов в составе нефти.
Ранее было показано, что ИА напрямую зависит от количества почвенных микроорганизмов [45], так к концу настоящего эксперимента наблюдалась незначительная корреляция активности инвертазы от числа гетеротрофных микроорганизмов (r = 0.35, p > 95%).
Таким образом, присутствие нефти вызывало подавление ИА. Загрязнение почвы свинцом, напротив, усиливало активность фермента на начальном этапе загрязнения. При комбинированной обработке поллютантами реакция почвенной инвертазы была неоднозначной, однако биоаугментация как при наличии только нефти, так и при совместном загрязнении в отдельных случаях оказывала положительное воздействие на активность фермента.
Активность уреазы. Показатель активности уреазы в почве характеризует потенциал минерализации мочевины. Фермент образует устойчивые комплексы (уреаза-гумус) и вносит большой вклад в плодородие почвы [55]. Его активность может быть подходящим индикатором комбинированного загрязнения (ТМ, полициклическими ароматическими углеводородами и др.), особенно на ранних стадиях процесса [72, 81].
Нефть оказала негативное воздействие на уреазную активность (УА) почвы (рис. 3a).
Рис. 3.
Уреазная активность почвы, загрязненной нефтью (a), свинцом в концентрации 450 мг/кг почвы (b), 900 мг/кг почвы (c), 1800 мг/кг почвы (d) и их сочетанием, в том числе при биоремедиации.
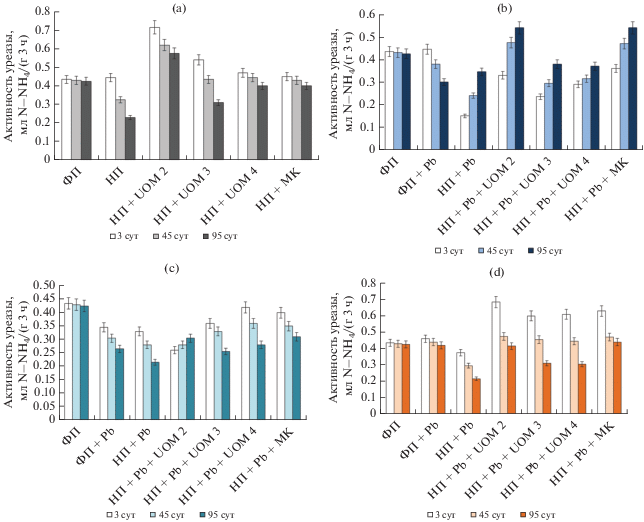
Интродукция микроорганизмов стимулировала ее на начальном этапе, однако со временем она снижалась, но все же превышала показатели нефтезагрязненной почвы и, в целом, была сопоставима с контрольными значениями. Внесение штамма UOM 2 приводило к увеличению УА на 64% по сравнению с контролем уже на третьи сутки, к концу эксперимента ее значения превышали контрольные на 25%.
Загрязнение почвы ацетатом свинца ингибировало почвенную уреазу. При совместном загрязнении УА была меньше по сравнению с контролем и вариантами только с одним видом поллютанта. Известно, что снижение УА происходит из-за изменений в молекулярной структуре фермента, вызванных ингибиторами. Предполагается, что ТМ связываются с сульфгидрильными группами активного центра, образуя эквиваленты сульфидов металлов, в то время как органические экотоксиканты (в том числе нефть) могут денатурировать всю структуру белка [71]. Вероятно, при совместном воздействии ксенобиотиков наблюдался синергетический эффект, который выражался в более быстром угнетении активности уреазы.
Биоаугментация благоприятно сказывалась на УА, а максимальных значений она достигала при использовании штамма UOM 2 и МК и к концу эксперимента составляла 0.54 в обоих вариантах против 0.43 мг N-NH4/г в контроле (рис. 3b). В почве с нефтью и с содержанием свинца в концентрациях 900 и 1800 мг/кг УА на 95-е сут была меньше в 2 раза по сравнению с контролем (рис. 3c, 3d). Использование микроорганизмов в этих случаях изначально стимулировало уреазу, однако со временем ее активность снижалась, что, вероятно, связано с исчерпанием субстрата для бактерий. Показатели УА в образцах с бактеризацией были больше, чем в вариантах без обработки и в некоторых случаях достигали контрольных значений.
Таким образом, комбинированное загрязнение почвы нефтью (5%) и свинцом в концентрациях 450–1800 мг/кг ингибировало УА сильнее, чем загрязнение почвы только свинцом. При совместном загрязнении нефтью и свинцом в количестве 450 мг/кг на начальном этапе УА резко уменьшалась и затем постепенно возрастала, а при увеличении дозировки свинца происходило медленное уменьшение УА. Использование штаммов микроорганизмов в целом благоприятно сказывалось на восстановлении активности фермента как в нефтесодержащей почве, так и при совместном загрязнении.
ЗАКЛЮЧЕНИЕ
В условиях модельного опыта загрязнение нефтью, свинцом и комбинированное загрязнение ими, а также биоаугментация отдельными культурами углеводородокисляющих микроорганизмов (УВОМ) Thalassospira xiamenensis UOM 2, Enterobacter sp. UOM 3, Pseudomonas songnenensis UOM 4 и микробной композицией, состоящей из вышеперечисленных штаммов, оказывали влияние на биологическую активность выщелоченного чернозема.
При всех изучаемых видах загрязнения наблюдался заметный фитотоксический эффект, который выражался в ухудшении всхожести и торможении роста корней редиса. Применение УВОМ уменьшало фитотоксичность. В почве с нефтью наиболее эффективным оказался штамм бактерий T. xiamenensis UOM 2; в случае комбинированного загрязнения при концентрации свинца 450 мг/кг – Enterobacter sp. UOM 3 и P. songnenensis UOM 4, при его более высоких концентрациях – T. xiamenensis UOM 2 и микробная композиция. Применение бактерий позволило перевести загрязненный выщелоченный чернозем в категорию почв с умеренной фитотоксичностью.
Интродуцированные УВОМ хорошо приживались в почве, содержащей оба поллютанта. При наличии только нефти, деградация углеводородов шла более интенсивно, чем в почве с комплексным загрязнением без внесения бактерий. Биоремедиация выщелоченного чернозема усиливала деструкцию этих ксенобиотиов. В почве только с нефтью их биодеградация достигала максимальных значений при использовании микроорганизмов T. xiamenensis UOM 2 и P. songnenensis UOM 4; при совместном действии поллютантов наибольшая степень разложения углеводородов наблюдалась при внесении Enterobacter sp. UOM 3 и P. songnenensis UOM 4 в почву со свинцом в количестве 450 мг/кг; T. xiamenensis UOM 2 и МК – в почву с 900 и 1800 мг/кг.
Загрязнение почвы нефтью, а также совместное загрязнение вызывали увеличение численности гетеротрофных микроорганизмов, очевидно, за счет активного развития углеводородокисляющей микробиоты. Наиболее чувствительными к присутствию нефти и свинца оказались актиномицеты.
В почве, содержащей нефть, а также при комплексном загрязнении была отмечена тенденция по снижению каталазной активности. Внесение в почву только ацетата свинца в количестве 450, 900 и 1800 мг/кг стимулировало активность фермента. Использование для биоремедиации штаммов микроорганизмов благоприятно сказывалось на этом показателе.
Нефтяное загрязнение вызывало подавление активности инвертазы, тогда как загрязнение почвы свинцом, напротив, усиливало ее на начальном этапе загрязнения. При комбинированной обработке поллютантами реакция почвенной инвертазы была неоднозначной, однако биоаугментация почвы, содержащей только нефть, и почвы, содержащей еще дополнительно и свинец, в отдельных случаях оказывала положительное воздействие на активность данного фермента.
Совместное действие поллютантов ингибировало уреазную активность сильнее, чем загрязнение только свинцом. Использование штаммов микроорганизмов в целом благоприятно сказывалось на восстановлении активности уреазы как в нефтезагрязненной почве, так и в почве, содержащей комплекс поллютантов.
Список литературы
Гришко В.Н., Сыщикова О.В. Сообщества актиномицетов рода Streptomyces в почвах, загрязненных тяжелыми металлами // Почвоведение. 2009. № 2. С. 235–243.
Зенова Г.М., Закалюкина Ю.В., Селянин В.В., Звягинцев Д.Г. Выделение и рост почвенных ацидофильных актиномицетов рода Micromonospora // Почвоведение. 2004. № 7. С. 847‒852.
Ившина И.Б., Криворучко А.В., Куюкина М.С., Костина Л.В., Пешкур Т.А., Каннингхэм К.Д. Биоремедиация нарушенных углеводородами и тяжелыми металлами почв с использованием Rhodococcus-биосурфактантов и иммобилизованных родококков // Аграрный вестник Урала. 2012. № 8. С. 65‒68.
Кабиров Р.Р., Киреева Н.А., Кабиров Т.Р., Дубовик И.Е., Якупова А.Б., Сафиуллина Л.М. Оценка биологической активности нефтезагрязненных почв с помощью интегрального показателя // Почвоведение. 2012. № 2. С. 184‒188.
Казеев К.Ш., Трушков А.В., Одабашян М.Ю., Колесников С.И. Постагрогенное изменение ферментативной активности и содержания органического углерода чернозема в первые 3 года залежного режима // Почвоведение. 2020. № 7. С. 901–910.
Киреева Н.А., Григориади А.С., Хайбуллина Е.Ф. Ассоциации углеводородокисляющих микроорганизмов для биоремедиации нефтезагрязненных почв // Вестник Башкирского ун-та. 2009. № 2. С. 391‒394.
Козлова Е.Н., Степанов А.Л., Лысак Л.В. Влияние бактериально-гумусовых препаратов на биологическую активность почв, загрязненных нефтепродуктами и тяжелыми металлами // Почвоведение. 2015. № 4. С. 452–461. https://doi.org/10.7868/S0032180X15020057
Колесников С.И., Азнаурьян Д.К., Казеев К.Ш., Вальков В.Ф. Устойчивость биологических свойств почв Юга России к нефтяному загрязнению // Экология. 2010. № 5. С. 357–364.
Колесников С.И., Жаркова М.Г., Казеев К.Ш., Кутузова И.В., Самохвалова Л.С., Налета Е.В., Зубков Д.А. Оценка экотоксичности тяжелых металлов и нефти по биологическим показателям чернозема // Экология. 2014. № 3. С. 163–173. https://doi.org/10.7868/S0367059714030056
Колесников С.И., Казеев К.Ш., Татосян М.Л., Вальков В.Ф. Влияние загрязнения нефтью и нефтепродуктами на биологическое состояние чернозема обыкновенного // Почвоведение. 2006. № 5. С. 616–620.
Коронелли Т.В. Принципы и методы интенсификации биологического разрушения углеводородов в окружающей среде // Прикладная биохимия и микробиология. 1996. № 6. С. 579‒585.
Коршунова Т.Ю., Четвериков С.П., Бакаева М.Д., Кузина Е.В., Рафикова Г.Ф., Четверикова Д.В., Логинов О.Н. Микроорганизмы в ликвидации последствий нефтяного загрязнения (обзор) // Прикладная биохимия и микробиология. 2019. № 4. С. 338–349.
Новоселова Е.И., Волкова О.О. Влияние тяжелых металлов на активность каталазы разных типов почв // Известия Оренбургского государственного аграрного ун-та. 2017. № 2. С. 190‒193.
Новоселова Е.И., Волкова О.О., Турьянова Р.Р. Ферментативная трансформация органических остатков в почвах, загрязненных тяжелыми металлами // Экология урбанизированных территорий. 2019. № 1. С. 75‒81. https://doi.org/10.24411/1816-1863-2019-11075
Новоселова Е.И., Киреева Н.А., Гарипова М.И. Роль ферментативной активности почв в осуществлении ею трофической функции в условиях нефтяного загрязнения // Вестник Башкирского ун-та. 2014. № 2. С. 474‒479.
Плешакова Е.В., Кабанцева Е.Г., Черновол В.С. Активность дегидрогеназ в нефтезагрязненных почвах как инструмент мониторинга технологий биоремедиации // Известия Саратовского ун-та. Сер. Химия. Биология. Экология. 2010. № 1. С. 40‒46.
Плешакова Е.В., Решетников М.В., Нгун К.Т., Шувалова Е.П. Микробиологическая и биохимическая индикация почв г. Медногорск // Агрохимия. 2016. № 1. С. 65–72.
Поляк Ю.М., Сухаревич В.И. Почвенные ферменты и загрязнение почв: биодеградация, биоремедиация, биоиндикация // Агрохимия. 2020. № 3. С. 83–93. https://doi.org/10.31857/S0002188120010123
Практикум по микробиологии / Под ред. А.И. Нетрусова. М.: Академия, 2005. 608 с.
Рафикова Г.Ф., Кузина Е.В., Столярова Е.А., Мухаматдьярова С.Р., Логинов О.Н. Комплексы микромицетов выщелоченного чернозема при загрязнении нефтью и внесении микроорганизмов-нефтедеструкторов // Микология и фитопатология. 2020. № 2. С. 107–115. https://doi.org/10.31857/S0026364820020099
Сэги Й. Методы почвенной микробиологии. М.: Колос, 1983. 296 с.
Хазиев Ф.Х. Методы почвенной энзимологии. М.: Наука, 2005. 252 с.
Четвериков С.П., Бакаева М.Д., Коршунова Т.Ю., Кузина Е.В., Рафикова Г.Ф., Четверикова Д.В., Высоцкая Л.Б., Логинов О.Н. Новый штамм Enterobacter sp. UOM 3 – деструктор нефти и продуцент индолилуксусной кислоты // Естественные и технические науки. 2019. № 7. С. 37–40. https://doi.org/10.25633/ETN.2019.07.13
Шарапова И.Э., Лаптева Е.М., Маслова С.П., Табаленкова Г.И., Гарабаджиу А.В. Использование интегрального коэффициента биологической активности и индекса фитотоксичности для оценки фиторемедиации нефтезагрязненных почв // Теоретическая и прикладная экология. 2015. № 2. С. 67‒73.
Adetunji A.T., Lewu F.B., Mulidzi R., Ncube B. The biological activities of β-glucosidase, phosphatase and urease as soil quality indicators: a review // J. Soil Sci. Plant Nutr. 2017. V. 17(3). P. 794–807. https://doi.org/10.4067/S0718-95162017000300018
Agnello A.C., Bagardc M., van Hullebuscha E.D., Esposito G., Huguenota D. Comparative bioremediation of heavy metals and petroleum hydrocarbons co-contaminated soil by natural attenuation, phytoremediation, bioaugmentation and bioaugmentation-assisted phytoremediation // Sci. Total Environ. 2016. V. 563–564. P. 693–703. https://doi.org/10.1016/j.scitotenv.2015.10.061
Ali M.H., Sattar M.T., Khan M.I., Naveed M., Rafique M., Alamri S., Siddiqui M.H. Enhanced growth of mungbean and remediation of petroleum hydrocarbons by Enterobacter sp. MN17 and biochar addition in diesel contaminated soil // Appl. Sci. 2020. V. 10. P. 8548. https://doi.org/10.3390/app10238548
Al-Mutairi N., Bufarsan A., Al-Rukaibi F. Ecorisk evaluation and treatability potential of soils contaminated with petroleum hydrocarbon-based fuels // Chemosphere. 2008. V. 74(1). P. 142‒148. https://doi.org/10.1016/j.chemosphere.2008.08.020
Aponte H., Medina J., Butler B., Meier S., Cornejo P., Kuzyakov Y. Soil quality indices for metal (loid) contamination: An enzymatic perspective // Land Degrad. Dev. 2020. V. 31(17). P. 2700–2719. https://doi.org/10.1002/ldr.3630
Athar H., Ambreen S., Javed M., Hina M., Rasul S., Zafar Z.U., Manzoor H., Ogbaga C.C., Afzal M., Al-Qurainy F, Ashraf M. Influence of sub-lethal crude oil concentration on growth, water relations and photosynthetic capacity of maize (Zea mays L.) plants // Environ. Sci. Pollut. Res. Int. 2018. V. 23. P. 18320–18331. https://doi.org/10.1007/s11356-016-6976-7
Bakaeva M., Kuzina E., Vysotskaya L., Kudoyarova G., Arkhipova T.Y., Rafikova G., Chetverikov S., Korshunova T., Chetverikova D., Loginov O. Capacity of Pseudomonas strains to degrade hydrocarbons, produce auxins and maintain plant growth under normal conditions and in the presence of petroleum contaminants // Plants. 2020. V. 9. P. 379. https://doi.org/10.3390/plants9030379
Beškoski V.P., Gojgić-Cvijović G., Milić J., Ilić M., Miletić S., Šolević T., Vrvić M.M. Ex situ bioremediation of a soil contaminated by mazut (heavy residual fuel oil) – a field experiment // Chemosphere. 2011. V. 83(1). P. 34–40. https://doi.org/10.1016/j.chemosphere.2011.01.020
Chen X., Achal V. Biostimulation of carbonate precipitation process in soil for copper immobilization // J. Hazard. Mater. 2019. V. 368. P. 705–713. https://doi.org/10.1016/j.jhazmat.2019.01.108
Cheng J., Sun Z., Yu Y., Li X., Li T. Effects of modified carbon black nanoparticles on plant-microbe remediation of petroleum and heavy metal co-contaminated soils // Int. J. Phytoremediat. 2019. V. 21(7). P. 634–642. https://doi.org/10.1080/15226514.2018.1556581
Chetverikov S., Vysotskaya L., Kuzina E., Arkhipova T., Bakaeva M., Rafikova G., Korshunova T., Chetverikova D., Hkudaygulov G., Kudoyarova G. Effects of association of barley plants with hydrocarbon-degrading bacteria on the content of soluble organic compounds in clean and oil-contaminated sand // Plants. 2021. V. 10. P. 975. https://doi.org/10.3390/plants10050975
eclercq I., Cappuyns V., Duclos Y. Monitored natural attenuation (MNA) of contaminated soils: state of the art in Europe – a critical evaluation // Sci. Total Environ. 2012. V. 426. P. 393–405. 10.1016/j.scitotenv.2012.03.04
del Carmen Cuevas-Díaz M., Martínez-Toledo Á., Guzmán-López O., Torres-López C.P., Ortega-Martínez A.D.C., Hermida-Mendoza L.J. Catalase and phosphatase activities during hydrocarbon removal from oil-contaminated soil amended with agro-industrial by-products and macronutrients // Water Air Soil Pollut. 2017. V. 228(4). P. 159. https://doi.org/10.1007/s11270-017-3336-2
Dwivedi A., Chitranshi S., Gupta A., Kumar A., Bhat J.L. Assessment of the petroleum oil degradation capacity of indigenous bacterial species isolated from petroleum oil-contaminated soil // Int. J. Environ. Res. 2019. V. 13. P. 735‒746. https://doi.org/10.1007/s41742-019-00210-y
El Fels L., Zamama M., El Asli A., Hafidi M. Assessment of biotransformation of organic matter during co-composting of sewage sludge-lignocelullosic waste by chemical, FTIR analyses, and phytotoxicity tests // Int. Biodeterior. Biodegrad. 2014. V. 87. P. 128–137. https://doi.org/10.1016/j.ibiod.2013.09.024
Etesami H. Bacterial mediated alleviation of heavy metal stress and decreased accumulation of metals in plant tissues: mechanisms and future prospects // Ecotoxicol. Environ. Saf. 2018. V. 147. P. 175–191. https://doi.org/10.1016/j.ecoenv.2017.08.032
Feng C., Ma Y., Jin X., Wang Z., Ma Y., Fu S., Chen H.Y. Soil enzyme activities increase following restoration of degraded subtropical forests // Geoderma. 2019. V. 351. P. 180–187. https://doi.org/10.1016/j.geoderma.2019.05.006
Giwa O.E., Ibitoye F.O. Bioremediation of heavy metal in crude oil contaminated soil using isolated Indigenous microorganism cultured with E. coli DE3 BL21 // Int. J. Engin. Appl. Sci. 2017. V. 4(6). P. 67–70.
Gómez-Sagasti M.T., Alkorta I., Becerril J.M., Epelde L., Anza M., Garbisu C. Microbial monitoring of the recovery of soil quality during heavy metal phytoremediation // Water Air Soil Pollut. 2012. V. 23(6). P. 3249–3262. https://doi.org/10.1007/s11270-012-1106-8
Hou W., Wang J., Nan Z., Christensen M.J., Xia C., Chen T., Zhang Z., Niu X. Epichloë gansuensis endophyte-infection alters soil enzymes activity and soil nutrients at different growth stages of Achnatherum inebrians // Plant Soil. 2020. V. 455(1). P. 227–240. https://doi.org/10.1007/s11104-020-04682-2
Hu J., Lin X., Wang J., Dai J., Chen R., Zhang J., Wong M.H. Microbial functional diversity, metabolic quotient, and invertase activity of a sandy loam soil as affected by long-term application of organic amendment and mineral fertilizer // J. Soil. Sediment. 2011. V. 11(2). P. 271–280. https://doi.org/10.1007/s11368-010-0308-1
Iyer A., Mody K., Jha B. Biosorption of heavy metals by a marine bacterium // Mar. Pollut. Bull. 2005. V. 50(3). P. 340–343. https://doi.org/10.1016/j.marpolbul.2004.11.012
Jerin I., Rahi M.S., Sultan T., Islam M.S., Sajib S.A., Hoque K.M.F., Reza M.A. Diesel degradation efficiency of Enterobacter sp., Acinetobacter sp., and Cedecea sp. isolated from petroleum waste dumping site: a bioremediation view point // Arch. Microbiol. 2021. V. 203. P. 5075–5084. https://doi.org/10.1007/s00203-021-02469-2
Kolesnikov S.I., Myasnikova M.A., Minnikova T.V., Ter-Misakyants T.A., Kazeev R.S., Akimenko Y.V. Assessment of meadow soil resistance of the Azov sea region to pollution with heavy metals and oil // Eco. Env. Cons. 2017. V. 23(4). P. 2346–2351.
Korneykova M.V., Myazin V.A., Fokina N.V. Restoration of oil-contaminated soils in mountain tundra (Murmansk region, Russia) // Green technologies and infrastructure to enhance urban ecosystem services. Springer, Cham, 2020. P. 187‒198. https://doi.org/10.1007/978-3-030-16091-3_21
Kuyukina M., Krivoruchko A., Ivshina I. Hydrocarbon- and metal-polluted soil bioremediation: progress and challenges // Microbiology Australia. 2018. V. 39. P. 133‒136. https://doi.org/10.1071/MA18041
Li M., Cheng X., Guo H. Heavy metal removal by biomineralization of urease producing bacteria isolated from soil // Int. Biodeterior. Biodegrad. 2013. V. 76. P. 81‒85. https://doi.org/10.1016/j.ibiod.2012.06.016
Li X., Lan X., Liu W., Cui X., Cui Z. Toxicity, migration and transformation characteristics of lead in soil-plant system: effect of lead species // J. Hazard. Mater. 2020. V. 395. 122676. https://doi.org/10.1016/j.jhazmat.2020.122676
Lin Q., Wang Z., Ma S., Chen Y. Evaluation of dissipation mechanisms by Lolium perenne L. and Raphanus sativus for pentachlorophenol (PCP) in copper co-contaminated soil // Sci. Total Environ. 2006. V. 368(2‒3). P. 814–822. https://doi.org/10.1016/j.scitotenv.2006.03.024
Ma Y.L., Lu W., Wan L.L., Luo N. Elucidation of fluoranthene degradative characteristics in a newly isolated Achromobacter xylosoxidans DN002 // Appl. Biochem. Biotechnol. 2019. V. 175. P. 1294–1305. https://doi.org/10.1007/s12010-014-1347-7
Makoi J.H., Ndakidemi P.A. Selected soil enzymes: examples of their potential roles in the ecosystem // Afr. J. Biotechnol. 2008. V. 7(3). P. 181–191.
Masindi V., Muedi K.L. Environmental contamination by heavy metals // Heavy Metals. IntechOpen: london, 2018. P. 115–132.
Megharaj M., Naidu R. Soil and brownfield bioremediation // Microb. Biotechnol. 2017. V. 10(5). P. 1244–1249. https://doi.org/10.1111/1751-7915.12840
Mishra S., Jyot J., Kuhad R.C., Lal B. In situ bioremediation potential of an oily sludge-degrading bacterial consortium // Curr. Microbiol. 2001. V. 43(5). P. 328–335. https://doi.org/10.1007/s002840010311
Mustafa S., Al-Douseri A., Majki K., Al-Saleh E. Potential of crude oil-degrading bacteria to co-resist heavy metals in soil // WIT Transactions on Ecology and the Environment. 2013. V. 173. P. 697‒705. https://doi.org/10.2495/SDP130581
Neina D. The role of soil pH in plant nutrition and soil remediation // Appl. Environ. Soil Sci. 2019. ID 5794869. https://doi.org/10.1155/2019/5794869
Nie M., Wang Y., Yu J., Xiao M., Jiang L., Yang J., Fang C., Chen J., Li B. Understanding plant–microbe interactions for phytoremediation of petroleum polluted soil // PLoS One. 2011. V. 6. e17961. https://doi.org/10.1371/journal.pone.0017961
Nosheen A., Yasmin H., Naz R., Bano A., Keyani R., Hussain I. Pseudomonas putida improved soil enzyme activity and growth of kasumbha under low input of mineral fertilizers // Soil Sci. Plant Nutr. 2018. V. 64(4). P. 520–525. https://doi.org/10.1080/00380768.2018.1461002
Oliveira A., Pampulha M.E. Effects of long-term heavy metal contamination on soil microbial characteristics // J. Biosci. Bioeng. 2006. V. 102(3). P. 157–161. https://doi.org/10.1263/jbb.102.157
Polyak Y.M., Bakina L.G., Chugunova M.V., Mayachkina N.V., Gerasimov A.O., Bure V.M. Effect of remediation strategies on biological activity of oil-contaminated soil – A field study // Int. Biodeterior. Biodegrad. 2018. V. 126. P. 57–68. https://doi.org/10.1016/j.ibiod.2017.10.004
Raiesi F., Salek-Gilani S. The potential activity of soil extracellular enzymes as an indicator for ecological restoration of rangeland soils after agricultural abandonment // Appl. Soil Ecol. 2018. V. 126. P. 140–147. https://doi.org/10.1016/j.apsoil.2018.02.022
Ravindran B., Mnkeni P.N.S. Bio-optimization of the carbon-to-nitrogen ratio for efficient vermicomposting of chicken manure and waste paper using Eisenia fetida // Environ. Sci. Pollut. Res. 2016. V. 23(17). P. 16965–16976. https://doi.org/10.1007/s11356-016-6873-0
Raymond R.L. Microbial oxidation of n-paraffinic hydrocarbons // Dev. Ind. Microbiol. 1961. V. 2(1). P. 23–32.
Sánchez-Cruz R., Tpia Vázquez I., Batista-García R.A., Méndez-Santiago E.W., Sánchez-Carbente M.D.R., Leija A., Lira-Ruan V., Hernández G., Wong-Villarreal A., Folch-Mallol J.L. Isolation and characterization of endophytes from nodules of Mimosa pudica with biotechnological potential // Microbiol Res. 2019. V. 218. P. 76‒86. https://doi.org/10.1016/j.micres.2018.09.008
Satapute P., Paidi M.K., Kurjogi M., Jogaiah S. Physiological adaptation and spectral annotation of arsenic and cadmium heavy metal-resistant and susceptible strain Pseudomonas taiwanensis // Environ. Pollut. 2019. V. 251. P. 555–563. https://doi.org/10.1016/j.envpol.2019.05.054
Saxena G., Kishor R., Bharagava R.N. Application of microbial enzymes in degradation and detoxification of organic and inorganic pollutants // Bioremediation of industrial waste for environmental safety. Springer, Singapore, 2020. P. 41–51.
Shen G., Lu Y., Hong J. Combined effect of heavy metals and polycyclic aromatic hydrocarbons on urease activity in soil // Ecotoxicol. Environ. Saf. 2006. V. 63(3). P. 474–480. https://doi.org/10.1016/j.ecoenv.2005.01.009
Shen G., Lu Y., Zhou Q., Hang J. Interaction of polycyclic aromatic hydrocarbons and heavy metals on soil enzyme // Chemosphere. 2005. V. 61. P. 1175–1182. https://doi.org/10.1016/j.chemosphere.2005.02.074
Sun S., Liu Q., Chen S., Yu W., Zhao C., Chen H. Optimization for microbial degradation of petroleum hydrocarbon (TPH) by Enterobacter sp. S-1 using response surface methodology // Petrol. Sci. Technol. 2019. V. 37. P. 821-828. https://doi.org/10.1080/10916466.2019.1566256
Tak H.I., Ahmad F., Babalola O.O. Advances in the application of plant growth-promoting rhizobacteria in phytoremediation of heavy metals // Rev. Environ. Contam. Toxicol. 2013. V. 223. P. 33–52. https://doi.org/10.1007/978-1-4614-5577-6_2
Tam N.F.Y., Tiquia S. Assessing toxicity of spent pig litter using a seed germination technique // Resour. Conserv. Recycl. 1994. V. 11(1–4). P. 261–274.
Varjani S.J. Microbial degradation of petroleum hydrocarbons // Bioresour. Technol. 2017. V. 223(1). P. 277–286. https://doi.org/10.1016/j.biortech.2016.10.037
Wang X., Zheng J., Han Z., Chen H. Bioremediation of crude oil-contaminated soil by hydrocarbon-degrading microorganisms immobilized on humic acid-modified biofuel ash // J. Chem. Technol. Biotechnol. 2019. V. 94(6). P. 1904–1912. https://doi.org/10.1002/jctb.5969
Xian Y., Wang M., Chen W. Quantitative assessment on soil enzyme activities of heavy metal contaminated soils with various soil properties // Chemosphere. 2015. V. 139. P. 604–608. https://doi.org/10.1016/j.chemosphere.2014.12.060
Xiao R., Wang S., Li R., Wang J.J., Zhang Z. Soil heavy metal contamination and health risks associated with artisanal gold mining in Tongguan, Shaanxi, China // Ecotoxicol. Environ. Saf. 2017. V. 141. P. 17–24. https://doi.org/10.1016/j.ecoenv.2017.03.002
Yang X., Liu J., McGrouther K., Huang H., Lu K., Guo X., He L., Lin X., Che L., Ye Z. Wang H. Effect of biochar on the extractability of heavy metals (Cd, Cu, Pb, and Zn) and enzyme activity in soil // Environ. Sci. Pollut. Res. Int. 2016. V. 23(2). P. 974–984. https://doi.org/10.1007/s11356-015-4233-0
Yang Z.X., Liu S.Q., Zheng D.W., Feng S.D. Effects of cadium, zinc and lead on soil enzyme activities // J. Environ. Sci. 2006. V. 18(6). P. 1135–1141. https://doi.org/10.1016/s1001-0742(06)60051-x
Zhang J., Shi Q., Fan S., Zhang Y., Zhang M., Zhang J. Distinction between Cr and other heavy-metal-resistant bacteria involved in C/N cycling in contaminated soils of copper producing sites // J. Hazard. Mater. 2021. V. 402. 123454. https://doi.org/10.1016/j.jhazmat.2020.123454
Zhou C., Ge N., Guo J., Zhu L., Ma Z., Cheng S., Wang J. Enterobacter asburiae reduces cadmium toxicity in maize plants by repressing iron uptake-associated pathways // J. Agric. Food Chem. V. 67. P. 10126‒10136. https://doi.org/10.1021/acs.jafc.9b03293
Дополнительные материалы отсутствуют.


