Почвоведение, 2022, № 3, стр. 347-353
Численность и морфологическое разнообразие бактериофагов в почвах
М. Р. Чекин a, *, Л. В. Лысак a, Е. В. Лапыгина a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: mrchekin@soil.msu.ru
Поступила в редакцию 23.06.2021
После доработки 29.09.2021
Принята к публикации 29.10.2021
- EDN: JKTTAH
- DOI: 10.31857/S0032180X22030042
Аннотация
С помощью метода эпифлуоресцентной микроскопии выявлено присутствие бактериофагов во всех образцах исследуемых почв (чернозема (Haplic Chernozem, WRB); дерново-подзолистой (Albic Retisol (Cutanic, Siltic), WRB), каштановой (Haplic Kastanozem, WRB), аллювиально-дерновой (Fluvisol (Loamic, Humic, WRB)). Численность бактериофагов, подсчитанная с помощью красителя SYBR Green 1, достигала значительных величин (0.34–5.7 млрд/г почвы). С помощью метода просвечивающей электронной микроскопии определены икосаэдрические, хвостатые и нитчатые морфотипы бактериофагов. Сравнение численности бактериофагов и бактерий в исследуемых образцах показало, что численность фагов была несколько меньше численности бактерий (за исключением показателей в образцах чернозема и почвы Антарктиды, где численность фагов была незначительно больше численности бактерий). Соотношение показателей численности бактериофаги/бактерии составляло от 0.16 до 1.67. С помощью красителя L7005 определена численность грамотрицательных и грамположительных клеток бактерий, выполнено сравнение с численностью бактериофагов в образцах торфяной и каштановой почвы. Отмечено преобладание грамотрицательных клеток бактерий (61% от общей численности бактерий). Численность фагов в переувлажненном биотопе (торфяной почве) была в 3 раза больше по сравнению с сухим биотопом (каштановой почвой). Выявленные высокие величины численности и значительное морфологическое разнообразие фагов позволяют предположить определенную роль в регуляции численности бактерий в почвах.
ВВЕДЕНИЕ
Бактериофаги (фаги) присутствуют во всех микробоценозах нашей планеты. Фаги не имеют энергетического обмена, у них отсутствует аппарат трансляции, который является важным компонентом всех живых организмов [4, 17, 27 ] .
В настоящий момент считается, что бактериофаги – наиболее многочисленные компоненты природных сообществ на Земле. Многими исследователями выделяется значимая роль бактериофагов в качестве регуляторов численности и структуры микробных сообществ в водных экосистемах [2, 19, 22, 28 ] . Известно об автолитической функции фагов, они участвуют в горизонтальном переносе генов бактерий [6, 14, 16, 30, 31, 32 ] . Значительно меньше сведений о роли бактериофагов в почве. Некоторые зарубежные авторы отмечают возможность выполнения фагами различных экологических функций в почве [18, 23, 26 ] , так как их численность достаточно высока (до 1010) [20]. Фаги чаще всего становятся объектом медицинских исследований, однако в отечественной и зарубежной научной литературе имеется ряд публикаций о роли бактериофагов в почве [5, 6, 10, 15, 21, 25].
Продолжение исследований роли фагов в почвенных микробных сообществах – важная задача, которая стоит перед современными микробиологами [7]. Особенность бактериофагов в том, что они не проявляют признаков живого вне клетки [9]. Область распространения фагов в природе зависит от чувствительных к ним бактерий [3]. В богатом микроорганизмами субстрате встречается большее количество фагов, взаимодействующих с конкретными бактериями из среды обитания [1].
Цель работы – определение численности бактериофагов и их морфологического разнообразия в некоторых почвах России для понимания их экологических функций в почве.
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследования служили образцы некоторых зональных и интразональных почв. Анализировали верхние (0–10 см) слои почвы. Образцы отбирали летом и осенью 2016–2018 гг. Анализировали свежеотобранные почвы, при необходимости образцы хранили в морозильной камере бытового холодильника при температуре –18°С. Изучали следующие почвы (по классификации почв 2004 г.):
– дерново-подзолистую типичную (Albic Retisol (Cutanic, Siltic), WRB) (Московская область, УОПЭЦ “Чашниково”), рН 3.3–5.5, содержание гумуса 3–7%;
– чернозем миграционно-мицелярный (Haplic Chernozem, WRB) (Белгородская область, участок заповедника “Белогорье”, Ямская степь), рН 6.0–7.0, содержание гумуса 6–9%;
– каштановую типичную (Haplic Kastanozem, WRB) (Волгоградская область, с. Качалино), pH 7.0–7.5, содержание гумуса 1.2–1.8%;
– торфяную олиготрофную (Dystriс Fibric Histosol, WRB) (Тверская область, Западнодвинский лесоболотный стационар ФГБУН Института лесоведения РАН), pH 2.5–4, содержание гумуса 1.2–1.5%;
– аллювильную серогумусовую дерновую (Fluvisol (Loamic, Humic), WRB) (Московская область, Озерский район, агрохолдинг “Сосновка”), pH 4.5–7.0, содержание гумуса 1–2%;
– пелозем (Limnic Fluvisol, WRB) (о. Новая Земля, Арктика), переувлажненный биотоп, формируются в условиях холодного и умеренно-холодного гумидного и семигумидного климата. Характеризуется кислой или близкой к нейтральной реакцией, слабой насыщенностью основаниями;
– петрозем (Histic Leptosol, WRB) (о. Новая Земля, Арктика) – сухой биотоп. Формирование почвы происходит в условиях гумидного и семигумидного климата, рН почвы кислая или близкая к нейтральной;
– псаммозем (Albic, WRB) (Антарктида, ст. Молодежная).
Численность бактериофагов в почве определяли с помощью красителя SYBR Green 1 (Molecular Probes, США) методом эпифлуоресцентной микроскопии [8, 29 ] . Краситель характеризуется высокой чувствительностью к ДНК и позволяет выявить бактериофагов с двуцепочечной ДНК. Навеску почвы 1 г помещали в 100 мл стерильной деионизированной профильтрованной через фильтр с диаметром пор 0.22 мкм (Millipore) воды. Для десорбции бактерий и фагов с поверхности почвенных частиц почвенную суспензию обрабатывали на ультразвуковом диспергаторе УЗДН-1 (22 кГц, 0.44 А, 2 мин), надосадочную жидкость пропускали через вакуумную фильтрационную систему Stericup (Millipore, размер пор 0.22 мкм). Для дальнейшего концентрирования фагов фильтрат (5 мл) концентрировали под вакуумом при небольшом разряжении (15–20 кПа) на мембранные диски из оксида алюминия Anodisk (Whatman, 25 мм) с диаметром пор 0.02 мкм. Затем диски высушивали на салфетке Kimwipe и переносили в пластиковую чашку Петри для окрашивания. Предварительно на дно чашки Петри для каждого диска наносили окрашивающий раствор: 2.5 мкл SYBR Green 1 (1 : 10) и 97.5 мкл профильтрованной через фильтр с диаметром пор 0.02 мкм стерильной деионизированной воды. Диски экспонировали 15 мин в темноте. Окрашенный диск помещали на предметное стекло, наносили на него антивыгорательный раствор ProLong Diamond Antifade Mountant (0.1%-ный раствор фенилендиамина) и накрывали покровным стеклом. Численности фагов считали с использованием люминесцентного микроскопа Zeiss Axioskop 2 plus (Германия) со светофильтром Filter set 09.
Общую численность бактерий в почвенной суспензии определяли по общепринятой методике с помощью красителя акридина оранжевого [11].
Численность грамположительных и грамотрицательных бактерий определяли с помощью красителя L 7005 (Live BacLight Bacterial Gram Stain Kit, Molecular Probes, USA) в соответствии с рекомендациями производителя.
Электронно-микроскопические исследования морфологического разнообразия бактериофагов проводили на электронном микроскопе JEM-100CX II. Фильтрат почвенной суспензии концентрировали центрифугированием (50 000 rpm на центрифуге MiniSpin Plus 5). Надосадочную жидкость сливали, остаток наносили на сетки. Сетки просматривали на просвечивающем электронном микроскопе JEM-100CX II при увеличении 500 и 1000 мкм.
Статистическую обработку данных количественного учета микроорганизмов проводили с помощью программ Microsoft Оffice Excel 2010 и Stаtistica 10.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Численность бактериофагов и бактерий определяли в наиболее отличающихся между собой условиях, выбраны несколько типов зональных и интразональных почв. С помощью метода эпифлуоресцентой микроскопии (краситель SYBR Green 1) фаги были обнаружены во всех проанализированных образцах верхних слоев (0–10 см) исследованных почв. Полученная численность бактериофагов составляла 0.3–5.7 млрд ед./г почвы, сходные значения численности отмечаются другими авторами в донных отложениях [24] (рис. 1).
Рис. 1.
Численность бактериофагов (краситель SYBR Green 1) в верхних слоях (0–10 см) исследуемых зональных (a) и интразональных (b) почв (млрд ед./г почвы). Почвы здесь и далее на рисунках: 1 – дерново-подзолистая типичная почва (Albic Retisol (Cutanic, Siltic), WRB); 2 – чернозем миграционно-мицелярный (Haplic Chernozem, WRB); 3 – каштановая типичная почва (Haplic Kastanozem, WRB); 4 – аллювильная серогумусовая дерновая почва (целина) (Fluvisol (Loamic, Humic, WRB)); 5 – аллювильная серогумусовая дерновая почва (пашня) (Fluvisol (Loamic, Humic, WRB)); 6 – торфяная олиготрофная почва (Dystric Fibric Histosol, WRB); 7 – пелозем (Limnic Fluvisol, WRB); 8 – петрозем (Histic Leptosol, WRB); 9 – псаммозем (Albic, WRB).
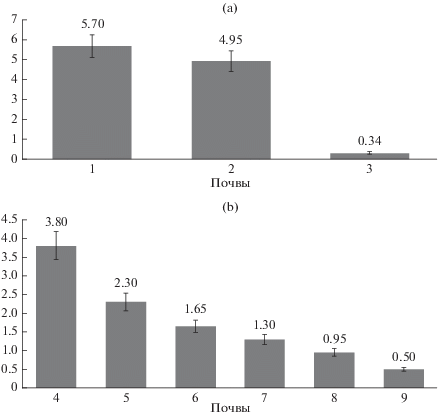
В зональных почвах (дерново-подзолистой, черноземе, каштановой) численность фаговых частиц составляла 0.34–5.7 млрд ед./г почвы. Максимальные значения численности отмечены в дерново-подзолистой почве (5.7 млрд ед./г почвы), в черноземе (5.0 млрд ед./г почвы), минимальная численность зафиксирована в каштановой почве (0.34 млрд ед./г).
В интразональных почвах (торфяной, аллювиальной дерновой, петроземе, пелоземе, псаммоземе) численность фагов варьировала от 0.5 до 3.8 млрд ед./г: максимальная численность отмечена в почвах Арктики (в пелоземе 3.8, в петроземе – 2.3 млрд ед./г почвы), численность фагов в целинной аллювиальной почве и ее окультуренном аналоге (пашне) составляла 1.65 и 0.95 млрд ед./г почвы, в торфяной почве – 1.3 млрд ед./г почвы, минимальная численность наблюдалась в почве Антарктиды – псаммоземе (0.5 млрд ед./г почвы). Следует отметить, что в арктических почвах численность фагов в переувлажненном биотопе (пелозем) в 1.5 раз больше, чем в сухом биотопе (петрозем).
Таким образом, бактериофаги обнаружены во всех исследованных образцах верхних горизонтов почв. Численность бактериофагов, подсчитанная с помощью красителя SYBR Green 1, достигала значительных величин (0.34–5.7 млрд ед./г почвы). Подсчитанная численность фагов сравнима с их численностью в донных отложениях [24], лесных почвах штата Делавер [33 ] и на 2–3 порядка больше, чем в пустынных почвах [23]. При этом результаты численности фагов в почве можно сравнить с результатами исследования Шах Махмуд [15].
Морфологическое разнообразие бактериофагов. С помощью ПЭМ обнаружены следующие морфотипы бактериофагов: хвостатые, икосаэдрические и нитчатые. Наличие нитчатых фагов отмечено в почвах полярных областей (рис. 2) и экосистем [12–14].
Сравнение численности бактериофагов с общей численностью бактерий и численностью грамположительных/грамотрицательных бактерий. Известно, что численность бактериофагов связана с численностью бактерий в водных экосистемах [19]. В нашем исследовании было проведено сопоставление численности фагов с численностью бактерий. Данные, полученные при помощи эпифлуоресцентной микроскопии (краситель АО), показали, что практически во всех образцах почв численность бактерий была выше аналогичного показателя бактериофагов (за исключением чернозема и образца почвы Антарктиды). Максимальные значения численности бактерий получены для целинной аллювиальной почвы (10.15 млрд кл./г почвы), меньшим значением показателя характеризовались образцы пелозема и дерново-подзолистой почвы (4.4 и 6.2 млрд кл./г почвы соответственно). В остальных образцах значения не превышали 4 млрд кл./г почвы. Минимальные значения были получены для псаммозема (Антарктида) (0.3 млрд кл./г почвы). Близкие значения показателя (от 0.16 до 1.67 млрд кл./г почвы) отмечаются другими авторами [33 ] . В донных отложениях соотношение численности бактериофагов к бактериям составляет 20–80 [24] (рис. 3).
Рис. 3.
Численность бактериофагов (краситель SYBR Green 1) (млрд ед./г почвы) и бактерий (краситель АО) (млрд кл./г почвы) в верхних горизонтах исследуемых почв.
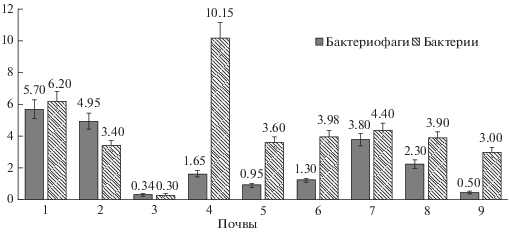
В исследованных образцах почв показатель численности был больше у бактерий (за исключением показателей в образцах чернозема и псаммозема). Отношение численности бактериофагов к бактериям варьировало от 0.16 до 1.67.
С помощью современного красителя L 7005 определяли численность и долю грамотрицательных и грамположительных клеток бактерий (рис. 4). Исследовали торфяную и каштановую почвы в качестве примеров влажного и сухого биотопа. В торфяной почве численность клеток грамотрицательных бактерий составляла 2.2 млрд кл./г почвы (61% от общей численности бактерий), численность грамположительных клеток – 1.4 млрд кл./г почвы (39% от общей численности бактерий), в каштановой почве наблюдалось обратное соотношение и преобладание грамположительных клеток, их численность оказалась равной 1.7 млрд кл./г почвы (57% от общей численности бактерий), численность грамотрицательных клеток равнялась 1.3 млрд/г каштановой почвы (43% от общей численности бактерий).
Рис. 4.
Численность бактериофагов (млрд ед./г почвы), грамположительных и грамотрицательных бактерий (млрд кл./г почвы) в торфяной (1) и каштановой (2) почвах.
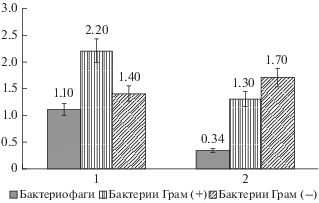
При этом численность фагов во влажном биотопе (торфяной почве) в 3 раза больше, чем в сухом (каштановой почве). Учитывая характерное для переувлажненных местообитаний преобладание грамотрицательных клеток бактерий, а также высокую численность фагов во влажных биотопах, можно предположить зависимость численности фагов от грамотрицательных клеток бактерий, что, в свою очередь, зависит от влажности почвы. В переувлажненном биотопе (торфяной почве) отмечено преобладание грамотрицательных клеток бактерий (61% от общей численности бактерий).
ЗАКЛЮЧЕНИЕ
Использование нового высокочувствительного красителя SYBR Green 1 позволило выявить в исследованных почвах присутствие значительного количества бактериофагов. Значения численности бактериофагов достигало нескольких млрд ед./г почвы. Примененный метод определения численности фагов учитывает лишь двуцепочечные ДНК-содержащие фаги. Полученные нами величины не учитывают одноцепочечных ДНК- и РНК-содержащих фагов и фагов, находящихся внутри бактериальных клеток, поэтому общая численность фагов значительно больше. Выявленные высокие значения численности и значительное морфологическое разнообразие фагов позволяют предположить, что они играют определенную роль в регуляции численности бактерий в почвах. Очевидно, в почве присутствуют бактериофаги с разным воздействием на бактерии. Полученные данные требуют дальнейшего осмысления и продолжения исследований.
Список литературы
Воронина М.В., Бугаева Е.Н., Васильев Д.М., Кабанова А.П., Баранник А.П., Шнейдер М.М., Мирошников К.А. Характеристика бактериофага Pectobacterium carotovorum subsp. Carotovorum pp16, перспективного для биоконтроля мягкой гнили картофеля // Микробиология. 2019. Т. 88. № 4. С. 458–469. https://doi.org/10.1134/S0026365619040116
Дрюккер В.В., Дутова Н.В. Бактериофаги как новое трофическое звено в экосистеме глубоководного озера Байкал // Доклады АН. 2009. Т. 427. № 2. С. 277–281.
Кадников В.В., Марданов А.В., Ивасенко Д.А., Анциферов Д.В., Белецкий А.В., Карначук О.В., Равин Н.В. Новый бактериофаг порядка Caudovirales, обнаруженный в метагеноме грунта в районе подземного горения угля // Микробиология. 2019. Т. 88. № 2. С. 240–244. https://doi.org/10.1134/S0026365619020150
Каттер Э., Сулаквелидзе А. Бактериофаги: биология и практическое применение. М.: Научный мир, 2012. 640 с.
Конбаева Г.М., Еспембетов Б.А., Сырым Н.С. Изучение биологических свойств бактериофагов активных в отношении атипичных микобактерий // Аграрная наука и образование на современном этапе развития. 2019. Т. 1. С. 251–256.
Копылов А.И., Косолапов Д.Б., Заботкина Е.А. Влияние вирусов на гетеротрофный бактериопланктон водохранилищ // Микробиология. 2011. Т. 80. № 2. С. 241–260.
Куликов Е.Е., Голомидова А.К., Морозова В.В., Козлова Ю.Н., Летаров А.В. Бактериофаги группы Т5 как потенциальные агенты фаготерапии // Микробиология. 2019. Т. 88. № 6. С. 730–734. https://doi.org/10.1134/S0026365619060065
Лапыгина Е.В., Лысак Л.В., Москвина М.И., Звягинцев Д.Г. Численность вирусов в аллювиально-дерновой почве (метод прямой эпифлуоресцентной микроскопии) // Микробиология. 2016. Т. 85. № 6. С. 748–751. https://doi.org/10.7868/S0026365616060148
Летаров А.В. Современные концепции биологии бактериофагов. М.: ДеЛи, 2019. 384 с.
Мартынова К.В., Феоктистова Н.А., Васильев Д.А. Биологические свойства бактериофагов Bacillus coagulans // Аграрная наука и образование на современном этапе развития: опыт, проблемы и пути их решения. Ульяновск: УлГАУ, 2019. Т. I. УлГАУ, 2019.
Методы почвенной микробиологии и биохимии / Под ред. Д.Г. Звягинцева. М.: Изд-во Моск. ун-та, 1991. 304 с.
Сургучева Н.А., Филиппова С.Н., Куликов Е.Е., Брушков А.В., Рогов В.В. Фаговые частицы в подземных льдах Арктики // Микробиология. 2019. Т. 88. № 2. С. 224–229. https://doi.org/10.1134/S0026365619020162
Филиппова С.Н., Сургучева Н.А., Куликов Е.Е., Сорокин В.В., Акимов В.Н., Бейдж А.К., Маккей Л., Андерсен Д., Гальченко В.Ф. Обнаружение фагов в популяции бактерий озера Унтерзее (Антарктида) // Микробиология. 2013. Т. 82. № 3. С. 366–369. https://doi.org/10.7868/S0026365613030051
Филиппова С.Н., Сургучева Н.А., Сорокин В.В., Акимов В.Н., Карнышева Э.А., Брушков А.В., Гальченко В.Ф. Бактериофаги низкотемпературных систем Арктики и Антарктики // Микробиология. 2016. Т. 85. № 3. С. 337–346. https://doi.org/10.7868/S0026365616030046
Шах Махмуд Р., Гарифулина К.И., Ульянова В.В., Евтюгин В.Г., Миндубаева Л.Н., Хазиева Л.Р., Дудкина Е.В., Вершинина В.И., Колпаков А.И., Ильинская О.Н. Бактериофаги почвенных бацилл: новый поливалентный фаг Bacillus altitudinis // Молекулярная генетика, микробиология и вирусология. 2017. Т. 35. № 2. С. 59–64. https://doi.org/10.18821/0208-0613-2017-35-2-59-64
Шестаков С.В. Как происходит и чем лимитируется горизонтальный перенос генов у бактерий // Экологическая генетика. 2007. № 2. https://cyberleninka.ru/article/n/kak-proishodit-i-chem-limitiruetsya-gorizontalnyy-perenos-genov-u-bakteriy
Brussow H., Kutter E. Phage ecology // Bacteriophages: Biol. Appl. 2005. V. 70. P. 129–163.
Burroughs N.J., Marsh P., Wellington, E.M. Mathematical analysis of growth and interaction dynamics of streptomycetes and a bacteriophage in soil // Appl. Environ. Microbiol. 2000. V. 66. № 9. P. 3868–3877. https://doi.org/10.1128/AEM.66.9.3868-3877.2000
Danovaro R., Corinaldesi C., Filippini M., Fischer U.R., Gessner M.O., Jacquet S., Magagnini M., Velimirov B. Viriobenthos in freshwater and marine sediments: a review // Freshwater Biology. 2008. V. 53. № 6. P. 1196–1213. https://doi.org/10.1111/j.1365-2427.2008.01961.x
Elford W.J., Andrewes C.H. The sizes of different bacteriophages // British J. Experimental Pathology. 1932. V. 13. № 5. P. 446.
Farnell-Jackson E.A., Ward A.K. Seasonal patterns of viruses, bacteria and dissolved organic carbon in a riverine wetland // Freshwater Biology. 2003. V. 48. P. 841–851. https://doi.org/10.1127/0003-9136/2004/0161-0225
Fuhrman J.A. Marine viruses and their biogeochemical and ecological effects // Nature. 1999. V. 399. P. 541–548. https://doi.org/10.1038/21119
Gonzales-Martin C., Teigell-Perez N., Lyles M., Valladares B., Griffin D.W. Epifluorescent direct counts of bacteria and viruses from topsoil of various desert dust storm regions // Res. Microbiol. 2013. V. 81. P. 17–21. https://doi.org/10.1016/j.resmic.2012.08.009
Helton R.R., Liu L., Wommack K.E. Assessment of factors influencing direct enumeration of viruses within estuarine sediments // Appl. Environ. Microbiol. 2006. V. 72. P. 4767–4774. https://doi.org/10.1128/AEM.00297-06
Kimura M., Jia Z.-J., Nakayama N., Asakawa S. Ecology of viruses in soils: past, present and future perspectives // Soil Sci. Plant Nutrition. 2008. V. 54. № 1. P. 1–32. https://doi.org/10.1111/j.1747-0765.2007.00197.x
Дополнительные материалы отсутствуют.



