Почвоведение, 2022, № 4, стр. 469-481
Влияние гуминовых кислот на формирование биопленок на поверхности полиэтилена и его биодеградацию почвенными бактериями
К. И. Богданов a, *, Н. В. Костина a, В. К. Плакунов b, М. В. Журина b
a Факультет почвоведения, МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт микробиологии им. С.Н. Виноградского РАН
117312 Москва, пр-т 60-летия Октября, 7/2, Россия
* E-mail: bogdanovkrl@gmail.com
Поступила в редакцию 17.08.2021
После доработки 21.09.2021
Принята к публикации 08.11.2021
- EDN: AKXLUK
- DOI: 10.31857/S0032180X22040050
Аннотация
Исследовано влияние гуминовых кислот на формирование мультивидовых биопленок на поверхности полиэтилена высокого давления и на начальные этапы его биокоррозии. Способность к образованию биопленок на поверхности полиэтилена и начальные этапы его биодеструкции изучена у двух бактериальных сообществ (бинарного и мультивидового), выделенных с поверхности полиэтилена, инкубированного в верхнем слое почвы (0–5 см) в течение 180 сут в Мьянме. Для выделения микроорганизмов образцы полиэтилена стерильно доставляли в лабораторию (г. Москва) и помещали во флаконы с жидкой средой LB, разбавленной минеральной средой М9 в 50 раз с добавкой 0.1%-ного раствора парафинов С11–С16 в качестве дополнительного источника углерода, далее выполняли рассевы для получения отдельных колоний. Гуминовые кислоты выделяли методом щелочной экстракции из верхних горизонтов ферраллитной почвы, в которой инкубировали полиэтилен (Мьянма), и чернозема типичного, отобранного в Липецкой области (Orthic Acrisol и Haplic Chernozem по World Reference Base for soil resources 2014). Также гуминовые кислоты экстрагировали из гуматного удобрения компании “Флексом” на основе низинного торфа. Формирование биопленок на поверхности полиэтилена оценивали по окрашиванию кристаллическим фиолетовым, изменение поверхности полиэтилена после удаления биопленок – денситометрическим методом. Впервые выявлен стимулирующий эффект гуминовых кислот в широком диапазоне концентраций на рост биопленок на поверхности полиэтилена и начальном этапе его биодеградации. Методические подходы и полученные результаты дополняют сведения о биодеструкции полиэтилена и могут быть применены в биотехнологиях.
ВВЕДЕНИЕ
Стремительное накопление пластмассовых отходов, как в природных средах, так и в городах, приводит к серьезным проблемам: от гибели животных и растений до ухудшения здоровья человека [14]. В 2019 г. произведено в общей сложности 368 млн т пластиков, что отражает широкое распространение их использования в технике и быту [27].
Такое количество пластиков и их отходов вызывает серьезное беспокойство о сохранности окружающей среды. Более того, в отличие от многих других органических материалов и загрязнителей окружающей среды синтетические пластики химически инертны, что осложняет процесс их разложения [4, 31]. Существует множество механических и физико-химических методов утилизации пластиков, но они имеют массу недостатков. Биодеградация, несмотря на низкую скорость, является наиболее безопасным для окружающей среды способом борьбы с пластиковыми отходами [7, 29]. В целях ускорения процесса биодеградации проводят обработку пластиковых поверхностей ультрафиолетовым излучением [28] и специальными реагентами для стимуляции образования биопленок. С этой же целью модифицируют структуру полиэтилена, внедряя биоразлагаемые добавки (целлюлозу или крахмал) или металлы, понижающие его биоустойчивость [16].
На скорость биодеградации пластиков в почве могут оказывать влияние многие почвенные компоненты, в частности гуминовые кислоты (ГК), однако их роль в этих процессах практически не изучена. Известно, что гуминовые соединения служат источником питания и донорами электронов для почвенных микроорганизмов [24] и стимулируют рост растений [11].
Добавление в качестве единственного источника углерода ГК обеспечивает рост микроорганизмов на минеральной среде [6]. Кроме этого, ГК индуцируют синтез ферментов микроорганизмами и повышают их метаболическую активность, но также могут деактивировать способность микроорганизмов продуцировать внеклеточные ферменты [21].
В настоящее время ученые интенсивно исследуют биодеградацию пластмасс, в том числе полиэтилена, тестируя отдельные штаммы микроорганизмов на способность формировать биопленки на поверхности пластмасс и нарушать ее структуру. Однако до сих пор в мировой литературе мало работ, посвященных мультивидовым биопленкам и их воздействию на полиэтилен. ГК являются предметом интенсивного изучения и несмотря на то, что их взаимодействие с микроорганизмами подробно изучено, публикаций, связанных с влиянием ГК на биопленки (особенно, мультивидовые), немного. Проводились исследования по применению ГК в качестве биоремедиантов загрязненных природных сред [10, 22], однако участию ГК в биодеградации полиэтилена – одного из основных загрязнителей окружающей среды – уделяется недостаточно внимания.
Цель работы – изучение микробной колонизации пластин полиэтилена высокого давления (ПВД) и формирования мультивидовых биопленок на их поверхности почвенными микроорганизмами в присутствии растворов ГК, а также оценка влияния ГК на начальные этапы биодеградации ПВД. Для этого опытные образцы ПВД предварительно инкубировали в почве, затем с их поверхности выделяли сообщества и чистые культуры почвенных микроорганизмов, которые использовали в дальнейшей работе.
ОБЪЕКТЫ И МЕТОДЫ
Исследуемые сообщества микроорганизмов выделяли с поверхности образцов ПВД, инкубированных в верхнем слое (0–5 см) почвы Orthic Acrisol и на ее границе с воздухом в районе г. Мемьо, Мьянма. Образцы доставляли в Мьянму в стерильных пакетах на самолете. Опыт проводили в огороженном пространстве (в саду или другой закрытой от посторонних людей территории), для одного образца выделяли участок 10 × 10 см. Образцы извлекали из пакетов в перчатках и погружали в почву на глубину до 5 см и огораживали место экспонирования.
Приготовление и экспонирование образцов ПВД. В качестве экспериментальных образцов использовали ПВД марки 15803-020, произведенный согласно ГОСТ 16337-77 на предприятии ПАО “Казаньоргсинтез”. Образцы разрезали на круги диаметром 10 см и подвергали обработке УФ в течение 1 ч по 30 мин с каждой стороны (УФ-лампа ДБ 30-01 мощностью 30 Вт, бактерицидная мощность 6 Вт, 253.7 нм) для стерилизации и ускорения последующей деструкции полимера под действием окружающей среды (подробная методика изготовления образцов описана в статье Журиной [1], в данной работе использовали образцы без добавления биоцида).
Культивирование сообществ микроорганизмов. После инкубации образцы ПВД собирали в стерильные пакеты и доставляли в лабораторию на самолете при комнатной температуре. Образцы стерильно нарезали на полоски 1 × 2 см и помещали во флаконы объемом 30 мл с жидкой средой LB (Lennox), разбавленной минеральной средой М9 в 50 раз с добавлением 0.1% парафинов С11–С16 (жидкость для розжига на основе линейных парафинов Grillkoff производства “НПО Тверской проект”) в качестве дополнительного источника углерода. Флаконы инкубировали на качалке при 150 об./мин 7 сут при температуре 30°С. После этого рассевали на плотную среду LA (LB с добавлением 2% агара) для получения колоний чистых и смешанных культур. Чашки инкубировали 7 сут при температуре 30°С.
Посевной материал из смешанных культур, выделенных с поверхности полиэтилена, готовили следующим образом. Выбирали сообщества с разными морфологическими признаками, затем микробиологической петлей брали биомассу микроорганизмов с чашки, помещали в колбу с 20 мл жидкой среды LB и инкубировали при 150 об./мин на качалке в течение 24 ч при температуре 30°С.
Экстракция гуминовых кислот. В экспериментах использовали ГК, выделенные из следующих источников: верхнего горизонта ферраллитной почвы Orthic Acrisol, г. Мемьо, Мьянма (ГКА); верхнего горизонта чернозема типичного (Haplic Chernozem), Липецкая область (ГКЧ); гуматного удобрения на основе низинного торфа компании “Флексом” (ГКТ). В данной работе не проводили анализ элементного состава ГК. Согласно литературным данным [23, 30 ], в среднем ГК содержат до 60% С, 5% H, 4% N, 40% O и различные функциональные группы: COOH, ArOH и др.
ГК выделяли методом щелочной экстракции [3] из образцов почв. К навеске воздушно-сухой декальцинированной почвы приливали 0.1 н. раствор NaOH в соотношении почва : щелочь 1 : 5, суспензию перемешивали на магнитной мешалке в течение 2 ч и оставляли до полного осаждения частиц почвы. К раствору гуминовых веществ добавляли 1 н. раствор HCl до pH 1–2, затем центрифугировали при 8000 об./мин в течение 20 мин. Супернатант удаляли, выпавший осадок ГК тщательно промывали дистиллированной водой и высушивали при температуре 30°С.
ГК также экстрагировали из торфяного удобрения “Флексом”. Удобрение фильтровали через фильтр “белая лента”. К фильтрату добавляли 1 н. раствор HCl до pH 1–2, затем центрифугировали при 8000 об./мин в течение 20 мин. Супернатант удаляли, выпавший осадок ГК тщательно промывали дистиллированной водой и высушивали при температуре 30°С.
Приготовление растворов гуминовых кислот. Навеску высушенных ГК массой 0.1 г помещали в 10 мл 0.1 M NaOH и перемешивали на встряхивателе Vortex (Heidolph REAX top) до полного растворения. Затем pH раствора доводили 1 н. раствором HCl до 7.0.
Раствор ГК фильтровали с помощью бактериального фильтра с диаметром пор 0.22 мкм в стерильный флакон. Далее раствор концентрации 10 мг/мл использовали для приготовления разведений в стерильном натрий-фосфатном буфере (pH 7.2). Учитывая дальнейшее разбавление в 2 раза (в результате добавления среды в процессе эксперимента), готовили следующие разведения: 10, 5, 2, 1, 0.5 и 0.2 мг/мл [6]. Растворы хранили при температуре 2–4°С.
Изучение роста микроорганизмов на среде с ГК в качестве единственного и дополнительного источника углерода и энергии. В ячейки 96-луночного планшета добавляли по 50 мкл стерильной минеральной среды М9. Затем в часть лунок помещали по 50 мкл растворов гуматов разной концентрации, выделенных из разных субстратов. Итоговая концентрация ГК в лунках составляла 5, 2.5, 1, 0.5, 0.25 и 0.1 мг/мл. Далее в лунки помещали по 5 мкл посевного материала, выращенного на среде М9, оптическая плотность при длине волны 540 нм (ОП540) которого составляла 0.1 (подробнее про исследуемые сообщества см. далее). Контроль: 50 мкл среды М9 и 50 мкл натрий-фосфатного буфера с добавлением посевного материала. Отрицательный контроль: 50 мкл среды М9 и 50 мкл натрий-фосфатного буфера.
В другом варианте опыта в ячейки планшета добавляли по 50 мкл стерильной богатой питательной среды LB. Затем в часть лунок помещали по 50 мкл растворов ГК разной концентрации, выделенных из разных субстратов. В лунки также помещали по 5 мкл посевного материала, оптическая плотность при длине волны 540 нм (ОП540 = = 0.1). Контроль: 50 мкл среды LB и 50 мкл натрий-фосфатного буфера с добавлением посевного материала. Отрицательный контроль: 50 мкл среды LB и 50 мкл натрий-фосфатного буфера.
Измерения условной оптической плотности (светорассеяние + светопоглощение) проводили на планшетном ридере Xmark (Biorad, US) при длине волны 492 нм (ОП492) спустя 72 ч инкубации при температуре 30°С. Рост оценивали по разности между оптической плотностью суспензии клеток в лунке после инкубации и начальной оптической плотностью в лунке до добавления посевного материала. При обработке результатов учитывали уменьшение концентрации растворов гуматов в 2 раза при разбавлении в среде.
Тестирование сообществ на способность к росту на полиэтиленах. Из листов пленки ПВД толщиной 150 мкм (ГОСТ 10354–82) нарезали пластины 1 × 2 см, помещали в чашки Петри и стерилизовали УФ по описанной выше методике. Стерильные пластины ПВД хранили при комнатной температуре в чашках Петри.
Тестируемые пластинки ПВД стерильно пластмассовым пинцетом погружали в застывшую среду LA примерно на 1/2 их высоты. Вокруг основания пластин ПВД вносили по 100 мкл суспензии клеток посевного материала, полученного при культивировании смешанных культур. На одну из чашек помещали пластины ПВД без добавления посевного материала, чтобы получить отрицательный контроль. Чашки инкубировали 7 сут при 30°C.
Далее пластины извлекали из плотной среды, ополаскивали от остатков дистиллированной водой и использовали для определения суммарного количества биопленок, сформировавшихся на ПВД, и оценивали повреждение его поверхности денситометрическим методом.
Количественная оценка условной биомассы биопленок. В случае окрашивания кристаллическим фиолетовым (КФ), пластины фиксировали 2 мл 96%-ного этанола и после удаления этанола и подсушивания на воздухе помещали в 2 мл 0.1%‑ного водного раствора КФ на 60 мин. Пластины промывали дистиллированной водой для удаления не связанного с биопленками красителя, после чего вновь подсушивали на воздухе. Связанный с биопленками краситель экстрагировали 2 мл 96%-ного этанола до практически полного обесцвечивания образца. Оптическую плотность экстрактов измеряли при 590 нм (ОП590) против экстракта отрицательного контроля [5].
Количественная оценка условной биомассы биопленок на поверхности полиэтилена при внесении растворов ГК. Пластины ПВД помещали на чашки Петри с плотной средой LA по описанной выше методике. Затем в область основания пластин вносили медицинским шприцем 100 мкл стерильных растворов гуматов разной концентрации (2.5, 0.5, 0.25 и 0.05 мг/мл). Также на основания пластин вносили 100 мкл суспензии суточного посевного материала, приготовленного на среде LB (ОП540 = = 0.1). На часть чашек микробную культуру не добавляли, чтобы получить отрицательный контроль. Чашки инкубировали при 30°С.
Через 7 и 14 сут по описанным методикам оценивали суммарное количество биопленок, сформированных на поверхности пластин ПВД, и изменение шероховатости поверхности пластин.
Сканирующая микроскопия. Для подготовки образцов к сканирующей микроскопии их фиксировали 2.5%-ным раствором глутарового альдегида. Затем промывали натрий-фосфатным буфером 2 раза. Далее последовательно обрабатывали этиловым спиртом концентрации: 30% (1–2 мин), 50% (5–10 мин), 70% (5 мин), 96% (5 мин). Образцы прикрепляли к столбикам для сканирующей микроскопии (микроскоп JEOL-IT 200, Япония) двусторонним скотчем, затем напыляли золотом.
Изменение шероховатости поверхности ПВД под воздействием микробных биопленок. Использовали ранее описанную методику [1]. Вкратце: пластины ПВД помещали в 5%-ный раствор бихромата калия в 98%-ной серной кислоте на 24 ч для удаления биопленок. Далее пластины ПВД промывали дистиллированной водой, сушили на воздухе и фотографировали с помощью микроскопа DNX 30 (фирма Levenhuk Inc., США) при боковом освещении под углом 5° относительно горизонтальной поверхности на черном не рассеивающем свет фоне. Полученные фотографии обрабатывали в Photoshop CS6: обрезали края, оставляя только поверхность пластины ПВД, размер изображений изменяли до 200 × 200 пикселей, инвертировали, переводили в черно-белый вариант и сохраняли файлы в формате .bmp. Затем фотографии загружали в программу Sorbfil TLC View для денситометра “Сорбфил” (ТУ 4436-003-16943778-99, ЗАО НПО “Техноком”, Россия) и проводили количественный анализ изменения шероховатости поверхности пластин, сравнивая яркость опытных образцов и отрицательного контроля. Для этого вычисляли площади пиков, а затем переводили полученные значения площади (в пикселях) в проценты относительно отрицательного контроля.
Статистическая обработка. При оценке достоверности различий применяли непараметрический U-критерий Манна–Уитни (при P < 0.05 различия считали значимыми), сравнивая результаты, полученные для ряда концентраций ГК, с результатами контрольных опытов. На графиках отображали медианные значения абсолютных или относительных величин, варьирование данных отображали в виде 95%-ного доверительного интервала. Относительные значения (изменения шероховатости поверхности пластин ПВД) рассчитывали путем деления опытных значений площади пиков (в пикселях) на значения площади пиков отрицательного контроля. Корреляцию между тотальной биомассой биопленок, сформированных на пластинах ПВД, и степенью изменения поверхности пластин рассчитывали с помощью коэффициента корреляции Спирмена. Все измерения проводили минимум в трех повторностях. Статистическую обработку и построение графиков выполняли в программе GraphPad Prism 8.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
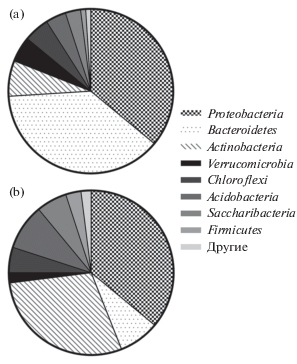
Выделение сообществ микроорганизмов с поверхности ПВД, инкубируемого в почве. Были проанализированы сообщества микроорганизмов, выросшие на образцах ПВД в результате природных испытаний. В лаборатории BioSpark методом New Generation Sequence (NGS) анализировали гипервариабельный регион v3-v4 16S рДНК микробных сообществ с образца ПВД, извлеченного из почвы спустя 180 дней инкубации и из образца почвы без ПВД (рис. 1). Как следует из диаграмм, представители филума Proteobacteria присутствовали в равном соотношении, как в образце почвы, так и на поверхности полиэтилена (36% от общего состава). Примечательно, что представители филума Bacteroidetes доминировали, составляя 38% от таксономического состава в образце почвы, однако их численность уменьшалась до 8% на поверхности полиэтилена. Важно отметить, что количество микроорганизмов, относящихся к филуму Actinobacteria, напротив, значительно увеличивалось на поверхности полиэтилена по сравнению с образцом почвы: 29 и 7% от общего числа микроорганизмов соответственно. Наблюдали незначительное увеличение числа представителей филумов Firmicutes, Saccharibacteria и Acidobacteria на поверхности полиэтилена. По результатам можно судить о высокой способности представителей данных филумов почвенных микроорганизмов формировать биопленки на поверхности полиэтилена. Это позволяет предположить, что среди микроорганизмов, относящихся к данным филумам, есть активные деструкторы полиэтилена.
Рис. 1.
Соотношение филумов домена Bacteria в образцах почвы Orthic Acrisol из Мьянмы (a) и на образцах полиэтилена, инкубированного в данной почве (b).
На разбавленной среде LB с добавлением парафинов было выделено более 20 мультивидовых сообществ микроорганизмов. Всем сообществам присваивали порядковые номера и пересевали на плотные среды аналогичного состава, после чего смешанные культуры, различающиеся по макро- и микроморфологическим признакам, отбирали для исследования на способность формировать биопленки на поверхности образцов и нарушать его структуру. Для детального таксономического анализа и выделения чистых культур путем рассева на плотной среде были выбраны два сообщества.
Таксономическая принадлежность выделенных чистых культур была определена с помощью секвенирования генов 16S рРНК. Так, первое сообщество (1) содержало два штамма бактерий: Gordonia terrae 3612 и Rhizobium radiobacter (Agrobacterium tumefaciens) ATCC 23308. Второе сообщество (2) было мультивидовым и включало следующие штаммы: Cellulosimicrobium cellulans DSM 43879, Bacillus albus MCCC 1A02146, Bacillus badius DSM 23T, Bacillus firmus NBRC 15306, Brevundimonas naejangsanensis BIO-TAS2-2, Lysinibacillus pakistanensis NCCP-54, Microbacterium paraoxydans CF36 и Pusillimonas thiosulfatoxidans YE3.
Влияние гуматов в качестве единственного и дополнительного источника углерода на рост смешанных культур. Исследовали влияние ГК на рост микроорганизмов и выбирали оптимальные концентрации для дальнейшего изучения эффекта ГК на процесс формирования биопленок на поверхности ПВД (рис. 2).
Рис. 2.
Рост микробных сообществ в присутствии растворов ГК, выделенных из акрисоли (a, b), чернозема (c, d) и торфяного удобрения (e, f) на жидких средах: минеральной среде М9 (a, c, e) и богатой среде LB (b, d, f). Контроль (0): без добавления ГК. Время инкубации: 72 ч. Варьирование представляли в виде 95% доверительного интервала медианы.
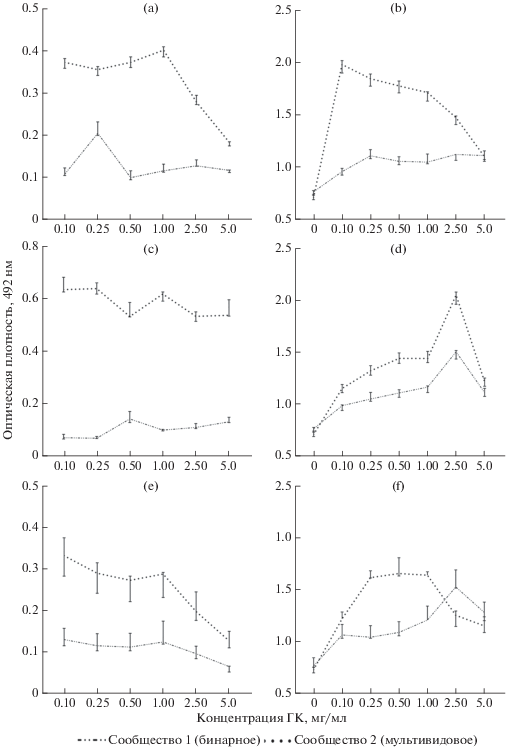
Из приведенных диаграмм видно, что ГК в качестве единственного источника углерода (рис. 2a, 2c, 2e) обеспечивали рост исследуемых сообществ микроорганизмов во всем диапазоне концентраций, но эффект от ГК ослаблялся при увеличении концентрации до 2.5–5 мг/мл. При внесении ГК в качестве дополнительного источника углерода (рис. 2b, 2d, 2f) наблюдали аналогичную зависимость: спустя 72 ч инкубации максимальный эффект от ГК отмечали в диапазоне от 0.1 до 0.5 мг/мл. Однако в большинстве опытов при повышении концентрации до 2.5 мг/мл стимуляция уменьшалась. Такая зависимость роста почвенных микроорганизмов от концентрации ГК частично совпадает с полученными ранее данными [6], но стоит учитывать индивидуальные свойства конкретного вида микроорганизмов и взаимоотношения организмов внутри сообществ. Во всех вариантах опыта лучший рост продемонстрировало мультивидовое сообщество 2, тогда как эффект от внесения ГК в бинарное сообщество 1 выражен слабее. Во-первых, это может быть связано с присутствием в мультивидовом сообществе быстрорастущих микроорганизмов (например, Bacillus spp.), обусловливающих прирост биомассы. Во-вторых, учитывая незначительное отличие результатов контрольных опытов, можно предположить наличие специфичного воздействия ГК на метаболизм клеток [28] и на формирования взаимовыгодных отношений внутри микробных сообществ, направленных на окисление субстратов (в данном случае ГК).
Таким образом, стимуляцию роста наблюдали во всем изученном диапазоне концентраций ГК: 0.1–5 мг/мл, но оптимум для роста всех изученных сообществ лежал в пределах 0.1–1 мг/мл, что соответствует содержанию ГК в различных природных средах [2]. Известно, что механизмы взаимоотношения микроорганизмов и гумусовых веществ носят комплексный характер, включая как абиотические, так и биотические окислительно-восстановительные взаимодействия. Одним из важнейших таких взаимодействий является способность почвенных гетеротрофных микроорганизмов к разложению органического вещества почвы (в том числе гумуса), с усвоением C и N и высвобождением части этих элементов в виде CO2, CH4, NO2 в атмосферу [28]. По результатам исследования влияния ГК разного происхождения на рост сообществ был скорректирован диапазон концентраций для выращивания биопленок на плотной среде. Для дальнейшей работы брали концентрации ГК, на которых сообщества продемонстрировали лучший рост (менее 2.5 мг/мл), также добавляли вариант с меньшим содержанием ГК (0.05 мг/мл). Несмотря на то, что стимулирующий эффект от ГК был более заметен при росте микроорганизмов на минеральной среде М9, лишенной иных источников углерода, лучший прирост биомассы наблюдали в присутствии гуматов в качестве дополнительного источника углерода. Поэтому для дальнейших исследований влияния ГК на формирования биопленок на поверхности пластин ПВД выбрали богатую среду LA (LB + 2% агара).
Оценка суммарного количества биопленок, сформировавшихся на поверхности ПВД. При изучении влияния ГК на процесс формирования биопленок на поверхности пластин ПВД были получены результаты, представленные на рис. 3.
Рис. 3.
Количественная оценка формирования биопленок бинарным сообществом 1 (a) и мультивидовым сообществом 2 (b) на поверхности пластин ПВД по окрашиванию КФ в присутствии ГК, выделенных из акрисоли (ГКА), чернозема (ГКЧ) и торфяного удобрения (ГКТ). Контроль (0): без добавления ГК. Время инкубации: 7 и 14 сут. Варьирование представляли в виде 95%-ного доверительного интервала медианы.
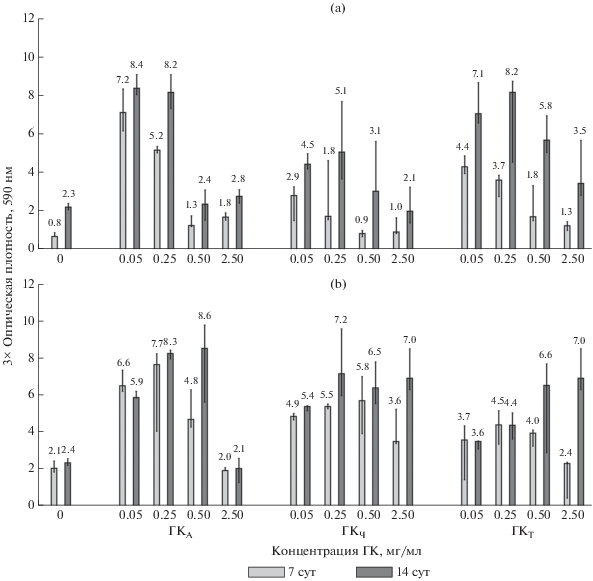
Наблюдали повышение суммарной массы биопленок, сформированных на поверхности пластин ПВД бинарным сообществом 1 спустя 7 сут инкубации при содержании ГКА 0.05–0.25 мг/мл в среде LA по сравнению с контрольным образцом (рис. 3a). Также наблюдали прирост биопленок на 14 сут для всего диапазона концентраций ГКА, но он был незначительный. При повышении концентрации до 0.5–2.5 мг/мл эффект от ГКА уменьшался, и масса биопленок практически не отличалась от таковой в контрольном образце ПВД. ГКЧ оказывали слабое влияние на рост биопленок как через 7 сут, так и через 14 сут инкубации. Эффекты от ГКА и ГКТ выравнивались на 14 сут, однако в отличие от ГКА эффект ГКТ проявлялся также в диапазоне концентраций 0.50–2.5 мг/мл.
Можно предположить, что в составе ГКА и ГКТ содержится больше доступного углерода (или других пищевых субстратов) для микроорганизмов, входящих в бинарное сообщество 1. С другой стороны, существует вероятность, что ГКТ содержат меньше токсичных для изучаемых микроорганизмов соединений фенольной природы, чем почвенные ГК [19], что также может являться причиной стимуляции формирования биопленок в присутствии ГКТ.
По результатам оценки формирования биопленок мультивидовым сообществом 2 (рис. 3b) видно, что спустя 7 сут эффект ГКА и ГКЧ при концентрациях 0.05–0.25 мг/мл выражен сильнее, чем эффект остальных ГК. Прирост тотальной биомассы биопленок на 14 сут был хорошо заметен при содержании в среде повышенной концентрации (2.5 мг/мл) ГКЧ и ГКТ. Стоит отметить, что ГКА также стимулировали обрастание пластин ПВД при концентрации 0.5 мг/мл, но при концентрации 2.5 мг/мл стимуляция отсутствовала, и результат не отличался от результата контрольного опыта.
Таким образом, ГК, выделенные из разных источников, в разной степени стимулировали процесс формирования биопленок на поверхности пластин ПВД. Так, наибольший эффект на рост биопленок наблюдали при внесении в среду LA гуминовых кислот, выделенных из акрисоли. С одной стороны, можно предположить, что ГКА являются более привычным субстратом для исследованных сообществ микроорганизмов, так как изначально эти сообщества выделены с ПВД, инкубированных в данной почве (г. Мемьо, Мьянма). С другой стороны, причина может заключаться в вариабельности состава ГК разного происхождения, обусловленной различиями в процессах гумусообразования и природными условиями, характерными для разных почв. Стимуляцию роста биопленок наблюдали для всего изученного диапазона концентраций ГК, 0.05–2.5 мг/мл. Как и в случае роста микроорганизмов на жидких средах LB и М9, оптимум находился в пределах 0.05–0.25 мг/мл. Во всех случаях наблюдали прирост биопленок на 14 сут инкубации по сравнению с 7 сут, что свидетельствует о влиянии ГК на поздние стадии созревания биопленок.
Важно отметить, что не выявлено прямой зависимости между видовым разнообразием сообщества и биомассой сформированных сообществом биопленок. Так, в присутствии 0.5 мг/мл ГКА и всех вариантов концентраций ГКЧ мультивидовое сообщество 2 сформировало большую массу биопленок на поверхности пластин ПВД. Однако при внесении ГКТ наблюдали интересную особенность – бинарное сообщество 1 продемонстрировало бóльшую способность формировать биопленки на ПВД в присутствии 0.05–0.25 мг/мл ГКТ, тогда как для мультивидового сообщества 2 лучший рост отмечали в области высоких концентраций ГКТ.
На сегодняшний день нет данных, подтверждающих наличие прямого воздействия гуминовых веществ на деструкцию и свойства ПВД, но исследования влияния ГК на адгезию микроорганизмов к различным субстратам показали, что ГК способны как увеличивать адгезию микробных клеток к поверхностям раздела, так и уменьшать ее [23, 26 ]. Можно предположить, что стимуляция роста биопленок в присутствии ГК может быть обусловлена не только обогащением среды питательными веществами, но и повышением адгезии бактерий к ПВД в результате внесения ГК.
Провели исследование архитектуры биопленок, сформированных на поверхности полиэтилена бинарным сообществом 1 и входящими в это сообщество чистыми культурами Gordonia terrae и Rhizobium radiobacter спустя 5 дней инкубации при температуре 30°С (рис. 4). Обе чистые культуры формировали хорошо структурированные биопленки, однако можно заметить повышенное количество “тяжей” матрикса между клетками в бинарной биопленке. Такая картина может быть связана с благоприятными взаимоотношениями данных микроорганизмов, приводящими к повышению синтеза компонентов матрикса и усилению его защитной роли [1].
Рис. 4.
Моновидовые биопленки, сформированные Gordonia terrae (a) и Rhizobium radiobacter (b) на поверхности ПВД. Стрелками отмечено повышенное содержание тяжей матрикса в бинарной биопленке (c). Клетки Gordonia terrae (1), образующие характерные V-формы, и Rhizobium radiobacter (2) в составе бинарной биопленки (d).

Оценка изменения поверхности полиэтилена после роста на нем биопленок. На рис. 5 представлены результаты оценки изменения структуры поверхности ПВД после удаления биопленок, сформировавшихся на пластинах ПВД спустя 7 и 14 сут инкубации в присутствии ГК на питательной среде LA.
Рис. 5.
Оценка степени деструкции пластин ПВД бинарным сообществом 1 (a) и мультивидовым сообществом 2 (b) в присутствии ГК, выделенных из акрисоли (ГКА), чернозема (ГКЧ) и торфяного удобрения (ГКТ). Контроль (0): без добавления ГК. Отрицательный контроль: не инкубируемая пластина ПВД (отмечен пунктирной линией). Время инкубации 7 и 14 сут.

На рис. 5a видно, что все ГК оказывали положительный эффект на начальную биодеградацию пластин ПВД. Так, присутствие разных ГК в пределах 0.05–0.5 мг/мл приводило к повышению шероховатости поверхности полиэтилена в 2–2.5 раза спустя 7 сут инкубации. На 14 сут инкубации максимальный эффект наблюдали на образце ПВД, инкубируемом с 0.25 мг/мл ГКА – шероховатость поверхности увеличилась в 3.5 раза по сравнению с данными для отрицательного контроля. Хотя стимулирующий эффект ГК на биокоррозию ПВД спустя 7 сут инкубации при концентрации 2.5 мг/мл отсутствовал, через 14 сут отмечали значительное изменение поверхности ПВД.
Согласно литературным данным [8, 18], представители рода Gordonia, входящие в состав бинарного сообщества 1, являются активными деструкторами высокомолекулярных полимеров (в том числе ПВД) и часто обнаруживаются в средах, загрязненных пластиком и нефтью. В частности, способность к биодеградации сложных органических веществ была обнаружена у вида Gordonia terrae, входящего в состав исследованного бинарного сообщества [9]. Известно, что представители рода Rhizobium также способны к трансформации полимеров на основе полиэтилена [13, 15]. Таким образом, повышение интенсивности начальной биодеградации ПВД при внесении ГК может быть связано не только с увеличением биомассы биопленок, но и с приспособленностью микроорганизмов к деструкции высокомолекулярных полимеров.
На рис. 5b видно, что присутствие в среде ГКА и ГКЧ в концентрации 0.25–0.5 мг/мл оказывало стимулирующий эффект на биодеградацию ПВД, и шероховатость поверхности его пластин увеличивалась более, чем в 3 раза на 14 сут инкубации по сравнению с отрицательным контролем. Однако добавление ГКТ в меньшей степени влияло на изменение поверхности полиэтилена: поверхность образцов, инкубированных с ГКТ, отличалась от поверхности контрольных образцов максимум на 30% спустя 14 сут. Также не наблюдали эффект от ГК на биодеградацию полиэтилена при концентрации ГКТ, равной 2.5 мг/мл.
Так как мультивидовое сообщество 2 включало 8 видов микроорганизмов, сложно сделать корректные выводы о вкладе конкретного вида в процесс биодеградации. С другой стороны, опираясь на исследования способности данных родов Bacillus, Microbacterium, Cellulosimicrobium и Lysinibacillus к биодеградации ПВД [12, 17, 20, 25, 32 ], можно предположить ведущую роль некоторых микроорганизмов в сообществе.
В результате работы выявлена положительная корреляция между биомассой сформированных биопленок и степенью изменения поверхности ПВД, однако связь данных показателей зависела от видового разнообразия сообщества микроорганизмов (табл. 1).
ЗАКЛЮЧЕНИЕ
Все исследованные ГК стимулировали начальную биокоррозию пластин ПВД исследованными сообществами микроорганизмов. Максимальный эффект наблюдали спустя 14 сут инкубации при концентрации ГК в диапазоне 0.05–0.25 мг/мл. При повышении концентрации ГК до 2.5 мг/мл в некоторых случаях наблюдали подавление стимулирующего эффекта и проявление ингибирующего действия ГК на процесс биодеградации полиэтилена. Положительный эффект от внесения ГК на биодеградацию полиэтилена может наблюдаться в результате стимуляции ферментативной активности микроорганизмов, также он может быть связан с повышением количества доступных питательных веществ в среде, и, следовательно, с увеличением биомассы бактерий в биопленках. Не менее важными факторами, влияющими на процесс биодеградации, являются равномерное распределение клеток на поверхности пластин ПВД и положение пластин в среде (глубина погружения в агар). Несомненно, степень биодеградации в значительной степени зависит от начальных характеристик поверхности ПВД, прямо влияющих на адгезию клеток к пластине (так, наличие трещин и иных дефектов на поверхности пластин ПВД увеличивает адгезионную способность клеток).
Список литературы
Журина М.В., Ганнесен А.В., Мартьянов С.В., Плакунов В.К. Экспресс-метод определения взаимосвязи биокоррозии полиэтилена биопленками Chromobacterium violaceum c их способностью формировать внеклеточный полимерный матрикс // Микробиология. 2020. Т. 89. № 1. С. 52–58. https://doi.org/10.31857/S0026365620010176
Орлов Д.С. Свойства и функции гуминовых веществ. Гуминовые вещества в биосфере. М.: Наука, 1993. С. 16–27.
Орлов Д.С., Гришина Л.А. Практикум по химии гумуса. М.: Изд-во Моск. ун-та, 1981. 272 с.
Плакунов В.К., Ганнесен А.В., Мартьянов С.В., Журина М.В. Биокоррозия синтетических пластмасс: механизмы деградации и способы защиты // Микробиология. 2020. Т. 89. № 6. С. 631–645. https://doi.org/10.31857/S0026365620060142
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Универсальный метод количественной характеристики роста и метаболической активности микробных биопленок в статических моделях // Микробиология. 2016. Т. 85. № 4. С. 484–489. https://doi.org/10.7868/S0026365616040157
Тихонов В.В., Якушев А.В., Завгородняя Ю.А., Бызов Б.А., Демин В.В. Действие гуминовых кислот на рост бактерий // Почвоведение. 2010. № 3. С. 333–341.
Bardají D.K.R., Moretto J.A.S., Furlan J.P.R., Stehling E.G. A mini review: current advances in polyethylene biodegradation // World J. Microbiol. Biotechnol. 2020. V. 36. P. 32. https://doi.org/10.1007/s11274-020-2808-5
Bonhomme S., Cuer A., Delort A.-M., Lemaire J., Sancelme M., Scott G. Environmental biodegradation of polyethylene // Polymer Degradation and Stability. 2003. V. 81. № 3. P. 441–452. https://doi.org/10.1016/S0141-3910(03)00129-0
Drzyzga O. The strengths and weaknesses of Gordonia: A review of an emerging genus with increasing biotechnological potential // Critical Rev. Microbiol. 2012. V. 38. № 4. P. 300–316. https://doi.org/10.3109/1040841X.2012.668134
Fashina T., Adesanwo O., Adebiyi F. Influence of humic acid on biodegradation of petroleum hydrocarbons in oil-contaminated soils // Energy Sources, Part A: Recovery, Utilization, and Environmental Effects. 2016. V. 38. № 17. P. 1–11. https://doi.org/10.1080/15567036.2015.1079571
Fedotov G.N., Shoba S.A., Fedotova M.F., Demin V.V. On the Probable Nature of Biological Activity of Humic Substances // Eurasian Soil Science. 2018. V. 51. P. 1034–1041. https://doi.org/10.1134/S1064229318090053
Floreza J.M.R., Bassia A., Thompson M.R. Microbial degradation and deterioration of polyethylene – A review // Int. Biodeterioration Biodegradation. 2014. V. 88. P. 83–90. https://doi.org/10.1016/j.ibiod.2013.12.014
Gautam N., Kaur I. Soil burial biodegradation studies of starch grafted polyethylene and identification of Rhizobium meliloti therefrom // J. Environ. Chem. Ecotoxico. 2013. V. 5. № 6. P. 147–158. https://doi.org/10.5897/JECE09.022
Gong J., Kong T., Li Y., Li Q., Li Z., Zhang J. Biodegradation of Microplastic Derived from Poly (ethylene terephthalate) with Bacterial Whole-Cell Biocatalysts // Polymers. 2018. V. 10. № 12. P. 1326. https://doi.org/10.3390/polym10121326
Hiraga K., Taniguchi I., Yoshida S., Kimura Y., Oda K. Biodegradation of waste PET // EMBO Reports. 2019. V. 20. № 11. https://doi.org/10.15252/embr.201949365
Jeon H.J., Kim M.N. Degradation of linear low-density polyethylene (LLDPE) exposed to UV-irradiation // Eur. Polym. J. 2014. V. 52. P. 146–153. https://doi.org/10.1016/j.eurpolymj.2014.01.007
Jeon J.-M., Park S.-J., Choi T.-R., Park J.-H., Yang Y.-H., Yoon J.-J. Biodegradation of polyethylene and polypropylene by Lysinibacillus species JJY0216 isolated from soil grove // Polymer Degradation and Stability. 2021. V. 191. https://doi.org/10.1016/j.polymdegradstab.2021.109662
Jin C.E., Kim M.N. Change of bacterial community in oil-polluted soil after enrichment cultivation with low-molecular-weight polyethylene // Int. Biodeterioration Biodegradation. 2017. V. 118. P. 27–33. https://doi.org/10.1016/j.ibiod.2017.01.020
Klavins M., Purmalis O. Properties and structure of raised bog peat humic acids // J. Molecular Structure. 2013. V. 1050. P. 103–113. https://doi.org/10.1016/j.molstruc.2013.07.021
Kumar S., Raut S. Microbial degradation of low-density polyethylene (LDPE): A review // J. Environ. Chem. Engineer. 2015. V. 3. № 1. P. 462–473. https://doi.org/10.1016/j.jece.2015.01.003
Lipczynska-Kochany E. Humic substances, their microbial interactions and effects on biological transformations of organic pollutants in water and soil: A review // Chemosphere. 2018. V. 202. P. 420–437. https://doi.org/10.1016/j.chemosphere.2018.03.104
Lipczynska-Kochany E., Kochany J. Effect of humic substances on the Fenton treatment of wastewater at acidic and neutral pH // Chemosphere. 2008. V. 73. P. 745–750. https://doi.org/10.1016/j.chemosphere.2008.06.028
Nardi S., Schiavon M., Francioso O. Chemical Structure and Biological Activity of Humic Substances Define Their Role as Plant Growth Promoters // Molecules. 2021. V. 26. P. 2256. https://doi.org/10.3390/molecules26082256
Nikolaev Y.A., Demkina E.V., Borzenkov I.A., Ivanova A.E., Kanapatsky T.A., Konstantinov A.I., Volikov A.B., Perminova I.V., El-Registan G.I. Role of the Structure of Humic Substances in Increasing Bacterial Survival // Open Access J. Microbiol. Biotechnol. 2020. V. 5 I. 4. https://doi.org/10.23880/oajmb-16000174
Nkem B.M., Halimoon N., Yusoff F.M., Johari W.L. W., Zakaria M.P., Medipally S.R., Kannan N. Isolation, identification and diesel-oil biodegradation capacities of indigenous hydrocarbon-degrading strains of Cellulosimicrobium cellulans and Acinetobacter baumannii from tarball at Terengganu beach, Malaysia // Marine Poll. Bull. 2016. V. 107 I. 1. P. 261–268. https://doi.org/10.1016/j.marpolbul.2016.03.060
Parent M.E. From bacterial adhesion to biofilm formation: impact of humic acid and quorum sensing: Dissertation for the Degree of Doctor of Philosophy. The Pennsylvania State University, Pennsylvania, 2006.
Plastics – the Facts 2020. An analysis of European plastics production, demand and waste data / Plastic Europe, Association of Plastics Monufactures – 2020.
Pukalchik M., Kydralieva K., Yakimenko O., Fedoseeva E., Terekhova V. Outlining the Potential Role of Humic Products in Modifying Biological Properties of the Soil–A Review // Frontiers Environ. Sci. 2019. V. 7. P. 80. https://doi.org/10.3389/fenvs.2019.00080
Ren L., Men L., Zhang Z., Guan F., Tian J., Wang B., Wang J., Zhang Y., Zhang W. Biodegradation of Polyethylene by Enterobacter sp. D1 from the Guts of Wax Moth Galleria mellonella // Int. J. Environ. Res. Public. Health. 2019. V. 11. P. 1941. https://doi.org/10.3390/ijerph16111941
Ritchie J., Perdue M. Analytical constraints on acidic functional groups in humic substances // Org. Geochem. 2008. V. 39. № 6. P. 783–799. https://doi.org/10.1016/j.orggeochem.2008.03.003
Xiangqing J., Chuan Q., Tobias F., Zhibin G., Zheng H. Efficient and selective degradation of polyethylenes into liquid fuels and waxes under mild conditions // Sci. Adv. 2016. V. 2. № 6. https://doi.org/10.1126/sciadv.1501591
Zhineng H., Wenli C., Xingmin R., Peng C., Wenfeng T., Qiaoyun H. Effects of humic acid on adhesion of Bacillus subtilis to phyllosilicates and goethite // Chemical Geology. 2015. V. 416. P. 19–27. https://doi.org/10.1016/j.chemgeo.2015.10.017
Дополнительные материалы отсутствуют.


