Почвоведение, 2022, № 4, стр. 454-468
Влияние лесных пожаров на микробиологические свойства торфяных олиготрофных почв и торфяно-подзолов глеевых в болотах северной части Сым-Дубчесского междуречья (Красноярский край)
И. Д. Гродницкая a, *, Л. В. Карпенко a, О. Э. Пашкеева a, Н. Н. Гончарова b, В. В. Старцев b, О. А. Батурина c, А. А. Дымов b
a Институт леса им. В.Н. Сукачева ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок, 50/28, Россия
b Институт биологии ФИЦ Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
c Институт химической биологии и фундаментальной медицины СО РАН, Центр коллективного пользования “Геномика” СО РАН
630090 Новосибирск, пр-т Акад. Лаврентьева, 8, Россия
* E-mail: igrod@ksc.krasn.ru
Поступила в редакцию 20.09.2021
После доработки 30.11.2021
Принята к публикации 01.12.2021
- EDN: BRDIWU
- DOI: 10.31857/S0032180X22040098
Аннотация
Исследовали два участка (FHS1 и FHS2) торфяных олиготрофных почв (Fibric Histosols) и два участка (PZ1 и PZ2) торфяно-подзолов (Histic Podzols) болот, расположенных в окрестностях базы Среднеенисейского стационара Института леса СО РАН. Показано, что пожары оказывали влияние на первоначальное заболачивание исследованных территорий. Отмечено, что пирогенные горизонты торфяных почв в целом были обогащены зольными элементами, но отличались между собой по содержанию С и N. Функциональная активность микробных сообществ исследованных почв низкая, что сказывается на содержании микробной биомассы и интенсивности дыхания. В пирогенных горизонтах из-за недостатка доступных органических веществ восстановление микробной активности происходит медленно. Таксономическая структура сообществ прокариот и грибов различалась между собой по участкам и горизонтам. Развитие бактерий и грибов в пирогенных горизонтах тесно связано с глубиной их залегания и временем прошедших пожаров. Прокариоты Proteobacteria и Archaea играют ведущую роль в освоении пирогенных горизонтов, количество их операционных таксономических единиц значительно больше, чем в непирогенных горизонтах, где доминируют Acidobacteria. Микобиомы участков FHS1 и FHS2 меньше по количеству операционных таксономических единиц и видовому разнообразию по сравнению с PZ1 и PZ2. Грибов больше в непирогенных горизонтах, в то время как в пирогенных их количество и биоразнообразие снижено. В состав микобиомов верхних пирогенных горизонтов входят особые группы карботрофных грибов, способных развиваться на углях.
ВВЕДЕНИЕ
Пожары в бореальных лесах Сибири являются естественным экологическим фактором развития современных лесных экосистем и направленности процессов почвообразования. Как отмечалось многими авторами, в результате пожаров существенно изменяются физико-химические и биологические свойства, водно-воздушный и гидротермический режимы почв, что увеличивает поверхностный сток и часто ведет к заболачиванию территории [1, 5, 11]. Пожары изменяют количество и стабильность органического вещества, что оказывает непосредственное влияние на биологические свойства почв [17, 18, 20]. Биологическая активность почв обусловлена функционированием в них микробных сообществ и фауны, отвечающих за разложение почти всех (80–90%) органических соединений [18, 24]. Микроорганизмы играют фундаментальную роль в регуляции биогеохимических циклов в наземных экосистемах, отвечают за процессы почвообразования, определяют качество плодородия почв [4, 13, 16, 26]. Пирогенное воздействие на почву вызывает термическую деструкцию всей биоты [16–18]. Это приводит к уменьшению содержания органического вещества и изменению качества почвы, скорости минерализационных процессов, влияет на состояние почвенных микробиомов и содержание микробной биомассы. В то же время есть сведения, что после пожаров низкой интенсивности содержание органического вещества почвы увеличивается из-за накопления частично сгоревшей растительности и способствует восстановлению микробной биомассы до прежнего допожарного уровня [17, 24].
Исследованию пирогенных воздействий на компоненты лесных экосистем, в том числе почв Сибирского региона, посвящено немало работ [1, 2, 5]. Среди них недостаточно исследований по оценке влияния постпирогенных процессов на химические и микробиологические свойства торфяных почв. Особый интерес для изучения влияния пожаров на такие почвы представляют собой болота между реками Сым и Дубчес (крупных левобережных притоков Енисея), которые в отличие от западносибирских аналогов мало изучены. История возникновения этих болот, возраст, растительность и стратиграфия некоторых из них описаны ранее [7]. Исследования, связанные с влиянием пожаров на формирование болот, оценкой возраста торфов, химические свойства, биологическую активность, количественный и качественный состав бактериобиомов и микобиомов в торфяных и пирогенных горизонтах почв среднетаежной подзоны Енисейского левобережья, приводятся впервые.
Цель работы – оценка влияния лесных пожаров на химические и микробиологические свойства торфяных олиготрофных почв и торфяно-подзолов северной части Сым-Дубчесского междуречья. Для этого определяли ботанический состав торфа и степень его разложения, возраст торфов методом радиоуглеродного датирования по 14С, физико-химические свойства почв на исследованных участках болот, микробиологическую активность торфяных горизонтов, качественный состав бактериобиомов и микобиомов отдельных горизонтов торфяных почв.
ОБЪЕКТЫ И МЕТОДЫ
Объекты исследований. Территория исследований относится к Сымско-Дубчесскому среднетаежному кедрово-сосновому району и включает в себя Приенисейскую окраину Западно-Сибирской низменности в бассейнах рек Сыма и Дубчеса [3, 7]. Она расположена на второй надпойменной террасе Енисея высотой от 20 до 30 м и шириной от 15 до 20 км. Общая лесистость территории – 73%, наибольшая ее часть занята сосновыми борами зеленомошно-брусничными, зеленомошно-черничными, багульниковыми, которые наиболее сильно подвергаются природным лесным пожарам [1]. Заболоченность территории больше 35%, преобладают грядово-мочажинные комплексы и сосново-кустарничково-сфагновые фитоценозы (сосновые рямы).
Исследования проводили в 2019 г. на торфяных олиготрофных почвах и торфяно-подзолах болотных участков, расположенных в окрестностях базы Среднеенисейского стационара Института леса им. В.Н. Сукачева СО РАН (обсерватория ZOTTO, 60°43′–60°51′ N, 88°57′–89°34′ E). Объектами исследований были почвы верховых болот различной мощности: торфяные олиготрофные почвы Fibric Histosols: участки 1 (FHS1) и 3 (FHS2), и торфяно-подзолы Histic Podzols: участки 2 (PZ1) и 4 (PZ2) – сосняк кустарничково-сфагновый, пройденный пожаром в 2012 г.
На участках проводили детальные геоботанические описания и закладывали почвенные разрезы. Согласно [6], в состав торфяных почв включали верхний слой торфа, в котором расположена основная масса корней, нижележащую торфяную залежь и верхние горизонты минеральной почвы. Верхний аэрируемый слой торфа представляет собой современную стадию почвообразования, нижележащие слои – предшествующие стадии развития. Генетические горизонты торфяных почв выделяли по ботаническому составу торфа, степени его разложения и кислотности. В почвенных профилях всех участков на различной глубине обнаружены признаки пожаров (пирогенные слои). В настоящей работе приводим краткую характеристику современного растительного покрова непосредственно на участках болот и заболоченного сосняка, краткое морфологическое описание профилей заложенных разрезов.
Методы исследований. Образцы торфа для определения ботанического состава, степени разложения, радиоуглеродного возраста, физико-химических свойств и микробиологических анализов отбирали из разрезов послойно в соответствии с генетическими горизонтами из пяти точек. Интервал отбора образцов определяли визуально, по мере изменения морфологической структуры торфа (цвет, ботанический состав), но не менее чем через 20 см. Одновременно с отбором образцов визуально отмечали нахождение пирогенных прослоек и микро- и макрочастиц углей по глубине торфяной колонки. Затем образцы помещали в морозильную камеру при температуре минус 20°С и хранили до начала анализов.
Определение химических свойств почв. Кислотность торфов определяли с помощью Edge HI2002-02 pH-метра (Hanna Instruments, Румыния) с цифровым электродом (±0.01 pH) при соотношении почва: раствор (для подстилок – 1 : 25, для минеральных горизонтов – 1 : 2.5). Обменные катионы (Ca2+, Mg2+, K+, Na+) экстрагировали 1 М CH3COONH4 на механическом экстракторе (Sampletek, Mavco Industries Inc., Lawrenceburg, США) согласно методическим рекомендациям [30]. Концентрацию катионов определяли на ICP (ICP Spectro Ciros CCD, Spectro Al, Kleve, Германия). Емкость катионного обмена (cation exchange capacity – CEC) рассчитывали по [30]. Степень насыщенности основаниями (base saturation – BS) – как отношение суммы обменных катионов к CEC (%). Содержание органического углерода и азота определяли на элементном анализаторе ЕА-1110 (Carlo Erba) в ЦКП “Хроматография” Института биологии ФИЦ Коми НЦ УрО РАН. Ботанический анализ торфа, степень его разложения и классификацию торфов выполняли общепринятыми в болотоведении методами [10, 12, 32]. В анализируемых слоях торфа визуально отмечали нахождение микрочастиц углей.
Возраст торфа по 14С (14 образцов) определяли в аналитическом центре изотопных исследований ИМКЭС СО РАН жидкостно-сцинтилляционным методом с помощью cпектрометра-радиометра Quantulus (ТомЦКП СО РАН) (Томск). Калибровку радиоуглеродного возраста в календарный возраст торфов проводили с помощью программы CALIB REV-7.10. Основой периодизации голоцена послужили модели [14].
Для удобства исследований почвенных микробиомов торфяную залежь исследованных участков условно разделили на три зоны: аэробную – зону биологической активности (0–60 см), чередующихся окислительно-восстановительных условий (60–130 см) и анаэробиозиса, где доступ кислорода ограничен (150–240 см) [3].
Дыхательную активность хемоорганотрофного микробного сообщества торфяных почв исследовали методом субстрат-индуцированного дыхания (СИД), согласно методам [8, 15, 28] определяли биомассу гетеротрофных микроорганизмов (МБ), базальное дыхание (БД), микробный метаболический коэффициент (QR). Скорость продуцирования СО2 определяли на газовом хроматографе Agilent Technologies 6890 N Network GC (США). Подробно методика определения СИД и БД описана в [3]. Микробную биомассу (МБ = = Смик) почвенного образца определяли согласно [28], путем пересчета скорости СИД по формуле:
Микробный метаболический коэффициент (QR) рассчитывали по отношению БД/СИД [15]. Вклад микробного углерода (Смик, %) в общее органическое вещество рассчитывали как Смик(%) × × 100/Сорг.
Выделение общей геномной ДНК проводили с помощью набора DNeasy PowerSoil Kit (Qiagen) в соответствии с инструкциями производителя. Качество ДНК оценивали методом электрофореза в 1%-ном агарозном геле, а количество на Quibit (Life Technologies) и Nanodrop (Thermo Fisher Scientific).
Определение прокариот и грибов. Для идентификации бактерий и архей использовали регион V4 гена 16S рРНК. Ампликоны получали с помощью праймеров 519F (5'-CAGCMGCCGCGGTAATWC-3') и 806R (5'-GGACTACNVGGGTWTCTAAT-3'), содержащих адаптерные последовательности (Illumina), линкер и баркод [21, 31]. Для анализа состава грибов использовали регион ITS2, амплификацию которого проводили праймерами ITS3_KYO2 (5'-GATGAAGAACGYAGYRAA-3') и ITS4 (5'-TCC TCC GCT TAT TGA TAT GC-3'). Секвенирование вели на геномном секвенаторе MiSeq (Illumina) с использованием набора реагентов v3 (2 × 300, Illumina) в ЦКП “Геномика” (ИХБФМ СО РАН).
Полученные парные последовательности анализировали с помощью UPARSE скриптов, используя Usearch v11.0.667 [19]. Биоинформатическая обработка включала перекрывание парных ридов, фильтрацию по качеству и длине, учет одинаковых последовательностей, отбрасывание синглетонов, удаление химер и получение операционных таксономических единиц (ОТЕ) с помощью алгоритма кластеризации UPARSE.
Таксономическую принадлежность ОТЕ определяли с помощью SINTAX, используя в качестве референсов базы 16S RDP v16 [31] и ITS UNITE USEARCH/UTAX V.2018.11.18.
Для выявления зависимостей между микробиологической активностью исследуемых участков (FHS1, FHS2, PZ1 и PZ2) и химическими параметрами, ботаническим составом и степенью разложения торфов проводили дисперсионный и корреляционный анализы; коэффициенты корреляции (r) были значимы при р < 0.05 (р < 0.01). С помощью кластерного анализа определяли различия прокариотного и грибного микробиомов 4 участков торфяных почв по индексам биоразнообразия. Для подтверждения различий между химическими, микробиологическими параметрами исследуемых почв использовали метод главных компонент. При обработке полученных данных использовали программы Microsoft Excel 2003, Statistica 12, Past 3.25.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Характеристика растительности и почвенных профилей на исследованных участках болот. Участок FHS1 расположен на олиготрофной окрайке обводненного грядово-мочажинного аапа болота, залегающего в обширной депрессии на водоразделе рек Дубчеса и Хойбы (60°52′22″ N; 89°24′16″ E; высота 69 м над ур. м.). Разрез заложен на гряде. Растительность участка комплексная, олиготрофная. На кочках и грядах преобладают полидоминантные кустарничково-сфагновые и кустарничково-морошково-сфагновые фитоценозы. Древесный ярус представлен сосной обыкновенной (Pinus sylvestris L.) высотой до 6.0 м. Общая мощность торфяной залежи составляет 430 см. В данной публикации представлены результаты по верхним 200 см. В профиле почвы выделены следующие генетические горизонты: ТО1–ТO10, которые различаются по ботаническому составу и степени разложения торфа. В горизонтах ТО1–ТО7 степень разложения торфа слабая и средняя (3–5 и 15–20%), торф бурого цвета из Sphagnum fuscum. На глубине 40–60 см редко встречались угли. Торфяная залежь верхового типа, полностью сложена топяными торфами моховой и травяно-моховой групп. Согласно [9], почва отнесена к торфяной олиготрофной. По международной классификации – Fibric Histosol [32].
Участок FHS2 находится в пределах небольшого по площади (около 0.7 га) верхового сосново-кустарничково-сфагнового болота, расположенного в замкнутой бессточной котловине между лесными гривами (60°48′47.2″ N; 89°19′47.3″ E; высота 124 м над ур. м.). Микрорельеф представлен кочками и небольшими мочажинами, занимающими около 5–10%. Растительный покров мозаичный, основную площадь занимает сосново-кустарничково-сфагновый фитоценоз. Древесный ярус, образованный болотной формой сосны обыкновенной, сильно разрежен (сомкнутость 0.1). Деревья разновозрастные и разновысотные (от 1 до 8 м). Подрост представлен сосной обыкновенной и сосной кедровой (Pinus sibirica Du Tour). Состав растительности травяно-кустарничкового и мохово-лишайникового ярусов аналогичен участку FHS1. Выделены следующие горизонты: ТО1–ТО2, ТO3–ТO5, ТO6–ТO11 (пушицево-сфагновый верховой торф), Т12pyr, G – с глубины 240 см, подстилаемый влажным белесым песком, бесструктурный, с сизыми пятнами закиси железа. В основании залежи обнаружены угли – 10%. В горизонтах ТО1–ТО5 степень разложения торфа низкая и средняя (5–10 и 10–25%), в ТO6–ТO11 высокая (30–35%). Почва торфяная олиготрофная [9], по международной классификации [32] она отнесена к Fibric Histosol.
Участок PZ1 расположен на границе сосняка багульниково-сфагнового и верхового болота (60°44′53.8″ N, 89°00′18.5″ E, высота 121 м над ур. моря). Это заболоченный сосняк багульниково-сфагновый (200 × 200 м). Встречаются единичные остолопы и подсушины. Микрорельеф образован хорошо выраженными моховыми подушками из Sphagnum fuscum и мелкими западинами. Древостой представлен сосной, общая сомкнутость 0.1–0.2, высота 3–5 м, состав 10С. Травяно-кустарничковый ярус образован вересковыми кустарничками и осокой Carex globularis L., ОПП составляет 70%. Мхи представлены Sphagnum fuscum, S. capillifolium (Ehrh.) Hedw., S. angustifolium (C.E.O. Jensen ex Russow), ОПП – 100%. Разрез заложен в переходной части от болота к лесу. Вода в разрезе отмечается на глубине 20 см. В профиле почвы выделены следующие генетические горизонты: Т1, Т2–Т3, Тpyr, Eg, BHg, BCg. Горизонт T1 представлен живым очесом, степень разложения слабая – 3–8%. В почве на границе с минеральными горизонтами четко диагностируется пирогенный слой, где анатомическое строение растений-торфообразователей не идентифицируется. Почва отнесена к торфяно-подзолу глеевому иллювиально-гумусовому [9], по международной классификации [32] – к Histic Podzol.
Участок PZ2 расположен в сосняке багульниковом (60°43′10.4″ N, 89°17′47.7″ E, высота 94 м над ур. моря), который горел в 2012 г. Древостой погиб практически полностью, встречаются единичные живые деревья. Общая сомкнутость древостоя – 0.2–0.3, высота – 20.0 м, состав 10С. Травяно-кустарничковый ярус образован болотными кустарничками и осокой (Carex globularis), ОПП – 65%. Мохово-лишайниковый ярус представлен Sphagnum capillifolium и Polytrichum strictum, ОПП – 50%. Разрез заложен с захватом живой сфагновой подушки и выгоревшего мха. Мощность живого сфагнума на свежем пирогенном горизонте – до 5 см. В профиле почвы выделены следующие генетические горизонты: T1pyr, T2–T3, T4pyr, Eg, BHg, BF2g, ВСg. Пирогенный горизонт T1pyr (0–1 см) характеризуется обилием обугленных частей напочвенного покрова (угли, сажа и продукты горения). В горизонтах T2–T3 разложение торфа низкое (10%), T4pyr – полностью выгорел. Уровень почвенно-грунтовых вод на 45 см. Почва отнесена к торфяно-подзолу глеевому иллювиально-гумусово-железистому (пирогенному) [9], по [32] – Gleyic Histic Podzol.
Возраст торфов. В торфяных разрезах, заложенных на исследованных участках, на различных глубинах отобрано 14 образцов для радиоуглеродного датирования по 14С. Установлено, что на участке FHS1 (200 см) процесс торфонакопления начался в первой половине бореального периода голоцена – 2405 калиброванных лет назад (кал. л. н.), а на участке FHS2 – в первой половине атлантического периода (~7535 кал. л. н.). Органогенные горизонты торфяно-подзолов более молодые. Их возраст на участке PZ1 составляет около 1810 кал. л. н., а на PZ2 – всего 560 кал. л. н. (табл. 1).
Таблица 1.
Результаты радиоуглеродного датирования торфа
| Лабораторный номер | Вид торфа | Глубина отбора образца, см | 14С*, возраст, лет | Среднее вероятное значение** |
|---|---|---|---|---|
| FHS1 | ||||
| ИМКЭС-14С1926 | Верховой, фускум | 35–40 | 504 ± 65 | 1415 AD |
| ИМКЭС-14С1920 | Верховой, комплексный | 40–60 | 418 ± 65 | 1494 AD |
| ИМКЭС-14С1930 | Верховой, фускум | 100–120 | 1363 ± 65 | 665 AD |
| ИМКЭС-14С1923 | Переходный, пушицево-сфагновый | 140–160 | 2040 ± 80 | –61 BC |
| ИМКЭС-14С1925 | Переходный, медиум | 180–200 | 2405 ± 95 | –540 ВС |
| FHS2 | ||||
| ИМКЭС-14С1925 | Верховой, пушицево-сфагновый | 60–70 | 1430 ± 120 | 602 AD |
| ИМКЭС-14С1920 | Пушицевый, переходный | 107–108 | 2915 ± 115 | –1119 ВС |
| ИМКЭС-14С1924 | Пушицевый, переходный | 120–130 | 4125 ± 95 | –2702 ВС |
| ИМКЭС-14С1890 | Пушицевый, переходный | 160–170 | 4690 ± 130 | –3452 ВС |
| ИМКЭС-14С181 | Пушицевый, переходный | 210–220 | 8050 ± 150 | –6984 ВС |
| ИМКЭС-14С1897 | Древесно-травяной, переходный | 239–240 | 7535 ± 120 | –6388 ВС |
| PZ1 | ||||
| ИМКЭС-14С1918 | Верховой, фускум | 40–55 | 214 ± 70 | 1748 AD |
| ИМКЭС-14С1923 | Пирогенный слой | 55–65 | 1810 ± 65 | 210 AD |
| PZ2 | ||||
| ИМКЭС-14С1894 | Переходный торф | 21–22 | 560 ± 110 | 1377 AD |
Выявлено, что в атлантическом (АТ) и суббореальном (SB) периодах исследуемые ландшафты имеют схожую историю палеопожаров. В субатлантическом периоде (SA) она различна. Максимальное содержание частиц угля наблюдается на двух глубинах торфяных горизонтов, датируемых концом бореального (ВО) и АТ периодов (от 6000 до 8370 кал. л. н.), а также в SA периоде (от 2500 кал. л. н. до настоящего времени) [2]. Показано, что суббореал (SB) характеризуется существенно меньшим числом лесных пожаров по сравнению с атлантиком (АТ), в котором среднегодовая температура воздуха была выше современной на 2–3°С. В торфяных почвах всех исследованных участков болот отмечено высокое содержание макроскопических частиц угля в нижних горизонтах. Полагаем, что пожары оказывали существенное влияние на процесс заболачивания территорий в их инициальной стадии.
Физико-химические свойства торфов. В почвах всех исследованных участков наибольшую кислотность отмечали в верхних слоях (0–60 см), которая снижалась по профилю. Торфяные олиготрофные почвы (FHS1 и FHS2) характеризуются сильнокислой и кислой реакцией среды (рНводн 3.3–5.0). В органогенных горизонтах торфяно-подзолов глеевых (PZ1 и PZ2) кислотность близка к олиготрофным почвам – (рНводн 3.8–4.0), минеральные горизонты менее кислые – от 4.8–5.9 (табл. 2). Для органогенных горизонтов всех разрезов характерна низкая зольность (массовая доля золы 1.2–5.9% на сухое вещество). Зольность минеральных горизонтов почв варьирует от 66.2 до 98.3%. Содержание Сорг между разрезами различается слабо, а его величина по горизонтам колеблется от 47 до 54.5%, содержание азота (N) варьирует сильнее – от 0.56 до 3.10%. При этом в олиготрофной почве FHS2 в средней и нижней частях профиля более высокое содержание азота по сравнению с FHS1.
Таблица 2.
Физико-химические свойства исследуемых почв
| Гори-зонт | Глубина, см | рНводн | C, % | N, % | Содержание обменных оснований, смоль(экв)/кг |
BS*, % | ППП, % | Зольность, % |
||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ca2+ | Mg2+ | K+ | Na+ | сумма | ||||||||
| Торфяная олиготрофная почва (FHS1) | ||||||||||||
| ТO1 | 0–20 | 3.9 | 47.9 | 0.67 | 4.57 | 2.16 | 2.35 | 0.16 | 9.24 | 8.20 | 97.9 | 2.0 |
| TO2 | 20–40 | 3.3 | 49.3 | 0.83 | 2.90 | 2.56 | 0.25 | 0.17 | 5.88 | 5.15 | 97.4 | 2.4 |
| TO3 | 40–60 | 3.7 | 46.0 | 0.84 | 5.50 | 2.72 | 0.17 | 0.15 | 8.54 | 7.15 | 98.2 | 1.6 |
| TO4 | 60–80 | 3.7 | 45.3 | 0.67 | 5.82 | 3.16 | 0.05 | 0.14 | 9.17 | 7.27 | 98.1 | 1.8 |
| TO5 | 80–100 | 3.9 | 47.7 | 0.83 | 5.48 | 2.85 | 0.05 | 0.13 | 8.51 | 7.14 | 98.3 | 1.6 |
| TO6 | 100–120 | 4.1 | 50.0 | 0.98 | 5.11 | 2.47 | 0.04 | 0.10 | 7.72 | 7.01 | 98.3 | 1.6 |
| TO7 | 120–140 | 4.0 | 45.6 | 0.56 | 6.39 | 2.95 | 0.05 | 0.12 | 9.51 | 8.17 | 98.7 | 1.2 |
| TO8 | 140–160 | 4.1 | 47.2 | 0.78 | 5.80 | 2.55 | 0.07 | 0.12 | 8.54 | 8.72 | 98.7 | 1.2 |
| TO9 | 160–180 | 4.1 | 46.3 | 0.72 | 5.87 | 2.55 | 0.05 | 0.11 | 8.58 | 8.05 | 98.4 | 1.4 |
| TO10 | 180–200 | 4.2 | 48.0 | 0.80 | 5.83 | 2.33 | 0.06 | 0.11 | 8.33 | 7.77 | 98.6 | 1.3 |
| Торфяная олиготрофная почва (FHS2) | ||||||||||||
| ТO1 | 0–20 | 3.7 | 47.8 | 0.71 | 4.57 | 1.77 | 1.18 | 0.11 | 7.63 | 6.87 | 97.7 | 2.2 |
| TO2 | 20–40 | 4.1 | 49.8 | 1.55 | 4.18 | 1.40 | 0.31 | 0.14 | 6.03 | 6.82 | 97.9 | 1.9 |
| TO3 | 40–60 | 4.1 | 50.7 | 1.44 | 3.06 | 1.03 | 0.15 | 0.12 | 4.36 | 5.11 | 97.8 | 2.0 |
| TO4 | 60–80 | 4.3 | 51.9 | 1.41 | 2.75 | 0.93 | 0.15 | 0.12 | 3.95 | 4.66 | 97.8 | 2.0 |
| TO5 | 80–100 | 4.2 | 51.8 | 1.72 | 2.23 | 0.76 | 0.11 | 0.10 | 3.22 | 3.61 | 97.9 | 2.0 |
| TO6 | 100–120 | 4.6 | 52.5 | 2.06 | 1.61 | 0.57 | 0.12 | 0.11 | 2.41 | 3.09 | 98.5 | 1.4 |
| TO7 | 120–140 | 4.8 | 52.8 | 2.66 | 1.30 | 0.48 | 0.11 | 0.13 | 2.02 | 2.67 | 97.3 | 2.5 |
| ТO8 | 140–160 | 4.7 | 52.8 | 2.80 | 1.17 | 0.46 | 0.09 | 0.11 | 1.83 | 2.77 | 97.8 | 2.1 |
| TO9 | 160–180 | 4.9 | 52.3 | 3.10 | 1.42 | 0.57 | 0.10 | 0.12 | 2.21 | 3.71 | 98.0 | 1.9 |
| TO10 | 180–200 | 5.0 | 51.5 | 2.70 | 2.54 | 0.99 | 0.13 | 0.17 | 3.83 | 5.55 | 95.8 | 3.9 |
| TO11 | 200–230 | 5.1 | 53.5 | 2.70 | 2.33 | 0.73 | 0.09 | 0.16 | 3.31 | 5.77 | 97.6 | 2.2 |
| TO12 | 230–235 | 5.2 | 53.3 | 2.10 | 2.85 | 1.12 | 0.09 | 0.13 | 4.19 | 6.10 | 93.6 | 5.9 |
| Tpyr | 235–240 | 4.9 | 25.8 | 0.88 | 2.10 | 0.96 | 0.21 | 0.06 | 3.33 | 8.15 | 31.3 | 66.2 |
| G | 240–260 | 4.8 | 2.7 | 0.13 | 1.57 | 1.14 | 0.24 | 0.04 | 2.99 | 25.82 | 5.3 | 92.9 |
| Торфяно-подзол глеевый иллювиально-гумусовый (PZ1) | ||||||||||||
| T1 | 0–10 | 4.0 | 48.0 | 1.07 | 9.41 | 2.08 | 2.27 | 0.26 | 14.02 | 16.04 | 97.1 | 2.7 |
| 10–30 | 4.1 | 46.0 | 0.96 | 9.09 | 2.42 | 1.35 | 0.40 | 13.26 | 14.05 | 95.8 | 3.8 | |
| Т2 | 30–40 | 3.8 | 47.1 | 1.00 | 5.86 | 2.35 | 0.97 | 0.44 | 9.62 | 10.29 | 97.5 | 2.2 |
| Т3 | 40–55 | 3.9 | 46.9 | 1.10 | 5.00 | 2.16 | 0.98 | 0.32 | 8.46 | 9.48 | 96.8 | 2.9 |
| Тpyr | 55–65 | 4.6 | 36.9 | 0.71 | 0.72 | 0.16 | 0.15 | 0.02 | 1.05 | 2.27 | 26.0 | 71.4 |
| Еg | 65–75 | 5.5 | 0.35 | 0.02 | 0.02 | 0 | 0.02 | 0.01 | 0.05 | 7.20 | 0.3 | 99.7 |
| BHg | 75–90 | 5.0 | 13.8 | 0.47 | 0.13 | 0.02 | 0.06 | 0.04 | 0.25 | 1.64 | 6.8 | 91.7 |
| BCg | 90–↓ | 5.6 | 1.0 | 0.04 | 0.12 | 0 | 0.04 | 0.02 | 0.18 | 6.89 | 1.5 | 98.0 |
| Торфяно-подзол глеевый иллювиально-гумусовый (PZ2) | ||||||||||||
| T1pyr | 0–1 | 4.6 | 53.2 | 1.74 | 6.78 | 1.33 | 1.29 | 0.06 | 9.46 | 10.53 | 95.0 | 4.1 |
| T2 | 1–10 | 3.9 | 47.5 | 1.03 | 5.51 | 3.08 | 1.61 | 0.25 | 10.45 | 9.56 | 97.8 | 2.0 |
| T3 | 10–22 | 4.0 | 49.2 | 1.21 | 1.91 | 1.62 | 1.06 | 0.24 | 4.83 | 5.45 | 95.6 | 4.0 |
| T4pyr | 22–25 | 4.3 | 47.3 | 1.00 | 0.86 | 0.59 | 0.39 | 0.17 | 2.01 | 2.57 | 65.4 | 32.5 |
| E | 25–47 | 5.9 | 0.2 | <0.01 | 0.02 | 0.01 | 0 | 0 | 0.03 | 19.05 | 0.1 | 99.9 |
| BF1 | 47–60 | 5.2 | 19.0 | 0.45 | 0.12 | 0.03 | 0.02 | 0.01 | 0.18 | 1.14 | 7.2 | 90.5 |
| BF2 | 60–75 | 5.3 | 2.5 | 0.05 | 0.06 | 0.04 | 0.01 | 0.01 | 0.12 | 3.15 | 2.0 | 97.3 |
| BC | 75–100 | 5.1 | 0.5 | 0.04 | 0.08 | 0.04 | 0.05 | 0.02 | 0.19 | 10.93 | 1.2 | 98.3 |
Содержание углерода в подзолистом горизонте Е участков PZ1 и PZ2 снижается до минимума (0.35 и 0.2%) по сравнению с торфяными горизонтами. В иллювиальных горизонтах (BHF и BF) содержание Сорг существенно увеличивается (до 13.8–19.0%) по сравнению с горизонтом Е. В подстилающих горизонтах ВСg количество углерода уменьшается по сравнению с вышележащими горизонтами. Такая же закономерность наблюдается с содержанием азота. Состав почвенного поглощающего комплекса исследуемых почв достаточно стабильный. В торфяных олиготрофных почвах участков FHS1 и FHS2 преобладает Ca2+, его концентрация изменяется от 2.9 до 6.4 смоль (экв)/кг в разрезе FHS1 и 1.2–4.6 смоль (экв)/кг в разрезе FHS2. Содержание обменного магния составляет 2.2–3.2 (FHS1) и 0.5–1.8 (FHS2) смоль (экв)/кг. Содержание обменных K+ и Na+ в органогенных горизонтах (за исключением горизонтов TO) не превышает 0.3 смоль (экв)/кг.
Органогенные горизонты торфяно-подзолов (PZ1 и PZ2) характеризуются более высокими концентрациями обменного Ca: в PZ1 – 5.0–9.4, в PZ2 – 1.9–6.8 смоль (экв)/кг. Концентрации Mg2+, K+ и Na+ в целом повторяют профильные закономерности распределения обменных катионов Ca. Минеральные горизонты этих почв существенно отличаются от органогенных по концентрациям обменных катионов. Горизонты с пирогенными признаками имеют более высокое содержание обменных катионов, что в целом совпадает с ранее опубликованными данными [20, 23, 29], вероятно, это связано с поступлением оснований из золы, образующейся после пожаров. В целом пирогенные горизонты несколько отличаются по морфологическим и химическим свойствам. В органогенных горизонтах участков FHS1, PZ1, PZ2, граничащих с минеральными, наблюдается уменьшение содержания углерода, азота и обменных катионов при возрастании зольности по сравнению с FHS2. В горизонте Tpyr участка FHS2, на глубине 235–240 см содержание углерода и азота в 2 раза меньше по сравнению с вышележащим горизонтом при возрастании зольности с 5.9 до 66.2%. “Молодой” (верхний) пирогенный горизонт участка PZ2 отличается бóльшим содержанием углерода, азота и кальция по сравнению с нижележащим горизонтом. Образование пирогенного горизонта связано с пожаром семилетней давности и, вероятно, с неполным сгоранием подстилки и древесных остатков. При этом для него характерна низкая зольность, что, вероятно, связано с вымыванием зольных элементов в нижележащие горизонты.
Микробиологические характеристики торфяных почв. Ранее показано, что торфяные почвы болот среднетаежной части Приенисейской Сибири характеризуются низким содержанием микробной биомассы, которая неравномерно распределена по почвенному профилю [3]. Содержание МБ в почвах исследуемых участков не уменьшалось с глубиной, а зависело от состава торфа, степени его разложения и рН. Наибольшие значения МБ приурочены к аэробным горизонтам почвы.
Торфяные олиготрофные почвы участков FHS1 и FHS2 отличались сильнокислой реакцией среды и наименьшими значениями МБ (рис. 1). Максимальные значения МБ отмечены на глубинах 0–20 (77 и 131 мкг С/г почвы) и 120–140 см (71 и 28 мкг С/г почвы), минимальные – на глубине 100–120 см и в пирогенном горизонте участка FHS2. Доля содержания Смик в содержании Сорг составляла в среднем по профилю торфяных почв 0.005 (FHS1) и 0.009% (FHS2), наибольший вклад Смик в Сорг отмечен в аэробной зоне FHS1 – 0.006% и в анаэробной зоне FHS2 – 0.025%. Значения QR варьировали по профилю участков, наибольшие отмечены в аэробной зоне (рис. 2).
Рис. 1.
Распределение микробной биомассы (МБ) и базального дыхания (БД) по профилю почв участков FHS1, FHS2, PZ1 и PZ2 Сым-Дубчесского междуречья (п. Зотино) (приведены средние значения, n = 3).
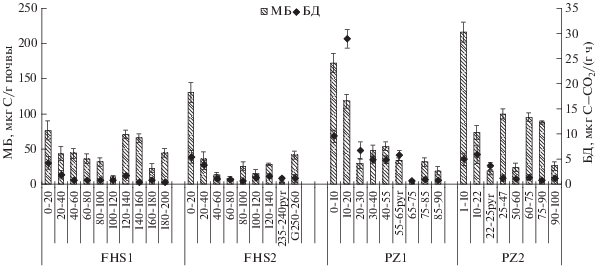
Рис. 2.
Распределение микробного метаболического коэффициента (QR) по профилю почв участков FHS1, FHS2, PZ1 и PZ2 Сым-Дубчесского междуречья (п. Зотино) (приведены средние значения, n = 3).
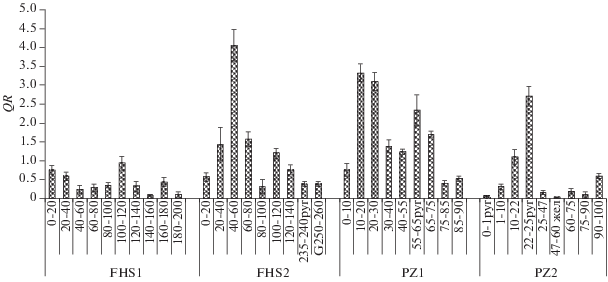
В торфяно-подзолах участков PZ1 и PZ2 органогенные горизонты характеризовались меньшей мощностью по сравнению с участками FHS. Реакция среды в верхних горизонтах среднекислая, в них не выделяется строго анаэробной зоны. Вниз по профилю кислотность снижается до слабокислой. Содержание МБ больше, чем в FHS1 и FHS2, максимальные значения МБ также приурочены к аэробной зоне. На участке PZ1 интенсивное микробное дыхание (БД) верхних горизонтов с глубиной уменьшается до 0.73 мкг С–СО2/(г ч). В горизонте Е, после Epyr, значения МБ и БД резко уменьшаются из-за недостатка органических веществ, что согласуется и коррелирует с химическими показателями: МБ и БД с Сорг (r = 0.82, 0.95) и N (r = 0.96, 0.8). Доля содержания Смик в Сорг составляла в среднем по профилю болота 0.08%. Значения QR больше в верхних слоях торфяника, чем в нижней минеральной части, где после пирогенного горизонта количество органического вещества меньше.
В торфяно-подзолах заболоченного сосняка PZ2 деструкционные процессы протекали более интенсивно, о чем свидетельствуют значения МБ и БД. В целом содержание МБ в почве участка PZ2 больше, чем в PZ1 в 1.5 раза. Максимальными значениями МБ характеризуются слои 0–10 и 47–60 см (с железом). Известно, что недавно горевший напочвенный покров первоначально заселяется особыми группами бактерий и грибов – карботрофами, способными солюбилизировать свежие угли, превращая их в коллоидные почвенные растворы, осваиваемые затем другими группами почвенных организмов [22]. В другом пирогенном горизонте (22–25pyr см) зарегистрировано наименьшее значение МБ (18 мкг С/г почвы) и высокие БД и QR, что говорит о стрессовом состоянии микробоценоза. Оставшееся органическое вещество после пожара, видимо, не способно поддерживать высокую численность различных популяций микроорганизмов, что может быть причиной сокращения их биомассы [26, 27]. Еще одним высоким значением МБ (605 мкг С/г почвы) на участке PZ2 выделяется горизонт ВНF (47–60 см), в котором выявлены сцементированные железистые конкреции железа разной величины. Здесь отмечено высокое для минеральных горизонтов содержание С (19%). Полагаем, что в этом горизонте углерод прочно связан с соединениями железа и доступен не всем микробным группам, а только хемолитотрофным и хемоорганогетеротрофным железоредуцирующим бактериям, способным окислять и откладывать вне клетки окислы железа и марганца, доступные затем другим группам микроорганизмов. В этом горизонте также низкое содержание доступного для микробов органического вещества, о чем свидетельствуют небольшие значения QR (0.03). В целом по профилю значения QR низкие, кроме отдельных горизонтов, что связано либо со стрессом (22–25pyr) микробоценоза, либо с интенсивными деструкционными процессами в них (10–22 см). Доля содержания Смик в Сорг высокая, в среднем по профилю составляет 0.54%.
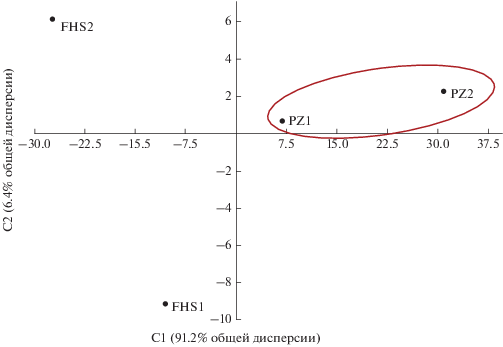
Методом главных компонент показано, что торфяные олиготрофные почвы и торфяно-подзолы исследуемых участков, расположенных в одном болотном массиве, существенно различались между собой по химическим свойствам и микробиологической активности (рис. 3). На первую компоненту приходится 91% общей дисперсии, на вторую – 6%. На плоскости главных компонент участок FHS2 находится выше других точек, FHS1 – ниже, то есть имеют большую и меньшую координаты по второй компоненте, и отличаются от почв остальных участков по второму признаку (где больший вклад несет BS), в свою очередь почвы участков PZ1/PZ2 и FHS1/FHS2 различаются между собой по первому признаку – содержанию МБ.
Рис. 3.
Положение участков FHS1, FHS2, PZ1 и PZ2 торфяных почв в плоскости двух главных компонент, полученных по основным химическим и микробиологическим характеристикам (усредненные данные по горизонтам). Каждая точка характеризуется следующими почвенными параметрами: МБ, БД, QR, рН, Сорг, степень разложения торфа, N, Са, Mg, K, Na и BS.
Таксномический состав бактерио- и микобиомов в торфяных почвах. В высокообводненных исследуемых участках создаются условия для развития аэробных (гетеротрофов), факультативно-анаэробных и анаэробных микроорганизмов, поскольку микробная активность регистрировалась в нижних (анаэробных) слоях торфяников. В этой связи важно установить качественный состав и количественное соотношение основных представителей микробных сообществ (прокариот), а также выяснить роль грибов в деструкционных процессах.
Оценка бактериального и грибного разнообразия торфяных почв. Для всех проанализированных образцов исследуемых почв были рассчитаны индексы α-разнообразия для прокариотных и грибных сообществ каждого участка. Оценка и сравнение биоразнообразия прокариот проведены на уровне типов (фил), по отдельным классам и родам. Отмечено, что микробиомы имеют большое видовое разнообразие, о чем свидетельствуют индексы таксономической структуры и относительного обилия грибных и бактериальных сообществ (Шеннона, Маргалефа, Фишера, Chao, Бергера–Паркера, Симпсона) (табл. 3).
Таблица 3.
Индексы α-разнообразия бактерий и грибов для 4 участков торфяных почв (средний индекс по группе ± стандартное отклонение)
| Индекс биоразнообразия |
Участок | |||
|---|---|---|---|---|
| FHS1 | FHS2 | PZ1 | PZ2 | |
| Bacteria | ||||
| Chao1 | 1638.6 ± 304.5 | 1273 ± 165.7 | 1439.6 ± 233.7 | 1555.1 ± 434.6 |
| Richness | 1130.5 ± 88.4 | 874 ± 137.5 | 1061.5 ± 252.4 | 1145 ± 445.6 |
| Шеннон | 4.35 ± 0.31 | 3.91 ± 0.48 | 4.62 ± 0.11 | 4.62 ± 0.46 |
| Бергер–Паркер | 0.14 ± 0.04 | 0.21 ± 0.09 | 0.11 ± 0.03 | 0.13 ± 0.05 |
| Симпсон | 0.04 ± 0.01 | 0.08 ± 0.04 | 0.03 ± 0 | 0.04 ± 0.02 |
| Менхиник | 4.54 ± 0.2 | 3.7 ± 0.2 | 5.45 ± 0.3 | 5.6 ± 0.3 |
| Маргалеф | 74.2 ± 0.8 | 52.7 ± 3.6 | 73.7 ± 8.5 | 77.9 ± 24 |
| Фишер | 144.3 ± 7.2 | 98.6 ± 7.2 | 151.4 ± 8.9 | 161.6 ± 49.4 |
| Fungi | ||||
| Chao1 | 38 ± 38.2 | 53 ± 11.5* | 43.6 ± 20.6 | 90.5 ± 26.9* |
| Richness | 38 ± 38.2 | 53 ± 11.5* | 42.5 ± 20.5 | 88.3 ± 24.8* |
| Шеннон | 2.03 ± 1.2 | 2.98 ± 0.43 | 1.43 ± 0.91 | 2.99 ± 0.73 |
| Бергер–Паркер | 0.38 ± 0.27 | 0.26 ± 0.12 | 0.6 ± 0.34 | 0.2 ± 0.11 |
| Симпсон | 0.25 ± 0.21 | 0.11 ± 0.05 | 0.45 ± 0.37 | 0.1 ± 0.07 |
| Менхиник | 0.06 ± 0.02 | 0.09 ± 0.01 | 0.07 ± 0.02 | 0.10 ± 0.02 |
| Маргалеф | 0.92 ± 0.62 | 1.56 ± 0.19 | 1.31 ± 0.46 | 1.72 ± 0.34 |
| Фишер | 1.05 ± 0.68 | 1.26 ± 0.23 | 1.46 ± 0.53 | 1.95 ± 0.41 |
Индекс Chao1, оценивающий предположительное реальное количество ОТЕ в сообществе, менялся для бактерий/архей в диапазоне от 1273 до 1638, в то время как для грибов значения индексов были на порядок меньше (от 38 до 95). Только в случае грибов наблюдалось достоверное различие (p < 0.1) по индексу Chao1 и близкому к нему индексу видового богатства (Richness) между участками PZ2 и FHS2 (PZ2 > FHS2) примерно в 2 раза. Индексы таксономического обилия (Шеннона) и структуры прокариот (Бергера–Паркера, Симпсона), характеризующие разнообразие и выравненность сообщества, были в случае прокариот >4, а для грибов <3 (Шеннона), что согласуется со значениями индексов Симпсона и Бергера–Паркера, которые больше для микобиомов по сравнению с бактериобиомами. Индексы Менхиника, Маргалефа, Фишера имеют бóльшие значения в торфяно-подзолах. В торфяных олиготрофных почвах меньшее количество видов и сильное доминирование одних видов над другими (высокий показатель доминирования). В целом разнообразие и видовое богатство бактериобиомов исследованных участков с разной мощностью торфа высокие и достоверно не различались между собой. Существенные различия между участками проявились в распределении грибов. Микобиомы участков FHS1 и FHS2 достоверно меньше по численности и видовому разнообразию по сравнению с PZ1 и PZ2.
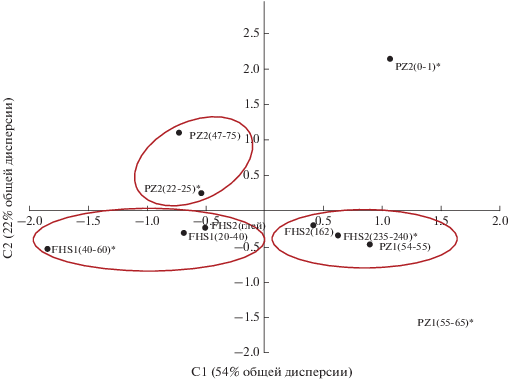
Кластерный анализ на основе индексов биоразнообразия грибного и бактериального сообществ (по горизонтам) показал следующее: на четвертом шаге в один кластер объединились участки FHS2(235–240)*–FHS2(162)–FHS1(20–40) и PZ2(22–25)–FHS2(глей)–PZ1(54–55), последним к ним присоединяется PZ2(47–75), который имеет наименьшее сходство с остальными. В отдельный кластер на втором шаге отделяются три пирогенных горизонта – FHS1(40–60), PZ1(55–65) и РZ2(0–1) (рис. 4), что свидетельствует о сильном влиянии пирогенного фактора на α-разнообразие бактерий и грибов.
Рис. 4.
Вертикальная древовидная диаграмма кластерного анализа горизонтов почв исследованных участков на основе индексов биоразнообразия грибных и бактериальных сообществ; звездочкой отмечены пирогенные горизонты.

Таксономический анализ пирогенных и непирогенных горизонтов торфяных почв четырех участков показал, что среди бактерий преобладали представители двух типов (Acidobactrtia и Proteobacteria), на долю которых приходится 60–80% общего количества. Представители домена Archaea в среднем составляли в торфяных олиготрофных почвах 3.5 и 29.5%, а в торфяно-подзолах – 3 и 8.6%. Анаэробных архей (в том числе метаногенов) обнаружено от 0.02 до 4.5%, что свидетельствует о наличии зон строгого анаэробиозиса в некоторых горизонтах (табл. 4).
Таблица 4.
Относительное содержание прокариот на уровне типов в образцах торфов исследуемых участков, усредненные данные по горизонтам, %
| Таксономическая принадлежность, Phylum | Доля OTЕ от общего числа полученных последовательностей | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| FHS1 | FHS2 | PZ1 | PZ2 | |||||||
| глубина, см | ||||||||||
| 20–40 | 40–60 (угли) | 162 | 235–240pyr | G 240–245 | 53–55 | 55–65pyr | 0–1pyr | 22–25pyr | 47–75 | |
| Всего ридов | 20 696 | 39 807 | 26 973 | 29 826 | 16 036 | 9183 | 33 334 | 28 283 | 7713 | 24 965 |
| Bacteria | ||||||||||
| Количество ридов | 20 471 | 37 511 | 15 780 | 19 161 | 15 646 | 9035 | 31 852 | 28 028 | 7381 | 19 792 |
| Acidobacteria | 59.14 | 31.73 | 25 | 8.66 | 5.93 | 51.68 | 43.16 | 17.6 | 44.06 | 38.41 |
| Proteobacteria | 19.32 | 40.57 | 13.54 | 18.44 | 57.54 | 19.87 | 24.91 | 22.88 | 16.52 | 22.46 |
| Actinobacteria | 5.22 | 4.07 | 2.44 | 0.92 | 8.84 | 7.45 | 4.44 | 30.34 | 11.36 | 2.72 |
| Verrucomicrobia | 3.61 | 4.04 | 4.05 | 4.72 | 1.01 | 3.68 | 2.7 | 4.33 | 1.80 | 2.70 |
| Planctomycetes | 1.09 | 2.82 | 0.81 | 0.40 | 0.36 | 3.93 | 2.92 | 6.58 | 5.71 | 1.34 |
| Bacterioidetes | 0.77 | 0.28 | 1.08 | 3.47 | 7.76 | 0.88 | 0.99 | 1.93 | 0.35 | 0.91 |
| Firmicutes | 0.35 | 0.17 | 0.6 | 0.34 | 12.58 | 0.11 | 0.16 | 0.23 | 0.30 | 0.74 |
| Chloroflexi | 0.19 | 0.01 | 0.76 | 4.52 | 0.39 | 0 | 0.01 | 0.06 | 0.03 | 0.46 |
| Chlamydiae | 0.42 | 0.13 | 0.007 | 0.02 | 0 | 0.54 | 0.13 | 0.31 | 0.06 | 0.01 |
| Candidate division WPS-1 | 1.46 | 0.76 | 0.15 | 0.03 | 0.16 | 1.89 | 1.08 | 0.77 | 1.80 | 0.09 |
| Candidate division WPS-2 | 0.98 | 0.24 | 0.04 | 0.02 | 0.25 | 0.33 | 0.26 | 2.34 | 1.04 | 0.05 |
| Cyanobacteria/Chloroplast | 0.12 | 0.02 | 0.06 | 0.15 | 0.44 | 0.1 | 0.009 | 1.81 | 0 | 0.03 |
| Armatimonadetes | 0.07 | 0.1 | 0.04 | 0.07 | 0 | 0.22 | 0.1 | 0.68 | 0 | 0.02 |
| Candidatus Saccharibacteria | 0.09 | 0.005 | 0 | 0.003 | 0 | 0.04 | 0.02 | 0.30 | 0.01 | 0.004 |
| Deinococcus-Thermus | 0.01 | 0.005 | 0.007 | 0 | 0.34 | 0.01 | 0.01 | 0.01 | 0 | 0.008 |
| Неклассифицированные бактерии | 5.83 | 9.26 | 9.84 | 22.48 | 1.94 | 7.63 | 14.62 | 8.90 | 12.6 | 8.96 |
| Archaea | ||||||||||
| Количество ридов | 268 | 2296 | 11 165 | 10 661 | 357 | 148 | 1482 | 255 | 332 | 5173 |
| Euryarchaeota | 0.5 | 4.56 | 2.38 | 1.43 | 0.09 | 0.12 | 0.2 | 0.09 | 0.01 | 0.02 |
| Thaumarchaeota | 0.52 | 0.37 | 33.13 | 10.42 | 1.32 | 1.32 | 3.89 | 0.3 | 3.98 | 9.1 |
| Crenarchaeota | 0.01 | 0.1 | 2.63 | 21.64 | 0.53 | 0.01 | 0.13 | 0.08 | 0.13 | 0.009 |
| Pacearchaeota | 0 | 0 | 0.36 | 0.99 | 0.006 | 0 | 0.07 | 0 | 0 | 0.18 |
| Неклассифицированные археи | 0.17 | 0.72 | 2.90 | 1.25 | 0.28 | 0.16 | 0.15 | 0.42 | 0.18 | 0.35 |
Развитие бактериобиомов и микобиомов в пирогенных горизонтах тесно связано со временем прошедших пожаров и глубиной их залегания. В пирогенных горизонтах исследуемых почв количество выделенных ОТЕ прокариот в целом превышало выше- и нижележащие горизонты: в почвах FHS1 и FHS2 в 1.2–1.9 раз, в PZ1 и PZ2 – в 3.6 и 1.2 раза. Ранее показано, что в некоторых выжженных почвах бактериальная биомасса может увеличиться до 80% от общей микробной биомассы, так как пожар увеличивает количество легкоминерализованных соединений, которые могут быстро использоваться бактериями с большими метаболическими способностями [26, 27]. В пирогенно деструктурированных горизонтах увеличивается содержание аммония и доступного фосфора, что усиливает восстановление многих гетеротрофных бактерий [25]. В этих горизонтах обнаружены в основном бактерии филумов Proteobacteria, Actinobacteria, Planctomycetes, Verrucomicrobia, Bacteroidetes. Доля Acidobacteria снижена в 1.8–2.8 (FHS1 и FHS2) и в 1.2 и 2.1 раза (PZ1 и PZ2) по сравнению с непирогенными горизонтами. Кроме того, существенный вклад в освоение пирогенных горизонтов вносили представители домена Archaea (Thaumarchaeota, Crenarchaeota и Euryarchaeota), содержание которых колебалось от 4.4 до 35.7% в зависимости от участка.
В непирогенных горизонтах доминировали ацидофильные (Acidobacteria) и споровые бактерии (Firmicutes), последних было в 2.5–3.2 раза больше, чем в пирогенных горизонтах. Доля архей колебалась от 1.3 до 41.4%. Среди них преобладали представители филы Thaumarchaeota (род Nitrososphaera), участвующие в аэробном окислении аммиака до нитрита. Отмечалось, что Nitrososphaera обладает ферментом монооксигеназой аммиака, обеспечивающим способность окислять аммиак или мочевину и, возможно, цианат [25].
Присутствие грибов (микро- и макромицетов) отмечено по всему профилю торфяных почв, даже на глубине 240–260 см (в глее). Среди грибов преобладали представители типов Ascomycota и Basidiomycota (табл. 5).
Таблица 5.
Относительное содержание грибов (FUNGI) на уровне типов в образцах торфов исследуемых участков, усредненные данные по горизонтам, %
| Таксономическая принадлежность, Phylum | Доля OTЕ от общего числа полученных последоватyельностей | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| FHS1 | FHS2 | PZ1 | PZ2 | |||||||
| глубина, см | ||||||||||
| 20–40 | 40–60 (угли) | 162 | 235–240pyr | G 240–245 | 53–55 | 55–65pyr | 0–1pyr | 22–25pyr | 47–75 | |
| Количество ридов | 33 206 | 27 433 | 49 329 | 49 002 | 35 11 | 46 121 | 44 345 | 50 186 | 23 617 | 31 702 |
| Ascomycota | 54.22 | 3.23 | 75.91 | 80.34 | 57.99 | 92.63 | 95.97 | 94.34 | 76.76 | 49.79 |
| Basidiomycota | 29.9 | 1.33 | 16.04 | 8.21 | 32.42 | 2.62 | 1.28 | 4.8 | 3.18 | 22.88 |
| Mucoromycota | 2.23 | 56.96 | 0 | 0.28 | 1.16 | 2.53 | 0.14 | 0.7 | 15.21 | 1.46 |
| Неклассифицированные грибы | 13.66 | 38.48 | 8.04 | 11.17 | 8.44 | 2.22 | 3.02 | 0.16 | 4.85 | 25.88 |
Структура грибных сообществ пирогенных горизонтов отличалась от таковой выше- и нижележащих не пирогенных. Количество ОТЕ грибов в них снижено в среднем в 1.2–1.5 раза, что согласуется с данными других авторов, утверждающих, что грибы более восприимчивы к пожарам, чем бактерии [26, 27]. В пирогенных горизонтах увеличивается доля представителей Ascomycota и Mucoromycota, существенно снижается Basidiomycota. Участки торфяных олиготрофных почв отличались между собой по качественному составу грибов и по числу выявленных родов. На участке FНS1 в горизонте 40–60pyr доминировали мукоровые грибы (Mucoromycota), содержание которых достигало 57% (unc_Mortierella и Mucor), а также грибы порядков Ascomycota и GS22 (до 39%). На участке FHS2 в горизонте 235–240pyr доминировали дрожжи (Lipomyces, 43%, Metschnikowia, 31%, Barnettozyma, 7%) и рода Piloderma (15%). В почве PZ1 доминировали базидиомицеты родов Lactaris (39%) и Curvibasidium (15%), аскомицеты Chromelosporium (31%). В PZ2 (0–1pyr и 22–25pyr) доминировали дрожжи родов Sporobolomyces (69%), Cryptococcus (2–3%) и мукоровые грибы родов Umbelopsis (7–69%) и Mortierella (16%). Кроме того, в пирогенном горизонте (0–1 см) участка PZ2 отмечено большое количество карботрофов, среди которых выявлены аскомицеты-карботрофы из классов Dothideomycetes, Eurotiomycetes, Sordariomycetes. Субстрат, на котором развиваются эти грибы, представляет собой смесь минеральных частиц почвы и угля, образовавшегося после сгорания древесины, содержит чистый углерод с примесью полимерных углеводов, что делает его богатой питательной средой для развития карботрофов, занимающих экологическую нишу недоступную большинству других грибов и растений. Уголь как сорбент может поглощать питательные органические и минеральные вещества из почвы [22].
Рис. 5.
Положение разных горизонтов исследованных почв в плоскости двух главных компонент, полученных на основе данных: МБ и фил бактерий и грибов.
В непирогенных горизонтах разнообразие грибов различалось по участкам. На FHS1 и FHS2 выявлено в среднем около 11 родов (Jaapia, Inocube, Cryptococcus, Debaryomyces, Rhodotorula, Metschnikowia, Malassezia, Suillus и др.). Особенно интересен глеевый (G) горизонт на участке FHS2, где на глубине 240–250 см было выделено большее количество ОТЕ грибов (12 родов), чем в вышележащих горизонтах.
В непирогенных горизонтах участка PZ1 доминировали базидиомицеты родов Jaapia (14%), Clavaria (62%), Cortinarius (2%), Boletus (1.7%) и мукоровые родов Mortierella (12%) и Umbelopsis (1.4%). Представителей родов Cryptococcus (1.4%), Metschnikowia (1%), Malassezia (1%) было значительно меньше, чем в пирогенных горизонтах. На участке PZ2 в горизонте 47–75 см качественный состав грибов представлен большим числом родов (18), из них доминировали Metschnikowia (29%), Jaapia (23%), Rhodotorula (14%), Cryptococcus (9%), Inocube (6%), Debaryomyces (4%) и др.
ЗАКЛЮЧЕНИЕ
Исследования торфяных олиготорофных почв и торфяно-подзолов показали, что пожары оказали существенное влияние на их развитие. Отмечено, что пирогенные горизонты торфяных почв отличаются от вмещающей их торфяной залежи, проявляющиеся в ряде химических свойств. Данные горизонты отличаются по содержанию углерода и азота, обогащены зольными элементами. Это сказывается на развитии и активности микробных сообществ. Содержание микробной биомассы и интенсивность дыхания в торфяных почвах исследуемых участков низкие, особенно в пирогенных горизонтах; из-за недостатка органического вещества восстановление микробной активности происходит медленно.
Качественный и количественный составы бактериобиомов и микобиомов торфяных почв различались между собой как по участкам, так и по горизонтам (пирогенным и непирогенным). Разнообразие и видовое богатство прокариот торфяно-подзолов и торфяных олиготрофных почв достаточно высоки, что нельзя сказать о разнообразии грибов. В целом в торфяных олиготрофных почвах отмечено меньшее обилие видов и высокий показатель доминирования одних видов над другими по сравнению с торфяно-подзолами. Микобиомы участков FHS1 и FHS2 достоверно меньше по численности и видовому разнообразию по сравнению с PZ1 и PZ2. Развитие бактерий и грибов в пирогенных горизонтах тесно связано со временем прошедших пожаров и глубиной их залегания. Таксономическая структура сообществ бактерий в пирогенных горизонтах отличается от таковой непирогенных. Существенный вклад в освоение пирогенных горизонтов торфяных олиготрофных почв вносят представители Proteobacteria, Euryarchaeota и Thaumarchaeota, торфяно-подзолов – Proteobacteria, Microgenomates, Actinobacteria и Thaumarchaeota. Грибы развиваются лучше в непирогенных горизонтах, в то время как в пирогенных их количество и биоразнообразие снижено. В состав микобиомов верхнего пирогенного слоя PZ2 входят особые группы карботрофных грибов, способные развиваться на углях, солюбилизировать их для освоения других групп организмов.
Список литературы
Воздействие пожаров на компоненты экосистемы среднетаежных сосняков Сибири. Новосибирск: Наука. Сиб. отд-ние, 2014. 232 с.
Горбач Н.М., Старцев В.В., Прокушкин А.С., Дымов А.А. Динамика пожаров в средней тайге Красноярского края в голоцене // Мат-лы молодежной конф. “Актуальные проблемы экологии и биологии”. Сыктывкар, 2021. С. 72–74.
Гродницкая И.Д., Карпенко Л.В., Сырцов С.Н., Прокушкин А.С. Микробиологические особенности и стратиграфия торфов двух типов болот северной части Сым-Дубчесского междуречья (Красноярский край) // Известия РАН. Сер. биологическая. 2018. № 2. С. 179–190.
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А., Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1096.
Ефремова Т.Т., Пименов А.В., Ефремов С.П., Аврова А.Ф. Влияние лесоторфяных пожаров на почвы и потери углерода в фитогенных микроповышениях горных болот юга Средней Сибири // Сибирский экологический журн. 2021. № 3. С. 351–363.
Инишева Л.И. Торфяные почвы: их генезис и классификация // Почвоведение. 2006. № 7. С. 781–786.
Карпенко Л.В., Прокушкин А.С. Реконструкция пожаров в девственных лесах средней тайги Приенисейской Сибири в голоцене // Сибирский лесной журн. 2019. № 5. С. 61–69.
Методы почвенной микробиологии и биохимии / Под ред. Д.Г. Звягинцева М.: Изд-во Моск. ун-та, 1991. 303 с.
Полевой определитель почв России. М., 2008. 182 с.
Пьявченко Н.И. Степень разложения торфа и методы ее определения. Красноярск, 1963. 55 с.
Сирин А.А., Макаров Д.А., Гуммерт И., Маслов А.А., Гульбе Я.И. Глубина прогорания торфа и потери углерода при лесном подземном пожаре // Лесоведение. 2019. № 5. С. 410–422.
Хотинский Н.А. Дискуссионные проблемы реконструкции и корреляции палеоклиматов голоцена // Палеоклиматы позднеледниковья и голоцена. М.: Наука, 1989. С. 12–17.
Чернов Т.И., Семенов М.В. Управление почвенными микробными сообществами: возможности и перспективы (обзор) // Почвоведение. 2021. № 12. С. 1506–1522. https://doi.org/10.31857/S0032180X21120029
Чичагова О.А. Радиоуглеродное датирование гумуса почв. Метод и его применение в почвоведении и палеогеографии. М.: Наука, 1985. 158 с.
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. № 3. P. 314–322.
Barreiro A., Díaz-Raviña M. Fire impacts on soil microorganisms: Mass, activity, and diversity // Current Opinion in Environmental Science & Health. 2021. V. 22. P. 100264. https://doi.org/10.1016/j.coesh.2021.100264
Certini G. Effects of fire on properties of forest soils: a review // Oecologia. 2005. V. 143. P. 1–10.https://doi.org/10.1007/s00442-004-188-8
Certini G., Moya D., Lucas-Borja M.E., Mastrolonardo G. The impact of fire on soil-dwelling biota: A review // Forest Ecology and Management. 2021. V. 488. P. 118989. https://doi.org/10.1016/j.foreco.2021.118989
Edgar R.C. UPARSE: highly accurate OTU sequences from microbial amplicon reads // Nat Methods. 2013. № 10. P. 996–998. https://doi.org/10.1038/nmeth.2604
Dymov A.A., Startsev V.V., Milanovsky E.Yu., Valdes-Korovkin I.A., Farkhodov Yu.R., Yudina A.V., Donnerhack O., Guggenberger G. Soils and soil organic matter transformations during the two years after a low-intensity surface fire (Subpolar Ural, Russia) // Geoderma. 2021. V. 404. P. 1–10. https://doi.org/10.1016/j.geoderma.2021.115278
Fadrosh D.W., Ma B., Gajer P., Sengamalay N., Ott S., Brotman R.M., Ravel J. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform // Microbiome. 2014. V. 2. P. 6. https://doi.org/10.1186/2049-2618-2-6
Ghani M.J., Rajoka M.I., Kalsoon Akhtar. Investigations in fungal solubilization of coal: mechanisms and significance // Biotchnology and Bioprocess Engineering. 2015. V. 20. P. 634–642.https://doi.org/10.1007/s12257-015-0162-5
Klopatek J.M., Klopatek C.C., DeBano L.F. Fire effects on nutrient pools of woodland floor materials and soils in a pinyon-juniper ecosystem // Fire and Environ. 1991. V. 69. P. 154–160.
Knicker H. How does fire affect the nature and stability of soil organic nitrogen and carbon? A review // Biogeochemistry. 2007. V. 85 P. 91–118. https://doi.org/10.1007/s10533-007-9104-4
Könneke M., Schubert D.M., Brown P.C., Hügler M., Standfest S. et al. Ammonia-oxidizing archaea use the most energy-efficient aerobic pathway for CO2 fixation // Proc Natl Acad Sci (USA) early edition, 2014. https://doi.org/10.1186/s12915-016-0274-1
Mataix-Solera J., Guerrero C., García-Orenes F., Bárcenas G.M., Torres M.P. Forest fire effects on soil microbiology // Fire Effects on Soils and Restoration Strategies. Cerdà Science Publishers: Enfield, 2009. P. 133–175.
Pietikäinen J., Hiukka R., Fritze H. Does short-term heating of forest humus change its properties as a substrate for microbes? // Soil Biol. Biochem. 2000. V. 32. P. 277–288. https://doi.org/10.1016/S0038-0717(99)00164-9
Sparling G.T. The substrate-induced respiration method // Methods in applied soil microbiology and biochemistry. London: Acad. Press, 1995. P. 397–404.
Ulery A.L., Graham R.C., Goforth B.R., Hubbert K.R. Fire effects on cation exchange capacity of California forest and woodland soils // Geoderma. 2016. V. 286. P. 125–130. https://doi.org/10.1016/j.geoderma.2016.10.028
Van Reeuwijk L.P. (Ed.) Procedures for soil analysis. Technical Paper 9. ISRIC, Wageningen, 2002.
Wang Q., Garrity G.M., Tiedje J.M., Cole J.R. Naïve Bayesian Classifier for Rapid Assignment of rRNA Sequences into the New Bacterial Taxonomy // Appl. Environ. Microbiol. 2007. V. 73(16). P. 5261–5267. https://doi.org/10.1128/AEM.00062-0
World Reference Base for Soil Resources 2014, International Soil Classification System for Naming Soils and Creating Legends for Soil Maps, World Soil Res. Rep. no. 106, update 2015. FAO, Rome. www.fao.org
Дополнительные материалы отсутствуют.


