Почвоведение, 2022, № 5, стр. 615-630
Оценка современных рисков избыточного накопления тяжелых металлов в почвах на основе концепции критических нагрузок (обзор)
С. В. Копцик a, *, Г. Н. Копцик b
a Физический факультет МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, Россия
b Факультет почвоведения МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, Россия
* E-mail: koptsik@phys.msu.ru
Поступила в редакцию 27.12.2021
После доработки 30.12.2021
Принята к публикации 30.12.2021
- EDN: SNJYDE
- DOI: 10.31857/S0032180X22050033
Аннотация
На международном уровне для оценки рисков избыточного поступления загрязняющих веществ в экосистемы активно используется концепция критических нагрузок, разработанная в рамках Конвенции о трансграничном загрязнении воздуха на большие расстояния под эгидой Европейской экономической комиссии ООН. В обзоре рассмотрены основные принципы концепции критических нагрузок и методы ее применения для оценки текущих рисков избыточного накопления тяжелых металлов (ТМ) в почвах как компонентах наземных экосистем с точки зрения экотоксикологического воздействия (на растения, почвенные беспозвоночные и микроорганизмы). В рамках концепции критические концентрации Cd, Pb, Cu и Zn для почв впервые оцениваются с помощью функций критических концентраций, учитывающих свойства почв (прежде всего, кислотность, содержание органического вещества и илистой фракции). Основное внимание уделено обоснованию и развитию моделей оценки критических концентраций и функций преобразования, связывающих концентрации соединений ТМ в почвах и почвенных растворах. Современные экологические риски избыточного накопления ТМ оцениваются путем сравнения с их критическими концентрациями. Текущие проблемы и дальнейшие перспективы анализа современных экологических рисков на основе концепции критических нагрузок включают снижение неопределенности оценок, совместное воздействие разных металлов при многокомпонентном загрязнении, полевую проверку процессов и результатов моделирования, влияние изменений климата и землепользования.
ВВЕДЕНИЕ
В последние десятилетия растущее загрязнение окружающей среды тяжелыми металлами (ТМ) в результате интенсивной индустриализации, урбанизации и агропроизводства сопровождается их накоплением в почвах и токсичным воздействием на растения, почвенную биоту и, в конечном итоге, на человека [43, 50, 102]. Широкое распространение подверженных негативному антропогенному воздействию земель в Европе [76, 101] и в мире [43] свидетельствует о глобальном характере загрязнения. Экологическая опасность загрязнения почв ТМ особенно велика для территорий, прилегающих к большим индустриальным комплексам [3, 6, 42, 60], мегаполисам [26] и/или подверженных длительной сельскохозяйственной обработке [52, 53], где поступление ТМ из антропогенных источников намного превышает природное.
Антропогенное загрязнение почв относится к числу приоритетных экологических проблем, разрешение которых требует фундаментальных знаний и научно-обоснованных методологических подходов. При взаимодействии биосферы с загрязняющими веществами почвам принадлежит особая роль, поскольку их буферные свойства определяют не только степень изменения самих почв под влиянием антропогенной нагрузки, но и количество поллютантов, поступающее в другие компоненты экосистем – живые организмы, грунтовые и поверхностные воды, почвообразующие породы и, потенциально, в океаны [50]. Аккумуляция поллютантов в почвах сопровождается долговременным негативным воздействием на экосистемы. Проблема зачастую усугубляется неблагоприятным сочетанием природных и антропогенных факторов, приводящим к превышению токсичных для биоты уровней загрязняющих веществ. Возникает необходимость количественного анализа, оценки и прогноза пределов трансформации и устойчивости почв по отношению к поллютантам, рисков их избыточного накопления в почвах с учетом совокупности воздействия многих факторов с целью регулирования негативного воздействия на экосистемы, установления приоритетов и эффективности ремедиации загрязненных почв.
Цель работы – проанализировать возможности, достоинства и ограничения концепции критических нагрузок для оценки современных рисков избыточного накопления ТМ в почвах как компонентах наземных экосистем на настоящем этапе развития.
КОНЦЕПЦИЯ КРИТИЧЕСКИХ НАГРУЗОК
На международном уровне идеи постепенного внедрения современных естественно-научных подходов в экологическое нормирование нашла реальное воплощение в разработке и развитии концепции критических нагрузок в рамках Конвенции о трансграничном загрязнении воздуха на большие расстояния (CLRTAP) под эгидой Европейской экономической комиссии ООН.
Критическая нагрузка – это наибольшая скорость поступления загрязняющих веществ (с выпадениями, удобрениями и из других источников), меньше которой не будет происходить вредное воздействие на здоровье человека, а также на структуру и функции экосистемы на интересующем участке в долгосрочной перспективе, согласно имеющимся данным [54]. Расчет критических нагрузок ТМ основан на балансе всех существенных входящих и исходящих потоков металлов для рассматриваемой экосистемы в состоянии установившегося равновесия [27]. Потенциальные риски или превышения критических нагрузок при различных сценариях выбросов загрязняющих веществ могут быть использованы для разработки стратегий сокращения выбросов, которые уравновешивают экологические риски и экономические затраты [54].
Первоначально концепция была разработана и с середины 1980-х гг. широко используется для оценки критических нагрузок кислотообразующих загрязняющих веществ (S и N), сравнения с современной атмосферной нагрузкой и выработки стратегии сокращения выбросов поллютантов в атмосферу [27, 29, 70, 95]. Первые подходы к оценке критических нагрузок ТМ для наземных [31] и водных [32] экосистем были предложены в 1990-е гг. Современное методическое руководство, разработанное в рамках СLRTAP, было принято для “приоритетных металлов” Cd, Pb и Hg [27, 38, 104]. Основное внимание этим металлам связано с их включением в Протокол по тяжелым металлам 1998 г. к СLRTAP, который был ратифицирован 29-ю странами и вступил в силу в конце 2003 г. Внимание фокусируется не только на экотоксикологических рисках для наземных экосистем, где атмосферные выпадения металлов являются преобладающим внешним источником, но и на токсикологических рисках для человека, включая агросистемы. В агросистемах под нагрузкой понимается внесение удобрений, навоза (иногда осадка сточных вод) и атмосферных выпадений. В настоящее время перечень металлов и металлоидов расширен до Cd, Pb, Cu, Ni, Zn, Cr, Hg, As, Se [62, 82]. Разработка и согласование методов расчета, создание единой базы данных и карт критических нагрузок и их превышений проводятся Координационным центром по воздействиям (Coordination Centre for Effects (CCE): https://www.umweltbundesamt.de/en/Coordination_Centre_for_Effects) и международной программой сотрудничества по моделированию и картографированию (International Cooperative Programme on Modelling and Mapping of Critical Levels and Loads and Air Pollution Effects, Risks and Trends (ICP M&M): https://unece.org/modelling-and-mapping).
Развитие и применение этих научно-обоснованных подходов позволили оценить долговременное допустимое поступление ТМ в наземные экосистемы Европы [34–37, 51, 81, 90, 92] и Канады [40, 67]. В нашей стране регулярную оценку трансграничного переноса и выпадений ТМ выполняет Метеорологический Синтезирующий Центр-Восток (МСЦ-В) (http://www.msceast.org). Однако критические нагрузки для наземных экосистем были оценены лишь в единичных случаях для кислотных выпадений [1, 4, 7, 12, 19, 58] и еще реже – для ТМ [5, 51], и никак не отразились в реальной практике нормирования.
ОЦЕНКА СОВРЕМЕННЫХ РИСКОВ ИЗБЫТОЧНОГО НАКОПЛЕНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В ПОЧВАХ
Рассмотренный выше подход к анализу рисков путем сравнения с критическими нагрузками, отражающими допустимые скорости поступления загрязняющих веществ в наземные экосистемы, предназначен для превентивной оценки рисков, связанных с будущими поступлениями поллютантов. Однако он не позволяет проводить оценку современных рисков избыточного содержания ТМ в почвах в результате накопленного загрязнения [62]. Эта задача решается путем сравнения с пороговыми значениями (критическими концентрациями или стандартами качества окружающей среды). Критическими считаются такие концентрации ТМ в почвах и/или почвенных растворах, которые не оказывают заметное неблагоприятное воздействие на растения и почвенную биоту [35, 37]. Критическое (пороговое) воздействие соответствует договорному значению вероятности наблюдения негативных биологических эффектов или, другими словами, условно допустимому риску.
Ключевые этапы оценки современных рисков избыточного накопления ТМ включают: 1) выбор реципиентов; 2) определение критических концентраций ТМ для растений, микроорганизмов и беспозвоночных в почвах; 3) нахождение функций преобразования, описывающих связи различных форм ТМ в твердой и жидкой фазах почв в зависимости от их свойств [35, 37].
Выбор реципиентов. Озабоченность по поводу поступления металлов в наземные экосистемы связана с: 1 – экотоксикологическим воздействием на почвенные организмы и растения и на водные организмы из-за стока в поверхностные воды; 2 – поглощением животными через пищевые цепи, что может иметь последствия для здоровья животных и человека [35, 37]. Воздействие на почвенные организмы, включая микроорганизмы и беспозвоночные, такие как нематоды и дождевые черви, приводит к уменьшению видового разнообразия, численности и биомассы [20]. Воздействие на сосудистые растения проявляется в токсических (замедление развития и роста корней и побегов), физиологических (повышение концентрации крахмала и общего сахара, снижение содержания питательных веществ в листовых тканях) и биохимических (снижение активности ферментов) [17, 18, 23, 80] симптомах. Воздействие на гидробионты, включая водоросли, ракообразных и рыб, включает воздействие на функцию дыхания, нервную систему, а также скорость роста и воспроизводства. Основанные на этих воздействиях стандарты качества окружающей среды или критические пределы для металлов в почвах и поверхностных водах используются в процессе оценки экологических рисков [35].
Помимо прямого воздействия на почвенные организмы, металлы могут передаваться через пищевые цепи, оказывая негативное воздействие на животных и людей (вторичное отравление). Накопление ТМ в пищевых цепях особенно важно для Cd и Hg и, в меньшей степени, для Pb, биологические функции которых в наземных организмах неизвестны [35]. В некоторых странах также существует озабоченность по поводу избыточного поступления Cd, Cu и Zn в сельскохозяйственные культуры [52, 53]. Избыток этих металлов может привести к снижению урожайности сельскохозяйственных культур и качества пищевых продуктов [35].
В целом широкий выбор реципиентов обусловлен целями защиты окружающей среды и потому имеет политический аспект. Выбор первоочередных реципиентов и определение приоритетных путей воздействия может происходить априори на основе таких факторов, как землепользование и социально-политические соображения [62]. Представленный обзор ограничен исключительно почвами как компонентами наземных экосистем, а критические концентрации ТМ обосновываются в зависимости от соотношения прямых и косвенных воздействий на такие реципиенты, как растения, почвенные микроорганизмы и беспозвоночные.
Выбор пороговых или критических концентраций, гарантирующих защиту наиболее чувствительных компонентов экосистем, представляет исключительно важную и сложную задачу. Такие концентрации, установленные в лабораторных исследованиях растений и почвенных организмов, характеризуются широким диапазоном в зависимости от вида организмов-реципиентов и типа биогеохимических процессов (табл. 1).
Таблица 1.
Критические концентрации тяжелых металлов, найденные в ранних экотоксикологических исследованиях, мг/кг
| Индикатор (среда) | Cd | Cu | Ni | Pb | Zn | Ссылка |
|---|---|---|---|---|---|---|
| Среднее содержание в почвах | 0.35 | 30 | 50 | 19 | 70 | [49] |
| Критические/экотоксилогические концентрации | ||||||
| Растения (почва) | 3–5 | 60–125 | 100 | 50–400 | 70–400 | [55] |
| Растения (раствор*) | 0.01–0.11 | 0.02–0.1 | – | 0.1–0.21 | 0.1–1.0 | [103] |
| Разложение и аккумуляция опада** | 1.1–885 | 41.4–1400 | 640–1300 | 255.6–8500 | 282–25750 | [17] |
| Минерализация углерода** | 1.1–600 | 25–1400 | 6.6–1200 | 78–11872 | 71–2000 | [17] |
| Трансформация азота** | 2–200 | 15–1445 | 2–50 | 200–8000 | 30–26 000 | [17] |
| Ферментативная активность** | 1.56 | 25–1900 | 1200 | 78–1700 | 71–1900 | [17] |
| Ферментативная активность | 3–>100 | – | – | 700–>1000 | 300–>10 000 | [8] |
| Биомасса микроорганизмов** | 4.7–1120 | 15–61139 | 6.6–1900 | 22–21320 | 139–75826 | [17] |
| Биомасса микроорганизмов (подстилка) | 19–1120 | 71–2600 | 1900 | 260–7562 | 300–41 100 | [103] |
| Почвенные беспозвоночные: | ||||||
| подстилка | – | 657–2509 | – | 132–230 | 1165–3585 | [103] |
| минеральная часть | 26–885 | 78–2500 | – | 34–4800 | 171–25 750 | |
| Почвенные беспозвоночные | 10–50 | <100 | – | 100–200 | <500 | [20] |
| Почвенные организмы (подстилка) | 1.7 | – | – | 320 | 110 | [107] |
| Предельно допустимые концентрации | ||||||
| Валовое содержание в почве | 3–3.5 | 50–100 | 30–50 | 50–100 | 150–300 | [55] |
| 0.4 + 0.007 × × (L + 3H)*** | 15 + 0.6 × × L + H)*** |
– | 50 + L + H*** | 50 + 1.5 × × (2L + H)*** |
[32] | |
| Концентрация в почвенном растворе* | 0.02 | 0.02 | – | 0.1 | 0.2 | [32] |
| Подвижные металлы в почве | 3.0 | 4.0 | 23.0 | [11] | ||
В качестве идеальных пороговых значений концентраций воздействия поллютанта в экотоксикологии часто используются концентрации, не вызывающие наблюдаемого эффекта (No Observed Effect Concentrations, NOECs), вызывающие минимальный наблюдаемый эффект (Lowest Observed Effect Concentrations, LOECs) или максимально допустимые концентрации токсиканта (maximum acceptable toxicant concentration, MATC) – средние геометрические между NOEC и LOEC. К этим критериям количественно близки, как правило, более надежно экспериментально определяемые токсикологические показатели ЕС5 и EC10 (или вычисляемые из наиболее надежно определяемой величины EC50), где концентрация эффекта ЕСX – это концентрация поллютанта, при которой эффект негативного воздействия наблюдается в x% случаев по сравнению с контрольной группой измерений. Договорные показатели ЕС5 и EC10 все чаще стали использоваться в качестве пороговых значений концентраций воздействия поллютанта, вызывающих минимальную долю негативного эффекта [109]; на английском они также образно называются суррогатными NOEC.
Следует отметить, что большинство принятых в нормировании пределов в основном связано с валовым содержанием металлов в органогенных или минеральных слоях почв [8, 17, 103]. Кроме того, эти пределы по-прежнему часто выражаются как единое значение для почв или рассчитываются как средневзвешенное для почвенных компонентов, не основанное на экотоксикологических оценках [35].
Применение единого значения валового содержания металлов в почвах не соответствует требованиям корректной индикации возможных негативных воздействий и вызывает справедливую критику [2, 10, 15, 35, 37, 93]. Действительно, использование единой концентрации металлов в качестве критического предела для экотоксикологического воздействия на почвенные организмы не учитывает наблюдаемые различия в токсичности металлов в почвах разного состава [94]. В настоящее время большинство ученых убеждено, что различия токсичности для многих организмов обусловлены поглощением металлов из почвенного раствора [83]. Только растворимая и мобильная фракция может вымываться или поглощаться растениями и попадать в пищевую цепочку [84]. Растворимость, подвижность и биодоступность металлов зависят от множества почвенных, микробных и растительных факторов, а также от свойств самих металлов. Такие свойства почв, как рН, емкость катионного обмена, содержание органического вещества и илистых частиц значительно влияют на биодоступность и токсичность металлов для биоты [13, 37, 48, 94, 108 ].
Обоснование и развитие моделей оценки критических концентраций. В основе оценок риска загрязнения наземных экосистем ТМ лежит представление об опасности их накопления в живых организмах, об их непосредственном поступлении в почвенную биоту и в растительность при корневом поглощении и о дальнейшем влиянии на животных по цепям питания. При этом определяющими оказываются процессы, протекающие на границе живого организма с водой [9, 71], а концептуальные основы химической модели токсичности совпадают для водных и наземных (почвенных) экосистем. Вначале считалось, что среди подвижных форм ТМ концентрация свободных ионов ТМ, или их химическая активность в почвенном растворе наилучшим образом коррелирует с их поглощением растительностью и функционированием микроорганизмов [25, 79] и, как следствие, в целом определяет токсическое воздействие на экосистемы.
Активность ТМ может и не являться оптимальным химическим показателем их токсического воздействия; так, например, биологический отклик гидробионтов лучше коррелирует с накоплением ТМ в отдельных органах, чем с концентрацией свободных ионов ТМ в окружающей воде [25]. Стало ясно, что необходимо учитывать химические взаимодействия ТМ непосредственно с биомолекулами органов-мишеней организма, рассматриваемых как ансамбль отдельных позиций, к которым металлы могут присоединяться [56, 77]. Химическая модель связывания ионов ТМ с биомолекулами [39, 91, 96] является одним из наиболее продвинутых инструментов анализа токсичности ТМ. Она позволяет одновременно учитывать, как комплексообразование ТМ с абиотическими лигандами (растворенным органическим веществом, карбонатами, хлоридами, сульфидами и т. д.), так и конкуренцию между свободными катионами токсичных ТМ и всегда присутствующими в поверхностных и почвенных водах другими катионами (Ca2+, Mg2+, H+, K+, Na+ и т. д.) за связывание с биотическими лигандами. Свободные ионы ТМ сначала взаимодействуют с физиологически активными зонами биомембран (например, в ионных каналах, транслоказах), затем обычно, хотя и необязательно, проникают в живой организм. Поглощение токсичных ТМ и конкурентное ингибирование проникновения необходимых организму катионов в основном и определяют токсическое действие ТМ [72, 91].
Ключевые публикации [39, 78, 88] заложили концептуальные и технические основы процесс-ориентированного моделирования биотического лиганда и продемонстрировали полезность этой модели в прогнозировании острой токсичности ТМ для гидробионтов. Хотя эти статьи основывались на предположении о кратковременной нагрузке ТМ на биотический лиганд как ключевом факторе, вызывающем долговременную токсичность, они показали, что нагрузку ТМ проще не измерять, а для целей создания модели ее можно оценить, решая обратную задачу из экспериментальных данных о токсичности. По сравнению с количеством моделей, лежащих в этом русле и разработанных позднее, существует относительно немного исследований, в которых были бы определены физиологические механизмы фактического накопления ТМ в биотическом лиганде. Переход к такому моделированию взаимосвязи нагрузки на биотический лиганд и токсичности окружающей среды, по сути, поддерживает только концептуальную механистическую основу, что теоретическая критическая нагрузка ТМ на лиганд вызывает критический уровень токсичности. Такой подход возник частично по соображениям целесообразности, связанным с трудоемкостью, технической сложностью и дороговизной экспериментальных измерений нагрузок ТМ, а частично обусловлен тем, что во многих случаях подобные измерения просто практически невозможно провести. Даже при измерении концентрации ТМ в ткани или органе концентрация ТМ в месте токсического действия, скорее всего, не является единственным измеряемым накоплением; вместо этого обычно предполагается, что измеренная концентрация в ткани или органе пропорциональна неизмеримой в настоящее время концентрации в месте воздействия. Для большинства ТМ механизмы хронической токсичности и, следовательно, биотические лиганды-мишени все еще остаются плохо изученными [68].
Именно адекватность сделанных упрощений как химической, так и, особенно, биологической подмоделей (рассмотрение чрезвычайно сложных живых систем – отдельных организмов и сообществ – как “математической конструкции”, описываемой теми же закономерностями, что и обычный молекулярный лиганд) привели к неплохой аппроксимации наблюдаемых связей и, в конечном итоге, к признанию моделей биотического лиганда. При таком подходе, естественно, биотический лиганд рассматривается как эффективный параметр/оператор модели, а химическая нагрузка – как эффективная переменная, то есть это не реальные, непосредственно измеряемые величины, а величины, которые надо оценивать на основе наблюдаемых эффектов. Отклик биологической системы (токсическое действие) на внешнюю химическую нагрузку остается единственной непосредственно измеряемой переменной.
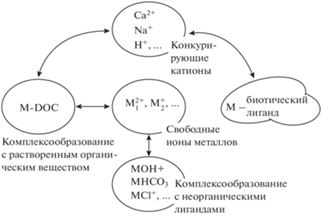
В первоначальной формулировке модели (рис. 1) биотический лиганд, несущий отрицательный заряд, рассматривался как набор монодентатных позиций для связывания катионов, главным образом, для простоты рассмотрения и ввиду недостаточности экспериментальных данных для включения в модель более сложных взаимодействий. Природа образования комплексов полагается электростатической – связь возникает за счет притяжения ионов с зарядами разных знаков. Законы действующих масс, связывающие между собой равновесные активности исходных веществ и продуктов реакции в химической термодинамике, в случае связывания различных катионов с определенными позициями биотического лиганда, могут быть записаны как
(1)
$\left[ {{{M}_{i}}\,BL} \right] = {{K}_{{{{M}_{i}}\,BL}}}\left( {M_{i}^{{z + }}} \right)\left[ {BL} \right]\,,$Связывание катионов с другими органическими лигандами или с трансформированным в почве растворенным органическим веществом исходно биологического происхождения количественно представляет собой весьма существенную часть общего комплексоообразоания, а сложность этого модуля может быть сопоставима со сложностью самой модели, он выделен на рис. 1 в отдельный блок. Модели биотического лиганда гидробионтов в качестве такого механистического модуля химических равновесий использовали модели WHAM разных поколений [99], модель NICA-Donnan [58] и Стокгольмскую гумусовую модель [47]. Поскольку концентрации растворенного органического вещества в почвенных водах зачастую превышают соответствующие концентрации в поверхностных водах, удачный выбор модуля химических равновесий, настроенного на моделирование почвенных вод, представляется не менее важным, чем при моделировании водных сред.
Выше отмечалось, что концептуальной химической мерой биологического отклика живого на химическое воздействие токсичных ТМ является их связывание с наиболее критичными органами живых организмов, или соответствующие величины $\left[ {{{M}_{i}}\,BL} \right]$ для ТМ. Предполагая слабую зависимость общего числа доступных для связывания позиций $\left[ {BL} \right]$ от $\left( {M_{i}^{{z + }}} \right),$ естественно ожидать линейную зависимость между концентрациями связанных на биотическом лиганде и свободных катионов, но такой вывод не очевиден, ввиду сложного, строго говоря, нелинейного характера модели. Вскоре после работы [39] было показано [30], что эта модель в широких диапазонах изменения наблюдаемых активностей обусловливает хорошую линейную аппроксимацию зависимостей между химическими активностями конкурирующих катионов и активностью свободных ионов ТМ, соответствующей эффекту ЕСx, наблюдаемому с вероятностью x (выраженной в %). Соответственно, было показано, что константы устойчивости конкурирующих катионов можно оценить с помощью обычной линейной регрессии. Введение в модель экотоксикологических показателей и определенных на их основе констант устойчивости ТМ явным образом отражает биологическую составляющую модели биотического лиганда.
Работа [30] спровоцировала лавинообразный рост интереса к модели и относительно простых однофакторных экспериментальных определений эффективных констант устойчивости для многих ТМ, разных видов организмов, химического состава соединений исследованных вод. Как результат такого развития исследований и наполнения модели фактическим содержанием (константами), модель из чисто теоретической постепенно стала преобразовываться в рабочий инструмент анализа вод и предсказания экологической ситуации. Дальнейшее развитие модели шло параллельно двумя противоположно направленными путями. С одной стороны, происходило ее некоторое усложнение за счет включения ранее не учтенных явлений. А с другой стороны, по мере постепенного накопления в исследовательских группах рабочих баз данных, связывающих исходные измеренные концентрации и экотоксикологические показатели с рассчитанными активностями, начался противоположный процесс кардинального упрощения модели на базе достигнутого нового уровня знаний.
В настоящее время модели биотического лиганда включают как классические, предсказывающие острую токсичность на основе измеренных накоплений [28, 39], так и адаптированные к данным об острой и хронической токсичности модели [73, 89], а также модели, прогнозирующие токсичность с использованием гуминовой кислоты или других поверхностей в качестве заменителей биотических лигандов [100]. Хотя принципиальная возможность применения моделей биотического лиганда к оценкам токсичности смесей ТМ была понятна с самого начала исследований модели [39], практические исследования в этом направлении затруднены комбинаторно большим числом требуемых вариантов опытов. Однако в последние годы наметился прогресс и в этом [44, 45, 69, 74].
Высокая требовательность моделей биотического лиганда к детальности знания входных химических параметров среды, с одной стороны, огранивает широкое практическое использование моделей для оценок качества окружающей среды, а с другой, делает невозможным непосредственное использование уже созданных баз геохимических данных ввиду отсутствия ряда параметров, необходимых для моделирования. Вместе с тем постепенное накопление опыта и результатов моделирования с помощью механистических моделей биотического лиганда с неизбежностью повлекло поиск эмпирических закономерностей связей предсказываемой переменной с массивом смоделированных активностей различных соединений, а не всех доступных данных, включающих концентрационные. Это привело к созданию обобщенных моделей, которые могут быть такими же простыми, как регрессия с одной переменной, например, токсичность свободных ионов ТМ в зависимости от pH [68, 106]. Существенное преимущество такого подхода заключается в том, что исследуются только переменные, включенные в механистическую модель, то есть происходит выбраковка переменных, которые не могут быть связаны с предсказываемой переменной модели причинно-следственными связями (разумеется, в рамках достаточно общих концептуальных ограничений механистической модели).
Широкое признание моделей биодоступности ТМ в научном сообществе не всегда выражается в их соответствующем применении регулирующими органами [68]. Модель биотического лиганда была включена в нормативную базу для меди в водных объектах Агентством защиты окружающей среды США [41]. В Европейском союзе стандарты качества окружающей среды в соответствии с Рамочной директивой по водным ресурсам и оценке рисков основаны на использовании нескольких подобных моделей, разработанных для защиты водорослей/растений, беспозвоночных и рыб (см. [73] для Ni; [105] для Cu и Zn; и [106] для Pb; [68]). В России, как и в ряде других стран, законодательно утверждены категориальные нормы максимально допустимого загрязнения как водных объектов, так и почв. Несмотря на общепризнанный факт, что изменчивость почвенных свойств непосредственно влияет на биодоступность и токсичность ТМ в почвах, для каждого нормируемого потенциально-опасного металла установлено единое значение предельно допустимой концентрации (ПДК) для всей территории страны или ограниченный набор значений ориентировочно допустимых концентраций (ОДК), каждое из которых характеризует широкий класс почв [11]. Принятие такого упрощенного подхода связано, в конечном итоге, с ограниченностью имеющихся знаний о влиянии поллютантов на живые организмы. В этих условиях в экологическом регулировании более предпочтительными являются сравнительно простые, основанные на моделях биодоступности, регрессионные модели. По мере накопления знаний появляется возможность более детальным, для наиболее изученных свойств – непрерывным образом учитывать изменчивость окружающей среды при нормировании. Развитие рассмотренного континуального подхода имеет целью постепенный переход к нормированию в масштабе экосистемы.
Ниже представлено описание эмпирических моделей распределения металлов между почвой и почвенным раствором, которые связывают концентрации металлов в растворе с их концентрациями в твердой фазе и свойствами почвы (так называемые функции преобразования). Изложен подход к использованию этих моделей для определения критических пределов, связанных с экотоксикологическим воздействием, для Cd, Pb, Cu и Zn в почвах и почвенных растворах.
Kритические пределы концентраций металлов в почвах, связанные с экотоксикологическим воздействием. Критические концентрации свободных ионов металлов в почвенном растворе в принципе могут быть оценены из критических концентраций химически активных металлов с использованием функций преобразования [35]. Формально это просто эмпирические решения типа (2) (см. ниже), но они аппроксимируют решения описанных выше химических моделей для экспериментальных данных разных авторов и различных вод при одновременном учете экотоксикологических ограничений, и тем самым одновременно отражают и причинно-следственный (а не только корреляционный), и геохимический, и экологический характер прогнозируемых связей. Критические концентрации свободных ионов металлов ([M]free;crit) были получены как функция pH почвенного раствора в соответствии с:
Авторы [63, 64] разработали алгоритм определения параметров функции преобразования (2), связывающей вычисленные (соответствующие имеющимся данным по критическим концентрациям ТМ для почвенных организмов и растений, а именно NOEC, LOEC и их “суррогатам”) критические активности свободных ионов металлов с активностями основных катионов в почвенном растворе, влияющих на доступность ТМ. Вычисленные в соответствии с описанной логикой параметры уравнения для Cd и Pb приведены в табл. 2. Отметим, что определенные таким образом величины $\left[ {{{M}_{{free;crit}}}} \right]$ никоим образом не отражают расчетный вклад в них ионов водорода. В действительности, уравнение (2) характеризует суммарный результат действия всех катионов, включая H+; вклад же собственно H+ составляет лишь некоторую поправку к суммарному эффекту. Легко измеряемая переменная pH является только удобной мерой, агрегирующей действие всех катионов раствора. По знаку коэффициента ${{\alpha }_{{crit}}},$ суммарный результат можно также назвать защитным эффектом, обусловленным, наряду с H+, основными катионами (Ca2+, Mg2+, K+, Na+).
Таблица 2.
Значения коэффициентов ${{\alpha }_{{crit}}}$ и ${{\gamma }_{{crit}}}$ (моль/л) в уравнении (2) для расчета критических концентраций свободных ионов металлов в почвенных растворах (по [35])
| Металл | ${{\alpha }_{{crit}}}$ | ${{\gamma }_{{crit}}}$ |
|---|---|---|
| Cd | 0.32 | 6.34 |
| Pb | 1.23 | 2.05 |
Эти критически важные функции свободных ионов металлов в растворе основаны на: (а) наборах данных по токсичности NOEC или EC10 для основных организмов в почвах, включая информацию о свойствах почв, влияющих на биодоступность, (б) функциях преобразования, описывающих связи между концентрацией свободных ионов металлов в растворе и содержанием химически активного металла в твердой фазе почв (предполагается, что оно равно содержанию добавленного металла в токсикологических опытах), и (в) статистических подходах для нахождения предельных функций и уровня защиты 95% [35]. Набор данных, взятых из отчетов по проектам оценки рисков в Европейском Союзе для ТМ, включал (а) редуцентов (микроорганизмы или связанные с ними почвенные процессы, например, ферментативная активность), (б) консументов, таких как беспозвоночные (дождевые черви и членистоногие) и (в) первичных продуцентов, в частности растения. Более подробная информация приведена в [35, 37, 64].
Критические общие концентрации металлов в почвенном растворе, исходя из критических концентраций свободных ионов металлов, должны определяться как сумма концентраций (а) свободных ионов металлов [Mfree], (б) растворенных неорганических комплексов [MDIC], таких как MOH+, ${\text{MHCO}}_{3}^{ + },$ MCl+ и (в) металлов [MDOM], связанных с растворенным органическим веществом [DOM], а именно:
(3)
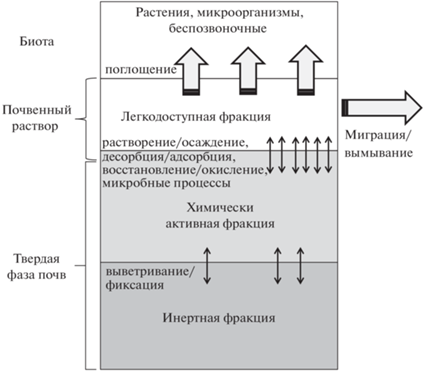
${{\left[ M \right]}_{{tot}}} = \,\,{{\left[ M \right]}_{{free}}} + \,\,{{\left[ M \right]}_{{DIC}}} + \,\,{{\left[ M \right]}_{{DOM}}} \times \,\,\left[ {DOM} \right],$Критические концентрации химически активных (потенциально доступных) металлов в почвах, связанные с экотоксикологическим воздействием на почвенные организмы и растения, были получены в лабораторных экспериментах на основе NOEC добавленных металлов [64]. Предполагается, что эти концентрации равны концентрациям химически активных металлов в почвах, которые потенциально доступны для обмена с почвенным раствором (рис. 2). В эту фракцию не входят металлы, которые включены в кристаллические решетки минералов и непосредственно не доступны для растворения. Химически активная фракция в почвах часто определяется экстракцией 0.43 М раствором HNO3 [46]. Влияние почвенных свойств, определяющих биодоступность и токсичность металлов, было учтено путем соотнесения критических значений с pH почвенных растворов и содержанием органического вещества в почвах [64, 37 ]:
где Mre,crit – критическая концентрация химически активного металла в почве (мг/кг); pH – pH почвенного раствора, а SOM – содержание органического вещества в почве (%). Значения для b0, b1 и b2, приведены в табл. 3. Результаты основаны на тех же наборах данных, что и для критических концентраций свободных ионов металлов.Рис. 2.
Распределение общего пула тяжелых металлов в почвах: легкодоступная фракция (свободные ионы металлов, комплексы с растворенным органическим веществом), химически активная фракция (осадки, металлы, сорбированные илом и органическим веществом, аморфные оксиды металлов, карбонаты, металл-органические комплексы) и инертная фракция (встроенные в кристаллическую решетку, сульфидные минералы, кристаллические оксиды металлов). Размер различных фракций и интенсивность наиболее важных почвенных процессов варьируют в зависимости от металла и условий окружающей среды (по [85], модифицировано).
Критические валовые концентрации металлов, которые важны для регулирующих органов, могут быть получены с помощью функций преобразования на основе концентраций химически активных металлов согласно [35, 86]:
(5)
$\begin{gathered} \lg {{M}_{{tot,crit}}} = {{c}_{0}} + {{c}_{1}}\lg {{M}_{{re,crit}}} + \\ + \,\,{{c}_{2}}\lg SOM + {{c}_{3}}\lg clay, \\ \end{gathered} $Таблица 4.
Значения коэффициентов с0–с3 в уравнении (5), связывающем валовое содержание Cd и Pb (Mtot,crit, мг/кг) с содержанием их химически активных (потенциально доступных) соединений (Mre,crit), почвенного органического вещества (SOM, %) и ила (clay), квадрат коэффициента детерминации $\left( {R_{{{\text{adj}}}}^{2}} \right)$ и среднеквадратичная ошибка (se(Y)) (по [35, 86])
| Металл | c0 | c1 | c2 | c3 | $R_{{{\text{adj}}}}^{2}$ | se(Y) |
|---|---|---|---|---|---|---|
| Cd | 0.028 | 0.877 | 0.009 | 0.081 | 0.96 | 0.10 |
| Pb | 0.323 | 0.810 | 0.035 | 0.136 | 0.92 | 0.13 |
ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ
Ключевыми в контроле поведения ТМ, включая их воздействие на реципиенты, являются процессы мобилизации и связывания, возможности количественных оценок которых варьируют. Основные процессы связывания ТМ в почвах – комплексообразование, сорбция, ионный обмен и осаждение – достаточно хорошо изучены в лабораторных условиях. Однако трудности в изучении распределения ТМ между твердой фазой почв и почвенным раствором сохраняются при реальных соотношениях почва : раствор в полевых условиях. К последним, в частности, относится добавление растворимых солей ТМ в адсорбционных и экотоксикологических лабораторных экспериментах, не учитывающих долговременные процессы связывания металлов и снижения их биодоступности, характерные для полевых условий [61, 65, 75, 87, 93]. Необходимы усилия по моделированию процесса старения в зависимости от свойств почв и времени взаимодействия [110]. Полевые исследования, в частности, распределения металлов между почвой и почвенным раствором, обладают несомненным приоритетом [62].
Пространственные масштабы и разрешение. Являясь функциями почвенных свойств, критические концентрации заметно меняются в пространстве. Пространственное разрешение для оценки критических концентраций и их превышений зависит от разрешения входных данных – пространственной доступности свойств почв с учетом их природной изменчивости и неопределенности из-за отсутствия данных. Данные по TМ имеют разрешение, варьирующее от местного до регионального и континентального [62].
В перспективе пространственные масштабы оценки критических концентраций и их превышений должны зависеть от характера решаемой проблемы загрязнения. По мере сокращения атмосферных выбросов крупными промышленными источниками загрязнения возникнет необходимость иметь дело с прямым поступлением поллютантов с удобрениями, навозом и твердыми биологическими веществами, а также с диффузными атмосферными источниками, такими как выбросы транспортных средств [35, 62]. Более точное пространственное разрешение критических концентраций может стать важным в локальных масштабах; например, рассеивание цинка в результате износа шин в пределах 10–100 м от автомагистралей может потребовать крупномасштабного картографирования. Однако преимущества более точного разрешения необходимо сопоставить с вероятными более высокими затратами на мониторинг [62].
Большая часть неопределенности оценок современных рисков избыточного накопления ТМ с точки зрения экотоксикологического воздействия проистекает из неопределенности используемых критических концентраций, на которую, в свою очередь, влияют неопределенности функций критических концентраций [34, 82]. Критические концентрации Cr, As и Se основаны на очень небольшом числе источников и поэтому весьма неопределенны. Для более надежных оценок критических нагрузок этих элементов необходим тщательный анализ существующих экотоксикологических данных [82]. Неопределенность критических концентраций в значительной степени зависит от неопределенности функций преобразования, связывающих металлы в твердой фазе почв с металлами в почвенных растворах, и от свойств почв, влияющих на эту связь (в частности, pH и содержания органического вещества) [34].
Отдельного внимания требует проблема оценки экологических рисков при многокомпонентном загрязнении. В реальных условиях многокомпонентного загрязнения возникает необходимость учета различных синергических эффектов: комбинированного (одновременное или последовательное действие нескольких веществ при одном и том же пути поступления), комплексного (поступления одного вредного вещества в организм различными путями и с различными средами — с воздухом, водой, пищей, через кожные покровы) и сочетанного воздействия всего многообразия физических, химических и биологических факторов. В этих случаях измерение токсической нагрузки – сложная проблема, не имеющая однозначного решения [45, 48, 74]. Решение проблемы оценки отклика экосистемы на совместное воздействие стрессовых факторов в условиях многокомпонентного загрязнения требует дальнейших исследований.
В свете оценки экологических рисков особую актуальность приобретает анализ возможного влияния изменения климата на мобильность, биологическую доступность и токсичность ТМ. Проявление такого влияния вполне ожидаемо в Арктике, подверженной в настоящее время наиболее быстрой трансформации. К российскому сектору относится не менее трети площади циркумполярной Арктики; суша арктической зоны занимает 18% территории страны [14]. Многие аспекты функционирования природных экосистем в высоких широтах чувствительны к изменениям климата. Основными механизмами, с помощью которых изменение климата влияет на экологические риски загрязнения почвы, являются вероятные изменения экотоксикологического воздействия загрязняющих веществ и трансформация путей их переноса, связанных с изменениями количества осадков, поверхностного стока, испарения [21, 57]. Кроме этого, изменение климата вызывает трансформацию почвенных условий – температуры, влажности, pH, окислительно-восстановительного потенциала, содержания органического вещества, азота, фосфора, минеральных фракций, микробиологической активности, приводящих к изменению процессов связывания/высвобождения, окисления/восстановления и состава соединений ТМ в почвах [21]. Так, современный климат Арктики определяет медленное разложение органического вещества, что приводит к его аккумуляции вместе со связанными элементами, несмотря на низкое поступление. Потепление климата с быстро нарастающей температурой в высоких широтах [16] может ускорить круговорот углерода и других элементов, особенно в почвах, что может сопровождаться первоначальным высвобождением ТМ [24].
Изменение климата может изменить водный режим, типы растительности и вызвать изменения в землепользовании. Изменения количества удобрений и твердых биологических веществ, вносимых на сельскохозяйственные угодья, скорость и степень индустриализации и урбанизации, естественные сукцессии растительности также могут повлиять на поведение ТМ [62]. Традиционно воздействия атмосферного загрязнения и климата рассматривались по отдельности. Однако совместное воздействие может значительно отличаться от суммы отдельных воздействий [22, 33].
ЗАКЛЮЧЕНИЕ
Обзор приведенных работ показывает, что критические концентрации ТМ в почвах и почвенных растворах, связанные с экотоксикологическими эффектами, следует определять как функцию основных свойств почв и почвенных растворов. Воздействие на микроорганизмы, растения и, в значительной степени, на беспозвоночных происходит через почвенный раствор [83]. В соответствии с принципами модели активности свободных ионов [25, 71] и модели биотического лиганда [39, 96], поглощение ТМ, вызывающее токсический эффект, можно рассматривать как происходящее при взаимодействии свободных ионов металлов в почвенном растворе с организмом. Степень этого взаимодействия и, следовательно, степень токсического воздействия данной концентрации свободных ионов металлов, будет также зависеть от концентраций других катионов раствора, которые конкурируют с токсичным металлом за связывание с организмом. Таким образом, основой оценки экологических рисков служит подход к установлению критических пределов для свободных ионов металлов. В частности, pH-зависимая функция критических значений активности свободных ионов металлов является подходящим инструментом для описания воздействия Cd, Pb, Cu и Zn [35, 37, 64]. Наиболее важными переменными функций преобразования для расчета критических значений ТМ в почвах являются pH, содержание органического вещества и ила [35, 86]. Поскольку эти свойства сильно различаются в зависимости от типа почв, диапазон критических концентраций металлов может быть большим [37]. Уменьшение неопределенностей в функциях критических концентраций металлов является важнейшим направлением дальнейших исследований. Полевая проверка полученных оценок относится к неоспоримым приоритетам [62].
Новый вызов представляет совместное воздействие антропогенного загрязнения и других изменений окружающей среды, таких как изменения климата. Процессы, определяющие поведение ТМ в экосистемах, подвержены влиянию климатических изменений, что, в свою очередь, влияет на уровень их интегрального воздействия. Эта фундаментальная задача почвоведения и экологии к настоящему времени практически не исследована, хотя актуальность и практическая потребность понимания климатических эффектов для обеспечения безопасности почвы и рационального природопользования не вызывает сомнений [66]. В связи с этим исследования устойчивости почв к ТМ, рисков их избыточного накопления в наземных экосистемах, приоритетов для восстановления техногенных территорий и реакции на климатические изменения имеют неоспоримое фундаментальное и прикладное значение.
Список литературы
Башкин В.Н., Козлов М.Я., Припутина И.В., Абрамычев А.Ю. Количественная оценка и картографирование критических нагрузок серы и азота на наземные и пресноводные экосистемы европейской части России // Проблемы региональной экологии. 1998. № 1. С. 26–42.
Ильин В.Б. Тяжелые металлы и неметаллы в системе почва–растение. Новосибирск: Изд-во СО РАН, 2012. 220 с.
Кашулина Г.М. Экстремальное загрязнение почв выбросами медно-никелевого предприятия на Кольском полуострове // Почвоведение. 2017. № 7. С. 860–873.
Кислотные осадки и лесные почвы / Под ред. В.В. Никонова, Г.Н. Копцик. Апатиты, 1999. 320 с.
Копцик Г.Н. Устойчивость лесных почв к атмосферному загрязнению // Лесоведение. 2004. № 4. С. 61–71.
Копцик Г.Н., Копцик С.В., Смирнова И.Е., Синичкина М.А. Ремедиация почв техногенных пустошей в Кольской Субарктике: современное состояние и многолетняя динамика // Почвоведение. 2021. № 4. С. 489–501.
Копцик С.В., Копцик Г.Н., Алябина И.О. Оценка риска избыточного поступления соединений серы в наземные экосистемы Кольского полуострова // Экология. 2008. № 5. С. 347–356.
Микроорганизмы и охрана почв / Под ред. Д.Г. Звягинцева. М.: Изд-во Моск. ун-та, 1989. 206 с.
Некоторые вопросы токсичности ионов металлов / Под ред. Х. Зигель, А. Зигель. М.: Мир, 1993. 367 с.
Плеханова И.О., Золотарева О.А., Тарасенко И.Д., Яковлев А.С. Оценка экотоксичности почв в условиях загрязнения тяжелыми металлами // Почвоведение. 2019. № 10. С. 1243–1258.
СанПиН 1.2.3685-21 “Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания”.
Семенов М.Ю. Критические нагрузки подкисляющих соединений на наземные экосистемы Азиатской части России. Новосибирск: Наука, 2002. 314 с.
Терехова В.А., Прудникова Е.В., Кирюшина А.П., Карпухин М.М., Плеханова И.О., Якименко О.С. Фитотоксичность тяжелых металлов в дерново-подзолистых почвах разной степени окультуренности // Почвоведение. 2021. № 6. С. 757–768.
Тишков А.А. “Арктический вектор” в сохранении наземных экосистем и биоразнообразия // Арктика: экология и экономика. 2012. № 2(6). С. 28–43.
Allen H.E. The significance of trace metal speciation for water, sediment and soil quality standards // Sci. Total Environ. 1993. V. 134. P. 23–45. https://doi.org/10.1016/S0048-9697(05)80004-X
AMAP, 2021. Arctic Climate Change Update 2021: Key Trends and Impacts. Summary for Policy-makers. Arctic Monitoring and Assessment Programme (AMAP), Tromsø, Norway. 16 p.
Bååth E. Effects of heavy metals in soil on microbial processes and populations. A literature review // Water Air Soil Pollut. 1989. V. 47. P. 335–379.
Balsberg-Påhlsson A.M. Toxicity of heavy metals (Zn, Cu, Cd, Pb) to vascular plants // Water Air Soil Pollut. 1989. V. 47. P. 287–319.
Bashkin V.N., Kozlov M.Y., Priputina I.V., Abramychev A.Y., Dedkova I.S. Calculation and mapping of critical loads of S, N and acidity on ecosystems of the Northern Asia // Water Air Soil Pollut. 1995. V. 85. P. 2395–2400. https://doi.org/10.1007/BF01186192
Bengtsson G., Tranvik L. Critical metal concentrations for forest soil invertebrates // Water Air Soil Pollut. 1989. V. 47. P. 381–417.
Biswas B., Qi F., Biswas J.K., Wijayawardena A., Khan M.A.I., Naidu R. The Fate of Chemical Pollutants with Soil Properties and Processes in the Climate Change Paradigm–A Review // Soil Syst. 2018. V. 2(3). № 51. https://doi.org/10.3390/soilsystems2030051
Bytnerowicz A., Omasa K., Paoletti E. Integrated effects of air pollution and climate change on forest: a northern hemisphere perspective // Environ. Pollut. 2007. V. 147. P. 438–445. https://doi.org/10.1016/j.envpol.2006.08.028
Cadmium Toxicity and Tolerance in Plants. From Physiology to Remediation / Eds.: M. Hasanuzzaman, M.N.V. Prasad, M. Fujita. Academic Press, 2019. 619 p. https://doi.org/10.1016/C2017-0-02050-5
Callaghan T.V., Björn L.O., Chernov Y., Chapin T., Christensen T.R., Huntley B., Ims R.A. et al. Effects on the function of arctic ecosystems in the short- and long-term perspectives. Ambio. 2004. V. 33. P. 448–458. https://doi.org/10.1639/0044-7447(2004)033[0448:EOTFOA]2.0.CO;2
Campbell P.G.C. Interactions between trace metals and aquatic organisms: A critique on the free-ion activity model // Metal speciation and bioavailability in aquatic systems. N.Y.: Wiley, 1995. P. 45–102.
Cheng H., Li M., Zhao C., Li K., Peng M., Qin A., Cheng X. Overview of trace metals in the urban soil of 31 metropolises in China // J. Geochem. Explor. 2014. V. 139. P. 31–52. https://doi.org/10.1016/j.gexplo.2013.08.012
CLRTAP, 2017. Mapping critical loads for ecosystems. Chapter V of Manual on methodologies and criteria for modelling and mapping critical loads and levels and air pollution effects, risks and trends. UNECE Convention on Long-range Transboundary Air Pollution; accessed 15.12.2021 at www.icpmapping.org.
Crémazy A., Wood C.M., Ng T.Y.T., Smith D.S., Chowdhury M.J. Experimentally derived acute and chronic copper biotic ligand models for rainbow trout // Aquat. Toxicol. 2017. V. 192. P. 224–240. https://doi.org/10.1016/j.aquatox.2017.07.013
Critical Loads for Sulphur and Nitrogen / Eds.: J. Nilsson, R. Greenfelt. UN-ECE, NCM. 1988. 418 p.
De Schamphelaere K.A.C., Janssen C.R. A biotic ligand model predicting acute copper toxicity for Daphnia magna: The effects of calcium, magnesium, sodium, potassium, and pH // Environ. Sci. Technol. 2002. V. 36. P. 48–54. https://doi.org/10.1021/es000253s
De Vries W., Bakker D.J. Manual for calculating critical loads of heavy metals for terrestrial ecosystems. Guidelines for critical limits, calculation methods and input data. Report 166. Wageningen: DLO Winand Staring Centre, 1998. 173 p.
De Vries W., Bakker D.J., Sverdrup H.U. Manual for calculating critical loads of heavy metals for aquatic ecosystems. Guidelines for critical limits, calculation methods and input data. Report 165. Wageningen: DLO Winand Staring Centre, 1998. 91 p.
De Vries W., Dobbertin M.H., Solberg S, van Dobben H.F., Schaub M. Impacts of acid deposition, ozone exposure and weather conditions on forest ecosystems in Europe: an overview // Plant Soil. 2014. V. 380. P. 1–45. https://doi.org/10.1007/s11104-014-2056-2
De Vries W., Groenenberg J.E. Evaluation of approaches to calculate critical metal loads for forest ecosystems // Environ. Pollut. 2009. V. 157. Iss. 12. P. 3422–3432.
De Vries W., Groenenberg J.E., Lofts S., Tipping E., Posch M. Critical Loads of Heavy Metals for Soils // Heavy Metals in Soils: Trace Metals and Metalloids in Soils and their Bioavailability. Environmental Pollution book series (EPOL, volume 22). Dordrecht: Springer Science + Business Media 2013. https://doi.org/10.1007/978-94-007-4470-7_8
De Vries W., Groenenberg J.E., Posch M. Mass Balance Approaches to Assess Critical Loads and Target Loads of Metals for Terrestrial and Aquatic Ecosystems // Critical Loads and Dynamic Risk Assessments. Springer, 2015. P. 207–222. https://doi.org/10.1007/978-94-017-9508-1_7
De Vries W., Lofts S., Tipping E., Meili M., Groenenberg J.E., Schütze G. Impact of Soil Properties on Critical Concentrations of Cadmium, Lead, Copper, Zinc, and Mercury in Soil and Soil Solution in View of Ecotoxicological Effects // Rev. Environ. Contam. Toxicol. 2007. V. 191. P. 47–89. https://doi.org/10.1007/978-0-387-69163-3_3
De Vries W., Schütze G., Lofts S., Tipping E., Meili M., Römkens P.F.A.M., Groenenberg J.E. Calculation of critical loads for cadmium, lead and mercury. Background document to a mapping manual on critical loads of cadmium, lead and mercury. Alterra-report 1104. Wageningen: Alterra, 2005. 143 p.
Di Toro D.M., Allen H.E., Bergman H.L., Meyer J.S., Paquin P.R., Santore R.C. Biotic ligand model of the acute toxicity of metals. 1. Technical basis // Environ Toxicol Chem. 2001. V. 20. P. 2383–2396. https://doi.org/10.1002/etc.5620201034
Doyle P.J., Gutzman D.W., Sheppard M.I., Sheppard S.C., Bird G.A., Hrebenyk D. An ecological risk assessment of air emissions of trace metals from copper and zinc production facilities // Hum. ecol. risk assess. 2003. V. 9. P. 607–636. https://doi.org/10.1080/713609925
EPA-822-R-07-001. Aquatic Life Ambient Freshwater Quality Criteria. Copper 2007 Revision. 204 p.
Ettler V. Soil contamination near non-ferrous metal smelters: A review // J. Appl. Geochem. 2016. V. 64. P. 56–74. https://doi.org/10.1016/j.apgeochem.2015.09.020
FAO and UNEP. 2021. Global assessment of soil pollution – Summary for policy makers. Rome: FAO, 2021. 62 p. https://doi.org/10.4060/cb4827en
Farley K.J., Meyer J.S. Metal mixtures model evaluation project: 3. Lessons learned and steps forward // Environ. Toxicol. Chem. 2015. V. 34. P. 821–832. https://doi.org/10.1002/etc.2837
Farley K.J., Meyer J.S., Balistrieri L.S., De Schamphelaere K.A.C., Iwasaki Y., Janssen C.R., Kamo M. et al. Metal mixture modeling evaluation project: 2. Comparison of four modeling approaches // Environ. Toxicol. Chem. 2015. V. 34. P. 741–753. https://doi.org/10.1002/etc.2820
Groenenberg J.E., Römkens P.F.A.M., Van Zomeren A., Rodrigues S.M., Comans R.N.J. Evaluation of the Single Dilute (0.43 M) Nitric Acid Extraction to Determine Geochemically Reactive Elements in Soil // Environ. Sci. Technol. 2017. V. 51. P. 2246–2253. https://doi.org/10.1021/acs.est.6b05151
Gustafsson J.P. Modeling the acid–base properties and metal complexation of humic substances with the Stockholm humic model // J. Colloid Interface Sci. 2001. V. 244. P. 102–112. https://doi.org/10.1006/jcis.2001.7871
Hale B., Gopalapillai Y., Pellegrino A., Jennett T., Kikkert J., Lau W., Schlekat C., McLaughlin M.J. Validation of site-specific soil Ni toxicity thresholds with independent ecotoxicity and biogeochemistry data for elevated soil Ni // Environ. Pollut. 2017. V. 231. P. 165-172. https://doi.org/10.1016/j.envpol.2017.08.008
Handbook of Soil Science / Ed.-in-chief M.E. Sumner. Boca Raton–London–N.Y.–Washington, D.C.: CRC Press, 2000. P. G-163.
Heavy Metals in Soils: Trace Metals and Metalloids in Soils and their Bioavailability / Ed. B.J. Alloway. N.Y., London: Springer, 2012. 613 p.
Hettelingh J.P., Slootweg J., Posch M., Ilyin I. Preliminary modelling and mapping of critical loads of cadmium and lead in Europe. Bilthoven: CCE MSC-East Moscow and CCE Bilthoven, RIVM Report 259101011, 2002. 7 p.
Hou D., O’Connor D., Igalavithana A.D., Alessi D.S., Luo J., Tsang D.C.W., Sparks D.L. et al. Metal contamination and bioremediation of agricultural soils for food safety and sustainability // Nat. Rev. Earth Environ. 2020. V. 1. P. 366–381. https://doi.org/10.1038/s43017-020-0061-y
Hu Z., Li J., Wang H., Ye Z., Wang X., Li Y., Liu D., Song Z. Soil Contamination with Heavy Metals and Its Impact on Food Security in China // J. Geoscience and Environment Protection. 2019. V. 7. № 5. P. 168–183. https://doi.org/10.4236/gep.2019.75015
ICP Modelling & Mapping Manual on Methodologies and Criteria for Modelling and Mapping Critical Loads & Levels and Air Pollution Effects, Risks and Trends; UBA-Texte 52/04; Federal Environmental Agency (Umweltbundesamt): Berlin, 2004; www.icpmapping.org.
Irwin R.J., Van Mouwerik M., Stevens L., Seese M.D., Basham W. Environmental Contaminants Encyclopedia. National Park Service, Water Resources Division, Fort Collins, Colorado, 1997.
Janssen C.R., Heijerick D.G., De Schamphelaere K.A.C., Allen H.E. Environmental risk assessment of metals: tools for incorporating bioavailability // Environ. Int. 2003. V. 28(8). P. 793–800. https://doi.org/10.1016/S0160-4120(02)00126-5
Jarsjö J., Andersson-Sköld Y., Fröberg M., Pietroń J., Borgströme R., Löv Å., Kleja D.B. Projecting impacts of climate change on metal mobilization at contaminated sites: Controls by the groundwater level // Sci. Total Environ. 2020. V. 712. 135560. https://doi.org/10.1016/j.scitotenv.2019.135560
Kinniburgh D.G., Milne C.J., Benedetti M.F., Pinheiro J.P., Filius J., Koopal L.K., Van Riemsdijk W.H. Metal ion binding by humic acid: Application of the NICA-Donnan model // Environ. Sci. Technol. 1996. V. 30. P. 1687–1698. https://doi.org/10.1524/ract.92.9.567.54984
Koptsik G., Koptsik S. Critical loads of acid deposition for forest ecosystems in the Kola Peninsula // Water Air Soil Pollut. 1995. V. 85. P. 2553–2558. https://doi.org/10.1007/BF01186218
Kozlov M.V., Zvereva E.L. Industrial barrens: extreme habitats created by non-ferrous metallurgy // Life in Extreme Environments. Dordrecht: Springer, 2007. P. 69–97. https://doi.org/10.1007/978-1-4020-6285-8_5
Lock K., Janssen C.R. Influence of Aging on Metal Availability in Soils // Rev. Environ. Contam. Toxicol. 2003. V. 178. P. 1–21. https://doi.org/10.1007/0-387-21728-2_1
Lofts S., Chapman P.M., Dwyer R., McLaughlin M.J., Schoeters I., Sheppard S.C., Adams W.J. et al. Critical loads of metals and other trace elements to terrestrial environments // Environ. Sci. Techn. 2007. V. 41(18). P. 6326–6331. https://doi.org/10.1021/es0726106
Lofts S., Spurgeon D.J., Svendsen C. Fractions Affected and Probabilistic Risk Assessment of Cu, Zn, Cd, and Pb in Soils Using the Free Ion Approach // Environ. Sci. Technol. 2005. V. 39. № 21. P. 8533–8540. https://doi.org/10.1021/es048121c
Lofts S., Spurgeon D.J., Svendsen C., Tipping E. Deriving soil critical limits for Cu, Zn, Cd and Pb: a method based on free ion concentrations // Environ. Sci. Technol. 2004. V. 38(13). P. 3623–3631. https://doi.org/10.1021/es030155h
Ma Y., Lombi E., Oliver I.W., Nolan A.L., McLaughlin M.J. Long-Term Aging of Copper Added to Soils // Environ. Sci. Technol. 2006. V. 40(20). P. 6310–6317. https://doi.org/10.1021/es060306r
McBratney A., Fielda D.J., Koch A. The dimensions of soil security // Geoderma. 2014. V. 213. P. 203–213. https://doi.org/10.1016/j.geoderma.2013.08.013
Meadows M., Watmough S.A. An Assessment of Long-term Risks of Metals in Sudbury: A Critical Loads Approach // Water Air Soil Pollut. 2012. V. 223. P. 4343–4354. https://doi.org/10.1007/s11270-012-1199-0
Mebane C.A., Chowdhury M.J., De Schamphelaere K.A.C., Lofts S., Paquin P.R., Santore R.C., Wood C.M. Metal Bioavailability Models: Current Status, Lessons Learned, Considerations for Regulatory Use, and the Path Forward // Environ Toxicol Chem. 2020. V. 39. № 1. P. 60–84. https://doi.org/10.1002/etc.4560
Meyer J.S., Farley K.J., Garman E.R. Metal mixtures modeling evaluation project: 1. Background // Environ Toxicol Chem. 2015. V. 34. P. 726–740. https://doi.org/10.1002/etc.2792
Modelling and Mapping the Impacts of Atmospheric Deposition of Nitrogen and Sulphur. CCE Status Report 2015 / Eds.: J. Slootweg, M. Posch, J.-P. Hettelingh. 2016. 182 p.
Morel F.M.M. Principles of aquatic chemistry. N.Y.: John Wiley & Sons, Inc., Somerset, 1983. 446 p.
Niyogi S., Wood C.M. Biotic ligand model, a flexible tool for developing site-specific water quality guidelines for metals // Environ. Sci. Technol. 2004. V. 38(23). P. 6177–6192. https://doi.org/10.1021/es0496524
Nys C., Janssen C.R., Van Sprang P., De Schamphelaere K.A.C. The effect of pH on chronic aquatic nickel toxicity is dependent on the pH itself: Extending the chronic nickel bioavailability models. Environ Toxicol Chem. 2016. V. 35. P. 1097–1106. https://doi.org/10.1002/etc.3232
Nys C., Van Regenmortel T., Janssen C.R., Oorts K., Smolders E., De Schamphelaere K.A.C. A framework for ecological risk assessment of metal mixtures in aquatic systems // Environ Toxicol Chem. 2018. V. 37. P. 623–642. https://doi.org/10.1002/etc.4039
Oorts K., Smolders E., Lanno R., Chowdhury M.J. Bioavailability and Ecotoxicity of Lead in Soil: Implications for Setting Ecological Soil Quality Standards // Environ Toxicol Chem. 2021. V. 40. № 7. P. 1948–1961. https://doi.org/10.1002/etc.5051
Panagos P., Van Liedekerke M., Yigini Y., Montanarella L. Contaminated Sites in Europe: Review of the Current Situation Based on Data Collected through a European Network // J. Environ. Public Health. 2013. V. 2013. Article ID 158764. 11 p. https://doi.org/10.1155/2013/158764
Paquin P.R., Gorsuch J.W., Apte S., Batley G.E., Bowles K.C., Campbell P.G.C., Delos C.G. et al. The biotic ligand model: a historical overview // Comp. Biochem. Physiol. Part – C: Toxicol. Pharmacol. 2002. V. 133. № 1-2. P. 3–35. https://doi.org/10.1016/S1532-0456(02)00112-6
Paquin P.R., Santore R.C., Wu K.B., Kavvadas C.D., Di Toro D.M. The biotic ligand model: A model of the acute toxicity of metals to aquatic life // Environ. Sci. Policy. 2000. V. 3 (Suppl. 1). P. 172–182. https://doi.org/10.1016/S1462-9011(00)00047-2
Parker D.R., Pedler J.F. Reevaluating the free-ion activity model of trace metal availability to higher plants // Plant Soil. 1997. V. 196. № 2. P. 223–228.
Physiology and Biochemistry of Metal Toxicity and Tolerance in Plants / Eds.: M.N. Prasad, K. Strzalka. B.V. Dordrecht: Springer, 2002. 432 p. https://doi.org/10.1007/978-94-017-2660-3
Preliminary modelling and mapping of critical loads of cadmium and lead in Europe / Eds.: J.-P. Hettelingh, J. Slootweg, M. Posch, S. Dutchak, I. Ilyin. 2002. RIVM Report 259101011/2002. Bilthoven, The Netherlands. 127 p.
Reinds G.J., Groenenberg J.E., de Vries W. Critical Loads of copper, nickel, zinc, arsenic, chromium and selenium for terrestrial ecosystems at a European scale. A preliminary assessment. Wageningen, Alterra, Alterra-rapport 1355. 2006. 46 p.
Ritchie G.S.P., Sposito G. Speciation in soils. Chemical Speciation in the Environment. Oxford: Blackwell, 2001. P. 237–264. https://doi.org/10.1002/9780470988312.CH9
Robinson B., Bolan N., Mahimairaja S., Clothier B. Solubility, Mobility, and Bioaccumulation of Trace Elements: Abiotic Processes in the Rhizosphere // Trace Elements in the Environment. Biogeochemistry, Biotechnology, and Bioremediation. 1st Edition. Boca Raton: CRC Press, 2005. P. 93–106. https://doi.org/10.1201/9781420032048
Rodrigues S.M., Henriques B., Ferreira da Silva E., Pereira M.E., Duarte A.C, Römkens P.F.A.M. Evaluation of an approach for the characterization of reactive and available pools of twenty potentially toxic elements in soils: Part I – The role of key soil properties in the variation of contaminants’ reactivity // Chemosphere. 2010. V. 81. Iss. 11. P. 1549–1559. https://doi.org/10.1016/j.chemosphere.2010.07.026
Römkens P.F.A.M., Groenenberg J.E., Bonten L.T.C., de Vries W., Bril J. Derivation of partition relationships to calculate Cd, Cu, Ni, Pb and Zn solubility and activity in soil solutions. Rapport 305. Wageningen: Alterra, 2004.
Santa-Cruz J., Peñaloza P., Korneykova M.V., Neaman A. Thresholds of Metal and Metalloid Toxicity in Field-Collected Anthropogenically Contaminated Soils: A Review // Geogr. Environ. Sustain. 2021. V. 14. № 2. P. 6–21. https://doi.org/10.24057/2071-9388-2021-023
Santore R.C., Paquin P.R., Di Toro D.M., Allen H.E., Meyer J.S. Biotic ligand model of the acute toxicity of metals. 2. Application to acute copper toxicity in freshwater fish and Daphnia // Environ. Toxicol. Chem. 2001. V. 20. P. 2397–2402. https://doi.org/10.1897/1551-5028(2001)020<2397: BLMOTA>2.0.CO;2
Santore R.C., Ryan A.C., Kroglund F., Teien H.C., Rodriguez P.H., Stubblefield W.A., Cardwell A.S. et al. Development and application of a biotic ligand model for predicting the toxicity of dissolved and precipitated aluminum // Environ. Toxicol. Chem. 2018. V. 37. P. 70–79. https://doi.org/10.1002/etc.4020
Schlutow A., Schrцder W., Scheuschner T. Assessing the relevance of atmospheric heavy metal deposition with regard to ecosystem integrity and human health in Germany // Environ. Sci. Eur. 2021. V. 33(7). https://doi.org/10.1186/s12302-020-00391-w
Slaveykova V.I., Wilkinson K.J. Predicting the bioavailability of metals and metal complexes: Critical review of the biotic ligand model // Environ. Chem. 2005. V. 2(1). P. 9–24. https://doi.org/10.1071/EN04076
Slootweg J., Hettelingh J.-P., Posch M., Schütze G., Spranger T., de Vries W., Reinds G.J. et al. European Critical Loads of Cadmium, Lead and Mercury and their Exceedances // Water Air Soil Pollut.: Focus. 2007. V. 7. P. 371–377. https://doi.org/10.1007/978-1-4020-5885-1_41
Smolders E., Oorts K., Van Sprang P., Schoeters I., Janssen C.R., McGrath S.P., Mclaughlin M.J. Toxicity of Trace Metals in Soil as Affected by Soil Type and Aging After Contamination: Using Calibrated Bioavailability Models to Set Ecological Soil Standards // Environ. Toxicol. Chem. 2009. V. 28. Iss. 8. P. 1633–1642. https://doi.org/10.1897/08-592.1
Spurgeon D.J., Hopkin S.P. Effects of variations of the organic matter content and pH of soils on the availability and toxicity of zinc to the earthworm Eisenia fetida // Pedobiologia. 1996. V. 40. P. 80–96.
Sverdrup H., de Vries W., Henriksen A. Mapping Critical Loads. UN-ECE, NMR. Stockholm, 1990. 122 p.
Thakali S., Allen H. E., Di Toro D.M., Ponizovsky A.A., Rooney C.P., Zhao F.-J., McGrath S.P. A terrestrial biotic ligand model. 1. Development and application to Cu and Ni toxicities to barley root elongation in soils // Environ. Sci. Technol. 2006. V. 40. P. 7085–7093. https://doi.org/10.1021/es061171s
Tipping E. Cation binding by humic substances. Cambridge: Cambridge University Press, 2002. 434 p.
Tipping E. Modelling Al competition for heavy metal binding by dissolved organic matter in soil and surface waters of acid and neutral pH // Geoderma. 2005. V. 127. P. 293–304. https://doi.org/10.1016/j.geoderma.2004.12.003
Tipping E., Lofts S., Sonke J.E. Humic Ion-Binding Model VII: A revised parameterisation of cation-binding by humic substances // Environ. Chem. 2011. V. 8(3). P. 225–235. https://doi.org/10.1071/EN11016
Tipping E., Stockdale A., Lofts S. Systematic analysis of freshwater metal toxicity with WHAM-FTOX. Aquat. Toxicol. 2019. V. 212. P. 128–137.
Tóth G., Hermann T., Szatmári G., Pásztor L. Maps of heavy metals in the soils of the European Union and proposed priority areas for detailed assessment // Sci. Total Environ. 2016. V. 565. P. 1054–1062. https://doi.org/10.1016/j.scitotenv.2016.05.115
Towards Cleaner Air. Scientific Assessment Report 2016 / Eds.: R. Maas, P. Grennfelt. Oslo: EMEP Steering Body and Working Group on Effects of the Convention on Long-Range Transboundary Air Pollution, 2016. xx+50 p.
Tyler G. Critical concentrations of heavy metals in the mor horizon of Swedish forests // Solna, Sweden, Swedish Environmental Protection Agency. 1992. Report 4078. 38 p.
UBA. Mapping manual 2004. Manual on methodologies and criteria for modelling and mapping critical loads and levels and air pollution effects, risks and trends. www.icpmapping.org.
Van Regenmortel T., Nys C., Janssen C.R., Lofts S., De Schamphelaere K.A.C. Comparison of four methods for bioavailability-based risk assessment of mixtures of Cu, Zn and Ni in freshwater // Environ. Toxicol. Chem. 2017. V. 36. P. 2123–2138. https://doi.org/10.1002/etc.3746
Van Sprang P.A., Nys C., Blust R.J.P., Chowdhury J., Gustafsson J.P., Janssen C.J., De Schamphelaere K.A.C. The derivation of effects threshold concentrations of lead for European freshwater ecosystems // Environ. Toxicol. Chem. 2016. V. 35. P. 1310–1320. https://doi.org/10.1002/etc.3262
Vanmechelen L., Groenemans R., Van Ranst E. Forest soil conditions in Europe. Results of a Large-Scale Soil Survey. EC-UN/ECE, Brussels, Geneva, 1997. 261 p.
Waalewijn-Kool P.L., Rupp S., Lofts S., Svendsen C., van Gestel C.A.M. Effect of soil organic matter content and pH on the toxicity of ZnO nanoparticles to Folsomia candida // Ecotoxicol. Environ. Saf. 2014. V. 108. P. 9–15. https://doi.org/10.1016/j.ecoenv.2014.06.031www.elsevier.com
Warne M.St.J., van Dam R. NOEC and LOEC data should no longer be generated or used // Australas. J. Ecotoxicol. 2008. V. 14. P. 1–5.
Zeng S., Li J., Wei D., Ma Y. A new model integrating short- and long-term aging of copper added to soils // PLOS ONE. 2017. V. 12(8). e0182944. https://doi.org/10.1371/journal.pone.0182944
Дополнительные материалы отсутствуют.