Почвоведение, 2022, № 5, стр. 586-599
Биотестирование экотоксичности почв при химическом загрязнении: современные подходы к интеграции для оценки экологического состояния (обзор)
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский пр., 33, Россия
* E-mail: vterekhova@gmail.com
Поступила в редакцию 10.12.2021
После доработки 23.12.2021
Принята к публикации 30.12.2021
- EDN: RAQEFC
- DOI: 10.31857/S0032180X22050094
Аннотация
Рассмотрены основные направления использования биотестирования для оценки экологического риска загрязнений: а) прогностическое, направленное на прогнозирование возможных эффектов химических веществ и определение безопасных уровней их применения, б) диагностическое, позволяющее дать оценку реальной угрозы или ущерба в моменте. Проанализированы исторические этапы развития экотоксикологии. Дано представление о разнообразии тест-систем и методах оценки экотоксичности, критериях подбора тест-видов в батареи биотестов. Приведены примеры применения OMICS-технологий, молекулярных биомаркеров, наноэкотоксикологии и экотоксикогеномики в оценке токсичности почв. В мировой практике для сравнения результатов в стандартных испытаниях в качестве референтного образца рекомендована стандартная почва (Reference/Standard/Artificial soil) согласно протоколу ISO11268. Акцентируется внимание на актуальности и проблемах оценки почв на основе биотической концепции современного экологического контроля, охарактеризованы достоинства и недостатки некоторых способов и индексов экологического состояния почв, базирующихся на использовании реакций живых систем на загрязнение среды обитания (в частности, так называемый, интегральный показатель биологического состояния почвы – ИПБС, функциональное разнообразие микробиома – ФБР, индекс состояния по методологии ТРИАД). На современном этапе оптимальным способом интеграции результатов биотестирования в общую оценку почв представляется междисциплинарная методология ТРИАД, предусматривающая комплекс химических, биоиндикационных (in situ) и токсикологических (ex situ) исследований.
ВВЕДЕНИЕ
Последние 30 лет оценка экотоксичности почв получила надежное методологическое обоснование в контроле качества наземных экосистем. Биотическая концепция стала доминирующей в экологическом контроле природных сред [10]. Широкое использование биологической диагностики наряду с биоиндикационными наблюдениями in situ предполагает лабораторную оценку экотоксичности образцов при биотестировании ex situ. Биотестирование – признанный полезный экотоксикологический подход, направленный на защиту экосистем от антропогенного воздействия. В течение нескольких последних десятилетий биотестирование применяется в оценке качества природных сред и техногенных объектов, к которым относят производственные отходы, промышленные препараты, применяемые в различных отраслях народного хозяйства, в том числе химические, бактериальные, гуматно-композитные материалы и сорбенты для восстановления нарушенных почв.
Качество почв определяют как одну из наиболее сложных составляющих качества окружающей среды [40]. Качество воды и воздуха подразумевает, в основном, чистоту субстанций, которая напрямую влияет на потребление и здоровье людей и животных или на естественные экосистемы [42, 48]. В определении “качество почвы” заложены более сложные представления. Оно не ограничивается только степенью загрязнения [33]. В широком смысле качество почвы обычно определяется как “способность почвы функционировать в рамках экосистемы и границ землепользования для поддержания биологической продуктивности, поддержания качества окружающей среды и развития растений и здоровья животных”, при этом понятие “здоровье животных” включает здоровье человека [49]. Качество почвы можно оценить как для агроэкосистем, где основной, но не исключительной, экосистемной услугой является продуктивность, так и для природных экосистем. Химическое загрязнение традиционными (тяжелые металлы, пестициды, нефтепродукты, ПАУ) [2, 6, 8, 48] или относительно новыми (фармпрепараты и антибиотики, наноматериалы, микропластики) [64, 65] токсикантами представляет большую угрозу устойчивому функционированию почвенных экосистем и качеству окружающей среды в целом. Характеристика экологического качества всех трех компонентов окружающей среды (вода, воздух, почва), согласно целому ряду нормативных документов, включает оценку токсичности [9, 25–29, 59–63, 76–81].
Исторические аспекты экотоксикологии. Начало развития почвенной экотоксикологии в мировой практике связывают с наблюдениями за воздействием пестицидов на почвенных беспозвоночных в 1960-х гг. [51, 53]. Этот период характеризуется большим вниманием к эффектам химических веществ в целом на объекты окружающей среды. В этой связи часто вспоминают американскую журналистку Рэйчел Карсон, впервые привлекшую внимание публикацией в 1962 г. своей книги “Безмолвная весна” (англ. “Silent Spring”) к негативным последствиям все более широкого использования синтетических пестицидов в послевоенные годы. В книге прозвучало предостережение о том, что борьба за урожай химическими средствами неизбежно ведет к угрозе здоровью человека, а первые сигналы уже следует видеть в воздействии пестицидов, особенно ДДТ, на птиц – поющие птицы замолкают по причине бесконтрольного распространения хлорированных пестицидов, накапливающихся в пищевой цепи. Появление этой книги было ярким событием и важным триггером рождения новой науки – экотоксикологии (ecotoxicology), для становления которой много сделал Рене Траут, связав в 1969 г. воедино элементы ряда естественных наук (таких как химия, биохимия, физиология, популяционная генетика и др.), определив понятия, предмет и методы исследования новой науки.
Книга Р. Карсон, привлекшая всеобщее внимание к загрязнению среды, оказалась важным, но не единственным импульсом к развитию токсикологических исследований. Этому способствовало массовое внедрение технологий и использование с начала ХIХ в. химических продуктов в различных сферах, необходимость оценки последствий таких антропогенных воздействий. Впервые на законодательном уровне биотестирование было включено в оперативный контроль загрязнения вод в США, где с целью защиты окружающей среды и здоровья людей создано было Агентство по охране окружающей среды (United States Environmental Protection Agency; US EPA). Впоследствии такие организации, призванные разрабатывать нормы и следить за их исполнением, стали законодательно стимулировать внедрение биотестов в практику и в других странах.
В 1980- и 1990-х гг. успешно решались вопросы методического обеспечения экотоксикологических исследований для оценки риска химических веществ. В этот период было разработано немало тестов на экотоксичность с использованием отдельных видов живых организмов. Они были основаны, прежде всего, на интегральной характеристике – выживаемости особей.
Большой вклад во внедрение биотестов в природоохранную практику нашей страны внесла школа отечественных гидробиологов под руководством профессора МГУ Строганова [15]. В 1990 г. Государственным комитетом СССР по охране природы был утвержден первый нормативный документ в области экотоксикологической оценки водных объектов “Методическое руководство по биотестированию воды” (РД 118-02-90), предусматривающее использование небольшого набора гидробионтов: водоросли – Scеnedesmus quadricauda, Chlorella vulgaris, беспозвоночные Daphnia magna, Ceriodaphnia affinis, рыбы – Poecilia reticulatus. В 1991 г. были утверждены “Правила охраны поверхностных вод”, регулирующие очистку и сброс сточных вод в водные объекты с помощью токсикологического контроля методами биотестирования [12]. Разработанные в методическом документе принципы и в настоящее время используются в законодательных актах с целью охраны не только водных, но и почвенных ресурсов.
Разнообразие тест-систем и методов оценки экотоксичности. Показателем экотоксичности служит степень изменения определенных параметров живых систем разного уровня организации, которая фиксируется различными методами. Это могут быть биохимические, биофизические методы, визуальный подсчет, разные виды микроскопии. Так, при исследовании реакций на химическое загрязнение представителей микобиоты с помощью световой микроскопии показаны изменения под воздействием солей тяжелых металлов и нефтепродуктов в прорастании спор у ряда микромицетов (Phoma spp., Fusarium oxysporum, Stemphylium sp., Trichоderma harzianum, Penicillium frequentans, Mucor racemosum) [18, 21]. Методом люминесцентной микроскопии с применением специфического красителя установлена трансформация морфо-биологической структуры биомассы микроскопических грибов под влиянием отходов производства минеральных удобрений [17]. Методом посева на плотные среды присутствие поллютантов можно регистрировать по изменению радиальной скорости роста колоний микромицетов (виды родов Phoma, Fusarium, Thielaviopsis) [17, 21]. При культивировании в жидких средах влияние токсичных веществ контролируется по накоплению биомассы [16, 17, 21, 52].
В конце 1990-х и начале 2000-х гг. в почвенной экотоксикологии появились стандартизованные международными организациями (OECD – Организация экономического сотрудничества и развития и ISO – Международная организация по стандартизации) биотесты, основанные на учете показателей смертности и воспроизводства энхитреид [79], дождевых червей [78, 80] и коллембол [77]. Позднее для тех же организмов были утверждены поведенческие тесты (избегание) [62], а для дождевых червей и энхитреид еще и тест по биоаккумуляции [100]. Появилась целая серия нормативных документов, регламентирующих использование высших растений [76, 81, 84, 86] и микроорганизмов [60, 85].
Тест-организмы, “перенесенные” из окружающей среды в контролируемые условия лабораторного культивирования, должны соответствовать ряду требований. Как правило, указывается, что они должны быть представлены широко распространенными в природных условиях видами, легко доступны в течение всего года в больших количествах, представлять генетически максимально однородную популяцию, свободны от возбудителей болезней и паразитов. Самое важное что стандартизованные тест-организмы должны обладать стабильной высокой чувствительностью к токсикантам, которая по требованиям стандартных методик измерений токсичности должна регулярно контролироваться в лаборатории по реакции на модельные токсиканты. В идеале они должны быть чувствительны к широкому спектру токсинов (или к группе соединений) для целей их идентификации в средах, а наблюдаемая реакция должна быть воспроизводимой.
Батареи биотестов. Со временем все более популярными становятся так называемые батареи биотестов – серии тест-систем, основанные на реакциях разных видов живых организмов на один и тот же объект воздействия [38, 54, 94, 101]. Более сложные комплексные модельные системы, ориентированные на измерение структурных и функциональных показателей, характеризующих биодоступность и аккумуляцию токсикантов, также приобретают популярность [4, 5].
Внедрение батарей биотестов считается особенно эффективным при анализе смешанного загрязнения окружающей среды. Они дают возможность объединить тест-отклики в одну оценку, что позволяет классифицировать участки по степени их загрязнения, сравнивать воздействие различных коммерческих продуктов при выявлении токсичности в образцах со смешанным загрязнением [57]. Этот период связывают с появлением интегративных многомаркерных концепций – Multi-Markered Bioindication Concept (MMBC). На использовании батареи из двух тест-систем с участием организмов разной таксономической принадлежности основана, например, современная экспериментальная оценка класса опасности отходов, согласно действующим “Критериям отнесения отходов к I–V классам опасности по степени негативного воздействия на окружающую среду” (утв. приказом Минприроды России от 4 декабря 2014 г. № 536) [9].
В то же время не затихает дискуссия о размере батареи биотестов, обоснованности включения тех или иных тестов, значении чувствительности отдельных тест-видов. Результатам отклика одного тест-вида в пределах батареи с высокой и широкой чувствительностью придается решающее значение: если хотя бы один вид обнаружил токсичность, то пробу принято относить к токсичной. В других подходах показана возможность использования ограниченного числа тест-видов, но выбранных в соответствии с их специфической чувствительностью к поллютантам, в первую очередь, участвующим в загрязнении участка. Это аргументируется повышением рентабельности состава батареи [72, 73].
Все чаще в работах последних лет экспериментально обосновывается необходимость концепции специфических тестов, так называемых, “site-specific ecotoxicological tests”, результаты которых можно объединить в один интегрированный индекс [16, 102].
Для улучшения, как дискриминации, так и полноценного заключения о степени загрязненности участков все же целесообразно в биотестах, интегрированных в батареи, использовать большее количество тест-видов, включая те, что обладают высокой чувствительностью к определенным видам загрязнения [54, 73]. Например, Агентство по охране окружающей среды США для обнаружения диоксинов и диоксиноподобных соединений в почвах и отложениях рекомендует проводить скрининг с помощью анализа CALUX® (Chemically Activated LUciferase eXpression) (https://www.epa.gov/sites/default/files/2015-12/documents/4435.pdf).
Наш двадцатилетний опыт экотоксикологических исследований свидетельствует о необходимости адаптации методик измерений, существующих в реестре Федерального информационного фонда по обеспечению единства измерений РФ, к конкретным видам загрязнений почв, поскольку чувствительность тест-культур заметно различается [16, 23].
Критерии подбора тест-видов в батареи включают, среди прочего, практичность, определяемую выполнимостью и рентабельностью испытания, приемлемость, включая такие аспекты, как стандартизация, воспроизводимость и статистическая достоверность метода испытаний, а также экологическое значение, включая чувствительность. Ван Гестель с соавт. [102] считают, что для получения сбалансированной батареи тестов необходимо обеспечивать, с одной стороны, репрезентативность исследуемой экосистемы или биотопов, а именно, включать организмы, представляющие разные функциональные группы, разные таксономические группы и разные пути воздействия; а, с другой, репрезентативность ответных реакций тест-видов, что означает их действительную актуальность для нормального функционирования популяций и сообществ (выживаемости, воспроизводства) [102].
Включение представителей основных трофических уровней (продуцентов, консументов и редуцентов) в батарею биотестов в определенной мере отражает экосистемный подход к оценке риска загрязнения и повышает надежность биодиагностики качества и устойчивого функционирования экосистем [16]. Такой подход, конечно, не заменит полевые испытания в природных экосистемах, а лишь дополняет их, причем позволяет получить сигналы о неблагополучии в опережающем режиме [2].
Молекулярные биомаркеры. В 1990 г. потребность в оценке путей воздействия химических веществ на живые организмы, интерес к изучению биодоступности поллютантов и необходимость ее оценки послужили стимулом к развитию новых методов, в которых чувствительные и потенциальные инструменты раннего предупреждения о негативной воздействии представляли биохимические тест-функции (биомаркеры) [66, 96]. Такие ранние биомаркерные эффекты наблюдаются у многих видов почвенных беспозвоночных (изопод) [50], а также у микроорганизмов. В частности, известны разнообразные мишени токсического действия органических и неорганических загрязнителей на грибные клетки: 1 – ингибируют ферментативную активность; 2 – вызывают окислительный стресс или взаимодействуют с системами, которые обычно защищают от вредного воздействия свободных радикалов, 3 – токсичные металлы вытесняют или заменяют ионы металлов в металлоферментах, которые вследствие этого инактивируется и 4 – вызывают нарушение целостности мембран [3, 34, 41].
Химические вещества, воздействуя на мембраны грибов – первый встречающих их физико-химический барьер, способны вызывать количественные и качественные изменения их липидного состава [14]. В частности, анализ липидных профилей грибов показал, что тяжелые металлы (ионы Ni, Cu, Zn) влияли на состав липидных компонентов и меняли текучесть мембран Curvularia lunata [82, 83]. Ионы Pb вызывали существенное повреждение цитоплазматической мембраны, снижая доли фосфатидилхолинов и ненасыщенных жирных кислот в составе фосфолипидов мицелия Paecilomyces marquandi [95].
Подобные биомаркеры могут действовать как чувствительный индикатор раннего предупреждения о возможных эффектах на более высоких уровнях биологической организации, а также могут предоставлять информацию о способе действия химического вещества.
Достижения молекулярной биологии способствуют разработке новых биосенсоров для исследования биодоступности и (эко)токсичности как тяжелых металлов, так и наночастиц на их основе. В наноэкотоксикологии уже применяются металлоспецифические бактериальные биосенсоры на основе рекомбинантных микроорганизмов в сочетании с набором мультитрофных биотестов на беспозвоночных, водорослях и бактериях [65].
Научный интерес привлекает сочетание различных факторов стресса, причем не только взаимодействие между различными химическими веществами (токсичность смесей), но и проявление токсичности при совместном действии химических агентов и другими факторами стресса [99, 103].
Экотоксикогеномика. Все больший интерес вызывают OMICS технологии как инструменты в оценке экологической значимости воздействия химического стресса, экологической уязвимости живых систем на генетическом уровне.
При сравнении различных биохимические тест-параметров [96] показано, что ответы на уровне генов (повреждения ДНК) были наиболее чувствительными к кадмию. Геномика, протеомика, транскриптомика значительно расширяют набор инструментов экотоксикологии. В настоящее время экотоксикогеномика рассматривается как инструмент, позволяющий лучше понять молекулярные механизмы действия химических веществ и механизмы формирования устойчивости к загрязнению, в частности, устойчивость к металлам или пестицидам [103].
Экотоксикогеномика также может помочь раскрыть механизмы воздействия различных частиц на организмы, как было показано на примере наночастиц металлов [65] или частиц микропластика [64]. Инструменты экотоксикогеномики могут быть полезны в эконанотоксикологии, но это требует еще значительных усилий и дальнейших исследований, прежде чем они могут быть применены в практике оценки экотоксикологического риска загрязнения почв.
Подходы к оценке экотоксичности почв. Воздействие в тест-системах измеряется посредством имитации возможных путей поступления вредного вещества в организм, поэтому основными средами для тестируемых объектов являются водные. А отсюда следует, что в качестве биологических чувствительных сенсоров чаще других выступают гидробионты – простейшие, водоросли, ракообразные и другие организмы или их элементы.
Изучение токсичности твердых компонентов окружающей среды (почвы, донные осадки, грунты, отходы и т. п.) по реакциям гидробионтов считают опосредованным способом воздействия на биосенсоры [17]. Этот подход получил название элюатного, поскольку при его реализации используют водные вытяжки (экстракты выщелачивания, элюаты твердых объектов). К сожалению, некоторые виды загрязнений проявляют гидрофобные свойства, накапливаясь в почве или отложениях. В таких случаях биотестирование в тест-системах, основанных на реакциях гидробионтов и анализе водных экстрактов, не всегда может отражать токсичность данного образца почвы или донных отложений.
Очевидно, что исследования почвы, как и других твердых субстратов, должны проводиться с помощью аборигенных тест-видов. Такой подход, в котором анализируется твердая масса при непосредственном контакте с почвообитащими организмами, получил название аппликатного, или контактного (иногда называемого субстратного), биотестирования [16].
Для оценки качества и токсичности целых образцов почв наиболее информативным подходом представляется использование беспозвоночных животных [59, 77–80] и высших растений, среди них немало традиционно применяющихся видов однодольных и двудольных растений [75, 76, 81, 84, 86, 88].
Референтная почва. Для стандартизации метода и облегчения сравнения результатов во всех стандартных испытаниях применяется референтный образец – стандартная почва (Reference/ Standard/Artificial soil) согласно протоколу ISO 11268-2. В ее составе торф (10%), каолиновая глина (20%) и кварцевый песок (70%) с добавлением некоторого количества CaCO3 (pH 6.0). По своим свойствам эта почва напоминает супесчаную. В некоторых руководствах допускается использование 5% торфа [101].
Использование референтной почвы важно для сравнения токсичности разных препаратов и прогноза их действия в природных почвах. Вместе с тем, представление о том, что тип почвы важен при определении токсичности химических веществ, сопровождалось растущим пониманием концепции биодоступности: только часть общего количества химического вещества в почве доступна для поглощения организмами и, следовательно, является действующим началом, актуальным для оценки рисков. Это было не раз продемонстрировано в экспериментальных работах [11, 16, 19, 89].
В почвах, различающихся по кислотности, содержанию глины и органических веществ, которые влияют на доступность свинца, одна и та же доза свинца (2000 мг Pb/кг почвы) в разной степени была губительной для дождевых червей Eisenia andrei [39]. Через 28 сут экспозиции в одних образцах все черви погибали, в других почвах смертность не наблюдалась, а в третьих погибала только часть особей. В дерново-подзолистой почве с двух полей, различающихся по содержанию органического углерода, при одинаковом уровне полиметаллического загрязнения комплексом солей свинца, меди и цинка тест-растения горчицы белой Sinapis alba резко различались по ростовым показателям и накоплению биомассы [19].
Тяжелые металлы по-разному влияют на накопление биомассы грибов и бактерий, а также на структуру микромицетных сообществ в почвах одного типа, различающихся по гумусированности. Под действием тяжелых металлов доли резистентных к химическому загрязнению меланизированных форм грибов, как правило, резистентных к неблагоприятным воздействиям [107], в сильногумусированной увеличивалась на 25.9%, а в слабогумусированной — на 45.7% [20].
Биотестирование экотоксикологического риска. В востребованности биотестов для экологического контроля и риска загрязнений можно выделить два направления – прогностическое и реальную биодиагностику – оценку почв в моменте.
Первый направлен на прогнозирование возможных эффектов химических веществ, чтобы регулировать их использование, контролировать и предотвращать их появление на рынке. С этой целью лабораторные биотесты проводятся для определения безопасных уровней конкретных химических веществ (обычно новых препаратов), поступающих в почвы и другие среды.
Второй подход – диагностический, он позволяет дать оценку реального экологического риска или ущерба, и в случае выявления токсического загрязнения принимать управленческие решения для восстановления нарушенных почв и снижения риска химического загрязнения.
Прогностический подход практически полностью основывается на принципах токсикологии человека и предполагает, что потенциальное действие химического вещества для экосистем можно оценить по его токсичности относительно стандартизованных тест-культур чувствительных видов в контролируемых лабораторных условиях. Чтобы получить правильное представление о потенциальной опасности химического вещества для экосистемы испытание проводится в серии тестов с набором видов. При определении безопасных уровней химикатов проводят оценки острой и хронической токсичности. В вариантах оценки токсичности острой в краткосрочных опытах оценивается выживаемость, при хронической в продолжительных экспериментах оценивается, как правило, плодовитость.
Определен набор токсикометрических показателей, с помощью которых количественно оценивается токсичность, отражающая концентрации действующего вещества, вызывающие смертность или отклонение от контроля значений любых других тест-функций на определенную величину за определенный срок экспозиции тест-организмов в образце исследуемого объекта. Токсичность количественно оценивается с помощью концентрационных параметров, таких как LC10 и LC50 (концентрации, вызывающие гибель соответственно 10 и 50% тест-организмов в выборках, подвергнутых воздействию), EC10 и EC50 (концентрации, вызывающие снижение на 10 и 50% соответственно, любых тест-функций, например, роста или количества произведенных молодых особей), а также NOEC и LOEC (концентрации, соответственно, не вызывающие наблюдаемые эффекты и вызывающие минимальные наблюдаемые эффекты) [25–29, 59–63].
Таким образом, при прогностическом подходе результаты тестов на токсичность используются для установления пороговых значений или безопасных уровней химических веществ в почве. Если есть возможность получить данные о токсичности в нескольких тест-системах, основанных на откликах разных видов (в идеале ≥8), то применяется статистический метод распределения видовой чувствительности (SSD – species sensitivity distribution) [22, 87].
Ранее в нашей работе получены критические значения ряда показателей загрязнения почвы (Со, Cr, Zn, U, Ra) с отвалов урановых шахт (пос. Каджи-Сай, Кыргызстан), обеспечивающие заданную допустимую вероятность экологического риска на основе метода SSD, примененного по отношению к токсичности выявленных в почве элементов для отдельных видов почвенных микромицетов [22].
Диагностический подход при использовании биотестирования дает эффективный инструмент для оценки степени токсичности и мониторинга экологического качества почв. Эти оценки имеют решающее значение для планирования и успешного проведения восстановительных мероприятий.
Таким образом, и для прогноза последствий применения конкретных веществ, и для диагностики качества почв используются тесты на токсичность, и в обоих случаях рекомендуется не один, а серия тестов.
Способы интеграции результатов биотестирования в экологическую оценку. В зависимости от типа воздействия на экосистемы в разной степени меняются токсичность, микробиологические, другие биологические, физико-химические показатели почвы. Известно немало индексов и систем оценок, в которых предлагается та или иная степень интеграции разных параметров экосистем [6, 7, 13, 30, 45]. Недавно в рамках концепции качества почвы (или здоровья почвы – SH) был представлен подход, который позиционируется как целостный, дающий представление о взаимодействии между основными компонентами почвенной системы [40]. Однако сами авторы констатируют, что целостный подход реализовать непросто, поскольку почва представляет собой сложную систему, в которой задействованы и взаимодействуют физические, химические и биологические характеристики и процессы. Подход в рамках концепции SH можно рассматривать как желаемый, но нереальный на данном этапе инструмент практического использования [40].
Использование биотических показателей в интегральной оценке почв заметно прогрессирует в последние десятилетия, целый ряд предложений по обобщению разнообразных индексов находит практическое применение.
Интегральный показатель биологического состояния почвы. Одним из примеров комплексной оценки может служить интегральный показатель биологического состояния почвы (ИПБС), предложенный в качестве критерия степени нарушения экологических функций почвы [6]. Он основан на балльной оценке вначале отдельных показателей состояния биоты для конкретного образца (или варианта опыта) относительно максимального наблюдаемого значения в серии образцов (или вариантов опыта), в затем из суммы относительных значений показателей (баллов) рассчитывается средний оценочный балл ряда изученных показателей. Интегральный показатель эколого-биологического состояния почвы конкретного рассчитывается по формуле:
Помимо индикационных показателей этот индекс может включать и оценку токсичности, то есть результаты биотестирования. При диагностике загрязнений авторы предлагают принимать значение каждого из показателей в незагрязненной почве за 100%, и по отношению к нему в процентах выражать значения этого же показателя в загрязненной почве. Принято считать, что если значения ИПБС уменьшились менее чем на 5%, то почва выполняет свои экологические функции нормально, при снижении значений ИПБС на 5–10% происходит нарушение информационных экофункций, на 10–25% – биохимических, физико-химических, химических и целостных, более чем на 25% – физических. К недостаткам такого подхода следует отнести отсутствие учета реальных изменений химических и физических свойств нарушенных почв.
Интегральный индекс экологического состояния экосистемы. Оригинальная методика используется для оценки экологического состояния пресноводных экосистем [1], которая может быть применима и к оценке почв. Интегральный индекс экологического состояния экосистемы (ИИЭС) представляет собой комбинацию двух составляющих, отражающих экологическое состояние по химическим и биологическим показателям. ИИЭС определяется как
где Вi и Нi – соответственно анализируемые биотические и гидрохимические показатели, выраженные в относительных единицах (баллах); Nb и Nh – количество отобранных показателей [1].Эта методика также основана на анализе безразмерных величин (баллов), которые устанавливаются на основании экспертных оценок. Кривая зависимости между антропогенной нагрузкой и ИИЭС по своему характеру является типичной S-образной функцией “доза-эффект” с характерной точкой перегиба, которая характеризует критический уровень антропогенной нагрузки [2, 22].
Индекс функционального биоразнообразия микробиома. Оригинальный способ оценки активности почвенного микробиома представлен в литературе интегральным показателем “здоровья почв”, основанным на параметрах функционального биоразнообразия (ФБР) почвенного микробного сообщества, вычисленный на основе спектров потребления субстратов, полученных методом мультисубстратного тестирования [4, 5].
Методология ТРИАД. Комплексную оценку состояния природных сред предполагает так называемый “триадный подход” (TRIAD approach), с 2017 г., включенный в систему международных стандартов – ISO 19204:2017 “Качество почвы. Методика оценки экологического риска локального загрязнения почвы (триадный подход к оценке качества почвы)” [43, 61]. Парадигма ТРИАД сформулирована Питером Чапменом применительно к оценке загрязнения донных отложений как алгоритм, позволяющий оценить потенциальные вредные воздействия на экосистему, учитывая одновременно концентрации химических веществ, биодоступность поллютантов и экотоксикологические параметры наблюдаемых экосистем [43, 44]. Он основан на методологии междисциплинарного уровня и учитывает данные химических (ИСх), биоиндикационных (ИСб) и токсикологических (ИСт) исследований [43, 47, 89–91] (рис. 1).
Рис. 1.
Графическое представление обобщенного индекса состояния почв – ИС (слева) и исследованные показатели в почве разных участков урбаноземов г. Кирова (справа) (по [13]). Обозначения: контроль: ИCх, ИБб, ИCт – индексы состояния почв, рассчитанные, соответственно, по химическим, биоиндикационным и токсикологическим показателям.
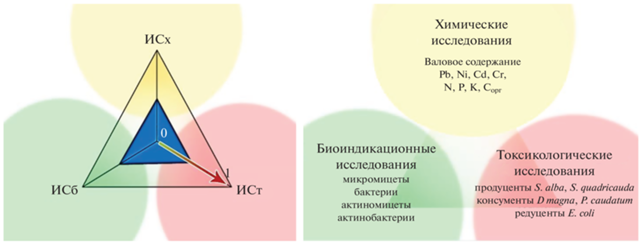
Расчет индексов состояния (ИСх, ИСт и ИСб) проходит в несколько этапов путем сравнения полученных значений для пробы с данными фона или предельно допустимыми концентрациями (ПДК) [47, 93].
При расчете индекса состояния почв по биоиндикационным показателям ИСб в каждом исследуемом образце сравнивают с таковыми в фоновом образце. Аналогичным образом проводят оценку токсикологических показателей для индекса состояния ИСт. Индексы состояния по токсикологическим и биоиндикационным параметрам рассчитывают на основе средних арифметических из всех измеренных показателей. Для всех составляющих применяют функции определенного вида для перехода к шкале, нормированной от 0 до 1 [13, 93].
Поскольку биотические (токсикологические и биоиндикационные) показатели являются наиболее информативными с точки зрения поддержания устойчивого состояния экосистем и выполнения почвами экологических функций, в частности, такой как среда обитания для живых организмов [16], то при расчете интегрального индекса состояния по триаде показателей – химическим, токсикологическим и биоиндикационным (ИСх, ИСт и ИСб, соответственно) предложено применять весовые коэффициенты, равные 1.5 и 2.0 [47]. Тогда формула для расчета интегрального индекса состояния (ИС) имеет вид:
В работе Пукальчик с соавт. [13] предложены градации ИС, диапазоны значений которых соответствует пятиуровневой шкале и которые характеризуют соответствующую степень антропогенной нагрузки на почвы и экологическое состояние почв [2, 30] (табл. 1).
Таблица 1.
Соответствие интегрального индекса состояния, определенного на основе методологии ТРИАД, категориям качества почв, состояния и нагрузки
| Значение ИС | Категория качества почв | Степень нагрузки | Состояние почвы |
|---|---|---|---|
| ИС = 0 | I | Допустимая | Фоновое |
| 0 < ИС < 0.30 | II | Низкая | Слабо нарушенное |
| 0.30 ≤ ИС < 0.50 | III | Средняя | Нарушенное |
| 0.50 ≤ ИС ≤ 0.79 | IV | Высокая | Сильно нарушенное |
| 0.79 ≤ ИС ≤ 1 | V | Очень высокая | Необратимо нарушенное |
Как видно из таблицы, полярные значения (0 и 1) соответствуют градациям “хорошо” и “плохо”, то есть чем больше индекс – тем больше отличие от фона и тем большую химическую нагрузку испытывают почвы.
Результаты биотестирования, обработанные по описанному выше алгоритму методологии ТРИАД, включены в интегральный индекс для оценки состояния почв на загрязненных и фоновых участках урбаноземов г. Кирова, для характеристики состояния почв горных экосистем Киргизии вблизи размещения радиоактивных отходов [98], для определения степени восстановления почв после применения ремедиационных препаратов [89, 90], для обоснования необходимости ремедиации [58] почв, загрязненных тяжелыми металлами на шести площадках в радиусе 2 км от заброшенной шахты (КНДР), в которой добывали золото (Au), свинец (Pb) и цинк (Zn). В отсутствие фоновых территорий аналогичные критерии и тесты были применены для оценки почв и сопоставления экологического риска загрязнения двух участков вблизи полигона отходов в Северной Испании, изученных выше и ниже по течению реки относительно места размещения свалки [55], а также во многих других работах [11, 32, 67, 70].
ЗАКЛЮЧЕНИЕ
Результат биотестирования представляет собой классическую экспериментальную методическую оценку токсикометрических показателей живых систем (целых организмов или их частей) после воздействия на них анализируемых объектов. Разработанная в сфере медицинской токсикологии методологическая основа биологического тестирования дала инструмент для лабораторной оценки токсичности не только в медицине и ветеринарии. Использование методов биотестирования давно уже распространилось за границы области, определяемой как сфера разработки нормативов содержания химических веществ в окружающей среде, первичной оценки свойств новых веществ. Биотестирование во всем мире используют для анализа экологического состояния природных сред, испытавших вредное воздействие техногенных факторов, а также при установлении степени опасности отходов производства и потребления [9, 25–29, 45].
Биотестирование дает информацию о неблагополучии для устойчивого функционирования экосистем в опережающем режиме, до проявления видимых изменений биоты в отличии от биоиндикации, методы которой фиксируют в природных условиях уже проявившиеся под воздействием факторов изменения в состоянии биоценозов.
Со времени публикации первых схем и инструментов оценки и мониторинга качества почвы в 1990-х гг. появилось более 60-ти национальных и региональных подходов, разработанных преимущественно в Северной Америке, Европе и Китае. Основное внимание в этих подходах уделено характеристике плодородия почв, которую рассматривают как их способность обеспечивать питательными элементами и водой растения, а также отсутствие токсичных веществ (www.fao.org). В связи с этим некоторые авторы считают необходимым дополнить характеристику качества почвы, оптимальной для роста сельскохозяйственных культур, показателями биоразнообразия и функциональной активности почвенной микробиоты [7, 20]. Так, микробная биомасса почвы и ее дыхательная активность могут в определенной степени служить показателями ее изменения при разных воздействиях [36, 60], а значит – характеризовать ее здоровье. Эти показатели включены в программы экологического мониторинга почв и наземных экосистем ряда европейских стран [7, 36].
В настоящее время практическая востребованность методов биотестирования отражена в современной нормативно-правовой документации соответствующих регулирующих органов. Аттестация методов измерения токсичности, которая обеспечивает получение результатов с установленными показателями точности, стала возможной во многом благодаря введению строгой процедуры стандартизации методов и тест-организмов (ГОСТ Р 8.563–2009). В нашей стране в разных сферах производственной деятельности (сельскохозяйственной, медицинской и природоохранной) используются наборы биотестов, регламентированные к применению для оценки качества почв приказами соответствующих министерств, методическими указаниями и руководствами.
Для создания стандартной методики биотестирования необходимо пройти строгую процедуру, которая включает регламентацию видовой принадлежности тест-организма, обеспечение определенного уровня чувствительности тест-культуры, создание оптимальных условий для поддержания тест-культуры в регламентированных методикой условиях. Хотя первые методики биотестирования были аттестованы сравнительно недавно (в 90-х годах прошлого столетия) к настоящему времени уже значительное количество стандартных биотестов внесено в федеральный реестр как рекомендованные для практического экологического контроля окружающей среды. Подробнее с ними можно познакомиться на сайте https://fgis.gost.ru/fundmetrology/registry/16. Эти документы являются практическими руководствами, направленными на внедрение в лабораторные исследования методов экотоксикологического контроля.
Оценка токсичности – важная, но не единственная составляющая интегральной оценки экологического качества почв. Оптимальным способом интеграции результатов биотестирования в общую оценку почв представляется методология ТРИАД, основанная на учете данных количественного химического анализа содержания загрязняющих веществ, результатов биоиндикации – наблюдений за состоянием представителей биоты в природных условиях (in situ) и показателей токсичности почв по отношению к стандартизованным тест-культурам в лабораторных условиях (ex situ). Этот междисциплинарный вариант интеграции данных не лишен спорных моментов в алгоритме расчетов (в частности, на этапе присвоения так называемых “весовых коэффициентов” биотическим показателям [47]), однако методология ТРИАД за два десятка лет с момента выхода работы Чапмена [44] прошла широкую апробацию во многих странах на почвах с разным характером и уровнем загрязнений. Реализация ее в форме международного стандарта ISO 19204-2017 [61] дает действенный инструмент для оценки и сравнения экологического качества почв и прогнозирования эффектов химических веществ, намеренно или ненамеренно попадающих в почвы.
Список литературы
Биоиндикация экологического состояния равнинных рек / Под ред. О.В. Бухарина, Г.С. Розенберга. М.: Наука, 2007. 408 с.
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локальный уровень). Екатеринбург: УИФ Наука, 1994. 280 с.
Горбунова Е.А., Терехова В.А. Тяжелые металлы как фактор стресса для грибов: проявление их действия на клеточном и организменном уровнях // Микология и фитопатология. 1995. Т. 29. № 4. С. 63–69.
Горленко М.В., Кожевин П.А. Мультисубстратное тестирование природных микробных сообществ. М.: МАКС Пресс, 2005. 88 с.
Горленко М.В., Якименко О.С., Голиченков М.В., Костина Н.В. Функциональное биоразнообразие почвенных микробных сообществ при внесении органических субстратов различной природы // Вестник Моск. ун-та. Сер. 17, почвоведение. 2012. № 2. С. 20–27.
Казеев К.Ш., Колесников С.И., Вальков В.Ф. Биологическая диагностика и индикация почв: методология и методы исследований. Ростов-на-Дону, 2003. 204 с.
Кирюшин В.И. Методология комплексной оценки сельскохозяйственных земель // Почвоведение. 2020. № 7. С. 871–879. https://doi.org/10.31857/S0032180X20070060
Копцик Г.Н. Современные подходы к ремедиации почв, загрязненных тяжелыми металлами (обзор литературы) // Почвоведение. 2014. № 7. С. 851–868. https://doi.org/10.31857/S0032180X21040092
Критерии отнесения отходов к I–V классам опасности по степени негативного воздействия на окружающую среду. Утв. приказом Министерства природных ресурсов и экологии РФ от 4 декабря 2014 г. № 536.
Левич А.П. Биотическая концепция контроля природной среды // Доклады Академии наук. 1994. Т. 337. № 2. С. 280–282.
Маячкина Н.В., Чугунова М.В. Особенности биотестирования почв с целью их экотоксикологической оценки // Вестник Нижегородского ун-та им. Н.И. Лобачевского. 2009. № 1. С. 84–93.
Правила охраны поверхностных вод Госкомприроды СССР. От 21.02.91.
Пукальчик М.А., Терехова В.А., Якименко О.С., Кыдраливева К.А., Акулова М.И. Метод ТРИАД для оценки ремедиационного действия гуминовых препаратов на урбаноземы // Почвоведение. 2015. № 6. С. 751–760.
Розенцвет О.А., Федосеева Е.В., Терехова В.А. Липидные биомаркеры в экологической оценке почвенной биоты: анализ жирных кислот (обзор) // Успехи современной биологии. 2019. Т. 139. № 2. С. 161–177. https://doi.org/10.1134/S0042132419020078
Строганов Н.С. Методика определения токсичности водной среды. М.: Наука, 1971. С. 14.
Терехова В.А. Биотестирование почв: подходы и проблемы // Почвоведение. 2011. № 2. С. 190–198.
Терехова В.А. Значение микологических исследований для контроля качества почв // Почвоведение. 2007. № 5. С. 643–648.
Терехова В.А. Микромицеты в экологической оценке водных и наземных экосистем. М.: Наука, 2007. 215 с.
Терехова В.А., Прудникова Е.В., Кирюшина А.П., Карпухин М.М., Плеханова И.О., Якименко О.С. Фитотоксичность тяжелых металлов в дерново-подзолистых почвах разной степени окультуренности // Почвоведение. 2021. № 6. С. 757–768. https://doi.org/10.31857/s0032180x21060137
Терехова В.А., Федосеева Е.В., Бельфег Ю.В., Кирюшина А.П., Рычагова А.Г., Верховцева Н.В. Структура микробных комплексов при моделировании полиметаллического загрязнения и ремедиации агродерново-подзолистых почв // Вестник Моск. ун-та. Сер. 17, почвоведение. 2021. № 1. С. 38–45.
Терехова В.А., Швед Л.Г. Изменение морфо-биохимических признаков водных грибов под воздействием тяжелых металлов // Экология. 1994. № 6. С. 77–79.
Терехова В.А., Шитиков В.К., Иванова А.Е., Кыдралиева К.А. Оценка экологического риска техногенного загрязнения почвы на основе статистического распределения встречаемости видов микромицетов // Экология. 2017. № 5. С. 339–346.
Тимофеев М.А., Терехова В.А., Кожевин П.А. Биотестирование почв при загрязнении кадмием // Вестник Моск. ун-та. Сер. 17, почвоведение. 2010. № 4. С. 44–47.
Филенко О.Ф., Исакова Е.Ф., Черномордина А.В. Особенности действия бихромата калия на генерации и модельные популяции низших ракообразных. Актуальные проблемы водной токсикологии. Борок: Институт биологии внутренних вод РАН, 2004. С. 176–194.
ФР 1.39.2007.03222 Биологические методы контроля. Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости дафний. М.: Акварос, 2007. 51 с.
ФР.1.31.2020.38716 Биологические методы контроля. Методика измерений биологической активности гуминовых веществ методами фитотестирования “Фитоскан – 2”. М.: Изд-во Моск. ун-та, 2008. 25 с.
ФР.1.39.2006.02506 ПНД Ф 14.1:2:3.13-06 (16.1:2.3:3.10-06) Методика определения токсичности отходов, почв, осадков сточных, поверхностных и грунтовых вод методом биотестирования с использованием равноресничных инфузорий Paramecium caudatum Ehrenberg. М.: Изд-во Моск. ун-та, 2006. 30 с.
ФР.1.39.2007.03221 Биологические методы контроля. Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости цериодафний. М.: Акварос, 2007. 56 с.
ФР.1.39.2007.03223 Биологические методы контроля. Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по изменению уровня флуоресценции хлорофилла и численности клеток водорослей. М.: Акварос, 2007. 41 с.
Яковлев А.С., Макаров О.А. Экологическая оценка, экологическое нормирование и рекультивация земель: основные термины и определения // Использование и охрана природных ресурсов в России. 2006. № 3(87). С. 64–70.
Acosta Rodríguez I., Martínez-Juárez V.M., Cárdenas-González J.F., Moctezuma-Zárate M.D.G. Biosorption of Arsenic(III) from Aqueous Solutions by Modified Fungal Biomass of Paecilomyces sp. // Bioinorganic chemistry and applications. 2013. https://doi.org/10.1155/2013/376780
Aljahdali M.O., Alhassan A.B. Ecological risk assessment of heavy metal contamination in mangrove habitats, using biochemical markers and pollution indices: a case study of Avicennia marina L. in the Rabigh lagoon, Red Sea // Saudi J. Biol. Sci. 2020. V. 27. P. 1174–1184. https://doi.org/10.1016/j.sjbs.2020.02.004
Andrews S.S., Karlen D.L., Mitchell J.P. A comparison of soil quality indexing methods for vegetable production systems in Northern California // Agric. Ecosyst. Environ. 2002. V. 90. № 1. P. 25–45. https://doi.org/10.1016/S0167-8809(01)00174-8
Baldrian P. Effect of heavy metals on saprotrophic soil fungi. Soil Heavy Metals // Soil Biology. 2010. V. 19. P. 263–281. https://doi.org/10.1007/978-3-642-02436-8
Barman A., Gohain D., Bora U., Tamuli R. Phospholipases play multiple cellular roles including growth, stress tolerance, sexual development, and virulence in fungi // Microbiol. Res. 2018. V. 209. December 2017. P. 55–69. https://doi.org/10.1016/j.micres.2017.12.012
Blagodatskaya E., Kuzyakov Y. Active microorganisms in soil: critical review of estimation criteria and approaches // Soil Biology and Biochemistry. 2013. V. 67. P. 192–211. https://doi.org/10.1016/j.soilbio.2013.08.024
Bondarenko L., Kahru A., Terekhova V., Dzhardimalieva G., Uchanov P., Kydralieva K. Effects of humic acids on the ecotoxicity of Fe3O4 nanoparticles and Fe-ions: Impact of oxidation and aging // Nanomaterials. 2020. V. 10. № 10. P. 2011. https://doi.org/10.3390/nano10102011
Brack W., Altenburger R., Ensenbach U., Moder M., Segne H., Schuurmann G. Bioassay-directed identification of organic toxicants in river sediment in the industrial region of Bitterfeld- A contribution to Hazard Assessment // Arch. Environ. Contam. Toxicol. 1999. № 37. P. 164–174.
Bradham K.D., Dayton E.A., Basta N.T., Schroder J., Payton M., Lanno R.P. Effect of soil properties on lead bioavailability and toxicity to earthworms // Environmental Toxicology and Chemistry: An International J. 2006. V. 25. № 3. P. 769–775. https://doi.org/10.1897/04-552R.1
Bünemann E.K., Bongiorno G., Bai Z., Creamer R.E., De Deyn G., de Goede R., Brussaard L. Soil quality – A critical review // Soil Biology and Biochemistry. 2018. № 120. P. 105–125. https://doi.org/10.1016/j.soilbio.2018.01.030
Calonne M., Fontaine J., Debiane D., Laruelle F., Grandmougin-Ferjani A., Lounès-Hadj Sahraoui A. The arbuscular mycorrhizal Rhizophagus irregularis activates storage lipid biosynthesis to cope with the benzo[a]pyrene oxidative stress // Phytochemistry. 2014. V. 97. P. 30–37. https://doi.org/10.1016/j.phytochem.2013.10.014
Carter M.R., Gregorich E.G., Anderson D.W., Doran J.W., Janzen H.H., Pierce F.J. Concepts of soil quality and their significance // Developments in Soil Science. Elsevier, 1997. P. 1–19.
Chapman P.A. Decision making framework for sediment assessment developed for the Great Lakes // Human and Ecological Risk Assessment. 2005. V. 8. № 7. P. 1641–1655. https://doi.org/10.1080/20028091057538
Chapman P.M. The sediment quality Triad approach to determining pollution-induced degradation // Sci. Total Environ. 1990. V. 97. P. 815–825. https://doi.org/10.1016/0048-9697(90)90277-2
Chapman P.M., McDonald B.G., Lawrence G.S. Weight-of-Evidence issues and frameworks for sediment quality (and other) assessments // Human and Ecological Risk Assessment. 2002. V. 8. № 7. P. 1489–1515. https://doi.org/10.1080/20028091057457
Chodak M., Klimek B., Azarbad H., Jaźwa M. Functional diversity of soil microbial communities under Scot’s pine, Norway spruce, silver birch and mixed boreal forests // Pedobiologia. 2015. V. 58. № 2–3. P. 81–88. https://doi.org/10.1016/j.pedobi.2015.04.002
Dagnino A.S., Sforzini A., Dondero F., Fenoglio S., Bona E., Jens J. A weight-of-evidence approach for the integration of environmental “triad” data to assess ecological risk and biological vulnerability // Integrated Environmental Assessment and Management. 2008. V. 4. № 3. P. 314–326.
Davidson D.A. Soil quality assessment: recent advances and controversies // Progress in Environmental Science. 2000. V. 2. P. 342–350.
Doran J.W., Zeiss M.R. Soil health and sustainability: managing the biotic component of soil quality// Appl. Soil Ecol. 2000. V. 15. № 1. P. 3–11.
Drobne D., Jemec A., Pipan Tkalec Z. In vivo screening to determine hazards of nanoparticles: Nanosized TiO2 // Environmental Pollution. 2009. V. 157. P. 1157–1164. https://doi.org/10.1016/j.envpol.2008.10.018
Edwards P.J. Soil pollutants and soil animals // Scientific American 1969. V. 220. P. 88–99. https://doi.org/10/1038/scientificamerican0469-88
Fedoseeva E.V., Tereshina V.M., Danilova O.A., Ianutsevich E.A., Yakimenko O.S., Terekhova V.A. Effect of humic acid on the composition of osmolytes and lipids in a melanin-containing phytopathogenic fungus Alternaria alternata // Environmental Research. 2021. V. 193. P. 110395. https://doi.org/10.1016/j.envres.2020.110395
Fox C.J.S. The effect of five herbicides щи the numbers of certain invertebrates on the number of grassland soil // Canadian J. Plant Science. 1964. V. 44. № 5. P. 405–409. https://doi.org/10.4141/cjps64-080
Grenni P., Caracciolo A.B., Patrolecco L. et al. A bioassay battery for the ecotoxicity assessment of soils conditioned with two different commercial foaming products // Ecotoxicology and Environmental Safety. 2018. V. 148. P. 1067–1077. https://doi.org/10.1016/j.ecoenv.2017.11.071
Gutiérrez L., Garbisu C., Ciprián E., Becerril J.M., Soto M., Etxebarria J., Epelde L. Application of ecological risk assessment based on a novel TRIAD-tiered approach to contaminated soil surrounding a closed non-sealed landfill // Sci. Total Environ. 2015. V. 514. P. 49–59. https://doi.org/10.1016/j.scitotenv.2015.01.103
Hagner M., Romantschuk M., Penttinen O.P., Egfors A., Marchand C., Augustsson A. Assessing toxicity of metal contaminated soil from glassworks sites with a battery of biotests // Sci. Total Environ. 2018. V. 613–614. P. 30–38. https://doi.org/10.1016/j.scitotenv.2017.08.121
Hartwell S. Demonstration of a toxicological risk ranking method to correlate measures of ambient toxicity and fish community diversity // Environ. Toxicol. Chem. 1997. V. 16. № 2. P. 361–371.
Hong Y.K., Yoon D.H., Kim J.W., Chae M.J., Ko B.K., Kim S.C. Ecological risk assessment of heavy metal-contaminated soil using the triad approach // J. Soils and Sediments. 2021. V. 21(8). P. 2732–2743.
ISO 11268-2:2012 Soil quality – Effects of pollutants on earthworms – Part 2: Determination of effects on reproduction of Eisenia fetida / Eisenia Andrei. 2018.
ISO 16072:2002 Soil quality – Laboratory methods for determination of microbial soil respiration. 2016.
ISO 19204:2017 Soil quality – Procedure for site-specific ecological risk assessment of soil contamination (soil quality TRIAD approach) 2017 / Качество почвы. Методика оценки экологического риска локального загрязнения почвы (триадный подход к оценке качества почвы).
ISO Soil quality – Avoidance test for determining the quality of soils and effects of chemicals on behavior – Part 1: Test with earthworms (Eisenia fetida and Eisenia andrei). ISO 17512-1. International Standardization Organization, Geneva. 2008.
ISO Soil quality – Guidance on the choice and evaluation of bioassays for ecotoxicological characterization of soils and soil materials. ISO 17616. International Standardization Organization, Geneva. 2008.
Jiang X., Chen H., Liao Y., Ye Z., Li M., Klobučar G. Ecotoxicity and genotoxicity of polystyrene microplastics on higher plant Vicia faba // Environ. Pollut. 2019. V. 250. P. 831–838.
Kahru A., Dubourguier H.-C., Blinova I., Ivask A., Kasemets K. Biotests and Biosensors for Ecotoxicology of Metal Oxide Nanoparticles: A Minireview // Sensors. 2008. V. 8. P. 5153–5170. https://doi.org/10.3390/s8085153
Kammenga J.E., Dallinger R., Donker M.H., Köhler H.-R., Simonsen V., Triebskorn R., Weeks J.M. Biomarkers in terrestrial invertebrates for ecotoxicological soil risk assessment // Rev. Environ. Contam. Toxicol. 2000. V. 164. P. 93–147.
Karjalainen A.M., Kilpi-Koski J., Väisänen A.O., Penttinen S., Van Gestel C.A., Penttinen O.P. Ecological risks of an old wood impregnation mill: application of the triad approach // Integrated Environmental Assessment and Management: An International J. 2009. V. 5. № 3. P. 379–389. https://doi.org/10.1897/IEAM_2008-072.1
Klimek B.M., Niklińska M., Jaźwa A., Tarasek I., Tekielak Ł., Musielok Ł. Covariation of soil bacteria functional diversity and vegetation diversity along an altitudinal climatic gradient in the Western Carpathians // Pedobiologia. 2015. V. 58(2–3). P. 105–112. https://doi.org/10.1016/j.pedobi.2015.04.005
Klimek B., Sitarz A., Choczyński M., Niklińska M. The effects of heavy metals and total petroleum hydrocarbons on soil bacterial activity and functional diversity in the Upper Silesia industrial region (Poland) // Water, Air, & Soil Pollution. 2016. V. 227. № 8. P. 1–9. https://link.springer.com/article/10.1007/s11270-016-2966-0
Klimkowicz–Pawlas A., Maliszewska–Kordybach B., Smreczak B. Triad-based screening risk assessment of the agricultural area exposed to the long-term PAHs contamination // Environ. Geochem. Health. 2019. V. 41. P. 1369–1385. https://link.springer.com/article/10.1007/s10653-018-0220-y
Kydralieva K., Bondarenko L., Terekhova V., Chistyakova N., Patsaeva S., Rabinskiy L., Dzhardimalieva G. Characterization and bioactivity of magnetite-based nanocomposites // Mater. Today: Proceedings. 2021. № 34. Р. 317–321. https://doi.org/10.1016/j.matpr.2020.05.363
Lors C., Ponge J.F., Martínez Aldaya M., Damidot D. Comparison of solid and liquid-phase bioassays using ecoscores to assess contaminated soils // Environ. Pollut. 2011. V. 159. P. 2974–2981. https://doi.org/10.1016/j.envpol.2011.04.028
Manzo S., Schiavo S., Aleksi P., Tabaku A. Application of a test battery integrated index for a first screening of the ecotoxicological threat posed by ports and harbors in the southern Adriatic Sea (Italy) // Environ. Monit. Assess. 2014. V. 186. № 11. P. 7127–7139. https://link.springer.com/article/10.1007/s10661-014-3915-2
Niklińska M., Klimek B. Effect of temperature on the respiration rate of forest soil organic layer along an elevation gradient in the Polish Carpathians// Biology and Fertility of Soils. 2007. V. 43. № 5. P. 511–518.
Nikolaeva O., Terekhova V. Improvement of laboratory phytotest for the ecological evaluation of soils // Eurasian Soil Science. 2017. V. 50. № 9. P. 1105–1114. https://link.springer.com/article/10.1134/S1064229317090058
OCSPP 850.4230: Early Seedling Growth Toxicity Test, EPA 712-C-010. US Environmental Protection Agency, Washington, 2012.
OECD Guidelines for the testing of Chemicals 232. Collembolan reproduction test in soil. Organisation for Economic Co-operation and Development, Paris, 2009.
OECD Guidelines for the Testing of Chemicals No. 207. Earthworm, Acute toxicity tests. Organisation for Economic Co-operation and Development, Paris, 1984.
OECD Guidelines for the Testing of Chemicals No. 220. Enchytraeid reproduction test. Organisation for Economic Co-operation and Development, Paris, 2004.
OECD Guidelines for the Testing of Chemicals No. 222. Earthworm reproduction test (Eisenia fetida / Eisenia andrei). Organisation for Economic Co-operation and Development, Paris, 2004.
OECD, Test No. 208: Terrestrial Plant Test: Seedling Emergence and Seedling Growth Test. OECD Guidelines for the Testing of Chemicals: Section 2. OECD, Paris, 2006.
Paraszkiewicz K., Bernat P., Długoński J. Effect of nickel, copper, and zinc on emulsifier production and saturation of cellular fatty acids in the filamentous fungus Curvularia lunata // Int. Biodeterior. Biodegradation. 2009. V. 63. № 1. P. 100–105. https://doi.org/10.1016/j.ibiod.2008.03.015
Paraszkiewicz K., Bernat P., Naliwajski M., Długoński J. Lipid peroxidation in the fungus Curvularia lunata exposed to nickel // Arch. Microbiol. 2010. V. 192. № 2. P. 135–141. https://doi.org/10.1007/s00203-009-0542-3
Persoone G., Blahoslav B., Blinova I. et al. A practical and user-friendly toxicity classification system with microbiotests for natural waters and wastewaters // Environ Toxicol. 2003. V. 18. № 6. P. 395–402. https://doi.org/10.1002/tox.10141
Persoone G., Janssen C., Coen W.De., New Microbiotests for Routine Toxicity Screening and Biomonitoring. Kluwer, N.Y., 2000.
Phytotoxkit. Seed germination and early growth microbiotest with higher plants. Standard Operational Procedure. Nazareth, Belgium: MicroBioTests Inc., 2004. 24 p.
Posthuma L., Suter G.W., Traas T. (Eds.) Species Sensitivity Distributions in Ecotoxicology. Lewis Publishers, Boca Raton, USA, 2002.
Prudnikova E.V., Neaman A., Terekhova V.A., Karpukhin M.M., Vorobeichik E.L., Smorkalov I.A., Dovletyarova E.A., Navarro-Villarroel K., Ginocchio R., Peñaloza P. Root elongation method for the quality assessment of metal-polluted soils: Whole soil or soil-water extract? // J. Plant Nutrition and Soil Science. 2020. V. 20. P. 2294–2303. https://doi.org/10.1007/s42729-020-00295-x
Pukalchik M.A., Terekhova V.A., Karpuchin M.M., Vavilova V.M. Comparison of eluate and direct soil bioassay methods of soil assessment in the case of contamination with heavy metals // Eurasian Soil Science. 2019. V. 52. № 4. P. 507–514. https://doi.org/10.1007/s11368-017-1841-y
Pukalchik M., Mercl F., Panova M., Břendová K., Terekhova V., Tlustoš P. The improvement of multi-contaminated sandy loam soil chemical and biological properties by the biochar, wood ash, and humic substances amendments // Environmental Pollution. 2017. V. 229. P. 516–524. https://doi.org/10.1016/j.envpol.2017.06.021
Ribé V., Aulenius E., Nehrenheim E., Martell U., Odlare M. Applying the Triad method in a risk assessment of a former surface treatment and metal industry site // J. hazardous Materials. 2012. V. 207–208. P. 15–20. https://doi.org/10.1016/j.jhazmat.2011.07.120
Ritz K., Black H.I., Campbel C.D., Harris J.A., Wood C. Selecting biological indica- tors for monitoring soils: a framework for balancing scientific and technical opinion to assist policy development // Ecol. Indic. 2009. V. 9. № 6. P. 1212–1221. https://doi.org/10.1016/j.ecolind.2009.02.009
Semenzin E., Critto A., Rutgers M., Marcomini A. Integration of bioavailability,ecology and ecotoxicology by three lines of evidence into ecological risk indexes for contaminated soil assessment // Sci. Total Environ. 2008. № 389. P. 71–86. https://doi.org/10.1016/j.scitotenv.2007.08.032
Sforzini S., Oliveri L., Chinaglia S., Viarengo A. Application of Biotests for the Determination of Soil Ecotoxicity after Exposure to Biodegradable Plastics // Front. Environ. Sci. 2016. V. 4. P. 68. https://doi.org/10.3389/fenvs.2016.00068
Słaba M., Bernat P., Różalska S., Nykiel J., Długoński J. Comparative study of metal induced phospholipid modifications in the heavy metal tolerant filamentous fungus Paecilomyces marquandii and implications for the fungal membrane integrity // Acta Biochimica Polonica. 2013. V. 60. № 4. https://doi.org/10.1016/j.biortech.2015.08.045
Spurgeon D.J., Ricketts H., Svendsen C., Morgan A.J., Kille P. Hierarchical responses of soil invertebrates (earthworms) to toxic metals stress // Environmental Science and Technology 2005. V. 39. P. 5327–5334. https://doi.org/10.1021/es050033k
Terekhova V.A., Pukalchik M.A., Yakovlev A.S. The TRIAD approach to ecological assessment of urban soils // Eurasian Soil Science. 2014. V. 47. № 9. P. 952–958. https://doi.org/10.1134/S1064229314090129
Totubaeva N., Tokpaeva Z., Kojobaev K., Usubalieva A., Terekhova V. Ecological assessment of technogenically disturbed soils of the mountain ecosystems of Kyrgyz Republic based on the TRIAD method // Polish J. Env studies, 2022.
Valko M., Morris H., Cronin M.T.D. Metals, toxicity and oxidative stress // Current medicinal chemistry. 2005. V. 12. № 10. P. 1161–1208. https://doi.org/10.2174/0929867053764635
Van Gestel C.A.M. Physico-chemical and biological parameters determine metal bioavailability in soils // Science of the Total Environment. 2008. V. 406. P. 385–395. https://doi.org/10.1016/j.scitotenv.2008.05.050
Van Gestel C.A.M. Soil ecotoxicology: state of the art and future directions. Advances in Terrestrial Isopod Biology // ZooKeys. 2012. V. 176. P. 275–296. https://doi.org/10.3897/zookeys.176.2275
Van Gestel C.A.M., Léon C.D., Van Straalen N.M. Evaluation of soil fauna ecotoxicity tests regarding their use in risk assessment // Soil Ecotoxicology. CRC Press, Inc., Boca Raton. 1997. P. 291–317.
Van Straalen N.M. Peer reviewed: ecotoxicology becomes stress ecology // Environmental Science & Technology. 2003. V. 37. № 17. P. 324A–330A. https://pubs.acs.org/doi/pdf/10.1021/es0325720
Van Straalen N.M., Feder M.E. Ecological and evolutionary functional genomics-how can it contribute to the risk assessment of chemicals? // Environmental Science & Technology 2012. V. 46. P. 3–9. https://doi.org/10.1021/es2034153
Van Straalen N.M., Janssens T.K.S., Roelofs D. Micro-evolution of toxicant tolerance: from single genes to the genome’s tangled bank // Ecotoxicology 2011. V. 20. P. 574–579. https://doi.org/10.1007/ s10646-011-0631-3
Wieczerzak M., Namieśnik J., Kudłak B. Bioassays as one of the Green Chemistry tools for assessing environmental quality: A review // Environment International. 2016. V. 94. P. 341–361. https://doi.org/10.1016/j.envint.2016.05.017
Zhdanova N.N., Vasilevskaya A.I., Artyshkova L.V. et al. Changes in micromycete communities in soil in response to pollution by long-lived radionuclides emitted in the Chernobyl accident // Mycological Research. 1994. V. 98. № 7. P. 789–795. https://doi.org/10.1016/S0953-7562(09)81057-5
Дополнительные материалы отсутствуют.


