Почвоведение, 2022, № 5, стр. 642-654
Разработка микробного консорциума для биоремедиации нефтезагрязненных почв Среднего Приобья
А. А. Ветрова a, *, С. Я. Трофимов b, Р. Р. Кинжаев b, Н. А. Аветов b, А. В. Арзамазова b, И. Ф. Пунтус a, О. И. Сазонова a, С. Л. Соколов a, Р. А. Стрелецкий b, К. В. Петриков a, Я. А. Делеган a, В. А. Самойленко a, А. Е. Филонов a
a Федеральный исследовательский центр “Пущинский научный центр биологических исследований
Российской академии наук”, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН,
просп. Науки
142290 Московская обл., Пущино, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: phdvetrova@gmail.com
Поступила в редакцию 01.11.2021
После доработки 22.11.2021
Принята к публикации 30.12.2021
- EDN: LQRTDQ
- DOI: 10.31857/S0032180X22050100
Аннотация
Из нефтезагрязненных образцов почв Среднего Приобья выделены микроорганизмы – деструкторы углеводородов, идентифицированные как представители родов Pseudomonas, Rhodococcus, Acinetobacter, Kocuria, Raoultella и Candida. Проведен их скрининг на способность к деградации различных классов углеводородов в широком температурном диапазоне (6–37°C), в кислых средах (до рН 4) и при повышенной засоленности (до 3%), на способность к продукции биоПАВ и на наличие генов, кодирующих ключевые ферменты деградации углеводородов. Составлен микробный консорциум в качестве основы биопрепарата для биоремедиации нефтезагрязненных почв Среднего Приобья, включающий штаммы Candida fluviatilis 24р-51, Rhodococcus erythropolis 24-44, Acinetobacter calcoaceticus 7-43 и Pseudomonas extremaustralis 7-31. Для данных микроорганизмов были подобраны режимы культивирования и лиофилизации биомассы. В лабораторных модельных системах оценена эффективность деградации углеводородов нефти разработанным микробным консорциумом. Степень деградации нефти микробным консорциумом в жидкой минеральной среде составила 56%, в модельном грунте – 22% за 10 сут при 24°C.
ВВЕДЕНИЕ
При интенсивной разработке и эксплуатации нефтяных месторождений окружающая природная среда испытывает существенную техногенную нагрузку, часто приводящую к загрязнению и деградации экосистем [17]. Большинство нефтяных месторождений Западной Сибири располагается в географическом районе Среднего Приобья (Ханты-Мансийский автономный округ – Югра) на севере таежной зоны Западной Сибири, отличающейся высокой степенью заболоченности [2, 13]. Данные территории находятся под постоянным негативным воздействием процессов нефтезагрязнения и техногенного засоления почв. Существующие физические, химические и термические методы очистки не позволяют провести полную рекультивацию нефтезагрязненных территорий. Биоремедиация является экологически безопасной и экономически выгодной технологией для ликвидации и минимизации последствий разливов нефти [35]. Разложение углеводородов в почве благодаря метаболической активности микроорганизмов определяется рядом экологических и биологических факторов, варьирующихся от места к месту, таких как pH почвы, температура, доступность кислорода и содержание питательных веществ, рост и выживаемость углеводородокисляющих микроорганизмов, а также биодоступность углеводородов [32]. На сегодняшний день имеется много данных о способности бактерий и грибов, выделенных из различных биотопов, к окислению углеводородов нефти [19, 23, 29, 39, 54]. Основными критериями для отбора перспективных углеводородокисляющих микроорганизмов при разработке микробных консорциумов для очистки окружающей среды от нефти и нефтепродуктов являются: способность к деградации разных классов углеводородов, наличие плазмид биодеградации, устойчивость к низким значениям рН и присутствию соли (хлорида натрия), способность к синтезу биологических поверхностно-активных веществ (биоПАВ) и окисление углеводородов в широком температурном диапазоне [3, 25, 36, 43, 49].
Целью данной работы была разработка микробного консорциума, перспективного для очистки нефтезагрязненных территорий Среднего Приобья.
ОБЪЕКТЫ И МЕТОДЫ
Пробоотбор и характеристика образцов. Отбор образцов осуществлялся на торфяных олиготрофных, мезотрофных и пойменных болотах, а также в заболоченном лесу из профиля оторфованного глеезема. В системе WRB почвы олиготрофных и мезотрофных болот определяются как Hyperdystric Histosols, почвы пойменного болота – Histic Fluvisols, а оторфованные глееземы – Histic Gleysols. Для каждого типа биогеоценоза образцы почв были отобраны на нескольких нефтезагрязненных участках нерекультивированных почв Среднего Приобья (различающихся степенью и возрастом загрязнения, наличием/отсутствием признаков засоления), и их фоновых (чистых) аналогах (подробное описание образцов представлено в статье [14]).
Содержание нефтепродуктов определяли методом ИК-спектрометрии [8]. Интенсивность эмиссии СО2 оценивали по количеству выделившегося СО2 из влажных образцов при комнатной температуре, отнесенного к массе сухой почвы [10]. Кислотность почвы определяли согласно ГОСТ 26423-85.
Среды и условия культивирования микроорганизмов. В работе использовали полноценную среду Лурия–Бертани [46] и минеральную среду Эванса [26]. Для получения агаризованных сред добавляли 2% (вес./об.) агара (“Difco”, США). Для получения сред с пониженными показателями кислотности рН доводили до значений 5 и 4 концентрированной соляной кислотой, для сред с повышенной засоленностью – вносили 3% (вес./об.) NaCl. Культивирование микроорганизмов в жидкой среде проводили в колбах Эрленмейера объемом 750 мл или пробирках объемом 50 мл при перемешивании на орбитальной качалке (120 об./мин). Температура и время культивирования указаны в описании конкретных экспериментов.
В качестве единственного источника углерода и энергии в жидкую минеральную среду добавляли в количестве 2% (вес./об. для твердых и об./об. для жидких) один из следующих субстратов: сырая нефть, дизельное топливо, нафталин, β-метилнафталин, фенантрен, антрацен, пирен, флуорен, камфора, бензол, этилбензол, фенол, протокатехоат натрия, салицилат натрия, 4-метилкатехол, нонан, декан, ундекан, додекан, или гексадекан, а гексан и октан вносили в отросток колбы для выращивания в парах. Для агаризованной среды Эванса дизельное топливо вносили в одноразовом пластиковом наконечнике на крышку перевернутой чашки Петри.
Определение численности микроорганизмов. Для образцов почвы брали 1 г навески и вносили ее в колбу со 100 мл физиологического раствора, для сухого препарата – 1 г навески вносили в 9 мл физиологического раствора. Пробы перемешивали в течение 30 мин. Далее использовали стандартную методику серийных разведений с высевом до отдельных колоний на агаризованные среды (среда Лурия–Бертани для определения общего количества микроорганизмов; среда Эванса с дизельным топливом для оценки численности нефтедеструкторов). Чашки Петри инкубировали при температуре 24°С в течение 2 сут (среда Лурия–Бертани) и 5 сут (среда Эванса). Высевы проводили в трех повторах.
Выделение и характеристика углеводородокисляющих микроорганизмов. Навеску смеси отобранных образцов почвы (общий вес 5 г) помещали в колбу Эрленмейера со 100 мл среды Эванса (рН 5, 3% хлорида натрия, 2% об./об. сырой нефти). Культивирование проводили в течении 10 сут при 24°C и 20 сут при 6°C. Затем делали высевы на агаризованную среду Лурия–Бертани. Морфологически различимые колонии клеток рассевали до отдельных колоний для получения чистых культур. Выделенные чистые штаммы вторично проверяли на углеводородокисляющую активность по росту в минеральной среде Эванса с нефтью при 24°С в течение 10 сут.
Таксономическая идентификация наиболее активных штаммов-нефтедеструкторов и поиск генов, ответственных за деградацию углеводородов. Геномную ДНК бактерий выделяли с использованием набора diaGene (Россия). Выделение плазмидной ДНК проводили методом щелочного лизиса [7].
Идентификацию выделенных микроорганизмов-деструкторов осуществляли определением первичной нуклеотидной последовательности фрагмента гена 16S рРНК (для бактерий) и ITS-региона (для дрожжевых грибов). Полимеразную цепную реакцию (ПЦР) осуществляли в термоциклере GeneAmp PCR System 9700 (Applied Biosystems, США). Нуклеотидная последовательность, температура отжига праймеров и размер ПЦР продуктов приведены в [11, 12]. Полученные ПЦР-продукты очищали, используя GeneJET PCR Purification Kit (Thermo Scientific, США) по протоколу фирмы изготовителя [28].
Определение нуклеотидной последовательности ампликонов проводили на секвенаторе Applied Biosystems 3130 × 1 с использованием набора для секвенирования BigDye v.3.1. Анализ идентичности нуклеотидных последовательностей выполняли с помощью программы BLASTN [18].
Электрофорез проводили в 0.8–1%-ном горизонтальном агарозном геле и 0.5× трис-боратном буфере [46]. Визуализацию ДНК проводили путем добавления бромистого этидия в агарозу в конечной концентрации 0.5 мкг/мл.
Пульс-электрофорез проводили по протоколу фирмы-производителя (Bio-Rad, США). Приготовление блок-вставок осуществляли согласно [15].
Определение субстратной специфичности микроорганизмов-деструкторов. Микроорганизмы культивировали в пробирках с 10 мл среды Эванса с добавлением субстрата при 24°С в течение 10 сут.
Продукция биологических поверхностно-активных веществ. Микроорганизмы выращивали на среде Эванса с дизельным топливом при 24°C в течение 5 сут. Культуральную жидкость отстаивали в течение 30 мин в делительных воронках, затем отбирали нижнюю, водную часть пробы, избавляясь таким образом от пленки остаточного субстрата. Измерение проводили методом Дю Нуи (отрыв кольца) на тензиометре К6 (Kruss, ФРГ) при комнатной температуре. Поверхностное натяжение раствора сравнения (минеральная среда Эванса) – 72 мН/м.
Модельные системы с сырой нефтью. Эксперименты с жидкой средой проводили в колбах Эрленмейера, содержащих по 100 мл среды Эванса и 2, 10 или 20% (об./об.) сырой нефти. Эксперименты с песком проводили в контейнерах, содержащих по 1 кг промытого и стерилизованного речного песка с 10% (вес./вес.) сырой нефти. Для инокулята брали суспензию микроорганизмов, выращенных на среде Лурия–Бертани, или образец сухого препарата, разведенного в физиологическом растворе. Посевную дозу рассчитывали для достижения итоговой концентрации микроорганизмов 1 × 107 КОЕ на мл или г среды. Культивирование проводили в течение 10 сут при 24°C. Колбы помещали на орбитальную качалку (120 об./мин), песок тщательно рыхлили при засеве и через 5 сут. Каждую систему готовили в трех повторах.
Оценка степени деградации нефти. Остаточное содержание углеводородов нефти в жидкой среде и песке определяли методом газовой хроматографии после экстракции хлористым метиленом в соответствии с [4]. Для проведения измерений использовали газовый хроматограф с пламенно-ионизационным детектором Agilent 6890N (Agilent, США) и капиллярную колонку типа DB-1 (30 м × 0.25 мм × 0.50 мкм). Степень деградации углеводородов оценивали по сравнению с контролем (модельная система с нефтью без микроорганизмов). Каждое измерение проводили в трех повторностях.
Культивирование штаммов микробного консорциума. Работа была выполнена на УНУ “Опытная технологическая установка ИБФМ РАН” (ОТУ ИБФМ РАН), рег. № 279918 на сайте www.ckp-rf.ru. Инокулят выращивали на среде Лурия–Бертани, объем вносимого инокулята составлял 100 мл. Культивирование выполняли в ферментерах объемом 10 л (АНКУМ), содержащих 7.5 л среды следующего состава (г/л): пептон – 7.0, дрожжевой экстракт – 5.0, хлорид натрия – 1.0, семиводный сульфат марганца – 0.1, семиводный сульфат магния – 0.3, сульфат аммония – 5.0, двенадцативодный гидроортофосфат калия – 2.0, двенадцативодный дигидроортофосфат калия – 0.5, глюкоза – 25.0. Параметры процесса культивирования поддерживали следующими: температура 28°C, рН 7.0, скорость перемешивания 450 об./мин, аэрация 0.5–1.0 л/мин. Продолжительность процесса культивирования микроорганизмов составляла 16–22 ч (до прекращения роста оптической плотности в течение 2–4 ч).
Отделение микробной биомассы проводили на центрифуге К-70 (Janezki, Германия) при скорости вращения ротора 4500 об./мин и температуре 5°C в течение 30 мин.
Получение сухого препарата. Полученную биомассу смешивали в соотношении 1 : 1 (вес./об.) с 5% раствором глутамата натрия. Суспензию замораживали при –40°C. Лиофилизацию производили в вакуум-сушильных аппаратах КС-30. Сухой препарат упаковывали в стерилизованные полиэтиленовые пакеты.
Статистическая обработка результатов. Обработку результатов осуществляли c помощью встроенного статистического пакета Excel (MS Office 2020).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Подробное описание отобранных образцов верхних горизонтов основных типов почв, относящихся к доминирующим типам биогеоценозов Среднего Приобья, представлено в публикации [14]. Почвы были диагностированы как торфяная олиготрофная, торфяная мезотрофная, аллювиальная болотная торфяная и глеезем оторфованный. При этом, хотя аллювиальные и мезотрофные торфяные почвы уступают по площади распространения в регионе олиготрофным, они играют большую роль в поддержании био- и педоразнообразия [1]. В табл. 1 приведены характеристики отобранных образцов почвы. Показатель рН в среднем для всех биотопов составлял 5.2. Наибольшая величина эмиссии углекислого газа была выявлена во всех чистых фоновых образцах, что, вероятно, свидетельствует об активном метаболизме микробного сообщества. В загрязненных образцах торфяной олиготрофной почвы высокая концентрация нефтепродуктов и низкие значения рН отрицательно влияли на количество нефтедеструкторов и интенсивность эмиссии CO2. Однако подобный эффект не наблюдался в загрязненных пробах остальных биотопов. Выявлена положительная корреляция между численностью нефтедеструкторов и показателем интенсивности эмиссии углекислого газа.
Таблица 1.
Характеристика отобранных образцов почвы
| Образец | Содержание нефтепродуктов, % | Доля (%) нефтедеструкторов от общей численности микроорганизмов | рН | Интенсивность эмиссии CO2* |
|---|---|---|---|---|
| Р2.1.1** | 46.6 | 2.26 | 3.9 | 3 |
| Р2.1.2 | 19.4 | 12.92 | 4.0 | 2 |
| Р2.2.1 | 43.4 | 7.27 | 5.0 | 3 |
| Р2.2.2 | 31.0 | 2.85 | 4.1 | 3 |
| Р3 | 22.7 | 24.56 | 6.2 | 2 |
| Р4.1 | 25.7 | 27.59 | 5.5 | 2 |
| Р4.2 | 34.1 | 18.82 | 5.8 | 2 |
| Р5 | 14.7 | 13.80 | 5.1 | 2 |
| Г2.1.1 | 36.3 | 4.18 | 5.2 | 3 |
| Г2.1.2 | 13.3 | 30.29 | 5.1 | 2 |
| Г2.2.1 | 18.0 | 16.26 | 5.7 | 1 |
| Г2.2.2 | 45.1 | 40.21 | 5.5 | 1 |
| Г3 | 34.7 | 33.63 | 5.8 | 1 |
| Л2 | 19.1 | 13.74 | 6.2 | 2 |
| М1 | 15.7 | 2.32 | 6.2 | 1 |
| М2 | 25.9 | 47.21 | 4.3 | 2 |
| П1 | 32.4 | 18.37 | 6.1 | 3 |
| Р1 (фон) | 0.9 | 3.02 | 4.0 | 1 |
| Г1 (фон) | 0.3 | 15.64 | 4.3 | 2 |
| Л1 (фон) | 1.4 | 12.33 | 5.2 | 1 |
| П1 (фон) | 0.1 | 2.94 | 5.8 | 1 |
* Величина эмиссии CO2: 1 – высокая, 2 – средняя, 3 – низкая (ранжирование выполнено в соответствии с результатами, описанными в [10]). ** Г – торфяная олиготрофная почва (мочажина олиготрофного грядово-мочажинно-сфагнового комплекса), Р – олиготрофное сосново-кустарничково-сфагновое болото, М – торфяная мезотрофная почва (мезотрофное березово-сосновое травяно-моховое болото – мезотрофное болото), П – аллювиальная болотная почва (эвтрофное аллювиальное травяно-осоковое болото), Л – глеезем оторфованный (темнохвойно-мелколиственный лес).
Трофимовым с соавт. показано, что в исследуемых нефтезагрязненных образцах основной вклад в образование углекислого газа, вероятно, вносят микроорганизмы-деструкторы, использующие соединения нефти в своем метаболизме [14]. Детальное изучение основных физико-химических свойств биотопов и показателей углеводородного состояния почв, а также оценка количества нефтедеструкторов позволили выбрать следующие образцы из трех биотопов: Р4.1, Г2.2.2, М2. В качестве критериев отбора использована следующая совокупность свойств: низкое значение рН, содержание углеводородов нефти более 25%, высокий показатель интенсивности эмиссии углекислого газа и доля нефтедеструкторов более 20%. Поскольку нефтезагрязненные образцы аллювиальной болотной почвы и глеезема оторфованного были единичными (П1 и Л2), то они также были отобраны для дальнейших экспериментов.
В результате накопительного культивирования смеси образцов почвы при 24°C было выделено 24 штамма, при 6°C – 20. Полученные чистые культуры микроорганизмов были вторично проверены на способность к росту на нефти, что позволило отобрать 14 микроорганизмов-нефтедеструкторов: 24р-61, 24-21, 7р-81, 24р-83, 24-41, 7р-72, 24-44, 7р-51, 7р-62, 7-43, 7-31, 24р-71, 24р-51, 7-41.
По данным ряда исследователей в образцах загрязненных почв с территорий действующих нефтеперерабатывающих заводов, сельскохозяйственных угодий или промышленных площадок наблюдается доминирование следующих бактериальных родов: Megamonas, Paenibacillus, Bacillus, Aquicella, Alicyclobacillus, Anaeromyxobacter, Bdellovibrio, Nitrospiria, Oscillospiria, Mycobacterium, Rhodococcus, Pseudomonas, Burkholderia, Chromobacterium, Xanthomonas и Acinetobacter [21, 42, 53]. В настоящем исследовании были выделены представители бактерий родов Pseudomonas (5 штаммов), Bacillus (1 штамм), Raoutella (1 штамм), Acinetobacter (1 штамм) и Kocuria (1 штамм) (табл. 2). Виды рода Pseudomonas зачастую являются наиболее распространенными микроорганизмами в нефтезагрязненных почвах, что свидетельствует о значительном вкладе штаммов данного рода в процесс деградации углеводородов [20]. Выявлено, что среди выделенных штаммов кроме бактерий присутствуют 5 представителей дрожжей вида Candida fluviatilis. По данным Поляковой [44] отличительной особенностью таксономической структуры микробного сообщества торфов является более высокая встречаемость и разнообразие дрожжей аскомицетового аффинитета родов Pichia, Debaryomyces, Metschnikowia, Candida по сравнению с другими почвами. Можно сделать предположение, что бактерии рода Pseudomonas и дрожжи Candida fluviatilis являются специфическими микроорганизмами почвенных биотопов Среднего Приобья и могут рассматриваться как важные участники процессов биодеградации.
Таблица 2.
Критерии отбора штаммов в консорциум
| Наименование штамма | Видовая принадлежность | Рост | Наличие плазмид | Синтез биоПАВ | Итоговый ранг | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| н-алканы | МАУ* | ПАУ | в широком температурном диапазоне | в кислых средах | в засоленных средах | |||||
| 24р-51 | Candida fluviatilis | ++ | – | + | ++ | ++ | ++ | – | – | 4 |
| 7-43 | Acinetobacter calcoaceticus | ++ | ++ | + | + | + | ++ | – | – | 4 |
| 7-31 | Pseudomonas extremaustralis | ++ | + | + | + | ++ | + | + | – | 4 |
| 24-44 | Rhodococcus erythropolis | + | + | – | + | ++ | ++ | – | + | 3 |
| 7р-81 | Pseudomonas fluorescens | ++ | ++ | ++ | – | – | + | + | – | 3 |
| 7-41 | Pseudomonas fluorescens | ++ | – | + | + | + | ++ | + | – | 3 |
| 24-21 | Candida fluviatilis | – | + | – | ++ | ++ | ++ | – | – | 2 |
| 24р-71 | Candida fluviatilis | + | – | – | ++ | ++ | ++ | – | – | 2 |
| 24р-83 | Candida fluviatilis | + | + | – | ++ | ++ | + | – | – | 2 |
| 7р-62 | Pseudomonas veronii | + | + | + | + | + | + | + | – | 2 |
| 24р-61 | Kocuria rosea | + | ++ | – | – | – | + | – | – | 1 |
| 24-41 | Raoultella planticola | ++ | – | – | + | + | – | – | – | 1 |
| 7р-72 | Candida fluviatilis | + | – | – | + | + | + | – | – | 1 |
| 7р-51 | Pseudomonas putida | + | + | ++ | – | – | – | + | – | 1 |
* МАУ – моноциклический ароматический углеводород, ПАУ – полициклический ароматический углеводород, биоПАВ – биологическое поверхностно-активное вещество. Примечание. Для этих категорий, а также для способности к росту в разных условиях каждому штамму присваивали один из трех уровней: низкий, умеренный и высокий (обозначения в табл. 2: “–”, “+”, “++” соответственно). Для двух категорий, синтез биоПАВ и наличие плазмид, вводили два уровня: наличие или отсутствие соответствующего свойства (обозначения в табл. 2: “–”, “+” соответственно). Итоговый ранг присваивался штаммам на основе обобщенной оценки их уровня по всем критериям. Всего было выделено 4 ранга (обозначения в табл. 2: “1–4”, где “4” – наилучшее соответствие всем критериям). Самый низкий ранг “1”, соответствующий микроорганизмам, плохо подходящим для включения в консорциум, был присвоен четырем штаммам, следующий ранг “2” – также четырем штаммам.
Для составления наиболее эффективного консорциума необходимо учитывать как особенности климата и почв региона, где планируется проведение ремедиационных мероприятий, так и общие принципы биодеградации, обеспечивающие возможность микробной деструкции субстратов-загрязнителей. На основе этого утверждения были сформулированы конкретные критерии отбора штаммов.
По данным авторов [14], для различных биотопов Среднего Приобья характерны засоленные почвы с низкими значениями рН. Кроме того, средняя температура летом в данном регионе варьирует от 7 до 35°C. Анализ результатов экспериментов по оценке способности микроорганизмов к деградации нефти в температурном диапазоне от 6 до 37°С при низких значениях рН и в присутствии хлорида натрия выявил штаммы, обладающие наиболее активным ростом в перечисленных условиях: штаммы Candida fluviatilis 24-21, 24р-51, 24р-71, 24р-83; Acinetobacter calcoaceticus 7-43; Rhodococcus erythropolis 24-44 и Pseudomonas extremaustralis 7-31 (табл. S1, S2 ). Следует отметить, что доминирующими в этих исследованиях были дрожжи вида Candida fluviatilis. Как известно, дрожжевые грибы зачастую преобладают в средах с высокой засоленностью и повышенной кислотностью.
Таблица 3.
Данные субстратной специфичности наиболее перспективных микроорганизмов-деструкторов
| Штаммы | Дизельное топливо | Нафталин | ß-Метилнафталин | Фенантрен | Антрацен | Пирен | Флуорен | Камфора | Бензол | Этилбензол | Фенол | 4-Метилкатехол | Протокатехоат | Гексан | Октан | Нонан | Декан | Ундекан | Додекан | Гексадекан | Салицилат |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 24-21 | 3* | 1 | 3 | 0.5 | 3 | ||||||||||||||||
| 24р-51 | 3 | 2 | 1 | 3 | 3 | 3 | 3 | 0.5 | |||||||||||||
| 24р-71 | 3 | 1 | 1 | 0.5 | 3 | 1 | |||||||||||||||
| 24р-83 | 3 | 2 | 2 | 2 | 2 | 0.5 | |||||||||||||||
| 24р-61 | 3 | 0.5 | 2 | 1 | 2 | 2 | 1 | 2 | 2 | 1 | |||||||||||
| 24-44 | 3 | 3 | 3 | 3 | 3 | ||||||||||||||||
| 24-41 | 2 | 2 | 2 | 2 | 2 | ||||||||||||||||
| 7р-72 | 2 | 0.5 | 2 | 2 | |||||||||||||||||
| 7-43 | 3 | 2 | 0.5 | 2 | 3 | 3 | 0.5 | 3 | 3 | 0.5 | |||||||||||
| 7-41 | 1 | 3 | 3 | 0.5 | 3 | 0.5 | 2 | 0.5 | 3 | 3 | 0.5 | ||||||||||
| 7р-62 | 1 | 3 | 3 | 1 | 2 | 3 | 2 | 1 | 0.5 | ||||||||||||
| 7-31 | 3 | 2 | 2 | 3 | 2 | 2 | 2 | 2 | 3 | 3 | 0.5 | ||||||||||
| 7р-51 | 2 | 1 | 1 | 3 | 1 | 1 | 0.5 | 0.5 | 1 | 0.5 | 0.5 | 1 | 1 | 3 | |||||||
| 7р-81 | 0.5 | 3 | 3 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 2 | 2 | 0.5 | 3 | 2 | 3 | 1 | 0.5 |
Алифатические, разветвленные и циклоалифатические алканы, а также различные моно- и полициклические ароматические углеводороды (ПАУ) являются наиболее распространенными углеводородами, входящими в состав нефти и продуктов ее переработки. Несмотря на то, что почвенные микроорганизмы утилизируют широкий класс субстратов, для биоремедиации территорий, загрязненных таким сложным комплексом углеводородов, необходимо все же совместное участие микроорганизмов, обладающих различными генетическими системами катаболизма углеводородов. В табл. 2 представлены результаты анализа штаммов на способность к росту на различных углеводородных субстратах. Выявлено, что псевдомонады 7р-81, 7-41, 7-31 и 7р-62 способны деградировать как алифатические, так и ароматические углеводороды. Дрожжи Candida fluviatilis и бактерия Rhodococcus erythropolis 24-44 обладали наиболее активным ростом в минеральной среде с н-алканами.
Знание метаболических путей и генов, участвующих в деградации углеводородов, помогает в оптимизации подходов к биоремедиации, поэтому наличие генов деградации н-алканов и ароматических углеводородов в исследуемых штаммах определяли методом ПЦР с праймерами к последовательностям известных катаболических генов.
Исследуемые штаммы были протестированы методом ПЦР на наличие гена alkB, кодирующего алкан гидроксилазу, с праймерами позволяющими амплифицировать фрагмент данного гена у таких филогенетически удаленных родов, как Pseudomonas, Rhodococcus, Burkolderia, Bacillus, Mycobacterium, Amycolicicoccus, Nocardioides, Prauserella, Micromonospora, Frankia, Alcanivorax и др. [50]. Ген alkB может служить маркером для определения биоремедиационного потенциала территорий, загрязненных нефтью [50]. Специфичная амплификация гена alkB наблюдалась у четырех исследованных в работе штаммов: P. extremaustralis 7-31, P. fluorescens 7-41, P. veronii 7p-62 и P. fluorescens 7p-81 (табл. S3 ). Rhodococcus erythropolis 24-44 способен к росту на алканах с длиной цепи от С9, однако в данном штамме не был обнаружен ген alkB, кодирующий алкан гидроксилазу. Следует отметить, что способность к деградации алканов у штаммов Rhodococcus sp. может быть обусловлена наличием CYP-генов, также ответственных за деградацию алканов [40]. Вероятно, в штамме Rhodococcus erythropolis 24-44 за окисление алканов отвечают CYP гены.
Начальной стадией деградации ПАУ у большинства микроорганизмов является включение атома кислорода в ароматическое кольцо при участии гидроксилирующей диоксигеназы. Гены phnAc и nahAc, кодирующие большие субъединицы фенантрен 3,4- и нафталин 1,2-, диоксигеназ, соответственно, считаются хорошими маркерами для оценки биодеградационного потенциала микрофлоры загрязненных нефтью и нефтепродуктами почв [34, 52]. Ни в одном из исследуемых образцов не наблюдалось специфичной амплификации гена phnAc. При амплификации гена большой субъединицы нафталин 1,2-диоксигеназы ПЦР-продукты соответствующего размера были получены только в случае псевдомонад: 7-31, 7-41, 7p-51, 7p-62 и 7p-81.
Штаммы P. putida 7p-51 и P. fluorescens 7p-81 способны к росту как на нафталине, так и на фенантрене в качестве единственного источника углерода и энергии. Однако по результатам ПЦР-анализа в данных штаммах присутствует только последовательность гена большой субъединицы нафталин 1,2-диоксигеназы. Известно, что нафталин 1,2-диоксигеназа обладает широкой субстратной специфичностью и может участвовать в окислении более высокомолекулярных ПАУ, таких как фенантрен, антрацен и бифенил [31, 47]. Вероятно, в этих штаммах расщепление кольца фенантрена также происходит при участии нафталин 1,2-диоксигеназы.
Салицилат служит ключевым интермедиатом в путях катаболизма многих ароматических углеводородов [22, 24, 27, 33]. Для изучения генетического контроля деградации салицилата у исследуемых штаммов проводили ПЦР-анализ на присутствие следующих катаболические гены: nahG, nahH и nagG, которые кодируют салицилат 1-гидроксилазу, катехол 2,3-диоксигеназу и большую субъединицу оксигеназного компонента салицилат 5-гидроксилазы соответственно. При амплификации гена nagG ПЦР-продуктов не было получено ни с одним из исследуемых образцов. Последовательности генов салицилат 1-гидроксилазы, nahG, а также гена катехол 2,3-диоксигеназы, nahH, были обнаружены только у штаммов рода Pseudomonas: 7-31, 7-41, 7p-51, 7p-62 и 7p-81.
Пять штаммов псевдомонад – P. extremaustralis 7-31, P. fluorescens 7-41, P. putida 7p-51, P. veronii 7p-62 и P. fluorescens 7p-81 – одновременно содержат последовательности генов nahAc, nahG, а также гена nahH, что свидетельствует о присутствии в данных штаммах “классических” оперонов катаболизма нафталина [5].
Известно, что гены, ответственные за катаболизм различных ксенобиотиков, могут иметь как хромосомную локализацию, так и располагаться на коньюгативных плазмидах большого размера [30, 45]. Для детекции плазмидной ДНК в исследуемых штаммах использовали два подхода: щелочной лизис и пульс-электрофорез в агарозных блок-вставках. Комбинация этих двух методов позволяет достоверно определить наличие в штамме плазмид даже относительно большого размера (более 200 т. п. н.). У пяти штаммов, относящихся к роду Pseudomonas (P. extremaustralis 7-31, P. fluorescens 7-41, P. putida 7p-51, P. veronii 7p-62 и P. fluorescens 7p-81), были обнаружены плазмидные ДНК размером более 180 т. п. н. Так как ни одним из двух вышеперечисленных подходов не удалось обнаружить плазмидные ДНК у оставшихся девяти штаммов, то можно с уверенностью утверждать об отсутствии плазмид в следующих штаммах: Candida fluviatilis 24-21, Raoutella planticola 24-41, Candida fluviatilis 24p-51, Kocuria rosea 24p-61, Candida fluviatilis 24p-71, Candida fluviatilis 24p-83, Acinetobacter calcoaceticus 7-43, Candida fluviatilis 7p-72, Rhodococcus erythropolis 24-44. Наличие гена nahH является косвенным свидетельством плазмидной локализации катаболических оперонов [48], весьма вероятно, что у исследуемых штаммов псевдомонад гены биодеградации нафталина также расположены на плазмидах.
Микроорганизмы обладают различными механизмами для обеспечения эффективного потребления углеводородных субстратов, например, такими как образование поверхностно-активных веществ [35]. БиоПАВ являются амфифильными соединениями, способными значительно снижать поверхностное и межфазное натяжение. Способность к продукции таких соединений широко распространена среди нефтеокисляющих микроорганизмов [16, 38]. Наличие в ростовой среде биоПАВ обеспечивает эмульгирование нерастворимых в воде субстратов, к которым относятся и углеводороды [37]. Такой механизм, как предполагается, способствует увеличению биодоступности субстрата для клеток, что облегчает его использования в качестве источника углерода и энергии, а, следовательно, позволяет повысить эффективность биодеградации в целом [41]. В качестве важнейшего критерия отбора продуцентов биоПАВ рассматривается уменьшение поверхностного натяжения культуральной среды не менее чем до 40 мН/м [51]. Среди исследуемых микроорганизмов, только для одного штамма, Rhodococus erythropolis 24-44, было отмечено существенное снижение поверхностного натяжения (до 30 ± 1 мН/м) (табл. S4 ), что свидетельствует о его способности к продукции эффективных биоПАВ.
Таким образом, были сформулированы следующие критерии, по которым производился отбор наиболее эффективных штаммов в итоговый консорциум: наличие широкого спектра окисляемых субстратов различных классов; способность к росту на углеводородах в широком температурном диапазоне; способность к росту на углеводородах в кислых средах; способность к росту на углеводородах при повышенном содержании соли; наличие плазмид; способность к продукции биоПАВ.
Спектр окисляемых субстратов оценивали отдельно для трех классов соединений: алканы, МАУ (моноциклические ароматические углеводороды) и ПАУ. Наиболее перспективными для включения в состав консорциума являлись штаммы, получившие высокие ранги “3” и “4”: Candida fluviatilis 24р-51, Rhodococcus erythropolis 24-44, Acinetobacter calcoaceticus 7-43, Pseudomonas fluorescens 7-41, Pseudomonas extremaustralis 7-31 и Pseudomonas fluorescens 7р-81. В процессе выполнения экспериментов была выявлена плохая осаждаемость клеток штамма 7р-81, что очень затрудняет получение биомассы для препарата. Кроме того, для меньшей конкуренции в метаболизме штаммов целесообразно включать микроорганизмы разных родов, поэтому в состав консорциума вошли штаммы Candida fluviatilis 24р-51, Rhodococcus erythropolis 24-44, Acinetobacter calcoaceticus 7-43 и Pseudomonas extremaustralis 7-31.
Отобранные штаммы были проанализированы в отношении эффективности деградации различных фракций нефти. Наблюдалось постепенное снижение деградационной активности штаммов Acinetobacter calcoaceticus 7-43 и Candida fluviatilis 24р-51 с увеличением уровня исходной концентрации нефти (рис. 1a). Деградационная активность штамма Pseudomonas extremaustralis 7-31 резко, в 5 раз, уменьшалась с увеличением количества нефти в среде с 2 до 10%. Деградация нефти штаммом Rhodococcus erythropolis 24-44 практически не изменялась с увеличением концентрации нефти в среде, однако менялось соотношение убыли углеводородов разных фракций: при высоких концентрациях штамм обладал большей активностью в отношении углеводородов высококипящей фракции нефти.
Рис. 1.
Степень деградации углеводородов разных фракций в жидкой минеральной среде с разным содержанием нефти (а) и в жидкой минеральной среде и песке с 10% нефти (b) относительно контрольных систем без микроорганизмов за 10 сут при температуре 24°C. Планки погрешностей обозначают стандартное отклонение для трех биологических повторов.
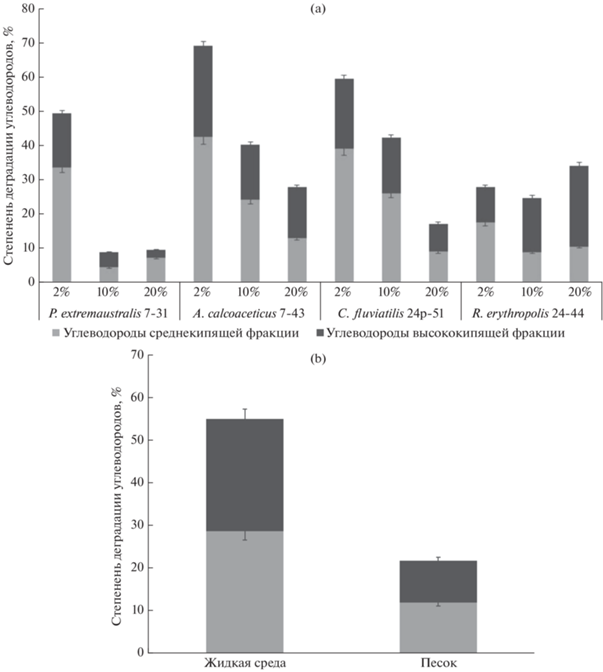
В модельных системах с 2% нефти была проведена качественная и количественная оценка остаточного содержания ПАУ (табл. S5 ). В системе со штаммом 24р-51 выявили наибольшее снижение концентрации нафталина и дибенз(а, h)антрацена. Штамм 7-31 активно потреблял нафталин, флуорантен, дибенз(а, h)антрацен и бензо(g,h, i)перилен. Для штамма 7-43 обнаружили наибольшее уменьшение количества нафталина, антрацена, флуорантена, бенз(а)антрацена, бенз(а)пирена и дибенз(а, h)антрацена. Для системы со штаммом 24-44 не выявлено значительного изменения концентрации ПАУ, в то же время родококк значительно деградировал н-алканы как среднекипящей, так и высококипящей фракций углеводородов нефти (табл. S6 ). Исходя из суммарных значений остаточных концентраций ПАУ (табл. S5 ), наибольшая общая деградация ПАУ выявлена в модельных системах со штаммом 7-31 по сравнению с контролем без микроорганизмов. Следует отметить, что к среднекипящей фракции углеводородов нефти относятся нафталин, аценафтен, флуорен, фенантрен и антрацен. Причем полученные результаты соотносятся с наличием генов деградации ПАУ, обнаруженных у штамма Pseudomonas extremaustralis 7-31, что, вероятно, и обусловило наибольшую убыль ароматических углеводородов.
Основой большинства биопрепаратов для очистки территорий и акваторий от нефтяных загрязнений являются живые клетки микроорганизмов, сохранившие высокую активность ферментных систем биодеградации компонентов нефти. Получение биомассы жизнеспособных бактерий (культивирование) является основным этапом получения биопрепарата. От качества полученного биоматериала зависит и эффективность биоремедиации. В то же время стадия культивирования микроорганизмов – одна из самых затратных: расходы на питательные среды, электроэнергию для биореакторов и т. д. составляют большую часть себестоимости готового биопрепарата. Поэтому на заключительном этапе работы проводили отработку режимов культивирования штаммов микробного консорциума. В табл. 4 представлены результаты по раздельному глубинному культивированию штаммов микробного консорциума. Длительность процесса составляла от 16 до 22 ч. Численность микроорганизмов в концентрированных суспензиях составляла более 1 × 109 КОЕ/мл, что свидетельствует о сбалансированности химического состава питательных сред и оптимально подобранных условиях культивирования штаммов. Куюкиной с соавт. [6] было продемонстрировано совместное культивирование микроорганизмов одного рода. Однако подобный подход невозможно было использовать в нашей работе, так как условия для оптимального роста бактерий и дрожжей микробного препарата значительно различались.
Таблица 4.
Культивирование штаммов консорциума и получение сухих препаратов
| Штамм | Время роста, ч | Вес концентри-рованной биомассы, г | Численность микроорга-низмов, КОЕ/мл в концентриро-ванной биомассе | Вес сухого препарата, г | Численность микроорганизмов, КОЕ/г сухого препарата |
|---|---|---|---|---|---|
| Candida fluviatilis 24р-51 | 20 | 140 | 2.2 × 1010 | 82 | 1.8 × 109 |
| Rhodococcus erythropolis 24-44 | 22 | 150 | 1.9 × 1010 | 98 | 1.1 × 1011 |
| Acinetobacter calcoaceticus 7-43 | 18 | 160 | 2.0 × 1010 | 71 | 1.6 × 1010 |
| Pseudomonas extremaustralis 7-31 | 16 | 110 | 5.2 × 109 | 88 | 2.5 × 109 |
Одним из критических параметров, определяющих качество бактериальных препаратов, используемых в различных отраслях, является сохранение числа жизнеспособных клеток (КОЕ) в процессе высушивания. Важнейшую роль для успешного решения задачи стабилизации КОЕ является выбор оптимальной композиции защитных сред (криопротекторов). В составе защитных сред основную роль играют две группы веществ: углеводно-белковые структуры, определяющие кристаллическую структуру при замораживании продуктов, и группа антиоксидантов. В качестве антиоксиданта использовали глутамат натрия в количестве 5%, продемонстрировавшего высокую эффективность в работе [9]. Численность жизнеспособных микроорганизмов в полученных сухих препаратах варьировала от 109 до 1011.
На основе полученных результатов был приготовлен сухой препарат, включающий штаммы, входящие в состав консорциума. Численность в концентрате составила – 1.5 × 1010 КОЕ/г сухого препарата. Через 1 мес. хранения сухого препарата консорциума при температуре 6°C численность микроорганизмов сократилась в 1.2 раза, что свидетельствует о высокой эффективности хранения биомассы микроорганизмов-нефтедеструкторов.
Для оценки качества полученного сухого препарата микробного консорциума были проведены модельные лабораторные эксперименты. Результаты анализа (рис. 1b) продемонстрировали более равномерное потребление углеводородов разных фракций нефти, как в жидкой минеральной среде, так и в песке, по сравнению с рис. 1a (уровень загрязнения 10%). Убыль нефти в жидкой минеральной среде составила 56%, что превышало показатели, полученные для отдельных микроорганизмов (рис. 1a). Деградация нефти микробным консорциумом в жидкой среде происходила в 2 раза быстрее по сравнению с песком. Вероятно, при активном перемешивании жидкой минеральной среды увеличивались доступ кислорода и равномерность распределения углеводородов в системе, что способствовало ускоренному потреблению углеводородов микроорганизмами консорциума. Для обеспечения эффективности деградации углеводородов нефти микробным консорциумом в почвенных системах необходима периодическая вспашка почвы и увеличение срока рекультивации.
ЗАКЛЮЧЕНИЕ
На основании анализа физиолого-биохимических и генетических свойств выделенных и идентифицированных штаммов-деструкторов углеводородов нефти составлен алгоритм разработки микробного консорциума для очистки нефтезагрязненных территорий Среднего Приобья. В состав микробного консорциума вошли следующие штаммы – Candida fluviatilis 24р-51, Rhodococcus erythropolis 24-44, Acinetobacter calcoaceticus 7-43 и Pseudomonas extremaustralis 7-31.
Список литературы
Аветов Н.А., Кузнецов О.Л., Шишконакова Е.А. Почвы олиго-мезотрофных и мезотрофных болот бореального пояса Западной Сибири: возможности геоботанической диагностики в рамках типа торфяных мезотрофных почв // Почвоведение. 2021. № 5. С. 568–581. https://doi.org/10.31857/S0032180X21030023
Аветов Н.А., Шишконакова Е.А. Загрязнение нефтью почв таежной зоны Западной Сибири // Бюл. Почв. ин-та им. В.В. Докучаева. 2011. № 68. С. 45–55.
Ветрова А.А., Иванова А.А., Филонов А.Е., Забелин В.А., Гафаров А.Б., Соколов С.Л., Нечаева И.А., Пунтус И.Ф., Боронин А.М. Биодеструкция нефти отдельными штаммами и принципы составления микробных консорциумов для очистки окружающей среды от углеводородов нефти // Известия Тульского гос. ун-та. Естественные науки. 2013. № 2. С. 241–257.
Другов Ю.С., Родин А.А. Экологические анализы при разливах нефти и нефтепродуктов: практическое руководство. М.: БИНОМ. Лаборатория знаний, 2007. 270 с.
Измалкова Т.Ю., Сазонова О.И., Соколов С.Л., Кошелева И.А., Боронин А.М. Плазмиды биодеградации нафталина и салицилата Р-7 группы несовместимости в штаммах флуоресцирующих псевдомонад // Микробиология. 2005. № 3(74). С. 342–348.
Куюкина М.С., Ившина И.Б. Пат. РФ № 2180276 // Бюл. изобр. 2002. № 7.
Маниатис Т., Фрич Э., Самбрук Д. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984. 480 с.
Методика выполнения измерений массовой доли нефтепродуктов в минеральных, органогенных, органо-минеральных почвах и донных отложениях методом ИК-спектрометрии: ПНД Ф 16.1:2.2.22-98. М., 1998.
Петриков К.В. Биологические поверхностно-активные вещества, продуцируемые микроорганизмами-нефтедеструкторами родов Pseudomonas и Rhodococcu. 2011. 136 с.
Практикум по почвоведению / Под ред. Н.Ф. Ганжары. М.: Агроконсалт, 2002. 280 с.
Сазонова О.И., Ветрова А.А., Гафаров А.Б., Соколов С.Л. Выделение эпифитных штаммов Aureobasidium pullulans, продуцирующих высокомолекулярные внеклеточные полисахариды. // Известия Тульского гос. ун-та. Естественные науки. 2017. № 4. С. 24–31.
Сазонова О.И., Ветрова А.А., Стрелецкий Р.А., Гафаров А.Б., Кошелева И.А., Филонов А.Е., Соколов С.Л. Штаммы Pseudomonas extremaustralis 7–31 и Pseudomonas fluorescens 7–41, деградирующие алифатические и ароматические углеводороды // Известия Тульского гос. ун-та. Естественные науки. 2019. № 3. С. 31–43.
Середина В.П., Колесникова Е.В., Кондыков В.А., Непотребный А.И., Огнев С.А. Особенности влияния нефтяного загрязнения на почвы средней тайги Западной Сибири // Нефтяное хозяйство. 2017. № 5. С. 108–112.
Трофимов С.Я., Арзамазова А.В., Кинжаев Р.Р., Аветов Н.А., Карпухин М.М. Минерализация органического вещества нефтезагрязненных и фоновых почв Среднего Приобья в лабораторных условиях // Вестник Моск. ун-та. Сер. 17. Почвоведение. 2021. № 2. С. 51–56.
Alonso R., Martín A., Peláez T., Marín M., Rodríguez-Creixéms M., Bouza E. An improved protocol for pulsed-field gel electrophoresis typing of Clostridium difficile // J. Medical Microbiology. 2005. V. 2(54). P. 155–157. https://doi.org/10.1099/jmm.0.45808-0
Antoniou E., Fodelianakis S., Korkakaki E., Kalogerakis N. Biosurfactant production from marine hydrocarbon-degrading consortia and pure bacterial strains using crude oil as carbon source // Frontiers in Microbiology. 2015. V. 06. https://doi.org/10.3389/fmicb.2015.00274
Barron M.G., Vivian D.N., Heintz R.A., Yim U.H. Long-term ecological impacts from oil spills: Comparison of Exxon Valdez, Hebei Spirit, and Deepwater Horizon // Environmental Science & Technology. 2020. V. 11(54). P. 6456–6467. https://doi.org/10.1021/acs.est.9b05020
BLAST: B. L. A. S. T. http://www.ncbi.nlm.nih.gov/BLAST
Brooijmans R.J.W., Pastink M.I., Siezen R.J. Hydrocarbon-degrading bacteria: the oil-spill clean-up crew // Microbial Biotechnology. 2009. V. 6(2). P. 587–594. https://doi.org/10.1111/j.1751-7915.2009.00151.x
Cabral L., Giovanella P., Pellizzer E.P., Teramoto E.H., Kiang C.H., Sette L.D. Microbial communities in petroleum-contaminated sites: Structure and metabolisms // Chemosphere. 2022. V. 2(286). P. 131752. https://doi.org/10.1016/j.chemosphere.2021.131752
Dasgupta A., Saikia R., Handique P.J. Mapping the bacterial community in Digboi oil refinery, India by high-throughput sequencing approach // Current Microbiology. 2018. V. 11(75). P. 1441–1446. https://doi.org/10.1007/s00284-018-1541-x
Davies J., Evans W. Oxidative metabolism of naphthalene by soil pseudomonads. The ring-fission mechanism // Biochemical J. 1964. V. 2(91). P. 251–261. https://doi.org/10.1042/bj0910251
Derguine-Mecheri L., Kebbouche-Gana S., Djenane D. Biosurfactant production from newly isolated Rhodotorula sp. YBR and its great potential in enhanced removal of hydrocarbons from contaminated soils // World Journal of Microbiology and Biotechnology. 2021. V. 1(37). P. 18. https://doi.org/10.1007/s11274-020-02983-3
Doddamani H.P., Ninnekar H.Z. Biodegradation of carbaryl by a Micrococcus species // Current Microbiology. 2001. V. 1(43). P. 69–73. https://doi.org/10.1007/s002840010262
Elumalai P., Parthipan P., Huang M., Muthukumar B., Cheng L., Govarthanan M., Rajasekar A. Enhanced biodegradation of hydrophobic organic pollutants by the bacterial consortium: Impact of enzymes and biosurfactants // Environmental Pollution. 2021. V. 289. P. 117956. https://doi.org/10.1016/j.envpol.2021.117956
Evans C.G.T., Herbert D., Tempest D.W. The continuous cultivation of microorganisms: 2. Construction of a chemostat // Methods in Microbiology. 1970. V. 2. P. 277–327.
Evans W., Fernley H., Griffiths E. Oxidative metabolism of phenanthrene and anthracene by soil pseudomonads. The ring-fission mechanism // Biochemical J. 1965. V. 3(95). P. 819–831. https://doi.org/10.1042/bj0950819
GeneJET PCR Purification Kit [Электронный ресурс]. URL: https://www.thermofisher.com/order/ catalog/product/K0702
Germida J.J., Frick C.M., Farrell R.E. Phytoremediation of oil-contaminated soils // Developments in Soil Science. 2002. V. 28. P. 169–186. https://doi.org/10.1016/S0166-2481(02)80015-0
Herrick J.B., Stuart-Keil K.G., Ghiorse W.C., Madsen E.L. Natural horizontal transfer of a naphthalene dioxygenase gene between bacteria native to a coal tar-contaminated field site // Applied and Environmental Microbiology. 1997. V. 6(63). P. 2330–2337. https://doi.org/10.1128/aem.63.6.2330-2337.1997
Kiyohara H., Torigoe S., Kaida N., Asaki T., Iida T., Hayashi H., Takizawa N. Cloning and characterization of a chromosomal gene cluster, pah, that encodes the upper pathway for phenanthrene and naphthalene utilization by Pseudomonas putida OUS82 // J. Bacteriology. 1994. V. 8(176). P. 2439–2443. https://doi.org/10.1128/jb.176.8.2439-2443.1994
Koshlaf E., Ball A. Soil bioremediation approaches for petroleum hydrocarbon polluted environments // AIMS Microbiology. 2017. V. 1(3). P. 25–49. https://doi.org/10.3934/microbiol.2017.1.25
Larkin M.J., Day M.J. The metabolism of carbaryl by three bacterial isolates, Pseudomonas spp. (NCIB 12042 & 12043) and Rhodococcus sp. (NCIB 12038) from garden soil // J. Applied Bacteriology. 1986. V. 3(60). P. 233–242. https://doi.org/10.1111/j.1365-2672.1986.tb01078.x
Laurie A.D., Lloyd-Jones G. Quantification of phnAc and nahAc in contaminated New Zealand soils by competitive PCR // Applied and Environmental Microbiology. 2000. V. 5(66). P. 1814–1817. https://doi.org/10.1128/AEM.66.5.1814-1817.2000
Ławniczak Ł., Woźniak-Karczewska M., Loibner A.P., Heipieper H.J., Chrzanowski Ł. Microbial degradation of hydrocarbons – basic principles for bioremediation: A review // Molecules. 2020. V. 4(25). P. 856. https://doi.org/10.3390/molecules25040856
Li X., Zhao L., Adam M. Biodegradation of marine crude oil pollution using a salt-tolerant bacterial consortium isolated from Bohai Bay, China // Marine Pollution Bulletin. 2016. V. 1(105). P. 43–50. https://doi.org/10.1016/j.marpolbul.2016.02.073
Markande A.R., Patel D., Varjani S. A review on biosurfactants: properties, applications and current developments // Bioresource Technology. 2021. V. 330. P. 124963.
Mehetre G.T., Dastager S.G., Dharne M.S. Biodegradation of mixed polycyclic aromatic hydrocarbons by pure and mixed cultures of biosurfactant producing thermophilic and thermo-tolerant bacteria // Science of the Total Environment. 2019. V. 679. P. 52–60.
Mnif S., Chamkha M., Sayadi S. Isolation and characterization of Halomonas sp. strain C2SS100, a hydrocarbon-degrading bacterium under hypersaline conditions // J. Applied Microbiology. 2009. V. 3(107). P. 785–794. https://doi.org/10.1111/j.1365-2672.2009.04251.x
Nie Y., Chi C.-Q., Fang H., Liang J.-L., Lu S.-L., Lai G.-L., Tang Y.-Q., Wu X.-L. Diverse alkane hydroxylase genes in microorganisms and environments // Scientific Reports. 2014. V. 1(4). P. 4968.
Patel S., Homaei A., Patil S., Daverey A. Microbial biosurfactants for oil spill remediation: pitfalls and potentials // Applied Microbiology and Biotechnology. 2019. V. 1(103). P. 27–37. https://doi.org/10.1007/s00253-018-9434-2
Patel V., Sharma A., Lal R., Al-Dhabi N.A., Madamwar D. Response and resilience of soil microbial communities inhabiting in edible oil stress/contamination from industrial estates // BMC Microbiology. 2016. V. 1(16). P. 50. https://doi.org/10.1186/s12866-016-0669-8
Perdigão R., Almeida C.M.R., Santos F., Carvalho M.F., Mucha A.P. Optimization of an autochthonous bacterial consortium obtained from beach sediments for bioremediation of petroleum hydrocarbons // Water. 2020. V. 1(13). P. 66. https://doi.org/10.3390/w13010066
Poliakova A.V., Chernov I.I., Panikov N.S. Yeast biodiversity in hydromorphic soils with reference to grass-Sphagnum swamp in Western Siberia and the hammocky tundra region (Barrow, Alaska) // Mikrobiologiia. 2001. V. 5(70). P. 714–720. https://doi.org/10.1023/A:1012328710111
Rosselló-Mora R.A., Lalucat J., García-Valdés E. Comparative biochemical and genetic analysis of naphthalene degradation among Pseudomonas stutzeri strains // Applied and Environmental Microbiology. 1994. V. 3(60). P. 966–972. https://doi.org/10.1128/aem.60.3.966-972.1994
Sambrook J., Russell D.W. Molecular cloning: A laboratory manual. N.Y.: Cold Spring Harbor Laboratory Press, 2001. 2100 p.
Sanseverino J., Applegate B.M., King J.M., Sayler G.S. Plasmid-mediated mineralization of naphthalene, phenanthrene, and anthracene // Applied and Environmental Microbiology. 1993. V. 6(59). P. 1931–1937. https://doi.org/10.1128/aem.59.6.1931-1937.1993
Timmis K.N., Lehrbach P.R., Harayama S., Don R.H., Mermod N., Bas S., Leppik R., Weightman A.J., Reineke W., Knackmuss H.J. Analysis and manipulation of plasmid-encoded pathways for the catabolism of aromatic compounds by soil bacteria. Boston, MA: Springer US, 1985. P. 719–739.
Tyagi M., Fonseca M.M.R. da, Carvalho C.C.C.R. de. Bioaugmentation and biostimulation strategies to improve the effectiveness of bioremediation processes // Biodegradation. 2011. V. 2(22). P. 231–241. https://doi.org/10.1007/s10532-010-9394-4
Viggor S., Juhanson J., Jõesaar M., Mitt M., Truu J., Vedler E., Heinaru A. Dynamic changes in the structure of microbial communities in Baltic Sea coastal seawater microcosms modified by crude oil, shale oil or diesel fuel // Microbiological Research. 2013. V. 7(168). P. 415–427. https://doi.org/10.1016/j.micres.2013.02.006
Walter V., Syldatk C., Hausmann R. Screening concepts for the isolation of biosurfactant producing microorganisms. N.Y.: Springer N.Y., 2010. P. 1–13. https://doi.org/10.1007/978-1-4419-5979-9_1
Yang Y., Wang J., Liao J., Xie S., Huang Y. Abundance and diversity of soil petroleum hydrocarbon-degrading microbial communities in oil exploring areas // Applied Microbiology and Biotechnology. 2015. V. 4(99). P. 1935–1946. https://doi.org/10.1007/s00253-014-6074-z
Zhou Z.-F., Wang M.-X., Zuo X.-H., Yao Y.-H. Comparative investigation of bacterial, fungal, and archaeal community structures in soils in a typical oilfield in Jianghan, China // Archives of Environmental Contamination and Toxicology. 2017. V. 1(72). P. 65–77. https://doi.org/10.1007/s00244-016-0333-1
Zinjarde S., Apte M., Mohite P., Kumar A.R. Yarrowia lipolytica and pollutants: Interactions and applications // Biotechnology Advances. 2014. V. 5(32). P. 920–933. https://doi.org/10.1016/j.biotechadv.2014.04.008
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. - Таблица S6.
Инструменты
Почвоведение


