Почвоведение, 2022, № 7, стр. 808-824
Распределение н-алканов в бугристых торфяниках крайнесеверной тайги европейского северо-востока России и их значение для палеоклиматической реконструкции
Д. Н. Габов a, *, Е. В. Яковлева a, Р. С. Василевич a, И. В. Груздев a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
167000 Республика Коми, Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: gabov@ib komisc.ru
Поступила в редакцию 29.11.2021
После доработки 07.12.2021
Принята к публикации 26.01.2022
- EDN: QYNCEY
- DOI: 10.31857/S0032180X22070048
Аннотация
В исследованных торфяниках определены н-алканы С14Н44–С31Н64, содержание которых по всем исследованным профилям почв связано как с разным ботаническим составом растительных остатков торфяников, так и разными климатическими условиями их формирования (температура, влажность). Суммарное содержание н-алканов максимально в период климатического оптимума голоцена и составляет 104–191 мкг/г для исследованных торфяников крайнесеверной тайги. Исследования состава н-алканов (гомологов с нечетным числом атомов углерода С21Н44, C23Н48, C25Н52, C27Н56, С29Н60, С31Н64) и их соотношений позволяют подтвердить особенности изменения растительных сообществ в слоях торфа, климатические условия генезиса торфяных почв. Полученные результаты в комплексе с радиоуглеродным и палеоботаническим анализами могут быть использованы для индикации исходной растительности по периодам торфообразования в голоцене и более точной реконструкции генезиса торфяника.
ВВЕДЕНИЕ
Торфообразование в тундре происходит при накоплении частично разложившихся растительных остатков в результате плохо выраженных процессов гумификации и минерализации растительности, а вечная мерзлота действует как гигантский морозильник, сохраняя постоянное качество древнего органического вещества. При этом разложение законсервированного органического вещества представляет собой комбинацию прерывающихся циклов деградации в случаях временного оттаивания многолетней мерзлоты [47].
В современных палеоклиматических исследованиях с каждым годом увеличивается доля публикаций по анализу химических и биологических маркеров [17]. н-алканы – хорошо известные молекулярные индикаторы-биомаркеры в органической геохимии на протяжении десятилетий [14, 18, 20, 46]. С химической точки зрения н-алканы представляют собой ряд гомологов неразветвленных углеводородов, которые относятся к классу липидов; они являются важными частями восков кутикулы растений; в составе которой сложная многокомпонентная смесь органических соединений (алканы, эфиры, жирные кислоты, спирты, кетоны и др.) [23, 31]. Обычно углеводороды воска представлены н-алканами c нечетным количеством атомов углерода, что обусловлено их образованием из соответствующих карбоновых кислот. При разложении растительных остатков н-алканы попадают в почву, где они считаются относительно устойчивыми к деградации [52]. Относительная доля насыщенных углеводородов с различной длиной цепи атомов углерода варьирует в разных видах растений. Сфагновые мхи имеют более высокую распространенность н-алканов с более короткой цепью (С21–С25) [24, 40, 56]. Спектр н-алканов в сосудистых растениях имеет максимумы н-алканов с более длинными цепями молекул (С27–С33) [15, 21, 30, 37].
В палеоэкологических исследованиях для описания различных климатических и осадочных процессов было разработано несколько индексов, описывающих вариации относительного содержания различных гомологов н-алканов. Подход диагностического соотношения в значительной степени основан на предположении, что углеводороды, используемые в расчетах, имеют одинаковую эффективность экстракции [12]. При этом в палеоэкологических исследованиях как правило реконструируют не только состав торфообразующей растительности, но и изменения локальной температуры и количества осадков в период образования торфов [16]. При всех существующих преимуществах применения соотношения н-aлканов для восстановления картины климатических изменений следует проявлять осторожность, так как молекулярное распределение насыщенных углеводородов может сильно варьировать, тем более в участках с широким разнообразием типов растительности [41, 44]. Поэтому использование только одного индекса не может адекватно выявить изменение палеоклимата и, как правило, исследуют несколько соотношений в комплексе с другими физико-химическими параметрами [36].
Цель работы – изучение тенденций профильного распределения н-алканов в бугристых торфяниках зоны крайнесеверной тайги Республики Коми, а также закономерностей изменения их качественного состава, вычисление соотношений насыщенных углеводородов для оценки путей образования и реконструкции климатических условий их накопления, комплексная реконструкция генезиса торфяных почв при использовании данных радиоуглеродного возраста ботанического состава торфа, н-алканов и их соотношений по профилю почв.
ОБЪЕКТЫ И МЕТОДЫ
Участок исследования расположен в зоне крайнесеверной тайги европейской части России (Республика Коми, бассейн р. Косью). Зональное деление дано согласно [7]. В районе исследования распространена редкоостровная многолетняя мерзлота [5]. Территория представляет полого-увалистые моренные равнины Предуралья, покрытые покровными пылеватыми суглинками мощностью <10 м [8]. Климат – умеренно континентальный, среднегодовая температура воздуха –3.9°С (по метеостанции г. Инта), сумма среднесуточных положительных температур ~1400°С, количество осадков за год ~700 мм [3].
Объекты исследования – торфяная олиготрофная (мерзлотная) почва (бугров) (Fibric Folic Cryic Histosols – согласно классификации WRB 2015 г.) (Р-1), торфяная олиготрофная деструктивная (мерзлотная) почва (торфяного пятна) (Fibric Folic Cryic Histosols (Turbic)) (Р-2), торфяная олиготрофная почва (мочажин) (Fibric Floatic Histosol) (Р-3). Координаты: 65°54′ с. ш. 60°26′ в. д. Разрезы заложены приблизительно в 11 км на юго-восток от ст. В. Инта (рис. 1). Многолетняя мерзлота в теплое время года находится на глубине 40–50 см в почвах, покрытых растительным покровом, 60–70 см – в почвах торфяных пятен без растительности, 180–200 см – в мочажинах (глубже торфяных слоев, в минеральной породе). Торф в верхней и нижней частях профиля перегнойного типа, темно-коричневый, сильно- и среднеразложившийся; в центральной части профиля – средне- и слаборазложившийся. Отбор проб торфа проведен в соответствии с ГОСТ 17644-83 и ГОСТ 11306-2013 при помощи мотобурения с использованием оригинальных пробоотборников в 2015–2017 гг. Описания почвенных разрезов приведены ниже.
Рис. 1.
Участки отбора проб торфа. Схема построена с использованием Геоинформационного портала Республики Коми https://gis.rkomi.ru/.

Р-1 – торфяная олиготрофная (мерзлотная) почва (бугров) (табл. 1). Разрез заложен на участке крупного торфяного бугра с хорошо развитой кустарничково-моховой растительностью, диаметр бугра около 12 м. В покрове вороника, брусника, голубика, морошка, зеленые мхи (pp. Dicranum, Polytricum) и лишайники (p. Cladina), по краям бугра – карликовая береза. Корни растений проникают до глубины залегания мерзлоты (40–44 см).
Таблица 1.
Свойства торфяных почв
| Горизонт, глубина, см | Радиоуг-леродный возраст, л. н. | Растительные ассоциации, % | Степень разложе-ния, % | TOC, % | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | ОВП, мВ | Золь-ность, % |
|---|---|---|---|---|---|---|---|
| Торфяная олиготрофная (мерзлотная) почва (бугров) (Р-1) | |||||||
| Т1, 0–10 | Не опр. | Кустарничково-сфагновый вид торфа: (Sphagnum, Pleurozium) – 70; Ericales – 25; Betula sp. – 5 | 20 | 51.7 | 3.53 | 386 | 1.8 |
| Т2, 10–20 | Не опр. | Сфагновый: (Sphagnum, Polytrichum sp., Dicranum sp.) – 80; Eriophorum – 5; Ericales – 10; Betula sp. – 5 | 15 | 50.2 | 3.49 | 373 | 3.4 |
| Т3, 20–30 | 2080 ± 60 | Сфагновый: (Sphagnum, Polytrichum sp., Warnstorfia sp.) – 75; (Scheuchzeria, Eriophorum) – 15; Ericales – 10 | 20–25 | 53.8 | 3.56 | 447 | 4.1 |
| Т4, 30–40 | Не опр. | Шейхцериевый: (Sphagnum, Warnstorfia sp.) – 30; (Scheuchzeria, Eriophorum, Carex) – 60; Ericales – 5; Betula sp. – 5 | 25 | 55.9 | 3.71 | 416 | 3.0 |
| Т5, 40–54 | Не опр. | Осоково-шейхцериевый: (Sphagnum, Warnstorfia sp.) – 10; (Scheuchzeria, Carex, Eriophorum, Menyanthes trifoliate) – 75; Ericales – 5; Betula sp. – 10 | 25–30 | 53.8 | 3.92 | 382 | 5.0 |
| Т6, 54–69 | Не опр. | Осоково-шейхцериевый: (Sphagnum, Warnstorfia sp.) – 10; (Scheuchzeria, Carex, Eriophorum) – 85; Ericales – 5 | 30 | 53.7 | 4.26 | 382 | 7.1 |
| Т7, 69–83 | Не опр. | Осоково-шейхцериевый: (Sphagnum, Calliergon sp.) – 25; (Scheuchzeria, Carex, Eriophorum, Equisetum) – 70; Ericales – 5 | 25–30 | 56.9 | 4.51 | 302 | 3.1 |
| Т8, 83–97 | Не опр. | Осоково-шейхцериевый: Sphagnum – 15; (Scheuchzeria, Carex, Eriophorum, Menyanthes trifoliata) – 80; Ericales – 5 | 25–30 | 55.2 | 4.84 | 277 | 4.9 |
| Т9, 97–111 | Не опр. | Не опр. | 25–30 | 56.1 | 4.91 | 271 | 3.4 |
| Т10, 111–126 | Не опр. | Осоково-гипновый: (Sphagnum, Warnstorfia sp.) – 45; (Scheuchzeria, Carex, Eriophorum, Equisetum) – 50; Ericales – 5 | 25–30 | 53.9 | 4.70 | 271 | 5.2 |
| Т11, 126–140 | Не опр. | Не опр. | 35 | 53.5 | 4.79 | 267 | 6.1 |
| Т12, 140–154 | Не опр. | Хвощово-осоковый: (Sphagnum, Warnstorfia sp.) – 25; (Carex, Eriophorum, Equisetum, Menyanthes trifoliate) – 65; Ericales – 5; Betula sp. – 5 | 30–35 | 52.9 | 4.84 | 269 | 7.3 |
| Т13, 154–169 | Не опр. | Не опр. | 30–35 | 53.1 | 4.72 | 269 | 6.5 |
| Т14, 169–183 | Не опр. | Хвощово-осоковый: Sphagnum – 25; (Carex, Eriophorum, Equisetum, Menyanthes trifoliate) – 70; Ericales – 5 | 30–35 | 53.2 | 4.73 | 257 | 5.6 |
| Т15, 183–197 | Не опр. | Хвощово-осоковый: Sphagnum – 20; (Carex, Equisetum, Menyanthes trifoliate) – 70; Betula sp. – 5 | 30–35 | 52.5 | 4.63 | 247 | 8.0 |
| Т16, 197–211 | Не опр. | Хвощово-осоковый: Sphagnum – 5; (Carex, Eriophorum, Equisetum, Calamagrostis, Menyanthes trifoliate) – 85; Salix – 5; Betula sp. – 5 | 30–35 | 48.7 | 4.69 | 243 | 14.7 |
| ТC1, 211–226 | Не опр. | Хвощово-осоковый: (Carex, Equisetum, Menyanthes trifoliate) – 90; Salix – 5; Betula sp. – 5 | 30–35 | 23.7 | 4.71 | 243 | 55.6 |
| ТC2, 226–233 | Не опр. | Не опр. | 35–40 | 25.7 | 4.86 | 254 | 56.1 |
| С1, 233–240 | Не опр. | Не опр. | Не опр. | 4.5 | 4.59 | 254 | 91.8 |
| С2, 240–259 | Не опр. | Не опр. | Не опр. | 1.0 | 4.42 | 292 | 97.1 |
| Торфяная олиготрофная деструктивная (мерзлотная) почва (Р-2) | |||||||
| Т1, 0–10 | 2680 ± 70 | Кустарниково-шейхцериевый вид торфа: (Scheuchzeria, Carex, Eriophorum) – 60; Ericales – 20; Betula pubescens – 20 | >50 | 54.7 | 3.49 | 383 | 6.5 |
| Т2, 10–20 | 2570 ± 60 | Осоково-шейхцериевый: (Sphagnum, Warnstorfia sp.) – 15; (Scheuchzeria, Carex, Eriophorum) – 60; Ericales – 10; Betula pubescens – 15 | 30 | 57.4 | 3.58 | 401 | 2.8 |
| Т3, 20–30 | Не опр. | Осоково-шейхцериевый: Calliergon sp. – 5; (Scheuchzeria, Carex, Eriophorum, Menyanthes trifoliata) – 75; Ericales – 10; Betula pubescens – 10 | 30 | 57.3 | 3.69 | 387 | 2.1 |
| Т4, 30–40 | 4640 ± 70 | Осоково-шейхцериевый: (Scheuchzeria, Carex, Eriophorum) – 85; Ericales – 10; Betula pubescens – 5 | 30 | 57.4 | 3.81 | 371 | 2.3 |
| Т5, 40–50 | Не опр. | Осоково-шейхцериевый: Warnstorfia sp. – 5; (Scheuchzeria, Carex, Eriophorum, Menyanthes trifoliata) – 75; (Ericales, Salix) – 10; Betula pubescens – 10 | 25 | 55.3 | 3.94 | 357 | 4.7 |
| Т6, 50–60 | Не опр. | Осоково-шейхцериевый: Warnstorfia sp. – 5; (Scheuchzeria, Carex, Eriophorum, Menyanthes trifoliata, Equisetum) – 85; Salix – 5; Betula pubescens – 5 | 25 | 56.4 | 3.95 | 313 | 2.5 |
| Т7, 60–70 | 4920 ± 70 | Осоково-шейхцериевый: Sphagnum – 10; (Scheuchzeria, Carex, Eriophorum, Menyanthes trifoliata) – 85; Ericales – 5 | 25 | 55.8 | 4.06 | 265 | 3.3 |
| Т8, 70–79 | Не опр. | Осоково-шейхцериевый: (Warnstorfia sp., Sphagnum) – 10; (Scheuchzeria, Carex, Eriophorum, Menyanthes trifoliata, Equisetum) – 85; Ericales – 5 | 25 | 55.4 | 4.41 | 252 | 4.1 |
| Т9, 79–90 | 5980 ± 80 | Осоково-шейхцериевый: Sphagnum – 10; (Scheuchzeria, Equisetum, Carex, Eriophorum) – 75; (Ericales, Salix) – 15 | 25 | 54.8 | 4.59 | 252 | 3.4 |
| Т10, 90–101 | Не опр. | Осоково-шейхцериевый: (Sphagnum, Calliergon sp.) – 15; (Scheuchzeria, Carex, Eriophorum, Menyanthes trifoliata, Equisetum) – 80; Ericales – 5 | 25–30 | 54.0 | 4.75 | 237 | 4.0 |
| Т11, 101–112 | 6510 ± 90 | Хвощово-вахтовый: Sphagnum – 15; (Scheuchzeria, Carex, Eriophorum, Menyanthes trifoliata, Equisetum) – 85 | 30–35 | 51.0 | 4.75 | 237 | 10.4 |
| Т12, 112–123 | Не опр. | Хвощово-вахтовый: (Sphagnum, Calliergon sp.) – 15; (Carex, Eriophorum, Menyanthes trifoliata, Equisetum) – 80; Betula pubescens – 5 | 30 | 53.9 | 4.89 | 260 | 4.9 |
| Т13, 123–134 | Не опр. | Хвощово-сфагновый: (Sphagnum, Warnstorfia sp.) – 40; (Equisetum, Menyanthes trifoliata, Carex) – 45; (Ericales, Salix) – 10, Betula pubescens – 5 | 25–30 | 53.3 | 4.74 | 260 | 6.1 |
| Т14, 134–145 | 7010 ± 90 | Хвощово-осоковый: (Sphagnum, Mnium) – 10; (Carex, Equisetum, Menyanthes trifoliata, Calamagrostis) – 70; Salix – 10, Betula pubescens – 10 | 30–35 | 49.3 | 4.84 | 240 | 12.5 |
| Т15, 145–156 | Не опр. | Древесно-осоковый: (Carex, Equisetum, Menyanthes trifoliata) – 65; Salix – 5, Betula pubescens – 30 | 35–40 | 35.4 | 4.96 | 240 | 35.3 |
| ТC1, 156–167 | 8060 ± 180 | Древесно-осоковый: (Carex, Equisetum) – 65; Salix – 10, (Betula pubescens, Pinus sylvestris) – 25 | 45–50 | 10.6 | 5.10 | 261 | 77.7 |
| ТC2, 167–170 | Не опр. | Не опр. | Не опр. | Не опр. | 4.52 | 261 | Не опр. |
| С, 170–181 | Не опр. | Не опр. | Не опр. | 1.3 | 4.47 | 293 | 94.8 |
| Торфяная олиготрофная почва (мочажин) (Р-3) | |||||||
| O, 0–5 | Не опр. | Пушицево-сфагновый вид торфа: Sphagnum – 75; Eriophorum – 25 | 10 | 48.8 | 2.81 | 268 | 2.4 |
| Т1, 5–10 | Не опр. | Сфагновый: Sphagnum – 75; (Eriophorum, Carex lasiocarpa) – 25 | 10 | 48.7 | 2.89 | 245 | 3.3 |
| Т2, 10–20 | Не опр. | Сфагновый: Sphagnum – 80; (Eriophorum, Carex lasiocarpa) – 20 | 15 | 49.2 | 2.85 | 290 | 6.8 |
| Т3, 20–30 | Не опр. | Сфагновый: (Sphagnum, Calliergon sp.) – 85; Eriophorum – 15 | 15 | 50.6 | 2.85 | 294 | 3.2 |
| Т4, 30–40 | Не опр. | Сфагновый: (Sphagnum, Calliergon sp.) – 80; (Eriophorum, Carex lasiocarpa) – 20 | 15 | 51.8 | 2.86 | 332 | 2.2 |
| Т5, 40–60 | Не опр. | Сфагновый: Sphagnum – 90; Eriophorum – 10 | 20 | 46.6 | 3.15 | 316 | 10.0 |
| Т6, 60–80 | Не опр. | Шейцхериевый: (Sphagnum, Warnstorfia sp.) – 20; (Scheuchzeria, Carex limosa, Eriophorum) – 80 | 25 | 51.8 | 3.25 | 286 | 4.6 |
| Т7, 80–100 | Не опр. | Шейцхериево-сфагновый: (Sphagnum, Warnstorfia sp.) – 55; (Scheuchzeria, Carex limosa) – 45 | 25 | 54.9 | 3.23 | 282 | 6.5 |
| Т8, 100–115 | Не опр. | Вахтово-сфагновый: (Sphagnum, Warnstorfia sp.) – 30; (Menyanthes trifoliate, Equisetum, Scheuchzeria, Carex limosa) – 70 | 25–30 | 55.5 | 3.32 | 264 | 5.1 |
| Т9, 115–130 | Не опр. | Вахтово-травяной: Sphagnum – 25; (Menyanthes trifoliate, Equisetum, Scheuchzeria, Carex limosa) – 75 | 30–35 | 51.8 | 3.45 | 244 | 9.2 |
| T10, 130–155 | Не опр. | Травяно-сфагновый: (Sphagnum, Warnstorfia sp.) – 65; (Menyanthes trifoliate, Equisetum, Scheuchzeria, Carex limosa) – 35 | 35–40 | 49.2 | 3.58 | 236 | 26.1 |
| G, 155–170 | Не опр. | Не опр. | Не опр. | Не опр. | 3.33 | 275 | 95.2 |
Р-2 – торфяная олиготрофная деструктивная (мерзлотная) почва. Разрез заложен ближе к краю торфяного бугра, в 5 м к западу от Р-1, на оголенном торфяном пятне, лишенном растительного покрова. Площадь торфяного пятна ~6 м2, на поверхности пятна четко выражено криогенное растрескивание и участки микропучения верхнего слоя торфа. На поверхности пятна единично встречены водорослевые корочки и талломы накипных лишайников, по его краевой части отмечено развитие зеленых мхов и лишайников. Сезонное протаивание 50–55 см.
Р-3 – торфяная олиготрофная почва (мочажин). Разрез заложен в обводненной мочажине (топи) между двумя торфяными буграми с перепадом высот около 3–4 м. Мочажины в пределах рассматриваемого бугристого болота незамкнутые, по площади превосходят площадь бугров, местами встречаются озерковые комплексы. Растительный покров пушицево-осоково-сфагновый с участием морошки и клюквы, последние преимущественно распространены по окраине болотного комплекса. Многолетняя мерзлота до глубины 160 см отсутствует.
Торф в верхней части профилей почв разрезов Р-1 и Р-2 темно-коричневый, более разложившийся для почв на эродированном торфяном пятне. В центральной части профилей торф слабо- и среднеразложившийся, в эвтрофном типе торфяной залежи степень разложения (R) увеличивается вниз по профилю, достигая 45–50%. В пределах сезонно-талого слоя (СТС) образцы торфа олиготрофной и мезоолиготрофной части разрезов на бугре (Р-1, Р-2) кислые с pH 3.5–4.1, что связано с высоким содержанием фульвокислот и низкомолекулярных органических кислот [10] и низким – суммы обменных форм кальция и магния (3.0–7.7 смоль(экв)/кг). По показателю зольности 2–6% торф классифицируется как мало- и среднезольный. Содержание углерода составляет 50–57% и связано со степенью разложения торфа.
В слое многолетнемерзлых пород (ММП) происходит постепенное увеличение значений pH с 3.9 до 5.1 вниз по торфяному профилю, что связано со сменой типа грунтового питания в периоды образования этих слоев с мезоэвтрофного на эвтрофное и увеличение содержания суммы обменных оснований с максимумом 143 ммоль/кг в почвообразующей породе. Массовая доля углерода в торфе ММП колеблется в диапазоне 51–57%, закономерно уменьшаясь в органо-минеральных и минеральных горизонтах нижней части профиля. Среднее содержание золы больше, чем в СТС 3–12%, что характерно для низинного торфа. В органо-минеральных и минеральных горизонтах зольность достигает 26–95%.
До глубины 40 см торф Р-3 представлен слаборазложившимися растительными остатками сфагновых мхов с примесью пушицы (R = 15%). Вниз по профилю с увеличением вклада травянистых видов степень разложения торфа также растет до 35–40%. Торфяная олиготрофная почва мочажины (Р-3) характеризуется сильнокислой реакцией водной вытяжки из торфа СТС с pH 2.8–2.9; этот показатель несколько увеличивается в слоях переходного торфа до pH 3.6. Это обусловлено доминированием по всему профилю сфагновых видов торфа, сформированных большей частью в субаэральных условиях. Распределение содержания углерода по профилю неоднородное (47–56%), с некоторым увеличением в торфе переходного типа. По показателю зольности профиль относится к торфам низкой и средней зольности 2–7%. Повышенное содержание золы (10%) торфа из слоя 40–60 см может быть связан с подъемом уровня грунтовых вод в период его формирования. Такое же увеличение зольности наблюдается в Р-2 на глубине 101–114 см. Это связано с влиянием водорастворимых минеральных компонентов почвообразующей породы.
Торфонакопление на исследованной территории началось 8060 ± 180 л. н. (IGAN 6331), в конце бореального–начале атлантического периодов (BO2 – AT1). Данные палеорастительности разрезов Р-1 и Р-2 показывают, что затоплению был подвергнут облесенный сосной и березой (Betula pubescens L., Pinus sylvestris L.) участок с господством эвтрофных травянистых сообществ (Carex cespitosa L., Equisetum fluviatile L.) и примесью кустарниковой ивы (p. Salix). В начале атлантического периода 8060 ± 180–7010 ± 90 л. н. (IGAN 5043) (стадия палеосообществ I) зафиксирована самая высокая линейная скорость торфонакопления в период голоцена, достигающая 0.8 мм/год, что свидетельствует об оптимальных климатических условиях, с максимальными температурами климатического лета [2]. На стадии палеосообществ II 7010 ± 90–6510 ± 90 л. н. (IGAN 5042) и стадии III 6510 ± 90–4920 ± 70 л. н. (IGAN 5040) в растительном покрове возрастает доля менее требовательных к минеральному питанию Menyanthes trifoliate L. и Carex limosa L. и появляются сфагновые мхи (Sphagnum squarrosum L. и S. riparium L., S. obtusum L., S. teres L.). Данные виды сфагновых мхов обычно произрастают на сильнообводненных участках. Отсутствие древесных остатков, а также планомерное уменьшение линейной скорости прироста торфа до 0.2 мм/год свидетельствуют, что в этот период участок болотного массива представлял собой топь и или болотную протоку. Стадия IV и V 4920 ± 70–2570 ± 60 л. н. (I-GAN 5038) характеризуется значительным увлажнением и преобладанием мезоолиготрофных и олиготрофных сообществ растений Scheuchzeria palustris, Eriophorum sp., Carex limosa, сфагновых мхов (Sphagnum russowii, S. subsecundum). Увеличение доли остатков Betula pubescens в торфе вверх по профилю с глубины 40–50 см свидетельствует о некотором уменьшении увлажненности участка. Падение скорости торфонакопления до 0.07 мм/год отражает значительное похолодание в суббореальном периоде.
Верхний слой торфа 0–30 см (Р-1, стадия IV–V, 2080 ± 60 л. н. (IGAN 5046); Р-2, 2680 ± 70 л. н. (IGAN 5037)) – это кустарничково-сфагновый верховой торф, вышедший на поверхность в результате морозного пучения. Согласно данным датирования, образование многолетней мерзлоты на исследуемой территории произошло в наиболее холодный субатлантический период (SA-1) ~2080 л. н., что хорошо согласуется с данными литературы [9, 43]. В данный временной отрезок отмечается наименьшая скорость приращения торфа (0.02 мм/год). Стадия палеосообществ V в олиготрофной деструктивной (мерзлотной) почве отсутствует вследствие разрушения верхнего торфяного слоя эрозией.
Методика исследований. Работы по определению ботанического состава и степени разложения торфа выполнены в лаборатории болотных экосистем Института биологии Карельского НЦ РАН. Радиоуглеродное датирование проб торфа осуществляли в лаборатории географии и эволюции почв Института географии РАН при помощи ультранизкофонового жидкосцинтилляционного альфа/бета спектрометра-радиометра Quantulus 1220 (PerkinElmer, Финляндия). Калибровка выполнена согласно Radiocarbon calibration program (calib. rev. 7.1.0), погрешность метода датировки не превышает 70–80 лет для каждой даты [28, 42, 45].
Работы по определению содержания н-алканов в целевых образцах проводили в ЦКП “Хроматография” на базе Института биологии ФИЦ Коми НЦ УрО РАН. Для экстракции н-алканов использовали автоматический экстрактор ASE-350 (Thermo Scientific, США). 1 г растертой пробы торфа экстрагировали смесью хлористый метилен: ацетон (1 : 1) 3 раза последовательно (t = = 100°С, p = 1650 psi). Для концентрирования полученных экстрактов применяли аппарат Кудерна-Даниша (t = 70°С), во время работы которого растворитель заменяли на гексан. Полученный концентрат пробы (V = 2 см3) очищали от полярных органических примесей методом колоночной хроматографии, сорбент – силикагель 60 (Fluka 60741, размер частиц 0.063–0.2 мм). Далее проводили газохроматографический анализ н-алканов при помощи хромато-масс-спектрометра “TRACE DSQ” (Thermo Scientific, США), режим полного ионного тока. Для идентификации углеводородов использовали программное обеспечение Xcalibur Data System (ver. 1.4 SR1) и библиотеку масс-спектров NIST05 (ver. 2.0, 220 тыс. соединений), а количественное определение – по характерным для н-алканов трем ионам с массами 57, 71 и 85. Внутренний стандарт – додекан С12Н26.
Стандартная смесь н-алканов, холостая проба и повторная проба были добавлены в каждую партию образцов (максимум 10 шт.) для проверки загрязнения примесями, количественного определения, идентификации пиков, прецизионности и точности метода. В холостой пробе не было обнаружено целевых соединений. При анализе н‑алканов С21–С31 (с нечетным числом атомов углерода) были оценены метрологические характеристики методики (n = 5, P = 0.95). При этом рассчитывали относительное стандартное отклонение от среднего значения (аналитическое варьирование) при анализе компонентов для двух разных образцов торфа, которое во всех случаях находилось в интервале от 10 до 20%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
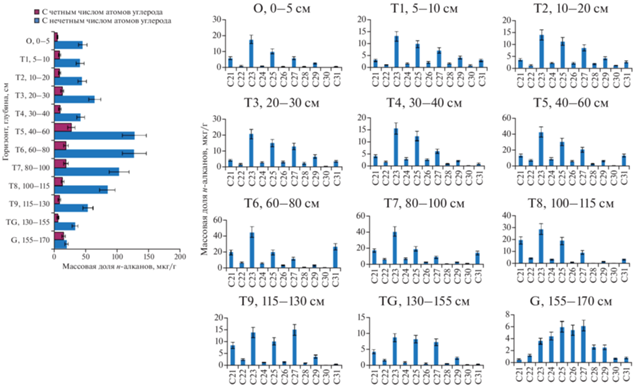
Распределение и состав н-алканов в экотоне крайнесеверной тайги. В исследованных торфяниках определены н-алканы С14–С31 со значительным преобладанием длинноцепочечных гомологов (>C21) с нечетным числом атомов углерода в молекуле по причине их основного происхождения от восков торфообразующих растений. Малое количество углеводородов со средней длиной цепи молекулы С14–С20 показывает незначительный привнос н-алканов из водорослей и бактерий [32]. Данные соединения далее не обсуждаются в статье вследствие их незначимой доли в общей сумме н-алканов. Суммарное содержание насыщенных углеводородов в торфяной олиготрофной (мерзлотной) почве (бугров) – 1.0–191.6 мкг/г (рис. 2), торфяной олиготрофной деструктивной (мерзлотной) почве – 7.7–137.9 мкг/г (рис. 3), торфяной олиготрофной почве (мочажин) – 34.5–154.9 мкг/г (рис. 4).
Рис. 2.
Распределение н-алканов в торфяной олиготрофной (мерзлотной) почве (бугров) (Р-1) крайнесеверной тайги.
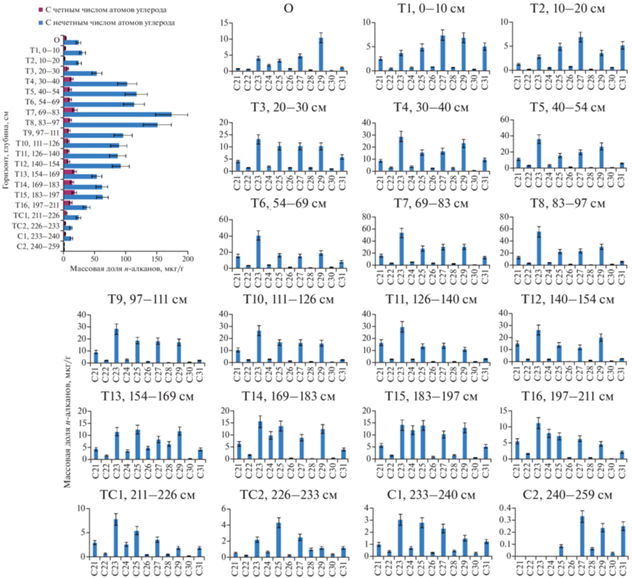
Рис. 3.
Распределение н-алканов в торфяной олиготрофной деструктивной (мерзлотной) почве (бугров) (Р-2) крайнесеверной тайги.

По профилям разрезов Р-1 и Р-2 вертикальная дифференциация н-алканов имеет схожие закономерности. В торфе, сформированном в начале атлантического периода 8060–7010 л. н., соответствующем горизонтам 134–170 см (Р-2) и 183–233 см (Р-1), преобладали растительные остатки травянистых родов (Carex, Equisetium) с примесью древесных (Betula pubescens) и кустарниковых родов (Salix, Ericales). Качественный состав н-алканов Р-2 смещен в сторону С27, С29, характерных для высших сосудистых растений, однако в Р-1 также высока доля гомологов С23, С25 вследствие более влажных условий его формирования в этот период (присутствие в ботаническом составе Menyanthes trifoliata и Sphagnum riparium). В данный промежуток времени происходило достаточно интенсивное образование н-алканов, учитывая большую степень разложения растительных остатков (35–50% для Р-2 и 30–40% для Р-1) – в пересчете на органический углерод массовая доля н-алканов составляет 66.9–178.9 мкг/г. Однако вследствие высокой зольности торфа данных горизонтов абсолютная массовая доля н-алканов в торфе незначительна и резко уменьшается в Р-2 от горизонта Т14 (35.3 мкг/г) до горизонта С (7.7 мкг/г) и в Р-1 от горизонта Т15 (80.1 мкг/г) до минерального горизонта С2 (1.0 мкг/г). В вышележащих горизонтах с Т13 (Р-2) и с Т14 (Р-1) до поверхности доля золы мала (табл. 1), доля органического углерода также практически постоянна – 51.0–57.4; 50.2–56.9% соответственно. Массовая доля н-алканов в горизонтах бугристых торфяников достигает 137.9 (Р-2) и 191.6 мкг/г (Р-1).
На следующей стадии торфонакопления (101–134 см Р-2, 126–197 см Р-1) (6510 л. н.) в растительном покрове возрастает доля вахты трехлистной (Menyanthes trifoliata), осоки топяной (Carex limosa), пушицы (Eriophorum sp.) и мезотрофных сфагновых мхов (Sphagnum riparium, Sphagnum squarrosum). В средний атлантик (AT-2) отмечается некоторое похолодание климата [2]. Массовая доля н-алканов составляет 70.4–80.6 мкг/г (Р-2) и 71.2–99.8 мкг/г (Р-1), а в качественном составе возрастает доля гомологов С23, С25, аккумулирующихся при разложении моховой растительности.
Стадия торфонакопления (10–101 см Р-2, 30–126 см Р-1) (6510–2680 (2080) л. н.) характеризуется бедным минеральным питанием и застойным переувлажнением. В растительном покрове повышенная доля шейхцерии (Scheuchzeria palustris), осоки топяной (Carex limosa) и пушицы (Eriophorum sp.), также присутствуют вересковые кустарнички. Массовая доля н-алканов в торфе: 59.0–137.9 (Р-2) и 96.3–191.6 мкг/г (Р-1). В качественном составе преобладают н-алканы С23, С25, С21. В Р-1 также высока доля гомологов С27, С29, что указывает на значительное накопление насыщенных углеводородов при разложении высших сосудистых растений и, как следствие, формирование его уже в более сухих условиях в этот период времени, чем Р-2. Рост массовой доли н-алканов в слоях торфа 70–79 и 20–40 см Р-2, вероятно, связан с потеплением позднего атлантического периода (AT-3, 5980~5500 л. н.) и среднего субборела (SB-2, ~4300~3200 л. н.) [1].
Верхний 20-сантиметровый слой торфа Р-2 (2680–2570 л. н.) – смесь более старых горизонтов торфов, сложенных травянистыми остатками средней степени разложенности и поднявшихся над поверхностью в результате морозного пучения. Кустарничково-мохово-лишайниковая растительность этого пятна позднее была разрушена вследствие эрозии. В результате присутствия макроостатков Betula pubescens и Ericales в слоях 0–20 см увеличивается доля гомологов высших растений (С25, С27, С29, С31), массовая доля н-алканов – 79.5–82.8 мкг/г. Близкий как по ботаническому составу и возрасту, так и по качественному составу н-алканов торф представлен в торфяной олиготрофной (мерзлотной) почве на глубине 30–40 см.
Верхние 30 см в Р-1 представлены преимущественно кустарничково-сфагновым и сфагновым видами торфа (Sphagnum russowii, Pleurozium, Polytrichum, Ericales), отлагавшимися с начала субатлантического периода (2080 л. н.). В условиях более сухого и холодного климата в современный период в горизонтах 0–30 см присутствуют значительные количества макроостатков Betula sp. и Ericales, а также их корни, значительно влияющие на смещение состава н-алканов в сторону соединений С27, С29, С31. Степень разложения этих горизонтов низкая (15–25%) из-за высокой доли сфагновых видов (55–60%), поэтому накопление насыщенных углеводородов минимально (27.0–33.3 мкг/г).
В начале субатлантического периода (2080 л. н.) также происходит почти полная остановка биохимических процессов деградации органических соединений в условиях отрицательных температур в горизонтах многолетнемерзлых пород глубже 70 см для Р-2 и 40 см для Р-1, вследствие чего количественный и качественный состав н-алканов фиксируется на определенном уровне в данный временной период. Тем не менее, в случаях временного оттаивания многолетней мерзлоты в периоды потепления субатлантического периода циклы деградации растительных остатков могли кратковременно запускаться вновь.
Торфяная олиготрофная почва (мочажин) (Р-3) развивалась с самого начала в условиях значительного избыточного увлажнения, в ботаническом составе нижних горизонтов 130–170 см преобладают мхи (Sphagnum и Warnstorfia sp.), а также травянистые остатки (Carex limosa, Equisetum, Menyanthes trifoliata). В составе идентифицированы как н-алканы С23, С25, характерные для мхов, так и С27, индикаторные для травянистых растительных остатков. Значительно увеличивается доля н-алкана С21, накопление которого возможно обусловлено фактором избыточного увлажнения. Суммарное содержание насыщенных углеводородов низкое из-за высокой минерализации и составляет 34.5–39.2 мкг/г.
В следующий временной период (горизонты 100–130 см) увеличивается доля гидрофильных травянистых растений (Menyanthes trifoliate, Equisetum, Carex limosa), в более влажных условиях их произрастания качественный состав н-алканов сдвигается в сторону гомологов С21, С23, С25, сумма углеводородов повышается до 61.5–98.1 мкг/г из-за увеличения доли органического углерода (46.6–55.5%) и небольшой зольности торфа (2.2–10.0%). Данные физико-химические параметры почвы Р-3 практически неизменны по профилю 0–130 см.
Дальнейшее торфонакопление (40–100 см) характеризуется еще более обильным застойным увлажнением. В растительном покрове резко повышается доля шейхцерии (Scheuchzeria palustris), пушицы (Eriophorum sp.) и осоки топяной (Carex limosa). С глубины 65 см и выше начинается значительное накопление остатков мхов рода Sphagnum. Доминируют гомологи н-алканов С23, С25, С21, также высока доля С27, что указывает на значительное накопление н-алканов при разложении высших сосудистых растений. Следует отметить увеличение гомолога С31, свидетельствующего о более теплом периоде климатического оптимума голоцена. Суммарная аккумуляция н-алканов в горизонтах 40–100 см максимальна и составляет 122.2–154.9 мкг/г.
Верхние 40 см в разрезе торфяной олиготрофной почвы (мочажин) представлены сфагновым типом торфа (доля Sphagnum – 75–90%), выделяющими при разложении н-алканы С23, С25. Также в ботаническом составе присутствует осока волосистоплодная (Carex lasiocarpa), характерная для мочажин и топких берегов водоемов, и видимо генерирующая при разложении гомологи С27, С29, С31, поступающие в том числе из корней живых растений. Степень разложения этих горизонтов еще меньше (10–15%), чем в разрезах Р-2 и Р-1, так как сфагновые мхи наиболее устойчивы к разложению [6, 11], поэтому накопление н-алканов уменьшается до 50.3–77.0 мкг/г.
Соотношения различных групп н-алканов для реконструкции климата. Оценка соотношений-биомаркеров Paq, Pwax, C23/C25, C23/C29 и C23/(C27 + C31) используется для получения информации о формирующих торфяник растениях в прошлые временные периоды и условиях увлажнения. Эта оценка отражает соотношения н-алканов разных растительных остатков друг к другу.
Paq первоначально разработан Ficken et al. [25] для оценки соотношения углеводородов в озерной растительности, а также для реконструкции климатических изменений при сопоставлении с количеством остатков водных макрофитов в торфе [34, 54, 55]:
(1)
${{P}_{{aq}}} = \frac{{{{{\text{C}}}_{{23}}} + {{{\text{C}}}_{{25}}}}}{{{{{\text{C}}}_{{23}}} + {{{\text{C}}}_{{25}}} + {{{\text{C}}}_{{29}}} + {{{\text{C}}}_{{31}}}}}.$Расчет Paq основан на том, что спектр н-алканов сфагновых видов максимален на C23 и C25, в то время как спектр н-алканов высших растений обычно максимален на C29 и C31, то есть близкие к единице отношения указывают на влажные условия формирования торфяных горизонтов, а меньшие значения – на сухие условия. Однако расчет только Paq может быть ошибочен, так как некоторые виды сфагнума и других мхов могут произрастать и в более сухих условиях и вносить значительный вклад в массовую долю алкана С25 [49] и не может использоваться для определения разницы между сфагнумом и водными макрофитами, особенно, когда растительные остатки сильно разложены или отсутствуют [38].
Pwax был разработан Zheng et al. [53] для оценки относительного вклада восковых углеводородов из высших растений к общему количеству углеводородов:
(2)
${{P}_{{wax}}} = \frac{{{{{\text{C}}}_{{27}}} + {{{\text{C}}}_{{29}}} + {{{\text{C}}}_{{31}}}}}{{{{{\text{C}}}_{{23}}} + {{{\text{C}}}_{{25}}} + {{{\text{C}}}_{{29}}} + {{{\text{C}}}_{{31}}}}}.$Близкие к единице значения этого соотношения отражают большой вклад сосудистых растений и, следовательно, более сухие условия, в то время как меньшие значения, близкие к нулю, указывают на влажные условия.
Bingham et al. [17] использовали соотношение C23/C25, которое показывает разницу между видами Sphagnum. Nichols et al. [34, 35] использовали соотношение н-алканов C23/C29, которые отражают пропорцию сфагнума и других мхов и сосудистых растений. Некоторые авторы [13, 27, 43] использовали модифицированный маркер C23/(C27 + C31) для описания палеовлажности торфяников, в том числе на севере России. При этом, как отмечает большинство исследователей, горизонты бугристых торфяников сложены из разных пропорций растительных остатков различных видов мхов и сосудистых растений, накопленных как в сухих, так и во влажных условиях прошлых временных периодов. Поэтому каждое соотношение по отдельности не совсем корректно отражает палеовлажность.
Расчет соотношений (рис. 5a, 5b) в торфяниках Р-2 и Р-1 указывают в целом на влажные условия их формирования в начальный период на глубинах 126–233 (Р-1) и 90–170 см (Р-2). При этом среднее на этих глубинах значение соотношений Paq, C23/C25, C23/C29 и C23/(C27 + C31) в разрезе Р-1 больше, чем в Р-2 (0.68; 1.31; 1.97; 1.19 и 0.62; 0.95; 1.74; 0.79 соответственно), а Pwax меньше (0.44 и 0.54 соответственно), что указывает на более влажные условия генезиса Р-1 ~8000–6800 л. н. В Р-2 134–145 см характеризуется повышением увлажнения в этот период и увеличением Paq, C23/C25, C23/C29 и C23/(C27 + C31) и уменьшением Pwax, а в Р-1 140–197 см – небольшим уменьшением влажности и незначительным уменьшением Paq, C23/C25, C23/C29 и C23/(C27 + C31) и увеличением Pwax. В вышележащем горизонте 126–140 см Р-1 и 101–112 см Р-2 опять несколько увеличивается увлажнение – на это также указывает повышение зольности до 7–10%, что характеризует высокий уровень грунтовых вод в этот период.
Рис. 5.
Значения соотношений Paq, Pwax, C23/C25, C23/C29 и C23/(C27 + C31), CPI, ACL27-31 в почвах торфяников крайнесеверной тайги: a – торфяная олиготрофная (мерзлотная) почва (бугров) (Р-1), b – торфяная олиготрофная деструктивная (мерзлотная) почва (бугров) (Р-2), c – торфяная олиготрофная почва (мочажин) (Р-3).

Стадия торфонакопления (20–90 см Р-2, 30–126 см Р-1) (~6200–3000 л. н.) характеризуется генезисом в более влажных условиях Р-2, а накопление растительных остатков в Р-1 уже в более сухих условиях в этот период времени. Среднее значение соотношений Paq, C23/C25, C23/C29 и C23/(C27 + C31) в Р-1 и Р-2: 0.66; 2.02; 1.66; 1.46 и 0.86; 2.71; 12.70; 2.45 соответственно, а Pwax: 0.46 и 0.28 соответственно. В Р-2 диагностируется резкий пик влажности по всем вычисляемым соотношениям, соответствующий глубинам 40–60 см (~4700 л. н.).
В горизонтах 0–30 см Р-1 и 0–20 см Р-2 среднее значение соотношений Paq, C23/C25, C23/C29 и C23/(C27 + C31) составляет 0.47; 0.96; 0.75; 0.51 и 0.77; 1.66; 4.9; 1.3 соответственно, Pwax: 0.65 и 0.40 соответственно, что указывает на более сухой и холодный климат с ~3000 л. н. до настоящего времени.
Формирование торфяной олиготрофной почвы (мочажин) происходило в условиях значительного избыточного увлажнения (Paq по всему профилю составляет 0.69–0.90, среднее – 0.81; Pwax – 0.24–0.50, среднее – 0.36). По экстремумам соотношений C23/C25, C23/C29 и C23/(C27 + C31) идентифицируется пиковое значение влажности на глубинах 60–100 см, а также в современный период (0–5 см) (рис. 5с).
Оценка соотношения нечетных н-алканов к четным (CPI – carbon preference index):
(3)
$CPI = \frac{{\sum {({{{\text{C}}}_{{21}}} + {{{\text{C}}}_{{23}}} + {{{\text{C}}}_{{25}}} + {{{\text{C}}}_{{27}}} + {{{\text{C}}}_{{29}}}) + \sum {({{{\text{C}}}_{{23}}} + {{{\text{C}}}_{{25}}} + {{{\text{C}}}_{{27}}} + {{{\text{C}}}_{{29}}} + {{{\text{C}}}_{{31}}})} } }}{{2 \times \sum {({{{\text{C}}}_{{22}}} + {{{\text{C}}}_{{24}}} + {{{\text{C}}}_{{26}}} + {{{\text{C}}}_{{28}}} + {{{\text{C}}}_{{30}}})} }}.$Значения CPI обычно связывают со степенью биоразложения органических остатков и микробиологической активностью [14], которая также может быть обусловлена климатическими параметрами. В холодном климате слабая микробная активность лишь незначительно изменяет молекулярное распределение н-алканов, сохраняя исходное преобладание нечетного числа углерода из растительных остатков и соответственно высокие значения CPI, тогда как теплый климат благоприятен для активной деградации растительных остатков и, следовательно, более низких значений CPI [48]. Более того, исследования, связанные с CPI современных почв и климатических условий, показывают, что значение CPI увеличивается с понижением температуры и осадков и может не зависеть от типов растительности [33]. Существуют данные о влиянии размера частиц торфа на состав н‑алканов и соответственно значения CPI, которые имеют относительно меньшие значения в более мелких, чем в более грубых фракциях. Полученные данные авторы обосновали более сильным гетеротрофным разложением мелкодисперсных фракций [51]. Глинистая фракция торфяных почв играет важную роль в устойчивости органического вещества к биодеградации, особенно в бескислородных средах [19].
Слои торфа 123–170 см Р-2 по данным радиоуглеродного датирования, сформированные в период ~8060–6800 л. н., характеризуются наименьшими значениями индексов CPI (2.9–4.8). Торф Р-1 на глубине 154–233 см также имеет минимальные показатели CPI. В ранний атлантический период (AT-1) температуры климатического лета были выше современных на 2–3°С [2]. В этот период происходит интенсивное образование н‑алканов при высокой микробиологической активности, что подтверждается высокой степенью разложения торфа (R = 35–50% для Р-2 и R = 30–40% для Р-1).
На следующей временной стадии (80–123 см Р-2, 54–154 см Р-1) (~6800–5980 л. н.) CPI значительно увеличивается до 7.1–9.7; 9.2–13.5 соответственно. По данным [1] средние температуры лета в средний атлантический период (AT-2) понизились по сравнению с AT-1 примерно на 0.5°С, что привело к уменьшению активности аэробных микроорганизмов. В слое 60–80 см Р-2 (5980–4920 л. н.), приходящемся на конец атлантического периода (AT-3) отмечено некоторое уменьшение индексов CPI. На последнюю треть атлантического периода приходится климатический оптимум голоцена II, в который температуры лета были сравнимы с AT-1. C наступлением суббореала (SB-1) резкое похолодание и уменьшение увлажненности климата привело к смене растительных сообществ. Наблюдается резкое увеличение CPI в слое 40–50 см Р-2, датированном периодом между (4920–4640 л. н.). Дальнейший рост CPI (20–40 см), вероятно, приходится на среднесуббореальное потепление SB-2.
В надмерзлотных воздухопроницаемых сезонно-талых слоях торфа (0–30 см Р-2 и 0–40 см Р-1) вследствие активности микроорганизмов в современный период (в сезоны положительных температур) протекают неперерывные процессы распада растительных остатков. Увеличивается доля четных н-алканов, а CPI падает до 4.1–7.6; 6.9–9.6 соответственно. При этом индекс CPI в Р-2 значительно меньше, чем Р-1 из-за лучшей прогреваемости слоев торфа в летний период. Это приводит к минерализации или трансформации нечетных н-алканов.
В Р-3 в нижних более разложившихся горизонтах 60–150 см, где во времена атлантического климатического оптимума активность микроорганизмов была высокой, CPI составляет 4.9–7.0. Тем не менее, индекс больше, чем в Р-2 и Р-1, вследствие избыточного увлажнения. В горизонтах 5–60 см в ботаническом составе доминирует сфагнум с низкой степенью разложения, но в то же время продуцирование четных гомологов увеличивается, CPI – 4.4–5.0. Причина этого – вероятно понижение уровня грунтовых вод в мочажине в некоторые годы, что приводит к большей активности микробиоты. Косвенно на это может указывать повышение зольности до 10.0% в горизонте Т5 (40–60 см). Очес живых растений мало подвержен деградации, продуцирует нечетные алканы из тканей растений, соответственно на глубине 0–5 см высокий CPI 9.1.
Оценка соотношения средней длины цепи н‑алкана (ACL – Average Chain Length). ACL также широко используется для реконструкции палеоклиматических условий произрастания торфообразующей растительности и представляет собой доминантное значение длины цепи длинноцепочечных н-алканов (>C27).
(4)
$AC{{L}_{{27 - 31}}} = \frac{{\sum {(27 \times {{{\text{C}}}_{{27}}} + 29 \times {{{\text{C}}}_{{29}}} + 31 \times {{{\text{C}}}_{{31}}})} }}{{\sum {({{{\text{C}}}_{{27}}} + {{{\text{C}}}_{{29}}} + {{{\text{C}}}_{{31}}})} }}.$Данный параметр показывает, что в более теплом климате сосудистые растения производят более длинноцепочечные липиды воска, чем в более прохладном климате, во избежание потерь влаги при испарении [26]. Многие авторы применяли это соотношение для реконструкции температурных условий [29, 39, 50], хотя существуют противоположные мнения об отсутствии корреляции между температурой и ACL высших растений [22], что указывает на осторожность при интерпретации изменений ACL в торфе.
Некоторое относительное увеличение данного параметра отмечено на глубинах 20–83 и 154–211 см Р-1, а также 10–30 и 100–156 Р-2, что может свидетельствовать об относительном потеплении климата в периоды аккумуляции органического вещества в этих слоях. В Р-3 четко идентифицируется пик теплого климата на глубинах 60–100 см (среднее значение ACL = 29.6). Ранее на схожих глубинах в этих же разрезах [4] было диагностировано значительное увеличение содержания 5,6‑ядерных полициклических ароматических углеводородов, аккумулирующихся предположительно при трансформации травянисто-древесной растительности во времена атлантических климатических оптимумов голоцена. В бугристых торфяниках Р-1 и Р-2 в слоях 80–154 и 30–100 см соответственно – диагностированы понижения ACL, то есть более прохладные климатические условия ~6200–4640 л. н., а также с ~2700 л. н. (глубины менее 10 см) до настоящего времени.
ВЫВОДЫ
Гомологический ряд н-алканов в бугристых торфяниках зоны крайнесеверной тайги представлен углеводородами С14–С31 с преобладанием структур с нечетным числом атомов углерода С21, C23, C25, C27, С29, С31. Содержание насыщенных углеводородов по всем исследованным профилям почв связано как с разным ботаническим составом растительных остатков торфяников, так и разными климатическими условиями их формирования (температура, влажность). Гомологи С21, C23, C25 ассоциируются, как правило, с гидрофильной растительностью (Sphagnum, Menyanthes trifoliate, Carex limosa, Scheuchzeria), а гомологи C27, С29, С31 – с высшей древесно-травянистой растительностью, произрастающей в более сухих условиях (Carex, Betula, Ericales, Equisetum). Суммарное содержание н-алканов максимально в период климатического оптимума голоцена и составляет 104–191 мкг/г для исследованных торфяников крайнесеверной тайги. С начала субатлантического периода (~2000 л. н.) количественный и качественный состав н-алканов в горизонтах многолетней мерзлоты торфяников фиксируется на определенном уровне вследствие почти полной остановки равновесных процессов накопления и трансформации органических веществ в условиях отрицательных температур. Исследование состава н-алканов и их соотношений позволяет диагностировать специфику изменений растительных ассоциаций в слоях торфа с течением времени, и с использованием других физико-химических показателей может применяться для комплексной реконструкции генезиса торфяника.
Список литературы
Андреичева Л.Н., Голубева Ю.В. Эволюция природной среды и климата Арктики в квартере // Вестник Института геологии. 2008. № 4. С. 2–6.
Андреичева Л.Н., Марченко-Вагапова Т.И., Буравская М.Н., Голубева Ю.В. Природная среда неоплейстоцена и голоцена на европейском северо-востоке России. М.: ГЕОС, 2015. 224 с.
Атлас Республики Коми по климату и гидрологии. М.: Дрофа, 1997. 116 с.
Габов Д.Н., Яковлева Е.В., Василевич Р.С., Кузнецов О.Л., Безносиков В.А. Полициклические ароматические углеводороды в мерзлотных бугристых торфяниках криолитозоны // Почвоведение. 2019. № 9. С. 1049–1062. https://doi.org/10.1134/S0032180X1909003X
Геокриологическая карта СССР, масштаб 1 : 2.5 млн / Под ред. Е.Д. Ершова, К.А. Кондратьевой. М.: Министерство геологии СССР и МГУ, 1998.
Головацкая Е.А., Никонова Л.Г. Разложение растительных остатков в торфяных почвах олиготрофных болот // Вестник Томск. гос. ун-та. Биология. 2013. № 3(23). С. 137–151. https://doi.org/10.17223/19988591/23/13
Грибова С.А., Исаченко Т.И., Лавренко Е.М. Растительность Европейской части СССР. Л.: Наука, 1980. 425 с.
Карта четвертичных отложений. Сер. Северо-Уральская. Q-41-V. Масштаб 1 : 200000. Министерство геологии и охраны недр СССР. 1959.
Пастухов А.В., Каверин Д.А., Гончарова Н.Н. Реликтовые бугристые мерзлотные торфяники на южном пределе Восточно-Европейской криолитозоны // Теоретическая и прикладная экология. 2015. № 1. С. 77–84.
Шамрикова Е.В., Каверин Д.А., Пастухов А.В., Лаптева Е.М., Кубик О.С., Пунегов В.В. Водорастворимые органические кислоты торфяных мерзлотных почв юго-востока Большеземельской тундры // Почвоведение. 2015. № 3. С. 288–295. https://doi.org/10.7868/S0032180X15030107
Яковлева Е.В., Габов Д.Н., Панюков А.Н. Аккумуляция полиаренов в растениях бугристых торфяников побережья Баренцева моря // Почвоведение. 2020. № 11. С. 1316–1327. https://doi.org/10.31857/S0032180X20110131
Aebig C.H.F., Curtin L., Hageman K.J., Moy C.M., Beltran C. Quantification of low molecular weight n-alkanes in lake sediment cores for paleoclimate studies // Organic Geochemistry. 2017. V. 107. P. 46–53.
Andersson R.A., Kuhry P., Meyers P., Zebuhr Y., Crill P., Morth M. Impacts of paleohydrological changes on n‑alkane biomarker compositions of a Holocene peat sequence in the eastern European Russian Arctic // Organic Geochemistry. 2011. V. 42. P. 1065–1075. https://doi.org/10.1016/j.orggeochem.2011.06.020
Andersson R.A., Meyers P.A. Effect of climate change on delivery and degradation of lipid biomarkers in a Holocene peat sequence in the Eastern European Russian Arctic // Organic Geochemistry. 2012. V. 53. P. 63–72. https://doi.org/10.1016/j.orggeochem.2012.05.002
Baas M., Pancost R., van Geel B., Sinninghe Damste J.S. A comparative study of lipids in Sphagnum species // Organic Geochemistry. 2000. V. 31. P. 535–541. https://doi.org/10.1016/S0146- 6380(00) 00037-1
Baker A., Routh J., Roychoudhury A.N. Biomarker records of palaeoenvironmental variations in subtropical Southern Africa since the late Pleistocene: Evidences from a coastal peatland // Palaeogeography, Palaeoclimatology, Palaeoecology. 2016. V. 451. P. 1–12. https://doi.org/10.1016/j.palaeo.2016.03.011
Bingham E.M., Mc Clymont E.L., Valiranta M., Mauquoy D., Roberts Z., Chambers F.M., Pancost R.D., Evershed R.P. Conservative composition of n-alkane biomarkers in Sphagnum species: implications for palaeoclimate reconstruction in ombrotrophic peat bogs // Organic Geochemistry. 2010. V. 41. P. 214–220. https:// doi. org/ 10. 1016/j. orgge ochem. 2009. 06. 010
Bray E.E., Evans E.D. Distribution of n-paraffins as a clue to recognition of source beds // Geochimica et Cosmochimica Acta. 1961. V. 22. Iss. 1. P. 2–15. https://doi.org/10.1016/0016-7037(61)90069-2
Chen S., Hong H., Huang X., Fang Q., Yin K., Wang C., Zhang Y., Cheng L., Algeo T.J. The role of organo-clay associations in limiting organic matter decay: Insights from the Dajiuhu peat soil, central China // Geoderma. 2018. V. 320. P. 149–160. https://doi.org/10.1016/j.geoderma.2018.01.013
Cranwell P.A. Diagenesis of free and bound lipids in terrestrial detritus deposited in a lacustrine sediment // Organic Geochemistry. 1981. V. 3. Iss. 3. P. 79–89. https://doi.org/10.1016/0146-6380(81)90002-4
Diefendorf A.F., Freeman K.H., Wing S.L., Graham H.V. Production of n-alkyl lipids in living plants and implications for the geologic past // Geochimica et Cosmochimica Acta. 2011. V. 75. P. 7472–7485. https://doi.org/10.1016/j.gca.2011.09.028
Diefendorf A.F., Freimuth E.J. Extracting the most from terrestrial plant-derived n-alkyl lipids and their carbon isotopes from the sedimentary record: A review // Organic Geochemistry. 2017. V. 103. P. 1–21. https://doi.org/10.1016/j.orggeochem.2016.10.016
Eglinton G., Hamilton R.J. Leaf Epicuticular Waxes: The waxy outer surfaces of most plants display a wide diversity of fine structure and chemical constituents // Science. 1967. V. 156. Iss. 3780. P. 1322–1335. https://doi.org/10.1126/science.156.3780.1322
Ficken K., Barber K., Eglington G. Lipid biomarker, δ13C and plantmacrofossil stratigraphy of a Scottish montane peat bog over the last two millennia // Organic Geochemistry. 1998. V. 28. P. 217–237. https://doi.org/10.1016/S0146-6380(97)00126-5
Ficken K.J., Li B., Swain D.L., Eglinton G. An n-alkane proxy for the sedimentary input of submerged/floating freshwater aquatic macrophytes // Organic Geochemistry. 2000. V. 31. P. 745–749. https://doi.org/10.1016/S0146-6380(00)00081-4
Gagosian R.B., Peltzer E.T. The importance of atmospheric input of terrestrial organic material to deep sea sediments // Organic Geochemistry. 1986. V. 10. Iss. 4–6. P. 661–669. https://doi.org/10.1016/S0146-6380(86)80002-X
He D., Huang H., Arismendi G.G. n-Alkane distribution in ombrotrophic peatlands from the northeastern Alberta, Canada, and its paleoclimatic implications // Palaeogeography, Palaeoclimatology, Palaeoecology. 2019. V. 528. P. 247–257. https://doi.org/10.1016/j.palaeo.2019.05.018
Hua Q., Barbetti M., Rakowski A.Z. Atmospheric radiocarbon for the period 1950-2010 // Radiocarbon. 2013. V. 55. Iss. 4. P. 2059–2072. https://doi.org/10.2458/azu_js_rc.v55i2.16177
Huang X., Meyers P.A., Xue J., Zhang Y., Wang X. Paleoclimate significance of n-alkane molecular distributions and δ2H values in surface peats across the monsoon region of China // Palaeogeography, Palaeoclimatology, Palaeoecology. 2016. V. 461. P. 77–86. https://doi.org/10.1016/j.palaeo.2016.08.011
Klaas B.J., Nierop G.J., Hageman J.A., Cleef A.M., Verstraten J.M. The straight-chain lipid biomarker composition of plant species responsible for the dominant biomass production along two altitudinal transects in the Ecuadorian Andes // Organic Geochemistry. 2006. V. 37. Iss. 11. P. 1514–1536. https://doi.org/10.1016/j.orggeochem.2006.06.018
Kolattukudy P.E. Lipid Polymers and Associated Phenols, Their Chemistry, Biosynthesis, and Role in Pathogenesis // The Structure, Biosynthesis, and Degradation of Wood. Recent Advances in Phytochemistry. 1977. V. 11. Springer, Boston, MA. https://doi.org/10.1007/978-1-4615-8873-3_6
Li G., Li L., Tarozo R., Longo W.M., Wang K.J., Dong H., Huang Y. Microbial production of long-chain n-alkanes: Implication for interpreting sedimentary leaf wax signals // Organic Geochemistry. 2018. V. 115. P. 24–31. https://doi.org/10.1016/j.orggeochem.2017.10.005
Luo P., Peng P., Lu H., Zheng Z., Wang X. Latitudinal variations of CPI values of long-chain n-alkanes in surface soils: Evidence for CPI as a proxy of aridity // Science China Earth Sciences. 2012. V. 55. Iss. 7. P. 1134–1146. https://doi.org/10.1007/s11430-012-4401-8
Nichols J.E., Booth R.K., Jackson S.T., Pendall E.G., Huang Y. Paleohydrologic reconstruction based on n‑alkane distributions in ombrotrophic peat // Organic Geochemistry. 2006. V. 37. P. 1505–1513. https://doi.org/10.1016/j.orggeochem.2006.06.020
Nichols J.E., Walcott M., Bradley R., Pilcher J., Huang Y. Quantitative assessment of precipitation seasonality and summer surface wetness using ombrotrophic sediments from an Arctic Norwegian peatland // Quaternary Research. 2009. V. 72. P. 443–451. https://doi.org/10.1016/j.yqres.2009.07.007
Njagi D.M., Routh J., Olago D., Gayantha K. A multi-proxy reconstruction of the late Holocene climate evolution in the Kapsabet Swamp, Kenya (East Africa) // Palaeogeography, Palaeoclimatology, Palaeoecology. 2021. V. 574. P. 110475. https://doi.org/10.1016/j.palaeo.2021.110475
Nott C.J., Xie S., Avsejs L.A., Maddy D., Chambers F.M., Evershed R.P. n-alkane distributions in ombrotrophic mires as indicators of vegetation change related to climatic variation // Organic Geochemistry. 2000. V. 31. P. 231–235. https://doi.org/10.1016/S0146-6380(99) 00153-9
Ortiz J.E., Gallego J.L., Torres T., Díaz-Bautista A., Sierra C. Palaeoenvironmental reconstruction of Northern Spain during the last 8000 cal yr BP based on the biomarker content of the Roñanzas peat bog (Asturias) // Organic Geochemistry. 2010. V. 41. P. 454–466. https://doi.org/10.1016/j.orggeochem.2010.02.003
Ortiz J.E., Torres T., Delgado A., Julia R., Lucini M., Llamas F.J., Reyes E., Soler V., Valle M. The palaeoenvironmental and palaeohydrological evolution of Padul Peat Bog (Granada, Spain) over one million years, from elemental, isotopic and molecular organic geochemical proxies // Organic Geochemistry. 2004. V. 35. P. 1243–1260. https://doi.org/10.1016/j.orggeochem.2004.05.013
Pancost R.D., Baas M., van Geel B., Sinninghe Damste J.S. Biomarkers as proxies for plant inputs to peats: an example from a sub-boreal ombrotrophic bog // Organic Geochemistry. 2002. V. 33. Iss. 7. P. 675–690. https://doi.org/10.1016/S0146-6380(02)00048-7
Rao Z., Wu Y., Zhu Z., Jia G., Henderson A. Is the maximum carbon number of long-chain n-alkanes an indicator of grassland or forest? Evidence from surface soils and modern plants // Chinese Sci. Bull. 2011. V. 56. Iss. 16. P. 1714–1720. https://doi.org/10.1007/s11434-011-4418-y
Reimer P.J., Bard E., Bayliss A., Beck J.W., Blackwell P.G., Bronk R.C., Buck C.E., Cheng H., Edwards R.L., Friedrich M., et al. IntCal13 and Marine13 Radiocarbon Age Calibration Curves 0–50,000 Years cal BP // Radiocarbon. 2013. V. 55. Iss. 4. P. 1869–1887. https://doi.org/10.2458/azu_js_rc.55.16947
Routh J., Hugelius G., Kuhry P., Filley T., Tillman P.K., Becher M., Crill P. Multi-proxy study of soil organic matter dynamics in permafrost peat deposits reveal vulnerability to climate change in the European Russian Arctic // Chemical Geology. 2014. V. 368. P. 104–117. https://doi.org/10.1016/j.chemgeo.2013.12.022
Schellekens J., Buurman P. n-alkane distributions as palaeoclimatic proxies in ombrotrophic peat: The role of decomposition and dominant vegetation // Geoderma. 2011. V. 164. P. 112–121. https://doi.org/10.1016/j.geoderma.2011.05.012
Shishlina N., Sevastyanov V., Zazovskaya E., van der Plicht J. Reservoir effect of archaeological samples from steppe bronze age cultures in southern Russia // Radiocarbon. 2014. V. 56. P. 767–778. https://doi.org/10.2458/56.16942
Skreczko S., Szymczyk A., Nadłonek W. Impacts of vegetation and palaeohydrological changes on the n-alkane composition of a Holocene peat sequence from the Upper Vistula Valley (southern Poland) // J. Soils and Sediments. 2021. V. 21. P. 2709–2718. https://doi.org/10.1007/s11368-021-02981-4
Strauss J., Schirrmeister L., Mangelsdorf K., Eichhorn L., Wetterich S., Herzschuh U. Organic-matter quality of deep permafrost carbon – a study from Arctic Siberia // Biogeosciences. 2015. V. 12. P. 2227–2245. https://doi.org/10.5194/bg-12-2227-2015
Vogts A., Moossen H., Rommerskirchen F., Rullkötter J. Distribution patterns and stable carbon isotopic composition of alkanes and alkan-1-ols from plant waxes of African rain forest and savanna C3 species // Organic Geochemistry. 2009. V. 40. Iss. 10. P. 1037–1054. https://doi.org/10.1016/j.orggeochem.2009.07.011
Vonk J.E., Gustafsson Ö. Calibrating n-alkane Sphagnum proxies in sub-Arctic Scandinavia // Organic Geochemistry. 2009. V. 40. Iss. 11. P. 1085–1090. https://doi.org/10.1016/j.orggeochem.2009.07.002
Wang J., Axia E., Xu Y., Wang G., Zhou L., Jia Y., Chen Z., Li J. Temperature effect on abundance and distribution of leaf wax n-alkanes across a temperature gradient along the 400 mm isohyet in China // Organic Geochemistry. 2018. V. 120. P. 31–41. https://doi.org/10.1016/j.orggeochem.2018.03.009
Wang X., Huang X., Sachse D., Hu Y., Xue J., Meyers P.A. Comparisons of lipid molecular and carbon isotopic compositions in two particle-size fractions from surface peat and their implications for lipid preservation // Environ. Earth Sci. 2016. V. 75. P. 1142. https://doi.org/10.1007/s12665-016-5960-3
Zech M., Krause T., Meszner S., Faust D. Incorrect when uncorrected: Reconstructing vegetation history using n-alkane biomarkers in loess-paleosol sequences – A case study from the Saxonian loess region, Germany // Quaternary International. 2013. V. 296. P. 108–116. https://doi.org/10.1016/j.quaint.2012.01.023
Zheng Y., Zhou W., Meyers P.A., Xie S. Lipid biomarkers in the Zoigê-Hongyuan peat deposit: Indicators of Holocene climate changes in West China // Organic Geochemistry. 2007. V. 38. № 11. P. 1927–1940. https://doi.org/10.1016/j.orggeochem.2007.06.012
Zhou W., Xie S., Meyers P.A., Zheng Y. Reconstruction of late glacial and Holocene climate evolution in southern China from geolipids and pollen in the Dingnan peat sequence // Organic Geochemistry. 2005. V. 38. P. 1272–1284. https://doi.org/10.1016/j.orggeochem.2005.04.005
Zhou W., Zheng Y., Meyers P.A., Jull A.J.T., Xie S. Postglacial climate-change record in biomarker lipid compositions of the Hani peat sequence, northeastern China // Earth Planet. Sci. Lett. 2010. V. 294. P. 37–46. https://doi.org/10.1016/j.epsl.2010.02.035
Zibulski R., Wesener F., Wilkes H., Plessen B., Pestryakova L.A., Herzschuh U. C=N ratio, stable isotope (13C, 15N), and n-alkane patterns of brown mosses along hydrological gradients of low-centred polygons of the Siberian Arctic // Biogeosciences. 2017. V. 14. P. 1617–1630. https://doi.org/10.5194/bg-14-1617-2017
Дополнительные материалы отсутствуют.