Почвоведение, 2022, № 7, стр. 860-875
Зависимость разложения органического вещества почвы и растительных остатков от температуры и влажности в длительных инкубационных экспериментах
В. М. Семенов a, *, Т. Н. Лебедева a, Н. Б. Зинякова a, Д. П. Хромычкина a, Д. А. Соколов a, В. О. Лопес де Гереню a, И. К. Кравченко b, Х. Ли c, М. В. Семенов d
a Институт физико-химических и биологических проблем почвоведения РАН – обособленное подразделение ФИЦ “Пущинский научный центр биологических исследований РАН”
142290 Пущино, Московской области, ул. Институтская, 2, Россия
b Фундаментальные основы биотехнологии РАН
117312 Москва, проспект 60-летия Октября, 7, корп. 2, Россия
c Институт прикладной экологии Академии наук КНР
110016 Шеньянг, Китай
d Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
* E-mail: v.m.semenov@mail.ru
Поступила в редакцию 25.11.2021
После доработки 07.12.2021
Принята к публикации 26.01.2022
- EDN: ACKYUG
- DOI: 10.31857/S0032180X22070085
Аннотация
Температура и влажность являются главными внешними факторами, контролирующими разложение и минерализацию органического вещества в почве. В двух многомесячных опытах исследовали влияние температуры (8 и 22°C) и влажности (15, 30 и 45 мас. %) серой лесной почвы (Luvic Retic Greyzemic Phaeozems (Loamic)) на разложение остатков деревьев (листья, мелкие ветви, тонкие корни) и сельскохозяйственных культур (надземная масса и корни клевера, солома и корни ячменя). Грубоизмельченные (2–10 мм) растительные остатки добавляли в почву в сухом виде в количестве 1% от массы почвы. Разложение органического вещества почвы и растительных остатков оценивали по количеству выделившегося из почвы С–СО2. Эффективность и скорость разложения органического вещества почвы и растительных остатков больше зависели от вида разлагаемого материала, чем от уровней температуры и влажности. Преимущественное разложение легкоразлагаемых компонентов скрадывало температурный отклик устойчивых соединений и низкокачественных растительных остатков. Медленно разлагаемые растительные остатки были более чувствительными к увлажнению почвы. Температурные коэффициенты Q10 минерализации органического вещества почвы и растительных остатков равнялись в среднем 1.66 ± 0.41 и 1.39 ± 0.06 соответственно, а влажностные коэффициенты W10 в диапазонах гравиметрической влажности 15–30 и 30–45% составляли для почвы 1.22 ± 0.09 и 1.21 ± 0.05 соответственно, а для растительных остатков – 1.29 ± 0.20 и 1.25 ± 0.13.
ВВЕДЕНИЕ
Мировые запасы почвенного углерода примерно в 3 раза больше атмосферного пула углерода, поэтому даже незначительные нарушения целостности почвенного органического вещества (ПОВ) могут сопровождаться ростом концентрации СО2 в атмосфере и повышением температуры приземного слоя воздуха. Глобальное потепление становится одним из доминирующих факторов воздействия на биосферу, а обусловленные изменением климата потери почвенного углерода происходят во многих экосистемах, демонстрируя в глобальном масштабе прогрессирующий тренд [10]. Считается, что микробное разложение органического вещества более чувствительно к глобальному потеплению, чем фотосинтез [33, 34, 39]. Если гетеротрофное дыхание контролируется главным образом температурой и влажностью почвы, то скорость фотосинтеза лимитируется более широким числом факторов, включая свет, концентрацию CO2 и доступность питательных веществ. Поэтому существующее равновесие между фиксацией и потерями углерода в экосистемах может измениться при более теплом климате в сторону резкого увеличения потока CO2 из почвы в атмосферу [16, 19]. Засуха, как одно из проявлений глобального потепления, оказывает воздействие на все звенья почвенного цикла углерода, включая продуктивность растений (NPP), поступление углерода в почву с растительным опадом и ризодепозитами, разложение растительных остатков в почве, почвенные пулы углерода и почвенную эмиссию CO2 [20]. В засушливых условиях уменьшаются потери почвенного углерода, поскольку разложение органического вещества замедляется сильнее, чем ограничивается поступление растительного углерода в почву [12, 50]. Однако секвестрирующий эффект засухи не стабилен и не продолжителен из-за быстрого отклика микробного сообщества на увлажнение [30, 44]. В свою очередь, накопление в почве органического вещества может уменьшить риск засухи в сельском хозяйстве [31].
Температура и влажность почвы являются основными внешними детерминантами почвенного дыхания [4]. Обнаруживаемый отклик гетеротрофного дыхания микроорганизмов и разложения органического вещества на изменение температуры при прочих постоянных условиях характеризует температурную чувствительность организмов-деструкторов и органического вещества [15, 19, 21, 22]. Температурная чувствительность разложения органического вещества проявляется по-разному в зависимости от природы вещества (растительные остатки или ПОВ), типа растительных остатков (надземная биомасса или корни), биохимического качества разлагаемого материала, доступности (защищенности) субстрата, структуры и функционального профиля микробного сообщества, влажности, аэрации, питательных свойств и pH почвы, уровня температуры [8, 15, 17, 19, 21, 24, 26, 27, 32, 36, 38, 42, 43]. По литературным данным различия в скорости разложения листового опада и тонких корней в разных биомах на 95 и 86% объяснялись среднегодовой температурой почвы [47].
Влажность почвы является вторым после температуры ключевым фактором, контролирующим микробное разложение почвенного органического углерода [41]. Основные механизмы влияния влажности на разложение органического вещества почвы и растительных остатков – это контроль подвижности и транспорта субстратов и ферментов, физиологической активности микроорганизмов, потоков газов в поровом пространстве, разрушение физических барьеров между порами, заселенными микроорганизмами, и органическими субстратами, сорбция воды растительными остатками из окружающих микрозон и ее удерживание [37]. Недостаток влаги ограничивает диффузию субстратов и ферментов в почвенной массе, уменьшает физиологическую и метаболическую активность микроорганизмов, что в итоге приводит к ослаблению почвенного дыхания [45]. Увеличение влажности до полевой влагоемкости после кратковременной засухи повышало вклад разложения листовой подстилки в общее почвенное дыхание с 5 до 37% [14]. При переувлажнении почвы нарушается газообмен, а поровое пространство становится непригодным из-за дефицита кислорода для жизнедеятельности аэробных микроорганизмов [41, 46]. Таким образом, отклик гетеротрофного дыхания на изменения влажности почвы не является монотонным; дыхание почвы возрастает от низкой до средней влажности почвы, достигает плато при оптимальной влажности и снова снижается при высокой влажности почвы [4, 18, 48]. Хотя общие закономерности влияния уровня влажности на разложение органического вещества и почвенное дыхание известны, до сих пор нет единого мнения о выраженности отклика на влажность и атмосферные осадки [14, 37, 48]. Среди причин расхождения выводов – различия в водоудерживающей способности, текстуре и структуре исследуемых почв [28], а также маскирующие эффекты температуры [18].
Цель исследования – оценить чувствительность разложения органического вещества почвы и разных видов растительных остатков к изменению температуры и влажности и определить температурные и влажностные коэффициенты для быстро и медленно разлагаемых органических материалов.
ОБЪЕКТЫ И МЕТОДЫ
Характеристика органических материалов и условия проведения опытов. Исследования проводили с образцами серой лесной почвы (Luvic Retic Greyzemic Phaeozems (Loamic)), лесной растительности и сельскохозяйственных культур. Почва была отобрана в сентябре на территории мелколиственного леса (54°8341′ N 37°5729′ E) и под посевом ячменя (54°8240′ N 37°5641′ E). Из проб, отобранных в нескольких точках верхнего (0–20 см) слоя, готовили смешанные образцы целинной и пахотной почвы. Во время высушивания на открытом воздухе массу почвы просеивали через сито 2 мм, удаляя крупные фрагменты растительных остатков >2 мм. Образцы лесной растительности (опавшие листья осины, опавшие мелкие ветви деревьев диаметром <10 мм, тонкие корни деревьев диаметром <10 мм) отбирали в октябре, сельскохозяйственных культур (надземная масса и корни клевера, солома и корни ячменя) – в первой декаде сентября. Все органические материалы высушивали при температуре 65°C и измельчали до частиц 10–2 мм, просеивая через сито с диаметром отверстий 2 мм. Величины содержания углерода и азота в органическом веществе почв и растительных остатков приведены в табл. S1 . Надземная масса и корни клевера были отнесены к быстро(сильно)разлагаемым, листья осины – к умеренно(средне)разлагаемым, а солома и корни ячменя, тонкие корни и мелкие ветви деревьев – к медленно(слабо)разлагаемым [3].
Опыт 1 с инкубацией растительных остатков с почвой при разных температурах. Воздушно-сухие навески растительных остатков массой 0.1 г смешивали с 10 г сухой почвы, помещали во флаконы объемом 100 мл, добавляли дистиллированную воду до влажности почвы 30 мас. %, закрывали силиконовыми пробками и инкубировали при температуре 8 и 22°C на протяжении 278 сут. Остатки лесной растительности инкубировались с почвой из-под леса, остатки сельскохозяйственных культур – с пахотной почвой. Контролями были образцы почвы из-под леса и с пашни без растительных остатков. Постоянную влажность инкубируемых образцов поддерживали регулярным добавлением дистиллированной воды до постоянной массы. Повторность – трехкратная. За весь период инкубации произведено 43 отбора газовых проб, в которых измеряли концентрацию С–СО2.
Опыт 2 с инкубацией растительных остатков с почвой при разных уровнях влажности почвы. Процедура подготовки опыта 2 была той же, что и для опыта 1. Флаконы с лесной и пахотной почвой с растительными остатками и без растительных остатков увлажняли до 15, 30 и 45 мас. % (приблизительно 32, 65 и 100% полной полевой влагоемкости), закрывали силиконовыми пробками и инкубировали при температуре 22°C на протяжении 249 сут. Исходные уровни влажности поддерживались на протяжении всего периода инкубации. Повторность – трехкратная. За весь период инкубации произведено 46 отборов газовых проб, в которых измеряли концентрацию С–СО2.
Определение скорости эмиссии и кумулятивной продукции C–CO2 инкубируемой почвой. Концентрацию C–CO2 в газовых пробах определяли на газовом хроматографе КристалЛюкс 4000М. Первое измерение газовой фазы проводили через 3–4 ч после первого увлажнения. В течение первой недели – ежедневно, затем – три раза в неделю. В течение второго месяца инкубации измерения С–СО2 проводили 2 раза в неделю, начиная с третьего месяца инкубации – 1 раз в 7 или 10 сут. После каждого срока отбора газовых проб флаконы с инкубируемыми образцами проветривали в течение 20 мин в вытяжном шкафу и закрывали силиконовой пробкой до следующего измерения. Кумулятивную величину продукции С–СО2 получали прибавлением количества выделившегося углерода в каждый срок измерения к сумме за предыдущие сроки. Чистое образование С–СО2 из растительных остатков устанавливали путем вычета C–CО2, выделившегося на контроле из почвы без добавления остатков.
Определение эффективности разложения органического вещества почвы и растительных остатков. Эффективность разложения органического вещества устанавливалась по кумулятивному количеству C–CO2, выделившегося на единицу массы образца, или в процентах к исходному содержанию органического углерода (Сорг) в соответствующем образце. Константу скорости разложения исследуемых образцов почвы и органических остатков в разные периоды инкубации и за весь исследуемый период рассчитывали по уравнению (1):
(1)
$k~ = ~--{{\left[ {\ln \left( {{{C}_{t}}_{2}} \right)--\ln \left( {{{C}_{t}}_{1}} \right)} \right]} \mathord{\left/ {\vphantom {{\left[ {\ln \left( {{{C}_{t}}_{2}} \right)--\ln \left( {{{C}_{t}}_{1}} \right)} \right]} t}} \right. \kern-0em} t},$Потенциально-минерализуемое органическое вещество (С0) в почве и растительных остатках рассчитывали по кумулятивному количеству минерализационных потерь органического вещества в виде C–CО2, используя однокомпонентное уравнение кинетики первого порядка (2):
где: Ct – сумма минерализационных потерь С–СО2 за время t, % от исходного Сорг; С0 – содержание углерода потенциально-минерализуемого органического вещества, % от Сорг в образце; k – константа скорости минерализации, сут–1.Температурный коэффициент разложения (Q10) вычисляли по формуле Вант Гоффа (3):
(3)
${{Q}_{{10}}}~ = ~{{({{{{R}_{2}}} \mathord{\left/ {\vphantom {{{{R}_{2}}} {{{R}_{1}}}}} \right. \kern-0em} {{{R}_{1}}}})}^{{{{10} \mathord{\left/ {\vphantom {{10} {(T2 - T1)}}} \right. \kern-0em} {(T2 - T1)}}}}},$Влажностный коэффициент (W10), показывающий изменение продукции С–СО2 с увеличением влажности почвы на 10 мас. % [6], рассчитывали по формулам (4) и (5):
(4)
${{R}_{{W1 + 10}}}~ = ~{{R}_{W}}_{1} + {{({{R}_{W}}_{2}--{{R}_{W}}_{1}) \times 10} \mathord{\left/ {\vphantom {{({{R}_{W}}_{2}--{{R}_{W}}_{1}) \times 10} {({{W}_{2}}--{{W}_{1}})}}} \right. \kern-0em} {({{W}_{2}}--{{W}_{1}})}},$(5)
${{W}_{{10}}}~ = ~~{{{{R}_{{W1 + 10}}}} \mathord{\left/ {\vphantom {{{{R}_{{W1 + 10}}}} {{{R}_{{W1}}}}}} \right. \kern-0em} {{{R}_{{W1}}}}},$Содержание общего углерода и общего азота в почве и растительных остатков определяли с помощью CNHS-анализатора (Leco 932, США). Вычисление биокинетических параметров минерализации C0 и k (уравнение (2)) проводили методом нелинейной оценки программы Statistica 10. Коэффициенты уравнения (2) с уровнем значимости P > 0.05 отвергались. Для расчетов температурного и влажностного коэффициентов, статистического анализа данных и графической иллюстрации экспериментального материала использовали программу MS Excel. Экспериментальные данные приведены в виде средних величин и их стандартных отклонений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние температуры и влажности на динамику разложения растительных остатков в почве. В опыте 1 наиболее существенные различия в эмиссии С–СО2 при разных температурах проявлялись на протяжении 1–2 недель с начала инкубации (рис. S1 ). При умеренной температуре 22°C наибольшая скорость выделения СО2 из почвы приходилась на первые трое суток с начала инкубации, после чего резко уменьшалась. При пониженной температуре (8°C) требовалось от 3 до 7 сут, чтобы достичь самой высокой для этой температуры скорости выделения СО2, которая при этом была меньше, чем при 22°C. По мере адаптации микроорганизмов к существующей температуре и израсходования легкоразлагаемых субстратов размеры выделения С–СО2 из почвы, инкубируемых при 8 и 22°C, выравнивались. Тем не менее, даже по истечении девяти месяцев инкубации более теплые условия стимулировали эмиссию С–СО2 из почвы, особенно в вариантах с растительными остатками.
Замедленное разложение и иной вид динамики разложения при пониженной температуре хорошо иллюстрируются долей минерализационных потерь углерода на разных стадиях инкубации (рис. S2 ). Если при низкой температуре 8°C за начальные 30 сут инкубации выделилось в зависимости от вида растительных остатков 18–53% от всего учтенного С–СО2, то при умеренной температуре 22°C – 21–70% соответственно. Наоборот, в течение последующих двух месяцев между 30 и 90-и сутками процент минерализационных потерь С–СО2 был выше при низкой температуре, чем при умеренной (24–36 и 17–25% соответственно). На конечном этапе наблюдений между 180–276 сутками, когда разложению в основном подвергаются исходно прочные компоненты растительных остатков, процент минерализационных потерь вновь был выше при высокой температуре, за исключением видов с узким отношением C/N (листья и корни клевера).
В отличие от влияния температуры динамика выделения С–СО2 при разных уровнях увлажнения была однотипной (рис. S3 ). При всех трех уровнях увлажнения наблюдалось экспоненциальное уменьшение скорости эмиссии диоксида углерода с течением времени без каких-либо пиков, и чем выше была исходная влажность, тем эквивалентно больше образовывалось С–СО2. На фоне трех уровней влажности более значимым фактором динамики выделения С–СО2 был вид разлагаемого материала. Например, при трех испытываемых уровнях влажности за первый месяц разложения листьев осины, корней деревьев, надземной массы клевера и корней ячменя выделилось 50–52, 44–45, 64–66 и 31–32% соответственно от всего учтенного С–СО2 за весь период инкубации (рис. S4 ). В конце инкубации между 180 и 249 сутками независимо от уровня влажности разложение этих видов растительных остатков давало соответственно 10–11, 14–15, 5–7 и 19% кумулятивной эмиссии С–СО2. Таким образом, изменение температуры отражается как на динамике, так и на размерах продукции С–СО2 разлагаемым органическим веществом, тогда как изменение влажности почвы – только на размерах разложения.
Эффективность минерализации органического вещества почвы и растительных остатков. В опыте 1 потенциально-минерализуемый пул органического вещества пахотной и лесной почвы составлял соответственно 2.6–6.5 и 5.5–8.0% от Сорг, остатков древесных растений – от 21 до 42%, а остатков сельскохозяйственных культур – от 31 до 72% (табл. 1). В опыте 2 с разными уровнями влажности потенциальная минерализация органического вещества почвы, остатков деревьев и сельскохозяйственных культур варьировала в пределах 3.8–9.4, 9–41 и 14–75% соответственно (табл. 2). Минерализационная способность органического вещества почвы была в среднем в 6 раз меньше, чем растительных остатков. Величины потенциальной минерализации органического вещества почвы и растительных остатков при стандартных условиях температуры (22°C) и влажности (30 мас. %) были идентичны величинам, полученным в предыдущих исследованиях [3].
Таблица 1.
Потенциально-минерализуемое органическое вещество почвы и растительных остатков при разной температуре инкубации
| Номер образца | Температура инкубации, °C | Потенциально- минерализуемый углерод (С0), % от добавленного | Константа скорости минерализации, сут–1 |
|---|---|---|---|
| 1. Почва из-под леса без растительных остатков | 8 | 5.5 ± 0.1 | 0.013 ± 0.000 |
| 22 | 8.0 ± 0.1 | 0.018 ± 0.000 | |
| 2. Опавшие листья осины | 8 | 30.0 ± 0.7 | 0.010 ± 0.001 |
| 22 | 41.8 ± 0.3 | 0.017 ± 0.001 | |
| 3. Опавшие мелкие ветви деревьев | 8 | 21.8 ± 0.9 | 0.006 ± 0.001 |
| 22 | 30.4 ± 0.7 | 0.007 ± 0.000 | |
| 4. Тонкие корни деревьев | 8 | 21.3 ± 1.3 | 0.004 ± 0.000 |
| 22 | 27.0 ± 0.4 | 0.006 ± 0.000 | |
| 5. Пахотная почва без растительных остатков | 8 | 2.6 ± 0.2 | 0.010 ± 0.000 |
| 22 | 6.5 ± 0.0 | 0.011 ± 0.001 | |
| 6. Надземная масса клевера | 8 | 37.9 ± 0.5 | 0.025 ± 0.002 |
| 22 | 58.4 ± 0.0 | 0.052 ± 0.000 | |
| 7. Корни клевера | 8 | 52.2 ± 5.1 | 0.020 ± 0.000 |
| 22 | 72.1 ± 0.4 | 0.055 ± 0.002 | |
| 8. Солома ячменя | 8 | 30.8 ± 0.1 | 0.011 ± 0.000 |
| 22 | 45.5 ± 0.4 | 0.009 ± 0.000 | |
| 9. Корни ячменя | 8 | 31.3 ± 0.6 | 0.004 ± 0.000 |
| 22 | 46.5 ± 4.6 | 0.004 ± 0.001 | |
| Среднее для почвы | 8 | 4.1 ± 2.0 | 0.011 ± 0.002 |
| 22 | 7.3 ± 1.0 | 0.014 ± 0.005 | |
| Среднее для растительных остатков | 8 | 32.2 ± 10.5 | 0.011 ± 0.008 |
| 22 | 46.0 ± 15.6 | 0.021 ± 0.022 |
Таблица 2.
Потенциально-минерализуемое органическое вещество почвы и растительных остатков при разной влажности инкубации
| Номер образца | Влажность почвы, мас. % | Потенциально- минерализуемый углерод (С0), % от добавленного | Константа скорости минерализации, сут–1 |
|---|---|---|---|
| 1. Почва из-под леса без растительных остатков | 15 | 6.5 ± 0.1 | 0.016 ± 0.000 |
| 30 | 8.1 ± 0.1 | 0.016 ± 0.000 | |
| 45 | 9.4 ± 0.1 | 0.016 ± 0.000 | |
| 2. Опавшие листья осины | 15 | 28.1 ± 0.5 | 0.036 ± 0.002 |
| 30 | 36.3 ± 0.6 | 0.035 ± 0.002 | |
| 45 | 41.3 ± 1.0 | 0.039 ± 0.002 | |
| 3. Опавшие мелкие ветви деревьев | 15 | 12.4 ± 0.1 | 0.044 ± 0.002 |
| 30 | 19.0 ± 0.1 | 0.038 ± 0.001 | |
| 45 | 24.2 ± 0.2 | 0.033 ± 0.001 | |
| 4. Тонкие корни деревьев | 15 | 9.0 ± 0.3 | 0.053 ± 0.004 |
| 30 | 15.9 ± 0.2 | 0.038 ± 0.001 | |
| 45 | 21.5 ± 0.5 | 0.031 ± 0.001 | |
| 5. Пахотная почва без растительных остатков | 15 | 3.8 ± 0.0 | 0.011 ± 0.000 |
| 30 | 5.5 ± 0.0 | 0.011 ± 0.000 | |
| 45 | 6.6 ± 0.0 | 0.011 ± 0.000 | |
| 6. Надземная масса клевера | 15 | 50.9 ± 0.1 | 0.060 ± 0.001 |
| 30 | 57.3 ± 0.2 | 0.063 ± 0.001 | |
| 45 | 65.0 ± 0.4 | 0.073 ± 0.000 | |
| 7. Корни клевера | 15 | 60.1 ± 2.4 | 0.068 ± 0.001 |
| 30 | 69.9 ± 3.0 | 0.070 ± 0.001 | |
| 45 | 75.2 ± 3.2 | 0.071 ± 0.001 | |
| 8. Солома ячменя | 15 | 26.6 ± 0.1 | 0.017 ± 0.000 |
| 30 | 36.2 ± 0.2 | 0.017 ± 0.000 | |
| 45 | 42.5 ± 0.1 | 0.016 ± 0.000 | |
| 9. Корни ячменя | 15 | 14.3 ± 0.0 | 0.010 ± 0.000 |
| 30 | 28.3 ± 0.2 | 0.009 ± 0.000 | |
| 45 | 36.1 ± 0.1 | 0.010 ± 0.000 | |
| Среднее для почвы | 15 | 5.2 ± 1.9 | 0.014 ± 0.004 |
| 30 | 6.8 ± 1.8 | 0.013 ± 0.004 | |
| 45 | 8.0 ± 2.0 | 0.013 ± 0.004 | |
| Среднее для растительных остатков | 15 | 28.8 ± 19.8 | 0.041 ± 0.022 |
| 30 | 37.6 ± 19.7 | 0.039 ± 0.022 | |
| 45 | 43.7 ± 19.9 | 0.039 ± 0.025 |
В более раннем исследовании вклад температуры в потенциальную минерализацию органического вещества трех разных почв составлял 71–86% [6]. В опыте 1 при температуре 22°C фактическая эффективность минерализации органического вещества почвы за 278 суток была в 1.6–2.6 раза больше, чем при 8°С, древесных остатков – в 1.6–1.7 раза, растительных остатков сельскохозяйственных культур – в 1.4–1.6 раза. Минерализация растительных остатков при 22°C теснее коррелировала с отношением C/N (r = –0.971, P < 0.001), чем при температуре 8°С (r = –0.941, P = 0.002). Различия по эффективности разложения между разными растительными остатками достигали 39–54% от внесенного, а при разных температурах – 9–24% от внесенного.
По литературным данным вклад влажности почвы в потенциальную минерализацию органического вещества почвы составляет 8–18%, а эффективность разложения растительного опада в условиях засухи уменьшается на 12.7% [6, 20]. Величины минерализации и ассимиляции микробами кукурузной соломы в почве при 55% водоудерживающей способности (WHC) были на 31 и 17% соответственно выше, по сравнению с таковыми при 25% WHC [13]. В опыте 2 при влажности 15 мас. % фактическая минерализация медленно разлагаемых растительных остатков за 249 суток была в 1.5–2.0 раза меньше, чем при средней влажности 30 мас. %, а быстро- и умеренноразлагаемых остатков – в 1.1–1.3 раза. Доведение влажности с 30 до 45 мас. % способствовало увеличению минерализации медленно разлагаемых остатков в 1.2–1.3 раза, а быстроразлагаемых – только в 1.1 раза. Прирост минерализации органического вещества почвы в интервалах влажности от 15 до 30 и с 30 до 45 мас. % составлял соответственно 1.2–1.4 и 1.1–1.2 раза. Минерализация растительных остатков одинаково тесно коррелировала с отношением C/N (r = –0.980, P < 0.001; r = –0.971, P ≤ 0.001; r = –0.970, P ≤ 0.001) при всех трех уровнях увлажнения почвы. Различия по эффективности разложения при разных уровнях влажности составляли 5–14% от внесенного, а между разными растительными остатками – 52–54% от добавленного в почву. Это свидетельствует о том, что вид и качество растительных остатков более значимый фактор их способности к минерализации, чем изменение уровня увлажнения. Органическое вещество пахотной почвы было более чувствительно к увлажнению, чем необрабатываемой почвы из-под леса.
В зависимости от вида растительных остатков и температуры инкубации константа скорости минерализации в начале разложения варьировала от 0.002 до 0.048 сут–1 (время существования от 20 до 500 сут), а в конце – от 0.0003 до 0.002 сут–1 (время существования 1.4–9.1 лет) (табл. 3). Самая высокая скорость разложения была свойственна биомассе клевера, самая низкая – ветвям и корням деревьев, корням ячменя. Повышение температуры по-разному влияло на скорость разложения сильно- и слабо разлагаемых растительных остатков в течение инкубации. В течение быстрой фазы константы скорости разложения листьев осины, надземной массы и корней клевера (сильно разлагаемые остатки) при температуре 22°С были в среднем в 3.6 раз больше, чем при температуре 8°С, а в течение медленной – в 2.2 раза. Наоборот, в первую неделю инкубации слабо разлагаемые остатки (ветви и корни деревьев, солома и корни ячменя) слабее реагировали на повышение температуры, чем на заключительном этапе. Увеличение константы скорости разложения этих остатков от повышения температуры с 8 до 22°С в начале и в конце инкубации составляло 1.4 и 2.6 раза соответственно.
Таблица 3.
Константы скорости разложения органического вещества почвы и растительных остатков в начале и в конце инкубации при разной температуре по формуле (1), сут–1
| Вариант | 0–7 сут | 18–276 сут | ||
|---|---|---|---|---|
| 8°С | 22°С | 8°С | 22°С | |
| 1. Почва из-под леса без растительных остатков | 0.001 | 0.003 | 0.0001 | 0.0002 |
| 2. Листья осины | 0.005 | 0.009 | 0.0004 | 0.001 |
| 3. Тонкие ветви деревьев | 0.003 | 0.003 | 0.0003 | 0.001 |
| 4. Тонкие корни деревьев | 0.002 | 0.002 | 0.0004 | 0.0009 |
| 5. Пахотная почва без растительных остатков | 0.001 | 0.001 | 0.0001 | 0.0001 |
| 6. Надземная масса клевера | 0.011 | 0.039 | 0.0004 | 0.0008 |
| 7. Корни клевера | 0.011 | 0.048 | 0.0009 | 0.002 |
| 8. Солома ячменя | 0.003 | 0.006 | 0.0006 | 0.002 |
| 9. Корни ячменя | 0.002 | 0.003 | 0.0006 | 0.001 |
Недостаточное увлажнение при 15 мас. % влажности существенно ограничивало скорость разложения растительных остатков на протяжении всего периода наблюдений (табл. 4). Увеличение влажности сопровождалось пропорциональным ростом константы скорости разложения, главным образом в течение быстрой фазы (0–7 сут). Если при 15% влажности константа скорости разложения составляла в среднем для разных видов 0.016 сут–1, то при трехкратном увеличении влажности – 0.024 сут–1. Наиболее заметное ускорение разложения с повышением уровня влажности проявлялось для быстроразлагаемых остатков клевера. На поздней стадии инкубации, когда остаются преимущественно устойчивые соединения, разложение лимитируется лишь ощутимым недостатком влаги, как это имело место в варианте с 15% уровнем влажности, а при умеренной и высокой обеспеченности влагой (30 и 45 мас. % соответственно) константа скорости разложения оставалась постоянной. Согласно распространенному мнению, уменьшение количества осадков приведет в долгосрочной перспективе к увеличению содержания углерода в почве лесных экосистем из-за более низкого разложения и более высокой химической стойкости органического вещества в результате изменений в составе подстилки [12]. Однако, как показывают результаты нашего опыта, сохранившийся или накопленный в течение засухи углерод, скорее всего, будет потерян при увеличении влажности почвы.
Таблица 4.
Константы скорости разложения органического вещества почвы и растительных остатков в начале и в конце инкубации при разных уровнях влажности почвы по формуле (1), сут–1
| Вариант | 15 мас. % | 30 мас. % | 45 мас. % | |||
|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | 2 | |
| 1. Почва из-под леса без растительных остатков | 0.0015 | 0.0001 | 0.0019 | 0.0002 | 0.0022 | 0.0002 |
| 2. Листья осины | 0.0119 | 0.0006 | 0.0154 | 0.0010 | 0.0193 | 0.0010 |
| 3. Тонкие ветви деревьев | 0.0058 | 0.0004 | 0.0085 | 0.0009 | 0.0102 | 0.0009 |
| 4. Тонкие корни деревьев | 0.0047 | 0.0004 | 0.0073 | 0.0010 | 0.0092 | 0.0010 |
| 5. Пахотная почва без растительных остатков | 0.0008 | 0.0001 | 0.0011 | 0.0002 | 0.0013 | 0.0002 |
| 6. Надземная масса клевера | 0.0382 | 0.0007 | 0.0450 | 0.0007 | 0.0564 | 0.0007 |
| 7. Корни клевера | 0.0448 | 0.0009 | 0.0545 | 0.0016 | 0.0600 | 0.0016 |
| 8. Солома ячменя | 0.0061 | 0.0008 | 0.0083 | 0.0015 | 0.0097 | 0.0015 |
| 9. Корни ячменя | 0.0018 | 0.0005 | 0.0038 | 0.0015 | 0.0050 | 0.0015 |
Таким образом, влияние температуры на разложение растительных остатков контролируется соотношением легко- и трудноминерализуемых соединений в их составе, при этом содержание быстро- и легкоразлагаемых компонентов выступало триггером отклика устойчивых соединений на повышение температуры. Чем меньше в растительных остатках размеры быстро- и легкоразлагаемых пулов, тем сильнее проявляется термочувствительность медленно и трудно разлагаемых компонентов. Влияние влажности на разложение проявляется по-другому, чем температуры, главным образом посредством изменения подвижности и позиционной доступности субстрата для микроорганизмов. Поэтому изменение константы скорости разложения по мере увеличения влажности было равномерным. Чем больше в растительных остатках содержалось лабильных соединений, тем быстрее проявлялся отклик на дополнительное увлажнение.
Температурный коэффициент разложения. Чувствительность деструкции и минерализации органического вещества к изменению температуры среды обычно выражают температурным коэффициентом Q10 [15, 19, 21, 22, 24]. Температурный коэффициент Q10, рассчитанный по дыханию почвы, характеризует преимущественно видимую (apparent) температурную чувствительность органического вещества, а не внутреннюю (intrinsic) температурную чувствительность [19]. Видимая температурная чувствительность отражает отклик разложения на изменение температуры, которая может быть подавлена или скрыта защитными механизмами субстрата в почве и другими условиями окружающей среды, тогда как внутренняя чувствительность обусловлена кинетическими свойствами различных соединений в органическом материале.
Коэффициенты Q10 разложения основных компонентов ПОВ сильно различаются в одной и той же почве (от 1.24 до 3.45), что свидетельствует о неоднородности свойств ПОВ и различном отклике отдельных соединений ПОВ на потепление [24]. По обобщенным данным температурный коэффициент минерализации органического вещества самой почвы составляет 2.26 ± 0.41, почвы с соломой – 2.02 ± 0.35, соломы – 1.67 ± 0.17 [32]. Однако в одном из инкубационных опытов коэффициенты Q10 для трех почв с пшеничной соломой и без соломы были приблизительно одинаковыми, составляя 1.61 [5]. Для 77 образцов почв, отобранных в зональных биомах, среднее значение Q10 составляло 3.0 (от 2.2 до 4.6) при этом 45% вариации Q10 было обусловлено качеством ПОВ [25]. Метаанализ данных Q10, показал, что в интервале исследуемых температур от –15 до +55°C первичные величины температурного коэффициента варьировали от 0.5 до 344, усредненные – от 1.2 до 174, средние для всего массива – 2.6 ± 1.2 (медиана – 2.39 при n = 494), нормализованные с учетом времени инкубации и температуры – 2.04 ± 1.09 (медиана – 1.85 при n = 317) [29]. Показано, что значения Q10 для растительного опада были достоверно ниже, чем для ПОВ, составляя соответственно 1.2–2.7 (в среднем 1.8) и 2.3–3.8 (в среднем 3.1) [21]. Чувствительность разложения к температуре была значительно выше у листового опада (Q10 = 2.17), чем у тонких корней (Q10 = 1.40) [47]. В другом исследовании, наоборот, разложение тонких корней было более чувствительно к температуре (Q10 = 4.21) по сравнению с листовым опадом (Q10 = 2.36) [9].
В нашем эксперименте температурный коэффициент Q10 минерализации ПОВ и растительных остатков за 178 сут инкубации составил в среднем 1.66 ± 0.41 и 1.39 ± 0.06 соответственно. Температурная чувствительность органического вещества почвы в отличие от растительных остатков контролируется не только качеством органических соединений, но и их физической защитой, создаваемой агрегацией и адсорбцией [7]. Различия по температурному коэффициенту между видами растительных остатков были не существенными. Термочувствительность растительных остатков, рассчитанная по кумулятивному количеству выделившегося С–СО2 в течение инкубации, отчетливее проявлялась на ранней стадии разложения (коэффициент Q10 составлял в среднем 1.74), чем на поздней (Q10 – в среднем 1.39) (рис. 1). Подобная закономерность наблюдалась в работе [2].
Рис. 1.
Температурные коэффициенты (Q10) разложения органического вещества почвы и растительных остатков в течение длительной инкубации, рассчитанные по кумулятивной продукции С–СО2. Обозначения вариантов здесь и далее: 1 – почва из-под леса без растительных остатков; 2 – опавшие листья осины; 3 – опавшие мелкие ветви деревьев; 4 – тонкие корни деревьев; 5 – пахотная почва без растительных остатков; 6 – надземная масса клевера; 7 – корни клевера; 8 – солома ячменя; 9 – корни ячменя.
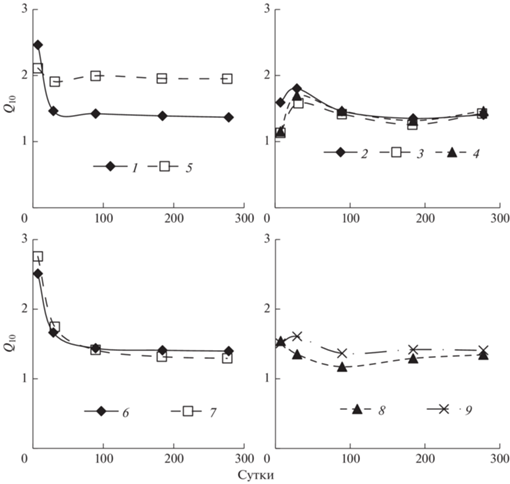
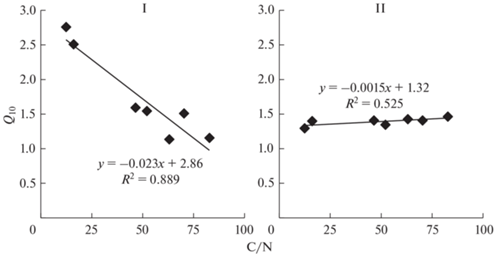
Оказалось, что термочувствительность разложения на ранней стадии отчетливее проявлялась для высококачественных растительных остатков с узким соотношением C/N, чем для низкокачественных с широким соотношением C/N (рис. 2). На поздней стадии разложения зависимость температурного коэффициента от качества органического вещества была не достоверной. Полученные данные согласуются с гипотезой, что, если значения Q10 устанавливаются по кумулятивному количеству выделившегося CO2 за длительный период времени, разложение не будет иметь явной температурной чувствительности из-за истощения и изменения качественного состава субстрата [26].
Рис. 2.
Температурный коэффициент (Q10) разложения растительных остатков с разным отношением C/N на ранней (I) и поздней (II) стадиях инкубации. I – 7 сут, II – 278 сут. Коэффициент Q10 рассчитан по кумулятивной продукции С–СО2.
Согласно кинетической теории, разложение структурно сложных и более защищенных субстратов требует большей энергии активации, чем структурно простых и лабильных субстратов [11]. Поэтому температурная чувствительность разложения остатков низкого качества, как и трудноразлагаемых компонентов органического вещества, должна быть выше, чем остатков более высокого качества и легкоразлагаемых компонентов. В ряде исследований разложение лабильного пула и “нового” органического вещества положительно реагировало на температуру, но разложение устойчивого пула и “старого” органического вещества проявляло более высокую температурную чувствительность [1, 19, 26, 35]. В других исследованиях температурная чувствительность разложения быстрооборачиваемого лабильного углерода не отличалась для медленно оборачиваемого устойчивого углерода [14, 23]. Имеются также данные, что разложение лабильных, высококачественных пулов органического вещества в составе растительных остатков было более чувствительно к температуре, чем устойчивых, низкокачественных [2, 40].
Если судить по кумулятивным величинам выделения С–СО2, то быстроразлагаемый (лабильный) пул органического вещества почвы и растительных остатков более термочувствителен, чем медленно разлагаемый (устойчивый) пул, а высококачественные растительные остатки более чувствительны к повышению температуры, чем низкокачественные (рис. 1). В действительности это не так и результаты нашего эксперимента не противоречат кинетической теории. Достаточно сравнить величины Q10, полученные по скорости выделения C–CO2 в начале инкубации, когда минерализуются быстроразлагаемые и легкодоступные соединения, и в конце инкубации, когда преобладают медленно разлагаемые и труднодоступные для микроорганизмов компоненты ПОВ или растительных остатков. Во всех вариантах температурный коэффициент образования СО2 был выше в конце инкубации, чем в начале (рис. 3). Коэффициент Q10 минерализации органического вещества почвы в начале и в конце инкубации составлял 1.31 ± 0.13 и 2.04 ± 0.51, а растительных остатков 1.50 ± 0.21 и 1.86 ± 0.31 соответственно.
Рис. 3.
Температурные коэффициенты (Q10) разложения органического вещества почвы и растительных остатков, рассчитанные по скорости выделения СО2 в начале и в конце инкубации. I – 7 сут с начала инкубации, II – 278 сут с начала инкубации.

Таким образом, органическое вещество демонстрирует разную термочувствительность при кратковременном и длительном влиянии повышенной температуры. Почвенные микроорганизмы могут адаптироваться к повышенной температуре при длительном влиянии температуры, в результате чего температурная чувствительность разложения оказывается меньше ожидаемой или демонстрирует иные зависимости [8, 49]. Уровень влажности почвы выступает маскирующим температурную чувствительность органического вещества фактором. По мере увеличения гравиметрической влажности почвы с 10 до 25% величина Q10 потенциальной минерализации органического вещества трех почв уменьшалась с 2.93 до 2.61 [6].
Влажностный коэффициент разложения. По аналогии с температурным коэффициентом Q10 влажностный коэффициент W10 показывает изменение скорости и размеров минерализации органического вещества при увеличении влажности на 10 мас. % [6]. В современных исследованиях нет общепринятого способа измерения и единого показателя влажности почвы [28], поэтому в литературе встречаются единичные значения влажностных коэффициентов. В цитируемой выше работе [6] влажностные коэффициенты потенциальной минерализации органического вещества трех пахотных почв (серой лесной, чернозема оподзоленного, темно-каштановой) в диапазонах влажности 10–25 и 25–40 мас. % были равны 1.30 ± 0.18 и 1.14 ± 0.08 соответственно. Также отмечено, что легкоминерализуемая фракция (W10 в интервале 10–25 и 25–40 мас. % 1.36 ± 0.08 и 1.10 ± 0.13 соответственно) оказалась более влагочувствительной по сравнению с трудноминерализуемой (W10 1.07 ± ± 0.22 и 1.00 ± 0.14 соответственно).
В другом опыте величины влажностных коэффициентов W10 для интервала увлажнения 10–40 мас. % за 150 сут инкубации в почвах без соломы составили в среднем 1.15, а в почвах с соломой – 1.24, то есть для обеспечения эффективной минерализации при внесении соломы возрастала потребность в увлажнении [5]. По данным, приведенным в работе [13], были вычислены влажностные коэффициенты минерализации органического вещества почвы и кукурузной соломы при гравиметрической влажности почвы 7.1 и 15.7% (25 и 55% от водоудерживающей способности). Значения коэффициентов для почвы составили 1.41 ± 0.17, для брутто-минерализации соломы – 1.50 ± 0.01 и нетто-минерализации соломы с вычетом прайминг-эффекта – 1.52 ± 0.00.
В опыте 2 влажностные коэффициенты W10 минерализации органического вещества почвы за 249 сут инкубации в интервале гравиметрической влажности 15–30 и 30–45% составляли 1.22 ± 0.09 и 1.21 ± 0.05 соответственно, а растительных остатков – 1.29 ± 0.20 и 1.25 ± 0.13 (рис. 4). При этом W10 отклик быстроразлагаемых остатков (листья осины, надземная масса и корни клевера) в этих интервалах влажности равнялся 1.12 ± 0.06 и 1.13 ± 0.04, тогда как медленно разлагаемых (ветви и корни деревьев, солома и корни ячменя) – 1.41 ± 0.18 и 1.35 ± 0.09. В отличие от температурного коэффициента Q10 значения влажностного коэффициента W10 практически не изменялись на протяжении инкубации (рис. 4). Например, через 30 сут величины W10 разложения органического вещества почвы (1.22 ± 0.09 и 1.21 ± 0.05) и растительных остатков (1.27 ± 0.20 и 1.25 ± 0.12) были практически теми же самыми, что и по истечению 249 сут. Как показано выше, температурные коэффициенты Q10, вычисленные по кумулятивному количеству С–СО2, искажали температурную чувствительность компонентов, разлагаемых в начале и в конце длительной инкубации, в отличие от таковых, получаемых по скорости эмиссии С–СО2. Наоборот, влажностные коэффициенты, рассчитанные по скорости выделения СО2 в начале и в конце инкубации, были фактически одинаковыми (рис. 5).
Рис. 4.
Влажностные коэффициенты (W10) разложения органического вещества почвы и растительных остатков в течение длительной инкубации, рассчитанные по кумулятивной продукции С–СО2.

Рис. 5.
Влажностные коэффициенты (W10) разложения органического вещества почвы и растительных остатков, рассчитанные по скорости выделения СО2 в начале и в конце инкубации. I – 7 сут с начала инкубации, II – 249 сут с начала инкубации.
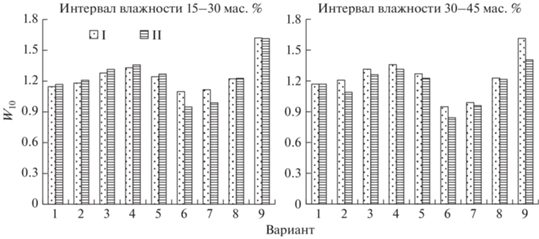
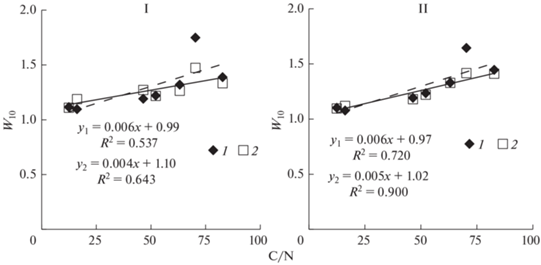
Главным фактором влагочувствительности разложения явилось качество разлагаемого материала. Для обоих интервалов влажности (15–30 и 30–45 мас. %), как в начале, так и в конце инкубации обнаруживалась прямая зависимость между отношением C/N в растительных остатках и влажностным коэффициентом (рис. 6). Органическое вещество медленноразлагаемых растительных остатков было более влагочувствительным, чем быстроразлагаемых. Следовательно, изменение уровня влажности создает предпосылки для усиления или ослабления разложения органического вещества посредством изменения доступности субстрата и физиологической активности деструкторов, но не влияет прямо на скорость биохимических процессов, вовлеченных в разложение субстрата.
Рис. 6.
Влажностный коэффициент (W10) кумулятивного разложения растительных остатков с разным отношением C/N на ранней (I) и поздней (II) стадиях инкубации. I – 7 сут, II – 249 сут; 1 – интервал влажности 15–30 мас. %, 2 – интервал влажности 30–45 мас. %. Коэффициент W10 рассчитан по кумулятивной продукции С–СО2.
ЗАКЛЮЧЕНИЕ
Температура и влажность – главные абиотические драйверы разложения органического вещества почвы и растительных остатков. При температуре 8°C эффективность разложения органического вещества почвы и растительных остатков была в среднем в 2.1 и 1.6 раза меньше, чем при умеренной температуре (22°C), а при низкой влажности почвы 15 мас. % – соответственно в 1.3 и 1.4 раза меньше, чем при средней влажности 30 мас. %. Замедление разложения органического вещества при низкой температуре и недостаточной влажности почвы создает видимость секвестрации углерода в почве. Однако сохранившееся из-за неблагоприятных внешних условий потенциально-минерализуемое органическое вещество остается нестабилизированным и чувствительным к увеличению температуры и влажности почвы.
Изменение температуры отражалось как на динамике, так и на размерах продукции С–СО2 разлагаемым органическим веществом, тогда как изменение влажности почвы – только на размерах разложения. В отличие от влияния температуры динамика выделения С–СО2 при разных уровнях увлажнения была однотипной. Качество органического вещества, то есть соотношение быстро- и медленноразлагаемых компонентов, было более значимым фактором эффективности и скорости разложения, чем уровни температуры и влажности. Минерализационная способность органического вещества почвы была в среднем в 6 раз меньше, чем растительных остатков.
Влияние температуры на разложение растительных остатков контролировалось соотношением легко- и трудноминерализуемых соединений в их составе. Чем меньше в растительных остатках быстро(легко)разлагаемых соединений, тем больше термочувствительность медленно(трудно)разлагаемого пула. Влияние влажности на разложение проявлялось посредством изменения подвижности и позиционной доступности субстрата для микроорганизмов и проявлялось равномерно в течение всей инкубации.
Температурный Q10 и влажностный W10 коэффициенты характеризуют отклик разложения органического вещества на изменение температуры и гравиметрической влажности. Температурные коэффициенты Q10 минерализации ПОВ и растительных остатков равнялись в среднем 1.66 ± 0.41 и 1.39 ± 0.06 соответственно, а влажностные коэффициенты W10 в интервалах гравиметрической влажности 15–30 и 30–45% составляли для почвы 1.22 ± 0.09 и 1.21 ± 0.05 соответственно, а для растительных остатков – 1.29 ± ± 0.20 и 1.25 ± 0.13.
Расчет температурного коэффициента разложения органического вещества по кумулятивному количеству выделившегося С–СО2 в течение инкубации, может скрадывать истинную термочувствительность, поэтому ее следует определять дискретно, в течение инкубации по фактической скорости выделения СО2. Значения влажностного коэффициента W10 практически не изменялись на протяжении инкубации.
Список литературы
Ларионова А.А., Квиткина А.К., Евдокимов И.В., Быховец С.С., Стулин А.Ф. Влияние температуры на интенсивность разложения лабильного и устойчивого органического вещества агрочернозема // Почвоведение. 2013. № 7. С. 803–812. https://doi.org/10.7868/S0032180X13070046
Ларионова А.А., Мальцева А.Н., Лопес де Гереню В.О., Квиткина А.К., Быховец С.С., Золотарева Б.Н., Кудеяров В.Н. Влияние температуры и влажности на минерализацию и гумификацию лиственного опада в модельном инкубационном эксперименте // Почвоведение. 2017. № 4. С. 438–448. https://doi.org/10.7868/S0032180X17020083
Семенов В.М., Паутова Н.Б., Лебедева Т.Н., Хромычкина Д.П., Семенова Н.А., Лопес де Гереню В.О. Разложение растительных остатков и формирование активного органического вещества в почве инкубационных экспериментов // Почвоведение. 2019. № 10. С. 1172–1184. https://doi.org/10.1134/S0032180X19100113
Смагин А.В., Садовникова Н.Б., Смагина М.В., Глаголев М.В., Шевченко Е.М., Хайдапова Д.Д., Губер А.К. Моделирование динамики органического вещества почв. М.: Изд-во Моск. ун-та, 2001. 120 с.
Тулина А.С. Влияние температуры, влажности и внесения соломы на динамику минерализации органического вещества и почвенные пулы углерода и азота // Агрохимия. 2019. № 3. С. 3–18. https://doi.org/10.1134/S0002188119030141
Тулина А.С., Семенов В.М. Оценка чувствительности минерализуемого пула почвенного органического вещества к изменению температуры и влажности // Почвоведение. 2015. № 8. С. 952–962. https://doi.org/10.7868/S0032180X15080109
Arevalo C.B.M., Chang S.X., Bhatti J.S., Sidders D. Mineralization Potential and Temperature Sensitivity of Soil Organic Carbon under Different Land Uses in the Parkland Region of Alberta, Canada // Soil Sci. Soc. Am. J. 2012. V. 76(1). P. 241–251. 1https://doi.org/1.0126/sssaj2011.0126
Blagodatskaya E., Blagodatsky S., Khomyakov N., Myachina O., Kuzyakov Y. Temperature sensitivity and enzymatic mechanisms of soil organic matter decomposition along an altitudinal gradient on Mount Kilimanjaro // Sci. Reports. 2016. V. 6. Art. No. 22240. https://doi.org/10.1038/srep22240
Bonanomi G., Idbella M., Zotti M., Santorufo L., Motti R., Maisto G., De Marco A. Decomposition and temperature sensitivity of fine root and leaf litter of 43 mediterranean species // Plant and Soil. 2021. V. 464. P. 453–465. https://doi.org/10.1007/s11104-021-04974-1
Bond-Lamberty B., Bailey V.L., Chen M., Gough C.M., Vargas R. Globally rising soil heterotrophic respiration over recent decades // Nature. 2018. V. 560. P. 80–83. https://doi.org/10.1038/s41586-018-0358-x
Bosatta E., Ågren G.I. Soil organic matter quality interpreted thermodynamically // Soil Biology and Biochemistry. 1999. V. 31(13). P. 1889–1891. https://doi.org/10.1016/S0038-0717(99)00105-4
Campo J., Merino A. Variations in soil carbon sequestration and their determinants along a precipitation gradient in seasonally dry tropical forest ecosystems // Global Change Biol. 2016. V. 22. P. 1942–1956. https://doi.org/10.1111/gcb.13244
Chen L., Zhang J.B., Zhao B.Z., Xin X.L., Zhou G.X., Tan J.F., Zhao J.H. Carbon mineralization and microbial attributes in straw-amended soils as affected by moisture levels // Pedosphere. 2014. V. 24. P. 167–177. https://doi.org/10.1016/S1002-0160(14)60003-5
Cisneros-Dozal L.M., Trumbore S.E., Hanson P.J. Effect of moisture on leaf litter decomposition and its contribution to soil respiration in a temperate forest // J. Geophysical Research. 2007. V. 112. Art. No. G01013. https://doi.org/10.1029/2006JG000197
Conant R.T., Ryan M.G., Ågren G.I., Birge H.E., Davidson E.A., Eliasson P.E., Evans S.E., Frey S.D., Giardina C.P., Hopkins F.M., Hyvönen R., Kirschbaum M.U.F., Lavallee J.M., Leifeld J., Parton W.J., Steinweg J.M., Wallenstein M.D., Wetterstedt J.Å.M., Bradford M.A. Temperature and soil organic matter decomposition rates – synthesis of current knowledge and a way forward // Global Change Biology. 2011. V. 17(11). P. 3392–3404. https://doi.org/10.1111/j.1365-2486.2011.02496.x
Cox P., Betts R., Jones C., Spall S.A., Totterdell I.J. Acceleration of global warming due to carbon-cycle feedbacks in a coupled climate model // Nature. 2000. V. 408. P. 184–187. https://doi.org/10.1038/35041539
Dalias P., Anderson J.M., Bottner P., Coûteaux M.-M. Temperature responses of carbon mineralization in conifer forest soils from different regional climates incubated under standard laboratory conditions // Global Change Biology. 2001. V. 7(2). P. 181–192. https://doi.org/10.1046/j.1365-2486.2001.00386.x
Davidson E.A., Belk E., Boone R.D. Soil water content and temperature as independent or confounded factors controlling soil respiration in a temperate mixed hardwood forest // Global Change Biology. 1998. V. 4. P. 217–227. https://doi.org/10.1046/j.1365-2486.1998.00128.x
Davidson E.A., Janssens I.A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change // Nature. 2006. V. 440. P. 165–173. https://doi.org/10.1038/nature04514
Deng L., Peng C., Kim D-G., Li J., Liu Y., Hai X., Liu Q., Huang C., Shangguan Z., Kuzyakov Y. Drought effects on soil carbon and nitrogen dynamics in global natural ecosystems // Earth-Science Reviews. 2021. V. 214. Art. No. 103501. https://doi.org/10.1016/j.earscirev.2020.103501
Erhagen B., Öquist M., Sparrman T., Haei M., Ilstedt U., Hedenström M., Schleucher J., Nilsson M.B. Temperature response of litter and soil organic matter decomposition is determined by chemical composition of organic material // Global Change Biology. 2013. V. 19(12). P. 3858–3871. https://doi.org/10.1111/gcb.12342
Fang C., Moncrieff J.B. The dependence of soil CO2 efflux on temperature // Soil Biol. Biochem. 2001. V. 33(2). P. 155–165. https://doi.org/10.1016/S0038-0717(00)00125-5
Fang C., Smith P., Moncrieff J.B., Smith J.U. Similar response of labile and resistant soil organic matter pools to changes in temperature // Nature. 2005. V. 433. P. 57–59. https://doi.org/10.1038/nature03138
Feng X., Simpson M.J. Temperature responses of individual soil organic matter components // J. Geophysical Res. 2008. V. 113. Art. No. G03036. https://doi.org/10.1029/2008JG000743
Fierer N., Colman B.P., Schimel J.P., Jackson R.B. Predicting the temperature dependence of microbial respiration in soil: A continental-scale analysis // Global Biogeochem. Cycles. 2006. V. 20(3). GB3026. https://doi.org/10.1029/2005GB002644
Fierer N., Craine J.M., Mclauchlan K., Schime l. J.P. Litter quality and the temperature sensitivity of decomposition // Ecology. 2005. V. 86(2). P. 320–326. https://doi.org/10.1890/04-1254
Frey S.D., Lee J., Mellilo J.M., Six J. The temperature response of soil microbial efficiency and its feedback to climate // Nature Climate Change. 2013. V. 3. P. 395–398. https://doi.org/10.1038/nclimate1796
Ghezzehei T.A., Sulman B., Arnold C.L., Bogie N.A., Berhe A.A. On the role of soil water retention characteristic on aerobic microbial respiration // Biogeosciences. 2019. V. 16(6). P. 1187–1209. https://doi.org/10.5194/bg-16-1187-2019
Hamdi S., Moyano F., Sall S., Bernoux M., Chevallier T. Synthesis analysis of the temperature sensitivity of soil respiration from laboratory studies in relation to incubation methods and soil conditions // Soil Biology and Biochem. 2013. V. 58. P. 115–126. https://doi.org/10.1016/j.soilbio.2012.11.012
Hueso S., Hernández T., García C. Resistance and resilience of the soil microbial biomass to severe drought in semiarid soils: The importance of organic amendments // Appl. Soil Ecol. 2011. V. 50. P. 27–36. https://doi.org/10.1016/j.apsoil.2011.07.014
Iizumi T., Wagai R. Leveraging drought risk reduction for sustainable food, soil and climate via soil organic carbon sequestration // Sci. Reports. 2019. V. 9. Art. No 19744. https://doi.org/10.1038/s41598-019-55835-y
Kätterer T., Reichstein M., Andrén O., Lomander A. Temperature dependence of organic matter decomposition: a critical review using literature data analyzed with different models // Biology and Fertility Soils. 1998. V. 27. P. 258–262. https://doi.org/10.1007/s003740050430
Kirschbaum M.U.F. The temperature dependence of soil organic matter decomposition, and the effect of global warming on soil organic C storage // Soil Biol. and Biochem. 1995. V. 27(6). P. 753–760. https://doi.org/10.1016/0038-0717(94)00242-S
Kirschbaum M.U.F. Will changes in soil organic carbon act as a positive or negative feedback on global warming? // Biogeochemistry. 2000. V. 48. P. 21–51. https://doi.org/10.1023/A:1006238902976
Knorr W., Prentice I.C., House J.I., Holland E.A. Long-term sensitivity of soil carbon turnover to warming // Nature. 2005. V. 433. P. 298–301. https://doi.org/10.1038/nature03226
Kurganova I., Lopes de Gerenyu V., Galibina N., Kapitsa E., Shorohova E. Coupled effect of temperature and mineral additions facilitates decay of aspen bark // Geoderma. 2018. V. 316. P. 27–37. https://doi.org/10.1016/j.geoderma.2017.12.014
Kutlu T., Guber A.K., Rivers M.L., Kravchenko A.N. Moisture absorption by plant residue in soil // Geoderma. 2018. V. 316. P. 47–55. https://doi.org/10.1016/j.geoderma.2017.11.043
Leifeld J., von Lützow M. Chemical and microbial activation energies of soil organic matter decomposition // Biology and Fertility Soils. 2014. V. 50. P. 147–153. https://doi.org/10.1007/s00374-013-0822-6
Lloyd J., Taylor J.A. On the temperature dependence of soil respiration // Functional Ecology. 1994. V. 8(3). P. 315–323. https://doi.org/10.2307/2389824
Melillo J.M., Steudler P.A., Aber J.D., Newkirk K., Lux H., Bowles F.P., Catricala C., Magill A., Ahrens T., Morrisseau S. Soil Warming and Carbon-Cycle Feedbacks to the Climate System // Science. 2002. V. 298(5601). P. 2173–2176. https://doi.org/10.1126/science.1074153
Moyano F.E., Manzoni S., Chenu C. Responses of soil heterotrophic respiration to moisture availability: An exploration of processes and models // Soil Biology and Biochem. 2013. V. 59. P. 72–85. https://doi.org/10.1016/j.soilbio.2013.01.002
Petraglia A., Cacciatori C., Chelli S., Fenu G., Calderisi G., Gargano D., Abeli T., Orsenigo S., Carbognani M. Litter decomposition: effects of temperature driven by soil moisture and vegetation type // Plant and Soil. 2019. V. 435. P. 187–200. https://doi.org/10.1007/s11104-018-3889-x
Reichstein M., Subke J.-A., Angeli A.C., Tenhunen J.D. Does the temperature sensitivity of decomposition of soil organic matter depend upon water content, soil horizon, or incubation time? // Global Change Biology. 2005. V. 11. P. 1754-1767. https://doi.org/10.1111/j.1365-2486.2005.01010.x
Rousk J., Smith A.R., Jones D.L. Investigating the long-term legacy of drought and warming on the soil microbial community across five European shrubland ecosystems // Global Change Biology. 2013. V. 9(12). P. 3872–3884. https://doi.org/10.1111/gcb.12338
Schimel J.P. Life in dry soils: Effects of drought on soil microbial communities and processes // Annual Review of Ecology, Evolution, and Systematics. 2018. V. 49. P. 409–432. https://doi.org/10.1146/annurev-ecolsys-110617-062614
Sierra C.A., Malghani S., Loescher H.W. Interactions among temperature, moisture, and oxygen concentrations in controlling decomposition rates in a boreal forest soil // Biogeosciences. 2017. V. 14. P. 703–710. https://doi.org/10.5194/bg-14-703-2017
Song S., Hu X., Zhu J., Zheng T., Zhang F., Ji C., Zhu J. The decomposition rates of leaf litter and fine root and their temperature sensitivities are influenced differently by biotic factors // Plant and Soil. 2021. V. 461. P. 603–616. https://doi.org/10.1007/s11104-021-04855-7
Vicca S., Bahn M., Estiarte M., van Loon E.E., Vargas R., Alberti G., Ambus P., Arain M.A., Beier C., Bentley L.P., Borken W., Buchmann N., Collins S.L., de Dato G., Dukes J.S., Escolar C., Fay P., Guidolotti G., Hanson P.J., Kahmen A., Kröel-Dulay G., Ladreiter-Knauss T. et al. Can current moisture responses predict soil CO2 efflux under altered precipitation regimes? A synthesis of manipulation experiments // Biogeosciences. 2014. V. 11. P. 2991–3013. https://doi.org/10.5194/bg-11-2991-2014
von Lützow M., Kögel-Knabner I. Temperature sensitivity of soil organic matter decomposition – what do we know? // Biology and Fertility Soils. 2009. V. 46. P. 1–15. https://doi.org/10.1007/s00374-009-0413-8
Zhou X.H., Zhou L.Y., Nie Y.Y., Fu Y.L., Du Z.G., Shao J.J., Zheng Z.M., Wang X.H. Similar responses of soil carbon storage to drought and irrigation in terrestrial ecosystems but with contrasting mechanisms: a meta-analysis // Agric. Ecosyst. and Environ. 2016. V. 228. P. 70–81. https://doi.org/10.1016/j.agee.2016.04.030
Дополнительные материалы
- скачать ESM.docx
- Приложение 1


