Почвоведение, 2022, № 7, стр. 843-859
Гетерофазный синтез гуминовых веществ иммобилизованной лакказой в проточных условиях при низких концентрациях субстрата
А. Г. Заварзина a, *, В. В. Демин a, О. В. Белова b, А. А. Леонтьевский b, А. В. Лисов b
a Факультет почвоведения МГУ им. М.В. Ломоносова
Ленинские горы, 1119991 Москва, Россия
b Пущинский научный центр биологических исследований РАН, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина
142290 Пущино, Россия
* E-mail: zavarzina@mail.ru
Поступила в редакцию 03.11.2021
После доработки 08.01.2022
Принята к публикации 26.01.2022
- EDN: QWBBXK
- DOI: 10.31857/S0032180X22070140
Аннотация
Гуминовыми веществами (ГВ) называют совокупность гетерогенных и полидисперсных соединений, образующихся при трансформации органических остатков в почвах и других природных средах. Роль свободнорадикальных реакций конденсации (вторичного синтеза) в образовании ГВ является предметом дискуссий. Изучена возможность синтеза ГВ из мономеров в динамических условиях и при низких концентрациях веществ в присутствии лакказы гриба Coprinus comatus F-2940. Лакказу иммобилизовывали на каолините, модифицированном гидроксидом алюминия. Исследованы некоторые свойства фермента, субстратная специфичность в отношении фенольных кислот-предшественников ГВ, влияние природы аминокислот на способность к образованию комплексов с фенольными кислотами в присутствии лакказы. При иммобилизации лакказы рН оптимум с 2.6-диметоксифенолом (2.6-ДМФ) смещался с рН 6.0 в кислую область (рН 4.4), уменьшалась термостабильность фермента, кинетические параметры окисления 2.6-ДМФ не менялись. По реакционной способности (процент конверсии кислот свободной лакказой) индивидуальные фенольные кислоты образовывали ряд: кофейная (72) > феруловая (53) > галловая = сиреневая (43) > протокатеховая (5.5) > > ванилиновая = п-гидроксибензойная (0). В смеси кислот наиболее эффективно окислялась галловая кислота (50%), остальные кислоты в сопоставимых количествах (13–17%). Конверсия фенольных кислот в их смеси увеличивалась в присутствии лизина. При пропускании смеси галловой, протокатеховой, сиреневой, феруловой кислот (0.01 мМ каждой) и лизина (0.02 мМ) через проточную микроколонку иммобилизованная лакказа эффективно окисляла фенольные кислоты, продукты реакции связывались с минеральной фазой, окрашивая ее в темный цвет. По данным высокоэффективной жидкостной хроматографии молекулярные массы веществ, экстрагированных с поверхности минерала, составляли 270–900 Да, то есть образовывались низкомолекулярные вещества типа фульвокислот. Установлена важная роль свободнорадикальных гетерофазных реакций в формировании молекулярного состава жидкой фазы и органо-минеральных комплексов.
ВВЕДЕНИЕ
Почвы являются главным резервуаром органического вещества в наземных экосистемах. Запасы углерода в почвенном гумусе (1500 Гт С) втрое превышают таковые в биомассе (550 Гт С) [19]. Гумус обусловливает плодородие почв и их функции в биосфере [9]. Процессы образования и деструкции веществ гумуса во многом сформировали и определяют современный климат, однако их природа и состав, а также механизмы стабилизации остаются предметом дискуссий [1, 10, 29, 37, 47].
Традиционно считается, что основу гумуса составляют гуминовые вещества (ГВ) – гетерогенная совокупность веществ, образующихся de novo (вне живых организмов) в процессе разложения и трансформации биомолекул органических остатков (гумификации) [5, 8]. Согласно гипотезам, важную роль в образовании ГВ почв играют реакции конденсации [5, 8, 20, 65]. Эта точка зрения отражена в одном из определений ГВ как “серии относительно высокомолекулярных веществ от желтой до темной окраски, образующихся в результате вторичного синтеза” [65]. По принципу растворимости в щелочах ГВ принято делить на гуминовые кислоты (ГК, растворимы в щелочных условиях, осаждаются при рН < 2), фульвокислоты (ФК, растворимы при всех значениях рН) и гумин (нерастворимый остаток). Гуминовые и фульвокислоты обогащены полярными функциональными группами и считаются наиболее реакционноспособными компонентами гумуса [8, 65].
Ранее ГВ описывали как относительно высокомолекулярные (5–100 кДа) темноокрашенные вещества, устойчивые к биодеструкции [8, 9 ]. В настоящее время это представление пересматривается [47]. Практически общепринята теория о ГВ как надмолекулярных ассоциатах небольших молекул (около 2–6 кДа) [59, 66]. Предложена модель почвенного континуума, согласно которой органическое вещество почв рассматривается как совокупность биомолекул на разных стадиях деструкции [47]. Реакции вторичного синтеза отрицаются, равно как и существование ГВ как массовых продуктов этого процесса [47]. Международным обществом по изучению гуминовых веществ (IHSS) ГВ в настоящее время определены как “комплексная и гетерогенная смесь полидисперсных материалов, образующихся в результате биохимических и химических реакций в процессе деструкции и трансформации растительных и микробных остатков (гумификации)” (www. h-umic-substances.org, 2020).
В результате возобновившейся дискуссии о природе гумуса опубликован ряд обзоров в защиту ГВ как специфических соединений почв и других природных сред [28, 37, 56], а также реакций вторичного синтеза как играющих важную роль в образовании этих соединений [29]. Классическим примером таких реакций, лежащим в основе конденсационной теории гумификации [5, 65], является окисление фенольных соединений до фенокси-радикалов и хинонов c последующими спонтанными свободнорадикальными реакциями при участии азотистых и других предшественников [5, 20, 65]. Окисление фенолов – каталитический процесс, который осуществляется в присутствии внеклеточных ферментов – фенолоксидаз и пероксидаз микроорганизмов [5, 21, 36] или абиогенных катализаторов – например, ионов Fe3+, Mn4+ в составе почвенных минералов [41]. Образование темноокрашенных ГК-подобных веществ из мономерных фенольных и азотистых предшественников показано во многих работах, в частности in vitro в присутствии пероксидазы [5, 14], лакказы [52, 75], тирозиназы [55] или почвенных минералов [41, 43]. Образование ГК-подобных темноокрашенных веществ из грибных фенольных метаболитов и азотистых соединений показано in vivo в жидкофазных культурах микроскопических грибов Epicoccum nigrum, Stachybotrys atra, S. chartarum, Aspergillus sydowi (работы Haider and Martin, 1967; Martin and Haider, 1969; Haider and Martin, 1970; цит. по [61]). Ферментативный катализ реакций конденсации эффективнее абиогенного, молекулярные массы продуктов выше [12, 21, 58, 55 ].
Процессам конденсации способствует наличие границы раздела фаз. В присутствии глинистых минералов увеличивается количество ГК-подобных веществ, образующихся в культурах грибов (Martin et al., 1972; цит по [61]); в присутствии иммобилизованной лакказы образуются более высокомолекулярные продукты из низкомолекулярных фенольных и азотистых предшественников, чем в гомогенной системе [75, 76]. Показано образование ГК-подобных веществ при твердофазном культивировании базидиомицета белой гнили [73], а также ре-полимеризация продуктов деструкции ГК на грибном мицелии при погруженном культивировании лигнолитического гриба [77].
Существенным ограничением лабораторных экспериментов по вторичному синтезу является то, что они проводятся в замкнутых системах и при высоких концентрациях предшественников. Концентрация мономеров составляет обычно 1–10 мг/мл [5, 64], что соответствует 5–50 мМ при молекулярной массе предшественников (фенольных кислот, аминокислот) около 200 г/моль. Это на несколько порядков больше, чем концентрации фенольных кислот в почвенных растворах, составляющие от долей до десятков микромолей [7, 57]. На свободные аминокислоты в почвенных растворах приходится менее 1% от растворенного органического азота, их концентрации обычно составляют 0.1–50 мкM [46, 74]. Возникает вопрос о возможности протекания биокаталитических реакций вторичного синтеза при низких концентрациях субстрата и о степени полимеризации предшественников в таких условиях.
Скорость и эффективность биокатализа определяется природой фермента. К биокатализаторам свободнорадикальных реакций, распространенным в почвах, относятся лакказа, тирозиназа, пероксидаза [23, 63]. Лакказа (КФ 1.10.3.2, бензендиол : кислород оксидоредуктаза) принадлежит семейству медьсодержащих оксидаз, содержит 4 атома меди в активном центре и катализирует окисление широкого ряда фенольных субстратов и ароматических аминов молекулярным кислородом, который восстанавливается до воды [33, 45]. Фенокси-радикалы и хиноны, образующиеся при каталитическом окислении субстратов, могут подвергаться реакциям спонтанной конденсации с образованием олигомеров и полимеров [45, 72 ]. Лакказа продуцируется аскомицетами, базидиомицетами и дейтеромицетами [16, 72], лакказо-подобные ферменты обнаружены в бактериях [45]. Фермент проявляет высокую активность в подстилках и гумусовых горизонтах почв [17, 30], что предполагает его участие в гетерофазных реакциях при гумификации.
Цель настоящей работы – изучить особенности биотрансформации фенольных кислот лакказой и возможность синтеза макромолекулярных гуминоподобных веществ в динамических условиях при низких концентрациях предшественников. В качестве продуцента фермента взят почвенный базидиомицет Coprinus comatus F-2940. Лакказу иммобилизовали на каолините, модифицированном гидроксидом алюминия. Ранее установлено, что при иммобилизации лакказы на этом сорбенте образуются более высокомолекулярные продукты из низкомолекулярных предшественников, чем при иммобилизации на “чистых” глинистых минералах [75, 76]. Изучены некоторые свойства свободного и иммобилизованного фермента, субстратная специфичность в отношении фенольных кислот – предшественников, влияние природы аминокислот на способность к образованию комплексов с фенольными соединениями. Эксперимент по синтезу ГВ в присутствии иммобилизованной лакказы проводили в проточной микроколонке. Нами показана эффективность ее использования для изучения сорбции фенольных кислот модифицированным каолинитом при низких концентрациях веществ [3, 4].
ОБЪЕКТЫ И МЕТОДЫ
Минерал. В работе использовали каолинит (Просяновское месторождение, Украина), модифицированный аморфной гидроокисью алюминия (каол-Al(OH)x) в количестве 2.5 ммоль Al/г. Некоторые физико-химические свойства минерала описаны ранее [3].
Фенольные кислоты и аминокислоты. Использовали галловую (GAL), протокатеховую (PCAT), п-гидроксибензойную (HDB), ванилиновую (VAN), феруловую (FER) и сиреневую (SYR) кислоты (Sigma-Aldrich, США). Некоторые свойства кислот описаны ранее [4]. В качестве аминокислот использовали тирозин, L-ДОФА, глицин, лизин, аргинин, триптофан. Все эксперименты с кислотами проводили в 5 мМ Na-ацетатном буфере (рН 4.5) – буфер A.
Лакказа. Штамм Coprinus comatus VKM F-2940 был взят во Всероссийской коллекции микроорганизмов (ВКМ, http://vkm.ru/). Лакказа гриба С. comatus 2940 была наработана и очищена до электрофоретически гомогенного состояния. Для наработки фермента инокулят выращивали 7 дней на среде (г/л): пептон – 2; дрожжевой экстракт – 2; MgSO4 – 0.2; KH2PO4 – 0.3; глюкоза – 2%. Инокулят вносили в колбы на 750 мл, содержащие 200 мл среды Кирка с высоким азотом в 20 мМ тартратном буфере (рН 4.5) (г/л): CaCl2 – 0.01; MgSO4 – 0.1; KH2PO4 – 0.3; глюкоза – 1%; Твин 80 – 0.05%; α-аспарагин – 0.9; NH4NO3–0.5 и индукторы лакказы – ионы Cu2+ (0.1 мМ) и Mn2+ (0.5 мМ). На 10 сутки культуральную жидкость отделяли и проводили очистку фермента.
Стадии очистки следующие: 1 – высаливание. Фермент осаждали из культуральной жидкости (NH4)2SO4 при 90% насыщения с последующим центрифугированием при 15 000 g 30 мин. Осадок растворяли в 20 мМ Na-ацетатном буфере рН 5.0 (буфер B) и диализовали против этого буфера (мембрана 10 кДа); 2 – ионообменная хроматография (на DEAE-Toyopearl). Белковый препарат наносили на колонку, уравновешенную буфером B, промывали тремя объемами этого буфера и элюировали со скоростью 1 мл/мин градиентом NaCl 0–1 М; 3 – гель-фильтрация нa HiLoad 26/60 Superdex 200 column (GE Healthcare, USA). На колонку, уравновешенную буфером B, содержащим 0.1 M NaCl, наносили белковый препарат и элюировали со скоростью 1 мл/мл. Активные фракции диализовали против буфера А; 4 – ионообменная хроматография на колонке UNOQ6 (Bio-Rad, Hercules, CA, США). Диализованный препарат наносили на колонку, уравновешенную буфером B, промывали тремя объемами буфера и элюировали линейным градиентом 0–1 M NaCl в буфере B. Очищенный препарат диализовали против буфера B и использовали в дальнейшей работе.
Молекулярная масса белка (SDS-ПААГ) составляла 71.3 кДа; концентрация белка в полученном препарате (по Бредфорд) – 0.03 мг/мл. Активность фермента определяли спектрофотометрически (спектрофотометр Shimadzu 1800, Япония) по скорости окисления субстрата АБТС (2.2-азино-бис-(3-этилбензтиазолин-6-сульфонат) в буфере А при 420 нм. Коэффициент экстинкции АБТС – ε420 = 36.000/М/см [38]. За единицу активности лакказы (ЕД) принимали количество фермента, катализирующего окисление 1 микромоля АБТС в минуту.
Иммобилизация лакказы. Лакказу иммобилизовывали путем добавления аликвоты фермента в буфере А к навеске минерала. Минерал предварительно уравновешивали с буфером A, встряхивая суспензию 5 мин при 1400 об./мин на термошейкере (TS-100C, Biosan, Латвия). Смесь центрифугировали 1 мин при 18000 g (центрифуга Elmi CM-50, Латвия). Надосадочный раствор заменяли 0.5 мл буфера A, содержащего ферментный препарат, и встряхивали на шейкере в течение 1 ч при 25°С. Далее измеряли активность в равновесном растворе в условных единицах (ΔA420/(мин мл)) с 1 мМ АБТС в буфере A. Минерал промывали 1 мл буфера A и оценивали активность в промывке. Эффективность иммобилизации (%) определяли как:
При характеристике свойств иммобилизованного фермента использовали навеску минерала 2 мг, в эксперименте в проточной колонке – 20 мг. При количествах белка 0.08 мкг/2 мг минерала и 0.71 мкг/20 мг эффективность иммобилизации составляла 90–100%.
Активность иммобилизованной лакказы измеряли, добавляя 1.5 мл 1.0 мМ АБТС в буфере A к минералу с ферментом. Смесь встряхивали на термошейкере (2 мин), центрифугировали (1 мин), отбирали пробу супернатанта (100 мкл) и процедуру повторяли трижды. Пробы супернатанта разбавляли в 900 мкл буфера и измеряли оптическую плотность при 420 нм. Активность оценивали по линейному приросту оптической плотности и рассчитывали в ЕД/навеску минерала, взятую для эксперимента.
Свойства лакказы. Все реакции проводили в буфере А. рН оптимум свободного и иммобилизованного фермента определяли с фенольным субстратом 2.6 диметоксифенолом (2.6-ДМФ) – 2 мМ в 5 мМ Na-ацетатном буфере в диапазоне рН 4.0–5.8. Термостабильность определяли, инкубируя фермент при заданной температуре 30 мин на термошейкере (1400 rpm, 25°С) и измеряя активность с 1 мМ АБТС. Кинетические константы определяли с 2.6-ДМФ в буфере А при рН 4.5.
Окисление индивидуальных фенольных кислот свободной лакказой. Субстратную специфичность в отношении фенольных кислот определяли для свободного фермента по убыли субстрата (% от исходного). Реакционные смеси объемом 1 мл содержали 2 мМ кислот и 0.05 ЕД лакказы. Реакцию проводили 1, 3 и 5 ч, затем останавливали с помощью 10 мМ NaN3. Концентрацию кислот определяли методом обратнофазовой жидкостной хроматографии (RP-HPLC) как описано ниже.
Окисление смеси фенольных кислот свободной лакказой С. comatus в присутствии и отсутствии аминокислот. Эксперименты проводили в буфере А. Готовили контрольную смесь фенольных кислот – галловой, протокатеховой, ванилиновой, феруловой, сиреневой по 2 мМ каждой. Также готовили аналогичную смесь фенольных кислот с добавлением аминокислоты в концентрации 2 мМ – тирозина, глицина, L-ДОФА, лизина, аргинина, или триптофана. В 1 мл смеси вносили 0.08 ЕД лакказы и инкубировали 1 час при 25°С. Фенольные кислоты до и после эксперимента определяли методом RP-H-PLC. Влияние аминокислот на трансформацию фенольных кислот лакказой оценивали по убыли фенольных кислот в системах с аминокислотами по сравнению с контролем.
Трансформация фенольных кислот в присутствии иммобилизованной лакказы в проточной микроколонке. Использовали тефлоновую микроколонку внутренним диаметром 7 мм, высотой 28 мм, объемом 1 мл. Принципиальная схема колонки приведена в работе [1]. Для удерживания образца минерала в колонке использовали двойные фильтры “синяя лента” (Апекслаб, Россия) на входе и выходе с колонки. Колонку подключали к хроматографической системе низкого давления BioLogic LP (BioRad, США) c коллектором фракций (Model 2110, BioRad, США).
Для приготовления исходного раствора фенольных кислот (галловой, протокатеховой, сиреневой, феруловой) навески кислот в эппендорфах растворяли в 200 мкл этанола и количественно переносили в мерную колбу на 100 мл, объем доводили буфером А. Также готовили исходный раствор лизина 0.2 мМ в 100 мл буфера А. Аликвоты исходных растворов использовали для приготовления рабочих растворов (в 200 мл буфера А). Рабочий раствор смеси фенольных кислот содержал 0.01 мМ каждой кислоты в буфере А; рабочий раствор смеси кислот с лизином содержал 0.01 мМ каждой кислоты и 0.02 мМ лизина в буфере А.
В проточном эксперименте 20 мг минерала, содержащего 0.03 ЕД активного фермента (24 мкл препарата, соответствующего 0.72 мкг белка) или то же количество инактивированной лакказы (фермент инактивировали перед иммобилизацией нагреванием 30 мин при 80°С), помещали в колонку, и промывали 3 мл буфера А. Далее раствор откачивали и прокачивали через колонку 50 мл раствора фенольных кислот на скорости 0.1 мл/мин. На выходе из колонки собирали фракции по 2 мл и определяли в них концентрацию кислот методом RP-HPLC. Некоторые фракции объединяли.
Суммарную убыль фенольных кислот в растворе, прошедшем через колонку (нмоль), рассчитывали по формуле:
По окончании проточного эксперимента остатки раствора откачивали из колонки и проводили десорбцию кислот при скорости 0.5 мл/мин сначала 16 мл буфера А, затем 24 мл 50 мМ Na-ацетатного буфера (рН 4.5). Перед сменой буфера раствор откачивали из колонки. Собирали фракции по 2 мл. После эксперимента по десорбции минерал количественно извлекали из колонки. Суспензию центрифугировали (2 мин, 18 000 g), супернатант отделяли. Проводили экстракцию веществ, связанных с минералом, сначала 1 мл 0.1 М HCl (30 мин, 1400 об./мин, термошейкер) и затем 1 мл 0.1 М NaOH в атмосфере азота (30 мин, 1400 об./мин, термошейкер). К экстрактам добавляли 20 мг NaF для связывания в комплекс ионов Al. В экстрактах определяли концентрацию кислот методом RP-HPLC и молекулярно-массовые распределения методом высокоэффективной жидкостной хроматографии (HPLC) как описано ниже.
Анализ фенольных кислот. Кислоты определяли с помощью RP-HPLC на хроматографе Agilent 1100 с диодно-матричным детектором, насосом (QuatPump), термостатом для колонок и инжектором (Rheodyne, Cotati, США). Для разделения фенольных кислот использовали колонку SunergiHydro-RP (150 × 4.6 мм, 4 мкм, Phenomenex, США). Стартовый раствор (раствор А) содержал 90% H2O, 5 об. % ацетонитрила и 5 об. % (0.1 мас. %) 3-фторуксусной кислоты. Градиент создавали раствором B, содержащим 95% ацетонитрила и 5 об. % 0.1 мас. % 3-фторуксусной кислоты: 0–20 мин – 5–15% B, 20–30 мин – 15–40% B, 30–40 мин – 40% В. Скорость элюирования составляла 0.5 мл/мин, объем пробы – 20 мкл. Температура колонки – 30°С. Кислоты количественно определяли по площадям хроматографических пиков [3].
Молекулярно-массовые распределения продуктов реакции, сорбированных на минерале. Анализ щелочных экстрактов проводили на хроматографической системе высокого давления Agilent 1100 (см. выше) и колонке TSK-2000 SW, используя 0.1 М фосфатный буфер (pH 7.0) с добавлением 0.1% SDS и 0.05% NaN3. Скорость потока составляла 0.5 мл/мин. Перед нанесением на колонку, реакцию рН в щелочных пробах доводили до 7.0 путем добавления микроколичеств HCl (15%) и контролируя рН микроэлектродом HI 1330 (Hanna Instruments, США). Колонку калибровали по глобулярным белкам – цитохром (12.5 кДа), рибонуклеаза А (17.8 кДа), химотрипсиноген А (25 кДа), овальбумин (45 кДа), бычий сывороточный альбумин (67 кДа) (Sigma, США), а также полистиролсульфоновым кислотам (ПСК) с массами 6.8, 10, 17, 32, 77 кДа (Sigma-Aldrich, США). Свободный объем колонки (Vo) определяли по голубому декстрану (2000 кДа), конечный объем (Vt) – по обратному пику растворителя. Молекулярные массы (MW) веществ (кДа) находили по уравнениям:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Иммобилизация лакказы Coprinus comatus и свойства фермента. Ферменты в почвах в основном связаны с твердой фазой [23], реакции протекают в гетерогенных системах. Распространенными неорганическими сорбентами ферментов являются глинистые минералы, а также слабоокристаллизованные гидроксиды, которые могут существовать как дискретные фазы или осаждаться на поверхности минералов [42]. Каолинит, модифицированный гидроксидом алюминия, может поэтому служить приемлемой моделью комплексных минеральных фаз. При модификации каолинита увеличивается площадь поверхности [3], и она приобретает положительный заряд за счет гидроксида алюминия (PZC 8.0–9.2 [40]). Это способствует сорбции лакказы (pI 3–3.5; www.brenda-enzymes.org), фенольных кислот [4], и продуктов их окисления [76].
Эффективность иммобилизации лакказы C. comatus на минерале составляла 90–100%. Ранее было показано, что при иммобилизации лакказы гриба Panus tigrinus на данном сорбенте и чистом каолините сорбция на первом была на порядок выше [76], таким образом, лакказа связывается преимущественно с гидроксидом алюминия. Высокое сродство к гидроксиду алюминия (изотермы сорбции H-типа) показано и для лакказы Trametes villosa [13].
Оптимум окисления фенольного субстрата 2.6-ДМФ для свободной лакказы находится в области рН 6.0 (табл. 1), что согласуется с литературными данными [18, 34]. У иммобилизованного фермента рН-оптимум смещался в кислую область (рН 4.4). Смещение рН-оптимума – известное явление [49], связанное с возможными конформационными изменениями фермента при сорбции и изменением степени ионизации составляющих его аминокислот [32]. Иммобилизация часто приводит к уменьшению чувствительности фермента к высоким температурам [31, 50], однако термостабильность свободной лакказы С. comatus была больше, чем иммобилизованной. Фермент полностью терял активность за 30 мин при 80°С. При иммобилизации ферментов каталитическая активность может уменьшаться или увеличиваться вследствие конформационных изменений белка при сорбции, влияющих на активный центр [31, 72]. Кинетические параметры окисления 2.6-ДМФ при иммобилизации практически не менялись, что было показано также для лакказы T. villosa при иммобилизации на гидроксиде алюминия [13]. В настоящей работе это может быть связано со смещением рН-оптимума при иммобилизации. Кинетические константы были измерены при рН 4.5, что близко к оптимуму иммобилизованного фермента (рН 4.4), тогда как у свободной лакказы при этом рН активность составляла 70% от максимальной (данные не показаны).
Таблица 1.
Некоторые свойства свободной и иммобилизованной лакказы C. comatus 2940
| Лакказа | рН оптимум, 2.6-ДМФ | Термостабильность, %* | Кинетические константы, 2.6-ДМФ | ||||
|---|---|---|---|---|---|---|---|
| 40°С | 50°С | 60°С | Км, мМ | Vmax, ЕД/мг | kcat, c–1 | ||
| Свободная | 6.0 | 92 | 83 | 62 | 0.23 ± 0.02 | 22.59 ± 1.11 | 27.84 ± 0.69 |
| Иммобилизованная | 4.4 | 84 | 62 | 14 | 0.22 ± 0.04 | 22.71 ± 0.81 | 26.99 ± 0.96 |
Таким образом, лакказа C. comatus при иммобилизации на минеральном сорбенте сохраняет высокую каталитическую активность, рН-оптимум смещается в область значений, характерных для кислых почв, что должно благоприятствовать участию фермента в биокаталитических процессах в таких почвах.
Субстратная специфичность лакказы C. comatus в отношении фенольных кислот – предшественников ГВ. Фенольные кислоты, изученные в работе, являются типичными продуктами деструкции лигнина и считаются предшественниками гумусовых кислот [65]. Реакционная способность этих соединений во многом определяет состав образующихся гуминовых веществ.
По скорости окисления свободной лакказой C. comatus индивидуальные фенольные кислоты образовывали ряд: CAF > FER > GAL = SYR > > PCAT > VAN = HDB (рис. 1а). Наиболее эффективно окислялись коричные кислоты – кофейная и феруловая (72 и 53% за 1 ч), затем гидроксибензойные – галловая и сиреневая (43%). Ванилиновая кислота реагировала очень слабо (6% через 5 ч инкубации), п-гидроксибензойная кислота изученной лакказой не окислялась.
Рис. 1.
Трансформация фенольных кислот свободной лакказой C. comatus в 5 мМ Na-ацетатном буфере (рН 4.5): (а) окисление индивидуальных фенольных кислот (2 мМ каждой) лакказой (0.05 ЕД активности): 1 – 1 ч реакции; 2 – 3 ч; 3 – 5 ч; (b) окисление фенольных кислот (ФК) лакказой в отсутствии и присутствии аминокислот (2 мМ каждого вещества, 0.08 ЕД лакказы). Реакции проводили на термошейкере (25 С, 1100 rpm) в инкубационных смесях объемом 1 мл. Кислоты: 1 – галловая; 2 – протокатеховая; 3 – ванилиновая; 4 – сиреневая; 5 – феруловая. Аминокислоты: 6 – L-ДОФА; 7 – триптофан.
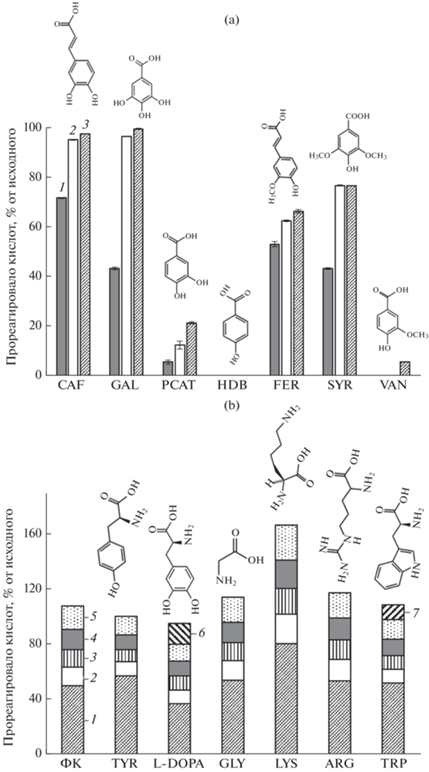
Скорость-лимитирующей стадией окисления субстратов лакказами является перенос 1е- от субстрата на медь T1-центра фермента [27]. Реакционная способность лакказы определяется разностью окислительно-восстановительных потенциалов (E°') T1 центра фермента и субстрата [54], а также стерическими факторами [70]. Окислительно-восстановительный потенциал Т1-центра у лакказ из разных продуцентов составляет 0.4–0.8 В. Наиболее высоким редокс-потенциалом обладают лакказы грибов белой гнили древесины (0.78 В), средним – лакказы почвенных базидиомицетов и аскомицетов (0.47–0.71 В), низким (0.42 В) – лакказы бактерий [27, 54]. Окислительно-восстановительный потенциал фенольных соединений находится в диапазоне 0.5–1.2 В [33]. Небольшие электронодонорные заместители (ОН-, NH2-, Cl-, OCH3- CH3-), особенно в орто-положении, повышают электронную плотность на фенокси-группе и облегчают процесс окисления [67, 70]; стерические факторы у таких заместителей играют небольшую роль [70]. Электроноакцепторные заместители (СООН, СОН, СОR, NO2) оттягивают на себя электронную плотность и замедляют окисление [26, 70]. Наличием двух электронодонорных OH-групп в галловой кислоте и двух OCH3 групп в сиреневой кислоте в орто-положении к фенокси-группе можно объяснить их высокую скорость окисления по сравнению с протокатеховой и ванилиновой кислотами (рис. 1а). Отсутствие электроноакцепторной COOH-группы, непосредственно связанной с бензольным кольцом, а также позитивный эффект Сα=Сβ связи на делокализацию электронов [26] способствует эффективному окислению кофейной и феруловой кислот. Лакказа С. comatus очень слабо окисляла ванилиновую кислоту, которая является типичным субстратом лакказ грибов белой гнили [24]. Это скорее всего связано с низким редокс-потенциалом лакказ С. comatus [34].
Трансформации каждой из фенольных кислот лакказой в их смеси (рис. 1b) значительно отличалась от реакций лакказы с индивидуальными кислотами (рис. 1а). В смеси порядок был следующий (% конверсии за 1 ч): GAL (49.9) > FER (16.9) > SYR (14.7) > PCAT (13.5) > VAN (13.0) (рис. 1b). По величинам окислительно-восстановительных потенциалов (В), определенных разными методами, кислоты образуют ряды: CAF (0.53) < SYR (0.75) < < FER (0.82) < VAN (0.88) [39]; GAL (0.26) < CAF (0.31) < FER (0.53) (vs. Ag/AgCl, [26]); CAF (0.45) < < SYR (0.49) < VAN (0.73) [62]. Преимущественное окисление галловой кислоты в смеси поэтому можно объяснить ее более низким окислительно-восстановительным потенциалом по сравнению с другими кислотами. В смеси кислот окислялась и ванилиновая кислота, что может быть связано с действием остальных кислот, как редокс-медиаторов [24].
Влияние природы аминокислот на взаимодействие с фенольными кислотами в присутствии лакказы C. comatus. Конденсация аминокислот с фенольными соединениями считается одним из механизмов включения азота в структуру гумусовых кислот [5, 65]. В качестве модельных аминокислот были взяты алифатическая нейтральная – глицин, алифатические основные – лизин и аргинин, ароматические кислоты – тирозин, триптофан и L-ДОФА (дигидроксифенилаланин). Все эти кислоты обнаруживаются в почвенных растворах [25, 68, 69]. Лизин, аргинин и триптофан относятся к наиболее реакционноспособным, так как они содержат свободные аминогруппу (–NH2), гуанидиновую группу (–С(NH2)2) и индольное кольцо. Эти группы легко вступают в реакции с карбонильной группой (С=O) альдегидов, кетонов и липидов, образуя темноокрашенные конденсаты (реакция Майара) [6], или в реакции с хинонной группой, образуя N-cодержащие гетерокомплексы (ГК и ФК-подобные соединения). L-ДОФА является предшественником меланинов – пигментов, сходных с ГВ по свойствам.
Способность аминокислот к взаимодействию с фенольными кислотами оценивали косвенно по увеличению конверсии фенольных кислот лакказой в смесях с аминокислотами по сравнению с контролем без них (рис. 1b). Лакказа С. comatus окисляла L-ДОФА и триптофан. В присутствии всех изученных аминокислот за исключением лизина и L-ДОФА количество окисляемых лакказой фенольных кислот значимо не менялось. В присутствии L-ДОФА существенно снижалось количество метаболизированной галловой кислоты (в 1.4 раза). В присутствии лизина степень конверсии каждой из фенольных кислот увеличивалась примерно в 1.5 раза по сравнению с контролем без аминокислот. Это свидетельствует о том, что лизин вступает в реакцию со всеми фенольными кислотами в смеси. Высокая реакционная способность лизина при взаимодействии с фенольными субстратами была показана и ранее [35]. Глицин, часто используемый при моделировании конденсационных реакций гумификации [43, 65], не реагировал с фенольными кислотами в их смеси.
Динамический проточный эксперимент. В динамическом эксперименте использовали кислоты, которые хорошо окислялись лакказой C. сomatus в гомогенной системе, а также лизин, так как в его присутствии существенно увеличивалась конверсия кислот лакказой (рис. 1b).
В варианте с инактивированным ферментом кислоты образовывали следующий ряд по убыли в растворе, прошедшем через колонку: GAL > > PCAT $ \gg $ FER > SYR (табл. 2, рис. 2). Убыль кислот была связана с их сорбцией минералом. Активная сорбция галловой и протокатеховой кислот модифицированным каолинитом показана нами ранее [3, 4] и обусловлена скорее всего образованием хелатных комплексов этих кислот с Al. В данной работе возможна также сорбция кислот на поверхности иммобилизованного белка [60]. Феруловая и сиреневая кислоты очень слабо сорбировались минералом в присутствии орто-дифенольных кислот, что обусловлено конкуренцией за места связывания [3, 4].
Таблица 2.
Убыль фенольных соединений (ФС) в растворе, прошедшем через колонку, и количество кислот, десорбированных с поверхности минерала (нмоль)
| Вариант опыта | Состав смеси | Количество вещества, нмоль | |||
|---|---|---|---|---|---|
| GAL* | PCAT | SYR | FER | ||
| Убыль кислот в растворе, прошедшем через колонку в первой порции элюата (2 мл) | |||||
| Лакказа | ФС | 11.49 ± 0.05** | 7.56 ± 0.09 | 4.21 ± 0.31 | 4.89 ± 0.26 |
| ФС + лизин | 11.98 ± 0.05 | 7.53 ± 0.09 | 3.55 ± 0.37 | 4.89 ± 0.25 | |
| Инактивированная лакказа | ФС | 10.92 ± 0.04 | 9.34 ± 0.11 | 1.28 ± 0.11 | 2.20 ± 0.12 |
| ФС + лизин | 12.66 ± 0.05 | 10.51 ± 0.12 | 0.80 ± 0.07 | 2.21 ± 0.11 | |
| Всего (в 50 мл) | |||||
| Лакказа | ФС | 133.97 ± 8.76 | 56.90 ± 7.14 | 34.79 ± 9.52 | 47.52 ± 1.54 |
| ФС + лизин | 157.78 ± 10.11 | 52.78 ± 6.58 | 41.61 ± 11.32 | 58.36 ± 1.88 | |
| Инактивированная лакказа | ФС | 77.17 ± 5.32 | 36.75 ± 5.29 | 4.96 ± 1.46 | 14.84 ± 0.89 |
| ФС + лизин | 70.13 ± 5.00 | 35.23 ± 4.88 | 3.15 ± 0.65 | 12.32 ± 0.68 | |
| Конверсия кислот лакказой*** | |||||
| ФС | 56.80 | 20.15 | 29.84 | 32.68 | |
| ФС + лизин | 87.65 | 17.55 | 38.46 | 48.03 | |
| Десорбция кислот, связанных с минералом 5 мМ Na-ацетатный буфер | |||||
| Лакказа | ФС | 1.00 | 2.09 | 0.42 | 2.83 |
| ФС + лизин | 0.56 | 2.31 | 0.51 | 1.97 | |
| Инактивированная лакказа | ФС | 5.70 | 7.85 | 1.87 | 3.13 |
| ФС + лизин | 4.08 | 4.02 | 1.46 | 3.88 | |
| 50 мМ Na-ацетатный буфер | |||||
| Лакказа | ФС | 0.00 | 2.95 | 0.00 | 1.16 |
| ФС + лизин | 0.21 | 2.27 | 0.25 | 1.30 | |
| Инактивированная лакказа | ФС | 12.41 | 13.29 | 0.00 | 0.78 |
| ФС + лизин | 9.16 | 11.52 | 0.28 | 1.65 | |
| Экстракция 0.1 М HCl | |||||
| Лакказа | ФС | 4.21 | 6.70 | 0.15 | 0.03 |
| ФС + лизин | 3.60 | 5.16 | 0.29 | 0.09 | |
| Инактивированная лакказа | ФС | 21.11 | 9.54 | 0.12 | 0.09 |
| ФС + лизин | 26.27 | 12.85 | 0.06 | 0.06 | |
| Всего десорбировано и экстрагировано кислот | |||||
| Лакказа | ФС | 5.21 (4)**** | 11.74 (21) | 0.57 (2.0) | 4.02 (8) |
| ФС + лизин | 4.37 (3) | 9.74 (18) | 1.05 (2.5) | 3.36 (6) | |
| Инактивированная лакказа | ФС | 39.22 (51) | 30.68 (83) | 1.99 (40) | 4.00 (27) |
| ФС + лизин | 39.51 (56) | 28.39 (81) | 1.80 (57) | 5.59 (45) | |
* GAL – галловая кислота, PCAT – протокатеховая, SYR – сиреневая, FER – феруловая. ** Среднее ± стандартное отклонение. *** Конверсия рассчитана как разность между общей убылью фенольных кислот в смесях с активным ферментом и контролем с инактивированным ферментом. **** В круглых скобках процент от общей убыли мономеров в растворе, прошедшем через колонку.
Рис. 2.
Трансформация фенольных кислот (0.01 мМ каждой) иммобилизованной лакказой C. comatus в отсутствии (открытые символы) и присутствии (темные символы) лизина (0.02 мМ) в проточной микроколонке. Круглые символы – активный фермент (0.03 ЕД, 0.7 мкг белка), треугольные – контроль с инактивированным ферментом (0.7 мкг белка). GAL – галловая кислота, PCAT – протокатеховая кислота, SYR – сиреневая кислота, FER – феруловая кислота. Общую убыль вещества в элюате (нмоль) рассчитывали как Ʃ(Сисх – Сэлюат) · Vфракции, где Сисх – исходная концентрация кислоты (0.01 мМ = 10 нмоль/мл), Сэлюат – концентрация кислоты на выходе из колонки (нмоль/мл), V – объем фракции (мл).

В варианте с активной лакказой убыль фенольных кислот в растворе, прошедшем через колонку, связана с: 1) сорбцией исходных веществ; 2) их окислением/конденсацией с образованием растворимых конъюгатов; 3) сорбцией продуктов окисления. Лакказа эффективно окисляла фенольные кислоты в динамических условиях, несмотря на низкие концентрации веществ. В присутствии лакказы существенно уменьшалось количество сиреневой и феруловой кислот в элюате – в 7.0 и 3.2 раза соответственно по сравнению с контролем с инактивированным ферментом (табл. 2). В наименьшей степени присутствие лакказы было выражено для протокатеховой кислоты, что хорошо согласуется с субстратной специфичностью свободного фермента (рис. 1а).
Для всех кислот, кроме галловой, эффект присутствия биокатализатора наблюдали уже в первой фракции элюата. Убыль галловой кислоты в начале эксперимента была в основном связана с ее сорбцией, о чем свидетельствуют близкие значения потери этого вещества в вариантах с активной и инактивированной лакказой. Сорбция уменьшала концентрацию галловой кислоты в растворе и, соответственно, скорость ее окисления лакказой. Негативное влияние сорбции на окисление галловой кислоты снижалось при заполнении активных центров минерала. С другой стороны, удаление галловой кислоты из реакционной смеси, а также заполнение сорбционных центров минерала способствовало эффективному окислению сиреневой и феруловой кислот уже в первых порциях раствора, проходящего через колонку. В гомогенной системе присутствие галловой кислоты мешало окислению сиреневой и феруловой кислот (рис. 1b). Таким образом, высокое сродство субстрата к минеральной фазе [3], оказывает существенное влияние на гетерофазный ферментативный катализ, определяя состав продуктов реакции.
Вклад лакказы в трансформацию кислот с учетом сорбции оценивали по разности между общей убылью фенольных кислот в варианте с активным ферментом и контроле с инактивированной лакказой. По степени конверсии лакказой в проточных условиях кислоты образовывали ряд GAL > FER > SYR > PCAT (табл. 2), который согласуется с закономерностями, установленными в гомогенной системе, однако при низких концентрациях субстрата разница в скорости окисления галловой кислоты и остальных кислот была не столь существенной, как при высоких (рис. 1b), что обусловлено причинами, о которых говорилось выше. Степень конверсии всех фенольных кислот, кроме протокатеховой, увеличивалась в присутствие лизина. Таким образом, свободнорадикальные реакции взаимодействия азотистых и фенольных соединений могут осуществляться в условиях промывного режима и при низких концентрациях веществ, характерных для почв.
Десорбция фенольных кислот и состав органо-минеральных комплексов. Об образовании продуктов свободнорадикальной конденсации и их составе можно косвенно судить по количеству и составу мономеров, десорбированных с поверхности минерала в вариантах с активным и инактивированным ферментом. Для этого проводили десорбцию ацетатным буфером возрастающей концентрации и затем экстракцию 0.1 М HCl. 5 мМ буфер предположительно десорбирует кислоты, связанные электростатическими и водородными связями, 50 мМ буфер десорбирует кислоты, образующие внутрисферные комплексы [4]. В присутствии HCl происходит растворение гидроксида алюминия, которым модифицирована поверхность каолинита, и переход в раствор связанных с ним веществ.
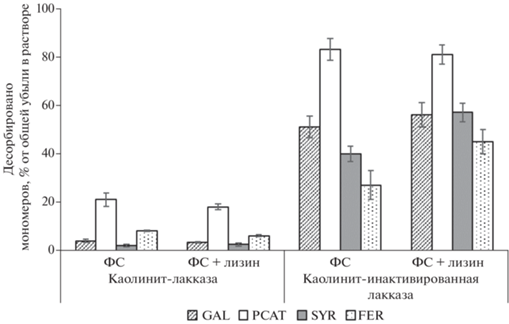
Феруловая и сиреневая кислоты в основном десорбировались 5 мМ ацетатным буфером, галловая и протокатеховая – 50 мМ буфером и 0.1 М HCl (рис. 3, табл. 2), что согласуется с данными, полученными ранее [4]. Количество кислот, десорбированных с поверхности минерала ацетатным буфером, было существенно ниже в вариантах с активной лакказой (рис. 3a, 3b, табл. 2) по сравнению с контролем с инактивированным ферментом (рис. 3c, 3d). Та же тенденция наблюдалась и в кислых экстрактах. Общее количество галловой, сиреневой и феруловой кислот извлеченных с поверхности минерала в варианте с инактивированным ферментом составляло 27–56% от их убыли в растворе, протокатеховой кислоты – около 80% (рис. 4). В варианте с активной лакказой эти величины резко уменьшались, составляя 5–8% для галловой, сиреневой и феруловой кислот и 30–40% для протокатеховой, что соответствует субстратной специфичности фермента. Наблюдаемую разницу можно считать косвенным показателем конденсации фенольных кислот и сорбции продуктов конденсации минералом. Можно предполагать, что среди последних преобладали продукты окисления галловой кислоты, о чем свидетельствует убыль ее в растворе, относительно малое количество мономеров, десорбированных с поверхности минерала (рис. 3, табл. 2), а также окрашивание поверхности минерала в темный цвет.
Рис. 3.
Десорбция кислот, сорбированных на минерале, 5 и 50 мМ ацетатным буфером в проточном эксперименте: (a) смесь кислот без лизина, лакказа 0.08 ЕД; (b) смесь кислот с лизином, лакказа 0.08 ЕД; (c) смесь кислот без лизина, инактивированная лакказа; (d) смесь кислот с лизином, инактивированная лакказа.
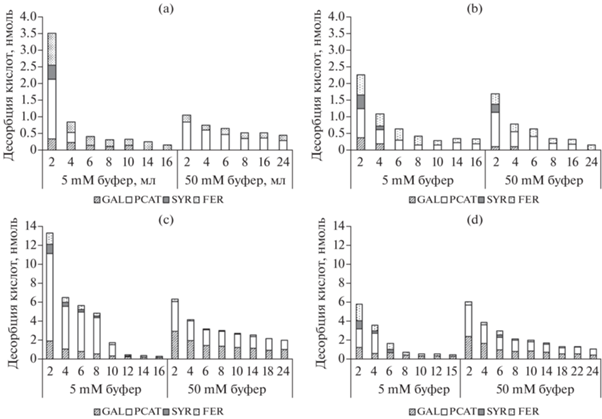
Рис. 4.
Количество фенольных мономеров, извлеченных (десорбированных ацетатным буфером и экстрагированных 0.1 М HCl) с поверхности минерала в опыте в проточной микроколонке в вариантах с активной и инактивированной лакказой (% от общей убыли в растворе, прошедшем через колонку).
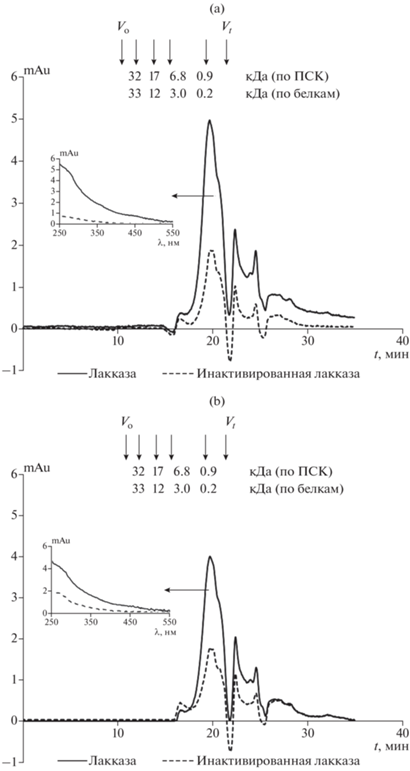
Молекулярно-массовые распределения продуктов реакции, связанных с поверхностью минерала. На хроматограммах щелочных экстрактов, полученных для вариантов с активной лакказой и инактивированным ферментом, присутствовали основной пик, выходящий близко к общему объему колонки, а также ряд “сорбционных” пиков, выходящих за разделяющим объемом колонки (рис. 5a, 5b) и принадлежащих, судя по спектрам, мономерам феруловой и сиреневой кислот (данные не показаны). Молекулярную массу основного пика оценить было трудно в связи с его положением близко к разделяющему объему колонки. При калибровке по глобулярным белкам она составляла около 270 Да, при калибровке по ПСК – 900 Да. Спектр веществ основного пика в варианте с активной лакказой существенно отличался как от спектров мономеров, так и от спектра основного пика в варианте с инактивированным ферментом значительным увеличением поглощения в видимой области (см. вставку на рис. 5). Это может свидетельствовать об образовании темноокрашенных олигомеров. Для фенольных соединений, в том числе ванилиновой и сиреневой [48], галловой [11], феруловой [22], кофейной [15] кислот хорошо известно образование димеров и тримеров (включая хинон-димеры) посредством С–С и С–О–С связей при их окислении лакказой и пероксидазой, а также димеризация с образованием сопряженных двойных связей [53]. В настоящей работе об образовании димеров/олигомеров и их связывании с твердой фазой свидетельствует существенная разница между количеством десорбированных мономеров в смесях с активным и инактивированным ферментом (рис. 4, табл. 2).
Рис. 5.
Молекулярно-массовые распределения веществ, связанных с поверхностью минерала и десорбированных 0.1 М NaOH после экстракции 0.1 M HCl: (a) – варианты без лизина, (b) – с лизином. Хроматографическая система высокого давления Agilent 1100, колонка TSK-2000 SW, 0.1 М фосфатный буфер (pH 7.0) с добавлением 0.1% SDS и 0.05% NaN3.
Ранее [75] нами показано образование полимерных ГК-подобных веществ (с массами 10–75 кДа, гель-фильтрация) в статических условиях в присутствии лакказы гриба белой гнили Panus tigrinus, иммобилизованной на модифицированном каолините. Смесь предшественников содержала кофейную, галловую, ванилиновую, феруловую, п‑гидроксибензойную кислоты (0.15 мг или 0.8 мМ каждой), аминокислоты триптофан (0.10 мг или 0.5 мМ), фенилаланин (0.1 мг или 0.6 мМ) и аргинин (0.05 мг или 0.3 мМ) и 0.08 ЕД лакказы. Эффективная полимеризация могла быть обусловлена несколькими причинами: 1) более высокой концентрацией субстратов; 2) высокой реакционной способностью фермента – лакказа P. tigrinus окисляет фенольные кислоты эффективнее, чем лакказа С. comatus (данные не показаны); 3) составом фенольных и азотистых мономеров, включая кофейную кислоту, которая окисляется быстрее, чем галловая (рис. 1а); 4) более длительным временем взаимодействия.
В проточном эксперименте фактором, ограничивающим полимеризацию, может быть низкая концентрация субстрата, определяющая скорость ферментативной реакции. Концентрация 0.01 мМ была на 1–2 порядка меньше значений Км (0.13–10 мМ) для лакказ при окислении фенольных соединений [70]. Тем не менее, даже в этих условиях происходит эффективная конверсия галловой, сиреневой и феруловой кислот лакказой (рис. 2, 4).
ЗАКЛЮЧЕНИЕ
Установлено, что в проточных условиях, моделирующих промывной режим почв гумидного климата, при концентрациях мономеров в пределах значений, характерных для почвенных растворов и в присутствии иммобилизованной лакказы почвенного продуцента образуются низкомолекулярные вещества типа фульвокислот. Показана важная роль гетерофазных реакций в формировании состава жидкой фазы и органо-минеральных комплексов. В отсутствие лакказы ведущую роль в распределении фенольных кислот между твердой и жидкой фазой играет структура кислот. Орто-дифенолы (галловая, протокатеховая кислоты) значительно эффективнее взаимодействуют с минеральной фазой, содержащей гидроксид алюминия, чем метоксизамещенные соединения (сиреневая и феруловая кислоты). В присутствии иммобилизованной лакказы распределение кислот между твердой и жидкой фазами определяется как способностью кислот к окислению, зависящей от окислительно-восстановительного потенциала, так и взаимодействиями с минеральной фазой. При свободных сорбционных центрах на минерале и низких концентрациях субстрата селективная сорбция одного из субстратов может как мешать (в случае галловой кислоты), так и способствовать (в случае феруловой и сиреневой кислот) ферментативному катализу в гетерогенной системе, определяя состав продуктов реакции. Наибольшей реакционной способностью в смеси кислот обладала галловая кислота, затем сиреневая и феруловая кислоты. Установлена важная роль лизина в формировании коньюгатов с фенольными соединениями в присутствии лакказы как в статических, так и проточных условиях.
Список литературы
Ермолин М.С., Федюнина Н.Н., Карандашев В.К., Федотов П.С. Изучение подвижности наночастиц оксида церия в почвах с использованием динамического экстрагирования в микроколонке и вращающейся спиральной колонке // Журн. аналит. химии. 2019. Т. 74. № 8. С. 624–633. https://doi.org/10.1134/S1061934819080070
Заварзина А.Г., Данченко Н.Н., Демин В.В., Артемьева З.С., Когут Б.М. Гуминовые вещества – гипотезы и реальность (обзор) // Почвоведение. 2021. № 8. С. 1449–1480.
Заварзина А.Г., Ермолин М.С., Демин В.В., Федотов П.С. Взаимодействие смеси фенольных кислот с модифицированным каолинитом в статических и динамических условиях // Почвоведение. 2018. № 8. С. 1004–1013. https://doi.org/10.1134/S0032180X18080129
Заварзина А.Г., Ермолин М.С., Демин В.В., Федотов П.С. Влияние уксусной кислоты и ацетат-ионов на сорбцию–десорбцию смеси фенольных кислот модифицированным каолинитом // Почвоведение. 2020. № 8. С. 948–958. https://doi.org/10.31857/S0032180X20080171
Кононова М.М. Органическое вещество почвы. М.: Изд-во АН СССР, 1963. 315 с.
Космачевская О.В. Вездесущая реакция Майара // Химия и жизнь. 2012. № 2. https://hij.ru/read/92/
Малинина М.С., Иванилова С.В. Фенольные соединения в растворах различных типов почв Центрального лесного заповедника // Почвоведение. 2008. № 4. С. 421–430. https://doi.org/10.1134/S1064229308040030
Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. М.: Изд-во Моск. ун-та, 1990. 325 с.
Орлов Д.С., Бирюкова О.Н., Суханова Н.И. Органическое вещество почв Российской Федерации. М.: Наука, 1996. 258 с.
Семенов В.М., Тулина А.С., Семенова Н.А., Иванникова Л.А. Гумификационные и негумификационные пути стабилизации органического вещества в почве (обзор) // Почвоведение. 2013. № 4. С. 393–407. https://doi.org/10.7868/S0032180X13040114
Ahn B.J., Gaikwad K.K., Lee Y.S. Characterization and properties of LDPE film with gallic-acid-based oxygen scavenging system useful as a functional packaging material // J. App. Pol. Sci. 2016. V. 133(43). https://doi.org/10.1002/app.44138
Ahn M.Y., Martinez C.E., Archibald D.D., Zimmerman A.R., Bollag J.M., Dec J. Transformation of catechol in presence of a laccase and birnessite // Soil Biol Biochem. 2006. V. 38. P. 1015–1020. https://doi.org/10.1016/j.soilbio.2005.08.016
Ahn M.Y., Zimmerman A.R., Martinez C.E., Archibald D.D., Bollag J.M., Dec J. Characteristics of Trametes villosa laccase adsorbed on aluminum hydroxide // Enz. Microb. Technol. 2007. V. 41. P. 141–148.https://doi.org/10.1016/j.enzmictec.2006.12.014
Alexandrova L.N., Arshavskay T.Th., Dorfman F.M., Lyuzin M.F., Yurlova O.V. Humus acids and their organo- mineral derivatives in soil // Int. Soil Sci. Congr. Trans. 1968. V. 3(9). P. 143–152.
Arakawa R., Yamaguchi M., Hotta H., Osakai T., Kimoto T. Product analysis of caffeic acid oxidation by on-line electrochemistry/electrospray ionization mass spectrometry // J. Am. Soc. Mass Spectrom. 2004. V. 15(8). P. 1228–1236. https://doi.org/10.1016/j.jasms.2004.05.007
Baldrian P. Fungal laccases-occurrence and properties // FEMS Microbiol. Rev. 2006. V. 30. P. 215–242. https://doi.org/10.1111/j.1574-4976.2005.00010.x
Baldrian P., Snajdr J. Lignocellulose-degrading enzymes in soil // Soil Enzymology. V. 22. Soil Biology. Berlin Heidelberg: Springer-Verlag, 2011. P. 167–186.
Bao S., Teng Z., Ding S. Heterologous expression and characterization of a novel laccase isoenzyme with dyes decolorization potential from Coprinus comatus // Molecular Biology Reports. 2012. V. 40(2). P. 1927–1936. https://doi.org/10.1007/s11033-012-2249-9
Batjes N.H. Total carbon and nitrogen in the soils of the world // Eur. J. Soil Sci. 2014. V. 65. P. 4–21. https://doi.org/10.1111/ejss.12114_2
Bollag J.M., Dec J., Huang P.M. Formation mechanisms of complex organic structures in soil habitats // Adv. Agron. 1997. V. 63. P. 237–265. https://doi.org/10.1016/S0065-2113(08)60245-X
Bollag J.M., Meyers C., Pal S., Huang P.M. The Role of Abiotic and Biotic Catalysts in the Transformation of Phenolic Compounds // Environmental Impact of Soil Component Interactions. Lewis, Boca Raton, 1995. P. 299–310.
Bunzel M., Ralph J., Brüning P., Steinhart H. Structural identification of dehydrotriferulic and dehydrotetraferulic acids isolated from insoluble maize bran fiber // J. Agr. Food Chem. 2006. V. 5(17). P. 6409–6418. https://doi.org/10.1021/jf061196a
Burns R.G., DeForest J.I., Marxsen J., Sinsabaugh R.I., Stromberger M.E., Wallenstein M.D., Weintraub M.N., Zoppini A. Soil enzymes in a changing environment: current knowledge and future directions // Soil Biol. Biochem. 2013. V. 58. P. 216–234. https://doi.org/10.1016/j.soilbio.2012.11.009
Cañas A.I., Camarero S. Laccases and their natural mediators: biotechnological tools for sustainable eco-friendly processes // Biotechnol Adv. 2010. V. 28. P. 694–705. https://doi.org/10.1016/j.biotechadv.2010.05.002
Cao X., Ma Q., Zhong C., Yang X., Zhu L., Zhang J. et al. Elevational Variation in Soil Amino Acid and Inorganic Nitrogen Concentrations in Taibai Mountain, China // PLoS ONE. 2016. V. 11. e0157979. https://doi.org/10.1371/journal.pone.0157979
Chiorcea-Paquim A., Enache T.A., De Souza Gil E., Oliveira-Brett A.M. Natural phenolic antioxidants electrochemistry: towards a new food science methodology // Compr. Rev. Food Sci. Food Saf. 2020. P. 1–47.https://doi.org/10.1111/1541-4337.12566
Christenson A., Dimcheva N., Ferapontova E.E. et al. Direct Electron Transfer Between Ligninolytic Redox Enzymes and Electrodes // Electroanalysis. 2004. V. 16. № 1314. P. 1074–1092. https://doi.org/10.1002/elan.200403004
Dou S., Shan J., Song X., Cao R., Wu M., Li Ch., Guan S. Are humic substances soil microbial residues or unique synthesized compounds? A perspective on their distinctiveness // Pedosphere. 2020. V. 30(2). P. 159–167. https://doi.org/10.1016/S1002-0160(20)60001-7
De Nobili M., Bravo C., Chen Y. The spontaneous secondary synthesis of soil organic matter components: a critical examination of the soil continuum model theory // Appl. Soil Ecol. 2020. V. 154. P. 10365. https://doi.org/10.1016/j.apsoil.2020.103655
Eichlerová I., Šnajdr J., Baldrian P. Laccase activity in soils: considerations for the measurement of enzyme activity // Chemosphere. 2012. V. 88. P. 1154–1160. https://doi.org/10.1016/j.chemosphere.2012.03.019
Fernández-Fernández M., Sanromán M.Á., Moldes D. Recent developments and applications of immobilized laccase // Biotechnol. Adv. 2013. V. 31. P. 1808–1825. https://doi.org/10.1016/j.biotechadv.2012.02.013
Frankenberger W.T., Jr., Johanson J.B. Effect of pH on enzyme stability in soils // Soil Biol Biochem. 1982. V. 14. P. 433–437. https://doi.org/10.1016/0038-0717(82)90101-8
Giardina P., Faraco V., Pezzella C., Piscitelli A., Vanhulle S., Sannia G. Laccases: a never-ending story // Cell. Mol. Life Sci. 2009. V. 67(3). P. 369–385. https://doi.org/10.1007/s00018-009-0169-1
Gu C., Zheng F., Long L., Wang J., Ding S. Engineering the Expression and Characterization of Two Novel Laccase Isoenzymes from Coprinus comatus in Pichia pastoris by Fusing an Additional Ten Amino Acids Tag at N-Terminus // PLoS ONE. 2014. V. 9(4). P. e93912. https://doi.org/10.1371/journal.pone.0093912
Haider K., Frederick L.R., Flaig W. Reactions between amino acid compounds and phenols during oxidation // Plant Soil. 1965. V. 22. P. 49–64. https://www.jstor.org/stable/42932090
Haider K., Schäffer A. Soil biochemistry. Science Publishers, Jersey, Plymouth, 2009. P. 132.
Hayes M.H.B., Swift R.S. Vindication of humic substances as a key component of organic matter in soil and water // Adv. Agronomy. 2020. V. 163. Ch. 1. https://doi.org/10.1016/bs.agron.2020.05.001
Heinfling A., Martinez A.T., Martinez M.J. et al. Purification and characterization of peroxidases from the dye-decolorizing fungus Bjerkandera adusta // FEMS Microbiol. Lett. 1998. V. 428. P. 43–50. https://doi.org/10.1016/S0014-5793(98)00512-2
Hradkowa I., Filip V. Antioxidant Stability of Phenolic Acids and Their Esters // Czech J. Food Sci. 2009. V. 27. P. 41–44.
Hsu P.H. Aluminum hydroxides and oxyhydroxides // Minerals in soil environments. SSSA Book Series No. 1. Madison, WI: Soil Science Society of America, 1989. P. 331.
Huang P.M. Abiotic Catalysis. Handbook of Soil Science. CRC, Boca Raton, FL, 2000. P. 303–334.
Huang P.M. The role of short-range ordered mineral colloids in abiotic transformation of organic compounds in the environment // Environmental impact of soil component interactions. 1. Natural and Anthropogenic Organics. Boca Raton, FL: CRC/Lewis Publishers, 1995. P. 135.
Huang P.M., Hardie A.G. Formation Mechanisms of Humic Substances in the Environment // Biophysico Chemical Processes Involving Natural Nonliving Organic Matter in Environmental Systems. Ch. 2. Hoboken: John Wiley & Sons, 2009. P. 84–98.
International Humic Substances Society (IHSS). 2021. What are humic substances? Available online at http:// humic-substances.org/what-arehumic-substances-2/
Janusz G., Pawlik A., Swiderska-Burek U., Polak J., Sulej J., Jarosz-Wilkołazka A., Paszczy’nski A. Laccase properties, physiological functions, and evolution // Int. J. Mol. Sci. 2020. V. 21(3). P. 966.https://doi.org/10.3390/ijms21030966
Jones D.L., Owen A.G., Farrar J.F. Simple method to enable the high resolution determination of total free amino acids in soil solutions and soil extracts // Soil Biol Biochem. 2002. V. 34. P. 1893–1902. https://doi.org/10.1016/S0038-0717(02)00203-1
Lehmann J., Kleber M. The contentious nature of soil organic matter // Nature. 2015. V. 528. P. 60–68. https://doi.org/10.1038/nature16069
Leonowicz A., Edgehill R.U., Bollag J.M. The effect of pH on the transformation of syringic and vanillic acids by the laccases of Rhizoctonia praticola and Trametes versicolor // Arch Microbiol. 1984. V. 137. P. 89–96. https://doi.org/10.1007/BF00414446
Leonowicz A., Sarkar J.M., Bollag J.M. Improvement in stability of an immobilized fungal laccase // Appl Microbiol Biotechnol. 1988. V. 29. P. 129–135.
Li Na., Xia Q., Niu M., Ping Q., Xiao H. Immobilizing laccase on different species wood biochar to remove the chlorinated Biphenyl in Wastewater // Scientific Reports. 2018. V. 8. P. 13947. https://doi.org/10.1038/s41598-018-32013-0
Lisov A., Belova O., Zavarzina A., Konstantinov A., Leontievsky A. The role of laccase from zygomycetous fungus Mortierella elasson in humic acids degradation // Agron. 2021. V. 11. P. 2169. https://doi.org/10.3390/agronomy11112169
Liu S.Y., Freyer A.J., Minard R.D., Bollag J.M. Enzyme-catalyzed complex formation of amino acid esters and phenolic humus constituents // Soil Sci. Soc. Am. J. 1985. V. 49. P. 337–342. https://doi.org/10.2136/sssaj1985.03615995004900020013x
Magario I., García Einschlag F.S., Rueda E.H., Zygadlo J., Ferreira M.L. Mechanisms of radical generation in the removal of phenol derivatives and pigments using different Fe-based catalytic systems // J. Mol. Cat. A: Chem. 2012. V. 352. P. 1–20. https://doi.org/10.1016/j.molcata.2011.10.006
Morozova O.L., Shumakovich G.P., Gorbacheva M.A., Shleev S.V., Yaropolov A.I. “Blue” laccases // Biokhimiya. 2007. V. 72. № 10. P. 1396–1412. https://doi.org/10.1134/s0006297907100112
Naidja A., Huang P.M., Dec J., Bollag J.M. Comparison of the reaction products from the transformation of catechol catalyzed by birnessite or tyrozinase // Soil Sci. Soc. Am. J. 1998. V. 62. P. 188–195. https://doi.org/10.1016/j.soilbio.2005.08.016
Olk D.C., Bloom P.R., Perdue E.M. et al. Environmental and agricultural relevance of humic fractions extracted by alkali from soils and natural waters // J. Environ. Qual. 2019. V. 48. P. 217–232. https://doi.org/10.2134/jeq2019.02.0041
Olofsson M.A., Norström S.H., Bylund D. Evaluation of sampling and sample preparation procedures for the determination of aromatic acids and their distribution in a podzol soil using liquid chromatography-tandem mass spectrometry // Geoderma. 2014. V. 23. P. 373–380. https://doi.org/10.1016/j.geoderma.2014.06.005
Pal S., Bollag J.M., Huang P.M. Role of abiotic and biotic catalysts in the transformation of phenolic compounds through oxidative coupling reactions // Soil Biol. Biochem. 1994. V. 26. P. 813–820. https://doi.org/10.1016/0038-0717(94)90297-6
Piccolo A. The supramolecular structure of humic substances: A novel understanding of humus chemistry and implications in soil sciences // Adv. Agron. 2002. V. 75. P. 57–134. https://doi.org/10.1016/S0065-2113(02)75003-7
Sęczyk Ł., Świeca M., Kapusta I., Gawlik-Dziki U. Protein–Phenolic Interactions as a Factor Affecting the Physicochemical Properties of White Bean Proteins // Molecules. 2009. V. 24(3). P. 408. https://doi.org/10.3390/molecules24030408
Schaeffer A., Nannipieri P., Kästner M., Schmidt B., Botterweck J. From humic substances to soil organic matter–microbial contributions. In honor of Konrad Haider and James P. Martin for their outstanding research contribution to soil science // J. Soils Sediments. 2015. V. 15. P. 1865–1881. https://doi.org/10.1007/s11368-015-1177-4
Simić A., Manojlović D., Šegan D., Todorović M. Electrochemical behavior and antioxidant and prooxidant activity of natural phenolics // Molecules. 2007. V. 12. P. 2327–2340. https://doi.org/10.3390/12102327
Sinsabaugh R.L. Phenol oxidase, peroxidase and organic matter dynamics of soil // Soil Biol. Biochem. 2010. V. 42. P. 391–404. https://doi.org/10.1016/j.soilbio.2009.10.014
Shindo H., Huang P.M. Catalytic effects of manganese(IV), iron(III), aluminum and silicon oxides on the formation of phenolic polymers // Soil Sci. Soc. Am. J. 1984. V. 48. P. 927–934. https://doi.org/10.2136/sssaj1984.03615995004800040045x
Stevenson F.J. Humus Chemistry. Genesis, composition, reactions. N.Y.: John Wiley & Sons, 1994. 512 p.
Sutton R., Sposito G. Molecular structure in humic substances: The new view // Environ. Sci. Technol. 2005. V. 39. P. 9009–9015. https://doi.org/10.1021/es050778q
Tadesse M.A., D’Annibale A., Galli C., Gentili P., Sergi F. An assessment of the relative contributions of redox and steric issues to laccase specificity towards putative substrates // Org. Biomol. Chem. 2008. V. 6. P. 868–878. https://doi.org/10.1039/B716002J
Warren C.R., Taranto M.T. Temporal variation in pools of amino acids, inorganic and microbial N in a temperate grassland soil // Soil Biol. Biochem. 2010. V. 42. P. 353–359. https://doi.org/10.1016/J.SOILBIO.2009.11.017
Werdin-Pfisterer N.R., Kielland K., Boone R.D. Soil amino acid composition across a boreal forest successional sequence // Soil Biol. Biochem. 2009. V. 41. P. 1210–1220. https://doi.org/10.1016/j.soilbio.2009.03.001
Xu F. Oxidation of phenols, anilines, and benzenethiols by fungal laccases: correlation between activity and redox potentials as well as halide inhibition // Biochem. 1996. V. 35. P. 7608–7614. https://doi.org/10.1021/bi952971a
Xu F. Effects of redox potential and hydroxide inhibition on the pH activity profile of fungal laccases // J. Biol. Chem. 1997. V. 272. P. 924–928.https://doi.org/10.1074/jbc.272.2.924
Yang J., Li W., Ng T.B., Deng X., Lin J., Ye X. Laccases: Production, Expression Regulation, and Applications in Pharmaceutical Biodegradation // Front. Microbiol. 2017. V. 8. P. 832. https://doi.org/10.3389/fmicb.2017.00832
Yavmetdinov I.S., Stepanova E.V., Gavrilova V.P., Lokshin B.V., Perminova I.V., Koroleva O.V. Isolation and characterization of humin-like substances produced by wood-degrading white-rot fungi // Appl. Biochem. Microbiol. Moscow. 2003. V. 39. P. 257–264.
Yu Z., Zhang Q., Kraus T.E.C., Dahlgren R.A., Anastasio C., Zasoski R.J. Contribution of amino compounds to dissolved organic nitrogen in forest soils // Biogeochemistry. 2002. V. 61. P. 173–198. https://www.jstor.org/stable/1469810
Zavarzina A.G. A mineral support and biotic catalyst are essential in the formation of highly polymeric soil humic substances // Eurasian Soil Sci. 2006. V. 39. P. S48–S53. https://doi.org/10.1134/S1064229306130096
Zavarzina A. Heterophase synthesis of humic acids in soils by immobilized phenol oxidases // Soil Enzymology. V. 22. Soil Biology. Berlin Heidelberg: Springer-Verlag, 2011. P. 207–228. https://doi.org/10.1007/978-3-642-14225-3_10
Zavarzina A.G., Lisov A.V., Leontievsky A.A. The role of ligninolytic enzymes laccase and a versatile peroxidase of the white-rot fungus Lentinus tigrinus in biotransformation of soil humic matter: comparative in vivo study // J. Geophys. Res. Biogeosciences. 2018. V. 123. P. 1–16. https://doi.org/10.1029/2017JG004309
Zavarzina A., Lisov A., Leontievsky A., Zavarzin A. Fungal oxidoreductases and humification in forest soils // Soil Enzymology. V. 22. Soil Biology. Berlin Heidelberg: Springer-Verlag, 2011. P. 187–205. https://doi.org/10.1007/978-3-642-14225-3_11
Дополнительные материалы отсутствуют.


