Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2019, № 12, стр. 94-103
Формирование активной поверхности электрокатализаторов окисления этанола и метанола ионно-ассистируемым осаждением редкоземельных металлов и платины на углеродные носители
В. В. Поплавский 1, *, А. В. Дорожко 1, В. Г. Матыс 1
1 Белорусский государственный технологический университет
220006 Минск, Беларусь
* E-mail: vasily.poplav@tut.by
Поступила в редакцию 11.12.2018
После доработки 22.01.2019
Принята к публикации 25.01.2019
Аннотация
Активные слои на поверхности углеродных носителей катализаторов AVCarb® Carbon Fiber Paper Р50 и Toray Carbon Fiber Paper TGP-H-060 Т сформированы в процессе ионно-ассистируемого осаждения платины и одного из редкоземельных металлов (Ce, Gd, Dy, Yb, Но) в качестве активирующей добавки с целью получения электрокатализаторов прямого окисления этанола и метанола для топливных элементов с полимерным мембранным электролитом. Осаждение атомов металла и перемешивание осаждаемого слоя с поверхностью подложки ускоренными ионами того же металла осуществляли, соответственно, из нейтральной фракции пара и плазмы вакуумного дугового разряда импульсного электродугового ионного источника. Отличительной особенностью полученных электрокатализаторов является их большая активность в процессе окисления более сложных молекул этанола по сравнению с метанолом.
ВВЕДЕНИЕ
Электрохимическое окисление этанола и метанола лежит в основе принципа действия топливных элементов – химических источников тока, в которых энергия, выделяемая при окислении топлива, преобразуется непосредственно в электрическую энергию. Такие источники тока отличаются высоким коэффициентом полезного действия, низкой токсичностью продуктов реакции, а также возможностью создания модульной конструкции для достижения большой мощности. Низкотемпературные топливные элементы с полимерным мембранным электролитом перспективны для широкого применения в стационарных установках небольшого размера, предназначенных для обеспечения резервного и автономного электропитания. Основное препятствие на пути их широкомасштабного использования – пока еще высокая стоимость по сравнению с традиционными устройствами, вырабатывающими энергию. Преимущественно разработаны элементы, в которых в качестве топлива используется водород. В последнее время интенсивно ведутся исследования по созданию топливных элементов прямого окисления органических спиртов – метанола и этанола (DMFC – Direct Methanol Fuel Cell; DEFC – Direct Ethanol Fuel Cell). Применение органических соединений вместо водорода позволяет снять проблему получения, очистки, хранения и распределения водорода, упростить систему подачи топлива. Этанол можно получить из биомассы, он является полностью возобновляемым источником энергии.
Электрохимические реакции, лежащие в основе принципа действия топливных элементов, протекают только при наличии катализатора. Электроды топливного элемента (электрокатализаторы) представляют собой нанесенные гетерогенные катализаторы, при приготовлении которых каталитические металлы наносят на химически инертный электропроводящий, чаще всего углеродный, носитель. В качестве основного каталитического металла электрокатализаторов топливных элементов используется платина. Для достижения высокой активности электрокатализаторов в состав каталитических слоев вводят активирующие добавки, в том числе редкоземельные металлы, что обусловлено механизмом окисления топлива.
Процесс электрохимического окисления и этанола, и метанола является многостадийным, сложным, до настоящего времени детально до конца не изученным. Он включает следующие основные стадии: электрохимическую адсорбцию молекул спирта, их разложение путем последовательного дегидрирования в адсорбированном состоянии, образование адсорбированных молекул оксида углерода COads и их последующее удаление при взаимодействии с хемосорбированными молекулами воды либо с группами OHads [1–4]. Процесс окисления этанола C2H5OH является более сложным по сравнению с окислением метанола CH3OH, так как необходимо обеспечить разрыв химической связи С–С [5].
Предполагается, что разложение адсорбированных на электрокатализаторе молекул с образованием ионов водорода, электронов и адсорбированного СОads эффективно катализируется платиной. Но для окисления образующихся на промежуточной стадии и блокирующих поверхность адсорбированных молекул СОads, а также СН3СОads до СО2 электрокатализатор должен обеспечивать также адсорбцию из раствора кислородсодержащих частиц, источником которых является вода [5, 6]. Поэтому катализатор электрохимического окисления метанола либо этанола наряду с платиной должен содержать компонент, являющийся промотором активации воды [6, 7].
В качестве такого компонента используют металл, на котором легче протекает адсорбция молекул воды или радикалов OH [8, 9]. Исследуют добавки различных металлов (Ru, Sn и других, их бинарные и тройные системы с платиной), способных активировать процесс окисления спиртов [5, 10]. Также широко исследуют композиции платины с редкоземельными металлами [11–21]. Металлы наносят на углеродные носители обычно в процессе осаждения из растворов их соединений и последующей термообработки, и чаще всего редкоземельный металл в составе каталитического слоя находится в форме оксида. Роль редкоземельных металлов или их оксидов заключается в активации процесса окисления адсорбированных промежуточных продуктов реакции до СО2 и их удаления с поверхности электрокатализатора [11–21].
Сложность электрокаталитического процесса окисления этанола и метанола, а также высокая стоимость металлов платиновой группы выдвигают требования поиска новых методов формирования и оптимизации состава каталитических слоев, в том числе с использованием вакуумных методов нанесения металлов. В [22–26] показано, что при ионно-ассистируемом осаждении активных металлов как на металлические (Al, Ti, Ta), так и на углеродные (стеклоуглерод) подложки с гладкой поверхностью образуются многокомпонентные аморфные поверхностные слои толщиной менее 100 нм, обладающие достаточно высокой активностью в процессах электрохимического окисления метанола и этанола. Достигнута также активность электрокатализаторов при ионно-ассистируемом осаждении платины, а также олова и платины на специальные углеродные носители [27, 28]. В сравнении с традиционными многостадийными методами приготовления катализаторов (пропитка носителя растворами соединений каждого из осаждаемых металлов, их восстановление до металлического состояния, многократная отмывка от примесей, сушка) формирование активной поверхности электрокатализаторов посредством ионно-лучевой обработки позволяет получать каталитические слои в один–два приема и значительно сократить расход благородного металла.
Цели настоящей работы: изучение возможности формирования активной поверхности электрокатализаторов окисления этанола и метанола в процессе ионно-ассистируемого осаждения платины и одного из редкоземельных металлов в качестве активирующей добавки из плазмы импульсного дугового разряда на углеродные носители AVCarb® Carbon Fiber Paper Р50 и Toray Carbon Fiber Paper TGP-H-060 Т; исследование свойств получаемых электрокатализаторов и состава формируемых поверхностных слоев.
МЕТОДИКА ЭКСПЕРИМЕНТА
В качестве носителей электрокатализаторов выбраны специальные углеродные материалы AVCarb® Carbon Fiber Paper Р50 (AVCarbCFP) и Toray Carbon Fiber Paper TGP-H-060 Т (TorayCFP), предназначенные для изготовления диффузионных слоев мембранно-электродных блоков низкотемпературных топливных элементов с полимерным мембранным электролитом. Мембранно-электродный блок является основным функциональным компонентом ячейки топливного элемента и состоит из ионопроводящей мембраны и контактирующих с ней диффузионных слоев из пористых материалов, через которые осуществляются подвод топлива и окислителя, токосъем, а также отвод продуктов соответствующей электрохимической реакции [29]. Диффузионные слои мембранно-электродных блоков топливных элементов обычно изготавливают из углеродных материалов с развитой поверхностью. Слои с нанесенными каталитическими металлами одновременно являются электрокатализаторами.
Основу носителей AVCarb® Carbon Fiber Paper Р50 и Toray Carbon Fiber Paper TGP-H-060 Т составляют нити полиакрилонитрила, который подвергается термоокислительной стабилизации и последующей карбонизации; их основные характеристики приведены в [30, 31]. Номинальная толщина AVCarb® Carbon Fiber Paper Р50 175 мкм, Toray Carbon Fiber Paper TGP-H-060 Т – 190 мкм. Носитель Toray Carbon Fiber Paper TGP-H-060 Т гидрофобизирован политетрафторэтиленом, носитель AVCarb® Carbon Fiber Paper Р50 не гидрофобизирован. Предварительную подготовку модифицируемой поверхности образцов углеродных носителей не осуществляли.
Каталитические слои формировали путем поочередного ионно-ассистируемого осаждения (IBAD – Ion Beam Assisted Deposition) одного из редкоземельных металлов (Ce, Gd, Dy, Yb, Ho) в качестве способствующей повышению активности добавки и платины – основного каталитического металла. Атомы каждого металла осаждали в один прием. Отличительной особенностью предложенного режима осаждения является использование ионов осаждаемого металла в качестве ионов, ассистирующих процессу осаждения. Осаждение атомов металла и перемешивание осаждаемого слоя с атомами поверхности подложки ускоренными ионами того же металла осуществляли в экспериментальной установке, соответственно, из нейтральной фракции пара и плазмы вакуумного дугового разряда импульсного электродугового ионного источника. Для ускорения ассистирующих ионов использовали напряжение 5 кВ. Плотность ионного тока составляла ~10 мкА/см2. В рабочей камере поддерживали вакуум ~10−2 Па.
Активность электрокатализаторов с полученными каталитическими слоями исследована в реакциях электрохимического окисления этанола и метанола. Измерения проведены методом циклической вольтамперометрии [32] с применением потенциостата IPC-Pro M и стандартной трехэлектродной электрохимической ячейки. В качестве рабочего электрода использовали исследуемый образец, в качестве вспомогательного – платиновый электрод, электродом сравнения являлся насыщенный хлоридсеребряный полуэлемент (Ag/AgCl). Значения разности потенциалов U на рабочем электроде отсчитаны относительно электрода сравнения. Измерения проводили при 20°C в растворах этанола и метанола в серной кислоте (1 M C2H5OH + 0.5 М H2SO4 и 1 M CH3OH + 0.5 М H2SO4). Растворы готовили на основе дистиллированной воды из серной кислоты марки ЧДА, метанола Merck ВЭЖХ (ВЭЖХ – высокоэффективная жидкостная хромотография) и этанола-ректификата. Скорость изменения разности потенциалов на исследуемых электродах при измерении в потенциодинамическом режиме составляла 50 или 100 мВ/с.
Морфология и элементный состав полученных слоев изучены методами растровой электронной микроскопии, рентгеновского электронно-зондового микроанализа, рентгеновского флуоресцентного анализа и спектрометрии резерфордовского обратного рассеяния.
Электронно-микроскопические исследования слоев проведены совместно с электронно-зондовым микроанализом с дисперсией по энергии квантов характеристического рентгеновского излучения, испускаемого атомами элементов, входящих в состав анализируемого слоя. Исследования выполнены с применением электронного микроскопа JSM-5610LV и спектрометра EDX JED-2201 (JEOL), а также микроскопа LEO 1455 VP в сочетании со спектрометром AZtec Energy Advanced X-Max80 (Oxford Instruments). Проанализировано также распределение элементов по поверхности исследуемых слоев. Энергия электронов, сканирующих поверхность материалов, составляла 20 кэВ.
Рентгеновский флуоресцентный анализ каталитических слоев с дисперсией характеристического рентгеновского излучения атомов по длинам волн проведен с помощью спектрометра PANalytical Axios. В качестве излучения, возбуждающего рентгеновскую флуоресценцию, использовано рентгеновское излучение родия, в качестве монохроматора-анализатора регистрируемого рентгеновского излучения – кристалл LiF(200).
Состав слоев изучен также методом спектрометрии резерфордовского обратного рассеяния с применением ускорительного комплекса AN-2500 (High Voltage Engineering Europe). Измерены спектры рассеяния ионов 4He при их начальной энергии Е0 = 1.5 МэВ. Спектры снимали при нормальном падении пучка анализирующих частиц на поверхность образца и угле рассеяния θ = 170°. Энергетическое разрешение спектрометра, оснащенного поверхностно-барьерным кремниевым детектором, составляло 18 кэВ. Осуществляли стандартную обработку спектров.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты исследования активности полученных электрокатализаторов на основе носителей AVCarb® Carbon Fiber Paper Р50 и Toray Carbon Fiber Paper TGP-H-060 Т в реакциях окисления этанола и метанола, включающих электрохимическую адсорбцию и разложение молекул спирта, образование адсорбированных молекул оксида углерода COads и их последующее удаление при взаимодействии с хемосорбированными молекулами воды либо с группами OHads с образованием ионов водорода, электронов и СО2, представлены на рис. 1 в виде циклических вольтамперограмм. Электрохимическое окисление каждого из спиртов в сернокислом растворе на циклических вольтамперограммах проявляется в виде специфических пиков тока при изменении разности потенциалов на электроде в направлениях как анода, так и катода [33]. На анодной части вольтамперограммы имеется пик тока (а) (рис. 1а), обусловленный многостадийным процессом окисления метанола или этанола. Уменьшение тока при дальнейшем увеличении разности потенциалов на электроде объясняется снижением скорости электрохимической адсорбции молекул спирта вследствие блокирования поверхности электрокатализатора продуктами процессов электрохимической адсорбции, в частности COads. При анодном окислении этанола (рис. 1а–г) проявляется и второй пик тока (b), который отсутствует на вольтамперограммах окисления метанола (рис. 1д, е). При последующей развертке разности потенциалов в направлении катода на вольтамперограмме появляется достаточно интенсивный пик тока (d) с максимумом при ~400 мВ, который обусловлен возобновлением процесса окисления этанола на восстановленной поверхности катализатора [33].
Рис. 1.
Циклические вольтамперограммы электрокатализаторов, сформированных в процессе ионно-ассистируемого осаждения: платины (а), гадолиния и платины (б) на носитель AVCarb® Carbon Fiber Paper Р50; платины (в), церия и платины (г) на носитель Toray Carbon Fiber Paper TGP-H-060 Т (раствор 1 M C2H5OH + 0.5 М H2SO4); платины (д), иттербия и платины (е) на носитель Toray Carbon Fiber Paper TGP-H-060 Т (раствор 1 M CH3OH + 0.5 М H2SO4).

Эти пики проявляются на циклических вольтамперограммах всех исследованных образцов электрокатализаторов, что свидетельствует об их активности в реакциях окисления и этанола, и метанола. В качестве характеристики активности принимают значения плотности тока I в пиках. Интенсивность пиков возрастает по мере циклирования примерно до десятого цикла (рис. 1б, е), что отображает процесс электрохимической активации модифицированной поверхности. Введение в дополнение к платине в состав поверхности электрокатализаторов редкоземельных металлов чаще всего приводит к повышению значений плотности тока в пиках, что свидетельствует о положительном влиянии активирующей добавки. Обнаруживается влияние природы носителя на характер изменения активности электрокатализаторов. Так, осаждение гадолиния наряду с платиной на носитель AVCarb® Carbon Fiber Paper Р50 существенно повышает активность в реакции окисления этанола (рис. 1а, б), в то время как активность электрокатализатора на основе Toray Carbon Fiber Paper TGP-H-060 Т несколько снижается. Значения плотности тока в пиках окисления более простых молекул метанола (рис. 1д, е) значительно меньше, чем при окислении этанола, для которого требуется разрыв связи С–С. Введение в состав каталитического слоя в дополнение к платине редкоземельного металла часто приводит к некоторому снижению активности электрокатализаторов в реакции окисления метанола. При осаждении на носитель Toray Carbon Fiber Paper TGP-H-060 Т иттербия и платины (рис. 1е, д), а также церия и платины активность поверхности в процессе окисления метанола возрастает.
В табл. 1 приведены значения разности потенциалов (относительно электрода сравнения Ag/AgCl) для характерных точек на циклических вольтамперограммах исследуемых образцов электрокатализаторов. Значения в точках получали из вольтамперограмм, измеренных при одинаковой скорости изменения разности потенциалов 100 мВ/с в десятом цикле. Точки a, b и d характеризуют максимумы соответствующих пиков тока (рис. 1а) окисления этанола либо метанола. Значения Uc, отвечающие точке с, отображают окончание процесса удаления адсорбированных на поверхности молекул и начало окисления топлива при катодной развертке разности потенциалов исследуемых электродов.
Таблица 1.
Значения разности потенциалов в характерных точках на циклических вольтамперограммах исследуемых образцов электрокатализаторов
| Образец | Направление развертки разности потенциалов | |||
|---|---|---|---|---|
| Анодное | Катодное | |||
| Ua, мВ | Ub, мВ | Uc, мВ | Ud, мВ | |
| Окисление этанола (раствор 1 M C2H5OH + 0.5 М H2SO4) | ||||
| Pt/AVCarbCFP | 725 | 1105 | 620 | 385 |
| Gd, Pt/AVCarbCFP | 725 | 1100 | 680 | 425 |
| Dy, Pt/AVCarbCFP | 720 | 1105 | 740 | 430 |
| Pt/TorayCFP | 695 | 1065 | 515 | 330 |
| Ce, Pt/TorayCFP | 705 | 1080 | 675 | 410 |
| Yb, Pt/TorayCFP | 700 | 1065 | 600 | 345 |
| Gd, Pt/TorayCFP | 705 | 1085 | 670 | 365 |
| Pt, Dy/TorayCFP | 740 | 1120 | 655 | 350 |
| Ho, Pt/TorayCFP | 695 | 1075 | 580 | 370 |
| Окисление метанола (раствор 1 M CH3OH + 0.5 М H2SO4) | ||||
| Pt/AVCarbCFP | 650 | – | 575 | 420 |
| Gd, Pt/AVCarbCFP | 690 | – | 580 | 440 |
| Dy, Pt/AVCarbCFP | 705 | – | 580 | 415 |
| Pt/TorayCFP | 645 | – | 475 | 405 |
| Ce, Pt/TorayCFP | 645 | – | 605 | 405 |
| Yb, Pt/TorayCFP | 665 | – | 690 | 450 |
| Gd, Pt/TorayCFP | 670 | – | 535 | 455 |
| Pt, Dy/TorayCFP | 655 | – | 540 | 435 |
| Ho, Pt/TorayCFP | 725 | – | 540 | 360 |
Анализ полученных данных показывает, что при анодной развертке разности потенциалов окисление топлива на всех образцах идет примерно при одинаковых значениях Ua и Ub ~ 700 мВ (точки а) и 1100 мВ (точки b при окислении этанола). В то же время значения Uс свидетельствуют о том, что процесс восстановления поверхности катализатора после анодной поляризации при катодной развертке разности потенциалов на образцах, в состав которых введен наряду с платиной редкоземельный металл, заканчивается намного раньше, чем на образцах электрокатализаторов Pt/AVCarbCFP и Pt/TorayCFP, не содержащих добавки. Это указывает на то, что добавки редкоземельного металла способствуют удалению адсорбированных на поверхности молекул COads вследствие активации молекул воды и восстановлению активности электрокатализаторов.
Проведен также анализ микроструктуры и элементного состава формируемой поверхности электрокатализаторов. Электронно-микроскопические исследования (рис. 2) показывают, что структура носителей AVCarb® Carbon Fiber Paper Р50 и Toray Carbon Fiber Paper TGP-H-060 Т различна. Морфология поверхности носителей при формировании на них каталитических слоев не изменяется. На поверхности имеются включения металлов размером порядка нескольких микрометров, которые обусловлены осаждением капель металла из дугового разряда ионного источника.
Рис. 2.
Электронно-микроскопические изображения поверхности электрокатализаторов, сформированной в процессе ионно-ассистируемого осаждения гадолиния и платины на носитель AVCarb® Carbon Fiber Paper Р50 (а), диспрозия и платины на носитель Toray Carbon Fiber Paper TGP-H-060 Т (б).

Рис. 3.
Распределение C (1), Ce (2), O (3), F (4), Pt (5) вдоль линии сканирования поверхности электрокатализатора, сформированной в процессе ионно-ассистируемого осаждения церия и платины на носитель Toray Carbon Fiber Paper TGP-H-060 Т (по данным энергодисперсионного микроанализа).
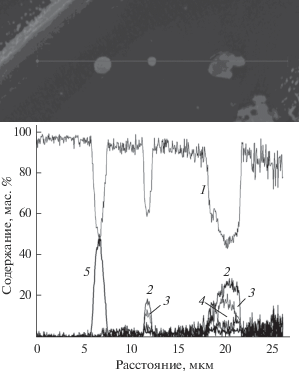
Рис. 4.
Распределение C (1), Pt (2), Gd (3), F (4) вдоль линии сканирования поверхности электрокатализатора, сформированной в процессе ионно-ассистируемого осаждения гадолиния и платины на носитель Toray Carbon Fiber Paper TGP-H-060 Т (по данным энергодисперсионного микроанализа).

При изучении поверхности электрокатализаторов методом энергодисперсионного электронно-зондового микроанализа обнаружено, что в ее состав входят атомы осаждаемых металлов и материала подложки (углерода и в случае гидрофобизированного Toray Carbon Fiber Paper TGP-H-060 Т – фтора), а также кислорода. Наличие кислорода обусловлено его осаждением из остаточной атмосферы рабочей вакуумной камеры, а также сорбционными процессами. В частности, распределение кислорода в составе слоя, сформированного в результате осаждения церия и платины, коррелирует с распределением церия (рис. 3, кривые 3 и 2), что дает возможность предположить образование оксида редкоземельного металла. В силу неоднородности структуры самих подложек распределение атомов элементов по поверхности также неоднородно (рис. 3, 4). Концентрация атомов осажденных металлов на основной части поверхности электрокатализаторов, исключая капельные образования, составляет по данным энергодисперсионного микроанализа в среднем несколько процентов.
Данные, полученные методом рентгеновского флуоресцентного анализа с дисперсией излучения по длинам волн, подтверждают элементный состав поверхности исследуемых образцов. В спектрах флуоресценции регистрируются спектральные линии L- и М-серий характеристического рентгеновского излучения атомов платины (рис. 5а), М-серии излучения атомов гадолиния (рис. 5б) и иттербия (рис. 6), а также линии излучения атомов других введенных в состав формируемых слоев редкоземельных металлов. Наблюдаются линии Kα-излучения атомов фтора и кислорода (рис. 5б, 6), также линии отраженного излучения атомов родия (рис. 5а), которое использовали для возбуждения рентгеновской флуоресценции.
Рис. 5.
Участки спектра рентгеновской флуоресценции элементов, входящих в состав поверхности электрокатализатора, сформированной в процессе ионно-ассистируемого осаждения гадолиния и платины на носитель Toray Carbon Fiber Paper TGP-H-060 Т, в интервале 2θ: а – 90°–140°; б – 20°–60°.

Рис. 6.
Участок спектра рентгеновской флуоресценции элементов, входящих в состав поверхности электрокатализатора, сформированной в процессе ионно-ассистируемого осаждения иттербия и платины на носитель Toray Carbon Fiber Paper TGP-H-060 Т.

На рис. 7 приведены в качестве примера спектры резерфордовского обратного рассеяния ионов 4Не на поверхности образцов электрокатализаторов, сформированных в процессе ионно-ассистируемого осаждения платины (спектр Pt/TorayCFP), а также гадолиния и платины на носители Toray Carbon Fiber Paper TGP-H-060 Т (спектр Gd, Pt/TorayCFP) и AVCarb® Carbon Fiber Paper Р50 (спектр Gd, Pt/AVCarbCFP). В состав полученных поверхностных слоев входят атомы осажденных металлов, материала носителя и примеси кислорода, что свидетельствует об ионном перемешивании всех компонентов слоя. Наблюдаются особенности распределения атомов осажденных металлов в слоях, полученных на различных подложках, что обусловлено структурой носителей. Концентрация осажденных металлов в максимуме распределения вблизи поверхности зависит от содержания металла в слое и составляет до 10 ат. %. Атомы металла, которые осаждаются первыми, находятся на несколько большем расстоянии от поверхности.
Рис. 7.
Спектры резерфордовского обратного рассеяния ионов 4Не на поверхности электрокатализаторов, сформированных осаждением: платины на носитель Toray Carbon Fiber Paper TGP-H-060 Т (квадраты); гадолиния и платины на носитель Toray Carbon Fiber Paper TGP-H-060 Т (кружки); гадолиния и платины на носитель AVCarb® Carbon Fiber Paper Р50 (треугольники).
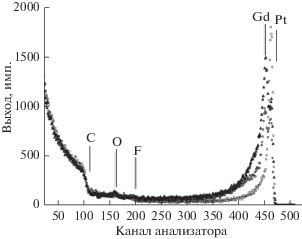
Следует принять во внимание, что корректная количественная обработка спектров резерфордовского обратного рассеяния затруднена вследствие нерегулярной пористой структуры носителей Toray Carbon Fiber Paper TGP-H-060 Т и AVCarb® Carbon Fiber Paper Р50. Результаты оценочных расчетов при обработке спектров показывают, что концентрация атомов платины, а также каждого осажденного редкоземельного металла в формируемых слоях составляет примерно 2 × × 1016 см–2, или в пересчете на массу менее 0.01 мг/см2.
Определение фазового состава формируемых в режиме ионно-ассистируемого осаждения слоев затруднено в силу их аморфной структуры [24, 25] и малой (~30 нм) толщины. В ходе исследований с применением рентгеновской фотоэлектронной спектроскопии, выполненных на модельном углеродном материале с гладкой поверхностью – стеклоуглероде, установлено [25], что в получаемых в аналогичных условиях слоях при ионно-ассистируемом осаждении платины атомы металла, углерода и кислорода находятся в нескольких различных валентных состояниях. Идентифицированы платина в металлическом состоянии, платина с хемосорбированным кислородом, платина в составе оксида PtO и в более высокой степени окисления.
ЗАКЛЮЧЕНИЕ
Сформирована каталитически активная поверхность электрокатализаторов на основе специальных углеродных носителей AVCarb® Carbon Fiber Paper Р50 и Toray Carbon Fiber Paper TGP-H-060 Т, предназначенных для изготовления диффузионных слоев мембранно-электродных блоков низкотемпературных топливных элементов с полимерным мембранным электролитом, методом ионно-ассистируемого осаждения платины и одного из редкоземельных металлов (Ce, Gd, Dy, Yb, Но) в качестве добавки, способствующей повышению активности, из плазмы вакуумного дугового разряда импульсного ионного источника. Использован режим, в котором металл вводится в формируемый каталитический слой на наноразмерном уровне в неравновесных условиях обработки ускоренными ионами осаждаемого металла. Получены многокомпонентные слои, содержащие атомы осажденных металлов и элементов, входящих в состав носителей, а также примеси кислорода.
Электрокатализаторы со сформированными поверхностными слоями сложного состава с очень низким (менее 0.01 мг/см2) содержанием платины проявляют активность в важных в практическом отношении процессах окисления органических спиртов – метанола и этанола, в то время как содержание платины в электрокатализаторах, используемых в топливных элементах, составляет ~1 мг/см2. Отличительной особенностью получаемых электрокатализаторов является их большая активность в процессе окисления более сложных молекул этанола по сравнению с метанолом, для которого необходимо обеспечить разрыв химической связи С–С. Введение в формируемые слои наряду с платиной редкоземельного металла в качестве активирующей добавки способствует удалению адсорбированных продуктов реакции на промежуточной стадии окисления топлива и чаще всего к существенному увеличению активности электрокатализаторов в реакции окисления этанола.
Формирование активной поверхности при осаждении двух металлов осуществляется в вакууме в два приема, что выгодно отличается от традиционных многостадийных методов приготовления нанесенных катализаторов, основанных на пропитке носителя растворами соединений каждого осаждаемого металла, их восстановлении до металлического состояния, многократной отмывке от примесей, сушке.
Список литературы
Iwasita T., Vielstich W. // J. Electroanal. Chem. 1986. V. 201. P. 403.
Iwasita T. // Electrochim. Acta. 2002. V. 47. P. 3663.
Sriramulu S., Jarvi T.D., Stuve E.M. // J. Electroanal. Chem. 1999. V. 467. P. 132.
Lei H.-W., Suh S., Gurau B. et al. // Electrochim. Acta. 2002. V. 47. P. 2913.
Tarasevich M.R., Kuzov A.V. // Int. Sci. J. Alternative En. Ecol. 2010. V. 87. № 7. P. 86.
Watanabe M., Motoo S. // J. Electroanal. Chem. 1975. V. 60. P. 259.
Watanabe M., Uchida M., Motoo S. // J. Electroanal. Chem. 1987. V. 229. P. 395.
Mukerjee S., Urian R.C. // Electrochim. Acta. 2002. V. 47. P. 3219.
Pereira, L.G., Paganin V.A., Ticianelli E.A. // Electrochim. Acta. 2008. V. 54. P. 1992.
Teng X. Anodic Catalyst Design for the Ethanol Oxidation Fuel Cell Reactions. http://www.formatex.info/energymaterialsbook/book/473-484.pdf
Hariyanto, Purwanto W.W., W-Soemantojo R., Stimming U. // J. Chem. Natural Resources Engin. FKKKSA Universiti Teknologi Malaysia. 2007. V. 2. P. 47.
Wang Y., Tabet-Aoul A., Gougis, Mohamedi M. // J. Power Sources. 2015. V. 273. P. 904.
Liu J., Liu C.T., Zhao L., Wang Z.B. // J. Nanomater. V. 2015. P. 963173.
Corradini P.G., Antolini E., Perez J. // J. Power Sources. 2014. V. 251. P. 402.
Yang Y., Zhang Z., Hu Z. // J. Rare Earths. 2011. V. 29. P. 58.
Antolini E., Perez J. // Int. J. Hydrogen En. 2011. V. 36. P. 15752.
Zhou Y., Gao Y., Liu Y., Liu J. // J. Power Sources. 2010. V. 195. P. 1605.
Neto A.O., Watanabe A.Y., Brandalise M. et al. // J. Alloys Compds. 2009. V. 476. P. 288.
De Souza R.F.B., Flausino A.E.A., Rascio D.C. et al. // Appl. Catalysis. B. 2009. V. 91. P. 516.
Neto A.O., Watanabe A.Y., Rodrigues R.M.D.S. et al. // Ionics. 2008. V. 14. P. 577.
Tang Z., Lu G. // J. Power Sources. 2006. V. 162. P. 1067.
Поплавский В.В., Мищенко Т.С., Матыс В.Г. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2010. № 7. С. 33.
Поплавский В.В., Мищенко Т.С., Матыс В.Г. // ЖТФ. 2010. Т. 2. С. 138.
Поплавский В.В., Стельмах Т.С., Матыс В.Г. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2012. № 9. С. 45.
Поплавский В.В., Дорожко А.В. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2013. № 4. С. 9.
Поплавский В.В., Дорожко А.В., Матыс В.Г. // Изв. вузов. Физика. 2014. Т. 57. № 10/3. С. 216.
Поплавский В.В., Дорожко А.В., Матыс В.Г. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2017. № 3. С. 52.
Поплавский В.В., Дорожко А.В., Матыс В.Г. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2017. № 7. С. 60.
Basu S. Fuel Cell Systems. http://web.iitd.ac.in/~sbasu/FC-Descrip.pdf
http://www.avcarb.com/product/carbon-paper
http://fuelcellsetc.com/store/Toray-Paper-060
Rudd E.J. // Thin Solid Films. 1977. V. 43. P. 1.
Фильштих В. Топливные элементы. М.: Мир, 1968. 360 с.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


